Method Article
シリアル セクション電子線トモグラフィーによるショウジョウバエ間接飛翔筋のミトコンドリア微細構造 3D
要約
このプロトコルではシリアル セクション電子線トモグラフィーのショウジョウバエ間接飛翔筋のミトコンドリアの構造を解明への応用を示す.
要約
ミトコンドリアは、カルシウム恒常性と細胞死を調節すると同様、代謝、脂質、ATP を生成する細胞の強豪です。このオルガネラのユニークな稜が豊富な二重膜の微細構造は、生体分子を分割することで複数の機能を遂行するエレガントな配置されます。ミトコンドリアの微細構造は、様々 な機能と密接に結び付くただし、これらの構造と機能の関係の細部は記述されている初めだけです。ここでは、シリアル セクション電子線トモグラフィーのショウジョウバエ間接飛翔筋のミトコンドリアの構造を解明への応用を示す.シリアル セクション電子線トモグラフィーは、3 次元で任意の細胞構造研究に適応させること。
概要
電子顕微鏡は、細胞アセンブリと細胞プロセスを実行する細胞小器官の構造のコンテキストを検討する貴重なツールです。方法は組織や細胞の微細構造とアルデヒド化学固定法のいずれかを維持するために開発されたまたは高圧によって続く (HPF) を凍結置換 (FS)1,2を凍結します。この埋め込み試料ブロック可能性があります断面、ステンド グラス、および透過型電子顕微鏡 (TEM) 観察。用いて電子顕微鏡、集束イオンビーム装置 (FIB) フライス加工, と Cryoem3,4で観察は、HPF 標本をなどの低温条件下で処理でした。
薄いセクション EM 有益な形態学的洞察力を提供しますが、結果の 2 D 画像はのみ特定断面の微細構造を明らかにできます。3 D ボリュームで微細構造を編成する方法の隠されたままです。3 つの次元の細胞の超微細構造を視覚化するために、傾斜画像のシリーズを取得され、戻ってトモグラフィー再構成5 (図 1) を生成すると予想電子断層撮影法が開発されました。二重傾斜シリーズは、サンプルの 90 ° の回転と傾きシリーズ第二弾の取得によって収集できます。これは限られたサンプリング角度に起因し、断層の解像度を向上させる行方不明ウェッジ アーティファクトを最小限に抑えます。
ここでは、シリアル セクション電子線トモグラフィーのショウジョウバエ間接飛翔筋 (IFM)6,7,8,9のミトコンドリアの微細構造の研究への応用について述べる.3 D 再構成全体ミトコンドリア (約 2.5 μ m 厚) のカバーを得るために連続切片はショウジョウバエIFM ティッシュのブロックから得られました。各セクションの自動データ収集ソフトウェアを使用して個別に採取した.トモグラフィー再構成が生成され、シリアル断層全体のミトコンドリアの再生ボリュームを取得する IMOD パッケージに参加していた。結合された断層は、3 D ソフトウェアによって分析されました。ミトコンドリアのクリステの密度は 3 次元で組織を明らかにしたセグメンテーション モデルを生成する分割されました。
プロトコル
1. 章ショウジョウバエのティッシュ振動刃ミクロトームを使用して
- 氷の上のショウジョウバエの麻酔し、4% 低融点アガロース リン酸バッファー内の 1 つの mL で各 1 つのフライを浸します。氷の上を固めるための agarose を許可します。通常、4-6 ハエが処理されます。
- Agarose のゲルに埋め込まれたショウジョウバエを 100 μ m の厚みでスライスをセクションし、0.1 M のリン酸バッファーで 2.5% グルタルアルデヒドを含む固定液に浸して振動刃ミクロトームを使用します。
注: は、組織のアーキテクチャは、他の方法と比べてよりそのまま残るので最寄り Vibratome 断面です。また、0.1 M のリン酸バッファーで 2.5% グルタルアルデヒドを含む固定液に IFM を解剖するには、ピンセットを解剖を使用できます。
2. 高圧凍結と凍結置換 (HPF/FS) 法による EM 試料の準備
- 続いて 2 滴 (~ 100 μ L) 20 %bsa を用いたリン酸バッファーのリン酸バッファーの 3 滴 (~ 150 μ L) の組織切片を洗います。HPF の満ちているバッファーと 20 %bsa のゴールドのキャリア セクションに配置し。
- ユーザー マニュアルによると高圧冷凍庫にキャリアを含んでいるサンプルをロードします。
- フリーズの後液体窒素下でホルダーからのキャリアを解放し、-140 ° C に冷却凍結置換デバイスに転送
- テーブル 12% グルタルアルデヒド、四酸化オスミウム 2%、0.1% アセトン酢酸ウランを含むカクテルの FS でのように、凍結置換プロトコルを実行します。
- 慎重に針をキャリアから標本を取り外します、室温で樹脂に試料を埋め込みます。65 ° C 16 h で樹脂を重合します。
注意: 他のタイプのサンプルを準備する FS のプロトコルを変更ください。HPF/FS は微細構造を保持し、細胞内容の喪失を最小限に抑えるために好まれる。- また、化学固定のプロトコルを適用します。一晩 2.5% グルタルアルデヒドで標本を修正、バッファーで洗浄し、1% オスミウム四酸化 2 における洗浄と修正し、昇順エタノールの濃度によって脱水し潜入し、16 65 ° C で重合する前にスパー樹脂標本を埋め込むh。
3. 電子線トモグラフィーの標本のシリアル セクションを準備します。
- 組織を含む必要なブロックの顔を公開する試料ブロックをトリミングします。
- 金の粒子を前処理 (10 nm の直径の) 30 分洗浄 1 %bsa と PBS バッファー内の金粒子の中断と。マーカを作成する炭素皮膜で被覆された銅スロット グリッド上の金の粒子をオーバーレイします。
- トモグラフィー買収の視野で十分なマーカ (少なくとも 5-10 マーカー) を持っている電子顕微鏡下で確認します。
- 200-250 nm、ウルトラミクロトームを用いた膜厚の切片をカットします。
- 薄片の完璧なループを使用してスロット グリッドの連続切片を収集します。
- 10 分間レイノルドの鉛クエン酸とセクションを染色します。
- セクションの上に基準の金粒子の第 2 層をオーバーレイします。
4. 二重傾斜電子線トモグラフィーを収集します。
- デュアル軸断層法ホルダーにグリッドに読み込むし、200 で透過型電子顕微鏡に挿入 kV。
- ユーセン トリック フォーカスで顕微鏡を合わせます。
- 自動データ収集ソフトウェアを設定します。調整し、マルチ スケールの画像設定で電子ビームを揃えます。操作詳細10 (図 2) は、ユーザー マニュアルを参照してください。
- 断層レントゲン写真撮影のコレクションの設定の下で炭素フィルムなしの空の領域でのカメラ暗いと明るい参照を取得します。
- 低倍率でグリッド アトラスを収集します。断層レントゲン写真撮影のコレクション対象として連続切片にミトコンドリアを選択します。
- +60 ° と 2 ° 刻みに-60 ° からフルティルト シリーズを取得ターゲットごとに軸 A。
注: のチルト角は、試料ホルダーの設計によって機械的に制限されます。ホルダーは、高角度のビームをブロックします。 - 2 番目のフルティルト シリーズを収集するために試料ホルダー 90 ° を回転します。新しいアトラスを取得します。対応する位置を選択し、ターゲットごとに軸 b フルティルト シリーズを取得します。
注: SerialEM、Xplore3D などの他のソフトウェア パッケージの自動データ収集があります。
5. 再構築 3 D 断層セグメントのサブボリューム ソフトウェアを使用して、
- IMOD ソフトウェア11を使用してデュアル軸の傾き画像の再構築します。
- 操作の詳細についてはユーザー マニュアルを参照してください。
- 金マーカの位置によって個々 の傾斜シリーズで揃えます。両方の軸のため戻って投影法によってまたは同時反復再構成手法 (SIRT) 法による断層を再構築と軸 B、それぞれ (図 3)。
- 結合の軸 A と軸 B 二重傾斜断層削減不足しているウェッジの成果物を生成します。
- カバー全体ミトコンドリア ボリュームの復元を取得する連続切片の二重傾斜断層が一緒に参加します。IMOD プログラムによって連続切片の間のギャップをモデル化します。
- 結合された断層と箱ボリューム分割の必要なサイズにトリミングします。
- 3 D ソフトウェアを利用した結合されたシリアル断画像を分析します。
- 操作の詳細についてはユーザー マニュアルを参照してください。
- 機能のコントラストを改善し背景の密度を減らすガウス フィルター (または他の目的のメソッド) で断層をフィルター処理します。
- 手動でまたは自動的に、ミトコンドリアの微細構造をセグメント化します。
- 3 D で検査できるようにセグメンテーション モデルを表示します。
- 3 D で利用可能なツールを使用してムービーを生成します。
結果
我々 は、そのエネルギッシュな状態や高齢化を反映したミトコンドリアのクリステの構造的特徴を分析するシリアル セクション電子線トモグラフィーを適用されます。ショウジョウバエIFM のミトコンドリア形成可能な統合を示した稜とマトリックス 3 D (図 4)7ネットワークします。さらに、ミトコンドリアの DNA 複製欠陥と老化の表現型変異ハエはタマネギのような旋回中心 (図 5)7のサブセクションに含まれるミトコンドリアを蓄積しました。
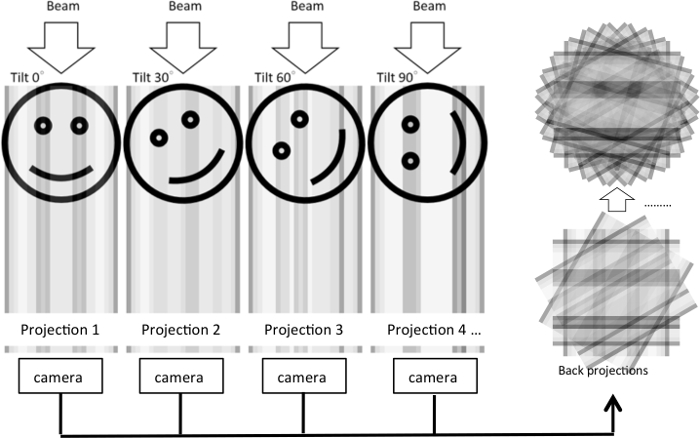
図 1: フルティルト シリーズから電子トモグラフィー再構成のイラスト。実験では、電子ビームは、オブジェクトをさまざまな程度に傾けると 3 D オブジェクトを通じて渡されます。各傾斜条件の 2D プロジェクションが生成され、カメラで撮影しました。2D プロジェクションに戻って中央のスライスの定理に基づく 3 D オブジェクトを再構築する投影されます。図では、さまざまな角度の下の 1 つのディメンションに投影は元の 2D 画像に同じプロセスが表示されます。1 D のプロジェクションは、2 D イメージを再構築する使用されます。この図の拡大版を表示するのにはここをクリックしてください。
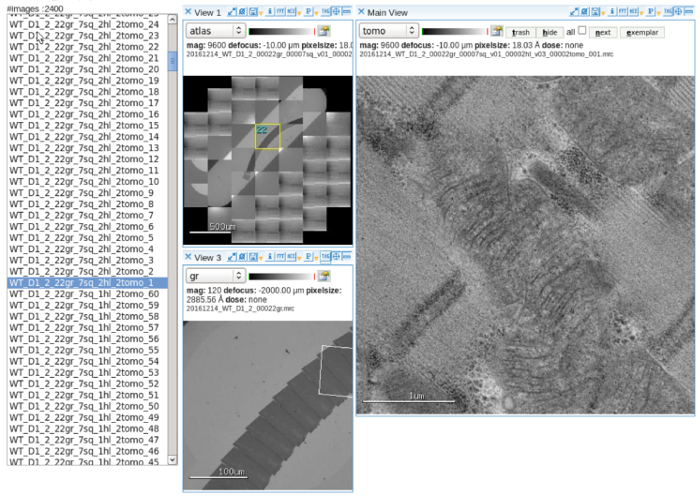
図 2: データの自動収集します。連続切片を含むスロット グリッドのアトラスを示すソフトウェアの画像ビューアーの表示、ミトコンドリアのターゲット設定と取得したマルチ スケール画像を傾けます。スケール バー = (左上パネル) 500 μ m、100 μ m (左下パネル)、1 μ m (右側のパネル)。この図の拡大版を表示するのにはここをクリックしてください。

ショウジョウバエ間接飛翔筋単一ミトコンドリアの図 3: シリアル セクション電子線トモグラフィー(A) 2次元顕微鏡写真と、ミトコンドリアのボリューム全体を覆う連続切片から (B) 3 D 断層。Z 軸を上下に並べて表示と縦断面図を作成する (C) 結合されたシリアル セクション断層と予想されます。特に、ティッシュは、材料、結合された断層間のギャップを残しての損失をもたらした。スケール バー = 500 nm。この図の拡大版を表示するのにはここをクリックしてください。
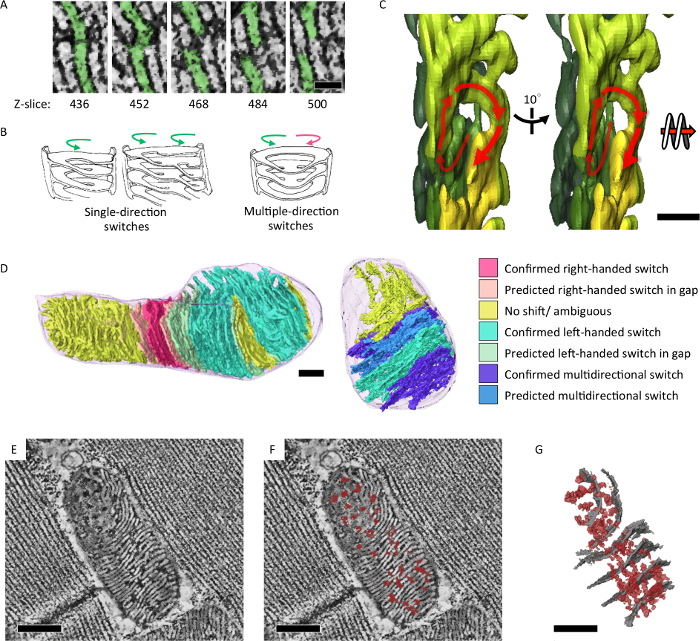
図 4: 内ミトコンドリア クリステと 3 D で明らかにマトリックス ネットワークを統合されています。(A) z 軸を介してラメラ膜の間のスイッチを示すミトコンドリア電子トモグラフィー再構成のスライス。(B) 右右利きや左利きの螺旋のスイッチング パターン観測稜のイラスト。3 D (D) 稜スイッチング パターンで左利きのスパイラルを示す (C) 断層セグメンテーションを分析し、(E, F) のセグメンテーション モデルにカラー表示。断層スライス稜膜 (白密度) を渡る横のマトリックス密度 (濃い密度、赤マーク) を表示します。(G) セグメンテーション (赤) は横のマトリックス密度を示す (E) で断層のモデルと (グレー) の代表的な稜。スケールバー = 50 nm (A)、200 nm (C) と 300 nm (D、E、F、G)。図は、江らからの転載7 この図の拡大版を表示するのにはここをクリックしてください。
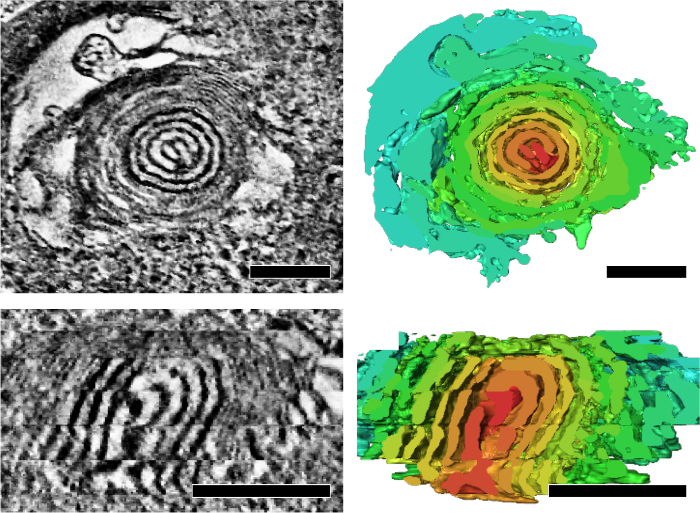
図 5: 高齢化の中にミトコンドリア DNA 複製欠陥とハエで蓄積されたタマネギのような旋回コアを持つミトコンドリア。代表的な断層スライスと断面図 (上) と旋回のコアの縦断面図 (下) を示す対応するセグメンテーション (右側のパネル)。ボリューム分割は旋回中心を強調する任意の色のレンダリングが表示されます。スケール バー: 200 nm。図は、江らからの転載7 この図の拡大版を表示するのにはここをクリックしてください。
| ステップ | Temp | 時間 | ソリューション | |||
| 1 | -140 ° C-9 0 ° C ~ | 30 分 | 液体窒素 | |||
| 2 | -90 ° C | 96 時間 | FS カクテル | |||
| 3 | --60 ° C に 90 ° C | 6 時間 (5 ° C/時間) | FS カクテル | |||
| 4 | -60 ° C | 12 時間 | FS カクテル | |||
| 5 | --25 ° c 60 ° C | 7 時間 (5 ° C/時間) | FS カクテル | |||
| 6 | -25 ° C | 12 時間 | FS カクテル | |||
| 7 | -25 ° C 0 ° C ~ | 5 時間 (5 ° C/時間) | FS カクテル | |||
| 8 | 0 ° C | 1 時間 × 3 回 | アセトン | |||
| 9 | 室温 | 樹脂浸透 | ||||
表 1: 凍結置換プロトコル。
ディスカッション
このプロトコルではショウジョウバエ間接飛翔筋のミトコンドリア微細構造 3 D を勉強するシリアル セクション電子断層撮影法を適用するために最適化されたワークフローをについて説明します。サンプルの超微細構造の保存は、このタイプの分析の主要な技術的な挑戦です。方法論的微細構造の 2 つが最も維持するためには、手順が含まれていた。まず、組織は組織アーキテクチャを可能な限り維持するために刃ミクロトームを振動を伴うセクショニングによってサンプリングされました。第二に、HPF/FS のプロトコルは、埋め込み試料ブロックの準備の間に細胞小器官の微細構造を維持するために最適化されました。試験片は水の氷点を下げるし、損傷の微細構造1氷結晶の形成を低減、高圧力下で凍結されました。標本としては厚さ 0.1 mm を瞬時にガラス固化体し、電磁界解析のための試料ブロックを生成する置換を凍結を受けることができます。化学固定法と比較した場合、HPF/FS による微細構造の保存性の向上が認められました。この一連の手順を使用すると、サンプルの準備のため、稜膜とミトコンドリアの二重膜の保存が劇的に向上しました。
供試体の連続切片を得ることはメソッドの最も困難なステップです。断面の厚みがいずれかの 250 に制限電子ビームは貫通力を限られた、nm または 500 nm 200 で TEM を使用して kV または 300 kV、それぞれ。以上 2 μ m こと、ミトコンドリアの膜厚があるので連続切片は、フル ・ ボリュームの復元を得る必要があります。ただし、細胞小器官全体にまたがる連続切片の十分な数の回復は技術的な課題です。台形の拠点間できるだけ平らにするブロック面をトリミング スロット グリッドの複数のセクションに対応し、こうしてより大きいボリュームをカバーすることができます。さらに、薄片の完璧なループを使用してグリッドへの連続切片の転送の成功率を増加します。
シリアル セクション電子線トモグラフィーは、標準 EM コア機器で実現できます。ただし、メソッドは、技術的な制約から生じるいくつかの必然的な制限をあります。1 つは材料が必然的に結合された再建のギャップを残して、連続切片の間失われることです。第二に、達成可能である限られた角度により生じた行方不明のくさびアーティファクトです。この制限は、試料ホルダーをフル回転で電子ビームをブロックせずにできないために発生します。これらの制限にもかかわらずシリアル セクション電子線トモグラフィーは、3 D で細胞と細胞小器官の微細構造を明らかにするための十分な解像度を提供します。
低温電子断層撮影法より小さいスケールで画像化、高分子錯体とアセンブリその場でサブ断層との組み合わせで nm または 1 オングストローム未満の解像度での構造体を取得するために使用できる新たな技術再建3。断面、集束イオンビーム加工液体窒素下でこのアプリケーションでは、セルを薄くしています。断層は、化学固定、脱水、または埋め込みすることがなく本来の状態に近い分子構造を保持する、低温条件下で収集されます。スケールのもう一方の端での解像度を犠牲にして大きな組織ボリュームを分析するシリアル ブロック面走査型電子顕微鏡は魅力的なモダリティにもかかわらず4特定の計測器が必要です。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
携帯研究所・生体生物で EM コアと中央研究院、台北、台湾の Cryoem コアの研究を行った。仕事は、中央研究院とほとんどによって支持されました。
資料
| Name | Company | Catalog Number | Comments |
| vibrating blade microtome | Leica | VT1200S | Tissue sectioning |
| high-pressure freezer | Leica | EM HPM100 | Specimen preparation |
| freeze-substitution device | Leica | EM AFS2 | Specimen preparation |
| ultramicrotome | Leica | EM UC7 | Ultra-thin sectioning |
| dual-axis tomography holder | Fischione | Model 2040 | tomography collection |
| transmission electron microscope | FEI | Tecnai F20 | tomography collection |
| CCD | Gatan | UltraScan 1000 | tomography collection |
| Leginon | NRAMM/AMI | tomography collection | |
| IMOD | Boulder Laboratory for 3-D Electron Microscopy of Cells | Tomography reconstruction | |
| Avizo 3D | FEI | Tomography analysis |
参考文献
- Dahl, R., Staehelin, L. A. High-pressure freezing for the preservation of biological structure: theory and practice. J Electron Microsc Tech. 13 (3), 165-174 (1989).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J Cell Biol. 17, 19-58 (1963).
- Rigort, A., et al. Micromachining tools and correlative approaches for cellular cryo-electron tomography. J Struct Biol. 172 (2), 169-179 (2010).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. 2 (11), e329 (2004).
- Lucic, V., Forster, F., Baumeister, W. Structural studies by electron tomography: from cells to molecules. Annu Rev Biochem. 74, 833-865 (2005).
- Soto, G. E., et al. Serial section electron tomography: a method for three-dimensional reconstruction of large structures. Neuroimage. 1 (3), 230-243 (1994).
- Jiang, Y. F., et al. Electron tomographic analysis reveals ultrastructural features of mitochondrial cristae architecture which reflect energetic state and aging. SciRep. 7, 45474 (2017).
- Cogliati, S., Enriquez, J. A., Scorrano, L. Mitochondrial Cristae: Where Beauty Meets Functionality. TrendsBiochemSci. 41 (3), 261-273 (2016).
- Friedman, J. R., Nunnari, J. Mitochondrial form and function. Nature. 505 (7483), 335-343 (2014).
- Suloway, C., et al. Fully automated, sequential tilt-series acquisition with Leginon. J Struct Biol. 167 (1), 11-18 (2009).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. J Struct Biol. 197 (2), 102-113 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved