Method Article
荧光寿命成像显微镜观察细胞内圈套的贩运
摘要
该协议描述了一种新的方法, 允许定量可视化的复杂形成的圈套蛋白, 基于 rster 共振能量转移, 和荧光寿命成像显微镜。
摘要
可溶性的N-ethylmaleimide 敏感融合蛋白 (NSF) 附着蛋白受体 (诱捕) 蛋白是膜交易的关键, 因为它们催化了真核细胞中的膜融合。诱捕蛋白家族由大约36不同的成员组成。特定的细胞内转运路线是由3或4诱捕蛋白的特定集合催化的, 从而有助于膜交易的专一性和保真度。然而, 研究诱捕蛋白的精确功能是技术上的挑战, 因为圈套是高度丰富和功能冗余, 与大多数陷阱具有多重和重叠的功能。在该协议中, 描述了一种新的在活细胞中诱捕复杂编队的可视化方法。这种方法的基础是表达圈套蛋白 c-终末期融合到荧光蛋白和测量其相互作用的 rster 共振能量转移 (苦恼) 使用荧光寿命成像显微镜 (电影)。利用多组分衰变模型拟合荧光寿命直方图, 电影允许 (半) 定量估计不同囊泡中圈套复合体的分数。该协议已成功地应用于可视化圈套复杂的形成在细胞膜和在内涵舱室在哺乳动物细胞线和主要免疫细胞, 并且可以容易地扩展到研究圈套作用在其他器官器在动物、植物和真菌细胞。
引言
膜的贩运是真核细胞的一个中心特征, 其中膜泡芽从一个捐献者的细胞器, 然后移动到和融合的目标器1,2。除线粒体外, 所有这些膜融合步骤都是由诱捕蛋白家族的成员1,2来催化的。圈套蛋白质家庭包括大约36名成员在哺乳动物细胞和大约20名成员在酵母2。诱捕蛋白包含一或两个 ~ 52 残滓-长, 本机非结构化的区域, 叫圈套主题。圈套蛋白质经常栓对细胞膜由 C 末端跨膜螺旋1,2。圈套可以被分类根据他们贡献对圈套复合体的中央残滓入精氨酸 (R) 和谷氨酰胺 (Q) 圈套1,2。膜融合是由3或4同源圈套的相互作用驱动, 共同贡献4圈套-主题和被分布在施主和受体膜1,2。网罗情结由一个 R 圈套主题和三 Q 圈套主题 (被称为 Qa, qb/t, 和 Qc) 组成。复杂的编队开始于陷阱图案的 N 个终点, 形成一个 so-called 的反式-圈套-复合体, 并向 C 终点的方向, 形成一个紧凑的α-螺旋盘绕卷束称为一个cis-圈套-复杂。甚至一个单一的圈套复合体的复杂形成将施主和受体膜结合在一起, 克服了膜融合的能量屏障3。
将不同的圈套配合物分配给细胞内的特定运输路线通常是技术上的挑战。虽然圈套明显地贡献了膜交易的特殊性, 他们是混杂的, 功能上多余的, 并且他们的作用重叠1,2。因此, 针对圈套的摄动实验, 如基因敲除、RNA 干扰、阻断抗体的引入, 或以可溶解的圈套片段作为显性阴性, 往往不会导致明显的表型陷阱补偿2,4。此外, 很难区分特定的膜融合步骤与上游贩运事件, 因为陷阱可以涉及多个运输路线2。利用显微镜方法对诱捕器进行定位研究, 使用 immunolabeling 或遗传融合对荧光报告蛋白, 有以下问题: (i) 陷阱定位到多个细胞器, 因为他们经常调解多个贩运步骤, 和 (ii)他们的定位并不自动意味着他们在功能上参与圈套复杂的形成。最后, 圈套复合体可以用沉淀实验来确定, 使用陷阱作为诱饵, 其他陷阱作为目标, 但这不允许把这些配合物分配给特定的细胞器或贩运路线。因此, 目前, 没有替代技术, 以可视化的圈套配合与 organellar 的决议。免疫荧光是不能证明圈套的相互作用, 但只能显示共存的存在或缺席, 而沉淀只可以显示圈套互动在整个细胞的人口, 但没有分配的器在这些交互发生。
为了克服这些限制, 新的方法, 允许定量可视化的活细胞中的圈套配合物的 organellar 分辨率最近开发了 Verboogen et al.5此方法基于光谱移位的荧光蛋白对其进行跨膜螺旋的表达。在完成了膜融合和形成一个cis-圈套复杂, 这些荧光在 C 总站的跨膜螺旋立即并列。荧光是然后在 rster 距离 (通常和 #60; 5 毫微米), 导致烦恼从绿色转移的施主荧光对红色被转移的接受者荧光5,6。焦虑的结果是在供体荧光的淬火和受体荧光的增加的排放量可以从施主和受体的比值 (比率烦恼) 来衡量。然而, 比率烦恼之间的两个不同的分子是具有挑战性的, 因为荧光相声和不同层次的施主和受体圈套在不同的细胞器和单元之间7,8。烦恼也可以从荧光寿命, 这是时间之间的激发和发射的光子。如果施主荧光能通过烦恼释放它的能量, 这竞争的过程导致明显缩短荧光寿命。这可以通过电影7,8来衡量。寿命烦恼比比率焦虑更健壮的是测量两个不同分子间的相互作用, 因为荧光寿命是荧光的内在属性, 对它的浓度不敏感。此外, 烦恼是由近似定量, 因为烦恼的效率是成反比的第六力量的距离之间的捐助者和受体荧光 (基本上是一个步骤功能)。因此, 通过拟合电影双衰变模型记录的荧光寿命直方图, 电影允许对参与圈套复杂编队的圈套分子的分数进行 (半) 定量估计.5。
最近, Verboogen et al.使用了这种电影方法在免疫系统的原树突状细胞中可视化圈套复杂的形成5。结果表明, 在遇到致病刺激后, 树突状细胞将其膜的贩运重新路由, 伴随着 R 圈套囊泡相关膜蛋白 (鞋面) 3 的增加络合, 而 Qa 陷阱 syntaxin 4 特别在等离子膜。这种增加的圈套复杂的形成可能需要满足增加分泌能力的分泌炎症细胞因子, 如 interleukin-65。本协议描述了在电影数据的可视化和 (半) 定量测量圈套配合物所需的实验步骤。解释了如何将全细胞荧光寿命直方图与单、双指数衰减函数相适应, 从而使视荧光寿命成为诱捕相互作用的定量估计。在这个协议中, 广泛使用的 HeLa 细胞线作为一个例子, 但该方法可以很容易地扩展到研究圈套复合物的其他真核细胞。
研究方案
1. 显微镜样品的制备
- syntaxin 4 融合到 mCitrine (syntaxin 4-mCitrine; 供体荧光) 和 R-圈套 VAMP3 融合到 mCherry (VAMP3-mCherry) 的表达
注意: 其他带有荧光蛋白的陷阱与 C 端跨膜螺旋的融合也可以使用。而不是 mCitrine-mCherry, 其他供受体对光谱分离荧光也可以使用 (例如, CFP-YFP)。- 生长 hela 细胞和分裂 90万 hela 细胞超过三35毫米直径的玻璃底盘适合显微镜。
注: 原则上, 本协议可适用于其他真核细胞类型和显微镜菜肴。- 维持 T75 烧瓶中的 HeLa 细胞培养, 10 毫升高糖 Dulbecco 氏改良鹰培养基 (DMEM), 辅以10% 胎小牛血清 (FCS) 和1% 抗生素-抗 (含两性霉素 B、青霉素和链霉素) 在37° c 和 5% CO2在单元文化孵化器中。
- 每周补充两次培养基, 每周1:10 次, 或当细胞达到 85-90% 70-100 到新的 T75 烧瓶 (平均50万细胞/烧瓶)。
- 用8毫升无菌磷酸缓冲盐水 (PBS) 去除 DMEM 并冲洗两次 HeLa 膜, 3 分钟。
- 取出 pbs, 并添加2毫升 pbs 与2毫米乙酸酸 (EDTA)。
- 孵育细胞为5分钟在37° c 和 5% CO2在单元培养孵化器, 随后轻轻搅动烧瓶, 以分离 HeLa 细胞从底部的烧瓶。
- 用10毫升培养基冲洗细胞, 将悬浮液转移至15毫升管, 并取出10µL 分进行计数。
- 用0.4% 台台盼蓝染色稀释分 1:1, 并用 Bürker 例9计数单元格。
注: 计数两个 4 x 4 平方和倍数的单元格数为1万的细胞/毫升的数量。 - 细胞计数后, 从15毫升管中取90万细胞, 除以3玻璃底盘 (见步骤 1.1.1), 并准备转染。
- 染通过电穿孔10 (参见材料表) 与 syntaxin 4-mCitrine 构造 (仅供者, 样品 #1), syntaxin 4-mCitrine 连同 VAMP3-mCherry (样品 #2), 和 syntaxin 3 融合到 mCitrine 和 mCherry (示例 #3)。
注: 其他细胞转染方法也可使用11。样本 #3 中的串联构造是估计最短寿命预期 (即, 最大预期烦恼) 的一种正控制。
- 生长 hela 细胞和分裂 90万 hela 细胞超过三35毫米直径的玻璃底盘适合显微镜。
- 培养细胞过夜在高葡萄糖 DMEM 供应与 10% FCS 和1% 抗生素抗在37° c 与 5% CO2在细胞培养孵化器。
- 用活细胞成像培养基 (140 毫米氯化钠) 吸 DMEM 并冲洗细胞一次2.5 毫米氯化钾, 1.8 毫米 CaCl2, 1 毫米氯化镁2, 20 毫米 HEPES, pH = 7.4, mOsm = 300; 查看材料表) 2 分钟, 然后将单元格放在新图像中中.
2. 电影数据的记录
- 将采样 #2 置于一个时域电影共焦显微镜下, 其脉冲励磁源用于供荧光 (即、mCitrine) 和分辨数据获取。将细胞保持在37° c, 加热阶段。
注: 本协议中使用的共焦显微镜装有 63X 1.20 NA 水浸泡物镜、脉冲白光激光器 (80 MHz 脉冲、#60; 100 ps 脉长)、光子倍增管 (PMT) 和与时间相关的单光子计数 (TCSPC) 系统 (请参阅材料表中的特定设置)。其他电影显微镜也可以使用 (例如, 单光子雪崩二极管 (SPAD) 而不是并联, 单脉冲激光器而不是白光脉冲激光器)。 - 选择一个具有可见表达的 mCitrine 和 mCherry 标记的诱捕蛋白的细胞, 并记录一个共焦图像 256 x 256 像素, 同时励磁两个荧光之前, 每电影测量。应使用大约2倍于显微镜 (200 nm) 的衍射有限空间分辨率的像素步长。为 mCitrine, 激发在516毫微米和收集放射从521-565 毫微米;为 mCherry, 激发在610毫微米并且收集放射从613-668 毫微米。
注意: 不要将成像平面放置在靠近碟底的位置 (在2µm 距离以内), 因为这将导致荧光寿命直方图中的反射峰值。同时激发的捐助者和受体荧光是首选, 因为这可以克服的潜在问题的样本移动。然而, 顺序励磁也可以使用。 - 通过单击运行电影, 将电影图像记录为与步骤2.2 中记录的共焦图像相同的尺寸和空间分辨率来录制电影图像。记录的图像至少5万光子的全细胞电影分析, 或至少400光子/像素。只激发 mCitrine 施主荧光, 而不是 mCherry 受体荧光, 从而激发在 516 nm, 并收集从 521-565 nm 发射。
- 重复步骤 2.1-2.3 为多个细胞和其他样品 #1 (仅供者) 和样品 #3 (mCitrine-mCherry 串联结构)。
- 记录仪器响应函数 (公路联合会)。将发射探测器的单色器调到激发波长 (例如, 记录从 510-550 nm 发射), 然后通过单击按钮运行电影来记录一个电影图像, 并从一个干净的玻璃覆盖滑块背面散射。使用相同的激发波长 (516 nm) 和激光功率, 用于在步骤 2.1-2.4 中记录单元数据。
注: 如果在公路联合会中有多个峰值可见, 或者如果无法调整发射单色, 则还可以使用具有超快寿命的荧光染料的溶液来测量, 例如, 在饱和水中的有机染料的荧光猝灭。碘化钾溶液。此外, 不需要严格记录一个公路联合会, 因为荧光直方图的衰变斜率也可以在不带褶积的情况下安装。然而, 一个公路联合会能够纠正所使用的光子探测器的定时特性, 从而使寿命直方图的拟合更加准确。
3。光子录音的转换到电影图象
- 下载并安装 PT32ICS 转换软件5。
注意: 寿命数据也可以通过其他软件进行分析, 包括一些显微镜供应商的软件。 - 配置 PT32ICS 软件。
- 通过设置将大小设置为 256 x 256 像素图像大小|大小。
- 通过设置将通道设置为2 |大小。
注: mCitrine 发射的通道完全依赖于显微镜的配置。错误的通道将导致没有光子的电影图像 (即, 黑色图像), 结果是一个空的 "LifetimeTable. txt" 文件。正确的通道可以通过试错来识别。 - 将输出设置为ImageJ (xyz) (或TRI2 (xyt)) 以生成电影映像 (步骤 3.4)。
- 按转换并加载一个或多个光子跟踪 (. pt3 文件)。要选择多个光子跟踪, 请按住Ctrl键。
注意: 新的64位. 机动格式也可以转换。 - 确保 PT32ICS 软件在保存 pt3 文件的同一文件夹中生成以下文件: 一个光子堆栈每. pt3 的光子跟踪在图像细胞仪标准格式 (. ics) 中, 一个位图文件每. pt3 光子跟踪 (. bmp), 每个转换的文本文件(_ Report.txt) 包含有关光子统计的信息 (即, 每个. pt3 光子跟踪, 探测器的时间分辨率), 以及每个转换的第二个文本文件 (_ LifetimeTable.txt), 包含总荧光寿命直方图, 以制表符分隔的格式为每个. pt3 光子迹。
注意:. ics 文件可用于单像素拟合, 以生成电影图像, 例如, 使用 TRI2 软件12、13或在斐济 ImageJ14、15中的纤细曲线拟合库。此文件也可用于相量分析16, 例如, 从 Spechron 的时间门控相位插件为斐济。位图文件不包含生存期信息。第二个文本文件用于4步中的整个单元格电影分析。
4. 用于全细胞电影分析的荧光寿命直方图拟合
注: 本步骤 (deconvoluted 拟合) 要求软件能够 deconvoluted 拟合。在不带褶积的情况下, 对荧光直方图的斜率进行拟合, 也可以用其他软件进行。
- 打开能够与反褶积 (材料表) 配合使用的数据分析软件程序, 并通过文件 |进口 |单个 ASCII。
- 重新组织该表, 使其位于表的第二列 (使用Copy和粘贴)。在第一列 a 的时间值旁边的第二列 B 中放置该公路联合会。
- 通过按ctrl+ A选择所有列并选择绘图 |多面板 |9面板。不要用高反射峰值 (图 4F) 分析光子迹。
- 使用Ctrl键选择包含将在 B 列中安装的质量控制的生存期直方图的所有列以及通过分析加载非线性管接头|配件 |非线性曲线拟合 |打开对话框。
- 通过将此函数添加到分析软件 (通过类别 |) 加载 deconvoluted fit 函数 (在补充文件 1中可用) 用户定义 |功能 |添加)。选择 fit 函数文件 "FLIM_convoluted_IRF. fdf"。此函数适用于带有 deconvoluted 的单指数衰减函数的荧光寿命直方图 (即, 表中的第二列 B) (公式 1):
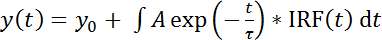 (公式 1)
(公式 1)
与t的时间, τ的明显荧光寿命,一个的振幅, 和y0的偏移量。
注意: 另一个选项是用双指数拟合函数 (公式 2) 拟合生存期直方图:
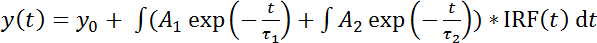 (公式 2)
(公式 2)
通过将慢速组件 (τ1) 的生存期固定到 "仅供者" 条件 (步骤 1.1.2: 示例 #1) 和快速组件 (τ2) 到串联构造 (示例 #3), 这允许估计从慢速 (a1) 和快速组件 (2; 请参阅讨论;公式 3):
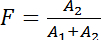 (公式 3)
(公式 3)
补充文件 2中提供了 deconvoluted 双指数拟合 "FLIM_convoluted_IRF_biexp. fdf" 的 fit 函数文件。 - 选择拟合曲线 |X 数据类型as 与输入数据相同。
注意: 这将导致适合的曲线的x轴缩放。 - 按fit调整曲线。
注意: 这将在数组中转换 fit 并生成一个 "报告表", 其中包含荧光寿命、偏移量和振幅的表。它还将生成一个带有拟合曲线和拟合残差的数据表。
结果
在图 1中显示了测试陷阱交互的电影的基本原理。同源诱捕蛋白跨膜螺旋的 c-终点与一对光谱转移的荧光蛋白 (如、mCitrine 和 mCherry) 融合。在膜融合后形成一个顺式-诱捕复合体会导致这些荧光蛋白被立即并列在一起而苦恼。图 2显示了表达荧光标记的诱捕蛋白的 HeLa 细胞的具有代表性的共焦图像。显示的是一个细胞表达 syntaxin 4-mCitrine (施主荧光) 与 VAMP3-mCherry (受体荧光), 以及控制条件的细胞只表示 syntaxin 4-mCitrine 构造 (捐助者只; 没有烦恼) 和 syntaxin 3 融合到两个 mCitrine和 mCherry 的串联 (最大预期烦恼)。图 3显示了伴随而来的荧光寿命和电影图像, 它们通过使用单指数衰减函数 (图 3AB) 和双指数衰减函数来拟合每个像素的生存期直方图 (图 3C-D).图 4A显示了由显微镜盖玻璃的背面散射测量的我们的设置。在图 4B-E中, 显示了整个细胞电影分析的代表荧光寿命直方图, 以及单指数衰减函数的伴随拟合曲线。图 4F显示了一个实验图像的荧光寿命直方图, 其成像距离显微镜盖玻璃的表面太近, 导致了突出的反射峰。图 4G显示了具有代表性的具有双指数衰减函数的生存期直方图。

图 1: 通过烦恼来可视化圈套复合体的基本原理的方案.(A) 神经元圈套的结构模型 (蛋白质数据库 3HD717) 囊泡相关膜蛋白 (鞋面) 2 (蓝色;R), syntaxin 1 (红色;Qa), 和 SNAP25 (绿色; 包含一个 qb/t 和 Qc 陷阱的主题)。syntaxin-1 的跨膜螺旋的 C 末端被共轭到 mCitrine (施主荧光; 蛋白质数据库 3DQ118)。VAMP2 的跨膜螺旋的 c-末端被共轭到 mCherry (受体荧光; 蛋白质数据库 2H5Q19)。(B) 圈套介导的膜融合方案引起烦躁。经过膜融合形成的一个cis-圈套复合体, 陷阱立即并列在一起, 造成烦恼。请单击此处查看此图的较大版本.
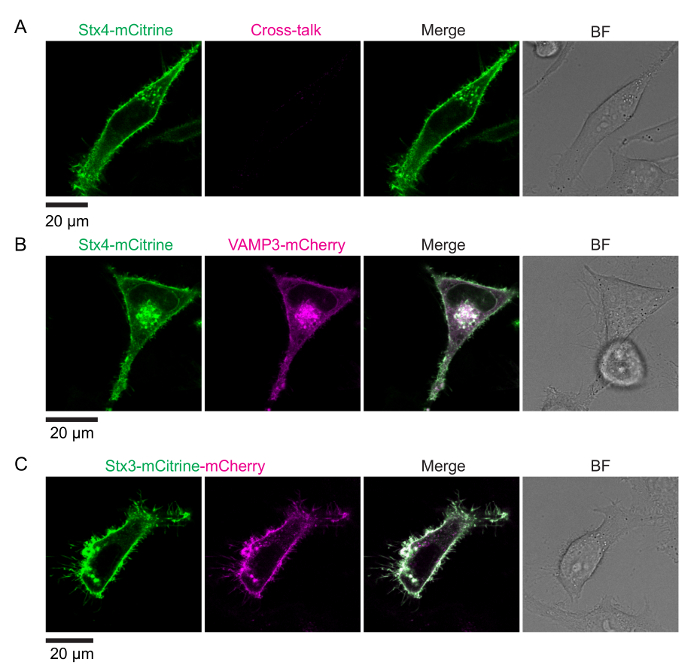
图 2: 与荧光蛋白融合的诱捕蛋白的表达.第一列: 捐助者荧光, 兴奋 516 nm。第二列: 受体荧光, 兴奋 610 nm。(A) 捐助者的唯一条件。表达 syntaxin 4-mCitrine (施主荧光; 绿色合并) 的 HeLa 细胞的具有代表性的共焦图像。受体通道 (第二列) 显示荧光相声。(B) 负控制 (无烦恼)。具有代表性的 HeLa 细胞的共焦图像, 表达 syntaxin 4-mCitrine 与 VAMP3-mCherry (受体荧光; 洋红色在合并)。(C) 正控制 (最大预期烦恼)。表达 syntaxin 3-mCitrine-mCherry 串联结构的 HeLa 细胞的具有代表性的共焦图像。注意, mCitrine 和 mCherry 信号的荧光信号并没有完全重叠, 很可能是由于 mCitrine 对溶酶体的抵抗力低于 mCherry (见讨论部分)。BF: 明亮的领域。刻度条, 20 µm.请单击此处查看此图的较大版本.
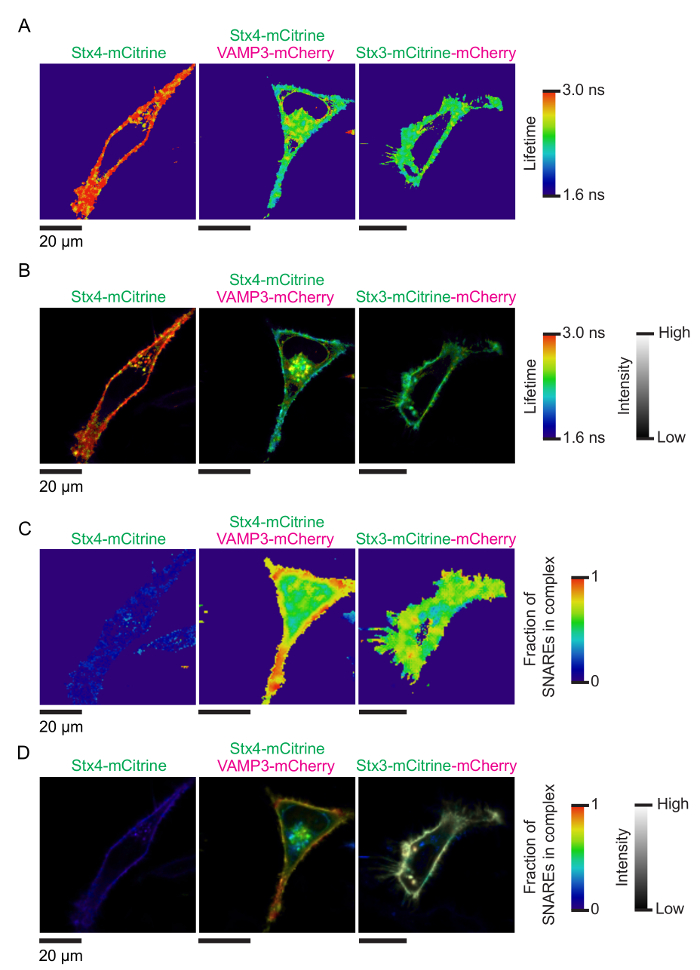
图 3: 电影的陷阱复杂编队的图像.(A) 显示在图 2中的单元格的具有代表性的荧光寿命图像。这些图像是通过先将 TCSPC 系统 (. pt3) 所记录的光子痕迹转换为使用 PT32ICS 软件的图像细胞仪标准 (. ics) 来生成的。然后使用 TRI2 软件12,13从15-100% 强度阈值、7像素圆分和 monoexponential 拟合算法 (马夸特) 生成单像素拟合荧光寿命图像。颜色表示平均明显的荧光寿命。(B) 电影图像, 其中荧光寿命图像 (在面板 A 中显示) 与 mCitrine 施主荧光的荧光强度是复杂的 (如图 2所示)。该卷积是使用 custom-made 宏的斐济 ImageJ 执行的 (请参见材料表)。(C) 荧光寿命和电影图像的 HeLa 细胞表达 syntaxin 4-mCitrine 和 VAMP3-mCherry 从面板 a-b, 但现在与拟合的双指数衰减曲线 (与终身固定的控制条件; 请参阅步骤4。4协议)。像素颜色用 VAMP3 (公式 3) 指示 syntaxin 4 的估计分数F 。(D) 与面板 B 相同, 但用于双指数拟合。该卷积是使用 custom-made 宏的斐济 ImageJ 执行的 (请参见材料表)。请单击此处查看此图的较大版本.
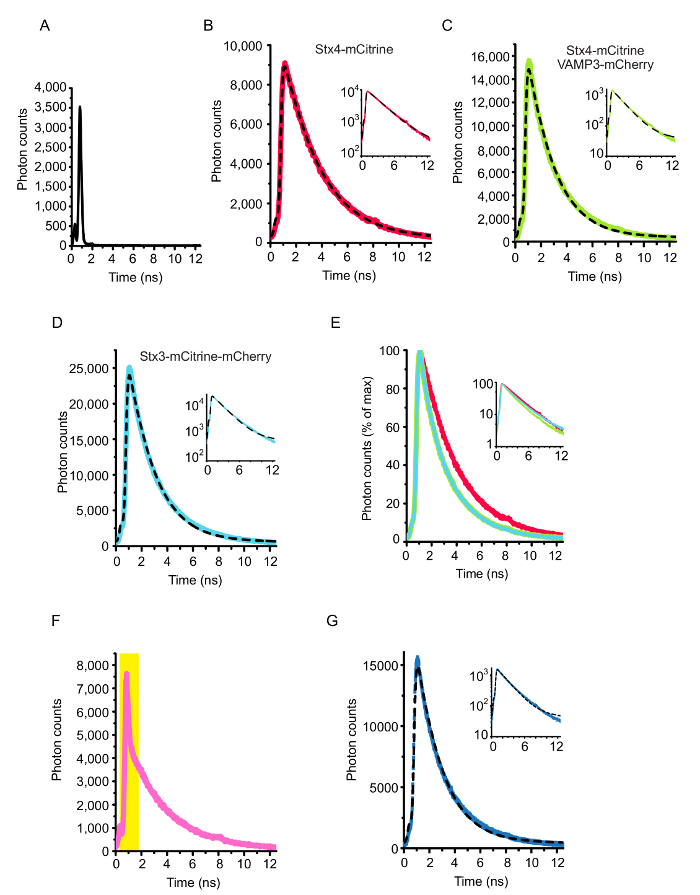
图 4: 整个单元格电影分析.(A) 安装程序的仪表响应函数 ()。用玻璃-水界面上的后向散射测量了公路联合会 (使用一个含水的清洁玻璃显微镜盘)。(B-E)图 2和图 3中显示的单元格的整个单元生存期直方图。图像中所有的光子都汇集在一起。曲线与 deconvoluted, 并装有单指数衰减函数 (方程式 1)。对于这些细胞, 荧光寿命为 2.82 ns (仅表达 syntaxin 4-mCitrine 的细胞; 仅供者; B 组), 2.09 ns (细胞 co-expressing syntaxin 4-mCitrine 与 VAMP3-mCherry; C) 和 2.08 ns (表示 syntaxin 3 的细胞mCitrine-mCherry 串联结构;最大预期烦恼控制;小组 D)。镶嵌显示相同的图形, 但现在与对数缩放的 y-axis。面板 E 显示了一个覆盖的衰变曲线的面板 b-D。(F) 一个荧光寿命直方图的例子, 记录太接近显微镜盖板的表面。这将导致一个大的反射峰值 (由黄色阴影区域描述)。(G) 与面板 C 相同, 但现在用双指数衰减曲线进行拟合, 并将寿命固定到控制条件 (请参见协议中的步骤 4.4)。快速 (A1) 的振幅和慢速 (a2) 组件分别为14.42 和 0.01, 从而导致在复杂的F 0.99 (公式 3) 中估计的陷阱分数。请单击此处查看此图的较大版本.
补充文件1。函数文件 FLIM_convoluted_IRF 请单击此处下载此文件.
补充文件2。函数文件 FLIM_convoluted_IRF_biexp 请单击此处下载此文件.
讨论
该协议展示了使用电影的 syntaxin 4 和 VAMP3 在活 HeLa 细胞的圈套相互作用的可视化。Syntaxin 4 是一种 Qa 陷阱蛋白, 主要定位在细胞膜上, 它介导胞1,2,20,21。VAMP3 是一个 R 圈套主要被描述在回收内涵隔间并且斡旋贩卖到其他体并且对血浆膜1,2,20。然而, 电影的检测可以很容易地适应研究其他诱捕蛋白。唯一的条件是, 这些陷阱包含一个 c-终端跨膜螺旋, 这是大多数诱捕蛋白的情况下, 远1,2。此外, 这里所描述的协议可以适用于任何真核细胞类型的圈套配合物的可视化, 包括植物和酵母。在本协议中, 我们使用缩短的荧光寿命的捐助者荧光作为一种措施的烦恼。作为一种互补的方法, 可以检查受体荧光的寿命, 因为致敏发射会产生一个明显的上升阶段, 从而提供了共振能量传递的明确证明。
目前, 电影技术可能无法想象在溶酶体舱室的圈套复合物。对于 syntaxin 3-mCitrine-mCherry 串联结构, mCherry 荧光往往可以发现更多的积累在 juxtanuclear 地区, 这可能对应于溶酶体舱室, 而 mCitrine 信号是更丰富的细胞外围5。mCherry 与 mCitrine 的相似的 juxtanuclear 积累被观察了, 当同样诱捕蛋白质熔化了到这些荧光蛋白质是 co-expressed 的5。溶酶体的特点是极低的 pH 值 (和 #60; 4) 和高活性的蛋白酶。与 mCitrine 荧光相比, mCherry 的 juxtanuclear 积累可能是由于 mCherry 荧光对溶酶体降解的抗性较高。这不是由于 pH 猝灭的 mCitrine, 因为 juxtanuclear 积累的 mCherry 也发生在固定的细胞5。因此, 电影技术低估了 juxtanuclear (溶酶体) 地区的烦恼量, 这将需要其他的荧光报告蛋白, 生存在严酷的条件内溶酶体流明。
电影原则上允许在复杂的5中获得对陷阱分数的 (半) 定量估计。正如我们在本协议中所解释的, 这需要用 double-exponential 衰变函数 (方程式 2) 来拟合荧光寿命直方图, 其中快速分量的振幅与复杂的圈套的分数成正比 (公式 3)。然而, 这样的配件与两个组成部分的模型是技术上的挑战。拟合与多个自由拟合参数 (两个荧光寿命和两个振幅) 需要大量的光子, 特别是因为参数将相互影响和小错误的寿命将影响的振幅和副反之亦然。为了克服这些拟合问题, 慢分量的荧光寿命可以固定到供者唯一条件的寿命 (即, 不烦恼; 只有 mCitrine 存在) 和快速分量对串联结构寿命的影响 (最大预期烦恼)。然而, 这也应该被解释与关心, 因为荧光寿命可能不是相同的在这些控制状态, 并且可能偏离由于多重原因 (灭, 偶极取向, 变化在微环境)。多圈套在接近的接近度 (和 #60; 10 nm) 可能导致距离依赖苦恼, 同样的原则, 允许烦恼被用作 "分子统治者", 但在这种情况下, 掩盖了定量的圈套复合物。此外, 定量估计并不总是有意义的, 因为标记的陷阱与内生 (未标记的) 陷阱竞争。结果, mCherry 标记的圈套的表达水平是一个主要决定因素为焦虑的百分比5。由于所有这些警告, 建议使用单指数衰减函数 (公式 1) 来拟合荧光寿命直方图。这有一个优点, 即它不需要任何先验知识的寿命和由此产生的明显的平均荧光寿命提供了一个坚实的衡量圈套络合5。
然而, 预计两组分拟合模型的定量电影成像将具有很强的应用前景。染色体内的圈套编码基因可以与荧光报告蛋白融合, 例如 CRISPR/CAS9。这就导致了内源性诱捕蛋白的荧光标记, 具有内生蛋白水平, 无标记圈套的背景, 从而允许对电影的圈套复合物的分数进行有意义的定量估计。虽然内生陷阱的表达水平可能相当低, 并给予相对较低的荧光信号, 但预计将获得足够数量的光子, 特别是对整个细胞电影 (只需要几个1,000 的光子)。此外, 这些电影测量可以执行更敏感的雪崩光电二极管探测器, 这也将导致更高的荧光信号和更好的光子统计。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了来自内梅亨大学医学中心的希帕蒂亚奖学金的支持, 这是从人类前沿科学项目的职业发展奖, 来自荷兰科学研究组织的万有引力方案 2013 (NWO;ICI-024.002.009), NWO (ALW 了 864.14.001) 的了赠款, 以及欧洲联盟第七框架方案下的欧洲研究理事会 (紧急救济协调员) 的起始赠款 (赠款协议编号 336479)。
材料
| Name | Company | Catalog Number | Comments |
| Plasmid DNA 'syntaxin 4-mCitrine' | Addgene | ID 92422 | Other SNAREs with fluorescent proteins fused to their C-terminal transmembrane helices can also be used. Instead of mCitrine-mCherry, other donor-acceptor pairs of spectrally separated fluorophores can also be used (e.g., CFP-YFP). |
| Plasmid DNA 'VAMP3-mCherry' | Addgene | ID 92423 | Other SNAREs with fluorescent proteins fused to their C-terminal transmembrane helices can also be used. Instead of mCitrine-mCherry, other donor-acceptor pairs of spectrally separated fluorophores can also be used (e.g., CFP-YFP). |
| Plasmid DNA 'syntaxin 3-mCitrine-mCherry' | Addgene | ID 92426 | Positive control for maximum achievable FRET. |
| Hela cells | |||
| 35 mm glass bottom dishes | Willco Wells | HBST-3522 | Other live cell imaging chambers will work as a substitute |
| Dulbecco's Modified Eagle Medium | Gibco, Life Technologies | 31966-021 | |
| Fetal calf serum | Greiner Bio-one | 758093 | |
| Antibiotic-antimycotic solution | Gibco, Life Technologies | 15240-062 | Pen/Strep will work as a substitute |
| Live cell imaging medium | Thermo Fisher Scientific | A14291DJ | Any other live cell imaging solution will work, as long as fluorescence from the medium is prevented |
| Leica SP8 confocal microscope with a 63x 1.20 NA water immersion objective | Leica | SP8 | Other confocal microscopes capable of time-domain FLIM can also be used |
| Pulsed white light laser | Leica | SP8 | Other pulsed laser sources can also be used |
| Time-Correlated Single Photon Counting (TCSPC) system | PicoQuant | PicoHarp 300 | |
| PT32ICS conversion software | Available at the 'Software'-section of www.membranetrafficking.com | ||
| data analysis software programme capable of deconvolution | Originlabs | OriginPro 2016 | |
| Fiji ImageJ | |||
| Custom-made Fiji ImageJ macro for convolution of FLIM image with Intensity | Fiji ImageJ | Available at the 'Software'-section of www.membranetrafficking.com | |
| Bürker Haemocytometer | VWR | 630-1541 | |
| HeLa cells | ATCC | ATCC CCL-2 | |
| PBS | B Braun Melsungen AG | 362 3140 | |
| EDTA 2 mM | Merck | 108417 | CAS: 60-00-4 |
| 15 mL tubes | Greiner Bio-one | 188271 | |
| Trypan blue | Sigma Aldrich | 93595 | CAS: 72-57-1 |
| NEON cell electroporation device | Thermo Fisher Scientific | MPK5000S |
参考文献
- Jahn, R., Scheller, R. H. SNAREs - engines for membrane fusion. Nat Rev Mol Cell Biol. 7 (9), 631-643 (2006).
- Hong, W. SNAREs and traffic. Biochim Biophys Acta. 1744 (2), 120-144 (2005).
- van den Bogaart, G., Jahn, R. Counting the SNAREs needed for membrane fusion. J Mol Cell Biol. 3 (4), 204-205 (2011).
- Bethani, I., Werner, A., Kadian, C., Geumann, U., Jahn, R., Rizzoli, S. O. Endosomal fusion upon SNARE knockdown is maintained by residual SNARE activity and enhanced docking. Traffic. 10 (10), 1543-1559 (2009).
- Verboogen, D. R. J., González Mancha, N., Ter Beest, M., van den Bogaart, G. Fluorescence lifetime imaging microscopy reveals rerouting of SNARE trafficking driving dendritic cell activation. eLife. 6, (2017).
- Degtyar, V., Hafez, I. M., Bray, C., Zucker, R. S. Dance of the SNAREs: assembly and rearrangements detected with FRET at neuronal synapses. J Neurosci. 33 (13), 5507-5523 (2013).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Wallrabe, H., Periasamy, A. Imaging protein molecules using FRET and FLIM microscopy. Curr Opin Biotechnol. 16 (1), 19-27 (2005).
- JoVE Science Education Database Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2017).
- Thermo Fisher Scientific. . NEON transfection system cell protocols HeLa. , (2017).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Barber, P. R., Ameer-Beg, S. M., Gilbey, J. D., Edens, R. J., Ezike, I., Vojnovic, B. Global and pixel kinetic data analysis for FRET detection by multi-photon time-domain FLIM. Proc. SPIE. 5700, 171 (2005).
- Barber, P., et al. Multiphoton time-domain fluorescence lifetime imaging microscopy: practical application to protein-protein interactions using global analysis. J R Soc Interface. 6 (Suppl 1), S93-S105 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Hinde, E., Digman, M. A., Welch, C., Hahn, K. M., Gratton, E. Biosensor Förster resonance energy transfer detection by the phasor approach to fluorescence lifetime imaging microscopy. Microsc Res Tech. 75 (3), 271-281 (2012).
- Stein, A., Weber, G., Wahl, M. C., Jahn, R. Helical extension of the neuronal SNARE complex into the membrane. Nature. 460 (7254), 525-528 (2009).
- Barstow, B., Ando, N., Kim, C. U., Gruner, S. M. Alteration of citrine structure by hydrostatic pressure explains the accompanying spectral shift. PNAS. 105 (36), 13362-13366 (2008).
- Shu, X., Shaner, N. C., Yarbrough, C. A., Tsien, R. Y., Remington, S. J. Novel chromophores and buried charges control color in mFruits. Biochemistry. 45 (32), 9639-9647 (2006).
- Veale, K. J., Offenhäuser, C., Lei, N., Stanley, A. C., Stow, J. L., Murray, R. Z. VAMP3 regulates podosome organisation in macrophages and together with Stx4/SNAP23 mediates adhesion, cell spreading and persistent migration. Exp Cell Res. 317 (13), 1817-1829 (2011).
- Gómez-Jaramillo, L., et al. Syntaxin-4 is implicated in the secretion of antibodies by human plasma cells. J Leukoc Biol. 95 (2), 305-312 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。