Method Article
Trichostatin a 和维生素 C 的组合治疗提高体细胞细胞核移植克隆小鼠的效率
摘要
我们用 trichostatin a、维生素 C 和去离子牛血清白蛋白来描述一种显著改进的小鼠克隆方法。我们展示了一个简化的、可重现的协议, 支持克隆胚胎的高效开发。因此, 该方法可以成为鼠标克隆的标准化程序。
摘要
体细胞核转移 (SCNT) 提供了一个独特的机会, 直接生产克隆动物从捐赠细胞, 它需要使用熟练的技术。此外, 克隆动物的成功生产, 特别是小鼠的繁殖效率仍然很低。已有许多尝试提高克隆效率, 和 trichostatin (TSA), 组蛋白乙酰抑制剂, 已被广泛用于提高克隆的效率。在这里, 我们报告了一个显著改进的克隆方法在小鼠。这种体细胞核转移方法涉及使用日本凝集病毒的信封 (HVJ), 这使得易于操作。此外, 使用两个小分子, TSA 和维生素 C (VC), 与去离子牛血清白蛋白 (dBSA) 的治疗, 是非常有效的胚胎发育。这种方法既不需要额外的注射, 也不要求基因操作, 因此提出了一种简单的、适合实际使用的方法。这种方法可以成为研究人员从培养细胞中生产转基因动物的技术上可行的方法。此外, 它可能是一个有用的方式来拯救濒危动物通过克隆。
引言
SCNT 技术通过只使用一个体细胞或一个细胞核转移到无核卵母细胞, 使克隆的动物得以生产。SCNT 技术的目的之一是从克隆胚胎中衍生核转移胚胎干细胞 (NT-ESCs) 线。在 1998年, 和歌山et al, 报告第一次生成成功克隆的鼠标命名为 Cumulina1。此后, 对小鼠的克隆进行了广泛的研究, 获得了对体细胞核重新编程的许多重要见解。另一方面, 这种技术伴随着许多微操作系统步骤, 很难掌握, 需要3月以上的强化训练 2.
使用 SCNT 克隆小鼠的生产已经从原始檀香山方法1, 融合方法3, 到凝集病毒的日本 (HVJ)4的细胞融合方法进化而来。然而, 直接注射细胞核通过细胞膜往往不利影响卵母细胞的生存。融合效率低, 因为每个细胞膜都有不同的硬度, 因此很难确定最佳条件。处理 HVJ 是费力的, 因为它需要特定的设备, 以安全的研究员和实验动物。最近, 为了融合供体细胞和卵母细胞胞浆, HVJ 已经使用了5。HVJ 只有在没有病毒增殖或感染能力的情况下才能融合膜。HVJ 基因组 rna 在 HVJ 中完全灭活。HVJ 的使用, 从而支持在 SCNT 期间容易处理细胞融合。
有几份报告显示, 用组蛋白乙酰抑制剂 TSA 治疗 SCNT 胚胎可显著提高活幼崽的生产效率, 从不到1% 到 6.5%6,7。TSA 处理通过修改 SCNT 胚胎中的组蛋白标记加速重新编程8。最近, 注射特殊的基因, 组蛋白赖氨酸去甲基酶 4 (KDM4), 其中删除组蛋白 H3 噬菌体 9 (H3K9) trimethylation 在 SCNT 胚胎, 特别是在 reprograming 抗性地区, 已显示, 以增加克隆的发展鼠标胚胎9。同时, VC 也作为组蛋白修饰符, 降低了 H3K910的 trimethylation。此外, VC 提高猪 SCNT 的胚胎发育10。据报道, 注射 dBSA 到 SCNT 胚胎导致胚胎发育的改善11。
我们以前发现, 小分子的组合, 即 TSA 和 VC, 连同 dBSA, 大大增强了 SCNT 胚胎的发展12。在这里, 我们详细介绍了以前报告的小鼠 SCNT 方法, 它代表高效和简单的克隆过程12。我们还描述了 HVJ 的处理。这些可以帮助发展和生殖生物学领域的许多研究人员保存遗传资源或通过这种 SCNT 方法生产转基因动物。
研究方案
所有动物规程符合一出大学的指南为实验室动物的关心和用途。
1. 文化媒体的准备工作
- 为胚培养制备改良的 KSOM (mKSOM) 培养基, 包括95毫米氯化钠、2.5 毫米氯化钾、0.35 毫米的2PO4、0.2 mm MgSO4 ·7H2O, 1.71 毫米 CaCl2 ·2H2O, 0.2 毫米 D (+) 葡萄糖, 0.2 毫米丙酮酸钠, 1.0 毫米 l-谷氨酰胺, 1.0 克/升 Polyvinylpyrrolidone (PVP), 25.07 毫米 NaHCO3, 10 毫米 dl-乳酸钠, 0.05 克/升青霉素, 和0.05 克/升链霉素在无菌水中。
- 准备 Hepes 缓冲的 CZB (HCZB) 培养基进行胚胎操作, 包括81.5 毫米氯化钠, 4.8 毫米氯化钾, 1.7 毫米 CaCl2 ·2H2O, 1.18 毫米 MgSO4 ·7H2O, 1.18 毫米的.2PO4, 0.11 毫米 EDTA ·2Na, 36.1 毫米 dl-乳酸钠, 5.55 毫米 D (+) 葡萄糖, 0.025 克/毫升青霉素, 0.035 克/升链霉素, 0.014 毫米苯酚红色, 1.0 克/升聚乙烯醇, 5.0 毫米 NaHCO3, 和20.0 毫米 Hepes 钠盐在无菌水中。
- 准备活化培养基为卵母细胞活化: mKSOM 培养基辅以50毫微米 TSA, 2 毫米 EGTA, 5 µg/毫升细胞松弛素 B (CB), 5 毫米SrCl2。
2. 去离子牛血清白蛋白 (dBSA) 的制备
- 在室温下将1.2 克的牛血清白蛋白 (BSA) 溶解在10毫升的无菌水中 (最后浓度为 12%)。
- 在室温无菌水中加入约0.12 克的混合离子交换树脂珠, 以温和搅拌的条件制备12% 的 BSA。
- 当珠子将颜色从蓝绿色变成金色时, 用吸管来恢复上清液。然后用新的珠子替换 (图 1)。
注: 更换珠子通常只执行一次。它可能需要一些替换来完成去离子。仅作为指南, 如果珠子的颜色保持不变从蓝绿色到金子, 它表明离子交换是完整的。 - 在确认珠子中没有颜色变化后, 恢复解决方案。
注: 如果恢复的解决方案变成多云, 离心机, 以防止堵塞过滤器 (175 x g, 5 分钟)。 - 使用250µL 10.5% NaHCO3来补充恢复的解决方案。
注: 此过程用于 dBSA 溶液中和 pH 条件。但是, NaHCO3可以是可有可无的。 - 使用0.45 µm 过滤器消毒上清液, 并以-20 摄氏度为 dBSA 库存溶液。
3. 卵母细胞收集
注意: 所有老鼠都是在光控和空调房间里保养的。
- 超排卵每只雌性 B6D2F1 鼠 (8-10 周), 腹腔注射7.5 内孕母马血清促性腺激素 (PMSG) 和7.5 的人绒毛膜促性腺激素 (hCG) 48 h 后 PMSG 注射液。
- 在 hCG 注射后, 宫颈脱位 14-16 小时进行安乐死。使用标准解剖技术13切开腹部以进入生殖道。简单地, 捏紧皮肤, 用剪刀在中线做一个小的侧向切口。将皮肤牢牢地固定在切口的上方和下方, 并将皮肤拉向头部和尾部。用剪刀切开腹膜, 把肠子的线圈推出来, 确认子宫、输卵管和卵巢两角的存在。
- 根除输卵管用小直剪刀和镊子, 放在一张滤纸上擦拭表面的血迹。在矿物油中设置输卵管。然后, 用解剖针切开输卵管的壶腹, 将来自输卵管壶腹的卵母细胞复合物移动到200µL 滴 HCZB 培养基中, 0.1% 透明质酸酶。在暖盘上孵育5分钟。
注意: 在 HCZB 培养基中, 0.1% 透明质酸酶的暴露时间超过10分钟对卵母细胞有害。 - 确认卵丘细胞在显微镜下从卵母细胞中释放, 转移第二减数分裂中期 (产业部) 阶段卵母细胞, 并将剩余的卵丘细胞移植到含有 0.3% dBSA 的 mKSOM 培养基中。然后, 在含有 0.3% dBSA 的 mKSOM 培养基中, 通过吹打 (使用 < 100 µm 内径的吸管) 将剩余的卵丘细胞分离, 洗涤产业部卵母细胞四次。
注: 使用小吸管有利于卵丘细胞的脱离。 - 孵化 Mll 阶段卵母细胞在 mKSOM 培养基包含 0.3% dBSA 在37°c 下 5% CO2孵化器, 直到摘除。
注: 建议使用直径略大于卵母细胞的小吸管。
4. 为核转移准备捐助者细胞
- 3.3-3.5 步后, 裸露的卵母细胞与卵丘-卵母细胞的复合体分离。转移少量 (大约2µL) 的剩余的卵丘细胞分散从卵丘-卵母 HCZB 培养基与0.1% 透明质酸酶到 HCZB 培养基 6% dBSA 使用吸管下显微镜。
- 将卵丘细胞放在 HCZB 培养基中, 6% dBSA 在37摄氏度, 直到 SCNT 需要。
注: 当成纤维细胞 (e. g) 被用作捐献细胞时, 将细胞从组织培养皿中分离出来, 并将其离心成颗粒。并用重悬 HCZB 培养基中含有 6% dBSA 的细胞颗粒。
5. 卵母细胞的摘除
- 准备 9% pvp 培养基, 添加0.9 克 pvp 到10毫升 HCZB 培养基, 保持在冰箱隔夜 (4 °c), 然后使用0.45 µm 过滤器消毒。
- 通过加入5毫克的 cb 到5毫升二甲基亚砜 (亚砜), 制备 cb 溶液 (浓度为1毫克/毫升)。用 HCZB 介质 (最终浓度为5µg/毫升) 稀释 CB 溶液, 并作为溶出液使用。
- 通过消毒吸管吸入和呼气 (内径: 150 µm 至200µm), 在含有5µg/毫升 CB (Mll) 的 HCZB 培养基中冲洗20µL 的卵母细胞。重复洗涤过程五次。在开始摘除过程前, 在变暖板上等待大约10分钟。
- 准备摘除室, 如图 2A所示。使用吸管 (内径: 150 µm 到200µm), 通过吸入和呼出 Mll 卵母细胞转移到摘除室;放置4µL 的溶出液, 并用矿物油盖住燃烧室。
注: 可使用60毫米培养皿的盖子代替腔室。 - 在室温下, 在显微镜下 (400X) 识别出产业部卵母细胞的纺锤和染色体。定向 Mll 阶段卵母细胞与发音的第一极性身体, 因此纺锤和染色体的定位在3或9点 (图 2B) 位置使用持有的吸管和微。
注: 显微镜使用的镜头总有400X 倍的放大倍数。另外, 物镜的物镜为 5 x/0.12 和 40 x/0.55。压电脉冲驱动的吸管允许快速钻井的透明透明。此外, 激光系统 (例如, XYClone) 也可以用于钻孔的透明透明代替压电驱动系统。 - 将压电脉冲强度设置为 3-6, 然后使用微操作系统吸管 (7-8 µm 内径平端尖端) 钻取到透明透明, 并将其压入脉冲驱动。在透明透明上打开一个孔后, 完全 enucleate 纺锤和染色体的细胞质量最小 (图 2C)。
注意: 在这个过程中, 卵母细胞倾向于紧密连接到盘子底部或吸管由于培养基没有 BSA14。在10分钟内, 摘除过程必须完成, 无核卵母细胞需要返回到孵化器。在一个摘除术中可以操作的卵母细胞的适当数量在10和20之间。对于大批量的卵母细胞, 摘除术是重复的。 - 确认可见光下细胞质中的染色体缺失 (图 2C, 中间), 然后在含有 0.3% dBSA 的 mKSOM 培养基中彻底清洗无核卵母细胞。在 5% CO2下, 将菜式引入孵化器37摄氏度, 直到细胞融合。
注: 摘除后, 从 ooplasm 中取出的细胞质含有纺锤和染色体。
6. 供体细胞与无核卵母细胞的融合
-
HVJ 的制备
- 添加260µL 冰冷 HVJ 悬浮液冻干 HVJ e (从套件, 见材料表) 和吸管向上和向下, 直到完全悬浮。
注: 在瓶中准备适量的冻干 HVJ, 260 µL HVJ 悬浮液包括在试剂盒中。 - 准备5µL 整除数的 HVJ 溶液, 然后存储在-80 °c, 直到细胞融合。
注意: 小心对待冰上的 HVJ, 因为它是温度敏感的。实验完成后, 适当的蒸压 HVJ 材料和容器, 完全灭活病毒成分。
- 添加260µL 冰冷 HVJ 悬浮液冻干 HVJ e (从套件, 见材料表) 和吸管向上和向下, 直到完全悬浮。
-
细胞融合
- 在使用前立即稀释5µL 的 HVJ 溶液与细胞融合缓冲器的20µL。将稀释后的 HVJ 溶液放在冰上, 直到使用。
注意: 单元融合缓冲区包含在 HVJ 套件中。 - 准备单元融合室, 如图 3A所示。使用吸管 (内径: 150 µm 到200µm) 将无核卵母细胞转移到 HCZB 培养基上;将每种溶液的4µL (HCZB 培养基中含有 6%-BSA 用于供体细胞、HVJ 溶液、HCZB medium,9%pvp 在 HCZB 培养基中), 并覆盖约1毫升矿物油的腔室。
注: 在一个细胞融合过程中, 适当数量的无核卵母细胞被转移到腔内进行操作是从5到30。对于更大的卵母细胞, 细胞融合过程是重复的。如果有的话, 可以使用60毫米的培养皿盖代替腔室。 - 在 400X magnificationat 室温下, 将无核卵母细胞置于显微镜下 HCZB 培养基中。用微操作系统吸管 (6-7 µm 内径平端) 吸入供体细胞, 并将细胞排出 HVJ 悬浮液中。
- 然后将卵丘细胞一个接一个地吸入 HVJ 悬浮液, 使其相互分离, 从而实现串联细胞融合。使用持有吸管将无核卵母细胞保持在 HCZB 培养基中。用压电脉冲 (强度为 3-6, 速度为 2-3) 钻出透明透明与微操作系统吸管。
- 在透明透明中打开孔后, 将卵丘细胞紧紧地放在卵母细胞膜上, 连同 HVJ 悬浮液, 其体积是卵丘细胞体积的5倍, 不经过卵母细胞膜。
注: 准备 6-7 µm 内直径微操作系统吸管的扁端尖卵丘细胞。吸管必须定期清洗使用 9% PVP 培养基, 以保持平滑的细胞释放。步骤 6.2.3-6.2.5 必须在10分钟内完成, 否则细胞融合的效率将会降低。HVJ 的膜融合活性通过热处理、洗涤剂处理或70% 乙醇进行灭活。实验结束后, 必须对 HVJ 溶液进行适当的处理。 - 在操作细胞融合后, 及时将卵母细胞转移到含有 0.3% dBSA 的 mKSOM 培养基中, 并在 5% CO2下移动到37°c 的孵化器中, 1 h。
- 在使用前立即稀释5µL 的 HVJ 溶液与细胞融合缓冲器的20µL。将稀释后的 HVJ 溶液放在冰上, 直到使用。
7. 重组卵母细胞的活化和 Trichostatin a 和维生素 C 的治疗
-
TSA 的准备
- 免除 5 mM TSA 解决方案到3µL 整除数, 并存储的解决方案在-20 摄氏度。
- 添加2.5 µL 5 毫米 TSA 库存解决方案1毫升亚砜 (浓度为12.5 µM)。
- 稀释8µL 12.5 µM TSA 库存溶液在2毫升的活化介质和 mKSOM 介质 (最终浓度为 50 nM)。
-
VC 的制备
- 将1毫克 VC 加入1毫升无菌内毒素的水中, 并贮存在-20 摄氏度。
- 将 VC 库存解决方案添加到 mKSOM 介质中 (最终浓度为10µg/毫升)。
-
重建卵母细胞的活化
- 细胞融合后一小时, 使用显微镜 (400X) 检查重建卵母细胞 (图 3B) 中的过早染色体凝结 (PCC)。
- 将重建后的卵母细胞转移到活化介质 (见步骤 1.3), 其中包含 TSA, 并在空气中的 5% CO2下孵育6小时 (图 3C)。观察 SCNT 胚胎中的亲核的形成, 然后在含有 0.3% dBSA 的 mKSOM 介质中应用2小时的 TSA 治疗 (图 2C)。
- 将 TSA 处理的胚胎转移到 mKSOM 培养基中, 辅以 VC 和孵育7小时, 如图 3D所示。
- 在 vc 治疗7小时后, 将 vc 处理的胚胎转移到含有 0.3% dBSA 的 mKSOM 培养基中, 并在空气中 5% CO2下孵育4天37摄氏度。
注: 在发现阴道插头 (pseudopregnancy 0.5 天)15时, 要生产克隆小鼠, 将形态正常的2细胞阶段胚胎转移到伪怀孕雌性小鼠 (MCH) 的输卵管。19.5 天后, 剖宫产术后植入部位和新生儿的数量被记录在案。
结果
为制备克隆小鼠胚胎, 采用卵丘细胞和胎成纤维细胞。卵母细胞活化后2细胞阶段的重建卵母细胞数量和发育情况见表 1。在所有条件下观察到了一个非常高的显微形成率 (89 到 100%) 和发展到2细胞阶段 (77 到 89%)。从卵丘细胞中提取的一些克隆胚胎, 发育到2细胞阶段, 被转移到伪怀孕雌性的输卵管。通过 TSA 和 VC (图 4) 的串行治疗, 从三名孕妇中产生了六克隆后代, 其中72个已移植的胚胎。据报告, 大约15% 的克隆胚胎通过遵循此 SCNT 过程12来发展到期限。此外, 在其他机构中移植克隆的2细胞胚胎已达到9至15% 个活子代, 这比单一的 TSA 治疗克隆胚胎更有发展。此外, 与 TSA 和 VC 的治疗显著提高了体外胚胎发育到胚泡阶段的效率 (表 2, P < 0.05, 学生的 t 测试)。这些体外发展数据表明, 小鼠菌株和细胞类型都不限制 TSA 和 VC 的正效应。这些结果表明, 这种 SCNT 方法促进了克隆胚胎的发育能力。

图 1: dBSA 的制备。
描述了准备 dBSA 解决方案的分步过程。离子交换的程度可以由珠子的颜色变化来判断。左上图显示, 1.2 克 BSA 在室温下溶解于10毫升的无菌水中。在 BSA 被溶化以后, 离子交换树脂珠子增加 (右上)。当 BSA 溶液与离子交换树脂珠的混合物改变颜色从蓝色绿色到金子 (右下), 替换珠子与新鲜的。左下角图表明, 珠子的颜色保持蓝绿色, 离子交换完成。请单击此处查看此图的较大版本.
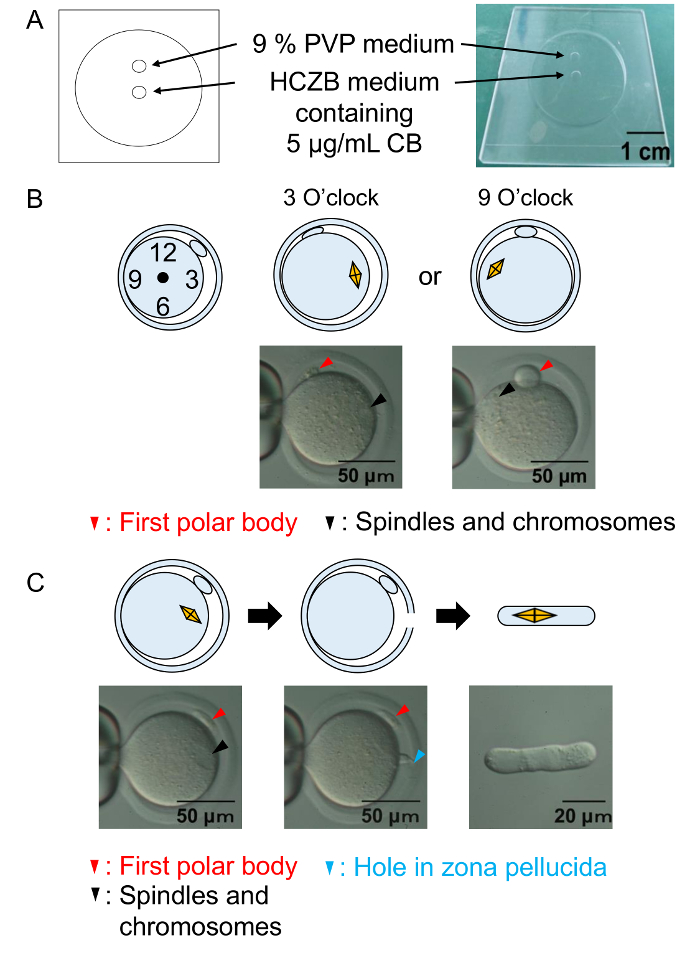
图 2: 摘除程序。
(A) 对摘除腔的说明。卵母细胞的摘除是在 HCZB 培养基中进行的。对于压电驱动系统, 用 9% PVP 介质的光斑来制备用于摘除的玻璃吸管。斑点被矿物油覆盖。(B) 图和显微图像在摘除前显示纺锤形和染色体的位置。黑色箭头: 纺锤和染色体。红色箭头: 第一个极性身体。(C) 图和显微图像显示成功的摘除。黑色箭头: 纺锤和染色体。红色箭头: 第一个极性身体。蓝色箭头: 在透明透明的洞。请单击此处查看此图的较大版本.
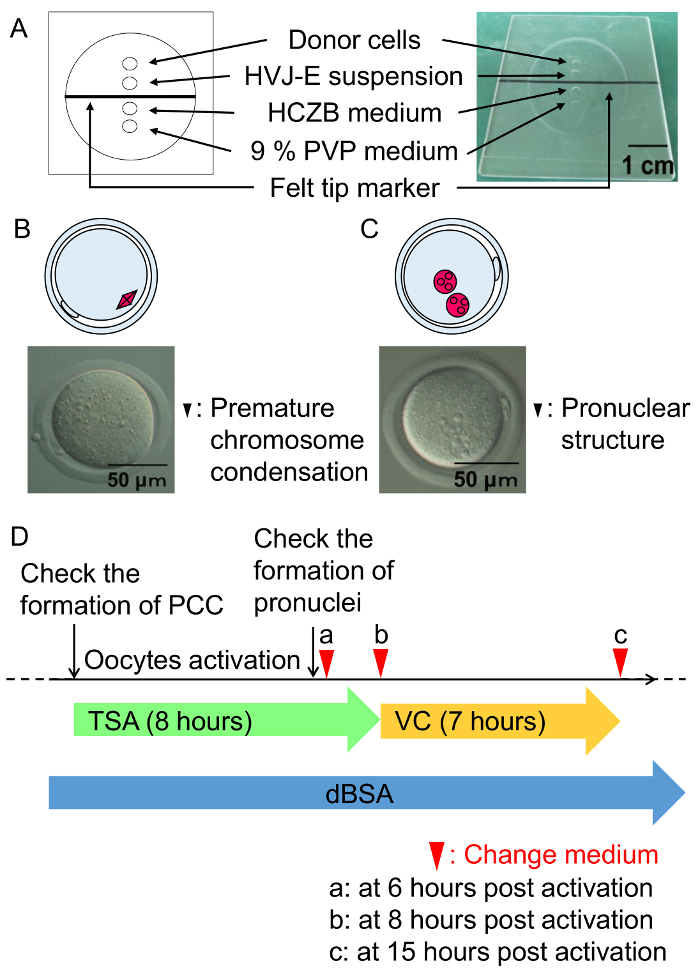
图 3: 细胞融合程序和 SCNT 胚胎的培养条件。
(A) 细胞融合室的图示。细胞融合是在含有 6% dBSA 的 HCZB 培养基中进行的。9% PVP 培养基的斑点用于制备细胞融合用的玻璃吸管。斑点被矿物油覆盖。(B) 在细胞融合 (黑色箭头) 后一小时内形成的一个图和过早染色体凝结的显微图像。(C) 图和显微结构的显微图像在激活后六小时形成 (黑色箭头)。(D) SCNT 胚胎的 TSA、VC 和 dBSA 治疗方案。绿色箭头代表治疗与 TSA, 其次是孵化与 VC (黄色箭头) 下 mKSOM 介质包含 0.3% dBSA (蓝色箭头)。箭头头指示改变介质的时间。请单击此处查看此图的较大版本.
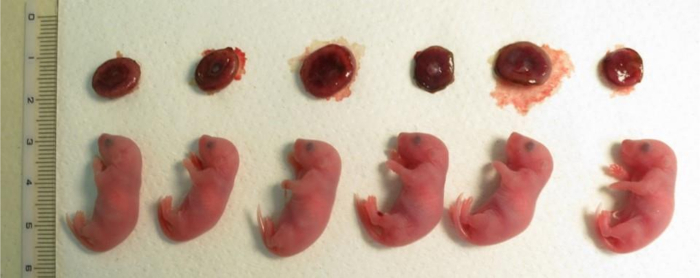
图 4: 在妊娠19.5 天后剖宫产后从卵丘细胞中提取的克隆后代。
在顶行有胎盘。这里显示的克隆后代是由三位寄养母亲在一次核转移实验中产生的。胎盘的大小是由体外受精的人所产生的大小的1.5 到2倍大。请单击此处查看此图的较大版本.
| 组 | 捐献者细胞类型 | 鼠标应变 | 大声 笑使用的卵母细胞 | 大声 笑的卵母细胞融合 | 大声 笑显示过早染色体凝结的卵母细胞 | 大声 笑显示 pronuclei 形成的卵母细胞 (%) | 大声 笑pronuclei 形成的卵母细胞的发育 2细胞胚胎 (%) | |
| TSA, VC | 积云 | C57BL/6× DBA/2 | 84 | 82 | 82 | 81 (99) | 72 (89) | |
| 治疗 | 积云 | C57BL/6× DBA/2 | 84 | 82 | 82 | 82 (100) | 68 (83) | |
| TSA, VC | 胎成纤维细胞 | 妇幼保健×MCH (民事代表) | 202 | 171 | 169 | 151 (89) | 124 (82) | |
| 治疗 | 胎成纤维细胞 | 妇幼保健×MCH (民事代表) | 201 | 171 | 147 | 142 (97) | 109 (77) | |
表 1: TSA 和 VC 处理对的影响体外将克隆的小鼠胚胎发育为2细胞阶段.
| 组 | 捐献者细胞类型 | 鼠标应变 | 大声 笑2细胞胚胎的使用 | 大声 笑2细胞胚胎发育到每个阶段 (%) | |||
| 4芯 | 桑椹胚 | 囊胚 | |||||
| TSA, VC | 积云 | C57BL/6× DBA/2 | 152 | 152 (100) | 149 (98) | 135 (89) a | |
| 治疗 | 积云 | C57BL/6× DBA/2 | 83 | 47 (57) | 41 (49) | 32 (39) b | |
| TSA, VC | 胎成纤维细胞 | 妇幼保健×MCH (民事代表) | 124 | 110 (89) | 101 (81) | 88 (71) c | |
| 治疗 | 胎成纤维细胞 | 妇幼保健×MCH (民事代表) | 109 | 54 (50) | 45 (41) | 29 (27) d | |
| a-b、c d同一捐献细胞内的不同上标表示显著差异 (P < 0.05) | |||||||
表 2: TSA 和 VC 处理对的影响体外将克隆的小鼠胚胎发育到胚泡阶段.
讨论
最后, 这些结果表明, 提出的 SCNT 方法可以减少技术困难, 提高 SCNT 的效率, 而不需要基因修改和 mRNA 补充 (表 1,表 2), 并确保克隆胚胎的稳定生产。这种方法使我们能够重建更多的 SCNT 胚胎比传统的方法, 由于更好的生存率和简化的协议。在这个协议中, 一个关键的步骤是细胞融合。为了成功地生产克隆小鼠, 至关重要的是要确保在细胞融合过程中维持在 HVJ 中所描述的适当量, 而卵母细胞需要在步骤 6.2.3 6.2.5 的10分钟内返回到孵化箱。由于20到30的捐献细胞可以与 HVJ 一起吸气, 在操作吸管的时间, 由一个手术获得的卵子的数量大于现有的方法。最后, 我们可以在10分钟内生产出大约20到30个卵母细胞。即使与大量的卵母细胞 (100 或更多) 一起工作, 细胞融合过程应采取一个小时或更短的重复步骤 6.2.3 6.2.5。此处介绍的方法和技术可以作为具有简化技术要求的高效协议。
目前, SCNT 胚胎发育的分子机制尚不清楚。这种改进的 SCNT 方法也有助于研究这种重新编程机制, 因为这种方法只能在一个实验中产生许多克隆胚胎。该方法使用体细胞与完整的细胞膜细胞融合。因此, 可能可以将此方法应用于其他单元, 如尾尖单元格16、支持单元17和胚胎干细胞18。当传统的 SCNT 方法用于注射相对较大的细胞, 如尾尖细胞, 直接进入卵母细胞膜, 它变得更加技术上要求获得活胚。此外, 相对硬细胞, 如支持细胞, 很难打破吹打注射。当考虑这些不同的细胞类型时, 利用 HVJ 的细胞融合方法简单有效。尽管 HVJ 的价值和安全性得到了令人信服的证明19、20, 但重新考虑使用 HVJ 为农业或生物医学目的生产克隆动物的可行性可能是很重要的。
此外, 最近有一组成功地生产了从尿细胞中提取的克隆小鼠21。为了抢救濒危哺乳动物物种, 从今以后 SCNT 使用非侵入性的细胞, 如尿细胞, 将是理想的。最近, 另一组使用抗原特定的 CD4+ T 细胞22直接生成克隆小鼠。这将是有趣的检查, 如果这种方法也适用于有效地克隆小鼠从这些细胞。此外, Latrunculin a 已被报告为抑制肌动蛋白聚合在摘除和孤雌激活的 SCNT 卵母细胞23更好的替代品。未来的研究可能揭示, Latrunculin 治疗, 而不是细胞松弛素 B, 进一步提高克隆后代的生成。此外, TSA 治疗已成功地用于小鼠, 猪24, 兔25通过改变治疗时间, 时间和浓度。此外, VC 不仅提高了猪 SCNT 的胚胎发育10, 而且还改善了人类和小鼠26中的 iPS 细胞生产。因此, 推测 tsa 和 vc 治疗也可以应用于其他哺乳动物物种是合情合理的, 我们可能需要优化每个物种的 tsa 和 vc 的治疗时间。
总之, 这种方法可以使克隆小鼠具有实用的效率水平和简单的程序。因此, 本研究的结果可以使我们利用 SCNT 技术来保护珍稀动物的遗传资源, 了解核重编程和早期胚胎发育的分子机制。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了 jsp KAKENHI 赠款编号 JP15H06753, JP16H01321, JP16H01222, JP17H05045 的支持, K.M. 为基础科学研究项目的住友基金会赠款 (150810 至 K.M.)。一出大学研究补助金 (15-2 至 K.M. 和硕士)。作案手法承认英国癌症研究 (C6946/A24843) 和威康信托基金提供的核心支持 (203144/z/16/z)。 我们感谢 n Backes-Kamimura 女士和 j. Horvat 先生进行证明阅读。
材料
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma-Aldrich, Co., Lcc. | 28-2270-5 | For medium |
| KCl | Wako Pure Chemical Industries, Ltd. | 169-03542 | For medium |
| KH2PO4 | Wako Pure Chemical Industries, Ltd. | 165-04242 | For medium |
| MgSO4 · 7H2O | Wako Pure Chemical Industries, Ltd. | 137-00402 | For medium |
| CaCl2 · 2H2O | Wako Pure Chemical Industries, Ltd. | 039-00431 | For medium |
| D(+)-Glucose | Wako Pure Chemical Industries, Ltd. | 041-00595 | For medium |
| Sodium Pyruvate | Wako Pure Chemical Industries, Ltd. | 199-03062 | For medium |
| L-Glutamine | Sigma-Aldrich, Co., Lcc. | G3126 | For medium |
| Polyvinylpyrrolidone | Wako Pure Chemical Industries, Ltd. | 168-17042 | For medium |
| NaHCO3 | Nacalai tesque, Inc. | 31213-15 | For medium |
| Sodium DL-Lactate | Nacalai tesque, Inc. | 31605-72 | For medium |
| Penicillin | Meiji Seika Pharma Co., Ltd. | 4987222637671 (GTIN-13) | For medium |
| Streptomycin | Meiji Seika Pharma Co., Ltd. | 4987222665643 (GTIN-13) | For medium |
| Sterile water, endotoxin free | Wako Pure Chemical Industries, Ltd. | 196-15645 | For medium |
| EDTA · 2Na | Dojindo Lab. | 345-01865 | For medium |
| Phenol red | Sigma-Aldrich, Co., Lcc. | P0290 | For medium |
| HEPES sodium salt | Sigma-Aldrich, Co., Lcc. | H3784 | For medium |
| Polyvinyl alcohol | Sigma-Aldrich, Co., Lcc. | P8136 | For medium |
| Bovine serum albumin | Sigma-Aldrich, Co., Lcc. | A3311 | For medium |
| BT AG 501-X8 (D) Resin | Bio-Rad Lab., Inc. | 143-7425 | For preparation of dBSA |
| Hyaluronidase | Sigma-Aldrich, Co., Lcc. | H3506 | For collection of oocytes and cumulus cells |
| Cytochalasin B | Wako Pure Chemical Industries, Ltd. | 034-17554 | For enucleation and oocytes activation |
| Piezo micro manipulator | Prime tech, Co., Ltd. | PMM-150FU | For micromanipulation |
| HVJ Envelope Cell Fusion Kit GenomONE-CF | Ishihara sangyo kaisha, Ltd. | CF001 | Containing 0.5 mL of HVJ-E suspension solution and 10 mL of cell fusion buffer for cell fusion |
| SrCl2 · 6H2O | Wako Pure Chemical Industries, Ltd. | 193-09442 | For oocytes activation |
| EGTA | Sigma-Aldrich, Co., Lcc. | E8145 | For oocytes activation |
| Dimethyl sulfoxide | Wako Pure Chemical Industries, Ltd. | 045-24511 | For solvent |
| Trichostatin A | Sigma-Aldrich, Co., Lcc. | T1952 | For incubating with SCNT embryos |
| L-Ascorbic acid | Sigma-Aldrich, Co., Lcc. | A5960 | For incubating with SCNT embryos |
| Mineral oil | Sigma-Aldrich, Co., Lcc. | M8410 | For covering medium |
参考文献
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Kishigami, S., et al. Production of cloned mice by somatic cell nuclear transfer. Nat Protoc. 1 (1), 125-138 (2006).
- Ogura, A., Inoue, K., Takano, K., Wakayama, T., Yanagimachi, R. Birth of mice after nuclear transfer by electrofusion using tail tip cells. Mol Reprod Dev. 57 (1), 55-59 (2000).
- Ono, Y., Shimozawa, N., Ito, M., Kono, T. Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer. Biol Reprod. 64 (1), 44-50 (2001).
- Matoba, S., et al. Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation. Cell. 159 (4), 884-895 (2014).
- Kishigami, S., et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer. Biochem Biophys Res Commun. 340 (1), 183-189 (2006).
- Rybouchkin, A., Kato, Y., Tsunoda, Y. Role of histone acetylation in reprogramming of somatic nuclei following nuclear transfer. Biol Reprod. 74 (6), 1083-1089 (2006).
- Bui, H. T., et al. Effect of trichostatin A on chromatin remodeling, histone modifications, DNA replication, and transcriptional activity in cloned mouse embryos. Biol Reprod. 83 (3), 454-463 (2010).
- Chen, J., et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat Genet. 45, 34-42 (2013).
- Huang, Y., et al. Vitamin C enhances in vitro and in vivo development of porcine somatic cell nuclear transfer embryos. Biochem Biophys Res Commun. 411 (2), 397-401 (2011).
- Isaji, Y., Yoshida, K., Imai, H., Yamada, M. An intracytoplasmic injection of deionized bovine serum albumin immediately after somatic cell nuclear transfer enhances full-term development of cloned mouse embryos. J Reprod Dev. 61 (6), 503-510 (2015).
- Miyamoto, K., et al. Reprogramming towards totipotency is greatly facilitated by synergistic effects of small molecules. Biol Open. 6, 415-424 (2017).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the mouse embryo: A laboratory manual. , (2014).
- Nakagata, N., Okamoto, M., Ueda, O., Suzuki, H. Positive effect of partial zona-pellucida dissection on the in vitro fertilizing capacity of cryopreserved C57BL/6J transgenic mouse spermatozoa of low motility. Biol Reprod. 57 (5), 1050-1055 (1997).
- Hogan, B., Costantini, F., Lacy, E. . Manipulating the mouse embryo. , (1986).
- Wakayama, T., Yanagimachi, R. Cloning of male mice from adult tail-tip cells. Nat Genet. 22 (2), 127-128 (1999).
- Ogura, A., et al. Production of male cloned mice from fresh, cultured, and cryopreserved immature sertoli cells. Biol Reprod. 62 (6), 1579-1584 (2000).
- Wakayama, T., Rodriguez, I., Perry, A. C., Yanagimachi, R., Mombaerts, P. Mice cloned from embryonic stem cells. Proc Natl Acad Sci U S A. 96 (26), 14984-14989 (1999).
- Tachibana, M., et al. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature. 461 (7262), 367-372 (2009).
- Yamada, M., et al. Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells. Nature. 510 (7506), 533-536 (2014).
- Mizutani, E., et al. Generation of cloned mice and nuclear transfer embryonic stem cell lines from urine-derived cells. Sci Rep. 6, 1-8 (2016).
- Kaminuma, O., et al. Hyper-reactive cloned mice generated by direct nuclear transfer of antigen-specific CD4+ T cells. EMBO Rep. 18 (6), 885-893 (2017).
- Terashita, Y., et al. Latrunculin A can improve the birth rate of cloned mice and simplify the nuclear transfer protocol by gently inhibiting actin polymerization. Biol Reprod. 86 (6), 180 (2012).
- Zhao, J., et al. Histone deacetylase inhibitors improve in vitro and in vivo developmental competence of somatic cell nuclear transfer porcine embryos. Cell Reprogram. 12 (1), 75-83 (2010).
- Shi, L. H., et al. Trichostatin A (TSA) improves the development of rabbit-rabbit intraspecies cloned embryos, but not rabbit-human interspecies cloned embryos. Dev Dyn. 237 (3), 640-648 (2008).
- Esteban, M. A., et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells. Cell Stem Cell. 6 (1), 71-79 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。