Method Article
Tratamiento combinacional de tricostatina A y la vitamina C mejora la eficiencia de la clonación de ratones por transferencia Nuclear de células somáticas
En este artículo
Resumen
Se describe un método altamente mejorado de ratón clonado utilizando tricostatina A, vitamina C y desionizada albúmina de suero bovino. Se muestra un protocolo simplificado, reproducible que apoya el desarrollo eficiente de embriones clonados. Por lo tanto, este método podría convertirse en un procedimiento estandarizado para la clonación de ratón.
Resumen
Transferencia nuclear de células somáticas (SCNT) ofrece una oportunidad única para producir directamente un animal clonado de una célula del donante, y requiere el uso de técnicas expertas. Además, la eficiencia de la clonación ha permanecido baja desde el éxito de la producción de los animales clonados, especialmente ratones. Ha habido muchos intentos para mejorar la eficacia de clonado y tricostatina A (TSA), un inhibidor de la deacetilasa de histona, se ha utilizado ampliamente para mejorar la eficiencia de la clonación. Aquí, Divulgamos un método de clonación mejoraron considerablemente en ratones. Este método de transferencia nuclear de célula somática consiste en el uso de virus Hemagglutinating de Japón (HVJ-E), que permite la fácil manipulación. Por otra parte, el tratamiento con dos pequeñas moléculas, TSA y vitamina C (VC), con albúmina de suero bovino desionizada (dBSA), es altamente eficaz para el desarrollo embrionario. Este enfoque requiere inyección adicional ni manipulación genética y por lo tanto presenta un método simple y conveniente para el uso práctico. Este método podría convertirse en un enfoque técnicamente para los investigadores producir animales genéticamente modificados de células cultivadas. Además, podría ser una manera útil para el rescate de animales en peligro de extinción a través de la clonación.
Introducción
La tecnología de células somáticas permite la producción de animales clonados utilizando una única célula somática o un núcleo para ser transferido a un ovocito enucleated. Uno de los propósitos de la técnica SCNT es la derivación de líneas de células madre embrionarias (ESCs de NT) de transferencia de embriones clonados. En 1998, Wakayama et al., divulgado producir un ratón clonado con éxito llamado Cumulina para el primer tiempo1. Desde entonces, la clonación de ratones ha sido ampliamente estudiada y se han obtenido muchos conocimientos importantes sobre reprogramación nuclear de núcleos somáticos. Por otro lado, esta técnica se acompaña de numerosos pasos de micromanipulación que son muy difíciles de master, que requiere entrenamiento intensivo de más de 3 meses2.
Producción de ratones clonados utilizando células somáticas ha evolucionado desde la original Honolulu método1, el método de electrofusión3, el método de fusión de la célula por virus Hemagglutinating de Japón (HVJ)4. Sin embargo, la inyección directa de un núcleo de la célula a través del cytomembrane tiende a afectar perjudicialmente la supervivencia del ovocito. La electrofusión es baja en la eficiencia, ya que cada membrana de la célula tiene diferentes durezas, lo que hace difícil determinar una condición óptima. El manejo de HVJ es laborioso, porque requiere equipo específico para la seguridad de los investigadores y animales de laboratorio. Recientemente, para fundir el citoplasma de la célula y óvulo de donante, HVJ-E ha sido usada5. HVJ-E sólo tiene la capacidad de fusionar las membranas sin la capacidad proliferativa o infecciosa del virus. RNAs genomic de HVJ son totalmente inactiva en HVJ-E. El uso de HVJ-E soporta así fácil manejo de fusión celular en células somáticas.
Varios informes han demostrado que el tratamiento de embriones de células somáticas con TSA, un inhibidor de la deacetilasa de histona, mejora significativamente la eficacia de la producción de energizados cachorros de menos de 1% a 6,5%6,7. Tratamiento de TSA acelera la reprogramación a través de la modificación de las histonas marcas en células somáticas de embriones8. Recientemente, la inyección de mRNAs particular, la subfamilia de demetilasa de lisina de las histonas 4 (KDM4), que retire lysin de histona H3 (H3K9) de 9 trimetilación en embriones de células somáticas, especialmente en regiones resistente a la reprogramación, se ha demostrado para aumentar el desarrollo de la clonación de embriones de ratón9. Mientras tanto, VC, que también sirve como un modificador de la histona, ha disminuido la trimetilación de H3K910. Además, VC mejora desarrollo embrionario en porcino SCNT10. Se ha reportado que la inyección de dBSA en embriones SCNT conduce a la mejora del desarrollo embrionario11.
Hemos encontrado que la combinación de moléculas pequeñas, es decir, TSA y VC, junto a dBSA, dramáticamente había mejorado desarrollo de células somáticas de embriones12. Aquí detallamos el método SCNT previamente divulgado para los ratones, lo que representa muy eficiente y simple clonación de procedimientos12. También describimos el manejo de HVJ-E. Estos podrían ayudar a muchos investigadores en el campo de la biología reproductiva y de desarrollo para preservar recursos genéticos o producir animales genéticamente modificados a través de este método SCNT.
Protocolo
Todos los procedimientos de animales conforman a las directrices de la Universidad de Kinda para el cuidado y uso de animales de laboratorio.
1. preparación de medios de cultivo
- Preparar el medio modificado de KSOM (mKSOM) para el cultivo de embriones, que consta de 95 mM NaCl, 2,5 mM KCl, 0.35 m m KH2PO4, 0,2 mM MgSO4 · 7H2O, 1,71 mM CaCl2 · 2H2O, 0,2 mM de D (+)-glucosa, piruvato de sodio, de 0,2 mM 1,0 mM L-glutamina, 1.0 g/L polivinilpirrolidona (PVP), 25,07 mM NaHCO3, 10 mM DL-lactato de sodio 0,05 g/L de penicilina y estreptomicina en agua estéril de 0.05 g/L.
- Preparar el medio tamponado con Hepes CZB (HCZB) para la manipulación de embriones, que consta de 81,5 mM NaCl, 4.8 mM KCl, 1,7 mM CaCl2 · 2H2O, 1,18 mM MgSO4 · 7H2O, 1.18 m m KH2PO4, 0,11 mM EDTA · 2na, 36,1 mM DL-lactato de sodio, 5,55 mM D (+)-glucosa, 0,025 g/mL penicilina, 0,035 g/L estreptomicina, 0,014 mM rojo de fenol, alcohol de polivinilo 1.0 g/L, 5,0 mM NaHCO3y 20,0 mM Hepes de sal de sodio en agua estéril.
- Preparar el medio de la activación para la activación del ovocito: mKSOM suplementado con 50 nM TSA 2 mM EGTA, 5 μg/mL citocalasina B (CB) y 5 mM SrCl2.
2. preparación de desionizada albúmina de suero bovino (dBSA)
- 1.2 g de albúmina de suero bovino (BSA) se disuelven en 10 mL de agua estéril a temperatura ambiente (una concentración final de 12%).
- Añadir aproximadamente 0,12 g de granos de la resina de intercambio iónico mixto a lo anterior preparado 12% de BSA en agua estéril a temperatura ambiente con agitación suave.
- Cuando los granos cambian de color del azul verdoso al oro, recuperar la solución sobrenadante con una pipeta. Luego reemplazar los granos con el fresco (figura 1).
Nota: La sustitución de los granos normalmente se realiza una sola vez. Posiblemente requiere unos reemplazos a desionización completa. Solamente como una guía, si el color de los granos no ha cambiado de verde al oro, indica que ese intercambio iónico está completa. - Recuperar la solución después de confirmar que no hay ningún cambio de color en los granos.
Nota: Si la solución recuperada se vuelve nublada, centrifugar para evitar que se atasque el filtro (175 x g, 5 min). - Complementar la recuperada la solución con 250 μl de 10.5% de NaHCO3.
Nota: Este proceso está destinado a la solución de dBSA neutralizar la condición de pH. Sin embargo, NaHCO3 puede ser prescindible. - Esterilizar el sobrenadante utilizando un filtro de 0,45 μm y almacenar a-20 ° C como solución madre de dBSA.
3. colección de ovocitos
Nota: Todos los ratones fueron mantenidos en habitaciones con aire acondicionado y luz-controlada.
- Super-ovular cada hembra ratón B6D2F1 (edad 8-10 semanas) por inyección intraperitoneal de 7,5 UI de gonadotropina sérica de yegua preñada (PMSG) y 7,5 UI de gonadotropina coriónica (hCG) 48 h después de la inyección de PMSG.
- Realizar la eutanasia mediante dislocación cervical 14-16 h después de la inyección de hCG. Haga una incisión en el abdomen para acceder al tracto reproductivo usando técnicas de disección estándar13. Brevemente, pellizcar la piel y hacer una pequeña incisión lateral en la línea media con unas tijeras. Mantenga la piel firmemente por encima y por debajo de la incisión y tirar la piel hacia la cabeza y la cola. Cortar el peritoneo con tijeras, empuje de las bobinas de la tripa y confirmar la presencia de los dos cuernos del útero, el oviducto y los ovarios.
- Extirpar los oviductos con pequeñas tijeras recta y pinzas, colocar en una hoja de papel de filtro para limpiar la sangre de la superficie. Establecer los oviductos en aceite mineral. Luego, encima de la ampolla del oviducto utilizando agujas de disección y mover los complejos cúmulo-ovocitos provenientes de la ampolla del oviducto en gotas de 200 μL de medio HCZB con la hialuronidasa de 0.1%. Incubar durante 5 minutos sobre una placa calentadora.
PRECAUCIÓN: Una exposición de más de 10 minutos en medio HCZB con hialuronidasa 0,1% sería perjudicial para los ovocitos. - Confirman que las células del cúmulo se liberan de los complejos cúmulo-ovocitos bajo un estereomicroscopio, transferencia segunda metafase meiótica (MII) etapa ovocitos con algunas células del cúmulo restante para mKSOM medio que contiene 0.3% dBSA. Luego, lave los ovocitos de la fase MII cuatro veces mediante pipeteo arriba y abajo (con una pipeta de < 100 μm de diámetro interno) en mKSOM medio que contiene 0.3% dBSA para separar las células del cúmulo restante.
Nota: El uso de una pipeta pequeña facilita el desprendimiento de las células del cúmulo. - Incubar ovocitos de etapa de Mll en mKSOM medio que contiene 0.3% dBSA a 37 ° C debajo del 5% CO2 incubadora hasta la enucleación.
Nota: Se recomienda una pipeta pequeña con un diámetro ligeramente mayor que la de los ovocitos.
4. preparación de células del donante para la transferencia Nuclear
- Después pasos 3.3-3.5, son aislados de los complejos cúmulo-ovocito ovocitos denudados. Transferir una pequeña cantidad (aproximadamente 2 μL) de las restantes células del cúmulo dispersadas de los complejos cúmulo-ovocitos en medio HCZB con 0.1% hialuronidasa al medio HCZB con dBSA 6% utilizando una pipeta bajo un estereomicroscopio.
- Coloque las células del cúmulo en medio HCZB con 6% dBSA en la placa de calentamiento a 37 ° C hasta que se necesite para SCNT.
Nota: Cuando las células del fibroblasto (e.g., células murinas fibroblastos fetales) son utilizado como células de un donante, separar las células de un plato de cultivo de tejidos y centrifugar en una pelotilla. Resuspender el precipitado de células en medio HCZB que contiene 6% de dBSA.
5. enucleación de ovocitos
- Preparar medio PVP 9% agregando 0,9 g PVP medio de HCZB de 10 mL, guardar en el refrigerador durante la noche (4 ° C) y luego esterilizar utilizando un filtro de 0.45 μm.
- Preparar soluciones madre CB (concentración de 1 mg/mL) añadiendo 5 mg de CB a 5 mL de dimetilsulfóxido (DMSO). Diluir la solución madre de CB con medio de HCZB (una concentración final de 5 μg/mL) y utilizar como solución de enucleación.
- Lavar los ovocitos de la fase de Mll en 20 μl de medio HCZB que contiene 5 μg/mL CB (solución de enucleación) por inhalar y exhalar a través de la pipeta esterilizada (diámetro interior: 150 μm a 200 μm). Repita el procedimiento de lavado 5 veces. Espere aproximadamente 10 minutos sobre el plato calefactor en la solución de enucleación antes de iniciar el proceso de enucleación.
- Prepare la cámara enucleación como se muestra en la figura 2A. Transfiera los ovocitos Mll a la cámara de enucleación por inhalando y exhalando con ayuda de la pipeta (diámetro interior: 150 μm a 200 μm); Coloque 4 μL de solución de enucleación y cubrir la cámara con aceite mineral.
Nota: En lugar de una cámara, puede utilizarse una cubierta de una caja Petri de 60 mm. - Identificar los ejes y los cromosomas del ovocito de la etapa MII bajo un microscopio (400 X) a temperatura ambiente. Oriente el ovocito de la etapa de Mll con el pronunciado primer cuerpo polar, por lo que el posicionamiento del husillo y cromosoma en los 3 o 9:00 (figura 2B) posición utilizando una tenencia pipeta y micropipeta.
Nota: El microscopio tiene lentes de aumento X 400 en total. Además, la lente del objetivo N.A es 5 X / 0.12 y 40 X / 0.55. La conducción de impulsos piezoeléctricos de la pipeta permite perforación rápida de la zona pelúcida. Además, un sistema de láser (por ejemplo, XYClone) también es utilizable para la perforación de la zona pelúcida en lugar del sistema de conducción del piezo. - Ajustar la intensidad de pulso piezo a 3-6 y taladro a la zona pelúcida mediante una pipeta de micromanipulación (7-8 μm diámetro interno terminó plana punta) con el pulso piezo de conducción. Después de abrir un agujero en la zona pelúcida, enuclear completamente los ejes y los cromosomas con una cantidad mínima de citoplasma (figura 2).
Nota: Durante este proceso, ovocitos tienden firmemente el fondo del plato o pipeta por medio sin BSA14. Dentro de 10 minutos, debe completarse el proceso de enucleación y los ovocitos enucleated deben ser devueltas a la incubadora. El número adecuado de ovocitos que se pueden manipular en una enucleación es entre 10 y 20. Para lotes más grandes de los ovocitos, se repite el procedimiento de enucleación. - Confirmar la ausencia de cromosomas en el citoplasma bajo luz visible (figura 2, centro), luego lave bien los ovocitos anucleados en medio de mKSOM que contiene 0.3% dBSA carecer de CB. Introducir el plato en la incubadora a 37 ° C debajo del 5% de CO2 hasta la fusión de la célula.
Nota: Después de la enucleación, el citoplasma de ooplasm contiene los husos y los cromosomas.
6. fusión de una célula del donante y un ovocito anucleado
-
Preparación de HVJ-E
- Añadir 260 μl de solución de suspensión HVJ-E helado liofilizado HVJ-e (desde el juego, ver la Tabla de materiales) y pipetear arriba y abajo hasta que totalmente falso.
Nota: La cantidad apropiada de liofilizado HVJ-E está preparada en una botella, y 260 solución de suspensión de μl HVJ-E está incluido en el kit. - Preparar 5 alícuotas de μl de la solución HVJ-E y luego almacenar a-80 ° C hasta la fusión de la célula.
Cuidado: Tratar cuidadosamente el HVJ-E en el hielo, ya que es sensible a la temperatura. Después de la terminación del experimento, apropiadamente autoclave HVJ-E materiales y recipientes para inactivar completamente los componentes de virus.
- Añadir 260 μl de solución de suspensión HVJ-E helado liofilizado HVJ-e (desde el juego, ver la Tabla de materiales) y pipetear arriba y abajo hasta que totalmente falso.
-
Fusión de la célula
- Diluir el 5 μl de solución HVJ-E con 20 μl del buffer de fusión celular inmediatamente antes del uso. Coloque la solución diluida de HVJ-E en hielo hasta su uso.
Nota: El buffer de fusión celular está incluido en el kit HVJ-E. - Prepare la cámara de fusión celular como se muestra en la Figura 3A. Transfiera los ovocitos enucleated a medio HCZB en la cámara de fusión de la célula usando la pipeta (diámetro interior: 150 μm a 200 μm); lugar 4 μL de cada solución (medio HCZB que contiene 6% -BSA para células de un donante, solución HVJ-E, HCZB medio, 9% PVP en medio HCZB) y cubrir la cámara con aproximadamente 1 mL de aceite mineral.
Nota: El número adecuado de ovocitos anucleadas que se transfieren a la cámara por manipulación durante el procedimiento de fusión de una célula es de 5 a 30. Para lotes más grandes de los ovocitos, se repite el procedimiento de fusión de la célula. En vez de cámara, puede utilizarse una cubierta de plato de Petri de 60 mm, si está disponible. - Coloque los ovocitos anucleados en medio de la HCZB bajo el microscopio a 400 X magnificationat de temperatura. Aspirar las células del donante con la pipeta de micromanipulación (6-7 μm diámetro interno terminó plana punta) y expulsar a las células en solución de suspensión HVJ-E.
- Luego aspirar células del cúmulo uno por uno con la solución de suspensión HVJ-E para ser igualmente separados entre sí, permitiendo la fusión de la serie de la célula. Mantenga el enucleated oocytes en medio HCZB con una pipeta de sujeción. Perforar la zona pelúcida con la pipeta de micromanipulación con el pulso de piezo (intensidad de la velocidad de 3-6, 2-3).
- Después de abrir el agujero en la zona pelúcida, coloque una célula cumulus firmemente a la membrana del ovocito, junto con solución de suspensión HVJ-E con un volumen 5 veces el volumen de una célula del cúmulo, sin pasar por la membrana del ovocito.
Nota: Preparar consejos de terminó plana de 6-7 μm diámetro interior de las pipetas de micromanipulación de células del cúmulo. Pipetas se deben lavar regularmente con 9% PVP medio para mantener la liberación suave de la célula. Pasos 6.2.3 - 6.2.5 deben ser terminados dentro de 10 minutos, o la eficacia de la fusión de la célula será más baja. Actividad de fusión de la membrana de HVJ-E es esterilizado por autoclave, tratamiento con detergente, o con etanol al 70%. Después del experimento, la solución HVJ-E debe eliminarse adecuadamente de. - Después de la manipulación de la fusión celular, rápidamente transfiera los ovocitos a mKSOM medio que contiene 0.3% dBSA y pasar a una incubadora a 37 ° C debajo del 5% de CO2 durante 1 hora.
- Diluir el 5 μl de solución HVJ-E con 20 μl del buffer de fusión celular inmediatamente antes del uso. Coloque la solución diluida de HVJ-E en hielo hasta su uso.
7. activación de ovocitos reconstruidos y tratamiento con tricostatina A y vitamina C
-
Preparación de TSA
- Pipetear en 3 alícuotas μl solución de TSA de 5 mM y la solución a-20 ° C.
- Añadir 2,5 μl de solución stock de la TSA de 5 mM a 1 mL de DMSO (una concentración de 12.5 μm).
- Diluir 8 μl de 12,5 μm TSA solución en 2 mL del medio de activación y mKSOM medio (una concentración final de 50 nM).
-
Preparación de CV
- Añadir 1 mg de VC en 1 mL de agua estéril libre de endotoxinas y almacenar a-20 ° C.
- Añadir la solución VC a mKSOM medio (una concentración final de 10 μg/mL).
-
Activación de los ovocitos reconstruidos
- Una hora después de la fusión celular, revise la condensación prematura de cromosomas (PCC) en los ovocitos reconstruidos (figura 3B) utilizando un microscopio (400 X).
- Transfiera los ovocitos reconstruidos al medio de la activación (véase el paso 1.3) que contienen TSA e incubar durante 6 h a 37 ° C debajo del 5% de CO2 en aire (figura 3). Observar la formación de pro-núcleos en los embriones de células somáticas, luego aplicar 2 horas más del tratamiento con TSA en mKSOM medio que contiene 0.3% dBSA (figura 2).
- Transferencia de los embriones tratados con TSA a mKSOM suplementado con VC e incubar durante 7 h, como se muestra en la figura 3D.
- Después de 7 h del tratamiento de VC, transferir los embriones tratados con VC a mKSOM medio que contiene 0.3% dBSA e incubar durante 4 días a 37 ° C debajo del 5% de CO2 en aire.
Nota: Para producir ratones clonados, transferencia de embriones en estadío de 2 células morfológicamente normales en los oviductos de pseudo-embarazadas ratones hembra (MCH(ICR)) en el día cuando un tapón vaginal se encuentra (día 0.5 de seudoembarazo)15. Después de 19,5 días, se registró el número de sitios de implantación y los recién nacidos después de la cesárea.
Resultados
Para producir embriones de ratón clonado, se utilizaron células del cúmulo y células de fibroblastos fetales. El número de ovocitos reconstruidos y desarrollo a la fase de 2 células después de la activación del ovocito se muestra en la tabla 1. Una muy alta tasa de formación pronuclear (89 a 100%) y desarrollo a la fase de 2 células (77 a 89%) se observaron en todas las condiciones. Algunos de los embriones clonados, que se deriva de las células del cúmulo y desarrollados para la fase de 2 células, fueron transferidos a oviductos de pseudo-hembras. Produjeron seis crías clonadas de 72 embriones transferidos de tres mujeres embarazadas el tratamiento serie de TSA y VC (figura 4). Aproximadamente el 15% de embriones clonados se han divulgado para convertirse a término siguiendo esta SCNT procedimientos12. Además, la transferencia de embriones de 2 células clonadas en otras instituciones ha logrado descendencia vivo de 9 a 15%, que representa mejor que el solo tratamiento de TSA en embriones clonados. Por otra parte, el tratamiento con TSA y VC mejoró significativamente la eficiencia de en vitro el desarrollo embrionario hasta la etapa de blastocisto (tabla 2, P < 0.05, prueba de t de Student). Estos datos de desarrollo en vitro demuestran que el efecto positivo de TSA y VC es limitado por las cepas de ratón ni por tipos de la célula. Estos resultados sugieren que este método SCNT facilita la capacidad de desarrollo de los embriones clonados.

Figura 1: Preparación de dBSA.
Se describen procedimientos paso a paso para preparar solución de dBSA. El grado de intercambio de iones puede ser juzgado por el cambio de color de los granos. En la figura izquierda superior muestra que 1,2 g de BSA se disuelve en 10 mL de agua estéril a temperatura ambiente. Después de BSA se disuelve, los granos de la resina de intercambio iónico se agregan (superior derecha). Cuando la mezcla de solución de BSA con granos de la resina de intercambio iónico cambiar color de azulverde a oro (abajo a la derecha), sustituir los granos frescos. La figura inferior izquierda muestra que el color de los granos sigue siendo azul y verde, e intercambio de ion se acaba. Haga clic aquí para ver una versión más grande de esta figura.
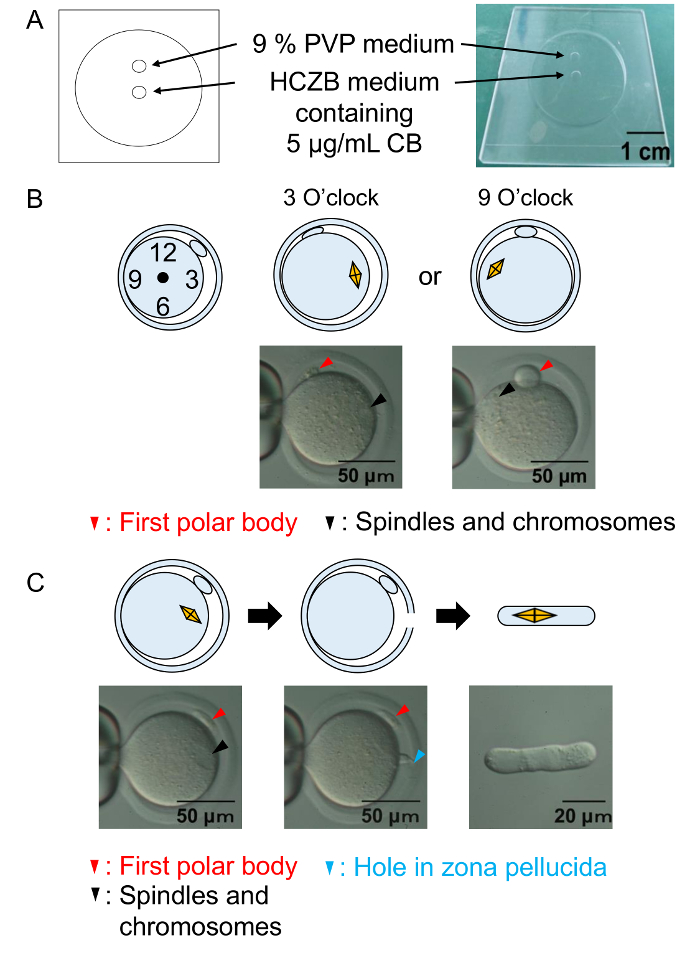
Figura 2: Procedimientos de la enucleación.
(A) una ilustración de la cámara de enucleación. Enucleación de ovocitos se realiza en el medio HCZB con CB. Para el sistema de conducción piezoeléctricas, un lugar de medio PVP 9% se utiliza para preparar la pipeta de cristal para enucleación. Puntos están cubiertos por aceite mineral. (B) un diagrama y una micrografía muestra la posición de los ejes y los cromosomas antes de la enucleación. Negro de las puntas de flecha: los husos y los cromosomas. Puntas de flecha rojos: el primer cuerpo polar. Diagrama (C) A y un micrográfo demostrar éxito enucleación. Negro de las puntas de flecha: los husos y los cromosomas. Flecha roja: el primer cuerpo polar. Flecha azul: el agujero en la zona pelúcida. Haga clic aquí para ver una versión más grande de esta figura.
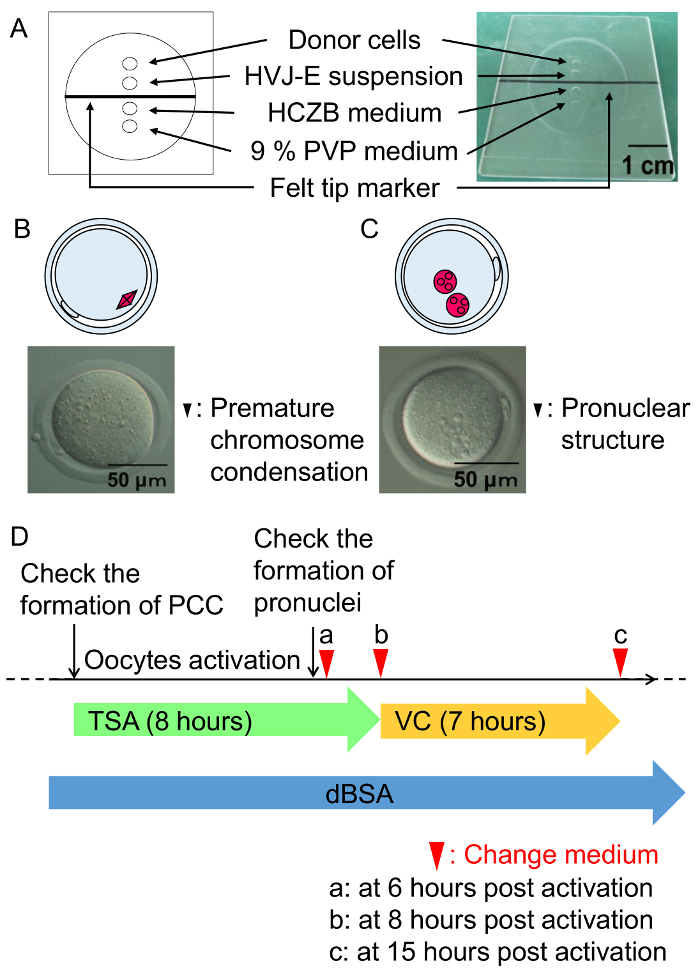
Figura 3: Procedimientos de fusión de la célula y condición de los embriones de células somáticas de la cultura.
(A) una ilustración de la cámara de fusión celular. Fusión celular se realiza en el medio HCZB que contiene 6% de dBSA. Un lugar de medio PVP 9% se utiliza para preparar la pipeta de vidrio de fusión celular. Puntos están cubiertos por aceite mineral. (B) un diagrama y una micrografía de la condensación prematura de cromosomas forman una hora después de la fusión de células (flecha negra). Diagrama (C) A y un micrográfo de la estructura pronuclear formaron seis horas después de la activación (flecha negra). (D) esquema de la TSA, VC y dBSA tratamiento de embriones de células somáticas. Flecha verde representa el tratamiento con TSA, seguido por la incubación con VC (flecha amarilla) bajo medio mKSOM con 0.3% dBSA (flecha azul). Cabezas de la flecha indican el momento para el cambio de medio. Haga clic aquí para ver una versión más grande de esta figura.
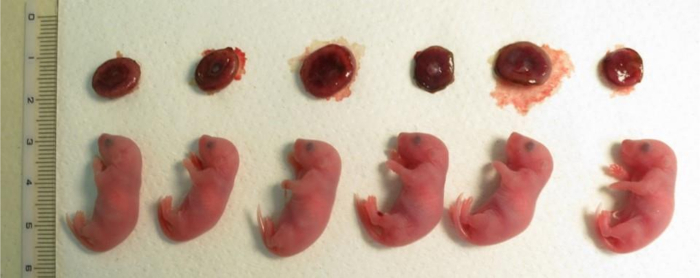
Figura 4: Crías clonadas derivan de células del cúmulo justo después de cesárea después de 19,5 días de embarazo.
La placenta está en la fila superior. La descendencia clonada que se muestra a continuación se obtuvieron en un experimento de transferencia nuclear de tres madres de crianza. El tamaño de la placenta fue de 1.5 a 2 veces más grande que el tamaño de los producidos por fertilización in vitro . Haga clic aquí para ver una versión más grande de esta figura.
| Grupo | Tipo de la célula donante | Cepa de ratón | No. de ovocitos utilizados | No. de ovocitos fusionados | No. de ovocitos que muestra condensación prematura de cromosomas | No. de ovocitos que muestran formación de pronúcleos (%) | No. de ovocitos pronúcleos formados que desarrolló a los embriones de 2 células (%) | |
| TSA, VC | Cumulus | C57BL/6 × DBA/2 | 84 | 82 | 82 | 81 (99) | 72 (89) | |
| no se trata | Cumulus | C57BL/6 × DBA/2 | 84 | 82 | 82 | 82 (100) | 68 (83) | |
| TSA, VC | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 202 | 171 | 169 | 151 (89) | 124 (82) | |
| no se trata | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 201 | 171 | 147 | 142 (97) | 109 (77) | |
Tabla 1: efectos del tratamiento TSA y VC en el en vitro desarrollo de embriones de ratón clonado a la etapa de células 2.
| Grupo | Tipo de la célula donante | Cepa de ratón | Jajaja de embriones de 2 células utilizados | Jajaja de embriones de 2 células desarrollaron a cada etapas (%) | |||
| 4-cell | mórula | blastocisto | |||||
| TSA, VC | Cumulus | C57BL/6 × DBA/2 | 152 | 152 (100) | 149 (98) | 135 (89) un | |
| no se trata | Cumulus | C57BL/6 × DBA/2 | 83 | 47 (57) | 41 (49) | 32 (39) b | |
| TSA, VC | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 124 | 110 (89) | 101 (81) | 88 (71) c | |
| no se trata | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 109 | 54 (50) | 45 (41) | 29 (27) d | |
| a-b, c, d Diferentes superíndices dentro de las mismas células de donantes representan diferencias significativas (P < 0.05) | |||||||
Tabla 2: efectos del tratamiento TSA y VC en el en vitro desarrollo de embriones de ratón clonado a la fase de blastocisto.
Discusión
En conclusión, estos resultados sugieren que el método presentado de células somáticas podría reducir dificultades técnicas y aumentar la eficiencia de células somáticas sin necesidad de modificaciones genéticas y la suplementación de mRNA (tabla 1, tabla 2) y asegurar producción estable de embriones clonados. Este método nos permite reconstruir más embriones de células somáticas que los métodos convencionales debido a la mejor tasa de supervivencia y protocolo simplificado. En este protocolo, un paso crítico es la fusión celular. Para producir con éxito ratones clonados, es vital para asegurar que la cantidad apropiada de HVJ-E se describe en el protocolo se mantiene durante el proceso de fusión celular y óvulos deben ser devueltas a la incubadora dentro de 10 minutos durante los pasos 6.2.3 - 6.2.5. Desde 20 a 30 células de un donante pueden aspirarse HVJ-e en un momento en la pipeta de la manipulación, el número de ovocitos obtenidos por una operación es mayor que la del método actual. Al final, podemos producir alrededor de 20 a 30 ovocitos re-construidos dentro de 10 minutos. Incluso cuando se trabaja con un lote grande de óvulos (100 o más), el procedimiento de fusión de la célula debe tomar una hora o menos repitiendo los pasos 6.2.3 - 6.2.5. El método y las técnicas presentadas aquí pueden servir como protocolos eficientes con técnica simplificada.
En la actualidad, los mecanismos moleculares subyacentes en el desarrollo de células somáticas de embriones aún no están claros. Este método mejorado de SCNT también contribuye al estudio de estos mecanismos de reprogramación, ya que este método puede producir muchos embriones clonados en un único experimento. Este método utiliza las células somáticas con membranas celulares intactas para la fusión de la célula. Por lo tanto, es posible aplicar este enfoque a otras células como punta de la cola de las células16,17de las células de sertoli y células de madre embrionaria (ES)18. Cuando los métodos convencionales de células somáticas se utilizan para inyectar las células relativamente grandes, tales como células de la punta de la cola, directamente en el citoplasma del ovocito, se convierte en aún más técnicamente exigente obtener embriones vivos. Además, las células relativamente duras, como las células de sertoli, son difíciles de romper mediante pipeteo para inyectar. Cuando se consideran estos tipos de células diferentes, el método de fusión de la célula utilizando HVJ-E es simple y eficaz. Aunque el valor y la seguridad de HVJ-E han sido convincentemente demostrado19,20, sería importante volver a considerar la viabilidad de utilizar HVJ-E para la producción de animales clonados para fines agrícolas o biomédicas.
Por otra parte, recientemente un grupo produjo con éxito ratones clonados derivadas de células de orina21. Para rescatar especies de mamíferos en peligro de extinción, en adelante SCNT usando las células recogidas de forma no invasiva, como la célula de la orina, será ideal. Más recientemente, otro grupo directamente ha generado ratones clonados utilizando específica de antígeno CD4+ T células22. Sería interesante examinar si este método también se aplica eficientemente clonar ratones de tales células. Además, se ha divulgado A Latrunculin como una mejor alternativa para inhibir la polimerización de la actina durante la enucleación y activación partenogenética de SCNT ovocitos23. Estudio puede revelar si el Latrunculin A tratamiento, en lugar de citocalasina B, mejora aún más la generación de crías clonadas. Además, el tratamiento de la TSA ha utilizado con éxito en ratones y cerdos24conejos25 por cambio de concentración, duración y tiempo de tratamiento. Además, VC no sólo mejora el desarrollo embrionario en porcino SCNT10, sino que también mejora la producción de células iPS en humanos y ratones26. Por lo tanto, es plausible especular que TSA y VC el tratamiento puede aplicarse también a otras especies de mamíferos, y puede que necesitemos optimizar el tiempo de tratamiento de TSA y VC para cada especie.
En conclusión, este método sería posible generar ratones clonados con un práctico nivel de eficiencia con procedimientos sencillos. Por lo tanto, los resultados de este estudio nos pueden llevar a utilizar la tecnología de células somáticas para la preservación de los recursos genéticos de animales raros y para la comprensión de los mecanismos moleculares de reprogramación nuclear y desarrollo embrionario temprano.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por números de concesión de JSPS KAKENHI JP15H06753, JP16H01321, JP16H01222, JP17H05045 a K.M. Sumitomo Fundación beca para proyectos de investigación de ciencia básica (150810 a K.M.). Beca de investigación de la Universidad de Kinda (15-I-2 K.M. y M.A.). M.O. reconoce el apoyo principal de Cancer Research UK (C6946/A24843) y el Wellcome Trust (203144/Z/16/Z). Agradecemos a la Sra. N. Backes-Kamimura y Sr. J. Horvat para corrección de pruebas.
Materiales
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma-Aldrich, Co., Lcc. | 28-2270-5 | For medium |
| KCl | Wako Pure Chemical Industries, Ltd. | 169-03542 | For medium |
| KH2PO4 | Wako Pure Chemical Industries, Ltd. | 165-04242 | For medium |
| MgSO4 · 7H2O | Wako Pure Chemical Industries, Ltd. | 137-00402 | For medium |
| CaCl2 · 2H2O | Wako Pure Chemical Industries, Ltd. | 039-00431 | For medium |
| D(+)-Glucose | Wako Pure Chemical Industries, Ltd. | 041-00595 | For medium |
| Sodium Pyruvate | Wako Pure Chemical Industries, Ltd. | 199-03062 | For medium |
| L-Glutamine | Sigma-Aldrich, Co., Lcc. | G3126 | For medium |
| Polyvinylpyrrolidone | Wako Pure Chemical Industries, Ltd. | 168-17042 | For medium |
| NaHCO3 | Nacalai tesque, Inc. | 31213-15 | For medium |
| Sodium DL-Lactate | Nacalai tesque, Inc. | 31605-72 | For medium |
| Penicillin | Meiji Seika Pharma Co., Ltd. | 4987222637671 (GTIN-13) | For medium |
| Streptomycin | Meiji Seika Pharma Co., Ltd. | 4987222665643 (GTIN-13) | For medium |
| Sterile water, endotoxin free | Wako Pure Chemical Industries, Ltd. | 196-15645 | For medium |
| EDTA · 2Na | Dojindo Lab. | 345-01865 | For medium |
| Phenol red | Sigma-Aldrich, Co., Lcc. | P0290 | For medium |
| HEPES sodium salt | Sigma-Aldrich, Co., Lcc. | H3784 | For medium |
| Polyvinyl alcohol | Sigma-Aldrich, Co., Lcc. | P8136 | For medium |
| Bovine serum albumin | Sigma-Aldrich, Co., Lcc. | A3311 | For medium |
| BT AG 501-X8 (D) Resin | Bio-Rad Lab., Inc. | 143-7425 | For preparation of dBSA |
| Hyaluronidase | Sigma-Aldrich, Co., Lcc. | H3506 | For collection of oocytes and cumulus cells |
| Cytochalasin B | Wako Pure Chemical Industries, Ltd. | 034-17554 | For enucleation and oocytes activation |
| Piezo micro manipulator | Prime tech, Co., Ltd. | PMM-150FU | For micromanipulation |
| HVJ Envelope Cell Fusion Kit GenomONE-CF | Ishihara sangyo kaisha, Ltd. | CF001 | Containing 0.5 mL of HVJ-E suspension solution and 10 mL of cell fusion buffer for cell fusion |
| SrCl2 · 6H2O | Wako Pure Chemical Industries, Ltd. | 193-09442 | For oocytes activation |
| EGTA | Sigma-Aldrich, Co., Lcc. | E8145 | For oocytes activation |
| Dimethyl sulfoxide | Wako Pure Chemical Industries, Ltd. | 045-24511 | For solvent |
| Trichostatin A | Sigma-Aldrich, Co., Lcc. | T1952 | For incubating with SCNT embryos |
| L-Ascorbic acid | Sigma-Aldrich, Co., Lcc. | A5960 | For incubating with SCNT embryos |
| Mineral oil | Sigma-Aldrich, Co., Lcc. | M8410 | For covering medium |
Referencias
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Kishigami, S., et al. Production of cloned mice by somatic cell nuclear transfer. Nat Protoc. 1 (1), 125-138 (2006).
- Ogura, A., Inoue, K., Takano, K., Wakayama, T., Yanagimachi, R. Birth of mice after nuclear transfer by electrofusion using tail tip cells. Mol Reprod Dev. 57 (1), 55-59 (2000).
- Ono, Y., Shimozawa, N., Ito, M., Kono, T. Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer. Biol Reprod. 64 (1), 44-50 (2001).
- Matoba, S., et al. Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation. Cell. 159 (4), 884-895 (2014).
- Kishigami, S., et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer. Biochem Biophys Res Commun. 340 (1), 183-189 (2006).
- Rybouchkin, A., Kato, Y., Tsunoda, Y. Role of histone acetylation in reprogramming of somatic nuclei following nuclear transfer. Biol Reprod. 74 (6), 1083-1089 (2006).
- Bui, H. T., et al. Effect of trichostatin A on chromatin remodeling, histone modifications, DNA replication, and transcriptional activity in cloned mouse embryos. Biol Reprod. 83 (3), 454-463 (2010).
- Chen, J., et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat Genet. 45, 34-42 (2013).
- Huang, Y., et al. Vitamin C enhances in vitro and in vivo development of porcine somatic cell nuclear transfer embryos. Biochem Biophys Res Commun. 411 (2), 397-401 (2011).
- Isaji, Y., Yoshida, K., Imai, H., Yamada, M. An intracytoplasmic injection of deionized bovine serum albumin immediately after somatic cell nuclear transfer enhances full-term development of cloned mouse embryos. J Reprod Dev. 61 (6), 503-510 (2015).
- Miyamoto, K., et al. Reprogramming towards totipotency is greatly facilitated by synergistic effects of small molecules. Biol Open. 6, 415-424 (2017).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the mouse embryo: A laboratory manual. , (2014).
- Nakagata, N., Okamoto, M., Ueda, O., Suzuki, H. Positive effect of partial zona-pellucida dissection on the in vitro fertilizing capacity of cryopreserved C57BL/6J transgenic mouse spermatozoa of low motility. Biol Reprod. 57 (5), 1050-1055 (1997).
- Hogan, B., Costantini, F., Lacy, E. . Manipulating the mouse embryo. , (1986).
- Wakayama, T., Yanagimachi, R. Cloning of male mice from adult tail-tip cells. Nat Genet. 22 (2), 127-128 (1999).
- Ogura, A., et al. Production of male cloned mice from fresh, cultured, and cryopreserved immature sertoli cells. Biol Reprod. 62 (6), 1579-1584 (2000).
- Wakayama, T., Rodriguez, I., Perry, A. C., Yanagimachi, R., Mombaerts, P. Mice cloned from embryonic stem cells. Proc Natl Acad Sci U S A. 96 (26), 14984-14989 (1999).
- Tachibana, M., et al. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature. 461 (7262), 367-372 (2009).
- Yamada, M., et al. Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells. Nature. 510 (7506), 533-536 (2014).
- Mizutani, E., et al. Generation of cloned mice and nuclear transfer embryonic stem cell lines from urine-derived cells. Sci Rep. 6, 1-8 (2016).
- Kaminuma, O., et al. Hyper-reactive cloned mice generated by direct nuclear transfer of antigen-specific CD4+ T cells. EMBO Rep. 18 (6), 885-893 (2017).
- Terashita, Y., et al. Latrunculin A can improve the birth rate of cloned mice and simplify the nuclear transfer protocol by gently inhibiting actin polymerization. Biol Reprod. 86 (6), 180 (2012).
- Zhao, J., et al. Histone deacetylase inhibitors improve in vitro and in vivo developmental competence of somatic cell nuclear transfer porcine embryos. Cell Reprogram. 12 (1), 75-83 (2010).
- Shi, L. H., et al. Trichostatin A (TSA) improves the development of rabbit-rabbit intraspecies cloned embryos, but not rabbit-human interspecies cloned embryos. Dev Dyn. 237 (3), 640-648 (2008).
- Esteban, M. A., et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells. Cell Stem Cell. 6 (1), 71-79 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados