Method Article
Комбинационный лечения трихостатин А и витамин С улучшает эффективность клонирования мышей путем переноса ядер соматических клеток
В этой статье
Резюме
Мы описываем метод значительно улучшена для мыши клонирования с помощью трихостатин A, витамин C и деионизированную бычьим сывороточным альбумином. Мы показываем упрощенный, воспроизводимые протокол, который поддерживает эффективное развитие клонированных эмбрионов. Следовательно этот метод может стать стандартизированной процедуры клонирования мыши.
Аннотация
Переноса ядер соматических клеток (SCNT) предоставляет уникальную возможность производить непосредственно клонированных животных от доноров клеток, и это требует использования искусных методов. Кроме того эффективность клонирования оставались низкими со времени успешного производства клонированных животных, особенно мышей. Там было много попыток, чтобы улучшить эффективность клонирования, и трихостатин (TSA), ингибиторов деацетилаз гистонов, широко используется для повышения эффективности клонирования. Здесь мы приводим метод значительно улучшена клонирования в мышей. Этот метод переноса ядер соматических клеток предполагает использование вируса Hemagglutinating Японии конверта (HVJ-E), который позволяет легко манипулировать. Кроме того лечение, с использованием двух маленьких молекул, TSA и витамином С (VC), с дейонизированной бычьим сывороточным альбумином (Брюа), является весьма эффективной для эмбрионального развития. Этот подход требует дополнительных инъекций ни генетические манипуляции и таким образом представляет метод простой, пригодных для практического использования. Этот метод может стать технически осуществимым подход для исследователей для создания генетически модифицированных животных от культивируемых клеток. Кроме того это может быть полезным способом для спасения редких животных через клонирование.
Введение
SCNT технология позволяет производство клонированных животных, используя только один соматических клеток или ядра могут быть переданы enucleated ооцитов. Одна из целей SCNT техники является производным линии эмбриональных стволовых клеток (NT-ЭСК) ядерной передачи от клонированных эмбрионов. В 1998 году Вакаяма и др., о которых сообщалось, производство успешно клонированных мыши, с именем Cumulina для первого времени1. С тех пор клонирование мышей широко изучен, и были получены многие важные идеи в ядерной перепрограммирования соматические ядра. С другой стороны, эта техника сопровождается многочисленными микроманипуляции шаги, которые являются довольно трудно мастер, требующих интенсивного обучения более чем на 3 месяца2.
Производство клонированных мышей с использованием SCNT превратилась из оригинального Гонолулу метод1, метод электрофузионных3, метод синтеза клеток Hemagglutinating вирусом Японии (HVJ)4. Однако прямым впрыском клеточного ядра через cytomembrane стремится нарушить ооцитов выживания. Электрофузионные низкой эффективности, так как каждый клеточной мембраны имеет различной твердости, что делает его трудно определить оптимальное состояние. Обработка HVJ является трудоемким, потому что он требует специального оборудования для обеспечения безопасности исследователей и лабораторных животных. Недавно чтобы предохранитель цитоплазме клеток и яйцеклетки доноров, HVJ-E был используется5. HVJ-E имеет только способность предохранитель мембраны без пролиферативных или инфекционные способность вирусов. Геномной РНК HVJ полностью инактивированных в HVJ-E. Таким образом, использование HVJ-E поддерживает управляемость синтеза клеток во время SCNT.
Несколько отчетов показали, что лечение SCNT эмбрионов с ВСТ, ингибиторов деацетилаз гистонов, значительно улучшает эффективность производства живых детенышей от менее чем 1% до 6,5%6,7. АСП лечение ускоряет перепрограммирования через изменения меток гистона SCNT эмбрионов8. Недавно, введения конкретных мРНК, гистонов лизин деметилазы подсемейство 4 (KDM4), который удалить гистонов H3 лизина 9 (H3K9) было показано, что trimethylation в SCNT эмбрионов, особенно на перепрограммирования устойчивые регионы, увеличить развитие клонированных эмбрионов мыши9. Тем временем VC, который также служит в качестве модификатора гистонов, уменьшилось trimethylation H3K910. Кроме того VC повышает эмбриональное развитие в свинину SCNT10. Сообщается, что инъекции Брюа в SCNT эмбрионов приводит к улучшению эмбрионального развития11.
Ранее мы обнаружили, что сочетание малых молекул, а именно: TSA и VC, вместе с Брюа, резко повысить развитие эмбрионов SCNT12. Здесь мы подробно сообщалось ранее SCNT метод для мышей, который представляет собой весьма эффективный и простой процедуры клонирования12. Мы также описывают обработку HVJ-E. Это может помочь много исследователей в области развития и репродуктивной биологии для сохранения генетических ресурсов или производить генетически модифицированных животных через этот метод SCNT.
протокол
Все животные процедуры соответствовал руководящим принципам Kindai университета для ухода и использования лабораторных животных.
1. Подготовка культуры средств массовой информации
- Подготовить измененный КСОМ (mKSOM) средний для культуры эмбрион, состоящий из 95 мм NaCl, 2,5 мм KCl, 0,35 мм х2PO4, 0,2 мм MgSO4 · 7H2O, 1.71 мм CaCl2 · 2H2O, 0,2 мм D (+)-глюкоза, 0,2 мм пируват натрия, 1,0 мм L-глютамином, 1,0 г/Л поливинилпирролидона (ПВП), 25.07 мм NaHCO3, 10 мм DL-Лактат натрия, 0,05 г/Л пенициллина и стрептомицина в стерильной воде 0,05 г/Л.
- Подготовка среднего Hepes амортизированное CZB (HCZB) для манипуляции эмбрион, состоящий из 81,5 мм NaCl, 4,8 мм KCl, 1.7 CaCl2 · 2H2O, 1,18 мм MgSO4 · 7H2O, 1,18 мм х2PO4, 0,11 мм ЭДТА · 2На, 36,1 мм DL-Лактат натрия, 5.55 мм D (+)-глюкоза, 0,025 г/мл пенициллин, 0,035 г/Л стрептомицина, 0,014 мм фенола красного, поливиниловый спирт 1,0 г/Л, 5.0 мм NaHCO3и 20,0 мм Hepes натриевой соли в стерильной воде.
- Приготовить средство активации для активации ооцитов: mKSOM средний дополнена 50 Нм TSA, 2 мм EGTA, 5 мкг/мл cytochalasin B (CB) и 5 мм SrCl2.
2. подготовка в деионизированной бычьим сывороточным альбумином (Брюа)
- 1.2 g бычьим сывороточным альбумином (БСА) растворяют в 10 мл стерильной воды при комнатной температуре (конечная концентрация 12%).
- Добавьте около 0,12 г смешанных ионообменные смолы бисера выше подготовил 12% BSA в стерильной воде при комнатной температуре с мягким перемешиванием.
- Когда бисер цвета от сине зеленого золота, восстановить супернатанта решения с помощью пипетки. Затем замените свежим бисер (рис. 1).
Примечание: Замена бисера обычно выполняется только один раз. Возможно, он требует несколько замен для завершения деионизации. Только в качестве ориентира, если цвет бисера остается неизменным от сине зеленый с золотом, он указывает, что ионного обмена является полным. - Восстановление решение после подтверждения, что нет никакого изменения цвета в бисер.
Примечание: Если восстановленные решение становится мутным, центрифуги для предотвращения засорения фильтра (175 x g, 5 мин). - Дополнить восстановленные решение с 250 мкл 10,5% NaHCO3.
Примечание: Данный процесс предназначен для нейтрализации рН условие решения Брюа. Однако NaHCO3 может быть необязательным. - Стерилизовать супернатанта, с помощью фильтра 0.45 мкм и хранить при температуре-20 ° C как Брюа Стоковый раствор.
3. яйцеклетка коллекция
Примечание: Все мышей были сохранены в свете контролируемую и кондиционированные номера.
- Супер овуляция каждая женщина B6D2F1 мышь (в возрасте 8-10 недель) внутрибрюшинной инъекцией 7,5 МЕ гонадотропина сыворотки беременных Маре (ГСЖК) и 7,5 ед хорионического гонадотропина человека (ХГЧ) 48 ч после инъекции ГСЖК.
- Выполнять эвтаназии, вывих шейного 14-16 ч после инъекции ХГЧ. Надрезать живота для доступа к репродуктивного тракта, используя стандартные рассечение методы13. Вкратце ущипнуть кожу и сделать небольшой боковой разрез на средней линии с ножницами. Придерживайте кожу прочно выше и ниже разреза и потяните кожу головы и хвоста. Вырезать ножницами брюшины, нажмите катушки кишечнике в сторону и подтвердить наличие двух рогов матки, яйцеводов и яичников.
- Истребить яйцеводов с небольшой прямые ножницы и щипчики, место на листе бумаги фильтр, чтобы стереть кровь с поверхности. Установите яйцеводов в минеральном масле. Затем разрезать ампула маточных труб, с помощью иглы рассечение и переместить комплексов кучевые ооцитов, приходя от ампула маточных труб в 200 мкл капли HCZB среды с 0.1% гиалуронидазы. Инкубируйте 5 мин на потепления тарелку.
Предупреждение: Экспозиции более чем 10 мин в HCZB среде с 0.1% гиалуронидаза бы пагубные последствия для ооцитов. - Убедитесь, что отель cumulus клетки освобождаются от кучевые ооцитов комплексы под стереомикроскопом, передача второй meiotic метафазы (MII) стадии яйцеклеток с некоторых оставшихся кучевые клетки mKSOM средних содержащие 0,3% Брюа. Затем, мыть ооциты стадии MII четыре раза, закупорить вверх и вниз (с помощью пипетки из < внутренний диаметр 100 мкм) в mKSOM средних содержащие 0,3% Брюа для отсоединения оставшиеся ячейки кучевые.
Примечание: Использование небольших пипетки облегчает отряд кучевые клеток. - Инкубировать Mll стадии яйцеклеток в mKSOM средних содержащие 0,3% Брюа при 37 ° C под 5% CO2 инкубатора до Энуклеация.
Примечание: Рекомендуется небольшой пипетку с диаметром, что немного больше, чем в яйцеклетку.
4. Подготовка клеток донора для передачи ядерной
- После шаги 3.3-3.5 оголенные ооциты изолированы от комплексов кучевые ооцитов. Передача оставшихся кучевые клетки рассеяны от кучевые ооцитов комплексов в HCZB среде с 0.1% гиалуронидаза средний HCZB с 6% Брюа с помощью пипетки под стереомикроскопом небольшое количество (примерно 2 мкл).
- Место кучевые клетки в HCZB среде с 6% Брюа на потепление пластине при 37 ° C до тех пор, пока необходимые для SCNT.
Примечание: Когда клетки фибробластов (например., мышиных плода фибробластов клетки), используется в качестве доноров клеток, отсоединить клетки культуры ткани блюдо и центрифуги их в гранулах. Ресуспензируйте Пелле клеток в HCZB среде, содержащей Брюа 6%.
5. Энуклеация ооцитов
- Подготовка 9% PVP среднего, добавив 0,9 г PVP 10 мл HCZB средний, держать в холодильнике на ночь (4 ° C) и затем стерилизовать его с помощью фильтра 0.45 мкм.
- Подготовьте CB акций решения (концентрации 1 мг/мл), добавив 5 мг CB до 5 мл диметилсульфоксида (ДМСО). Разбавить CB Стоковый раствор с HCZB среднего (конечная концентрация 5 мкг/мл) и использовать как Энуклеация решения.
- Мыть Mll стадии яйцеклеток в 20 мкл HCZB среды, содержащие 5 мкг/мл CB (Энуклеация раствор), вдыхая и выдыхая через стерилизованные пипетки (внутренний диаметр: 150 мкм до 200 мкм). Повторите процедуру Стиральная пять раз. Подождите приблизительно 10 минут на пластину потепления в растворе Энуклеация перед запуском процесса Энуклеация.
- Подготовьте Энуклеация камеру, как показано на рисунке 2А. Переноса ооцитов Mll Энуклеация камеру путем вдыхания и exhaling с помощью пипетки (внутренний диаметр: 150 мкм до 200 мкм); место 4 мкл раствора Энуклеация и охватывают в камеру с минеральным маслом.
Примечание: Вместо камере, может использоваться кавер-60 мм Петри. - Идентифицировать шпинделей и хромосомы яйцеклеток стадии MII под микроскопом (400 X) при комнатной температуре. Ориент Mll стадии ооцитов с выраженным первого полярного тельца, так что позиционирование шпинделя и хромосомы в 3 или 9 часов позиции (рис. 2B), с помощью пипетки Холдинг и микропипеткой.
Примечание: Микроскоп используется имеет линзы 400 X увеличением в общей сложности. Кроме того объектив Н.А-5 X / 0.12 и 40 X / 0,55. Пьезо вождение импульса из пипетки позволяет быстрое сверление zona pellucida. Кроме того лазерная система (например, XYClone) также может использоваться для бурения вителлинового вместо системы вождения piezo. - Установите интенсивность импульсов пьезо-3-6 и сверлить в zona pellucida, с помощью пипетки микроманипуляции (7-8 мкм внутренний диаметр закончилась с плоским отзыв) с пьезо пульс вождения. После открытия отверстие в zona pellucida, полностью enucleate шпинделей и хромосом с минимальным количеством цитоплазмы (рис. 2 c).
Примечание: В ходе этого процесса, ооциты склонны плотно прикрепить к нижней блюдо или Пипетка благодаря среде без BSA14. В течение 10 мин Энуклеация процесс должен быть завершен, и enucleated яйцеклеток должны быть возвращены в инкубаторе. Соответствующее количество яйцеклеток, которыми можно управлять в одном Энуклеация находится между 10 и 20. Для более крупных партий яйцеклеток Энуклеация процедура повторяется. - Подтвердить отсутствие хромосом в цитоплазме под видимого света (рис. 2 c, средний), а затем тщательно вымыть enucleated яйцеклеток в mKSOM среде, содержащей 0,3% Брюа хватает CB. Представить блюдо инкубатора при 37 ° C под 5% CO2 до слияния клеток.
Примечание: После Энуклеация, цитоплазме, удалены от ooplasm содержит шпинделей и хромосом.
6. слияние клеток донора и Enucleated ооцитов
-
Подготовка HVJ-E
- 260 мкл раствора ледяной HVJ-E подвеска лиофилизированные HVJ-е (из комплекта, см. Таблицу материалы) и Пипетка вверх и вниз до тех пор, пока полностью приостановлено.
Примечание: В бутылку готовится соответствующее количество лиофилизированные HVJ-E, и 260 мкл HVJ-E подвеска раствор входит в комплект. - Подготовить 5 аликвоты мкл раствора HVJ-E и затем хранить при температуре-80 ° C до слияния клеток.
Предупреждение: Внимательно относиться к HVJ-E на льду, так как это чувствительных к температуре. После завершения эксперимента, надлежащим образом автоклав HVJ-E материалы и контейнеры для полностью инактивировать вирус компонентов.
- 260 мкл раствора ледяной HVJ-E подвеска лиофилизированные HVJ-е (из комплекта, см. Таблицу материалы) и Пипетка вверх и вниз до тех пор, пока полностью приостановлено.
-
Слияние ячеек
- Разбавьте 5 мкл раствора HVJ-E с 20 мкл буфера слияние ячеек непосредственно перед использованием. Место разбавленный раствор HVJ-E на льду до использования.
Примечание: Буфер фьюжн клетки входит в комплект HVJ-Е. - Подготовка камеры слияние клеток, как показано на рисунке 3A. Передавать HCZB среднего enucleated яйцеклеток на камеру синтеза клеток с помощью пипетки (внутренний диаметр: 150 мкм до 200 мкм); место 4 мкл каждого решения (HCZB носитель содержит 6% -BSA для клеток донора, раствор HVJ-E, HCZB средний, 9% PVP в HCZB среде) и охватывают в камеру с примерно 1 мл минерального масла.
Примечание: Соответствующее количество энуклеированные ооцитов, которые передаются в палату для манипуляций в ходе одной процедуры слияния клеток составляет от 5 до 30. Для больших пакетов яйцеклеток повторяется процедура по сплавливания клеток. Вместо камеры Петри 60-мм крышка может использоваться, если таковые имеются. - Место enucleated яйцеклеток в HCZB среде под микроскопом при комнатной температуре 400 X magnificationat. Аспирационная клеток донора, с помощью пипетки микроманипуляции (6-7 мкм внутренний диаметр закончилась с плоским отзыв) и высылать клетки в HVJ-E подвеска решение.
- Затем, аспирационная кучевые клетки по одному HVJ-E подвеска раствором, чтобы быть одинаково отделены друг от друга, позволяя серийный клеток фьюжн. Держите enucleated яйцеклеток в HCZB среде с помощью пипетки Холдинг. Дрель вителлинового с микроманипуляции пипетку с пьезо импульса (интенсивность скорость 3-6, 2-3).
- После открытия в отверстие в zona pellucida, место кучевые клетки плотно мембраны яйцеклетки, наряду с HVJ-E подвеска решение с объемом 5 раз превышает объем ячейки, кучевые, без прохождения через мембраны яйцеклетки.
Примечание: 6-7 мкм внутренний диаметр плоским, закончившийся советы микроманипуляции пипеток подготовиться кучевые клеток. Пипетки должны мыть регулярно используя 9% PVP средство для поддержания гладкой клетки релиз. Шаги 6.2.3 - 6.2.5 должна быть завершена в течение 10 мин, или эффективность синтеза клеток будет ниже. Мембрана фьюжн активности HVJ-e обезврежена автоклавирования, лечение с моющими средствами, или 70% этиловом спирте. После эксперимента HVJ-E решения надлежащим образом утилизировать. - После манипуляций синтеза клеток, оперативно передать mKSOM средних содержащие 0,3% Брюа яйцеклеток и перейти к инкубатора при 37 ° C под 5% CO2 на 1 ч.
- Разбавьте 5 мкл раствора HVJ-E с 20 мкл буфера слияние ячеек непосредственно перед использованием. Место разбавленный раствор HVJ-E на льду до использования.
7. Активация реконструированный ооцитов и лечение с трихостатин А и витамин С
-
Подготовка ВСТ
- Отказаться от 5 мм ВСТ решения в 3 мкл аликвоты и сохранить решение при-20 ° C.
- 2.5 мкл 5 мм ВСТ Стоковый раствор, по 1 мл ДМСО (концентрация 12,5 мкм).
- Развести 8 мкл раствора 12,5 мкм TSA запасов в 2 мл активации среднего и среднего mKSOM (конечная концентрация 50 Нм).
-
Подготовка VC
- Добавьте VC 1 мг в 1 мл стерильной воды, эндотоксинов свободной и хранить при температуре от-20 ° C.
- Добавьте решение штока VC mKSOM среднего (конечной концентрации 10 мкг/мл).
-
Активация реконструированный яйцеклеток
- Один час после слияния клеток, проверьте преждевременной хромосома конденсации (PCC) в реконструированных ооцитов (рис. 3B) с помощью микроскопа (400 X).
- Передать реконструированный ооциты средство активации (см. шаг 1.3) содержащий TSA и инкубировать в течение 6 ч при 37 ° C под 5% CO2 в воздухе (рис. 3 c). Наблюдать за формирование pro ядер в SCNT эмбрионов, а затем применить 2 часов лечения TSA в mKSOM средних Брюа содержащие 0,3% (рис. 2 c).
- Передача TSA-лечить эмбрионы mKSOM средний дополнена VC и проинкубируйте 7 h, как показано на рисунке 3D.
- После 7 h VC лечения, передать mKSOM средних содержащие 0,3% Брюа VC-лечить эмбрионы и инкубировать в течение 4 дней при 37 ° C под 5% CO2 в воздухе.
Примечание: Для получения клонированной мышей, передача морфологически нормальных этап 2-клеток эмбрионов в яйцеводов псевдо-беременных самок мышей (MCH(ICR)) в день, когда Вагинальные вилка найден (день 0,5 pseudopregnancy)15. После 19,5 дней количество сайтов имплантации и новорожденных записываются после кесарева сечения.
Результаты
Для производства мыши клонированных эмбрионов, были использованы кучевые клетки и клетки плода фибробластов. Количество восстановленных ооцитов и разработки до этапа 2-клеток после активации ооцитов приведены в таблице 1. Очень высокий уровень pronuclear формирования (89-100%) и разработка на этап 2-клеток (77 до 89%) были замечены при любых условиях. Некоторые из клонированных эмбрионов, которые были полученные из клеток кучевые и разработаны для этапа 2-клеток, были переданы яйцеводов псевдо-беременных самок. Шесть клонированных потомство из 72 перенесенных эмбрионов были произведены от трех беременных женщин путем последовательного лечения TSA и VC (рис. 4). Приблизительно 15% из клонированных эмбрионов, как сообщается, развивать в срок, следуя этой процедуры SCNT12. Кроме того передача клонированных эмбрионов 2-клеток в других учебных заведениях достигла 9 до 15% живой потомство, которое представляет лучшего развития, чем одного лечения TSA на клонированных эмбрионов. Кроме того, лечение с ВСТ и VC значительно повысила эффективность в vitro эмбрионального развития к стадии бластоцисты (Таблица 2, P < 0,05, t критерия Стьюдента). Эти в vitro развития данные показывают, что положительный эффект TSA и VC ограничено ни мыши штаммов ни типы клеток. Эти результаты показывают, что этот метод SCNT облегчает развития способности клонированных эмбрионов.

Рисунок 1: Подготовка Брюа.
Пошаговые процедуры для подготовки решения Брюа изображены. Степень ионного обмена можно судить путем изменения цвета бисера. Верхний левый рисунок показывает что 1.2 g BSA растворяют в 10 мл стерильной воды при комнатной температуре. После роспуска BSA, ионообменные смолы бусины добавляются (справа вверху). Когда смесь раствора БСА с бусами ионообменные смолы изменение цвета от сине зеленого золота (снизу справа), заменить бисер пресной. Нижний левый рисунок показывает, что цвет бисера остается сине зеленый, и закончил ионного обмена. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
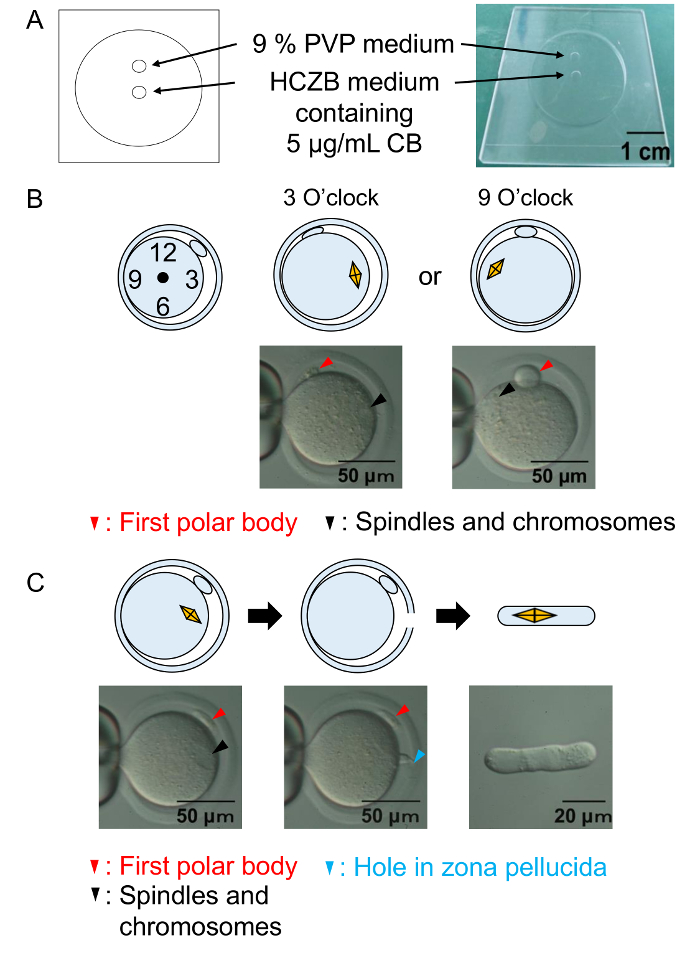
Рисунок 2: Энуклеация процедуры.
(A) Иллюстрация Энуклеация камеры. Энуклеация ооцитов осуществляется в HCZB среде с CB. Для системы вождения piezo место 9% PVP среды используется для подготовки Пипетки стеклянные для Энуклеация. Пятна покрыты минеральное масло. (B) схемы и Микрофотография показывают положение шпинделей и хромосомы до Энуклеация. Черные стрелки: шпиндели и хромосом. Красные стрелки: первого полярного тельца. (C) A схема и Микрофотография Показать успешные Энуклеация. Черные стрелки: шпиндели и хромосом. Красные стрелки: первого полярного тельца. Голубые стрелки: отверстие в zona pellucida. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
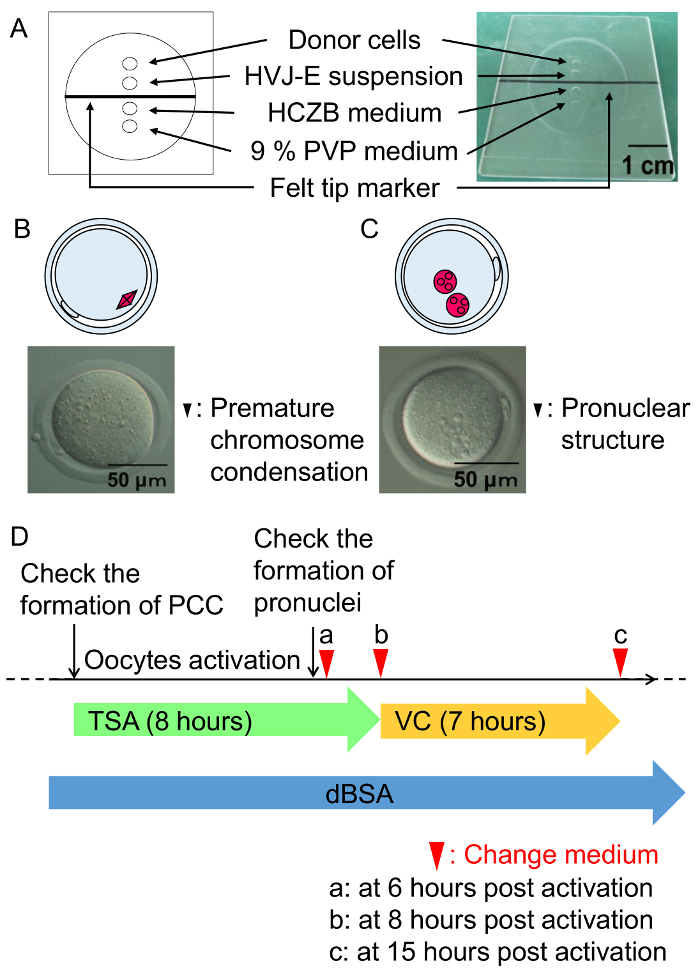
Рисунок 3: Мобильный fusion процедуры и культура состояние SCNT эмбрионов.
(A) Иллюстрация палаты слияние клеток. Слияние ячеек производится в HCZB среде, содержащей Брюа 6%. Место 9% PVP среды используется для подготовки Пипетки стеклянные для синтеза клеток. Пятна покрыты минеральное масло. (B) схемы и Микрофотография преждевременной хромосома конденсации сформировали один час после слияния клеток (черная стрелка). (C) A схема и Микрофотография pronuclear структуры сформированы шесть часов после активации (черные стрелки). (D) схема TSA, VC и Брюа лечения SCNT эмбрионов. Зеленая стрелка представляет собой лечение с ВСТ, следуют инкубации с VC (желтая стрелка) в mKSOM среде, содержащей с 0,3% Брюа (синяя стрелка). Стрел указывают время для изменения среды. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
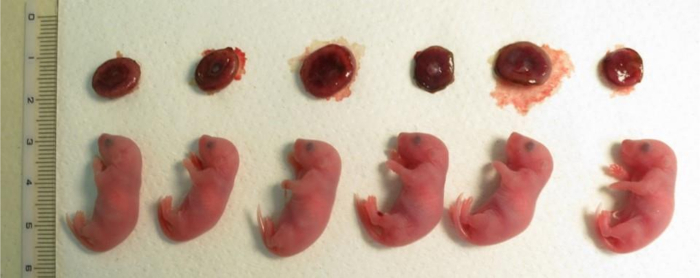
Рисунок 4: Клонированные потомство производными ячеек кучевые сразу после кесарева сечения после 19,5 дней беременности.
В верхней строке есть роль162. Клонированные потомство, показанный здесь были созданы в одном ядерной передачи эксперимент от трех приемных матерей. Размер плаценты был 1,5 – 2 раза больше, чем размер тех, кто получают путем оплодотворения в пробирке . Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Группа | Тип ячейки доноров | Штамм мыши | LOL яйцеклеток используется | LOL яйцеклеток наплавочные | LOL показаны конденсации преждевременной хромосомы яйцеклеток | LOL яйцеклеток, показаны pronuclei образованием (%) | LOL pronuclei сформированные яйцеклеток, разработанные к 2-клеток эмбрионов (%) | |
| TSA, VC | Отель Cumulus | C57BL/6 × DBA/2 | 84 | 82 | 82 | 81 (99) | 72 (89) | |
| лечить | Отель Cumulus | C57BL/6 × DBA/2 | 84 | 82 | 82 | 82 (100) | 68 (83) | |
| TSA, VC | плода фибробластов | MCH(ICR)×MCH(ICR) | 202 | 171 | 169 | 151 (89) | 124 (82) | |
| лечить | плода фибробластов | MCH(ICR)×MCH(ICR) | 201 | 171 | 147 | 142 (97) | 109 (77) | |
Таблица 1: эффекты TSA и VC лечения на в пробирке развитие зародышей клонированных мыши к стадии 2-элементный.
| Группа | Тип ячейки доноров | Штамм мыши | LOL 2-клеток эмбрионов используются | LOL 2-клеток эмбрионов разработаны для каждой стадии (%) | |||
| 4-элементная | морулы | бластоцисты | |||||
| TSA, VC | Отель Cumulus | C57BL/6 × DBA/2 | 152 | 152 (100) | 149 (98) | 135 (89) | |
| лечить | Отель Cumulus | C57BL/6 × DBA/2 | 83 | 47 (57) | 41 (49) | 32 (39) b | |
| TSA, VC | плода фибробластов | MCH(ICR)×MCH(ICR) | 124 | 110 (89) | 101 (81) | 88 (71) c | |
| лечить | плода фибробластов | MCH(ICR)×MCH(ICR) | 109 | 54 (50) | 45 (41) | 29 (27) d | |
| a-b, c-d Различные верхние в тех же ячейках доноров представляют собой значительные различия (P < 0,05) | |||||||
Таблица 2: эффекты TSA и VC лечения на в пробирке развитие зародышей клонированных мыши к стадии бластоцисты.
Обсуждение
В заключение эти результаты показывают, что метод представленных SCNT может снизить технические трудности и повысить эффективность SCNT без генетических модификаций и мРНК добавок (Таблица 1, Таблица 2) и обеспечить стабильное производство клонированных эмбрионов. Этот метод позволяет реконструировать более SCNT эмбрионов, чем традиционные методы связи с лучшей выживаемости и упрощенный протокол. В этом протоколе один критический шаг является слияние клеток. Чтобы успешно производить клонированных мышей, жизненно важно обеспечить надлежащее количество HVJ-E, указанных в протоколе поддерживается во время процесса слияния клеток и яйцеклеток должны быть возвращены в инкубатор в течение 10 мин на этапах 6.2.3 - 6.2.5. Так как клеток донора 20-30 может быть придыхательным вместе с HVJ-E одновременно в пипетку манипуляции, количество яйцеклеток, полученные от одной операции больше, чем у существующего метода. В конце концов мы можем производить около 20 до 30 вновь построенных яйцеклеток в течение 10 мин. Даже когда работает с большой партии ооцитов (100 или более), процедура по сплавливания ячейки должна занять около часа или менее, повторив шаги 6.2.3 - 6.2.5. Метод и представленные здесь методики может служить в качестве эффективных протоколов с упрощенной техническим требованиям.
В настоящее время молекулярные механизмы, лежащие в основе развитие зародышей SCNT до сих пор неясны. Этот усовершенствованный метод SCNT также способствует изучению таких перепрограммирования механизмов, поскольку этот метод может производить много клонированных эмбрионов в только одном эксперименте. Этот метод использует соматические клетки с нетронутыми клеточных мембран для синтеза клеток. Таким образом это может быть возможным применить этот подход к другие клетки, такие, как кончик хвоста клетки16, клетки Сертоли17и эмбриональных стволовых (ES) клетки18. Когда обычные SCNT методы используются для инъекций относительно крупных клеток, таких как клетки кончик хвоста, непосредственно в цитоплазму ооцита, она становится даже более технически сложных для получения живых эмбрионов. Кроме того относительно жестких клеток, таких как клетки Сертоли, трудно разорвать, закупорить для инъекций. При рассмотрении этих различных типов клеток, метод синтеза клеток, используя HVJ-E является простым и эффективным. Хотя значение и безопасности HVJ-e были убедительно продемонстрировали19,20, было бы важно вновь рассмотреть вопрос о целесообразности использования HVJ-E для производства клонированных животных для целей сельского хозяйства или биомедицинских.
Кроме того недавно одна группа успешно производит клонированных мышей, производные от мочи клетки21. Чтобы спасти исчезающих видов млекопитающих, отныне SCNT с использованием клеток, собранных в неинвазивные манере, например мочи ячейки, будет идеальным. Совсем недавно, другая группа непосредственно создается клонированный мышей с использованием антиген специфические CD4 клеток+ T22. Было бы интересно изучить, если этот метод применяется также эффективно клонировать мышей из таких клеток. Кроме того было сообщено Латрункулин A как лучшей альтернативой для ингибирования актина полимеризации в ходе Энуклеация и партеногенетических активации SCNT ооциты23. Будущие исследования может показывают ли A Латрункулин лечения, вместо cytochalasin B, далее улучшает поколения клонированных потомства. Кроме того АСП лечение успешно используется в мышей и свиней24, кролики25 , изменяя время лечения, период и концентрации. Кроме того VC не только повышает эмбриональное развитие в свинину SCNT10, но также улучшает iPS производства клеток в организме человека и мышей26. Таким образом это правдоподобно предположить, что TSA и VC лечение может также применяться для других видов млекопитающих, и нам может потребоваться оптимизировать время лечения TSA и VC для каждого вида.
В заключение этот метод позволит создавать клонированные мышей с практическим уровнем эффективности с простых процедур. Следовательно результаты этого исследования может привести нас, чтобы использовать технологию SCNT для сохранения генетических ресурсов редких животных и для понимания молекулярных механизмов ядерных перепрограммирования и раннего эмбрионального развития.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана JSP-страницы KAKENHI Грант номера JP15H06753, JP16H01321, JP16H01222, JP17H05045 Sumitomo к.м. Грант фонда для основных науки научно-исследовательских проектов (150810 к.м.). Kindai университет исследовательский грант (15-I-2 к.м. и м.а.). М.о. признать основной поддержки, предоставляемой исследований рака Великобритании (C6946/A24843) и Уэллком траст (203144/Z/16/Z). Мы благодарим г-жа N. Backes-Камимура и г-н J. Horvat за доказательство чтения.
Материалы
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma-Aldrich, Co., Lcc. | 28-2270-5 | For medium |
| KCl | Wako Pure Chemical Industries, Ltd. | 169-03542 | For medium |
| KH2PO4 | Wako Pure Chemical Industries, Ltd. | 165-04242 | For medium |
| MgSO4 · 7H2O | Wako Pure Chemical Industries, Ltd. | 137-00402 | For medium |
| CaCl2 · 2H2O | Wako Pure Chemical Industries, Ltd. | 039-00431 | For medium |
| D(+)-Glucose | Wako Pure Chemical Industries, Ltd. | 041-00595 | For medium |
| Sodium Pyruvate | Wako Pure Chemical Industries, Ltd. | 199-03062 | For medium |
| L-Glutamine | Sigma-Aldrich, Co., Lcc. | G3126 | For medium |
| Polyvinylpyrrolidone | Wako Pure Chemical Industries, Ltd. | 168-17042 | For medium |
| NaHCO3 | Nacalai tesque, Inc. | 31213-15 | For medium |
| Sodium DL-Lactate | Nacalai tesque, Inc. | 31605-72 | For medium |
| Penicillin | Meiji Seika Pharma Co., Ltd. | 4987222637671 (GTIN-13) | For medium |
| Streptomycin | Meiji Seika Pharma Co., Ltd. | 4987222665643 (GTIN-13) | For medium |
| Sterile water, endotoxin free | Wako Pure Chemical Industries, Ltd. | 196-15645 | For medium |
| EDTA · 2Na | Dojindo Lab. | 345-01865 | For medium |
| Phenol red | Sigma-Aldrich, Co., Lcc. | P0290 | For medium |
| HEPES sodium salt | Sigma-Aldrich, Co., Lcc. | H3784 | For medium |
| Polyvinyl alcohol | Sigma-Aldrich, Co., Lcc. | P8136 | For medium |
| Bovine serum albumin | Sigma-Aldrich, Co., Lcc. | A3311 | For medium |
| BT AG 501-X8 (D) Resin | Bio-Rad Lab., Inc. | 143-7425 | For preparation of dBSA |
| Hyaluronidase | Sigma-Aldrich, Co., Lcc. | H3506 | For collection of oocytes and cumulus cells |
| Cytochalasin B | Wako Pure Chemical Industries, Ltd. | 034-17554 | For enucleation and oocytes activation |
| Piezo micro manipulator | Prime tech, Co., Ltd. | PMM-150FU | For micromanipulation |
| HVJ Envelope Cell Fusion Kit GenomONE-CF | Ishihara sangyo kaisha, Ltd. | CF001 | Containing 0.5 mL of HVJ-E suspension solution and 10 mL of cell fusion buffer for cell fusion |
| SrCl2 · 6H2O | Wako Pure Chemical Industries, Ltd. | 193-09442 | For oocytes activation |
| EGTA | Sigma-Aldrich, Co., Lcc. | E8145 | For oocytes activation |
| Dimethyl sulfoxide | Wako Pure Chemical Industries, Ltd. | 045-24511 | For solvent |
| Trichostatin A | Sigma-Aldrich, Co., Lcc. | T1952 | For incubating with SCNT embryos |
| L-Ascorbic acid | Sigma-Aldrich, Co., Lcc. | A5960 | For incubating with SCNT embryos |
| Mineral oil | Sigma-Aldrich, Co., Lcc. | M8410 | For covering medium |
Ссылки
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Kishigami, S., et al. Production of cloned mice by somatic cell nuclear transfer. Nat Protoc. 1 (1), 125-138 (2006).
- Ogura, A., Inoue, K., Takano, K., Wakayama, T., Yanagimachi, R. Birth of mice after nuclear transfer by electrofusion using tail tip cells. Mol Reprod Dev. 57 (1), 55-59 (2000).
- Ono, Y., Shimozawa, N., Ito, M., Kono, T. Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer. Biol Reprod. 64 (1), 44-50 (2001).
- Matoba, S., et al. Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation. Cell. 159 (4), 884-895 (2014).
- Kishigami, S., et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer. Biochem Biophys Res Commun. 340 (1), 183-189 (2006).
- Rybouchkin, A., Kato, Y., Tsunoda, Y. Role of histone acetylation in reprogramming of somatic nuclei following nuclear transfer. Biol Reprod. 74 (6), 1083-1089 (2006).
- Bui, H. T., et al. Effect of trichostatin A on chromatin remodeling, histone modifications, DNA replication, and transcriptional activity in cloned mouse embryos. Biol Reprod. 83 (3), 454-463 (2010).
- Chen, J., et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat Genet. 45, 34-42 (2013).
- Huang, Y., et al. Vitamin C enhances in vitro and in vivo development of porcine somatic cell nuclear transfer embryos. Biochem Biophys Res Commun. 411 (2), 397-401 (2011).
- Isaji, Y., Yoshida, K., Imai, H., Yamada, M. An intracytoplasmic injection of deionized bovine serum albumin immediately after somatic cell nuclear transfer enhances full-term development of cloned mouse embryos. J Reprod Dev. 61 (6), 503-510 (2015).
- Miyamoto, K., et al. Reprogramming towards totipotency is greatly facilitated by synergistic effects of small molecules. Biol Open. 6, 415-424 (2017).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the mouse embryo: A laboratory manual. , (2014).
- Nakagata, N., Okamoto, M., Ueda, O., Suzuki, H. Positive effect of partial zona-pellucida dissection on the in vitro fertilizing capacity of cryopreserved C57BL/6J transgenic mouse spermatozoa of low motility. Biol Reprod. 57 (5), 1050-1055 (1997).
- Hogan, B., Costantini, F., Lacy, E. . Manipulating the mouse embryo. , (1986).
- Wakayama, T., Yanagimachi, R. Cloning of male mice from adult tail-tip cells. Nat Genet. 22 (2), 127-128 (1999).
- Ogura, A., et al. Production of male cloned mice from fresh, cultured, and cryopreserved immature sertoli cells. Biol Reprod. 62 (6), 1579-1584 (2000).
- Wakayama, T., Rodriguez, I., Perry, A. C., Yanagimachi, R., Mombaerts, P. Mice cloned from embryonic stem cells. Proc Natl Acad Sci U S A. 96 (26), 14984-14989 (1999).
- Tachibana, M., et al. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature. 461 (7262), 367-372 (2009).
- Yamada, M., et al. Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells. Nature. 510 (7506), 533-536 (2014).
- Mizutani, E., et al. Generation of cloned mice and nuclear transfer embryonic stem cell lines from urine-derived cells. Sci Rep. 6, 1-8 (2016).
- Kaminuma, O., et al. Hyper-reactive cloned mice generated by direct nuclear transfer of antigen-specific CD4+ T cells. EMBO Rep. 18 (6), 885-893 (2017).
- Terashita, Y., et al. Latrunculin A can improve the birth rate of cloned mice and simplify the nuclear transfer protocol by gently inhibiting actin polymerization. Biol Reprod. 86 (6), 180 (2012).
- Zhao, J., et al. Histone deacetylase inhibitors improve in vitro and in vivo developmental competence of somatic cell nuclear transfer porcine embryos. Cell Reprogram. 12 (1), 75-83 (2010).
- Shi, L. H., et al. Trichostatin A (TSA) improves the development of rabbit-rabbit intraspecies cloned embryos, but not rabbit-human interspecies cloned embryos. Dev Dyn. 237 (3), 640-648 (2008).
- Esteban, M. A., et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells. Cell Stem Cell. 6 (1), 71-79 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены