Method Article
Combinacional tratamento de tricostatina A e a vitamina C melhora a eficiência da clonagem de ratos por transferência Nuclear de células somáticas
Neste Artigo
Resumo
Nós descrevemos um método melhorado dramaticamente para clonagem de rato usando tricostatina A, vitamina C e desionizada albumina de soro bovino. Mostramos um protocolo simplificado, reprodutível, que suporta o desenvolvimento eficiente de embriões clonados. Assim, este método pode tornar-se um procedimento padronizado para clonagem de rato.
Resumo
Transferência nuclear de células somáticas (TNCS) oferece uma oportunidade única para produzir diretamente um animal clonado de uma célula do doador, e exige o uso de técnicas hábeis. Além disso, a eficiência da clonagem mantiveram-se baixas desde o sucesso da produção de animais clonados, especialmente os ratos. Tem havido muitas tentativas para melhorar a eficiência da clonagem, e tricostatina A (TSA), um inibidor de histona deacetilase, tem sido amplamente utilizada para aumentar a eficiência da clonagem. Aqui, nós relatamos um método de clonagem melhorou drasticamente em camundongos. Este método de transferência nuclear de células somáticas envolve o uso de vírus Hemagglutinating de Japão Envelope (HVJ-E), que permite a manipulação fácil. Além disso, o tratamento usando duas pequenas moléculas, TSA e vitamina C (VC), com albumina de soro bovino desionizada (dBSA), é altamente eficaz para o desenvolvimento embrionário. Essa abordagem requer a injeção adicional nem manipulação genética e, portanto, apresenta um método simples, apropriado para uso prático. Este método pode tornar-se uma abordagem tecnicamente viável para os investigadores produzir animais geneticamente modificados de células cultivadas. Além disso, pode ser uma maneira útil para o resgate de animais em extinção através de clonagem.
Introdução
A tecnologia de TNCS permite a produção de animais clonados usando apenas uma célula somática ou um núcleo para ser transferido para um ovócito sem núcleo. Um dos propósitos da técnica SCNT é a derivação de linhas de células-tronco embrionárias (NT-CES) transferência nuclear de embriões clonados. Em 1998, Wakayama et al., relataram produzindo um rato clonado com sucesso chamado Cumulina para o primeiro tempo1. Desde então, a clonagem de ratos tem sido amplamente estudada, e foram obtidos muitos insights importantes sobre reprogramação nuclear de núcleos somáticos. Por outro lado, esta técnica é acompanhada de inúmeros passos de micromanipulação que são muito difíceis de mestre, que exigem treinamento intensivo de mais de 3 meses2.
Produção de camundongos clonados usando TNCS tem evoluído a partir do original Honolulu método1, o método de eletrofusão3, para o método de fusão de células pelo vírus Hemagglutinating de Japão (HVJ)4. No entanto, a injeção direta de um núcleo celular através do cytomembrane tende a afetar prejudicialmente sobrevivência do oócito. A eletrofusão é baixa em eficiência, uma vez que cada membrana celular tem dureza diferente, tornando-se difícil determinar uma condição ideal. A manipulação de HVJ é trabalhosa, pois requer equipamentos específicos para a segurança dos investigadores e animais de laboratório. Recentemente, para fundir o citoplasma celular e oócito doador, HVJ-E tem sido usado5. HVJ-E só tem a habilidade de fundir as membranas sem a capacidade proliferativa ou infecciosa dos vírus. RNAs genômicos de HVJ são completamente inativada em HVJ-E. O uso de HVJ-E, portanto, suporta manipulação fácil de fusão celular durante TNCS.
Vários relatórios têm demonstrado que o tratamento de embriões de TNCS com TSA, um inibidor de histona deacetilase, melhora significativamente a eficiência de produção de filhotes vivos de menos de 1% a 6,5%6,7. Tratamento de TSA acelera reprogramação através da modificação do histone marcas em embriões de TNCS8. Recentemente, a injeção de mRNAs particulares, subfamília histona lisina demetilase 4 (KDM4), que remover lysin histona H3 9 (H3K9) trimethylation em embriões de TNCS, especialmente em regiões reprograming-resistente, foi mostrado para aumentar o desenvolvimento de clonado embriões de rato9. Enquanto isso, VC, que também serve como um modificador de histona, diminuiu a trimethylation de H3K910. Além disso, VC melhora o desenvolvimento embrionário em suínos TNCS10. Tem sido relatado que a injeção de dBSA em embriões de TNCS conduz para a melhoria do desenvolvimento embrionário11.
Encontramos anteriormente que a combinação de moléculas pequenas, ou seja, TSA e VC, juntamente com dBSA, dramaticamente melhorada desenvolvimento de embriões de TNCS12. Aqui, detalhamos o método de TNCS relatado anteriormente para ratos, o que representa altamente eficiente e simples clonagem procedimentos12. Também descrevemos a manipulação de HVJ-E. Estes poderiam ajudar muitos investigadores no campo da biologia reprodutiva e de desenvolvimento para preservar os recursos genéticos ou produzir animais geneticamente modificados através deste método de TNCS.
Protocolo
Todos os procedimentos de animais em conformidade com as diretrizes da Universidade Kindai para o cuidado e o uso de animais de laboratório.
1. preparação de meios de cultura
- Preparar o meio KSOM (mKSOM) modificado para cultura de embriões, consistindo de 95 mM NaCl, 2,5 mM KCl, 0,35 mM KH2PO4, 0,2 mM de MgSO4 · 7H2O, 1,71 mM CaCl2 · 2H2O, 0,2 mM D (+)-glicose, piruvato de sódio, de 0.2 mM 1.0 mM L-glutamina, 1,0 g/L de polivinilpirrolidona (PVP), mM 25,07 NaHCO3, 10 mM DL-lactato de sódio 0,05 g/L de penicilina e estreptomicina em água estéril de 0,05 g/L.
- Prepare o suporte do tampão Hepes CZB (HCZB) para a manipulação do embrião, consistindo de 81,5 mM NaCl, 4,8 mM KCl, 1,7 mM CaCl2 · 2H2O, 1,18 mM MgSO4 · 7H2O, 1,18 mM KH2PO4, 0,11 mM EDTA · 2NA, 36,1 mM DL-lactato de sódio, 5,55 mM D (+)-glicose, 0,025 g/mL penicilina, estreptomicina de 0,035 g/L, 0,014 mM vermelho de fenol, álcool polivinílico 1,0 g/L, 5,0 mM NaHCO3e 20,0 mM Hepes sal de sódio em água estéril.
- Prepare o suporte de ativação para a ativação do ovócito: mKSOM suplementado com 50 nM TSA, 2mm EGTA, 5 µ g/mL citocalasina B (CB) e 5 mM SrCl2.
2. preparação de água deionizada albumina de soro bovino (dBSA)
- Dissolva 1,2 g de albumina de soro bovino (BSA) em 10 mL de água estéril à temperatura ambiente (uma concentração final de 12%).
- Adicione cerca de 0,12 g de grânulos de resina de troca iônica misturado ao acima preparadas 12% de BSA em água estéril à temperatura ambiente com agitação suave.
- Quando os grânulos mudam cor de azul esverdeado a ouro, recuperar a solução sobrenadante com uma pipeta. Em seguida, substituir os grânulos com o fresco ones (Figura 1).
Nota: A substituição dos grânulos normalmente é executada apenas uma vez. Possivelmente requer algumas substituições de desionização completa. Apenas como um guia, se a cor dos grânulos permanece inalterada desde azul esverdeado a ouro, indica essa troca iônica está completa. - Recupere a solução depois de confirmar que não há alteração de cor em grânulos.
Nota: Se a solução recuperada torna-se nublado, centrifugar para evitar o entupimento do filtro (175 x g, 5 min). - Complementar o recuperado a solução com 250 µ l de 10,5% NaHCO3.
Nota: Este processo destina-se para a solução de dBSA neutralizar a condição de pH. No entanto, NaHCO3 pode ser dispensável. - Esterilizar o sobrenadante usando um filtro de 0,45 µm e armazenar a-20 ° C como solução estoque dBSA.
3. oócito coleção
Nota: Todos os ratos foram mantidos em quartos com ar condicionado e luz controlada.
- Superovular cada rato de B6D2F1 feminino (idade 8-10 semanas) por injeção intraperitoneal de 7,5 UI de gonadotrofina de soro de égua grávida (PMSG) e 7,5 UI de gonadotrofina coriônica humana (hCG) 48 h após a injeção de PMSG.
- Realizar a eutanásia por deslocamento cervical 14-16 h após a injeção de hCG. Faça uma incisão no abdômen para acessar o trato reprodutivo, usando técnicas de dissecação padrão13. Brevemente, beliscar a pele e fazer uma pequena incisão lateral na linha com uma tesoura. Mantenha a pele firmemente acima e abaixo da incisão e puxe a pele em direção a cabeça e a cauda. Cortar o peritônio usando a tesoura, empurre as bobinas do intestino fora do caminho e confirmar a presença dos dois chifres de ovários, os ovidutos e o útero.
- Estirpar ovidutos com pequena tesoura reta e pinças, colocar em uma folha de papel de filtro para limpar o sangue fora da superfície. Defina os ovidutos em óleo mineral. Em seguida, cortar na ampola de oviduto usando agulhas de dissecação e mover os complexos cumulus-oócito provenientes da ampola do oviduto em 200 gotas µ l de meio HCZB com hialuronidase 0,1%. Incube durante 5 min em uma placa de aquecimento.
Atenção: Uma exposição de mais de 10 min no meio de HCZB com 0,1% hialuronidase seria prejudicial para os oócitos. - Confirme que as células do cumulus são liberadas de complexos cumulus-oócito sob um estereomicroscópio, segundo transferência metáfase meiótica (MII) palco oócitos, com algumas células cumulus restantes para mKSOM médio contendo 0,3% dBSA. Em seguida, lave os oócitos de estágio MII quatro vezes pipetando para cima e para baixo (usando uma pipeta de < 100 µm de diâmetro interno) em mKSOM médio contendo 0,3% dBSA para desanexar as restantes células do cumulus.
Nota: O uso de uma pipeta pequena facilita o desprendimento das células cumulus. - Incubar os oócitos de palco Mll em mKSOM médio contendo dBSA 0,3% a 37 ° C abaixo dos 5% CO2 incubadora até enucleação.
Nota: Recomenda-se uma pequena pipeta com um diâmetro que é ligeiramente maior do que o oócito.
4. preparação de células de doadores por transferência Nuclear
- Depois passos 3.3-3.5, desnudos oócitos são isolados os complexos cumulus-oócito. Transferi uma pequena quantidade (cerca de 2 µ l) das restantes células cumulus dispersadas de complexos cumulus-oócito em meio HCZB com hialuronidase 0,1% para o meio HCZB com 6% dBSA usando uma pipeta sob um estereomicroscópio.
- Coloque as células do cumulus em meio HCZB com 6% dBSA na placa de aquecimento, a 37 ° C, até que seja necessário para TNCS.
Nota: Quando células de fibroblastos (EG., células de fibroblasto fetal murino) são usados como as células do doador, separar as células de um prato de cultura de tecidos e centrifugue-los em uma pelota. Ressuspender o precipitado de células em meio de HCZB, contendo 6% dBSA.
5. Enucleação de ovócitos
- Preparar médio de 9% PVP adicionando 0,9 g PVP para 10 mL de meio de HCZB, manter na geladeira durante a noite (4 ° C) e em seguida esterilizá-lo usando um filtro de 0,45 µm.
- Prepare soluções estoque de CB (concentração de 1 mg/mL) com a adição de 5 mg de CB a 5 mL de Dimetilsulfóxido (DMSO). Diluir a solução-mãe CB com média HCZB (uma concentração final de 5 µ g/mL) e usar como solução de enucleação.
- Lave os oócitos de palco Mll em 20 µ l de meio de HCZB contendo 5 µ g/mL CB (solução de Enucleação) por inalar e exalar através da pipeta esterilizada (diâmetro interno: 150 µm a 200 µm). Repita o procedimento de lavagem cinco vezes. Espere cerca de 10 min sobre a placa de aquecimento em solução de Enucleação antes de iniciar o processo de enucleação.
- Prepare a câmara de Enucleação, conforme mostrado na Figura 2A. Transferir os oócitos Mll para a câmara de Enucleação por inalar e exalar usando a pipeta (diâmetro interno: 150 µm a 200 µm); Coloque 4 µ l da solução de Enucleação e cubra a câmara com óleo mineral.
Nota: Em vez de uma câmara, uma tampa de uma caixa de Petri de 60 mm pode ser usada. - Identifica os eixos e cromossomos do oócito de estágio MII sob um microscópio (400x), à temperatura ambiente. Oriente o oócito de palco Mll com o pronuncia-se primeiro corpo polar, de modo que o posicionamento do eixo e do cromossoma é o 3 ou 09:00 posição (Figura 2B), usando uma pipeta de exploração e micropipeta.
Nota: O microscópio usado tem lentes de ampliação de X 400 no total. Além disso, a lente objetiva N.D. é 5 X / 0.12 e 40 X / 0.55. A condução de pulso piezo da pipeta permite rápida perfuração da zona pelúcida. Além disso, um sistema de laser (por exemplo, XYClone) também é útil para a perfuração da zona pelúcida no lugar do sistema de condução de piezo. - Defina a intensidade de pulso piezo para 3-6 e perfurar a zona pelúcida usando uma pipeta de micromanipulação (7-8 µm diâmetro interno extremidade plana ponta) com o pulso de piezo dirigindo. Depois de abrir um buraco na zona pelúcida, completamente enucleate os fusos e cromossomos com uma quantidade mínima de citoplasma (Figura 2).
Nota: Durante este processo, oócitos costumam firmemente anexar para o fundo do prato ou Pipetar devido o meio sem BSA14. Dentro de 10 min, deve ser concluído o processo de Enucleação e oócitos sem núcleo precisam ser retornado para a incubadora. O número apropriado de oócitos que podem ser manipulados em uma enucleação é entre 10 e 20. Para lotes maiores de oócitos, o procedimento de Enucleação é repetido. - Confirmar a ausência de cromossomos no citoplasma sob luz visível (Figura 2, médio) e, em seguida, lave os oócitos sem núcleo em meio de mKSOM contendo 0,3% dBSA falta CB. Introduzir o prato para a incubadora a 37 ° C abaixo de 5% de CO2 até fusão celular.
Nota: Após Enucleação, o citoplasma retirado ooplasma contém os fusos e cromossomos.
6. a fusão de uma célula doadora e um ovócito sem núcleo
-
Preparação de HVJ-E
- Adicionar 260 µ l da solução de suspensão HVJ-E gelada para HVJ-E liofilizado (do kit, consulte a Tabela de materiais) e pipetar acima e para baixo até totalmente suspenso.
Nota: A quantidade adequada de liofilizado HVJ-E é preparada em uma garrafa, e solução de suspensão 260 µ l HVJ-E está incluído no kit. - Prepare 5 alíquotas µ l da solução HVJ-E e em seguida, armazenar a-80 ° C até a fusão celular.
Atenção: Trate cuidadosamente o HVJ-E no gelo, uma vez que é sensível à temperatura. Após a conclusão do experimento, apropriadamente autoclave HVJ-E materiais e recipientes para inativar completamente componentes do vírus.
- Adicionar 260 µ l da solução de suspensão HVJ-E gelada para HVJ-E liofilizado (do kit, consulte a Tabela de materiais) e pipetar acima e para baixo até totalmente suspenso.
-
Fusão celular
- Dilua a 5 µ l de solução de HVJ-E com 20 µ l de buffer de fusão celular, imediatamente antes do uso. Coloque a solução diluída de HVJ-E no gelo até o uso.
Nota: A reserva de fusão celular está incluída no kit HVJ-E. - Prepare a câmara de fusão celular, como mostrado na Figura 3A. Transferir os oócitos sem núcleo para meio de HCZB na câmara de fusão celular, usando a pipeta (diâmetro interno: 150 µm a 200 µm); lugar 4 µ l de cada solução (meio de HCZB, contendo 6% -BSA para as células do doador, solução HVJ-E, HCZB médio, 9% PVP no meio de HCZB) e cobrir a câmara, com cerca de 1 mL de óleo mineral.
Nota: O número apropriado de oócitos sem núcleo que são transferidas para a câmara para manipulação durante um processo de fusão de células é de 5 a 30. Para lotes maiores de oócitos, o processo de fusão celular é repetido. Em vez de câmara, uma prato de Petri 60mm tampa pode ser usada, se disponível. - Coloque os oócitos sem núcleo médio e HCZB sob um microscópio à temperatura de 400 X magnificationat. Aspirar as células do doador com a pipeta de micromanipulação (6-7 µm diâmetro interno extremidade plana dica) e expulsar células em solução de suspensão HVJ-E.
- Em seguida, Aspire células cumulus um por um com a solução de suspensão HVJ-E igualmente ser separados uns dos outros, permitindo a fusão celular serial. Manter os oócitos sem núcleo médio e HCZB usando uma pipeta de exploração. Perfure a zona pelúcida, com a pipeta de micromanipulação com o pulso de piezo (intensidade de 3-6, velocidade de 2-3).
- Depois de abrir o orifício na zona pelúcida, coloque uma célula cumulus firmemente para a membrana do oócito, juntamente com a solução de suspensão HVJ-E com um volume de 5 vezes o volume de uma célula de cumulus, sem atravessar a membrana do oócito.
Nota: Prepare dicas extremidade plana de 6-7 µm diâmetro interno de pipetas de micromanipulação para células do cumulus. Pipetas devem ser lavadas regularmente usando meio de PVP de 9% para a manutenção de liberação suave da célula. Etapas 6.2.3 - 6.2.5 devem ser terminadas dentro de 10 min, ou a eficiência de fusão celular será menor. Atividade de fusão da membrana do HVJ-E é inativada por autoclave, tratamento com detergente, ou etanol a 70%. Após a experiência, a solução HVJ-E deve ser devidamente eliminada. - Após a manipulação de fusão celular, prontamente transferência de oócitos para mKSOM médio contendo 0,3% dBSA e mover para uma incubadora a 37 ° C abaixo de 5% de CO2 por 1h.
- Dilua a 5 µ l de solução de HVJ-E com 20 µ l de buffer de fusão celular, imediatamente antes do uso. Coloque a solução diluída de HVJ-E no gelo até o uso.
7. a ativação dos oócitos reconstruídos e tratamento com tricostatina A e vitamina C
-
Preparação de TSA
- Dispense o TSA de 5 mM a solução em 3 alíquotas µ l e armazenar a solução a-20 ° C.
- Adicione 2,5 µ l de solução-mãe de TSA 5 mM a 1 mL de DMSO (uma concentração de 12,5 µM).
- Diluir 8 µ l de 12,5 µM TSA solução em 2 mL do meio de ativação e mKSOM médio (uma concentração final de 50 nM).
-
Preparação de CV
- Adicionar 1 mg de VC em 1 mL de água estéril livre de endotoxinas e armazenar a-20 ° C.
- Adicione a solução de estoque VC para mKSOM médio (uma concentração final de 10 µ g/mL).
-
Ativação de oócitos reconstruídos
- Uma hora após a fusão celular, verifique a condensação cromossomo prematuro (PCC) em oócitos reconstruídos (Figura 3B) usando um microscópio (400x).
- Transferir os oócitos reconstruídos para o meio de ativação (consulte a etapa 1.3) contendo TSA e incubar durante 6 h a 37 ° C abaixo de 5% de CO2 no ar (Figura 3). Observar a formação de pro-núcleos nos embriões TNCS e, em seguida, aplicar-se 2 horas a mais de tratamento TSA em mKSOM médio contendo 0,3% dBSA (Figura 2).
- Transferir os embriões tratados com TSA para mKSOM suplementado com VC e incubar durante 7 h, conforme mostrado na Figura 3D.
- Depois de 7 h de tratamento VC, transferir os embriões tratados com VC para mKSOM médio contendo 0,3% dBSA e incubar durante 4 dias a 37 ° C abaixo de 5% de CO2 no ar.
Nota: Para produzir ratos clonados, transferir embriões morfologicamente normal 2-célula de estágio para os ovidutos de camundongos fêmeas grávidos pseudo (MCH(ICR)) no dia quando um plugue vaginal é encontrado (dia 0,5 de pseudopregnancy)15. Depois de dias de 19,5, o número de locais de implantação e recém-nascidos é registado após cesariana.
Resultados
Para produzir embriões clonados do rato, foram usadas células do cumulus e células de fibroblasto fetal. O número de oócitos reconstruídos e desenvolvimento para a fase 2-célula após a ativação do ovócito é mostrado na tabela 1. Uma taxa muito elevada de formação pró-nuclear (89 a 100%) e desenvolvimento para a fase 2-célula (77 a 89%) foram observadas todas as condições. Alguns dos embriões clonados, que foram derivados de células do cumulus e desenvolvidos para o estágio de 2 células, foram transferidos para ovidutos de fêmeas grávidas pseudo. Seis filhotes clonados fora 72 embriões transferidos foram produzidos a partir de três fêmeas grávidas por tratamento serial da TSA e VC (Figura 4). Aproximadamente 15% dos embriões clonados têm sido relatados para desenvolver a termo, seguindo este TNCS procedimentos12. Além disso, a transferência de embriões clonados de 2 células em outras instituições tem alcançado a prole ao vivo de 9 a 15%, que representa o desenvolvimento melhor do que o único tratamento de TSA em embriões clonados. Além disso, o tratamento com TSA e VC melhorou significativamente a eficiência de em vitro desenvolvimento embrionário para a fase de blastocisto (tabela 2, P < 0.05, teste t de Student). Estes dados do desenvolvimento em vitro demonstram que o efeito positivo da TSA e VC é limitado pelo cepas de rato nem pelos tipos de células. Estes resultados sugerem que esse método de TNCS facilita a capacidade de desenvolvimento dos embriões clonados.

Figura 1: Preparação do dBSA.
Procedimentos passo a passo para preparar a solução de dBSA são retratados. A extensão da troca iônica pode ser julgada pela mudança da cor dos grânulos. Mostra a figura à esquerda superior a 1,2 g de BSA é dissolvido em 10 mL de água estéril à temperatura ambiente. Depois de BSA é dissolvido, os grânulos de resina de troca iônica são adicionados (superior direito). Quando a mistura da solução de BSA com grânulos de resina de troca iônica mudar cor de azul e verde ao ouro (inferior direito), substitua os grânulos frescos. A figura inferior esquerdo mostra que a cor dos grânulos permanece azul esverdeado e troca iónica é concluída. Clique aqui para ver uma versão maior desta figura.
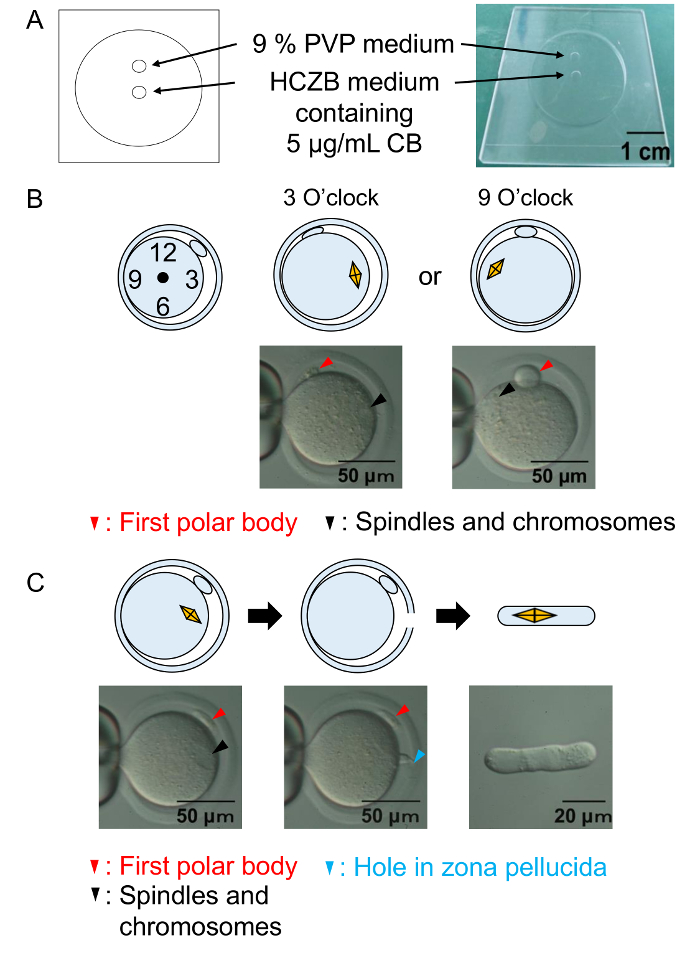
Figura 2: Procedimentos de enucleação.
(A) uma ilustração da câmara enucleação. Enucleação de ovócitos é realizada no meio de HCZB com CB. Para o sistema de condução de piezo, um ponto do meio PVP de 9% é usado para preparar a pipeta de vidro para enucleação. Pontos são cobertos por óleo mineral. (B) um diagrama e uma micrografia mostram a posição dos eixos e cromossomos antes de enucleação. Pontas de flechas de preto: os fusos e cromossomos. Pontas de seta vermelhas: o primeiro corpo polar. (C) um diagrama e uma micrografia mostrar Enucleação bem sucedida. Pontas de flechas de preto: os fusos e cromossomos. Seta vermelha: o primeiro corpo polar. Seta azul: o orifício na zona pelúcida. Clique aqui para ver uma versão maior desta figura.
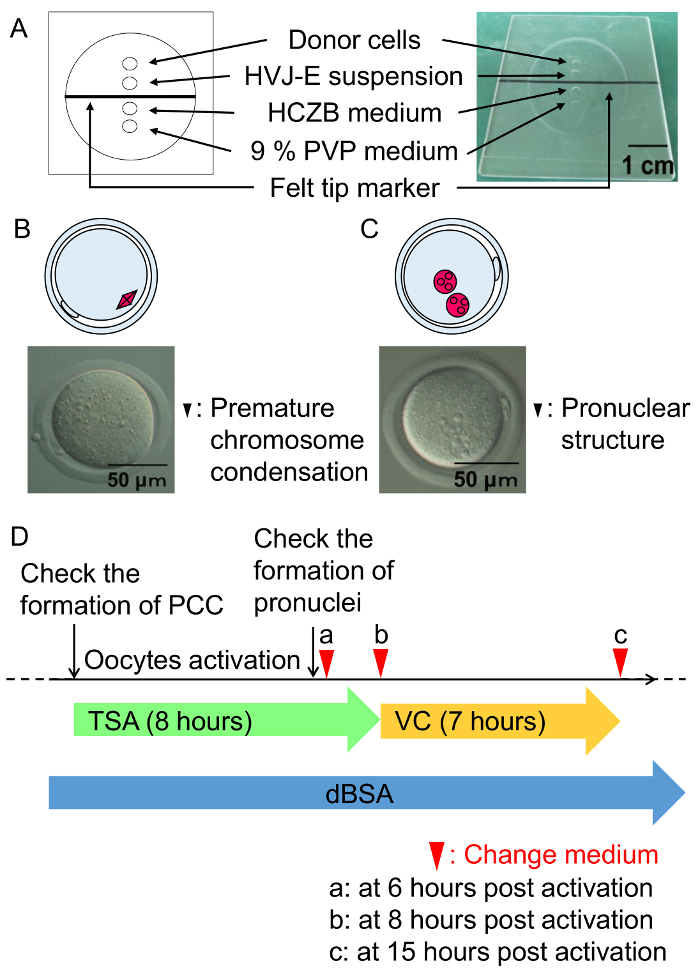
Figura 3: Procedimentos de fusão da pilha e cultura condição de embriões de TNCS.
(A) uma ilustração da câmara de fusão celular. Fusão celular é realizada no meio de HCZB, contendo 6% dBSA. Um ponto do meio PVP de 9% é usado para preparar a pipeta de vidro para fusão celular. Pontos são cobertos por óleo mineral. (B) um diagrama e uma micrografia da condensação cromossomo prematuro formaram uma hora após a fusão celular (seta preta). (C) um diagrama e uma micrografia da estrutura pró-nuclear formaram seis horas após a ativação (setas pretas). (D) o regime do TSA, VC e dBSA tratamento para embriões de TNCS. Arqueiro Verde representa tratamento com TSA, seguido de incubação com VC (seta amarela) sob mKSOM meio contendo com 0,3% dBSA (seta azul). Cabeças de seta para indicam o momento para mudar o meio. Clique aqui para ver uma versão maior desta figura.
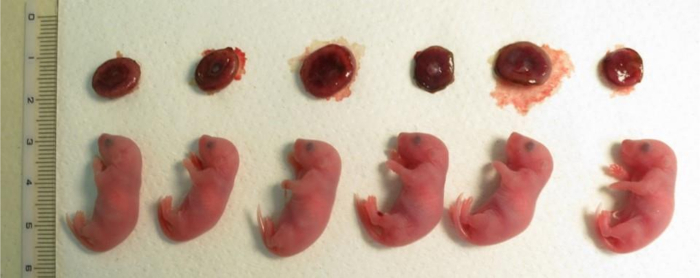
Figura 4: Prole clonado derivado de células cumulus logo após cesariana Depois de 19,5 dias de gravidez.
Há placentas na linha superior. A prole clonada mostrada aqui foram gerada em um experimento de transferência nuclear de três mães adotivas. O tamanho da placenta foi 1,5 a 2 vezes maior que o tamanho daqueles produzidos por fertilização in vitro . Clique aqui para ver uma versão maior desta figura.
| Grupo | Tipo de célula do doador | Cepa de rato | Não. de oócitos usados | Não. de oócitos fundidos | Não. de oócitos mostrando condensação cromossomo prematuro | Não. de oócitos mostrando formação pró-núcleos (%) | Não. de oócitos pronúcleos formados que desenvolveu a célula 2 embriões (%) | |
| TSA, VC | Cumulus | C57BL/6 × DBA/2 | 84 | 82 | 82 | 81 (99) | 72 (89) | |
| não tratada | Cumulus | C57BL/6 × DBA/2 | 84 | 82 | 82 | 82 (100) | 68 (83) | |
| TSA, VC | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 202 | 171 | 169 | 151 (89) | 124 (82) | |
| não tratada | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 201 | 171 | 147 | 142 (97) | 109 (77) | |
Tabela 1: efeitos do tratamento na TSA e VC o em vitro desenvolvimento de embriões clonados do mouse para o estágio de 2 células.
| Grupo | Tipo de célula do doador | Cepa de rato | Não. 2-célula embriões usados | Não. de 2-células embriões desenvolveram para cada fase (%) | |||
| 4 células | mórula | blastocisto | |||||
| TSA, VC | Cumulus | C57BL/6 × DBA/2 | 152 | 152 (100) | 149 (98) | 135 (89) um | |
| não tratada | Cumulus | C57BL/6 × DBA/2 | 83 | 47 (57) | 41 (49) | 32 (39) b | |
| TSA, VC | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 124 | 110 (89) | 101 (81) | 88 (71) c | |
| não tratada | fibroblasto fetal | MCH(ICR)×MCH(ICR) | 109 | 54 (50) | 45 (41) | 29 (27) d | |
| a-b, c-d Sobrescritos diferentes dentro das células de doador mesmo representam diferenças significativas (P < 0,05) | |||||||
Tabela 2: efeitos do tratamento na TSA e VC o em vitro desenvolvimento de embriões clonados do mouse para o estágio de blastocisto.
Discussão
Em conclusão, estes resultados sugerem que o método de TNCS apresentado poderia reduzir dificuldades técnicas e aumentar a eficiência das TNCS sem exigir modificações genéticas e suplementação de mRNA (tabela 1, tabela 2) e assegurar produção estável de embriões clonados. Este método nos permite reconstruir mais embriões TNCS que os métodos convencionais devido a melhor taxa de sobrevivência e protocolo simplificado. Neste protocolo, um passo crítico é fusão celular. Para produzir com sucesso ratos clonados, é vital para garantir que a quantidade apropriada de HVJ-E descrito no protocolo é mantida durante o processo de fusão celular e oócitos precisam ser devolvidos a incubadora dentro de 10 min, durante as etapas 6.2.3 - 6.2.5. Desde 20 a 30 células de doador podem ser aspiradas juntamente com HVJ-E em um momento da pipeta a manipulação, o número de oócitos obtidos por uma única operação é maior do que o método existente. No final, nós podemos produzir cerca de 20 a 30 oócitos re-construídos dentro de 10 min. Mesmo quando trabalhando com um grande lote de oócitos (100 ou mais), o processo de fusão celular deve demorar uma hora ou menos, repetindo as etapas 6.2.3 - 6.2.5. O método e as técnicas apresentadas aqui podem servir como protocolos eficientes com requisitos técnicos simplificados.
Neste momento, os mecanismos moleculares subjacentes ao desenvolvimento de embriões de TNCS são ainda pouco claras. Este método de TNCS melhorado também contribui para estudar os mecanismos de reprogramação, desde que esse método pode produzir muitos embriões clonados em apenas um experimento. Este método utiliza células somáticas com intactas as membranas celulares para fusão celular. Assim, pode ser possível aplicar esta abordagem a outras células, tais como a ponta de cauda células16,17das células de sertoli e pilhas de haste embrionária (ES)18. Quando os métodos convencionais de TNCS são usados para injetar células relativamente grandes, tais como células da cauda, diretamente para o citoplasma do oócito, torna-se ainda mais tecnicamente exigente obter embriões ao vivo. Além disso, relativamente difícil células, como células de sertoli, são difíceis de quebrar pipetando para injetar. Quando estes vários tipos de células são considerados, o método de fusão de células utilizando HVJ-E é simples e eficaz. Embora o valor e a segurança de HVJ-E têm sido demonstrado convincentemente19,20, pode ser importante para re-considerar a viabilidade de usando HVJ-E para a produção de animais clonados para fins agrícolas ou biomédicas.
Além disso, recentemente um grupo com sucesso produzidos camundongos clonados derivados de células de urina21. Para salvar as espécies de mamíferos ameaçadas de extinção, doravante TNCS usando as células coletadas de forma não-invasiva, como a célula de urina, será ideal. Mais recentemente, outro grupo tem gerado diretamente ratos clonados usando antígeno-específicos CD4+ T células22. Seria interessante examinar se este método também é aplicável para eficientemente clonar ratos de tais células. Além disso, A Latrunculin tem sido relatada como uma alternativa melhor para inibir a polimerização de actina durante Enucleação e ativação partenogenéticas de TNCS oócitos23. Estudos futuros podem revelar se o tratamento Latrunculin A, em vez de citocalasina B, melhora ainda mais a geração de prole clonado. Além disso, o tratamento de TSA tem sido usado com sucesso em ratos e porcos24coelhos25 , alterando a concentração, período e tempo de tratamento. Além disso, VC não só melhora o desenvolvimento embrionário em suínos TNCS10, mas também melhora a produção de células iPS em humanos e ratos26. Assim, é plausível especular que tratamento TSA e VC também pode ser aplicado a outras espécies de mamíferos, e talvez seja preciso otimizar o tempo de tratamento da TSA e VC para cada espécie.
Em conclusão, este método seria possível gerar camundongos clonados com nível prático de eficiência com procedimentos simples. Portanto, os resultados deste estudo podem nos levar a usar a tecnologia de TNCS para preservar os recursos genéticos de animais raros e para compreender os mecanismos moleculares da reprogramação nuclear e desenvolvimento embrionário inicial.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado por números de concessão JSPS KAKENHI JP15H06753, JP16H01321, JP16H01222, JP17H05045 de subsídio da Fundação K.M. Sumitomo para projetos de pesquisa de ciência básica (150810 para K.M.). Bolsa de investigação da Universidade de KINDAI (15-I-2 K.M. e M.A.). M.O. reconhece o suporte de núcleo fornecido pelo Cancer Research UK (C6946/A24843) e o Wellcome Trust (203144/Z/Z/16). Agradecemos a Sra. N. Backes-Kamimura e Sr. J. Horvat para a prova de leitura.
Materiais
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma-Aldrich, Co., Lcc. | 28-2270-5 | For medium |
| KCl | Wako Pure Chemical Industries, Ltd. | 169-03542 | For medium |
| KH2PO4 | Wako Pure Chemical Industries, Ltd. | 165-04242 | For medium |
| MgSO4 · 7H2O | Wako Pure Chemical Industries, Ltd. | 137-00402 | For medium |
| CaCl2 · 2H2O | Wako Pure Chemical Industries, Ltd. | 039-00431 | For medium |
| D(+)-Glucose | Wako Pure Chemical Industries, Ltd. | 041-00595 | For medium |
| Sodium Pyruvate | Wako Pure Chemical Industries, Ltd. | 199-03062 | For medium |
| L-Glutamine | Sigma-Aldrich, Co., Lcc. | G3126 | For medium |
| Polyvinylpyrrolidone | Wako Pure Chemical Industries, Ltd. | 168-17042 | For medium |
| NaHCO3 | Nacalai tesque, Inc. | 31213-15 | For medium |
| Sodium DL-Lactate | Nacalai tesque, Inc. | 31605-72 | For medium |
| Penicillin | Meiji Seika Pharma Co., Ltd. | 4987222637671 (GTIN-13) | For medium |
| Streptomycin | Meiji Seika Pharma Co., Ltd. | 4987222665643 (GTIN-13) | For medium |
| Sterile water, endotoxin free | Wako Pure Chemical Industries, Ltd. | 196-15645 | For medium |
| EDTA · 2Na | Dojindo Lab. | 345-01865 | For medium |
| Phenol red | Sigma-Aldrich, Co., Lcc. | P0290 | For medium |
| HEPES sodium salt | Sigma-Aldrich, Co., Lcc. | H3784 | For medium |
| Polyvinyl alcohol | Sigma-Aldrich, Co., Lcc. | P8136 | For medium |
| Bovine serum albumin | Sigma-Aldrich, Co., Lcc. | A3311 | For medium |
| BT AG 501-X8 (D) Resin | Bio-Rad Lab., Inc. | 143-7425 | For preparation of dBSA |
| Hyaluronidase | Sigma-Aldrich, Co., Lcc. | H3506 | For collection of oocytes and cumulus cells |
| Cytochalasin B | Wako Pure Chemical Industries, Ltd. | 034-17554 | For enucleation and oocytes activation |
| Piezo micro manipulator | Prime tech, Co., Ltd. | PMM-150FU | For micromanipulation |
| HVJ Envelope Cell Fusion Kit GenomONE-CF | Ishihara sangyo kaisha, Ltd. | CF001 | Containing 0.5 mL of HVJ-E suspension solution and 10 mL of cell fusion buffer for cell fusion |
| SrCl2 · 6H2O | Wako Pure Chemical Industries, Ltd. | 193-09442 | For oocytes activation |
| EGTA | Sigma-Aldrich, Co., Lcc. | E8145 | For oocytes activation |
| Dimethyl sulfoxide | Wako Pure Chemical Industries, Ltd. | 045-24511 | For solvent |
| Trichostatin A | Sigma-Aldrich, Co., Lcc. | T1952 | For incubating with SCNT embryos |
| L-Ascorbic acid | Sigma-Aldrich, Co., Lcc. | A5960 | For incubating with SCNT embryos |
| Mineral oil | Sigma-Aldrich, Co., Lcc. | M8410 | For covering medium |
Referências
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Kishigami, S., et al. Production of cloned mice by somatic cell nuclear transfer. Nat Protoc. 1 (1), 125-138 (2006).
- Ogura, A., Inoue, K., Takano, K., Wakayama, T., Yanagimachi, R. Birth of mice after nuclear transfer by electrofusion using tail tip cells. Mol Reprod Dev. 57 (1), 55-59 (2000).
- Ono, Y., Shimozawa, N., Ito, M., Kono, T. Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer. Biol Reprod. 64 (1), 44-50 (2001).
- Matoba, S., et al. Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation. Cell. 159 (4), 884-895 (2014).
- Kishigami, S., et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer. Biochem Biophys Res Commun. 340 (1), 183-189 (2006).
- Rybouchkin, A., Kato, Y., Tsunoda, Y. Role of histone acetylation in reprogramming of somatic nuclei following nuclear transfer. Biol Reprod. 74 (6), 1083-1089 (2006).
- Bui, H. T., et al. Effect of trichostatin A on chromatin remodeling, histone modifications, DNA replication, and transcriptional activity in cloned mouse embryos. Biol Reprod. 83 (3), 454-463 (2010).
- Chen, J., et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat Genet. 45, 34-42 (2013).
- Huang, Y., et al. Vitamin C enhances in vitro and in vivo development of porcine somatic cell nuclear transfer embryos. Biochem Biophys Res Commun. 411 (2), 397-401 (2011).
- Isaji, Y., Yoshida, K., Imai, H., Yamada, M. An intracytoplasmic injection of deionized bovine serum albumin immediately after somatic cell nuclear transfer enhances full-term development of cloned mouse embryos. J Reprod Dev. 61 (6), 503-510 (2015).
- Miyamoto, K., et al. Reprogramming towards totipotency is greatly facilitated by synergistic effects of small molecules. Biol Open. 6, 415-424 (2017).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the mouse embryo: A laboratory manual. , (2014).
- Nakagata, N., Okamoto, M., Ueda, O., Suzuki, H. Positive effect of partial zona-pellucida dissection on the in vitro fertilizing capacity of cryopreserved C57BL/6J transgenic mouse spermatozoa of low motility. Biol Reprod. 57 (5), 1050-1055 (1997).
- Hogan, B., Costantini, F., Lacy, E. . Manipulating the mouse embryo. , (1986).
- Wakayama, T., Yanagimachi, R. Cloning of male mice from adult tail-tip cells. Nat Genet. 22 (2), 127-128 (1999).
- Ogura, A., et al. Production of male cloned mice from fresh, cultured, and cryopreserved immature sertoli cells. Biol Reprod. 62 (6), 1579-1584 (2000).
- Wakayama, T., Rodriguez, I., Perry, A. C., Yanagimachi, R., Mombaerts, P. Mice cloned from embryonic stem cells. Proc Natl Acad Sci U S A. 96 (26), 14984-14989 (1999).
- Tachibana, M., et al. Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature. 461 (7262), 367-372 (2009).
- Yamada, M., et al. Human oocytes reprogram adult somatic nuclei of a type 1 diabetic to diploid pluripotent stem cells. Nature. 510 (7506), 533-536 (2014).
- Mizutani, E., et al. Generation of cloned mice and nuclear transfer embryonic stem cell lines from urine-derived cells. Sci Rep. 6, 1-8 (2016).
- Kaminuma, O., et al. Hyper-reactive cloned mice generated by direct nuclear transfer of antigen-specific CD4+ T cells. EMBO Rep. 18 (6), 885-893 (2017).
- Terashita, Y., et al. Latrunculin A can improve the birth rate of cloned mice and simplify the nuclear transfer protocol by gently inhibiting actin polymerization. Biol Reprod. 86 (6), 180 (2012).
- Zhao, J., et al. Histone deacetylase inhibitors improve in vitro and in vivo developmental competence of somatic cell nuclear transfer porcine embryos. Cell Reprogram. 12 (1), 75-83 (2010).
- Shi, L. H., et al. Trichostatin A (TSA) improves the development of rabbit-rabbit intraspecies cloned embryos, but not rabbit-human interspecies cloned embryos. Dev Dyn. 237 (3), 640-648 (2008).
- Esteban, M. A., et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells. Cell Stem Cell. 6 (1), 71-79 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados