Method Article
在体内果蝇蛹肌肌腱形态的影像学研究
摘要
在这里, 我们提出了一个简单易用和通用的方法来执行一般的发展过程和肌肉肌腱形态发生的活体成像, 特别是在生活的果蝇蛹。
摘要
肌肉连同肌腱和骨骼使包括人类在内的动物能够移动他们的身体部位。肌肉形态发生是高度保守的从动物到人类。因此, 强大的果蝇模型系统可以用来研究肌肉肌腱发展的概念, 也可以应用于人体肌肉生物学。在这里, 我们详细描述了成年肌肉肌腱系统的形态发生如何可以很容易地成像在生活中, 发展果蝇蛹。因此, 该方法允许调查蛋白质, 细胞和组织在他们的生理环境。除了一步一步的协议与有用的提示, 我们提供了一个全面的概述荧光标记标记蛋白, 适合研究肌肉肌腱系统。为了强调该协议的广泛应用, 我们展示了示例电影, 从长期的形态发生事件的可视化--在小时和天数的时间尺度上--到像肌肉抽搐这样的短期动态过程的可视化。发生在时间刻度上的秒数。在一起, 这项议定书应该使读者能够设计和执行活体成像实验, 以调查在完整的有机体的肌肉肌腱形态发生。
引言
肌肉肌腱装置允许包括人类在内的动物移动他们的身体部位。肌肉肌腱系统的分子积木是高度保守的。因此, 肌肉肌腱发育相关的概念, 如肌肉形态发生, 肌肉肌腱附着和纤维自组织, 可以研究使用果蝇作为一个容易接近模型系统。果蝇蛹系统具有若干实验优势。首先, 在蛹阶段--当成年肌肉形成时--有机体是无梗的, 因此在显微镜下很容易在数小时甚至数天内成像。第二, 许多肌肉形成足够近的蛹表面, 使他们可以在完整的, 部分半透明的生物体内成像。第三, 肌肉可以被调查在他们的自然环境, 在那里他们通过肌腱细胞连接到形成的外骨骼和组织紧张是建立起来的。这是不可能的在肌肉细胞培养系统。最后, 在果蝇中提供了大量的遗传工具。其中有许多荧光标记标记, 允许对特定的单元类型或亚细胞结构进行标记, 以便对在体内进行成像。
表 1总结了用于研究肌腱形态发生的最重要的标记。它包括标记表达使用 GAL4-UAS-system1和内标记的蛋白质标记2,3,4。GAL4-UAS-system 的优点是, 这些标记一般都是在高水平上表达的, 这就产生了一个很强的信号, 可以很容易地在整个安装的蛹中被成像。此外, 组织特异性可以通过选择 GAL4 司机仔细。在内源性控制下表达的融合蛋白的优势是, 可以对各自蛋白质的动力学进行研究在体内, 而它们也可以用作不同细胞类型或特定亚型结构的标记, 例如βPS-整合素-GFP 为肌肉附着部位。这些标记在实验设计和研究问题的选择上提供了很高的灵活性, 可以在现在和将来得到解决。
| 标签结构 | 标记 | 表达和本地化 | 类 | 股票编号 | 评论 | ref. | ||||||
| 肌肉 | Mef2-GAL4 | 所有的成肌细胞和所有阶段的肌肉 | GAL4 线 | BL 27390 | 5 | |||||||
| 1151-GAL4 | 成人肌肉前体和早期管直到≈24 h APF | GAL4 线, 增强器陷阱 | - | 6 | ||||||||
| Act79B-GAL4 | 跳跃肌肉在分化 | GAL4 线 | - | 7 | ||||||||
| Act88F-GAL4 | 间接飞行肌启动≈14 h 型 APF | GAL4 线 | - | 7 | ||||||||
| Act88F-Cameleon 3。1 | 间接飞行肌启动≈14 h 型 APF | Act88F 增强剂/启动子驱动 Cameleon 3。1 | - | Ca2 +指示器 | 8 | |||||||
| Act88F-GFP | 间接飞行肌启动≈14 h 型 APF | GFP-融合 (飞 TransgeneOme 线) | fTRG78 和 fTRG10028 | 4 | ||||||||
| 他-GFP | 成人肌肉前体, 核, 直到≈24 h APF 在间接飞行肌肉 | 增强剂/启动子-GFP 报告 | - | 1.5 kb 增强片段 | 9 | |||||||
| Mhc-头-GFP | DLM 模板中的微管和区分肌肉 | 增强剂/启动子与 Tau-GFP 报告 | BL 53739 | 10 | ||||||||
| βTub60D-GFP | 管中的微管 (例如, 在≈14的间接飞行肌肉中, ≈48 h 型 APF 后的强烈下降) | GFP-融合 (飞 TransgeneOme 线) | fTRG958 | 4 | ||||||||
| Mhc-GFP (weeP26) | 节 (粗丝) 在所有身体肌肉 (例如在间接飞行肌肉从≈30 h APF 开始) | GFP-陷阱 | - | 使用杂, 标签型子集 | 11 | |||||||
| Sls-GFP | 节 (Z 圆盘) 在所有身体肌肉 (例如在间接飞行肌肉从≈30 h APF 开始) | GFP-陷阱 (蝇线) | - | G53, 使用杂 | 2 | |||||||
| Zasp66-GFP | 所有身体肌肉的 Z 圆盘 | GFP-陷阱 (蝇线) | BL 6824 | ZCL0663 | 2,12 | |||||||
| Zasp52-GFP | 所有身体肌肉的 Z 圆盘 | GFP-陷阱 (蝇线) | BL 6838 | G00189 | 2,12 | |||||||
| 高温超导-GFP | 肌动蛋白结合;表达于上皮, 成肌细胞和管 | GFP-融合 (飞 TransgeneOme 线) | fTRG585 | 4 | ||||||||
| Dlg1-GFP | 各阶段肌肉的上皮细胞结、成肌和细胞膜 | GFP-融合 (飞 TransgeneOme 线) | fTRG502 | 4 | ||||||||
| 肌肉附着部位 | βPS-整合素-GFP | 肌肉附着部位 (例如, 在间接飞行肌肉中开始≈18 h AFP) | GFP-敲入 | - | 13 | |||||||
| 塔林-GFP 和-mCherry | 肌肉附着部位 (例如, 在间接飞行肌肉中开始≈18 h AFP) | GFP-陷阱 (模拟线) | - | 3 | ||||||||
| 塔林-GFP | 肌肉附着部位 (例如, 在间接飞行肌肉中开始≈18 h AFP) | GFP-融合 (飞 TransgeneOme 线) | fTRG587 | 4 | ||||||||
| 同类-GFP | 肌肉附着部位 (例如, 在间接飞行肌肉中开始≈18 h AFP) | GFP-陷阱 (蝇线) | 京都 110951 (ZCL3111) | ZCL3111, ZCL3192 | 2 | |||||||
| Vinc-GFP 和-RFP | 肌肉附着部位 (例如, 在间接飞行肌肉中开始≈18 h AFP) | GFP-融合 (转基因) | - | 13 | ||||||||
| 肌腱 | sr-GAL4 | 胸腱细胞, 贯穿蛹期 | GAL4 线, 增强器陷阱 | BL 26663 | 纯合致死 | 14 | ||||||
| 肌肉和肌腱 | Duf-GAL4 | 肌肉和上皮细胞, 早期发病 | GAL4 线 | BL 66682 | kirre-rP298, 方正细胞标记 | 15 | ||||||
| 记者 | 无人的-GFP-Gma | 肌动蛋白绑定 | 无人生产线 | BL 31776 | Moesin 融合到 GFP 的肌动蛋白结合域 | 16 | ||||||
| 无人mCherry-Gma | 肌动蛋白绑定 | 无人生产线 | - | 熔融 mCherry | 17 | |||||||
| 无人进行-Lifeact-GFP | 肌动蛋白绑定 | 无人生产线 | BL 35544 | 18 | ||||||||
| 无人Lifeact-Ruby | 肌动蛋白绑定 | 无人生产线 | BL 35545 | 18 | ||||||||
| 无人CD8-GFP | 膜结合 | 无人生产线 | 各种股票, 例如: BL 32184 | 19 | ||||||||
| 无人CD8-mCherry | 膜结合 | 无人生产线 | BL 27391 及27392 | 20 | ||||||||
| 无人mCherry-掌上电脑 | 膜结合 palmitoylation | 无人生产线 | BL 34514 | 无人brainbow | 21 | |||||||
表 1: 适于研究肌腱形态发生的荧光标记蛋白标记物在体内。
在这里, 我们详细地描述如何成像的肌肉肌腱形态发生在活蛹可以轻松和成功地执行 (图 1)。另外, 蛹可以固定, 解剖和 immunostained, 这使得使用抗体也标签蛋白质, 没有活的标记是可用的22。在这种情况下, 成像质量一般较高, 因为没有运动和结构的兴趣可以放置在接近接近片。然而, 解剖和固定可能导致损伤和分子或组织动力学, 例如, 肌肉抽搐, 只能在生物体内进行研究。
研究方案
1. 舞台蛹
- 设置一个十字架与 20-40 处女女性和大约20男性每瓶飞行食物 (图 1A)。另外, 如果股票将被使用, 每股翻转到新的瓶子。为了获得足够的蛹, 考虑每种基因都设置两瓶。
- 孵育瓶在25° c (或27° c 根据实验设计) 五到六天 (图 1B)。
注意: 每隔三天将苍蝇翻转一次, 以避免过度拥挤, 并保证蛹的持续供应。 - 使用湿刷子从瓶子的墙壁收集白色蛹并且转移他们到玻璃幻灯片 (图 1C)。时间的分期, 使蛹达到预期的年龄时, 启动活体成像显微镜下。
注意: 这些蛹看起来像老蛹的形状, 但它们仍然像幼虫一样洁白。在蛹形成 (0 h APF) 后, prepupal 阶段的起始被定义为0小时。 - 使用显微镜 (图 1D) 去除粘附在蛹上的苍蝇食物团簇, 用湿刷子将蛹的腹侧朝向玻璃滑动。丢弃仍在移动的蛹 (太年轻) 或开始变成褐色 (太旧)。这确保所有的蛹都具有相同的年龄 (0-1 h APF)。
- 用基因型、收集日期和时间标记幻灯片。将玻片移到一个培养皿中, 并加入一个湿纸巾, 防止蛹干燥 (图 1E)。
- 将蛹保存在25° c 或27° c 的孵卵器中, 直至达到预期的年龄。继续进行下一步1小时的成像之前, 使蛹有理想的年龄, 当启动实时成像 (步骤 3), 例如在 13 h APF 为电影显示在图 2A-d。
注意: 最早可行的起始时间点是在27° c 的 8-10 h APF 的蛹头外翻后。
2. 为影像准备蛹
- 确保蛹现在粘在玻璃滑梯上, 就像它们自然地粘在瓶子的墙壁上, 因为残留的苍蝇食物。不需要额外的胶水。如果蛹不粘得好, 因为高湿度, 打开培养皿几分钟, 让他们干。或者, 将它们转到玻璃幻灯片上的双面磁带上, 但通常不需要这样做。
-
打开窗口在蛹情况下为间接飞行肌肉的成像(图 1F;跳到2.3 部, 用于腹部肌肉成像。
- 将蛹粘在玻璃滑块上, 并将其置于显微镜下。调整缩放至2X。
- 使用生物级 #5 钳的一端, 轻轻地戳一个洞到蛹的情况下背部的翅膀, 腹部结束, 胸部开始。
- 切开蛹的情况下, 轻轻地将钳子移到胸腔的前端, 但避免损伤脆弱的机翼组织。
注意: 如果液体从蛹中漏出, 就会损坏;丢弃它, 重新开始与不同的蛹。 - 抬起蛹案件的部分以上的胸部与钳, 然后削减这部分罚款, 锋利的剪刀在背面中线的另一侧。
-
打开窗口蛹例腹部肌肉成像(图 1G)
- 将蛹贴在玻璃片上, 朝向显微镜下的研究员。调整缩放至2X。
- 使用生物级 #5 钳的一端, 轻轻地戳一个洞到蛹的情况下背部的翅膀, 胸部结束, 和腹部开始。
- 切开蛹的情况下, 轻轻地将钳子移向腹部的后端。
注意: 如果液体从蛹中漏出, 就会损坏;丢弃它, 重新开始与不同的蛹。 - 抬起蛹的情况下, 在腹部上方的钳, 然后削减这部分与罚款, 锋利的剪刀在背面中线的另一侧。
-
装入蛹(图 1H)
- 使用湿刷子转移多达五蛹到一个塑料幻灯片与凹槽 (定制, 可重复使用, 见讨论和材料清单)。根据凹槽的深度和蛹的厚度, 在两侧添加一个或两个间隔片。在每个间隔片下放一小滴水, 使其粘在幻灯片上, 并在每个边的凹槽和间隔片之间留一些空间。
注意: 间隔片也可以永久地连接到幻灯片与超级胶水, 提前。 - 对蛹进行定向, 以便在蛹的情况下, 使用刷子向上朝上。确保仔细定位蛹在正确的角度, 良好的成像质量。优化每个组织和发展时间点的角度。
注: 凹槽中的少量水分使蛹的定位更容易。用刷子沥干多余的水, 以免溺水。 - 在蛹上面片 (18 x 18 毫米) 而不接触它们。将小滴 (大约0.5 µL) 的50% 甘油溶液放在每个蛹的片上, 使用20µL 吸管打开。
注: 本程序确保液滴与蛹的间距相同。 - 将片翻转过来, 用手或用镊子 (标准 #5) 把它放在蛹的上方, 同时将片的一侧片在蛹旁边的间隔处。接下来, 轻轻地把片放到蛹上。确保蛹的开口正确地覆盖50% 甘油以获得良好的成像质量, 并防止蛹的干燥。
- 折叠一条胶带的一端, 并抓住它与钳 (标准 #5) 在这一端。轻轻地将胶带放在顶部片、间隔片 (s) 和塑料滑动的一侧。不要按下带子, 但。首先, 将幻灯片转到另一侧。
- 使用两个食指, 同时按下磁带两侧。此程序可确保蛹不移位。
- 检查蛹是否与片有很好的接触。为了获得最佳的成像质量, 蛹应在片下面轻轻地挤压。如有必要, 调整间隔片的数量。
- 通过在粘滞磁带上书写来标记幻灯片。
- 使用湿刷子转移多达五蛹到一个塑料幻灯片与凹槽 (定制, 可重复使用, 见讨论和材料清单)。根据凹槽的深度和蛹的厚度, 在两侧添加一个或两个间隔片。在每个间隔片下放一小滴水, 使其粘在幻灯片上, 并在每个边的凹槽和间隔片之间留一些空间。
3. 蛹的活体成像
- 安装方法允许对倒置显微镜 (图 1I) 和直立显微镜 (图 1J) 上的蛹进行成像。尤其适合实时成像的是扫描共焦显微镜、双光子显微镜和旋转圆盘共焦显微镜, 无论它们是倒置的还是直立的。对于长期电影, 使用温度控制阶段, 如果有的话。
- 使用眼睛和紫外线灯或透射光, 找到蛹和焦点内的蛹。
- 使用摄像头, 找到所需的结构, 并调整缩放级别。
- 对于长期电影, 定义一个 z 栈, 它包含了很好的结构 (例如, 间接的飞行肌肉, 它们的附着部位, 肌腱细胞或上述的组合), 并选择一个时间间隔。考虑为更好的图像质量做平均。对于高速, 短期电影, 选择一个单一的 z 平面, 以达到高帧率。
- 调整激光功率, 给出最好的信号, 但很少饱和。但是, 太高的激光功率会随着时间的推移而损伤蛹。
- 开始成像, 并返回不时检查电影和调整 z 堆栈定位, 如果必要的。

图 1: 工作流成像的肌肉肌腱形态发生在果蝇蛹.有关详细信息, 请参阅协议。请单击此处查看此图的较大版本.
结果
在开发蝇蛹时, 可以将各种组织成像成体内, 使其成为研究成体器官形态发生的理想模型体系。这些是间接飞行肌肉, 胸腔上皮包括肌腱细胞, 翼上皮, 腹部肌肉和心脏22,23,24,25,26,27. 在这里, 我们专注于肌肉和肌腱形态发生的活体成像。关于间接飞行肌肉和腹部肌肉形态发生的详细描述和其他方法研究肌肉生物学在果蝇, 我们参考读者到 Weitkunat 和 Schnorrer 201422。
间接飞行肌肉的实时成像
为了研究由 dorsolongitudinal 肌 (DLMs) 和 dorsoventral 肌 (DVMs) 组成的间接飞行肌肉的长期发展, 用 gfp 标记的球状 Moesin 肌动蛋白结合域 (无人机-gfp-Gma) 表示在所有肌肉使用肌细胞增强因子 2 (Mef2)-GAL4 驱动程序 (图 2AD,电影 S1)。在成像之前, 蛹机箱中的一个窗口在胸腔上方打开, 如图 1F所示。在双光子显微镜下, 在蛹形成 (11 h APF) 后, 从≈11 h 开始, z 栈每20分钟获得21小时。在此时间框架中, DLMs (图 2A"-d"中的绿色叠加) 首先启动对肌腱细胞的附着 (图 2A), 然后在肌肉附着成熟时分裂 (图 2B)。接下来, 管缩短 (图 2C), 直到它们最终达到 30 h APF (图 2D) 的最大压缩阶段。在一起, 这部电影突出了戏剧性的变化, 在时间尺度上发生的肌肉形态。

图 2: 间接飞行肌肉和肌腱形态发生的活体成像.(A-D)时间点从双光子电影 (电影 S1) 使用Mef2-GAL4, 无人机-GFP-Gma 作为一个标志肌动蛋白在间接飞行肌肉组成的 dorsolongitudinal 肌肉 (DLMs, 突出绿色在 "-d") 和 dorsoventral 肌肉 (DVMs, 以蓝色突出显示在 "-d" 中。刻度线为100µm. (E H)时间点从双光子电影 (电影 S2) 使用DufGAL4, 无人机-CD8-GFP 作为一个标志的间接飞行肌肉和胸部上皮包括肌腱细胞。面板 E ' H ' 显示一个覆盖与肌肉肌腱系统的模型在每个时间点, 突出的长细胞延长形成的肌腱上皮 (洋红) 与肌肉接触 (绿色)。刻度线是100µm (估计从成像结构的大小)。(升)时间点从双色, 旋转光盘共焦电影 (电影 S3) 专注于肌肉肌腱附着启动。肌腱细胞被标记为sr-GAL4, 无人机-棕榈 mCherry (洋红) 和 dorsolongitudinal 间接飞行肌肉与Mhc-头-GFP (绿色)。刻度线为10µm. 时间被表明作为 hh: 毫米在蛹形成以后 (有源 APF)。请注意, 并非所有的电影都是在一个温度控制的阶段获得的, 因此, 发展的时机可能会发散。请单击此处查看此图的较大版本.
为研究肌腱和肌肉形态发生的同时, 膜结合 GFP (无人机-CD8-GFP) 用目瞪口呆 (Duf)-GAL4 作为驱动, 这是表达在肌腱细胞和间接飞行肌肉 (图2E H, 影片 S2)。在双光子显微镜下, 每20分钟从 16 h 有源滤波器中取一个 z 栈, 20 小时。当管紧凑 (绿色叠加在图 2E"-h") 中, 肌腱细胞形成长的细胞扩展, 随时间延长 (红色覆盖在图 2E"-h")。两者结合在一起, 这部电影突出了肌腱和肌肉细胞在体内的密切相互作用。
为了更详细地研究肌肌腱的相互作用, 进行了双色、高倍率成像。蛹与肌球蛋白重链 (Mhc)-头-GFP 在 DLMs 和无人管理系统-palmitoylated-mCherry (无人使用-手掌-mCherry) 由条纹 (sr)-GAL4 的驱动, 每5分钟从 12 h APF 开始, 在旋转盘上进行4.5 小时的成像共焦显微镜 (图 2I-L, 电影 S3)。在 12 h APF, 管迁移到他们的肌腱靶细胞, 而形成长丝状在他们的提示 (图 2I)。随后, 肌肉和肌腱组织 interdigitate (图 2J, K) 形成一个稳定的附件。随着附件的成熟, 丝状的形式和肌肉肌腱接口平滑 (图 2L)。因此, 双色, 高倍率成像可以用来揭示细胞动力学细节在生物体。
腹部肌肉的活体成像
对于腹部肌肉的实时成像 (图 3, 电影 S4), Mef2-GAL4> 无人机 CD8-GFP 被用作标记, 在蛹情况下, 在图 1G中详细介绍了在腹部上方打开的窗口。类似于在图 2A-d中表示的间接飞行肌肉电影, 腹部肌肉的形成和生长可以在许多小时的发展中被遵循 (在电影 S4 中为 55 h)。在此期间, 成肌细胞融合形成生长的管 (图 3A)。myotube 提示迁移到他们的肌腱目标, 并在连接到肌腱细胞后, 肌肉的收缩单位, 节, 形成 (图 3B-d)。
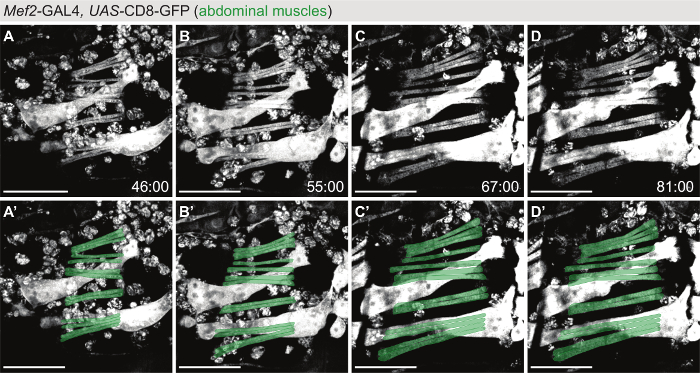
图 3: 腹部肌肉形态发生的活体成像.(A-D)时间点从电影 (电影 S4) 使用Mef2-GAL4, 无人机-CD8-GFP 作为一个标志, 以跟踪腹部肌肉形态发生。面板 A "-E" 显示覆盖与腹部肌肉集 (绿色) 的模型, 形成de 从头在蛹阶段。刻度线为100µm. 时间表示为 hh: mm APF。这部电影是在室温下获得的。请单击此处查看此图的较大版本.
抽动肌肉的活体成像
与图 2和图 3不同,图 4显示了在秒时间刻度上发生的肌肉动态: 肌肉收缩的实时记录。在共聚焦显微镜 (电影 S5) 中, 在单 z 平面上以 0.65 s 的时间分辨率对表达βPS-整合素-GFP 的蛹进行了成像。在图 4中显示的示例中, 三 DVMs (图 4A) 的附件站点被映像为10分钟, 从 42 h APF 开始。在此期间, 观察到五抽搐事件 (图 4B-f), 表明节已经装配好, 可以在此时的发展阶段支持协调收缩。因此, 肌肉抽搐成像可以作为一个功能性的读出 sarcomerogenesis 已经在间接飞行肌肉开发28, 而不是例如飞行测试, 只能执行后, 羽化。
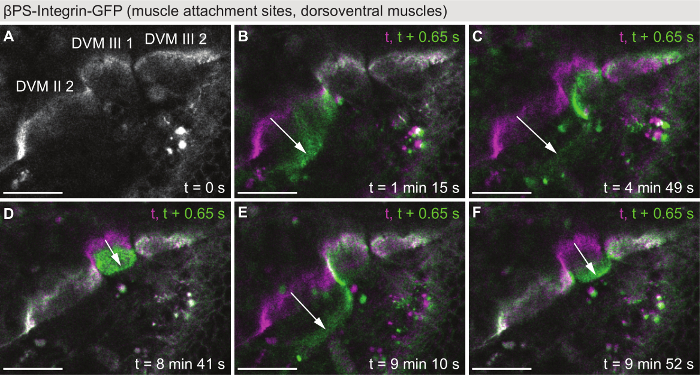
图 4: 抽动肌肉的实时成像。(a)第一次从电影 (电影 S5), 显示抽搐的 dorsoventral 间接飞行肌肉在 42 h APF 使用βPS-整合素-GFP 作为标记。在视野中的肌肉附着部位的 DVM II 2, DVM iii 1 和 DVM iii 2。(B-f)颜色覆盖五个别抽搐事件, 每一个显示帧前的抽搐 (洋红) 和第一帧的抽搐事件 (绿色)。注意个别肌纤维相互独立地抽动。箭头突出的抽搐运动。电影的时间分辨率是0.65 秒. 刻度线为25µm.请单击此处查看此图的较大版本.
内标记蛋白的实时成像
类似于βPS-整合素-GFP, 在内源控制下的果蝇中表达的大量融合蛋白的集合已经生成234。这些飞行线可以用来研究例如亚细胞定位或蛋白质表达谱的兴趣。该集合是特别有用的, 如果没有特定的抗体或蛋白质动力学需要研究的在体内没有固定。图 5显示了三 TransgeneOme (fTRG) 库中内表达的融合蛋白的示例, 胡力大勺 (高温超导)-gfp (图 5A, B), 塔林-gfp (图 5C, D) 和βTubulin60D-gfp (图 5E, F)。这些蛋白质的表达可以在所有自然表达的组织中进行研究。在这里, 我们显示胸腔上皮 (图 5A, C, E) 和间接飞行肌肉或他们的附件站点 (图 5B, D, F) 作为例子。
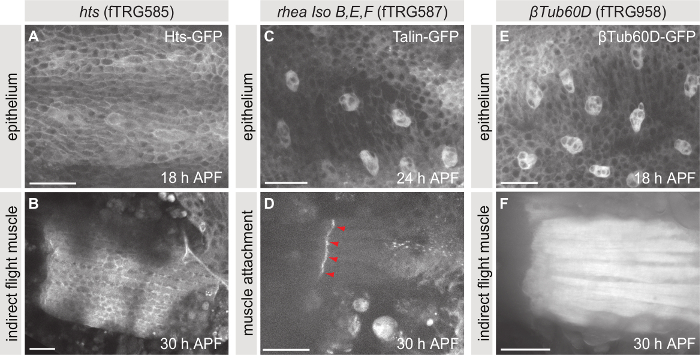
图 5: 内标记蛋白质的实时成像。(a、B)对表示高温-GFP 的蛹所采取的 z 栈的最大投影。(C, D)用塔林-GFP 表达的蛹的 z 栈的最大投影。(E, F)用βTubulin60D-GFP 表达的蛹的 z 栈的最大投影。小组 A, C 和 E 显示胸部上皮在 18, 24 和 18 h apf, 分别和小组 B, D 和 F 显示间接飞行肌肉或他们的附件站点在 30 h apf。刻度线为25µm.请单击此处查看此图的较大版本.
讨论
该协议描述了如何使用各种荧光标记蛋白质在活着的果蝇蛹中成像肌肉肌腱形态发生。这种体内成像策略可以用于研究整个生物体的自然环境中的发育过程。
对于一个成功的实验来说, 找到正确的发展时间点进行分析是至关重要的。例如, dorsolongitudinal 间接飞行肌肉启动附着在≈16 h apf23的肌腱目标, 而腹部肌肉发展后, 只在两端连接30和 40 h 有 apf 的26。因此, 以前发表的文献应该被用来找到正确的时间点的发展分析, 或者, 如果组织或结构的利益没有被详细研究之前, 整体发展必须首先特征。
在定制的塑料幻灯片上成功安装蛹, 重要的是沟槽有合适的尺寸: 凹槽需要 1.0-1.5 毫米宽, 0.3-0.4 毫米深。此深度允许根据需要将间隔片的精确距离调整到顶片。然而, 至少有一个间隔片应用于避免将50% 甘油从样品中排出毛细管力。正确定位的蛹在凹槽需要一些经验, 并应优化, 使结构的兴趣是尽可能接近片。
如果有大量的蛹被认为是在一个显微镜会议上成像, 它们都可以预先安装, 然后储存在一个孵化器, 直到成像, 以确保适当的发展时间。蛹应生存的整个过程, 也至少尝试 eclose, 如果保持在幻灯片后, 成像。生存率可以作为一个读数, 以检查是否成像条件损害蛹。
应根据实验要求仔细选择成像设置。对于短期电影, 高帧率与高信噪比需要平衡, 而相对较高的激光功率可以使用, 而不损害蛹太多。然而, 对于长期的电影, 激光功率必须保持在一个适度的水平和蛹不应该连续成像, 而是在某些时间点, 例如, 每20分钟。为了确保结构的利益不移出视野, 可能有必要重新调整的位置 z 栈之间的时间点。就我们所知, 蛹案本身的开放并不影响发展的时机。然而, 一个温度控制阶段应用于长期电影, 以确保适当的发展时间。考虑到这些因素, 可以获得高信息量的电影。
所提出的协议不仅可用于可视化肌肉肌腱形态发生, 也可用于其他发育组织, 例如翼上皮细胞29。只需要对本协议进行三项修改: (1) 在机翼上方而不是胸腔或腹部的蛹情况下打开, (2) 蛹与机翼朝向顶部片的位置, (3) 使用不同的荧光标记蛋白。随着 CRISPR/Cas9-technology 的进步, 越来越多的内标记荧光蛋白将可用, 因为它已经变得更直接的目标内源基因座在果蝇30,31,32. 在未来, 这将允许详细阐明许多蛋白质、细胞和整个组织在他们的生理环境中的动态。
披露声明
作者没有什么可透露的。
致谢
我们感谢马诺拉 Weitkunat 对电影 S3 的收购。我们感谢哈德 Fässler 的慷慨支持。这项工作得到了 EMBO 青年调查员方案 (傅), 欧洲研究理事会根据欧洲联盟的第七框架方案 (FP/2007-2013)/紧急救济会赠款 310939 (傅), 马克斯·普朗克协会 (S.B.L., 傅), 中心国家 de la研究科学研究 (CNRS) (傅), 卓越倡议 Aix-马赛大学 AMIDEX (傅), LabEX-通知 (傅) 和勃林格殷格翰全 (S.B.L.)。
材料
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Leica | MZ6 | product has been replaced by Leica M60 |
| fly food in bottles (or vials) | - | - | standard culture medium |
| paint brush | da Vinci | 1526Y | size 1 |
| microscope slides | Thermo Scientific | VWR: 631-1303 | 76 x 26 mm |
| double-sided tape (optional) | Scotch | 6651263 | 12 mm x 6.3 m |
| petri dishes | Greiner Bio-One | 632102 | 94 x 16 mm |
| paper tissues | Th.Geyer | 7695251 | |
| forceps #5 (Dumont, inox, standard) | Fine Science Tools | 11251-20 | 0.1 mm x 0.06 mm tip |
| forceps #5 (Dumont, inox, biology grade) | Fine Science Tools | 11252-20 | 0.05 mm x 0.02 mm tip |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | straight tip |
| plastic slides with a groove (reusable) | custom-built | - | 75 x 26 x 4 mm plexi glass slide with 1.0-1.5 mm wide and 0.3-0.4 mm deep groove |
| coverslips | Marienfeld | 107032 | 18 x 18 mm, No. 1.5H |
| glycerol | Sigma-Aldrich | 49781 | dilute to 50 % in water |
| adhesive tape | Tesa | 57370-02 | 1.5 mm x 10 m |
参考文献
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. P. Natl. Acad. Sci. USA. 98 (26), 15050-15055 (2001).
- Venken, K. J. T., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat. Meth. 8 (9), 737-743 (2011).
- Sarov, M., et al. A genome-wide resource for the analysis of protein localisation in Drosophila. eLife. 5, e12068 (2016).
- Ranganayakulu, G., Schulz, R. A., Olson, E. N. Wingless signaling induces nautilus expression in the ventral mesoderm of the Drosophila embryo. Dev. Biol. 176 (1), 143-148 (1996).
- Roy, S., Raghavan, K. V. Homeotic genes and the regulation of myoblast migration, fusion, and fibre-specific gene expression during adult myogenesis in Drosophila. Development. 124 (17), 3333-3341 (1997).
- Bryantsev, A. L., Baker, P. W., Lovato, T. L., Jaramillo, M. S., Cripps, R. M. Differential requirements for Myocyte Enhancer Factor-2 during adult myogenesis in Drosophila. Dev. Biol. 361 (2), 191-207 (2012).
- Gordon, S., Dickinson, M. H. Role of calcium in the regulation of mechanical power in insect flight. P. Natl. Acad. Sci. USA. 103 (11), 4311-4315 (2006).
- Jin, H., et al. Genome-Wide Screens for In Vivo Tinman Binding Sites Identify Cardiac Enhancers with Diverse Functional Architectures. PLoS Genet. 9 (1), e1003195 (2013).
- Chen, E. H., Olson, E. N. Antisocial, an intracellular adaptor protein, is required for myoblast fusion in Drosophila. Dev. Cell. 1 (5), 705-715 (2001).
- Clyne, P. J., Brotman, J. S., Sweeney, S. T., Davis, G. Green Fluorescent Protein Tagging Drosophila Proteins at Their Native Genomic Loci With Small P Elements. Genetics. 165 (3), 1433-1441 (2003).
- Katzemich, A., Liao, K. A., Czerniecki, S., Schöck, F. Alp/Enigma Family Proteins Cooperate in Z-Disc Formation and Myofibril Assembly. PLoS Genet. 9 (3), e1003342 (2013).
- Klapholz, B., et al. Alternative mechanisms for talin to mediate integrin function. Curr. Biol. 25 (7), 847-857 (2015).
- Schnorrer, F., Kalchhauser, I., Dickson, B. J. The transmembrane protein Kon-tiki couples to Dgrip to mediate myotube targeting in Drosophila. Dev. Cell. 12 (5), 751-766 (2007).
- Menon, S. D., Chia, W. Drosophila rolling pebbles: a multidomain protein required for myoblast fusion that recruits D-Titin in response to the myoblast attractant Dumbfounded. Dev. Cell. 1 (5), 691-703 (2001).
- Bloor, J. W., Kiehart, D. P. zipper Nonmuscle myosin-II functions downstream of PS2 integrin in Drosophila myogenesis and is necessary for myofibril formation. Dev. Biol. 239 (2), 215-228 (2001).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135 (4), 621-626 (2008).
- Hatan, M., Shinder, V., Israeli, D., Schnorrer, F., Volk, T. The Drosophila blood brain barrier is maintained by GPCR-dependent dynamic actin structures. J. Cell Biol. 192 (2), 307-319 (2011).
- Lee, T., Luo, L. Mosaic Analysis with a Repressible Cell Marker for Studies of Gene Function in Neuronal Morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Roy, S., Huang, H., Liu, S., Kornberg, T. B. Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science. 343 (6173), 1244624 (2014).
- Förster, D., Luschnig, S. Src42A-dependent polarized cell shape changes mediate epithelial tube elongation in Drosophila. Nat. Cell Biol. 14 (5), 526-534 (2012).
- Weitkunat, M., Schnorrer, F. A guide to study Drosophila muscle biology. Methods. 68 (1), 2-14 (2014).
- Weitkunat, M., Kaya-Çopur, A., Grill, S. W., Schnorrer, F. Tension and force-resistant attachment are essential for myofibrillogenesis in Drosophila flight muscle. Curr. Biol. 24 (7), 705-716 (2014).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. eLife. 4, e08519 (2015).
- Etournay, R., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Weitkunat, M., Brasse, M., Bausch, A. R., Schnorrer, F. Mechanical tension and spontaneous muscle twitching precede the formation of cross-striated muscle in vivo. Development. 144 (7), 1261-1272 (2017).
- Sellin, J., Albrecht, S., Kölsch, V., Paululat, A. Dynamics of heart differentiation, visualized utilizing heart enhancer elements of the Drosophila melanogaster bHLH transcription factor Hand. Gene Expr. Patterns. 6 (4), 360-375 (2006).
- Lemke, S. B., Schnorrer, F. Mechanical forces during muscle development. Mech. Develop. 144 (Pt A), 92-101 (2017).
- Classen, A. -. K., Aigouy, B., Giangrande, A., Eaton, S. Imaging Drosophila pupal wing morphogenesis. Methods Mol. Biol. 420, 265-275 (2008).
- Gratz, S. J., et al. Genome engineering of Drosophila with the CRISPR RNA-guided Cas9 nuclease. Genetics. 194 (4), 1029-1035 (2013).
- Zhang, X., Koolhaas, W. H., Schnorrer, F. A versatile two-step CRISPR- and RMCE-based strategy for efficient genome engineering in Drosophila. G3. 4 (12), 2409-2418 (2014).
- Port, F., Chen, H. -. M., Lee, T., Bullock, S. L. Optimized CRISPR/Cas tools for efficient germline and somatic genome engineering in Drosophila. P. Natl. Acad. Sci. USA. 111 (29), E2967-E2976 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。