Method Article
Na Vivo Imagem latente da morfogênese músculo-tendão em pupas de Drosophila
Neste Artigo
Resumo
Aqui, apresentamos um método fácil de usar e versátil para executar ao vivo de imagens de processos de desenvolvimento em geral e músculo-tendão morfogênese em particular na vida pupas de Drosophila .
Resumo
Músculos, juntamente com os tendões e o esqueleto permitem animais incluindo os seres humanos para mover partes do corpo. Morfogênese de músculo é altamente conservado de animais para os seres humanos. Portanto, o poderoso sistema de Drosophila modelo pode ser usado para estudar os conceitos de desenvolvimento de músculo-tendão que também pode ser aplicado a biologia do músculo humano. Aqui, descrevemos em detalhe como morfogênese do sistema músculo-tendão adulto pode facilmente ser fotografada em vida, desenvolvimento de pupas de Drosophila . Portanto, o método permite investigar proteínas, células e tecidos em seu ambiente fisiológico. Além de um protocolo passo a passo com dicas úteis, nós fornecemos uma visão abrangente das proteínas marcador fluorescente etiquetado que são apropriados para estudar o sistema músculo-tendão. Para destacar as aplicações versáteis do protocolo, mostramos filmes exemplo variando de visualização de eventos morfogenéticas a longo prazo – ocorrendo na escala de tempo de horas e dias – para visualização de processos dinâmicos a curto prazo como contracções musculares ocorrendo em escala de tempo de segundos. Tomados em conjunto, o presente protocolo deverá permitir o leitor a projetar e executar experimentos de geração de imagens ao vivo para investigar morfogênese músculo-tendão no organismo intacto.
Introdução
O aparelho músculo-tendão permite animais incluindo os seres humanos para mover partes do corpo. Os blocos de construção moleculares do sistema músculo-tendão são altamente conservados. Portanto, conceitos de desenvolvimento do músculo-tendão relevante para a biologia do músculo humano, por exemplo morfogênese de músculo, acessório do músculo-tendão e auto-organização Miofibrilha, podem ser estudados usando Drosophila melanogaster como um facilmente acessíveis modelo do sistema. O sistema de pupa de Drosophila tem várias vantagens experimentais. Em primeiro lugar, na fase de pupa – quando são formados os músculos adultos – o organismo é séssil e, portanto, fácil para a imagem em um microscópio durante um período de horas ou mesmo dias. Em segundo lugar, muitos forma músculos perto debaixo da superfície pupal para que eles podem ser fotografados dentro do organismo intacto, parcialmente translúcido. Em terceiro lugar, os músculos podem ser investigados em seu ambiente natural, onde eles estão conectados para o exoesqueleto formando através de células de tendão e tensão do tecido é acumulado. Isto não é possível em sistemas de cultura de células de músculo. E, finalmente, uma infinidade de ferramentas genéticas está disponível em Drosophila. Entre estes estão muitos marcadores de fluorescente etiquetados que permitam a rotulagem dos tipos de células específicas ou estruturas subcelulares para imagem latente na vivo.
A tabela 1 resume os marcadores mais importantes para estudar a morfogênese músculo-tendão. Isso inclui marcadores overexpressed usando o GAL4-UAS-sistema1 e endogenamente a tag proteína marcadores2,3,4. A vantagem do GAL4-UAS-sistema é que os marcadores são geralmente expressas em níveis elevados, resultando em um sinal forte que pode facilmente ser fotografado em pupas de toda a montagem. Além disso, especificidade de tecido é possível escolhendo drivers de GAL4 cuidadosamente. A vantagem das proteínas de fusão expressado sob controle endógeno é que a dinâmica das respectivas proteínas pode ser estudadas na vivo, enquanto eles também podem ser usados como marcadores para diferentes tipos de células ou estruturas subcelulares específicas, por exemplo, ΒPS-integrina-GFP para sites de fixação muscular. Juntos, estes marcadores fornecem alta flexibilidade no delineamento experimental e a escolha de problemas de pesquisa que pode ser resolvido agora e no futuro.
| Rotulado de estrutura | Marcador | Expressão e localização | Classe | Número conservado em estoque | Comentário | Ref. | ||||||
| Músculo | Mef2-GAL4 | todos os mioblastos e todos os músculos em todas as fases | Linha GAL4 | BL 27390 | 5 | |||||||
| 1151-GAL4 | precursores de músculo adulto e myotubes início até ≈24 h APF | Linha de GAL4, armadilha potenciador | - | 6 | ||||||||
| Act79B-GAL4 | saltar o músculo sobre diferenciação | Linha GAL4 | - | 7 | ||||||||
| Act88F-GAL4 | músculos de voo indirecto começando ≈14 h APF | Linha GAL4 | - | 7 | ||||||||
| Act88F- Cameleon 3.1 | músculos de voo indirecto começando ≈14 h APF | Potenciador de Act88F / promotor condução 3.1 Cameleon | - | Indicador de CA2 + | 8 | |||||||
| Act88F-GFP | músculos de voo indirecto começando ≈14 h APF | GFP-fusão (mosca TransgeneOme linha) | fTRG78 e fTRG10028 | 4 | ||||||||
| Ele- nls-GFP | precursores de músculo adulto, nucleares, até ≈24 h APF nos músculos de voo indirecto | potenciador/promotor com repórter nls-GFP | - | fragmento de potenciador de 1,5 kb | 9 | |||||||
| MHC-Tau-GFP | microtúbulos em modelos DLM e em diferenciar os músculos | potenciador/promotor com repórter Tau-GFP | BL 53739 | 10 | ||||||||
| ΒTub60D-GFP | microtúbulos em myotubes (por exemplo, nos músculos de voo indirecto de h ≈14 AFP, diminuindo fortemente após ≈48 h APF) | GFP-fusão (mosca TransgeneOme linha) | fTRG958 | 4 | ||||||||
| MHC-GFP (weeP26) | sarcômeros (filamento grosso) em todos os músculos do corpo (por exemplo, nos músculos de voo indirecta a partir ≈30 h APF) | GFP-armadilha | - | Use heterozigotos, rotula um subconjunto de isoforma | 11 | |||||||
| SLS-GFP | sarcômeros (Z-disco) em todos os músculos do corpo (por exemplo, nos músculos de voo indirecta a partir ≈30 h APF) | GFP-armadilha (linha FlyTrap) | - | G53, uso heterozigoto | 2 | |||||||
| Zasp66-GFP | Z-disco em todos os músculos do corpo | GFP-armadilha (linha FlyTrap) | BL 6824 | ZCL0663 | 2 , 12 | |||||||
| Zasp52-GFP | Z-disco em todos os músculos do corpo | GFP-armadilha (linha FlyTrap) | BL 6838 | G00189 | 2 , 12 | |||||||
| HTS-GFP | ligação da actina; expressa no epitélio, mioblastos e myotubes | GFP-fusão (mosca TransgeneOme linha) | fTRG585 | 4 | ||||||||
| Dlg1-GFP | junções célula epitelial, mioblastos e membranas nos músculos em todas as fases | GFP-fusão (mosca TransgeneOme linha) | fTRG502 | 4 | ||||||||
| Local de fixação do músculo | ΒPS-integrina-GFP | sites de fixação muscular (por exemplo, partida ≈18 h AFP nos músculos de voo indirecto) | GFP-batida-em | - | 13 | |||||||
| Talin-GFP e - mCherry | sites de fixação muscular (por exemplo, partida ≈18 h AFP nos músculos de voo indirecto) | GFP-armadilha (linha MiMIC) | - | 3 | ||||||||
| Talin-GFP | sites de fixação muscular (por exemplo, partida ≈18 h AFP nos músculos de voo indirecto) | GFP-fusão (mosca TransgeneOme linha) | fTRG587 | 4 | ||||||||
| Laia-GFP | sites de fixação muscular (por exemplo, partida ≈18 h AFP nos músculos de voo indirecto) | GFP-armadilha (linha FlyTrap) | Kyoto 110951 (ZCL3111) | ZCL3111, ZCL3192 | 2 | |||||||
| Vinc-GFP e - RFP | sites de fixação muscular (por exemplo, partida ≈18 h AFP nos músculos de voo indirecto) | GFP-fusão (transgene) | - | 13 | ||||||||
| Tendão | Sr-GAL4 | células de tendão do tórax, durante a fase de pupa | Linha de GAL4, armadilha potenciador | BL 26663 | homozigótica letal | 14 | ||||||
| Músculos e tendões | Duf-GAL4 | músculos e epitélios, início precoce | Linha GAL4 | BL 66682 | kirre-rP298, marcador de célula do fundador | 15 | ||||||
| UAS-repórteres | UAS- GFP-Gma | emperramento do actínio | Linha UAS | BL 31776 | domínio de ligação de actina de Moesin fundido a GFP | 16 | ||||||
| UAS- mCherry-Gma | emperramento do actínio | Linha UAS | - | GMA fundidos para mCherry | 17 | |||||||
| UAS- Lifeact-GFP | emperramento do actínio | Linha UAS | BL 35544 | 18 | ||||||||
| UAS- Lifeact-Ruby | emperramento do actínio | Linha UAS | BL 35545 | 18 | ||||||||
| UAS-CD8-GFP | vinculação de membrana | Linha UAS | várias acções, por exemplo: BL 32184 | 19 | ||||||||
| UAS-CD8-mCherry | vinculação de membrana | Linha UAS | BL 27391 e 27392 | 20 | ||||||||
| UAS-Palma-mCherry | ligação de membrana através de palmitoylation | Linha UAS | BL 34514 | UAS- brainbow | 21 | |||||||
Tabela 1: Fluorescente etiquetado marcadores de proteína adequadas para estudar músculo-tendão morfogênese na vivo.
Aqui, descrevemos em detalhe como imagem da morfogênese músculo-tendão em pupas de vida pode ser realizada facilmente e com sucesso (Figura 1). Alternativamente, podem ser corrigidas pupas, dissecados e immunostained, que permite o uso de anticorpos para rotular também proteínas, para o qual não vivo marcadores estão disponíveis22. Neste caso, a qualidade de imagem é geralmente maior, porque não há nenhum movimento e a estrutura de interesse pode ser colocada em estreita proximidade com a lamela. No entanto, dissecção e fixação podem levar a danos e molecular ou dinâmica de tecido, por exemplo, músculo tremer, só pode ser estudada em organismo vivo.
Protocolo
1. fase pupas
- Configure um cruzamento com fêmeas virgens de 20-40 e cerca de 20 machos por garrafa de comida de mosca (figura 1A). Alternativamente, se os estoques serão usados, flip cada estoque em odres novos. Para obter suficiente pupas, considere a criação duas garrafas por genótipo.
- Incube as garrafas a 25 ° C (ou 27 ° C, de acordo com o projeto experimental) por cinco a seis dias (figura 1B).
Nota: Manter invertendo as moscas a cada dois ou três dias para evitar superlotação e para garantir um fornecimento contínuo de pupas. - Use um pincel molhado para coletar pré-pupa branca das paredes das garrafas e transferi-los para as lâminas de vidro (Figura 1). A encenação o tempo tal que as pupas alcançar o desejado idade quando começar ao vivo de imagens sob o microscópio.
Nota: Estes pré-pupa parece mais velhas pupas em termos de sua forma, mas eles são ainda brancos como larvas. O início da fase de prepupal é definido como 0 h depois da formação do casulo (0 h APF). - Remover grupos de mosca alimento grudar as pupas com um pincel molhado e orientar o lado ventral das pupas em direção a lâmina de vidro usando um microscópio (Figura 1). Descarte de pupas que ainda estão se movendo (muito jovem) ou que começaram a virar marrom (muito velho). Isso garante que todas as pupas têm a mesma idade (0 - 1 h APF).
- Rotule os slides com genótipo, data e hora da coleta. Transferir as lâminas de vidro para uma placa de Petri cada e adicionar um lenço molhado para evitar que as pupas de secar (Figura 1E).
- Armazene as pupas na incubadora a 25 ° C ou 27 ° C, até que eles atinjam a idade desejada. Continuar com os próximos passos 1 h antes de imagem, para que as pupas têm o desejado idade quando começar a imagem ao vivo (etapa 3), por exemplo, às 13h APF para o filme mostrado na Figura 2A-D.
Nota: O mais antigo viável tempo ponto de partida é depois da cabeça-eversão das pupas ocorrem em 8-10 h APF a 27 ° C.
2. prepare pupas para a imagem latente
- Certifique-se de que as pupas agora manter a lâmina de vidro assim como naturalmente furam às paredes das garrafas por causa da comida de mosca residual. Não cola extra é necessária. Se as pupas não fica bem o suficiente por causa da alta umidade, abra a caixa de Petri para alguns min para deixá-los secar. Alternativamente, transferi-los para a fita dupla-face sobre uma lâmina de vidro, mas geralmente, isso não é necessário.
-
Janela aberta no caso para a imagem latente dos músculos de voo indirecto pupal (Figura 1F; Pular para seção 2.3 para a imagem latente dos músculos abdominais).
- Oriente as pupas degola para a lâmina de vidro com o anterior voltado para longe o pesquisador sob um estereomicroscópio. Ajuste o zoom de 2x.
- Usando uma das extremidades da biologia grau #5 pinças, suavemente fazer um buraco no caso da pupa dorsal à ala onde o abdome termina e começa o tórax.
- Para cortar aberto o caso pupal, suavemente mover a pinça para a extremidade anterior do tórax na asa, mas não danificar o tecido da asa vulnerável.
Nota: Se o fluido pinga da pupa, está danificado; descartá-lo e começar de novo com uma pupa diferente. - Levante a seção do caso pupal acima do tórax com a pinça e cortar esta seção com uma tesoura afiada, bem no lado oposto da linha média dorsal.
-
Janela aberta no caso de pupa para a imagem latente dos músculos abdominais (Figura 1)
- Oriente as pupas degola para a lâmina de vidro com a face anterior para o pesquisador sob um estereomicroscópio. Ajuste o zoom de 2x.
- Usando uma das extremidades da biologia grau #5 pinças, suavemente fazer um buraco no caso da pupa dorsal à ala onde termina o tórax e abdômen começa.
- Para cortar aberto o caso pupal, movimente suavemente a pinça em direcção a extremidade posterior do abdômen.
Nota: Se o fluido pinga da pupa, está danificado; descartá-lo e começar de novo com uma pupa diferente. - Levante a seção do caso pupal acima o abdômen com a pinça e cortar esta seção com uma tesoura afiada, bem no lado oposto da linha média dorsal.
-
Pupas de montagem (Figura 1 H)
- Use um pincel molhado para transferir pupas até cinco para um slide de plástico com um sulco (custom-built, reutilizáveis, veja discussão e lista de materiais). Adicione uma ou duas lamelas de espaçador para cada lado, dependendo da profundidade do sulco e a espessura das pupas. Colocar uma pequena gota de água por baixo de cada lamela de espaçador para torná-lo manter o slide e deixar algum espaço entre o groove e as espaçador de lamelas de cada lado.
Nota: As lamelas do espaçador podem também ser permanentemente ligadas ao slide com super bonder, antecipadamente. - Oriente as pupas tais que a abertura no caso pupal virado para cima, usando o pincel. Certifique-se de posicionamento cuidadoso das pupas no ângulo correto para a boa qualidade de imagem. Otimize o ângulo para cada tecido e ponto de tempo no desenvolvimento.
Nota: Uma pequena quantidade de água no sulco faz das pupas de posicionamento mais fácil. Escorra o excesso de água com o pincel depois para evitar o afogamento. - Segure uma lamela (18 x 18 mm) acima as pupas sem tocá-los. Coloque pequenas gotas (cerca de 0,5 µ l) de solução de glicerol 50% acima de cada caso pupal, abrindo no sentido do lamela com uma pipeta de 20 µ l.
Nota: Este procedimento assegura que as gotas de tem o mesmo espaçamento como as pupas. - Vire a lamela e posicione-o acima as pupas à mão ou usando fórceps (padrão #5) enquanto descansava um lado da lamela sobre as espaçador lamelas junto as pupas. Em seguida, delicadamente solte a lamela sobre as pupas. Certifique-se de que as aberturas de caso pupal são devidamente protegidas com 50% de glicerol para boa qualidade de imagem e para evitar as pupas de secar.
- Dobre mais uma extremidade de um pedaço de fita adesiva e agarrá-lo com pinça (padrão #5) para esse fim. Coloque delicadamente a fita que cobre uma borda da lamela superior, coverslip(s) o espaçador e o slide plástico em um lado. Não comprima a fita, ainda. Primeiro, vire o slide e repita para o outro lado.
- Use os dois dedos indicadores para pressionar para baixo a fita simultaneamente em ambos os lados. Este procedimento assegura que as pupas não são deslocadas.
- Verifique se as pupas estão bem em contacto com a lamela. Para uma qualidade de imagem ideal as pupas devem ser espremidas suavemente por baixo da lamela. Se necessário, ajuste o número de lamelas de espaçador.
- Rotule o slide por escrito sobre a fita-cola.
- Use um pincel molhado para transferir pupas até cinco para um slide de plástico com um sulco (custom-built, reutilizáveis, veja discussão e lista de materiais). Adicione uma ou duas lamelas de espaçador para cada lado, dependendo da profundidade do sulco e a espessura das pupas. Colocar uma pequena gota de água por baixo de cada lamela de espaçador para torná-lo manter o slide e deixar algum espaço entre o groove e as espaçador de lamelas de cada lado.
3. viver de imagem de pupas
- O método de montagem permite que a imagem das pupas em microscópios invertidos (Figura 1I) e em microscópios na posição vertical (Figura 1J). Especialmente apropriado para geração de imagens ao vivo está digitalizando microscópios confocal, dois fotões microscópios e microscópios confocal de fiação disco independentemente se eles são invertidos ou eretas. Para filmes a longo prazo, use um palco de temperatura controlada, se disponível.
- Usando a ocular e uma lâmpada UV ou a transmissão de luz, localize uma pupa e foco dentro a pupa.
- Usando a câmera, encontrar a estrutura desejada e ajustar o nível de zoom.
- Para filmes a longo prazo, definir um z-pilha que engloba a estrutura de juros bem (por exemplo, os músculos de voo indirecto, seus locais de fixação, as células de tendão ou uma combinação do acima mencionada) e escolher um intervalo de tempo. Considere fazer uma média para melhor qualidade de imagem. Para filmes de alta velocidade, a curto prazo, escolha um único z-plano para atingir uma taxa de quadros alta.
- Ajuste a potência do laser para dar o melhor sinal possível mas pouca saturação. No entanto, poder do laser muito alto pode danificar a pupa ao longo do tempo.
- Começar a imagem e retornar de vez em quando para ver o filme e reajustar o posicionamento do z-pilha se necessário.

Figura 1: fluxo de trabalho para geração de imagens ao vivo da morfogênese músculo-tendão em pupas de drosófila . Veja o protocolo para obter detalhes. Clique aqui para ver uma versão maior desta figura.
Resultados
Vários tecidos podem ser imagem na vivo no desenvolvimento de pupas voar, tornando-os um sistema modelo ideal para estudar a morfogênese dos órgãos adultos. Entre estes estão os músculos de voo indirecto, o epitélio do tórax, incluindo as células de tendão, o epitélio de asa, músculos abdominais e o coração22,23,24,25,26 , 27. aqui, focamos nas imagens ao vivo da morfogênese de músculos e tendões. Para uma descrição detalhada do músculo de voo indirecto e morfogênese do músculo abdominal e métodos adicionais para estudar Biologia do músculo em Drosophila, remetemos o leitor para Weitkunat e Schnorrer 201422.
Viver a imagem dos músculos de voo indirecto
Para estudar o desenvolvimento a longo prazo dos músculos do voo indireta consiste dos músculos dorsolongitudinal (webcam) e os músculos dorsoventral (DVMs), globular Moesin domínio de ligação de actina marcado com GFP (UAS -GFP-Gma) foi expressa em todos os os músculos usando o fator potenciador de miócito 2 (Mef2)-GAL4 condutor (Fig. 2A-D, Filme S1). Antes da imagem, uma janela no caso pupal foi aberta acima do tórax, como mostrado na Figura 1F. Em um microscópio de dois fotões, z-pilhas foram adquiridos a cada 20 min para 21 h iniciando no ≈11 h após a formação do casulo (11 h APF). Neste quadro de tempo, a webcam (verde sobreposições na Figura 2A'-D') primeiro iniciar o apego às células do tendão (Figura 2A) e em seguida dividido enquanto os ligamentos musculares maduras (Figura 2B). Em seguida, os myotubes encurtar (Figura 2), até finalmente chegarem a fase màxima compactada em 30 h APF (Figura 2D). Tomados em conjunto, este filme destaca as mudanças dramáticas na morfologia do músculo que ocorrem na escala de tempo de horas.

Figura 2: viver a imagem latente da morfogênese de músculos e tendões do voo indirecto. (A-D) Pontos de um filme de dois fotões (filme S1) usando Mef2-GAL4, UAS- GFP-Gma como um marcador para actina dos músculos de voo indirecto consistindo dos músculos dorsolongitudinal (webcam, realçado em verde na '-D') e o (músculos dorsoventral DVMs, realçadas em azul na '-D'). Barras de escala são 100 µm. (E-H) pontos de tempo de um filme de dois fotões (filme S2) usando Duf-GAL4UAS-CD8-GFP como marcador para músculos de voo indirecto e o epitélio do tórax, incluindo células de tendão. Painéis E'-H' mostrar uma sobreposição com um modelo do sistema músculo-tendão em cada ponto de tempo, destacar as extensões de tempo celulares formada por epitélio de tendão (magenta) em contacto com os músculos (verde). Barras de escala são 100 µm (estimativa de tamanho de imagens estruturas). (Eu-L) Tempo pontos de duas cores, girando disco confocal cinema (filme S3) com foco na iniciação de acessório do músculo-tendão. As células de tendão são rotuladas com sr-GAL4UAS-palm-mCherry (magenta) e a dorsolongitudinal indirecta voo músculos com Mhc -Tau-GFP (verde). Barras de escala são 10 µm. o tempo é indicado como hh: mm após a formação do casulo (APF). Note que nem todos os filmes foram adquiridos em um palco de temperatura controlada, portanto, pode desviar-se do desenvolvimento sincronismo. Clique aqui para ver uma versão maior desta figura.
Para estudar a morfogênese de tendão e músculo ao mesmo tempo, membrana-limite GFP (UAS -CD8-GFP) foi expressada usando Dumbfounded (Duf)-GAL4 como motorista, que é expressa em células o tendão e os músculos de voo indirecto (Figura 2E -H, filme S2). Um z-pilha foi tirada em um microscópio de dois fotões a cada 20 min, começando às 16h APF para 20 h. Enquanto os myotubes compacto (sobreposição verde na Figura 2E'-H'), o tendão células extensões de tempo celular de forma que alongar com tempo (magenta sobreposição na Figura 2E'-H'). Tomados em conjunto, este filme destaca a estreita interação entre o tendão e o músculo células na vivo.
Para investigar a interação músculo-tendão mais detalhadamente, realizou-se a imagem de duas cores, alta ampliação. Pupas com cadeia pesada de miosina (Mhc)-Tau-GFP na webcam e UAS -palmitoylated-mCherry (UAS -palm-mCherry), conduzido por listra (sr)-GAL4 nos tendões foram fotografada a cada 5 min, começando às 12h APF para 4,5 h em um disco girando microscópio confocal (Figura 2I-L, filme S3). A 12 h APF, os myotubes migrar para suas células-alvo do tendão ao formando filopodia longa em suas pontas (Figura 2I). Posteriormente, os músculos e tendões tecidos interdigitate (Figura 2J, K) para formar uma ligação estável. Como o acessório amadurece, menos filopodia forma e interface músculo-tendão suaviza (Figura 2 L). Assim, a imagem de duas cores, alta ampliação pode ser usada para revelar a dinâmica celular detalhadamente o organismo vivo.
Viver a imagem dos músculos abdominais
Para geração de imagens ao vivo dos músculos abdominais (Figura 3filme S4), Mef2-GAL4> UAS-CD8-GFP foi usado como um marcador e uma janela foi aberta acima no abdômen no caso pupal como detalhado na Figura 1. Semelhante ao filme de músculo voo indireto representado na Figura 2A-D, a formação e o crescimento dos músculos abdominais podem ser seguidos ao longo de muitas horas de desenvolvimento (55 h no filme S4). Durante este tempo, os mioblastos fundem-se para formar o crescimento myotubes (Figura 3A). As dicas de myotube migram para os alvos de tendão, e após fixar as células de tendão, formam-se as unidades contráteis dos músculos, os sarcômeros, (Figura 3B-D).
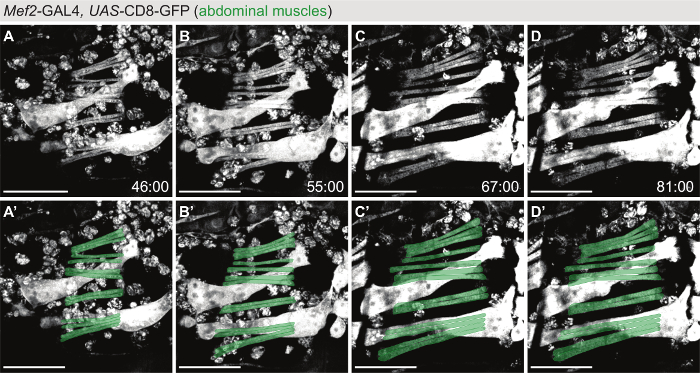
Figura 3: viver de imagem da morfogênese do músculo abdominal. (A-D) Pontos de um filme (filme S4) usando Mef2-GAL4UAS-CD8-GFP como marcador para seguir morfogênese do músculo abdominal. Painéis A'-E' Mostrar sobreposições com modelos de um conjunto de músculos abdominais (verde) que se forma de novo durante a fase de pupa. Barras de escala são 100 µm. tempo é indicado como hh: mm APF. O filme foi adquirido à temperatura ambiente. Clique aqui para ver uma versão maior desta figura.
Viver da imagem latente de se contraindo os músculos
Em contraste com a Figura 2 e Figura 3, a Figura 4 mostra a dinâmica muscular ocorrendo na escala de tempo de segundos: a gravação ao vivo de contrações musculares. Pupas expressando GFP-βPS-integrina sob controle endógeno foram fotografadas com uma resolução de tempo de 0,65 s em um único plano z em um microscópio confocal (Filme S5). No exemplo apresentado na Figura 4, os sítios de fixação de três DVMs (Figura 4A) foram fotografados por 10 minutos, começando a 42 h APF. Durante este tempo, contração de cinco eventos foram observados (Figura 4B-F), mostrando que os sarcômeros são montados já bem o suficiente para suportar contrações coordenadas neste ponto de tempo no desenvolvimento. Portanto, imagem latente de contracções musculares pode ser usado como uma leitura funcional para sarcomerogenesis já durante o desenvolvimento indireto voo músculo28, em oposição por exemplo testes de voo, que só pode ser realizada após a eclosão.
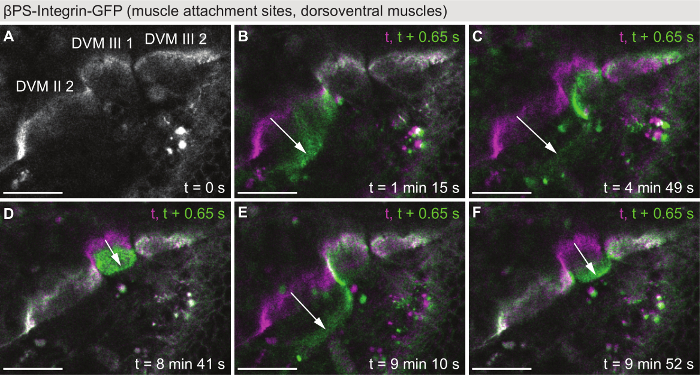
Figura 4: ao vivo por imagens do se contraindo os músculos. (A) primeiro tempo-ponto de um filme (filme S5) apresentando espasmos dos músculos de voo indirecto dorsoventral em 42 h APF usando βPS-integrina-GFP como marcador. No campo de visão é o músculo acessório sites de DVM II 2, DVM III 1 e DVM III 2. (B-F) Cor sobreposições de cinco eventos de contração individual, cada um mostrando o quadro antes da contração muscular (magenta) e o primeiro quadro do evento contração (verde). Note-se que as fibras musculares individuais se contrair independentemente uns dos outros. Setas destacam-se o movimento de contrair. O tempo de resolução do filme é 0,65 s. barras de escala são 25 µm. clique aqui para ver uma versão maior desta figura.
Viver a imagem latente de proteínas endogenamente marcadas
Semelhante ao βPS-integrina-GFP, uma grande coleção de proteínas da fusão expressado em Drosophila sob controle endógeno tem sido gerado2,3,4. Estas linhas de voar podem ser usadas para estudar, por exemplo, a Localização subcellular ou os perfis de expressão de proteínas de interesse. A coleção é especialmente útil se os anticorpos específicos não estão disponíveis ou dinâmica da proteína precisa ser investigado na vivo sem fixação. A Figura 5 mostra três exemplos de proteínas da fusão endogenamente expressa da biblioteca de TransgeneOme (fTRG) voar, Hu li tai shao (Hts)-GFP (Figura 5A, B), Talin-GFP (Figura 5, D) e ( βTubulin60D-GFP Figura 5E, F). A expressão destas proteínas pode ser estudada em todos os tecidos que expressá-las naturalmente. Aqui, nós mostramos o epitélio do tórax (Figura 5AC, E) e os músculos de voo indirecto ou seus sítios de ligação (Figura 5BD, F) como exemplos.
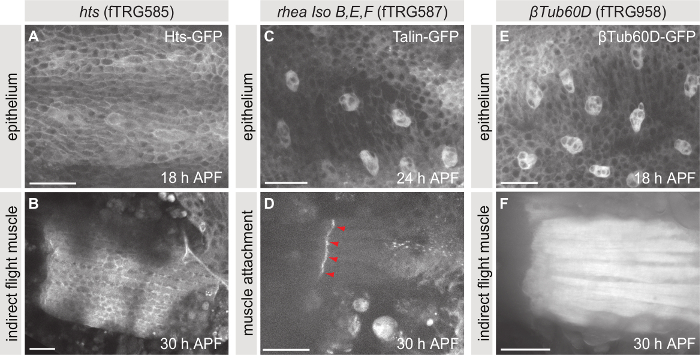
Figura 5: imagens ao vivo de endogenamente marcados proteínas. (A, B) Máximos projeções de z-pilhas tomadas de pupas expressando Hts-GFP. (C, D) Máximos projeções de z-pilhas tomadas de pupas expressando GFP-Talin. (E, F) Máximos projeções de z-pilhas tomadas de pupas expressando GFP-βTubulin60D. Painéis A, C e E mostram o epitélio do tórax em 18, 24 e 18 h APF, respectivamente e painéis B, D e F mostram os músculos de voo indirecto ou seus sites de apego a 30 h APF. Barras de escala são 25 µm. clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo apresentado descreve como imagem morfogênese músculo-tendão em vida pupas de drosófila usando uma variedade de proteínas fluorescente etiquetadas. Esta na vivo estratégia de imagem pode ser usado para estudar processos de desenvolvimento em seu ambiente natural de todo o organismo.
É crucial para uma experiência bem sucedida encontrar o ponto correto do desenvolvimento tempo para analisar. Por exemplo, dorsolongitudinal os músculos de voo indirecto iniciem acessório para seus destinos de tendão a h ≈16 APF23 enquanto músculos abdominais desenvolvem mais tarde e anexar em ambas as extremidades apenas entre 30 e 40 h APF26. Por conseguinte, literatura publicada anteriormente deve ser usada para encontrar pontos de certo tempo de desenvolvimento para analisar ou, se o tecido ou estrutura de interesse não foi estudada em detalhe antes, do desenvolvimento global tem de ser caracterizada primeiro.
Para pupas de montagem com êxito nas corrediças de plástico sob medidas, é importante que os sulcos têm dimensões adequadas: os sulcos precisam ser 1.0-1.5 mm largura e 0,3 - 0,4 mm de profundidade. Esta profundidade permite ajustar a distância exacta para a superior da lamela com lamelas de espaçador conforme necessário. No entanto, pelo menos uma lamela de espaçador deve ser usada para evitar desperdício do glicerol 50% da amostra por forças capilares. O posicionamento correcto das pupas no sulco requer alguma experiência e devem ser otimizada, tal que a estrutura de juros é tão próxima quanto possível da lamela.
Se um grande número de pupas é suposto ser fotografada na sessão de um microscópio, podem todos ser montados previamente e em seguida armazenados na incubadora até de imagem para garantir o sincronismo do desenvolvimento adequado. As pupas devem sobreviver a todo o procedimento e também pelo menos tentar eclose se manteve no slide, depois da imagem latente. A taxa de sobrevivência pode ser usada como uma leitura para verificar se as condições de imagem prejudicar as pupas.
As configurações de imagem devem ser escolhidas com cuidado de acordo com as condições experimentais. Para filmes a curto prazo, uma taxa de quadros alta contra uma alta relação sinal-ruído deve ser equilibrado, enquanto poder relativamente alta do laser pode ser usado sem danificar as pupas demais. No entanto, para filmes de longa duração, a potência do laser tem de ser mantido a um nível moderado e as pupas não devem ser fotografadas continuamente, mas sim em determinados pontos de tempo, por exemplo, a cada 20 min. Para garantir que a estrutura de interesse não se move fora do campo de visão, é necessário reajustar o posicionamento da z-pilha entre pontos de tempo. A nosso conhecimento, a abertura do caso pupal por si só não afeta cronometrando do desenvolvimento. No entanto, uma fase de temperatura controlada deve ser usada para filmes a longo prazo para garantir o sincronismo do desenvolvimento adequado. Com estas considerações em mente, podem ser adquiridos filmes altamente informativas.
O protocolo apresentado pode ser usado para visualizar Morfogênese músculo-tendão, não só mas também outros tecidos em desenvolvimento, por exemplo, a asa de epitélio da29. São necessárias apenas três modificações para este protocolo: (1) a abertura do caso pupal acima da asa em vez do tórax ou abdômen, (2) posicionamento de pupas com a asa para a topo da lamela e (3) a utilização de proteínas diferentes marcador fluorescente. Com o avanço da tecnologia CRISPR/Cas9, proteínas fluorescentes mais endogenamente etiquetadas estará disponíveis, porque tornou-se mais simples para atingir loci endógena em Drosophila30,31 , 32. no futuro, isto permitirá elucidar a dinâmica de numerosas proteínas, células e tecidos inteiras no seu ambiente fisiológico em detalhe.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a aquisição do filme S3-Manuela Weitkunat. Agradecemos a Reinhard Fässler generoso apoio. Este trabalho foi financiado pela EMBO Young Investigator programa (F.S.), o Conselho Europeu de investigação no âmbito do sétimo programa-quadro da União Europeia (FP/2007-2013) / ERC Grant 310939 (F.S.), a sociedade Max Planck (S.B.L., F.S.), o centro nacional de la Recherche Scientifique (CNRS) (F.S.), a iniciativa de excelência AMIDEX de Universidade de Aix-Marseille (F.S.), o LabEX-informar (F.S.) e a Boehringer Ingelheim Fonds (S.B.L.).
Materiais
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Leica | MZ6 | product has been replaced by Leica M60 |
| fly food in bottles (or vials) | - | - | standard culture medium |
| paint brush | da Vinci | 1526Y | size 1 |
| microscope slides | Thermo Scientific | VWR: 631-1303 | 76 x 26 mm |
| double-sided tape (optional) | Scotch | 6651263 | 12 mm x 6.3 m |
| petri dishes | Greiner Bio-One | 632102 | 94 x 16 mm |
| paper tissues | Th.Geyer | 7695251 | |
| forceps #5 (Dumont, inox, standard) | Fine Science Tools | 11251-20 | 0.1 mm x 0.06 mm tip |
| forceps #5 (Dumont, inox, biology grade) | Fine Science Tools | 11252-20 | 0.05 mm x 0.02 mm tip |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | straight tip |
| plastic slides with a groove (reusable) | custom-built | - | 75 x 26 x 4 mm plexi glass slide with 1.0-1.5 mm wide and 0.3-0.4 mm deep groove |
| coverslips | Marienfeld | 107032 | 18 x 18 mm, No. 1.5H |
| glycerol | Sigma-Aldrich | 49781 | dilute to 50 % in water |
| adhesive tape | Tesa | 57370-02 | 1.5 mm x 10 m |
Referências
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. P. Natl. Acad. Sci. USA. 98 (26), 15050-15055 (2001).
- Venken, K. J. T., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat. Meth. 8 (9), 737-743 (2011).
- Sarov, M., et al. A genome-wide resource for the analysis of protein localisation in Drosophila. eLife. 5, e12068 (2016).
- Ranganayakulu, G., Schulz, R. A., Olson, E. N. Wingless signaling induces nautilus expression in the ventral mesoderm of the Drosophila embryo. Dev. Biol. 176 (1), 143-148 (1996).
- Roy, S., Raghavan, K. V. Homeotic genes and the regulation of myoblast migration, fusion, and fibre-specific gene expression during adult myogenesis in Drosophila. Development. 124 (17), 3333-3341 (1997).
- Bryantsev, A. L., Baker, P. W., Lovato, T. L., Jaramillo, M. S., Cripps, R. M. Differential requirements for Myocyte Enhancer Factor-2 during adult myogenesis in Drosophila. Dev. Biol. 361 (2), 191-207 (2012).
- Gordon, S., Dickinson, M. H. Role of calcium in the regulation of mechanical power in insect flight. P. Natl. Acad. Sci. USA. 103 (11), 4311-4315 (2006).
- Jin, H., et al. Genome-Wide Screens for In Vivo Tinman Binding Sites Identify Cardiac Enhancers with Diverse Functional Architectures. PLoS Genet. 9 (1), e1003195 (2013).
- Chen, E. H., Olson, E. N. Antisocial, an intracellular adaptor protein, is required for myoblast fusion in Drosophila. Dev. Cell. 1 (5), 705-715 (2001).
- Clyne, P. J., Brotman, J. S., Sweeney, S. T., Davis, G. Green Fluorescent Protein Tagging Drosophila Proteins at Their Native Genomic Loci With Small P Elements. Genetics. 165 (3), 1433-1441 (2003).
- Katzemich, A., Liao, K. A., Czerniecki, S., Schöck, F. Alp/Enigma Family Proteins Cooperate in Z-Disc Formation and Myofibril Assembly. PLoS Genet. 9 (3), e1003342 (2013).
- Klapholz, B., et al. Alternative mechanisms for talin to mediate integrin function. Curr. Biol. 25 (7), 847-857 (2015).
- Schnorrer, F., Kalchhauser, I., Dickson, B. J. The transmembrane protein Kon-tiki couples to Dgrip to mediate myotube targeting in Drosophila. Dev. Cell. 12 (5), 751-766 (2007).
- Menon, S. D., Chia, W. Drosophila rolling pebbles: a multidomain protein required for myoblast fusion that recruits D-Titin in response to the myoblast attractant Dumbfounded. Dev. Cell. 1 (5), 691-703 (2001).
- Bloor, J. W., Kiehart, D. P. zipper Nonmuscle myosin-II functions downstream of PS2 integrin in Drosophila myogenesis and is necessary for myofibril formation. Dev. Biol. 239 (2), 215-228 (2001).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135 (4), 621-626 (2008).
- Hatan, M., Shinder, V., Israeli, D., Schnorrer, F., Volk, T. The Drosophila blood brain barrier is maintained by GPCR-dependent dynamic actin structures. J. Cell Biol. 192 (2), 307-319 (2011).
- Lee, T., Luo, L. Mosaic Analysis with a Repressible Cell Marker for Studies of Gene Function in Neuronal Morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Roy, S., Huang, H., Liu, S., Kornberg, T. B. Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science. 343 (6173), 1244624 (2014).
- Förster, D., Luschnig, S. Src42A-dependent polarized cell shape changes mediate epithelial tube elongation in Drosophila. Nat. Cell Biol. 14 (5), 526-534 (2012).
- Weitkunat, M., Schnorrer, F. A guide to study Drosophila muscle biology. Methods. 68 (1), 2-14 (2014).
- Weitkunat, M., Kaya-Çopur, A., Grill, S. W., Schnorrer, F. Tension and force-resistant attachment are essential for myofibrillogenesis in Drosophila flight muscle. Curr. Biol. 24 (7), 705-716 (2014).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. eLife. 4, e08519 (2015).
- Etournay, R., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Weitkunat, M., Brasse, M., Bausch, A. R., Schnorrer, F. Mechanical tension and spontaneous muscle twitching precede the formation of cross-striated muscle in vivo. Development. 144 (7), 1261-1272 (2017).
- Sellin, J., Albrecht, S., Kölsch, V., Paululat, A. Dynamics of heart differentiation, visualized utilizing heart enhancer elements of the Drosophila melanogaster bHLH transcription factor Hand. Gene Expr. Patterns. 6 (4), 360-375 (2006).
- Lemke, S. B., Schnorrer, F. Mechanical forces during muscle development. Mech. Develop. 144 (Pt A), 92-101 (2017).
- Classen, A. -. K., Aigouy, B., Giangrande, A., Eaton, S. Imaging Drosophila pupal wing morphogenesis. Methods Mol. Biol. 420, 265-275 (2008).
- Gratz, S. J., et al. Genome engineering of Drosophila with the CRISPR RNA-guided Cas9 nuclease. Genetics. 194 (4), 1029-1035 (2013).
- Zhang, X., Koolhaas, W. H., Schnorrer, F. A versatile two-step CRISPR- and RMCE-based strategy for efficient genome engineering in Drosophila. G3. 4 (12), 2409-2418 (2014).
- Port, F., Chen, H. -. M., Lee, T., Bullock, S. L. Optimized CRISPR/Cas tools for efficient germline and somatic genome engineering in Drosophila. P. Natl. Acad. Sci. USA. 111 (29), E2967-E2976 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados