Method Article
Vivo에서 근육-힘 줄 Morphogenesis 초파리 번데기에의 이미징
요약
여기, 우리 라이브 이미징 일반 및 근육-힘 줄 morphogenesis 개발 프로세스의 특히 생활에서 수행 하는 쉬운--사용 하 고 다양 한 방법 제시 초파리 번데기.
초록
힘 줄 및 골격 근육 그들의 본체 부품을 이동 하는 인간을 포함 한 동물을 사용 합니다. 근육 morphogenesis이 매우 인 간에 게 동물에서 보존 됩니다. 따라서, 강력한 초파리 모델 시스템 공부 또한 인간의 근육 생물학에 적용 될 수 있는 근육-힘 줄 개발의 개념을 사용할 수 있습니다. 여기, 우리가 자세히 설명 생활, 성인 근육-힘 줄 시스템의 morphogenesis 수 쉽게 몇 군데 하는 어떻게 초파리 번데기를 개발. 따라서, 방법 단백질, 세포와 조직 그들의 생리 적인 환경에서 조사 하 고 있습니다. 유용한 팁과 단계별 프로토콜, 뿐만 아니라 우리는 근육-힘 줄 시스템을 공부에 대 한 적합 한 붙일 태그가 마커 단백질의 포괄적인 개요를 제공 합니다. 프로토콜의 다양 한 응용 프로그램을 강조 하기 위해 우리 예 영화 장기 전체적 이벤트의 시각화에서 배열-시간과 일-근육 경련 같은 단기 동적 프로세스의 시각화의 시간 규모에 표시 초의 시간에 발생합니다. 함께 찍은,이 프로토콜 설계 하 고 그대로 유기 체에서 근육-힘 줄 morphogenesis 조사에 대 한 라이브 이미징 실험을 수행할 리더를 사용 해야 합니다.
서문
근육-힘 줄 장치 그들의 본체 부품을 이동 하는 인간을 포함 한 동물을 수 있습니다. 근육-힘 줄 시스템의 분자 빌딩 블록은 매우 보존. 따라서, 인간의 근육 생물학, 예를 들면 근육 morphogenesis, 근육-힘 줄 부착 및 myofibril 자기 조직에 대 한 관련 된 근육-힘 줄 개발의 개념 공부 될 수 있다 초파리 melanogaster 를 사용 하 여 쉽게 접근할 수로 모델 시스템입니다. 초파리 번데기 시스템 실험 장점이 몇 가지 있습니다. 첫째, 번데기 단계-성인 근육 형성 된다-때 유기 체는 착 하 고 몇 시간 또는 일 기간 동안에 현미경 이미지를 따라서 쉽게. 둘째, 많은 근육 양식 가까운 번데기 표면 아래에 그들은 그대로, 부분적으로 반투명 유기 체 안에 군데 될 수 있도록. 셋째, 근육 힘 줄 세포를 통해 형성 외 골격에 연결 된 및 조직 긴장은 쌓아 그들의 자연 환경에서 조사 될 수 있습니다. 이 근육 세포 배양 시스템에서 불가능합니다. 그리고 마지막으로, 유전 도구의 과다 초파리에서 사용할 수 있습니다. 이러한 가운데 많은 붙일 태그가 마커 특정 세포 유형 또는 vivo에서화상 진 찰에 대 한 subcellular 구조의 라벨을 허용 하는 있다.
표 1 에 요약 근육-힘 줄 morphogenesis 공부에 사용 하는 가장 중요 한 마커 합니다. 그것은 overexpressed GAL4 UAS 시스템1 을 사용 하 여 마커를 포함 하 고 endogenously 태그 단백질 마커2,,34. GAL4 UAS 시스템의 장점은 마커 쉽게 전체 산 번데기에는 몇 군데 수 강한 신호에 따른 높은 수준에서 일반적으로 표현 됩니다. 또한, 조직 특이성 GAL4 드라이버를 신중 하 게 선택 하 여 얻을 수 있습니다. 생 제어에서 표현 하는 융합 단백질의 장점은 각각 단백질의 역학 공부 수 비보에, 그들은 다른 세포 유형 또는 특정 subcellular 구조에 대 한 표식으로 사용 될 또한 수 있지만 예를 들어 ΒPS-Integrin-GFP 근육 첨부 파일 사이트. 함께, 이러한 마커 실험 설계 및 선택의 현재와 미래에 해결 될 수 있는 연구 문제에 높은 유연성을 제공 합니다.
| 분류 구조 | 표식 | 식 및 지역화 | 클래스 | 재고 번호 | 댓글 | 참고 | ||||||
| 근육 | Mef2-GAL4 | 모든 myoblasts와 모든 단계에서 모든 근육 | GAL4 선 | BL 27390 | 5 | |||||||
| 1151-GAL4 | 성인 근육 선구자와 이른 myotubes ≈24 h APF까지 | GAL4 라인, 증강 트랩 | - | 6 | ||||||||
| Act79B-GAL4 | 차별화에 따라 근육을 점프 | GAL4 선 | - | 7 | ||||||||
| Act88F-GAL4 | 간접적인 비행 근육 ≈14 h APF 시작 | GAL4 선 | - | 7 | ||||||||
| Act88F-Cameleon 3.1 | 간접적인 비행 근육 ≈14 h APF 시작 | Act88F 증강 발기인 운전 Cameleon 3.1 / | - | 캘리포니아2 + 표시기 | 8 | |||||||
| Act88F-GFP | 간접적인 비행 근육 ≈14 h APF 시작 | GFP 융합 (플라이 TransgeneOme 선) | fTRG78 및 fTRG10028 | 4 | ||||||||
| 그-nls-GFP | 성인 근육 선구자, 핵, ≈24 h APF 간접 비행 근육에까지 | nls-GFP 기자와 증강/발기인 | - | 1.5 kb 증강 조각 | 9 | |||||||
| Mhc-타우-GFP | microtubules DLM 템플릿 및 근육 분화 | 타우-GFP 기자와 증강/발기인 | BL 53739 | 10 | ||||||||
| ΒTub60D-GFP | microtubules (예: ≈14 h AFP, 강하게 ≈48 h APF 후 감소에서 간접 비행 근육)에 myotubes에서 | GFP 융합 (플라이 TransgeneOme 선) | fTRG958 | 4 | ||||||||
| Mhc-GFP (weeP26) | (예: 간접 비행 근육 ≈30 h APF에서에서 시작)에 있는 모든 신체 근육에 sarcomeres (두꺼운 필 라 멘 트) | GFP-트랩 | - | 사용 heterozygous, isoform 하위 집합 레이블 | 11 | |||||||
| Sls-GFP | (예: 간접 비행 근육 ≈30 h APF에서에서 시작)에 있는 모든 신체 근육에 sarcomeres (Z-디스크) | GFP-트랩 (파리 통 선) | - | G53 heterozygous 사용 | 2 | |||||||
| Zasp66-GFP | 모든 신체 근육에 Z-디스크 | GFP-트랩 (파리 통 선) | BL 6824 | ZCL0663 | 2 , 12 | |||||||
| Zasp52-GFP | 모든 신체 근육에 Z-디스크 | GFP-트랩 (파리 통 선) | BL 6838 | G00189 | 2 , 12 | |||||||
| Hts GFP | 말라 바인딩; 상피, myoblasts와 myotubes로 표현 | GFP 융합 (플라이 TransgeneOme 선) | fTRG585 | 4 | ||||||||
| Dlg1 GFP | 상피 세포 접합부, myoblasts와 모든 단계에서 근육 세포 막 | GFP 융합 (플라이 TransgeneOme 선) | fTRG502 | 4 | ||||||||
| 근육 첨부 파일 사이트 | ΒPS Integrin GFP | 근육 첨부 파일 사이트 (예를 들어, 시작 ≈18 h AFP 간접 비행 근육) | GFP 노크에 | - | 13 | |||||||
| 탈린-GFP와-mCherry | 근육 첨부 파일 사이트 (예를 들어, 시작 ≈18 h AFP 간접 비행 근육) | GFP-트랩 (모방 선) | - | 3 | ||||||||
| 탈린-GFP | 근육 첨부 파일 사이트 (예를 들어, 시작 ≈18 h AFP 간접 비행 근육) | GFP 융합 (플라이 TransgeneOme 선) | fTRG587 | 4 | ||||||||
| Ilk GFP | 근육 첨부 파일 사이트 (예를 들어, 시작 ≈18 h AFP 간접 비행 근육) | GFP-트랩 (파리 통 선) | 교토 110951 (ZCL3111) | ZCL3111, ZCL3192 | 2 | |||||||
| -RFP와 Vinc GFP | 근육 첨부 파일 사이트 (예를 들어, 시작 ≈18 h AFP 간접 비행 근육) | GFP 융합 (transgene) | - | 13 | ||||||||
| 힘 줄 | sr-GAL4 | 번데기 단계에 걸쳐 흉부 힘 줄 세포 | GAL4 라인, 증강 트랩 | BL 26663 | homozygous 치명적인 | 14 | ||||||
| 근육과 힘 줄 | Duf-GAL4 | 근육과 epithelia, 초기 증상 | GAL4 선 | BL 66682 | kirre-rP298, 설립자 셀 표식 | 15 | ||||||
| UAS-기자 | UAS-GFP-Gma | 말라 바인딩 | UAS 선 | BL 31776 | GFP를 융합 하는 Moesin의 말라 바인딩 도메인 | 16 | ||||||
| UAS-mCherry-Gma | 말라 바인딩 | UAS 선 | - | Gma는 mCherry를 융합 | 17 | |||||||
| UAS- Lifeact-GFP | 말라 바인딩 | UAS 선 | BL 35544 | 18 | ||||||||
| UAS-Lifeact-루비 | 말라 바인딩 | UAS 선 | BL 35545 | 18 | ||||||||
| UAS-CD8-GFP | 막 바인딩 | UAS 선 | 다양 한 주식, 예를 들면: BL 32184 | 19 | ||||||||
| UAS-CD8-mCherry | 막 바인딩 | UAS 선 | 27391 및 27392 BL | 20 | ||||||||
| UAS-팜-mCherry | palmitoylation 통해 막 바인딩 | UAS 선 | BL 34514 | UAS-brainbow | 21 | |||||||
표 1: 붙일 근육-힘 줄 morphogenesis에서 vivo에서공부를 위해 적당 한 단백질 마커 태그.
여기, 설명 자세히 어떻게 생활 pupae에서 근육-힘 줄 morphogenesis의 이미징 쉽게 그리고 성공적으로 수행할 수 있습니다 (그림 1). 또는, pupae 고쳐질 수 있다, 해 부와 immunostained 항 체 단백질을 아니 살고 마커 라벨을 사용 하 여 허용 하는 사용 가능한22. 이 경우에, 영상 품질이 일반적으로 더 높은 있기 때문에 운동 관심의 구조는 coverslip에 가까운 근접에 놓일 수 있습니다 합니다. 그러나, 해 부 및 고정 손상 하 고 분자를 발생할 수 있습니다 또는 조직 역학, 예를 들어 꿈 틀, 근육은 살아있는 유기 체에서 서만 공부 될 수 있다.
프로토콜
1. 단계 번데기
- 20-40 처녀 암컷과 비행 음식 (그림 1A)의 병 당 약 20 남성 크로스를 설정 합니다. 또는 주식을 사용 하는 경우에 각 주식 새로운 병으로 플립. 충분 한 번데기를 얻으려면 유전자 당 2 병을 설정을 하십시오.
- 5 ~ 6 일 (그림 1B)에 대 한 25 ° C (또는 실험적인 디자인에 따라 27 ° C)에서 병을 품 어.
참고:과 밀을 방지 하 고 번데기의 지속적인 공급을 보장 하기 위해 파리에 2 ~ 3 일 마다 내리고 계속. - 젖은 브러시를 사용 하 여 병의 벽에서 백색 prepupae를 수집 하 고 유리 슬라이드 (그림 1C)에 그들을 전송. 번데기는 원하는 도달 되도록 준비 시간 라이브 현미경 이미징 시작 나이.
참고: 이러한 prepupae 그들의 모양에서 오래 된 번데기 처럼 보이지만 그들은 여전히 애벌레 같은 흰색. Prepupal 무대의 puparium 형성 (0 h APF) 후 0 h로 정의 됩니다. - 젖은 브러시로 번데기에 집착 하는 비행 음식 덩어리를 제거 하 고 stereomicroscope (그림 1D)를 사용 하 여 유리 슬라이드 향해 pupae의 복 부 측 방향. 번데기는 아직도 (너무 젊은) 이동 하는 또는 그 갈색 차례 시작 했습니다 삭제 (너무 오래 된). 이렇게 하면 모든 pupae는 같은 나이 (0-1 h APF).
- 유전자 형, 날짜와 시간 컬렉션의 슬라이드를 레이블을 지정 합니다. 한 페 트리 접시를 유리 슬라이드를 전송 하 고 (그림 1E) 밖으로 건조에서 번데기를 방지 하기 위해 젖은 조직 추가.
- 원하는 나이 도달할 때까지 25 ° C에서 27 ° C 인큐베이터에 번데기를 저장 합니다. 번데기가 원하는 다음 단계 이미징, 전에 1 시간을 계속 예 그림 2A-D에 표시 된 영화에 대 한 13 h APF에서 라이브 영상 (3 단계)를 시작할 때 나이.
참고: 가장 이른 가능한 시간 출발점은 27 ° c.에 8-10 h APF에서 발생 하는 번데기의 머리 eversion 후
2. 이미징 Pupae 준비
- 그는 pupae 지금에 충실 유리 슬라이드 처럼 그들은 자연스럽 게 잔여 비행 음식 때문에 병의 벽에 붙어 확인 하십시오. 여분의 접착제는 필요 합니다. 번데기 높은 습도 때문에 충분히 충실 하지 않습니다, 그들이 말리 면 몇 분 페 트리 접시를 엽니다. 또는, 유리 슬라이드에 이중 면 테이프에 그들을 전송 하지만 일반적으로,이 필요 하지 않습니다.
-
간접적인 비행 근육의 이미징 번데기 케이스에서 창 열기 (1 층 그림; 2.3 복 부 근육의 이미징에 대 한 섹션을 건너뜁니다.)
- stereomicroscope에서 연구원에서 앞쪽 방향으로 유리 슬라이드에 집착 하는 번데기를 방향을 정하십시오. 2 X 확대/축소를 조정 합니다.
- #5 집게를 부드럽게 학년 생물학의 한쪽 끝을 사용 하 여 복 부 끝나는 날개 등 번데기 케이스에 구멍을 찌를 하 고 흉부 시작.
- 번데기의 경우 오픈 슬라이스, 부드럽게 날개 따라 흉부의 앞쪽 끝에는 집게를 이동 하지만 취약 한 날개 조직 손상 방지.
참고: 액체 누수 번데기에서 그것은 손상; 그것을 삭제 하 고 다른 번데기와 다시 시작. - 집게와 흉부 위에 번데기 케이스의 섹션을 들어올린 다음이 섹션 등 쪽 midline의 반대 측에 정밀한, 날카로운가 위로 잘라.
-
복 부 근육의 이미징 번데기 케이스에서 창 열기 (그림 1G)
- stereomicroscope에서 연구원으로 앞쪽 방향으로 유리 슬라이드에 집착 하는 번데기를 방향을 정하십시오. 2 X 확대/축소를 조정 합니다.
- #5 집게를 부드럽게 학년 생물학의 한쪽 끝을 사용 하 여 흉부 끝나는 날개 등 번데기 케이스에 구멍 그리고 복 부 시작.
- 번데기의 경우 오픈 슬라이스, 부드럽게 복 부의 후부 끝 집게가 이동 합니다.
참고: 액체 누수 번데기에서 그것은 손상; 그것을 삭제 하 고 다른 번데기와 다시 시작. - 집게와 복 부 위에 번데기 케이스의 섹션을 들어올린 다음이 섹션 등 쪽 midline의 반대 측에 정밀한, 날카로운가 위로 잘라.
-
산 번데기 (그림 1 H)
- 젖은 브러시를 사용 하 여 플라스틱 슬라이드 그루브 (사용자, 재사용, 참조 토론과 자료의 목록)을 최대 5 개의 pupae를 전송. 홈의 깊이 번데기의 두께 따라 각 측면에 하나 또는 두 개의 스페이서 coverslips를 추가 합니다. 슬라이드에 충실 하 고 양쪽에 홈 사이의 스페이서 coverslips 일부 공간을 떠날 수 있도록 각 공백 coverslip 아래 물 작은 방울을 넣어.
참고: 공백 coverslips 수 있습니다 또한 영구적으로 연결할 슈퍼 접착제, 슬라이드 미리. - 동양 번데기는 번데기의 경우에서 오프닝 얼굴 위쪽으로 브러시를 사용 하 여. 좋은 이미지 품질에 대 한 올바른 각도로 pupae 주의 위치를 확인 합니다. 각 조직 및 발달 시간 포인트에 대 한 각도 최적화 합니다.
참고: 작은 양의 물 홈에 게 쉽게 번데기의 위치. 브러시 나중 익사 방지를 가진 과잉의 물을 배수. - 그들을 건드리지 않고 번데기 위에 coverslip (18 x 18 m m)를 개최. 위의 각 번데기 경우에 coverslip 20 µ L 피 펫을 사용 하 여 50% 글리세롤 솔루션의 (약 0.5 µ L) 작은 방울을 배치 합니다.
참고:이 절차 방식 방울 번데기로 동일한 간격 있습니다. - coverslip 뒤집어 놓고 손 또는 번데기 옆 공백 coverslips에는 coverslip의 한쪽을 휴식 하는 동안 집게 (표준 #5)를 사용 하 여 번데기 위에 위치 합니다. 다음, 부드럽게 번데기에 coverslip 드롭. 번데기 케이스 구멍은 제대로 좋은 이미지 품질 및 번데기 건조 하지 않도록 50% 글리세롤 덮여 있는지 확인 합니다.
- 접착 테이프의 한 끝을 접어 하 고 그 끝에 집게 (표준 #5)와 그것을 잡아. 그것은 커버 최고 coverslip, 스페이서 coverslip(s) 그리고 1 개의 측에 플라스틱 슬라이드의 한 가장자리를 부드럽게 테이프를 배치 합니다. 누르지 마십시오 테이프, 아래로 아직. 먼저, 슬라이드를 돌아서 하 고 다른 측면에 대 한 반복 합니다.
- 두 집게 손가락을 사용 하 여 양쪽에 동시에 테이프를 눌러. 이 절차는 pupae 전치 하지는 보장 합니다.
- 번데기는 coverslip 연락 잘 인지 확인 하십시오. 최적의 영상 품질을 위해 번데기 한다는 coverslip 아래 부드럽게 압착 됩니다. 필요한 경우 스페이서 coverslips의 수를 조정 합니다.
- 스티커 테이프에 작성 하 여 슬라이드를 레이블을 지정 합니다.
- 젖은 브러시를 사용 하 여 플라스틱 슬라이드 그루브 (사용자, 재사용, 참조 토론과 자료의 목록)을 최대 5 개의 pupae를 전송. 홈의 깊이 번데기의 두께 따라 각 측면에 하나 또는 두 개의 스페이서 coverslips를 추가 합니다. 슬라이드에 충실 하 고 양쪽에 홈 사이의 스페이서 coverslips 일부 공간을 떠날 수 있도록 각 공백 coverslip 아래 물 작은 방울을 넣어.
3. 라이브 Pupae의 Imaging
- 장착 방법 (그림 1I) 거꾸로 현미경에 및 수직 현미경 (그림 1J)에 번데기의 영상 수 있습니다. 특히 라이브 이미징 confocal 현미경, 2 광자 현미경 및 반전 여부에 관계 없이 회전 디스크 confocal 현미경 검사는 적합 또는 직 립. 장기적인 영화에 대 한 가능한 경우 온도 제어 단계를 사용 합니다.
- Using은 안구 및 UV 램프 또는 빛 전송, 번데기와 번데기 안에 초점을 찾습니다.
- 카메라를 사용 하 여 원하는 구조를 찾을 하 고 확대/축소 수준을 조정.
- 장기적인 영화에 대 한 관심 잘 (예를 들어 간접 비행 근육, 그들의 첨부 파일 사이트, 힘 줄 세포 또는 상기 조합)의 구조를 포함 하는 z 스택을 정의 하 고 시간 간격을 선택 합니다. 더 나은 이미지 품질에 대 한 평균을 하는 것이 좋습니다. 고속, 짧은 영화에 대 한 높은 프레임 속도 달성 하기 위해 하나의 z 평면을 선택 합니다.
- 레이저 파워 가장 좋은 가능성 신호 하지만 약간 채도를 조정 합니다. 그러나, 너무 높은 레이저 전원 시간이 지남에 번데기를 손상 수 있습니다.
- 이미징 시작 하 고 때때로 영화를 확인 하 고 필요한 경우 z-스택 위치 재조정을 반환 합니다.

그림 1: 근육-힘 줄 morphogenesis 초파리 번데기에서의 라이브 영상에 대 한 워크플로. 자세한 내용은 프로토콜을 참조 하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
다양 한 조직 이미지 vivo에서 비행 pupae, 그들에 게 성인 기관의 morphogenesis 공부 하는 이상적인 모델 시스템을 만드는 개발 될 수 있습니다. 이러한 가운데는 간접 비행 근육, 힘 줄 세포를 포함 한 흉부 상피, 날개 상피, 복 부 근육과 심장22,23,,2425,26 , 27. 여기, 우리는 근육과 힘 줄 morphogenesis의 라이브 이미징에 초점. 간접적인 비행 근육 및 복 부 근육 morphogenesis 초파리에서 근육 생물학 공부에 대 한 추가 방법의 자세한 설명에 대 한 우리 Weitkunat과 겉 2014 년22에 독자를 참조 하십시오.
간접적인 비행 근육의 이미징 라이브
공부에 대 한 dorsolongitudinal 근육 (DLMs)와 dorsoventral 근육 (DVMs), 구형 Moesin 걸 바인딩 도메인 태그 GFP (UAS-GFP-Gma)로 구성 된 간접 비행 근육의 장기적인 발전을 모두 표현 했다 Myocyte 증강 인자 요인 2 (Mef2)를사용 하 여 근육-GAL4 드라이버 (그림 2A-D, 영화 S1). 이미징, 전에 번데기의 경우에서 창 그림 1 층에서처럼 흉부 위에 오픈 했습니다. 두 광자 현미경에 z-스택 21 h h ≈11 puparium 형성 (11 h APF) 후부터 매 20 분을 인수 했다. DLMs는이 기간에서 ( 그림 2A에서 오버레이 그린'-D') 먼저 힘 줄 세포 (그림 2A)에 첨부 파일을 시작 하 고 다음 첨부 파일을 근육 성숙 (그림 2B) 동안 분할. 그들은 마침내 30 h APF (그림 2D)에서 극대로 압축된 단계를 도달할 때까지 다음에 myotubes (그림 2C) 단축. 함께 찍은이 영화는 시간 시간 규모에서 발생 하는 근육 형태에 극적인 변화를 강조 표시 합니다.

그림 2: 간접 비행 근육과 힘 줄 morphogenesis의 영상 라이브. (A-D) Mef2를 사용 하 여 두 광자 동영상 (영화 S1)에서 시간-GAL4, UAS-GFP-Gma 걸 dorsolongitudinal 근육의 구성 된 간접 비행 근육에 대 한 표식으로 (DLMs, A에서 녹색으로 강조 표시 '-D')와 dorsoventral 근육 ( DVMs, A에서 파란색으로 강조 표시 '-D'). 스케일 바는 100 µ m. (E-H) 시간 포인트 Duf를 사용 하 여 두 광자 동영상 (영화 S2)에서-GAL4UAS-CD8-GFP 간접 비행 근육과 힘 줄 세포를 포함 한 흉부 상피에 대 한 표식으로. 패널 E'-H' 각 시간 지점에서 근육-힘 줄 시스템의 모델과 오버레이 표시 하 여 근육 (녹색) 접촉 힘 줄 상피 (마젠타)에 의해 형성 된 긴 세포 확장을 강조. 스케일 바는 100 µ m (이미지 구조체의 크기에서 추정). (나-L) 포인트 2-색상, 회전 디스크 confocal 영화 (영화 S3)에서 근육-힘 줄 부착 개시에 초점을 시간. 힘 줄 세포 sr표시 됩니다-GAL4UAS-팜-mCherry (마젠타색) 및 dorsolongitudinal 간접 비행 근육 Mhc-타우-GFP (녹색). 눈금 막대는 10 µ m. 시간으로 표시 됩니다 hh: mm puparium 형성 (APF) 후. 모든 영화는 온도 제어 단계에 인수 했다, 따라서, 발달 타이밍 갈리는 수 있습니다 note. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
동시에 힘 줄과 근육 morphogenesis 공부, 막 도약 GFP (UAS-CD8-GFP)를 사용 하 여 표현 되었다 Dumbfounded (Duf)-힘 줄 세포와 간접 비행 근육 (그림 2E에서 표현 되는 드라이버로 GAL4 -H, 영화 S2). Z-스택 마다 20 분 16 h 20 h APF에서 시작 2 광자 현미경에서 촬영 됐다. myotubes을 압축 하는 동안 ( 그림 2E녹색 오버레이'-H'), 힘 줄 세포 시간 연장 양식 긴 세포질 확장 ( 그림 2E마젠타 오버레이'-H'). 함께 찍은이 영화는 힘 줄과 근육 세포에서 vivo에서사이 가까운 상호 작용을 강조 표시 합니다.
근육-힘 줄 상호 작용을 좀 더 자세하게에서 조사, 2-색상, 높은 확대 이미징 수행 되었다. Myosin 무 겁 사슬 (Mhc)와 번데기-타우-GFP DLMs 및 UAS-palmitoylated-mCherry (UAS-팜-mCherry)에 의해 구동 스트라이프 (sr)-힘 줄에 GAL4 회전 디스크에 4.5 h 12 h APF에서 시작 하는 모든 5 분 촬영 했다 confocal 현미경 (그림 2I-L, 영화 S3). 12 h APF에 myotubes 그들의 끝 (그림 2I) 긴 filopodia를 형성 하는 동안 그들의 힘 줄 대상 셀으로 마이그레이션합니다. 그 후, 근육과 힘 줄 조직 interdigitate (그림 2J, K) 안정적인 첨부 파일을 형성. 첨부 파일 성숙, 적은 filopodia 형태와 근육-힘 줄 인터페이스 (그림 2 L) 부드러운. 따라서, 2-색상, 높은 확대 영상 살아있는 유기 체에서 세포 역학을 사용할 수 있습니다.
복 부 근육의 이미징 라이브
(그림 3영화 S4), 복 부 근육의 라이브 이미징에 대 한 Mef2-GAL4> UAS-CD8-GFP를 마커로 사용 하 고 창에 자세한 그림 1G으로 번데기 경우 복 부 위에 열렸다. 그림 2A-D에서 간접 비행 근육 영화와 마찬가지로, 형성 및 복 부 근육의 성장 개발 (영화 S4 55 h)의 많은 시간 동안 다음 수 있습니다. 이 시간 동안에 myoblasts 형태로 성장 하는 myotubes (그림 3A) 퓨즈. Myotube 팁 그들의 힘 줄 대상 마이그레이션 및 힘 줄 세포에 연결 후, sarcomeres 근육의 수축 단위 형성 된다 (그림 3B-D).
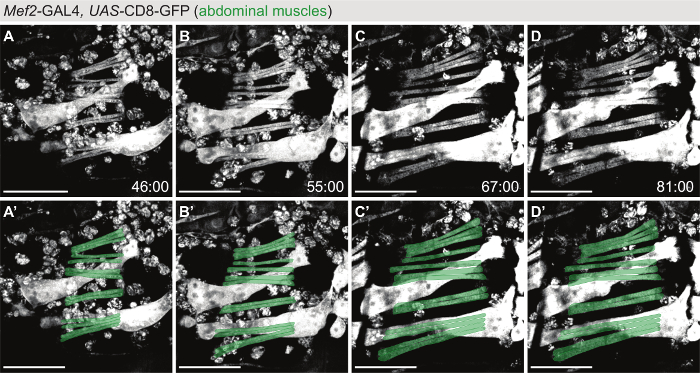
그림 3: 복 부 근육 morphogenesis의 영상 라이브. (A-D) Mef2를 사용 하 여 동영상 (영화 S4)에서 시간-GAL4UAS-CD8-GFP를 마커로 morphogenesis 복 부 근육을 따라. A 패널 '-E' 번데기 단계 드 노 보 를 형성 하는 복 부 근육 세트 (녹색)의 모델 오버레이 표시. 스케일 바는 100 µ m. 시간 hh: mm APF로 표시. 영화는 실 온에 인수 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
근육 경련의 이미징 라이브
달리 그림 2 와 그림 3, 그림 4 는 초의 시간 규모에서 발생 하는 근육 역학: 근육 수축의 라이브 녹음. Pupae 생 제어에서 βPS Integrin GFP를 표현 했다 0.65의 시간 분해능으로 몇 군데 confocal 현미경 (영화 S5)에 단일 z-평면에서 s. 그림 4에 표시 된 예제에서 세 DVMs (그림 4A)의 첨부 파일 사이트 했다 42 h APF에서 시작 하는 10 분 동안 몇 군데. 이 시간 동안, 5 트 이벤트 (그림 4B-F), 관찰 되었다 그는 sarcomeres 이미 조립 충분히 개발에서이 시간 시점 조정된 수축을 지원 하기 위해 보여주는. 따라서, 근육 경련의 이미징 간접 비행 근육 개발28, 예를 들어 비행 시험, 일수로 후 실행 될 수 있는 반대 동안에 이미 sarcomerogenesis에 대 한 기능 읽기로에 사용할 수 있습니다.
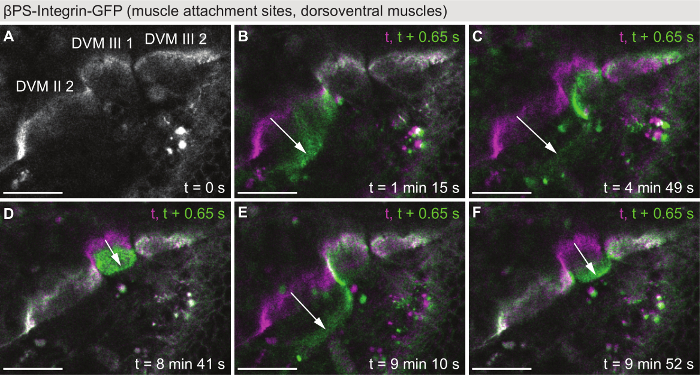
그림 4: 근육 경련의 영상 라이브. (A) βPS-Integrin-GFP를 마커로 42 h APF를 사용 하 여 dorsoventral 간접 비행 근육의 꿈 틀 보여주는 영화 (영화 S5)에서 처음으로 포인트. 보기의 필드에는 근육의 II 2 DVM, DVM III 1, DVM III 2 첨부 파일 사이트입니다. (B-F) 5 개별 트 위치 이벤트의 오버레이 (마젠타) 경련 전에 프레임 트 이벤트 (녹색)의 첫 번째 프레임을 보여주는 각 색. Note는 개별 근육 섬유 트 위치 하지 독립적으로 서로에서. 화살표는 꿈 틀 동작을 강조 표시합니다. 동영상의 시간 해상도 0.65 s. 스케일 바는 25 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Endogenously 태그 단백질의 이미징 라이브
ΒPS와 유사한-Integrin-GFP, 생 통제 초파리 에서 표현 하는 융합 단백질의 큰 컬렉션 생성 된2,,34되었습니다. 이러한 플라이 라인 subcellular 지 방화 또는 관심사의 단백질의 식 프로필 예를 들어 공부를 사용할 수 있습니다. 컬렉션은 특정 항 체는 사용할 수 없습니다 또는 단백질 역학 조사 vivo에서 고정 없이 해야 하는 경우에 특히 유용. 그림 5 는 비행 TransgeneOme (fTRG) 도서관, Hu li tai shao (Hts)에서 endogenously 표현된 융해 단백질의 세 가지 예제-GFP (그림 5A, B), 중부-GFP (그림 5C, D)와 βTubulin60D-GFP ( 그림 5E, F). 이 단백질의 표현은 자연스럽 게 그들을 표현 하는 모든 조직에서 공부 될 수 있다. 여기, 우리가 보여줍니다 흉부 상피 (그림 5AC, E) 및 간접 비행 근육 또는 그들의 첨부 파일 사이트 (그림 5BD, F) 예제로.
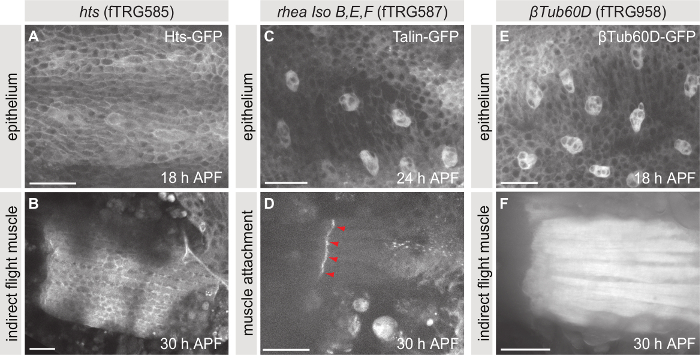
그림 5: 단백질 태그 endogenously의 라이브 영상. (A, B) Z-스택 pupae 표현 Hts GFP의 촬영의 최대 계획. (C, D) Z-스택 pupae 표현 중부 GFP의 촬영의 최대 계획. (E, F) Z-스택 βTubulin60D GFP를 표현 하는 번데기의 촬영의 최대 계획. 패널 A, C와 E 각각, 18, 24와 18 h APF, 흉부 상피를 표시 하 고 패널 B, D 및 F 간접 비행 근육 또는 그들의 첨부 파일 사이트 30 h APF에서 표시. 스케일 바는 25 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
제시 프로토콜 설명 하는 방법을 생활에 근육-힘 줄 morphogenesis 이미지 초파리 번데기 붙일 태그가 단백질의 다양 한을 사용 하 여. 이 비보에 이미징 전략 연구 개발 프로세스 전체 유기 체의 그들의 자연 환경에서 사용할 수 있습니다.
그것은 분석을 올바른 발달 시간 지점을 찾는 성공적인 실험에 대 한 중요 합니다. 예를 들어 dorsolongitudinal 간접 비행 근육 복 부 근육 나중 개발 30 및 40 h APF26사이 에서만 양쪽 끝에 연결 하는 동안 ≈16 h APF23 에서 그들의 힘 줄 대상에 첨부 파일을 시작 합니다. 따라서, 이전에 게시 문학 분석 개발의 적절 한 시기 포인트를 찾는 데 사용 해야 합니다 또는 조직 또는 관심의 구조 전에 자세히 공부 하지는 전체 개발 먼저 특징 있다.
맞춤식 플라스틱 슬라이드에 성공적으로 장착 pupae, 홈 적당 한 크기는 중요 하다: 홈 필요가 1.0-1.5 m m 넓고 0.3-0.4 m m 깊은. 이 깊이 필요에 따라 스페이서 coverslips와 최고 coverslip 정확한 거리를 조정 수 있습니다. 그러나, 적어도 하나의 공백 coverslip 모 세관 힘에 의해 배출 샘플에서 50% 글리세롤을 피하기 위해 사용 되어야 한다. 홈에 번데기의 정확한 위치 및 약간 경험의 구조는 coverslip에 가능한 한 가까이 되도록 최적화 되어야 합니다 필요 합니다.
Pupae의 많은 수는 한 현미경 세션에서 이미지를 경우, 그들은 수 모두 미리 탑재 되며 적절 한 발달 타이밍을 보장 하기 위해 이미징까지 인큐베이터에 저장 됩니다. 번데기 전체 절차 생존과 또한 적어도 영상 후 슬라이드에 보관 하는 경우 eclose를 하려고 한다. 생존 율 이미징 조건 번데기 손상 여부를 확인 하는 판독으로 사용할 수 있습니다.
영상 설정 실험 요구 사항에 따라 신중 하 게 선택 되어야 한다. 단기 영화에 대 한 높은 신호 대 잡음 비율에 대 한 높은 프레임 속도 상대적으로 높은 레이저 전원 번데기를 너무 많이 손상 없이 사용할 수 있습니다 하는 동안 균형 필요 합니다. 그러나, 장기 영화, 레이저 파워는 적당 한 수준에서 유지 되는 및 번데기 하지 오히려 점에서 특정 시간 마다 20 분 예를 들어 지속적으로 촬영 한다. 관심의 구조 보기의 필드 밖으로 이동 하지 않습니다 있도록 시간 점 사이 z 스택 위치를 재조정 하는 데 필요한 수 있습니다. 우리의 지식, 번데기 케이스의 오프닝 라기보다 미치지 않습니다 개발 타이밍. 그러나, 온도 제어 단계 장기 영화에 대 한 적절 한 발달 타이밍을 보장 하기 위해 사용 되어야 한다. 마음에 이러한 고려를 유지, 매우 유익한 영화 취득 될 수 있다.
근육-힘 줄 morphogenesis 뿐만 아니라 다른 개발 조직, 예를 들어 날개 상피29를 시각화 하 여 프로토콜을 사용할 수 있습니다. 이 프로토콜에 대 한만 세 수정이 필요: (1) 흉부 또는 복 부 대신 날개 위에 번데기 케이스의 열기, (2) 위치 최고 coverslip 및 (3) 날개와 번데기의 다른 형광 마커 단백질의 사용. CRISPR/Cas9-기술의 진보와 함께 더 많은 endogenously 태그 형광 단백질 가능할 것 이다, 그것은 되었다 초파리30,31 생 loci를 대상으로 더 간단 하기 때문에 , 32. 미래,이 수많은 단백질, 세포 조직과 전체 세부 사항에 그들의 생리 적인 환경에서의 역학 elucidating 있게 됩니다.
공개
저자는 공개 없다.
감사의 말
우리 영화 s 3의 인수에 대 한 마 뉴 엘라 Weitkunat 감사합니다. 우리는 관대 한 지원에 대 한 라인 Fässler에 감사입니다. 이 작품으로는 EMBO 영 조사 프로그램 (F.S.), 유럽 연합의 7 차 프레임 워크 프로그램 (FP/2007-2013) 아래 유럽 연구 위원회 지원 / ERC 그랜트 310939 (F.S.), 최대 Planck 학회 (S.B.L., F.S.), 센터 국립 드 라 검색 사이언스 (CNRS) (F.S.), 우수 이니셔티브 Aix 마 르 세 이유 대학 AMIDEX (F.S.), LabEX 알려 (F.S.)과 Boehringer 인 겔 하 임 Fonds (S.B.L.).
자료
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Leica | MZ6 | product has been replaced by Leica M60 |
| fly food in bottles (or vials) | - | - | standard culture medium |
| paint brush | da Vinci | 1526Y | size 1 |
| microscope slides | Thermo Scientific | VWR: 631-1303 | 76 x 26 mm |
| double-sided tape (optional) | Scotch | 6651263 | 12 mm x 6.3 m |
| petri dishes | Greiner Bio-One | 632102 | 94 x 16 mm |
| paper tissues | Th.Geyer | 7695251 | |
| forceps #5 (Dumont, inox, standard) | Fine Science Tools | 11251-20 | 0.1 mm x 0.06 mm tip |
| forceps #5 (Dumont, inox, biology grade) | Fine Science Tools | 11252-20 | 0.05 mm x 0.02 mm tip |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | straight tip |
| plastic slides with a groove (reusable) | custom-built | - | 75 x 26 x 4 mm plexi glass slide with 1.0-1.5 mm wide and 0.3-0.4 mm deep groove |
| coverslips | Marienfeld | 107032 | 18 x 18 mm, No. 1.5H |
| glycerol | Sigma-Aldrich | 49781 | dilute to 50 % in water |
| adhesive tape | Tesa | 57370-02 | 1.5 mm x 10 m |
참고문헌
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. P. Natl. Acad. Sci. USA. 98 (26), 15050-15055 (2001).
- Venken, K. J. T., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat. Meth. 8 (9), 737-743 (2011).
- Sarov, M., et al. A genome-wide resource for the analysis of protein localisation in Drosophila. eLife. 5, e12068 (2016).
- Ranganayakulu, G., Schulz, R. A., Olson, E. N. Wingless signaling induces nautilus expression in the ventral mesoderm of the Drosophila embryo. Dev. Biol. 176 (1), 143-148 (1996).
- Roy, S., Raghavan, K. V. Homeotic genes and the regulation of myoblast migration, fusion, and fibre-specific gene expression during adult myogenesis in Drosophila. Development. 124 (17), 3333-3341 (1997).
- Bryantsev, A. L., Baker, P. W., Lovato, T. L., Jaramillo, M. S., Cripps, R. M. Differential requirements for Myocyte Enhancer Factor-2 during adult myogenesis in Drosophila. Dev. Biol. 361 (2), 191-207 (2012).
- Gordon, S., Dickinson, M. H. Role of calcium in the regulation of mechanical power in insect flight. P. Natl. Acad. Sci. USA. 103 (11), 4311-4315 (2006).
- Jin, H., et al. Genome-Wide Screens for In Vivo Tinman Binding Sites Identify Cardiac Enhancers with Diverse Functional Architectures. PLoS Genet. 9 (1), e1003195 (2013).
- Chen, E. H., Olson, E. N. Antisocial, an intracellular adaptor protein, is required for myoblast fusion in Drosophila. Dev. Cell. 1 (5), 705-715 (2001).
- Clyne, P. J., Brotman, J. S., Sweeney, S. T., Davis, G. Green Fluorescent Protein Tagging Drosophila Proteins at Their Native Genomic Loci With Small P Elements. Genetics. 165 (3), 1433-1441 (2003).
- Katzemich, A., Liao, K. A., Czerniecki, S., Schöck, F. Alp/Enigma Family Proteins Cooperate in Z-Disc Formation and Myofibril Assembly. PLoS Genet. 9 (3), e1003342 (2013).
- Klapholz, B., et al. Alternative mechanisms for talin to mediate integrin function. Curr. Biol. 25 (7), 847-857 (2015).
- Schnorrer, F., Kalchhauser, I., Dickson, B. J. The transmembrane protein Kon-tiki couples to Dgrip to mediate myotube targeting in Drosophila. Dev. Cell. 12 (5), 751-766 (2007).
- Menon, S. D., Chia, W. Drosophila rolling pebbles: a multidomain protein required for myoblast fusion that recruits D-Titin in response to the myoblast attractant Dumbfounded. Dev. Cell. 1 (5), 691-703 (2001).
- Bloor, J. W., Kiehart, D. P. zipper Nonmuscle myosin-II functions downstream of PS2 integrin in Drosophila myogenesis and is necessary for myofibril formation. Dev. Biol. 239 (2), 215-228 (2001).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135 (4), 621-626 (2008).
- Hatan, M., Shinder, V., Israeli, D., Schnorrer, F., Volk, T. The Drosophila blood brain barrier is maintained by GPCR-dependent dynamic actin structures. J. Cell Biol. 192 (2), 307-319 (2011).
- Lee, T., Luo, L. Mosaic Analysis with a Repressible Cell Marker for Studies of Gene Function in Neuronal Morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Roy, S., Huang, H., Liu, S., Kornberg, T. B. Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science. 343 (6173), 1244624 (2014).
- Förster, D., Luschnig, S. Src42A-dependent polarized cell shape changes mediate epithelial tube elongation in Drosophila. Nat. Cell Biol. 14 (5), 526-534 (2012).
- Weitkunat, M., Schnorrer, F. A guide to study Drosophila muscle biology. Methods. 68 (1), 2-14 (2014).
- Weitkunat, M., Kaya-Çopur, A., Grill, S. W., Schnorrer, F. Tension and force-resistant attachment are essential for myofibrillogenesis in Drosophila flight muscle. Curr. Biol. 24 (7), 705-716 (2014).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. eLife. 4, e08519 (2015).
- Etournay, R., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Weitkunat, M., Brasse, M., Bausch, A. R., Schnorrer, F. Mechanical tension and spontaneous muscle twitching precede the formation of cross-striated muscle in vivo. Development. 144 (7), 1261-1272 (2017).
- Sellin, J., Albrecht, S., Kölsch, V., Paululat, A. Dynamics of heart differentiation, visualized utilizing heart enhancer elements of the Drosophila melanogaster bHLH transcription factor Hand. Gene Expr. Patterns. 6 (4), 360-375 (2006).
- Lemke, S. B., Schnorrer, F. Mechanical forces during muscle development. Mech. Develop. 144 (Pt A), 92-101 (2017).
- Classen, A. -. K., Aigouy, B., Giangrande, A., Eaton, S. Imaging Drosophila pupal wing morphogenesis. Methods Mol. Biol. 420, 265-275 (2008).
- Gratz, S. J., et al. Genome engineering of Drosophila with the CRISPR RNA-guided Cas9 nuclease. Genetics. 194 (4), 1029-1035 (2013).
- Zhang, X., Koolhaas, W. H., Schnorrer, F. A versatile two-step CRISPR- and RMCE-based strategy for efficient genome engineering in Drosophila. G3. 4 (12), 2409-2418 (2014).
- Port, F., Chen, H. -. M., Lee, T., Bullock, S. L. Optimized CRISPR/Cas tools for efficient germline and somatic genome engineering in Drosophila. P. Natl. Acad. Sci. USA. 111 (29), E2967-E2976 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유