Method Article
体内运动神经元变性小鼠前肢肌作用电位的电生理测量
摘要
神经传导的测量是评价变性小鼠模型的有用工具, 但它通常只用于刺激后肢的坐骨神经。在这里, 我们描述了一个技术, 以测量在体内的复合肌肉动作电位 (CMAP) 的小鼠前肢肌肉支配的臂丛神经。
摘要
评估神经轴突的功能提供了有关神经肌肉紊乱进展的详细信息。电生理记录提供了一种敏感的方法来测量神经传导的人和啮齿动物模型。为拓宽小鼠肌电图的技术可能性, 本文介绍了用针电极测量前肢臂丛神经的复合肌动作电位 (CMAPs)。CMAP 的录音后, 刺激坐骨神经在后肢曾被描述。新引入的方法允许在额外的站点上对神经电导率进行评估, 从而提供了对神经肌肉功能的更深刻的概述。该技术提供了有关功能轴突的相对数目和髓鞘形成水平的信息。因此, 该方法可用于评估轴索疾病和脱髓鞘的条件。这种微创方法不需要提取神经, 因此它适用于对同一动物进行纵向随访的重复测量。类似的录音是在临床设置, 以强调翻译相关性的方法。
引言
电生理学作为诊断工具, 在神经肌肉紊乱, 如运动神经元紊乱, plexopathies, 神经病, 神经肌肉连接紊乱, 和肌病。肌萎缩侧索硬化 (ALS), 其中主要是运动神经元受影响, 轴突损伤和肌肉麻痹1反映在减少 CMAP 振幅的神经传导研究 (NCS)。在夏科-玛丽牙病 (中) 轴突变性和脱髓鞘可以估计在周围神经使用2。该技术可用于确认诊断和评估疾病进展3,4。它能从动作电位振幅5的大小和脱髓鞘的程度来推断轴突病理, 从而降低传导速度、延长远端延迟或传导阻滞。6。
CMAP 测量是评价人和小鼠神经传导的一种快速、灵敏的方法。而在患者中, 在不同的地点例行执行的 CMAP 记录不同的神经和肌肉, 在小鼠, 通常只做了坐骨神经评估神经功能的后肢。然而, 在一些动物研究中, 记录 CMAP 在前-和后肢都是有利的, 例如, 遵循 ALS 和后肢之间的差异性疾病进展的小鼠模型。
本文介绍了用针电极记录小鼠前肢的 CMAPs 的方法。此外, 我们提供了一种方法来测量 CMAPs 从后肢, 同样与针电极。对后肢与环形电极 CMAPs 的测量, 已经提出了7,8。使用针电极记录 CMAPs 是一种快速的测量方法, 它不需要剃须毛皮, 并且测量后和前肢的过程只需要10分钟每动物为一位老练的研究员。此外, 这种微创方法是可行的重复测量, 以允许纵向随访的多神经的动物。
研究方案
根据库鲁汶大学的指导方针和相关的欧洲准则 (欧洲联盟指令 2010/63/欧盟的动物实验), 所有动物都被安置在标准条件下。所有动物实验均由库鲁汶地方伦理委员会批准。
1. 动物制剂和麻醉
- 用异氟醚/氧吸入诱导小鼠麻醉。使用4% 的异氟醚诱导麻醉和2-3% 的维护在2.5 升/分钟的氧气流量。根据老鼠的情况, 调整异氟醚的麻醉维护率,即小鼠和弱老鼠所需的麻醉剂较少。确认适当的麻醉,例如, 对后肢步行垫施加轻度压力, 检查是否有疼痛戒断反射。
- 用恒温加热板在37摄氏度控制小鼠体温, 防止麻醉时体温降低。
- 将鼠标与 nosecone 配合以维护麻醉。确保动物有足够的氧气通过检查 nosecone 不阻断呼吸道和动物呼吸稳定。
- 在录音过程中, 通过观察呼吸速度 (大约1赫兹麻醉) 和缺乏在轻度压力下的退缩反射来监测老鼠是否有足够的麻醉。如果麻醉不够深, 手动增加异氟醚浓度。
- 测量后, 让鼠标在加热板或红外线灯的温暖状态下恢复, 直到它恢复了足够的意识维持胸骨卧床, 大约2-5 分钟。不要让鼠标无人看管, 在其他老鼠的陪伴下, 直到它完全从麻醉中恢复。
2. CMAP 在后肢和前肢中的测定
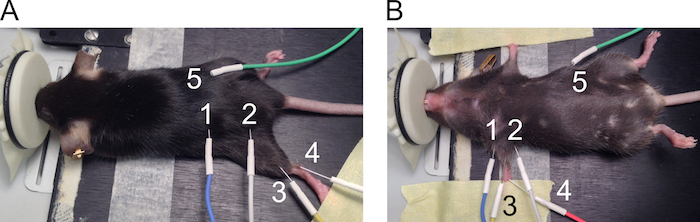
图1。CMAP 测量电极的定位.电极的位置显示后 (A) 和前肢 (B)。电极编号如下: 1: 阳极和 2: 阴极刺激电极, 3: 有源记录电极, 4: 参考电极, 和 5: 接地电极。请单击此处查看此图的较大版本.
- 使用 27 G 针电极为后肢和前肢 CMAP 测量。有关电极定位的推荐位置, 请参见图 1 。
- 将电极放置在后肢上, 如下所示。
- 将鼠标放在加热垫上的俯卧位置。在膝部伸展后肢, 用胶带将爪子附着在工作表面上 (图 1A)。
- 将刺激电极置于坐骨神经凹槽两侧, 距离约2厘米 (1 = 阳极和 2 = 阴极) 在电极之间。提起皮肤, 垂直插入针通过皮肤, 并推动约5毫米的针在皮肤下不刺穿底层肌肉。
- 同样, 放置记录电极 (3) 皮下对齐腓肠肌。将参考电极 (4) 插入到跟腱的30度角上, 并在皮肤下留下2-5 毫米针。将接地电极 (5) 以类似于刺激电极的方式放置在鼠标侧面, 但该电极的位置对测量不重要。
- 将电极放在前肢上, 如下所示。
- 将鼠标放在仰卧位置的加热垫上, 使用胶带将两个前肢伸展到身体两侧 (图 1B)。
- 将刺激电极 (1 = 阳极和 2 = 阴极) 置于前肢两侧, 与臂丛神经对齐。提起皮肤, 垂直插入针通过皮肤, 并推动约5毫米的针在皮肤下不刺穿底层肌肉。
- 将记录电极 (3) 置于二头肌肌肌肉的顶部, 解除皮肤。将参考电极 (4) 放在3毫米深度的步行垫上, 30 度角。将接地电极 (5) 置于鼠标侧面。
注意: 在这个设置中, 电极彼此接近。防止电极接触对方, 因为这扭曲了录音。
3. 数据采集
- 通过推动控制器单元中的经常性刺激按钮启动刺激, 并转动强度控制器旋钮来增加刺激。刺激所有轴突使用1脉冲/秒与0.1 毫秒的刺激期。从软件的下拉菜单中选择正确的频率和持续时间。
- 要达到 supramaximal 刺激 (5-20 ma; 在脱髓鞘条件高达 60 ma), 应用增加的刺激通过转动强度控制器旋钮, 直到 CMAP 反应的振幅停止增加。从那里, 进一步增加刺激 20%, 以确保 CMAP 振幅已达到其最大的反应。通过再次推动经常性刺激按钮结束刺激。
- 使用 "标记" 工具指示记录中的以下点: 启动刺激、启动响应、最大正峰值和最大负峰值 (图 2)。
- 确定延迟 (ms) 作为启动刺激到响应启动的延迟 (图 2)。将响应的起始定义为振幅开始增加的最早点。利用潜伏期评估轴突中的脱髓鞘。
- 测量振幅 (mV) 从最大负到最大正峰值 (图 2)。利用振幅的大小来关联功能轴突的数目。
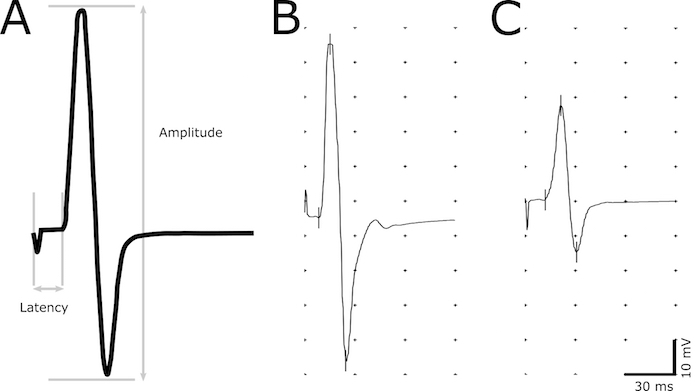
图2。CMAP 反应的代表形象.描述性 CMAP 响应, 指示用于计算振幅和滞后时间的点 (A)。延迟取决于从刺激到 CMAP 反应开始的延迟。从最大负到双相波最大正峰值, 测量峰值振幅。一种健康的非转基因动物 (B) 和患病动物, 具有长时间潜伏期和减少振幅 (C) 的典型记录。请单击此处查看此图的较大版本.
- 由于电极的精确放置会影响记录的结果值, 用 supramaximal 刺激替换电极并测量同一神经三次, 以确保获得最大的响应。使用录音的平均值。
结果
CMAPs 的电生理测量是一种微创和非常敏感的方法, 随着时间的推移神经肌肉功能。这里描述的技术允许对小鼠前肢神经传导进行评估, 从而提供对神经功能的洞察力。
CMAP 振幅和潜伏期的测量从后和前肢在疾病过程中的两个小鼠模型的 ALS, SOD1-G93A9和PrP-hFUS-WT3 10 (图 3), 并在一个小鼠模型, C61-PMP2211,12(图 4)。als 小鼠模型是通过过度表达 als 相关的人类基因, 即突变SOD1或野生型FUS。在这两种模型中, 小鼠发育肌萎缩, 类似于渐进性运动神经元变性导致瘫痪。在非转基因 littermate 控制中, 后肢和前肢的 CMAP 振幅没有随时间变化 (图 3A)。另一方面, SOD1-G93A 小鼠后肢坐骨神经的 CMAP 振幅显著下降, 甚至在60天左右症状出现前 (而第一个运动症状通常在三月的年龄被观察到)13.该年龄在非转基因 (非 tg) 窝的振幅为 90 mV, 而 SOD1-G93A 小鼠则只有 30 mv。随着疾病进展到150天的晚期症状阶段, 振幅的进一步下降幅度只有最小。与后肢坐骨神经相比, 前肢臂丛神经的 CMAP 振幅下降, 从而导致轴突退化。在前肢中, 随着 CMAP 振幅从 70 mv 降低到 30 mv, 在这些小鼠的运动缺陷显示之前和之后, 疾病进展也更加明显。
在 ALS 的 PrP-hFUS-WT3 小鼠模型中, 运动缺陷的发生大约在28天10岁时开始, 这与 CMAP 振幅下降的起始相重合。这是一个更加速的疾病模型, 因为小鼠接近结束阶段大约在65天的年龄。与前肢臂丛神经相比, 后肢坐骨神经的 CMAP 振幅下降较快, 表明后肢早期轴突变性 (图 3D)。这一观察支持这两种小鼠模型的临床观察, 因为后肢的瘫痪明显早于在疾病过程后期仍能正常工作的前肢。
一般来说, 与后肢相比, 前肢的潜伏期从刺激到启动的时间较短 (图 3B, E)。这仅仅是由于刺激和记录电极之间的距离较短。延迟提供了轴突的髓鞘形成水平的指示。我们的观察是, CMAP 潜伏期是延长在疾病进展中的小鼠模型的 als, 虽然 als 不是脱髓鞘疾病。这很可能是由于失去了更大, 更快的导电马达轴突。
C61-PMP22 小鼠 overexpressing 3-4 份人类 PMP22 和杂合子小鼠重述了一个非常温和的 CMT1A 疾病表型, 轻度脱髓鞘和减少 CMAPs, 但没有可见表型11,12。在 1.5-2 岁的 C61-PMP22 小鼠, CMAP 振幅减少, 潜伏期延长, 在后肢和前肢 (图 4)。与健康主题的记录相比, 显示的振幅和延迟响应的代表性记录分别在图 2C(B) 中列出。前肢的 CMAP 潜伏期不像后肢那样受影响。这与 CMT1A 患者是一致的, 因为更经常的患者有严重减少或无法察觉的 CMAPs 在下肢由于病理生理学性质的作为一个长度依赖性障碍14。此外, 疾病严重程度与 CMAP 振幅相关, 而不是潜伏期或传导速度, 因为振幅与轴突完整性的程度相关14,15。然而, 结果表明, 该方法对检测脱髓鞘过程 (如 CMT1A 中观察到的) 有足够的敏感性。
在非转基因组中, 振幅和潜伏期的变化率最低 (分别为变异系数2-15% 和 1-13%)。在所有转基因病例中, 测量值 (振幅8-51% 和潜伏期1-21% 的变异系数) 有更多的变化, 这很可能是由动物之间疾病进展的差异引起的。在所有情况下, 变异在后肢和前肢中都是相似的。针和表面电极的使用变化被报告为类似的16。
非转基因和 ALS 模型所需的刺激强度没有很大差异 (图 3C, F)。同样, 在这些病例中, 达到 supramaximal 刺激所需的刺激也类似于前-后肢和 5-12 mA 之间的变化。在 C61-PMP22, 增加刺激强度的要求得到了确认17 , 同样的表型在小鼠身上可见 (图 4C)。这种现象是由增加的电阻阻抗从肥厚的 endoneurial 改变17。
为了证实从前肢中记录的 CMAP 振幅是由于神经刺激而非肌肉刺激, 我们在5月大的非转基因 C57BL/6Jax 小鼠 (男性和女性) 的臂丛神经上进行了单侧部分切断 (图 5)。切断将 CMAP 振幅从 90 mv 降低到 20 mv, 表明大部分轴突在操作中断开。对侧前肢或后肢的振幅没有变化。这一结果强烈表明, 在二头肌肌中检测到的反应是由于神经刺激, 并没有导致肌肉刺激。
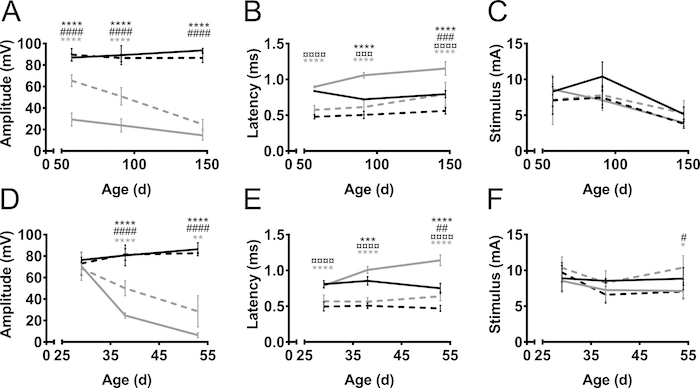
图3。CMAP 的振幅, 潜伏期, 和必要的刺激, 在疾病的过程中的后-和前肢的 ALS 小鼠模型.SOD1-G93A (AC) 和 PrP-hFUS-WT3 (d-F) 转基因 (tg) 小鼠和非转基因 (非 tg) 窝是在出现的运动症状, 在症状阶段, 并在疾病过程的晚症状阶段, 在年龄 57, 91, 147 天 (d) 或在 29, 38, 53 天为 SOD1-G93A 和 PrP-hFUS-WT3 小鼠, 分别。黑色: 非转基因后肢, 黑色虚线: 非转基因前肢, 灰色: 转基因后肢, 灰色虚线: 转基因前肢。结果表明, 在非转基因动物的后肢和前肢中, 振幅 (A、 D) 稳定。在转基因动物中, 在疾病过程中振幅下降。潜伏期 (B, E) 受此病影响较小, 并观察到后和前肢之间的主要差异, 无论基因型。所需刺激 (C、 F) 的变化在所有群体中都是极小的。对于 SOD1-G93A N = 4 在所有组除 tg 147 d, N = 3。对于年龄组29、38和53的 PrP-hFUS-WT3 小鼠, N 为非 tg 4、5和 4, 分别为 tg 7、5和3。符号表示组之间的差异如下: *: 非 tg 后肢与 tg, #: 非 tg 前肢与 tg 前肢, ¤: 非 tg 与非 tg 前肢, 灰 *: tg 与 tg 前肢。双路方差分析与 Tukey 的多比较测试, *: p < 0.05, **: p < 0.01, **: p < 0.001, ***: p < 0.0001. #: p < 0.05, #: p < 0.01, # #: p < 0.001, # #: p < 0.0001. ¤: p < 0.05, ¤¤: p < 0.01, ¤¤¤: p < 0.001, ¤¤¤¤: p < 0.0001。请单击此处查看此图的较大版本.
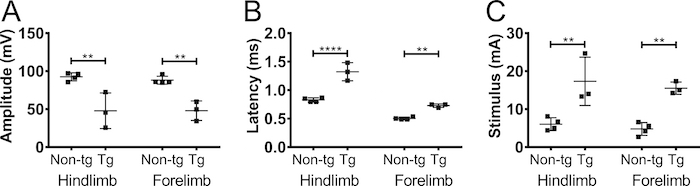
图4。CMAP 振幅, 潜伏期, 以及 CMT1A 小鼠后肢和前肢所需的刺激.C61-PMP22 转基因 (tg) 小鼠和非转基因 (非 tg) 窝测定了 1.5-2 岁。在转基因小鼠的后肢和前肢中, 振幅 (A) 均降低。在小鼠的所有肢体, 潜伏期 (B) 延长, 甚至在前肢的细微变化检测与此测量。C61-PMP22 小鼠对刺激强度 (C) 的要求增加, 与 CMT1A 患者的检测表型相似。结果为非 tg n = 4 和 tg n = 3 提供了平均值。双路方差分析与 Sidak 的多比较测试, **: p < 0.01, ***: p < 0.0001。请单击此处查看此图的较大版本.
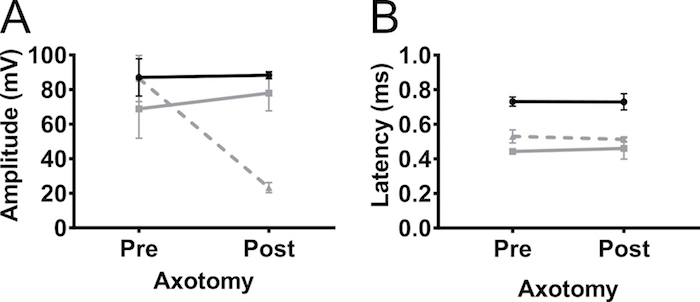
图5。前肢动作电位是由神经刺激引起的.为了排除观察到的 CMAP 反应是由肌肉刺激引起, (部分) 切断在臂丛神经上进行的可能性。CMAP 振幅 (A) 和潜伏期 (B) 记录在 (前) 和4天后 (后) 切断的臂丛神经在成年非转基因小鼠。切断减少了 CMAP 振幅, 表明反应是神经刺激引起的。黑色: 后肢, 灰色: 对侧前肢, 灰色虚线: 同侧前肢。结果显示为平均值 * SD, N = 2。请单击此处查看此图的较大版本.
讨论
敏感记录方法对于评估疾病进展, 特别是治疗神经元紊乱动物模型的疗效至关重要。确定 CMAPs 是一种微创的电生理技术, 它经常用于临床和实验设置, 以评估神经传导在神经肌肉和神经病理性疾病3,18。在这里, 我们描述了一个新的应用 CMAP 记录在小鼠, 以测量神经传导在臂丛神经的前肢。该方法允许对变性小鼠模型中的神经元功能进行更全面和详细的纵向评估。
针电极比环形电极稍具侵入性, 特别是在纵向研究中, 必须注意尽量减少组织损伤。方法的一个可能的缺点是导致损伤从刺穿神经或肌肉。然而, 在仔细的皮下放置电极后, 肌肉和神经的损伤和破坏是可以预防的。与使用环形电极的方法相比, 这里提出的方法不需要从身体的大部分部位刮毛。因此, 对体温的动物没有任何不适或影响。
电极的定位对于正确和一致的 CMAP 振幅和延迟记录至关重要。最好是重新定位电极, 并在每个站点执行三次测量, 以确认最大的刺激和响应是达到的。正确的录音应该产生双相曲线, 如图 2所示。为规范该方法, 无神经损伤的非转基因小鼠是建立合适的、一致的电极定位优化刺激的最佳模型。可复用针电极适用于重复使用, 如果他们定期消毒, 例如与戊二醛在动物之间20分钟, 并检查锐度。
在正常的成年小鼠中, 所记录的 CMAP 振幅在刺激坐骨神经和臂丛后通常为 80-100 mV。这比用环形电极测量的反应大得多, 因为产生 20-40 mV8、19、20结果的环形电极的皮肤产生了更高的阻抗。在 ALS 小鼠模型中, 刺激坐骨神经或臂丛神经麻痹后 CMAP 振幅降低到 10-30 mV。CMAP 振幅的大小在年轻的动物是小的, 因为 CMAP 振幅增加在发展期间21。
我们这里描述的方法在 ALS 的小鼠模型中特别有用, 其中神经支配和随后的运动缺陷发生在后肢的早期, 而不是前肢13。除神经支配外, 该方法还能检测到 CMAP 振幅的预防或减速下降的神经。症状发作年龄后肢肌肉 CMAP 振幅显著下降, 阻碍进一步疾病进展的随访;由于 CMAP 振幅在疾病的早期阶段达到极低的值, 在疾病过程中它们不会进一步减少。相比之下, 轴突丢失的进展, 在前肢臂丛神经的速度较慢, 并提出了一个更敏感的选择, 以测量疾病进展较长的时间的疾病。此外, 较不退化的前肢可以提供一个更有效的地点, 以评估旨在增强轴突功能的治疗方法。
显然, 所提出的技术为神经肌肉紊乱小鼠模型的表征提供了新的可能性。CMAP 从坐骨神经和臂丛中注射针电极的录音, 是一种快速、重现性的方法, 用于评估后肢和前肢的轴突丢失和脱髓鞘。该方法的灵敏度, 使检测轴突的缺陷, 甚至在显著的马达赤字可以记录, 从而使这些缺陷的早期量化。此外, 反复试验的可能性减少了所需动物的数量, 并详细概述了个别动物不同部位神经肌肉和神经病变疾病的进展情况。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了库鲁汶 ("开放未来" 和 C1), 科研基金 (FWO 住宿), 亨利 Latran 基金会, 杂色反疾病神经 Musculaires (ABMM), 肌肉萎缩症协会 (MDA), 和 als 协会和 als (比利时)。PVD 拥有 FWO-住宿的高级 investigatorship。RP 得到了来自中央治疗诊所 (CRC) 爱尔兰的赠款的支持, 目前得到爱尔兰国立大学和 FWO 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Resuable subdermal needle electrode, Pl/Ir | Technomed | TE/S61-434 | The Needle is 13 mm (0.51") in length, 0.4 mm (27G) in diameter |
| Natus electrodiagnostic system | Natus Neurology | UltraPro S100 | EMG device |
| Synergy | Natus Neurology | version 20.1.0.100 | EMG software for UltraPro S100 |
| Physitem Controller | Rothacher-Medical GmbH | TCAT-2LV | Heating pad |
| combi-vet Base Anesthesia System Digital Flowmeter with TEC 3 Vaporize | Rothacher & Partner | CV 30-301-D | Isoflurane Vaporizer and flowmeter |
| Iso-Vet 1000 mg/g | Piramal Healthcare UK Limited | AP/DRUGS/220/96 | Isoflurane |
| SOD1-G93A mice | The Jackson Laboratory | #002726 | ALS tg and non-tg control littermates, only females |
| PrP-hFUS-WT3 mice | The Jackson Laboratory | #017916 | ALS tg and non-tg control littermates, all groups balanced for males and females |
| C57BL/6Jax mice | The Jackson Laboratory | #000664 | Non-tg mice for axotomy, male and female |
| C61-PMP22 mice | Mouse line was generously donated by Prof. M. Sereda (The Max Planck Institute of Experimental Medicine, Göttingen, Germany). | CMT tg and non-tg control littermates, all groups balanced for males and females |
参考文献
- Brown, R. H., Al-Chalabi, A. Amyotrophic Lateral Sclerosis. N Engl J Med. 377 (2), 162-172 (2017).
- Prior, R., Van Helleputte, L., Benoy, V., Van Den Bosch, L. Defective axonal transport: A common pathological mechanism in inherited and acquired peripheral neuropathies. Neurobiol Dis. , 300-320 (2017).
- de Carvalho, M., et al. Electrodiagnostic criteria for diagnosis of ALS. Clin Neurophysiol. 119 (3), 497-503 (2008).
- Krajewski, K. M., et al. Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A. Brain. 123 (Pt 7), 1516-1527 (2000).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18 (4), 402-408 (1995).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19 (8), 946-952 (1996).
- Arnold, W. D., et al. Electrophysiological Motor Unit Number Estimation (MUNE) Measuring Compound Muscle Action Potential (CMAP) in Mouse Hindlimb Muscles. J Vis Exp. (103), (2015).
- Schulz, A., Walther, C., Morrison, H., Bauer, R. In vivo electrophysiological measurements on mouse sciatic nerves. J Vis Exp. (86), (2014).
- Gurney, M. E., et al. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Mitchell, J. C., et al. Overexpression of human wild-type FUS causes progressive motor neuron degeneration in an age- and dose-dependent fashion. Acta Neuropathol. 125 (2), 273-288 (2013).
- Robertson, A. M., et al. Comparison of a new pmp22 transgenic mouse line with other mouse models and human patients with CMT1A. J Anat. 200 (4), 377-390 (2002).
- Huxley, C., et al. Correlation between varying levels of PMP22 expression and the degree of demyelination and reduction in nerve conduction velocity in transgenic mice. Hum Mol Genet. 7 (3), 449-458 (1998).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Manganelli, F., et al. Nerve conduction velocity in CMT1A: what else can we tell. Eur J Neurol. 23 (10), 1566-1571 (2016).
- Cornett, K. M., et al. Phenotypic Variability of Childhood Charcot-Marie-Tooth Disease. JAMA Neurol. 73 (6), 645-651 (2016).
- Jacobson, W. C., Gabel, R. H., Brand, R. A. Surface vs. fine-wire electrode ensemble-averaged signals during gait. J Electromyogr Kinesiol. 5 (1), 37-44 (1995).
- Parker, V., Warman Chardon, J., Mills, J., Goldsmith, C., Bourque, P. R. Supramaximal Stimulus Intensity as a Diagnostic Tool in Chronic Demyelinating Neuropathy. Neurosci J. 2016, 6796270 (2016).
- Benoy, V., et al. Development of Improved HDAC6 Inhibitors as Pharmacological Therapy for Axonal Charcot-Marie-Tooth Disease. Neurotherapeutics. 14 (2), 417-428 (2017).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41 (6), 850-856 (2010).
- Srivastava, A. K., et al. Mutant HSPB1 overexpression in neurons is sufficient to cause age-related motor neuronopathy in mice. Neurobiol Dis. 47 (2), 163-173 (2012).
- Arnold, W. D., et al. Electrophysiological Biomarkers in Spinal Muscular Atrophy: Preclinical Proof of Concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。