Method Article
En Vivo Medición electrofisiológica de potencial de acción compuesto del músculo de las extremidades anteriores en modelos de ratón de la degeneración de la motoneurona
En este artículo
Resumen
La medición de la conducción nerviosa es una herramienta útil para evaluar modelos de neurodegeneración ratón pero es con frecuencia sólo se aplica para estimular el nervio ciático en miembros posteriores. Aquí, describimos una técnica para medir compuestos musculares potencial de acción (CMAP) en vivo en el ratón miembro anterior músculos inervados por el plexo braquial.
Resumen
Evaluar la funcionalidad del axón del nervio proporciona información detallada sobre la progresión de trastornos neuromusculares. Las grabaciones electrofisiológicas ofrecen un enfoque sensible para medir la conducción de los nervios en seres humanos y en modelos de roedores. Para ampliar las posibilidades técnicas de electromiografía en ratones, la medición de potenciales de acción compuestos del músculo (CMAPs) del nervio del plexo braquial en el miembro anterior utilizando electrodos de aguja se describe aquí. Grabaciones de CMAP después de estimular el nervio ciático en los miembros posteriores se han descrito previamente. El método recientemente introducido aquí permite la evaluación de la conductividad del nervio en un sitio adicional y proporciona así una visión más profunda de la funcionalidad neuromuscular. La técnica proporciona información sobre el número relativo de axones funcionales y el nivel de mielinización. Por lo tanto, este método puede ser aplicado para evaluar enfermedades axonales, así como condiciones desmielinizantes. Este método mínimamente invasivo no requiere la extracción del nervio y por lo tanto es adecuado para medidas repetidas para el seguimiento longitudinal en el mismo animal. Grabaciones similares se realizan en instalaciones clínicas para enfatizar la relevancia de la traslación del método.
Introducción
Electrofisiología se utiliza como una herramienta de diagnóstico en trastornos neuromusculares tales como trastornos de la motoneurona, plexopathies, neuropatías, trastornos de la Unión neuromuscular y miopatías. Esclerosis de lateral amiotrófica (ELA), en el que sobre todo las neuronas motoras se ven afectadas, el daño axonal y muscular parálisis1 se reflejan en la reducida amplitud CMAP en estudios de conducción nerviosa (NCS). En la enfermedad de Charcot-Marie-Tooth (CMT) se pueden estimar la degeneración axonal y desmielinización en los nervios periféricos con NCS2. Esta técnica puede utilizarse para confirmar el diagnóstico, así como para evaluar la progresión de la enfermedad3,4. NCS permite la valoración de la patología axonal, que se deduce de la magnitud del potencial de acción amplitud5, y el grado de desmielinización - que se traduce en velocidad de conducción menor, prolongadas latencias distales, o bloqueo de la conducción 6.
Medición de CMAP es un método rápido y sensible para evaluar la conducción nerviosa en los seres humanos y ratones. Mientras que en los pacientes el NCS se realizan rutinariamente en varios sitios para grabar los diferentes nervios y los músculos en los ratones, las mediciones de CMAP se hacen típicamente solamente para que el nervio ciático evaluar la funcionalidad del nervio en los miembros posteriores. Sin embargo, en algunos estudios en animales sería ventajoso registro CMAP en el fore - y posteriores, por ejemplo, para seguir la progresión de la enfermedad diferencial entre fore - y posteriores en modelos de ratón de ALS.
Aquí, presentamos un método para grabar CMAPs de las extremidades anteriores de los ratones utilizando electrodos de aguja. Además, ofrecemos un enfoque para medir CMAPs de miembros posteriores, asimismo con electrodos de aguja. La medición de la CMAPs de miembros posteriores con electrodos de anillo ha sido presentada antes de la7,8. La grabación de CMAPs utilizando electrodos de aguja es un método de medición rápido, no requiere rasurado de la piel y el procedimiento para la medición de los posteriores y extremidades anteriores toma sólo 10 minutos por animal para un investigador experimentado. Además, este acercamiento como mínimo invasor es factible para medidas repetidas permitir el seguimiento longitudinal de los nervios múltiples en animales.
Protocolo
Todos los animales fueron alojados bajo condiciones estándar según las directrices de la KU Leuven - Universidad de Lovaina y el asociado pautas europeas (Directiva 2010/63/Unión Europea para animales de experimentación). Todos los experimentos en animales fueron aprobados por el Comité ético local de la KU Leuven.
1. animal preparación y anestesia
- Inducir la anestesia en el ratón con la inhalación de oxígeno isoflurano. Utilizar 4% de isoflurano para la inducción de la anestesia y 2-3% para el mantenimiento a 2.5 L/min flujo de oxígeno. Ajustar el porcentaje de isoflurano para el mantenimiento de la anestesia según la condición del ratón, es decir, ratones pequeños y débiles requieren menos anestésicos. Confirmar anestesia adecuada p. ej., mediante la aplicación de presión suave a la trasera a pie almohadilla para comprobar la ausencia de un reflejo de retirada de dolor.
- Control de la temperatura del cuerpo del ratón usando una placa de calefacción termostático a 37 ° C para evitar la disminución de la temperatura corporal durante la anestesia.
- Ajuste el ratón con la nariz para el mantenimiento de la anestesia. Asegúrese de que el animal tiene suficiente suministro de oxígeno al comprobar que la ojiva no bloquea las vías respiratorias y que el animal respira constantemente.
- Durante la grabación, controlar si el ratón es suficientemente anestesiado observando la tasa de respiración (aproximadamente 1 Hz en anestesia) y la ausencia de un reflejo de retirada en la presión suave. Aumentar la concentración de isoflurano manualmente si la anestesia no es lo suficientemente profunda.
- Después de las mediciones, deje el ratón para recuperar la placa de calentamiento o en el calor de una lámpara infrarroja hasta que ha recuperado la conciencia suficiente para mantener el recumbency esternal, aproximadamente 2-5 minutos. No deje el ratón desatendida y en compañía de otros ratones hasta que ha recuperado de la anestesia.
2. medición de CMAP en miembros anteriores y posteriores
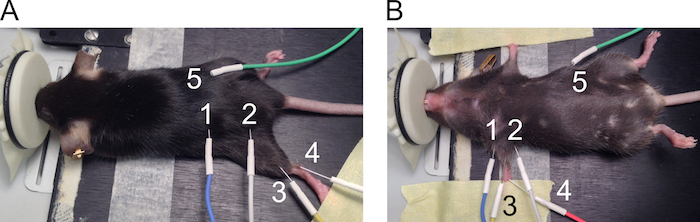
Figura 1. Colocación de los electrodos para la medición de la CMAP. Se presenta la posición de los electrodos posteriores (A) y miembros anteriores (B). Los electrodos se numeran como sigue: 1: ánodo y 2: cátodo de estimulación de electrodos, 3: electrodo de registro activo, 4: electrodo de referencia y 5: electrodo de tierra. Haga clic aquí para ver una versión más grande de esta figura.
- Usar los electrodos de aguja de 27 G para mediciones de CMAP trasera y miembro anterior. Vea la figura 1 para lugares recomendados de la colocación del electrodo.
- Coloque los electrodos en la trasera como sigue.
- Coloque el ratón sobre la almohada en la posición propensa. Extienda el miembro posterior en la rodilla y sujete la pata en la superficie de trabajo con cinta adhesiva (figura 1A).
- Coloque los electrodos estimulantes por vía subcutánea a ambos lados de la muesca ciática con una distancia de aproximadamente 2 cm (1 = ánodo y 2 = cátodo) entre los electrodos. Levantar la piel para insertar la aguja perpendicularmente a través de la piel y empuje aproximadamente 5 mm de la aguja bajo la piel sin perforar los músculos subyacentes.
- Del mismo modo, coloque el electrodo de la grabación (3) por vía subcutánea, alineando el músculo gastrocnemio. Insertar el electrodo de referencia (4) por vía subcutánea al lado del tendón de Aquiles en un ángulo de 30 grados y dejar 2-5 mm de la aguja bajo la piel. Coloque el electrodo de tierra (5) por vía subcutánea en el ratón de una manera similar como los electrodos estimulantes, pero la posición de este electrodo no es crítica para la medición.
- Coloque los electrodos en las extremidades anteriores como sigue.
- Coloque el ratón sobre la almohada en posición supina y cinta adhesiva de uso para ampliar ambas patas delanteras en los lados del cuerpo (figura 1B).
- Coloque los electrodos estimulantes (1 = ánodo y 2 = cátodo) por vía subcutánea a ambos lados de la extremidad delantera para alinear con el nervio del plexo braquial. Levantar la piel para insertar la aguja perpendicularmente a través de la piel y empuje aproximadamente 5 mm de la aguja bajo la piel sin perforar los músculos subyacentes.
- Coloque el electrodo de la grabación (3) por vía subcutánea en la parte superior del músculo del biceps-brachii levantando la piel. Coloque el electrodo de referencia (4) de las almohadillas a pie en profundidad de 3 mm en un ángulo de 30 grados. Coloque el electrodo de tierra (5) por vía subcutánea en el ratón.
Nota: Los electrodos están muy cerca uno del otro en esta configuración. Evitar que los electrodos tocan como esto distorsiona la grabación.
3. adquisición de datos
- Iniciar la estimulación pulsando el botón de estímulo recurrente en la unidad de control y gire la perilla del regulador de intensidad para aumentar el estímulo. Estimular todos los axones con 1 pulso/s de duración del estímulo de 0,1 ms. Seleccione la frecuencia correcta y la duración de menús desplegables en el software.
- Para llegar a estímulos supramaximal (5-20 mA; en demyelinating condiciones hasta 60 mA), aplicar estímulos aumento girando la perilla del regulador de intensidad hasta que la amplitud de la respuesta CMAP deja de aumentar. A partir de ahí, aumentar el estímulo en un 20% para garantizar que la amplitud CMAP ha alcanzado su máxima respuesta. Final la estimulación pulsando el botón de estímulo recurrente otra vez.
- Utilice la herramienta de marcador para indicar los siguientes puntos de la grabación: iniciación del estímulo, iniciación de la respuesta, el pico máximo positivo y el pico máximo negativo (figura 2).
- Determinar la latencia (en ms) como un retraso de la iniciación del estímulo a la iniciación de la respuesta (figura 2). La iniciación de la respuesta se define como el punto más temprano donde la amplitud comienza a aumentar. Utilice la latencia para evaluar desmielinización de los axones.
- Medida de la amplitud (mV) de la máxima negativa a pico máximo positivo (figura 2). Utilizar la magnitud de la amplitud para correlacionar el número de axones funcionales.
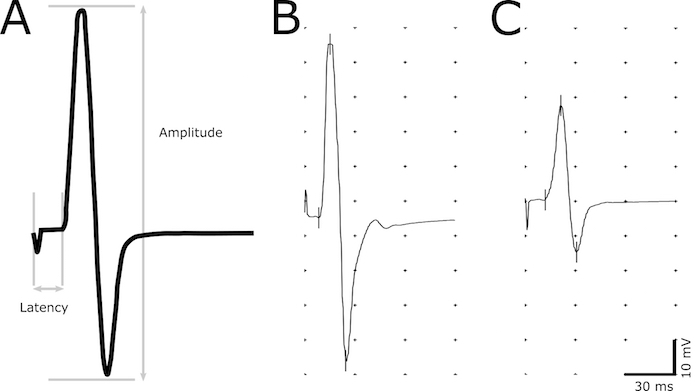
Figura 2. Imagen representativa de la respuesta CMAP. Una respuesta descriptiva del CMAP que indica los puntos utilizados para el cálculo de la amplitud y la latencia (A). Latencia es determinada por el retardo de la estimulación para el inicio de la respuesta CMAP. Amplitud pico a pico se mide desde el máximo negativo hasta el pico máximo positivo de la onda bifásica. Grabaciones representativas de un animal no-transgénicos saludable (B) y un animal enfermo con latencia prolongada y amplitud reducida (C). Haga clic aquí para ver una versión más grande de esta figura.
- Ya que la exacta colocación de los electrodos puede afectar el valor del resultado de la grabación, vuelva a colocar los electrodos y medir el mismo nervio por tres veces con estímulo supramaximal a garantizar la obtención de la respuesta mayor. Utilizar el medio de las grabaciones.
Resultados
Medidas electrofisiológicas de CMAPs utilizando electrodos de aguja es un método mínimamente invasivo y muy sensible para seguir la función neuromuscular con el tiempo. La técnica descrita aquí permite la evaluación de la conducción nerviosa de forelimb en ratones y por lo tanto, ofrece ideas sobre la funcionalidad del nervio.
El CMAP amplitudes y latencias se midieron de miembros anteriores y posteriores durante el curso de la enfermedad en dos modelos de ratón de ALS, SOD1 G93A9 y PrP-hFUS-WT310 (figura 3) y en un modelo de ratón de CMT, C61 PMP2211,12 (Figura 4). Modelos del ratón de ALS fueron creados por la sobreexpresión de genes humanos relacionados con ALS, es decir, ya sea mutado SOD1 o tipo salvaje FUS. En ambos modelos, los ratones desarrollan ALS que se asemeja a la degeneración progresiva de la motoneurona conduce a la parálisis. En los controles no transgénicos littermate, la amplitud CMAP hind - tanto de miembros anteriores no cambiaron con el tiempo (Figura 3A). Por otro lado, la amplitud CMAP del nervio ciático de la trasera fue disminuida ostensiblemente en los ratones de la SOD1 G93A, incluso antes de inicio de los síntomas alrededor de la edad de 60 días (mientras que los primeros síntomas del motor generalmente se observan en la edad de tres meses)13 . La amplitud fue 90 mV a esa edad en hermanos de camada no transgénicos (no-tg), mientras que en ratones de SOD1 G93A era sólo de 30 mV. Sólo había mínimo mayor caída en la amplitud como la enfermedad progresó a la etapa sintomática tardía a la edad de 150 días. La disminución en amplitud CMAP, y por lo tanto, la degeneración de los axones, se retrasó en el nervio del plexo braquial de los miembros anteriores en comparación con el nervio ciático de los miembros posteriores. En los miembros anteriores, la progresión de la enfermedad también era más sensible como el CMAP amplitud disminuida de 70 mV a 30 mV cuando se mide antes y después de la manifestación de los déficits motores en estos ratones.
En el modelo de PrP-hFUS-WT3 murino de esclerosis lateral amiotrófica, la aparición de déficit motor comienza aproximadamente a la edad de 28 días10, que coincide con el inicio de la disminución en la amplitud CMAP. Este es un modelo más acelerado de la enfermedad, como los ratones fase final aproximadamente a la edad de 65 días. La disminución de la amplitud CMAP ocurrió más rápidamente en el nervio ciático de la trasera en comparación con el nervio del plexo braquial en el forelimb, que indica una degeneración axonal antes en los miembros posteriores (figura 3D). Esta observación apoya la observación clínica en ambos de estos modelos de mouse como los miembros posteriores están paralizados en particular antes que las extremidades anteriores que permanecen funcionales hasta las últimas etapas del proceso de la enfermedad.
En general, la latencia de estímulo a la iniciación del potencial de acción era más corta en los miembros anteriores en comparación con posteriores (figura 3B, E). Esto es simplemente debido a la distancia más corta entre el estimulante y los electrodos de la grabación. La latencia proporciona una indicación del nivel de mielinización de los axones. Nuestra observación es que latencias CMAP se prolongan durante la progresión de la enfermedad en modelos de ratón de ALS, aunque no es una enfermedad desmielinizante. Esto es probablemente debido a la pérdida del más grande, más rápido realizar motor axons.
Los C61 PMP22 ratones overexpressing 3-4 copias de PMP22 humano y los ratones heterocigotos recapitulan un fenotipo de enfermedad CMT1A muy suave con leve desmielinización y CMAPs reducidas, pero con ningún fenotipo visible11,12. En 1.5-2 años de ratones de edad C61 PMP22, se reducen las amplitudes CMAP y latencias prolongadas en los miembros posteriores y extremidades anteriores (figura 4). Grabaciones representativas mostrando amplitud disminuida y una respuesta retrasada en comparación con una grabación de un sujeto sano se presentan en la figura 2B, respectivamente. Las latencias CMAP en los miembros anteriores no se ven afectadas tanto en los miembros posteriores. Esto es consistente con los pacientes de CMT1A, como más a menudo los pacientes tienen severamente reducidos o indetectables CMAPs en las extremidades inferiores debido a la naturaleza patofisiológica de CMT como un trastorno dependiente de la longitud14. Además, el grado de severidad de la enfermedad está correlacionado con la amplitud CMAP, en lugar de latencia o conducción velocidad, como las amplitudes se correlacionan con el grado de integridad axonal14,15. Sin embargo, los resultados indican que este método es lo suficientemente sensible para detectar desmielinizantes tales como los observados en CMT1A.
Variación en la amplitud y la latencia fue menor en los grupos no-transgénicas (coeficiente de variación 2-15% y el 1-13%, respectivamente). En todos los casos transgénicos, hubo más variación en las mediciones (coeficiente de variación de amplitud 8-51% y latencia 1-21%), que probablemente es causado por las diferencias en la progresión de la enfermedad entre los animales. En todos los casos, la variación fue similar en los miembros anteriores y posteriores. La variación en el uso de aguja y los electrodos de superficie se ha divulgado para ser similares16.
Las intensidades de estímulo requerido no variaron grandemente entre no-transgénicas y ALS modelos (figura 3, F). Además, el necesario estímulo a estímulo supramaximal en estos casos fue similar para la delantera - y posteriores y varió entre 5-12 mA. En CMT, el requisito para intensidades de estímulo creciente ha reconocido17 y el mismo fenotipo se observó en ratones C61 PMP22 (figura 4). El fenómeno ha sido explicado por la mayor impedancia eléctrica del endoneurial hipertrófica cambios17.
Para confirmar que la amplitud CMAP registrada de los miembros anteriores fue debido a la estimulación del nervio y no estimulación muscular, se realizó axotomía parcial unilateral en el nervio del plexo braquial en 5 meses no transgénicos C57BL/6Jax ratones (machos y hembras) ( Figura 5). Axotomía redujo la amplitud CMAP de 90 mV a 20 mV, lo que indica que la mayoría de los axones se desconectaron de la operación. No hubo cambios en la amplitud en el miembro contralateral anterior o en los miembros posteriores. Este resultado indica fuertemente que la respuesta detectada en biceps-brachii fue debido a la estimulación del nervio y no fueron consecuencia de la estimulación muscular.
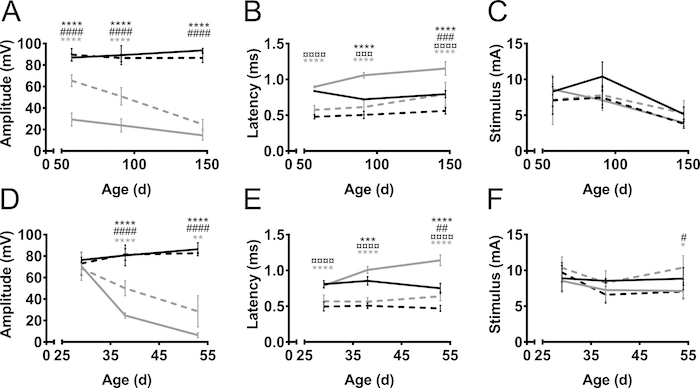
Figura 3. Amplitud CMAP, latencia y requiere estímulo sobre el curso de la enfermedad en el trasero y miembros anteriores en ELA ratón modelos. SOD1-G93A (A–C) y los ratones transgénicos (tg) PrP-hFUS-WT3 (FdeD–) y no-transgénicas hermanos de camada (no-tg) fueron medidos en el inicio de los síntomas motores, en la etapa sintomática y en la proceso de la fase tardía sintomática de la enfermedad, a edad 57 y 91 147 días (d) o a 29, 38 y 53 días para ratones SOD1 G93A y PrP-hFUS-WT3, respectivamente. Negro: Trasera no transgénicas, Negro rayado: miembro anterior no transgénicas, gris: transgénico trasera, gris discontinua: transgénico forelimb. Los resultados se presentan como media ± SD. Amplitudes (A, D) fueron estables en el tiempo en los animales no transgénicos tanto en miembros anteriores y posteriores. En animales transgénicos, amplitudes disminución durante el proceso de la enfermedad. Latencias (B, E) fueron menos afectados por la enfermedad y se observaron grandes diferencias entre traseras y patas delanteras, sin importar el genotipo. La variación en los estímulos necesarios (C, F) fue mínima en todos los grupos. SOD1 G93A n = 4 en todos los grupos excepto tg d 147, N = 3. Para PrP-hFUS-WT3 ratones en grupos de edad 29, 38 y 53, N es no-tg 4, 5 y 4 y tg 7, 5 y 3, respectivamente. Símbolos denotan la diferencia entre grupos como sigue: *: no tg trasera vs tg trasera, #: miembro anterior no tg y miembro anterior de tg, ¤: no tg trasera vs no-tg forelimb, gris *: tg trasera vs forelimb de tg. ANOVA de dos vías con Tukey del test de comparaciones múltiples, *: p < 0.05, **: p < 0.01, ***: p < 0.001, ***: p < 0.0001. #: p < 0.05, ##: p < 0.01, ###: p < 0.001, ### : p < 0.0001. ¤: p < 0.05, ¤¤: p < 0.01, ¤¤¤: p < 0.001, ¤¤¤: p < 0.0001. Haga clic aquí para ver una versión más grande de esta figura.
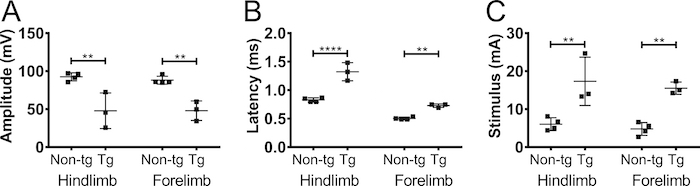
Figura 4. CMAP de amplitud, latencia y estímulo necesario en el trasero y miembros anteriores en ratones CMT1A. C61-PMP22 los ratones transgénicos (tg) y no-transgénicas hermanos de camada (no-tg) se midieron en 1.5-2 años de edad. Amplitud (A) se redujo en traseras y patas delanteras en ratones transgénicos. Latencia (B) fue prolongado en las extremidades en los ratones CMT y cambios incluso sutiles en miembros anteriores fue detectado con esta medida. Requisito para la intensidad del estímulo (C) se incrementó en C61 PMP22 ratones, que se asemeja al fenotipo detectado en pacientes de CMT1A. Los resultados se presentan como media ± SD, no tg n = 4 y tg N = 3. ANOVA de dos vías con Sidak de test de comparaciones múltiples, **: p < 0.01, ***: p < 0.0001. Haga clic aquí para ver una versión más grande de esta figura.
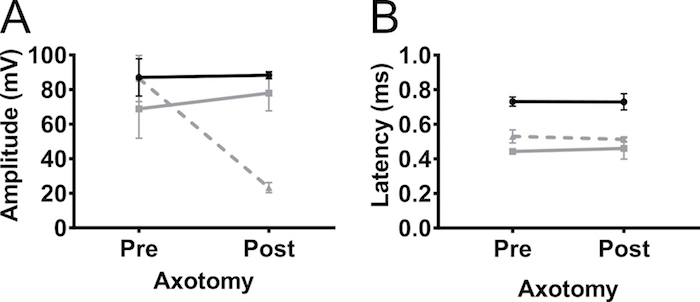
Figura 5. Potenciales de acción del miembro anterior son causados por estimulación nerviosa. Para excluir la posibilidad de que la respuesta observada del CMAP fue causada por la estimulación muscular, axotomía (parcial) fue realizada en el nervio del plexo braquial. Amplitud CMAP (A) y (B) la latencia se registraron antes (pre) y 4 días después (post) la axotomía del plexo braquial en adultos ratones no transgénicos. Axotomía disminuyó la amplitud CMAP que indica que la respuesta era debido a la estimulación del nervio. Negro: trasera, gris: forelimb contralateral, gris discontinua: miembro anterior ipsilateral. Los resultados se presentan como media ± SD, N = 2. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Métodos de grabación sensibles son esenciales para evaluar la progresión de la enfermedad y sobre todo la eficacia de una terapia en modelos animales de trastornos neuronales. Determinación de las CMAPs es una técnica electrofisiológica mínimamente invasiva, que se utiliza rutinariamente en las clínicas y en las configuraciones experimentales para evaluar la conducción nerviosa en los trastornos neuromusculares y neuropático3,18. Aquí, describimos una nueva aplicación para grabación en ratones para medir la conducción nerviosa en el nervio del plexo braquial de la extremidad delantera CMAP. El método presentado permite una evaluación longitudinal más versátil y detallada de la función neuronal en ratones modelos de neurodegeneración.
Los electrodos de aguja son un poco más invasivos que electrodos de anillo y sobre todo en estudios longitudinales se debe tener cuidado para reducir al mínimo daño tisular. Una posible desventaja del método es lesión resultante de la perforación de un nervio o músculo. Sin embargo, después de cuidadosa colocación subcutánea de los electrodos, la lesión y alteración de los músculos y los nervios pueden prevenirse. En contraste con el método utilizando electrodos de anillo, el método presentado aquí no requieren rasurado de la piel de las partes grandes del cuerpo. En consecuencia, no es ninguna molestia o efecto sobre la termorregulación del animal.
La colocación de los electrodos es fundamental para el registro correcto y consistente de la CMAP amplitudes y latencias. Es recomendable para volver a colocar los electrodos y a realizar dos o tres mediciones en cada sitio para confirmar que la máxima estimulación y las respuestas se logran. Grabaciones correcta deben producir curvas bifásicas como se muestra en la figura 2. Para estandarizar el método, ratones no transgénicos sin lesión de los nervios son los mejores modelos para establecer el electrodo apropiado y consistente para una óptima estimulación. Electrodos de aguja reutilizable están convenientes para el uso repetido si regularmente están esterilizadas, por ejemplo con glutaraldehído durante 20 minutos entre animales y examinado para nitidez.
En ratones adultos sanos, las amplitudes CMAP registradas con el método presentado son típicamente 80-100 mV después de estimular el nervio ciático y el plexo braquial. Esto es notablemente más grande que las respuestas medidas con electrodos de anillo, porque hay una mayor impedancia causada por la piel para los electrodos de anillo que produce resultados de 20-40 mV8,19,20. En modelos de ratón de ALS, las amplitudes CMAP después de la estimulación del nervio ciático o del plexo braquial en miembros paralizados disminuyen a 10-30 mV. La magnitud de la amplitud CMAP es menor en los animales jóvenes ya que la amplitud CMAP aumenta durante el desarrollo21.
El método que Describimos aquí es especialmente útil en modelos de ratón de ALS, en el que desnervación y posteriormente déficit motor, ocurre en los miembros posteriores que en los miembros anteriores13. Además de la denervación, el método podría detectar reinervación que se determina como impedida o retardada de la disminución en la amplitud CMAP. La dramática disminución en la amplitud CMAP en los músculos de los miembros posteriores ya en la edad de inicio de los síntomas dificulta el seguimiento de mayor progresión de la enfermedad; como la amplitud CMAP alcanza valores muy bajos en la etapa temprana de la enfermedad, no más disminuyen durante el proceso de la enfermedad. En cambio, la pérdida axonal avanza a un ritmo más lento en el nervio del plexo braquial de los miembros anteriores y presenta una opción más sensible para medir la progresión de la enfermedad sobre una duración más larga de la enfermedad. Por otra parte, los miembros anteriores menos degenerados podrían proporcionar un sitio más potente para la evaluación de enfoques terapéuticos que tienen como objetivo mejorar la función axonal.
Está claro que la técnica presentada proporciona nuevas posibilidades para la caracterización de ratón modelos de trastornos neuromusculares. Grabaciones de CMAP con electrodos de aguja desde el nervio ciático y el plexo braquial es un método rápido y reproducible para evaluar la pérdida axonal y demyelination en hind-así como en los miembros anteriores. La sensibilidad del método permite la detección de los déficit axonal incluso antes notable déficit motor puede ser grabado y así permite la cuantificación temprana de estos defectos. Además, la posibilidad de prueba repetida reduce el número de animales requeridos y proporciona una descripción detallada de la progresión de enfermedades neuromusculares y neuropáticas en diferentes sitios en un animal individual.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación ha sido apoyada por KU Leuven ('Abriendo el futuro' y C1), el fondo para la investigación científica Flanders (FWO-Vlaanderen), la Fundación de Letrán de Thierry, la Asociación Belge contre les males neuro-Musculaires (ABMM), la Distrofia Muscular Association (MDA), el y Asociación de ELA y la ELA Liga (Bélgica). PVD es un senior investigatorship de FWO-Vlaanderen. RP fue apoyado por subvenciones de la Irlanda de la clínica de recuperación Central (CRC) y se apoya en la actualidad la Universidad Nacional de Irlanda (NUI) y la FWO.
Materiales
| Name | Company | Catalog Number | Comments |
| Resuable subdermal needle electrode, Pl/Ir | Technomed | TE/S61-434 | The Needle is 13 mm (0.51") in length, 0.4 mm (27G) in diameter |
| Natus electrodiagnostic system | Natus Neurology | UltraPro S100 | EMG device |
| Synergy | Natus Neurology | version 20.1.0.100 | EMG software for UltraPro S100 |
| Physitem Controller | Rothacher-Medical GmbH | TCAT-2LV | Heating pad |
| combi-vet Base Anesthesia System Digital Flowmeter with TEC 3 Vaporize | Rothacher & Partner | CV 30-301-D | Isoflurane Vaporizer and flowmeter |
| Iso-Vet 1000 mg/g | Piramal Healthcare UK Limited | AP/DRUGS/220/96 | Isoflurane |
| SOD1-G93A mice | The Jackson Laboratory | #002726 | ALS tg and non-tg control littermates, only females |
| PrP-hFUS-WT3 mice | The Jackson Laboratory | #017916 | ALS tg and non-tg control littermates, all groups balanced for males and females |
| C57BL/6Jax mice | The Jackson Laboratory | #000664 | Non-tg mice for axotomy, male and female |
| C61-PMP22 mice | Mouse line was generously donated by Prof. M. Sereda (The Max Planck Institute of Experimental Medicine, Göttingen, Germany). | CMT tg and non-tg control littermates, all groups balanced for males and females |
Referencias
- Brown, R. H., Al-Chalabi, A. Amyotrophic Lateral Sclerosis. N Engl J Med. 377 (2), 162-172 (2017).
- Prior, R., Van Helleputte, L., Benoy, V., Van Den Bosch, L. Defective axonal transport: A common pathological mechanism in inherited and acquired peripheral neuropathies. Neurobiol Dis. , 300-320 (2017).
- de Carvalho, M., et al. Electrodiagnostic criteria for diagnosis of ALS. Clin Neurophysiol. 119 (3), 497-503 (2008).
- Krajewski, K. M., et al. Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A. Brain. 123 (Pt 7), 1516-1527 (2000).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18 (4), 402-408 (1995).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19 (8), 946-952 (1996).
- Arnold, W. D., et al. Electrophysiological Motor Unit Number Estimation (MUNE) Measuring Compound Muscle Action Potential (CMAP) in Mouse Hindlimb Muscles. J Vis Exp. (103), (2015).
- Schulz, A., Walther, C., Morrison, H., Bauer, R. In vivo electrophysiological measurements on mouse sciatic nerves. J Vis Exp. (86), (2014).
- Gurney, M. E., et al. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Mitchell, J. C., et al. Overexpression of human wild-type FUS causes progressive motor neuron degeneration in an age- and dose-dependent fashion. Acta Neuropathol. 125 (2), 273-288 (2013).
- Robertson, A. M., et al. Comparison of a new pmp22 transgenic mouse line with other mouse models and human patients with CMT1A. J Anat. 200 (4), 377-390 (2002).
- Huxley, C., et al. Correlation between varying levels of PMP22 expression and the degree of demyelination and reduction in nerve conduction velocity in transgenic mice. Hum Mol Genet. 7 (3), 449-458 (1998).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Manganelli, F., et al. Nerve conduction velocity in CMT1A: what else can we tell. Eur J Neurol. 23 (10), 1566-1571 (2016).
- Cornett, K. M., et al. Phenotypic Variability of Childhood Charcot-Marie-Tooth Disease. JAMA Neurol. 73 (6), 645-651 (2016).
- Jacobson, W. C., Gabel, R. H., Brand, R. A. Surface vs. fine-wire electrode ensemble-averaged signals during gait. J Electromyogr Kinesiol. 5 (1), 37-44 (1995).
- Parker, V., Warman Chardon, J., Mills, J., Goldsmith, C., Bourque, P. R. Supramaximal Stimulus Intensity as a Diagnostic Tool in Chronic Demyelinating Neuropathy. Neurosci J. 2016, 6796270 (2016).
- Benoy, V., et al. Development of Improved HDAC6 Inhibitors as Pharmacological Therapy for Axonal Charcot-Marie-Tooth Disease. Neurotherapeutics. 14 (2), 417-428 (2017).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41 (6), 850-856 (2010).
- Srivastava, A. K., et al. Mutant HSPB1 overexpression in neurons is sufficient to cause age-related motor neuronopathy in mice. Neurobiol Dis. 47 (2), 163-173 (2012).
- Arnold, W. D., et al. Electrophysiological Biomarkers in Spinal Muscular Atrophy: Preclinical Proof of Concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados