Method Article
In Vivo Elektrophysiologische Messungen der zusammengesetzten Muskel Aktionspotential aus die Vorderbeine in Maus-Modellen der Motor Neuron Degeneration
In diesem Artikel
Zusammenfassung
Die Messung der Nervenleitgeschwindigkeit ist ein nützliches Instrument zur Maus-Modellen der Neurodegeneration zu beurteilen, aber es ist häufig nur angewendet, um den Ischiasnerv im Hintergliedmaßen zu stimulieren. Hier beschreiben wir eine Technik, um zusammengesetzte Muskel Aktionspotential (CMAP) in Vivo in der Maus vordergliedmaße Muskeln innerviert den Plexus brachialis zu messen.
Zusammenfassung
Beurteilung der Funktionalität des Nerv Axons enthält detaillierte Informationen über das Fortschreiten der neuromuskulären Erkrankungen. Elektrophysiologische Aufnahmen bieten einen sensiblen Ansatz zur Messung der Nervenleitgeschwindigkeit bei Mensch und Nager-Modelle. Um die technischen Möglichkeiten der Elektromyographie bei Mäusen zu erweitern, ist die Messung der zusammengesetzten Muskel Aktionspotentiale (CMAPs) aus dem Plexus brachialis Nerven in der vordergliedmaße mit Nadelelektroden hier beschrieben. CMAP Aufnahmen nach Stimulierung der Ischiasnerv in Hintergliedmaßen sind bisher beschrieben worden. Die neu eingeführte Methode hier ermöglicht die Auswertung der Nerv Leitfähigkeit auf einen zusätzlichen Standort und bietet somit eine tiefere Übersicht über neuromuskuläre Funktionalität. Die Technik bietet Informationen über die relative Anzahl der funktionalen Axone und die Myelinisierung-Ebene. Dabei kann diese Methode angewendet werden, um axonalen Erkrankungen sowie demyelinisierende Bedingungen zu bewerten. Diese minimal-invasive Methode erfordert keine Extraktion des Nervs und eignet sich daher für wiederholte Messungen für längs-Follow-up im selben Tier. Ähnliche Aufnahmen erfolgen in klinischen Einrichtungen, die translationale Relevanz der Methode zu betonen.
Einleitung
Elektrophysiologie dient als diagnostisches Werkzeug in neuromuskulären Störungen wie Motoneuron-Erkrankungen, Plexopathies, Neuropathien, neuromuskulären Erkrankungen und Myopathien. Amyotrophe Lateralsklerose (ALS), in denen vor allem die motorischen Nervenzellen betroffen sind, sind die axonale Schädigung und Muskel Paralyse1 in reduzierten CMAP Amplituden auf Nerv Übertragung Studien (NCS) wider. Charcot-Marie-Tooth-Erkrankung (CMT) können axonale Degeneration und Demyelinisierung in peripheren Nerven mit NCS2geschätzt werden. Diese Technik kann verwendet werden für die Bestätigung der Diagnose als auch die Krankheit Fortschreiten3,4Bewertung. NCS ermöglichen die Abschätzung der axonale Pathologie, die von der Größenordnung des Aktionspotentials Amplitude5abgeleitet ist, und das Ausmaß der Demyelinisierung - führt zu reduzierten Leitgeschwindigkeit verlängert distalen Latenzen oder Wärmeleitung block 6.
CMAP-Messung ist eine schnelle und empfindliche Methode, Nervenleitgeschwindigkeit sowohl Menschen als auch Mäuse zu bewerten. Während bei Patienten der NCS an verschiedenen Standorten verschiedene Nerven und Muskeln, bei Mäusen, aufzeichnen routinemäßig durchgeführt werden erfolgt die CMAP-Messungen in der Regel nur für den Ischiasnerv Nerv Funktionalität in der Hintergliedmaßen zu beurteilen. Jedoch in einigen Tierversuchen wäre vorteilhaft zum Datensatz CMAP sowohl in der Vorder- und Hinterbeine, z. B. es, differenzielle Krankheitsprogression zwischen Vorder- und Hinterbeine in Mausmodellen ALS zu folgen.
Hier stellen wir eine Methode zur Erfassung von CMAPs aus die Vorderbeine von Mäusen mit Nadelelektroden. Darüber hinaus bieten wir einen Ansatz zur CMAPs von Hintergliedmaßen, ebenfalls mit Nadelelektroden zu messen. Die Messung der CMAPs von Hintergliedmaßen mit Ringelektroden wurde früher7,8vorgestellt. Die Aufnahme von CMAPs mit Nadelelektroden ist eine schnelle Messmethode, rasieren des Fells ist nicht erforderlich und das Verfahren zur Messung von Hind und Vorderbeine dauert nur 10 min pro Tier für ein erfahrener Forscher. Darüber hinaus ist diese minimal-invasive Ansatz für wiederholte Messungen ermöglichen längs-Follow-up von mehreren Nerven bei Tieren möglich.
Protokoll
Alle Tiere wurden unter normalen Bedingungen nach den Richtlinien der KU Leuven - Universität Leuven und den damit verbundenen europäischen Richtlinien (EU Richtlinie 2010/63/EU für Tierversuche) untergebracht. Alle Tierversuche wurden durch die lokale Ethikkommission der KU Leuven genehmigt.
(1) tierische Vorbereitung und Narkose
- Anästhesie in der Maus mit Isofluran/Sauerstoff-Inhalation zu induzieren. Verwenden Sie 4 % der Isofluran für die Induktion der Anästhesie und 2 bis 3 % für die Wartung bei 2,5 L/min Durchfluss von Sauerstoff. Passen Sie den Isofluran Prozentsatz für die Aufrechterhaltung der Narkose nach dem Zustand der Maus, d.h., klein und schwach Mäuse benötigen weniger Narkosemittel. Bestätigen Sie ausreichende Anästhesie z.B.durch leichten Druck auf die Megalosauridae walking Pad um die Abwesenheit von Schmerz Rückzug Reflex zu überprüfen.
- Steuern Sie die Maus Körpertemperatur mit einem thermostatischen Heizplatte bei 37 ° C, um die Abnahme der Körpertemperatur während der Narkose zu verhindern.
- Passen Sie die Maus mit der Nosecone für die Wartung der Narkose. Sicherstellen Sie, dass das Tier ausreichende Lieferung von Sauerstoff hat durch die Überprüfung, dass die Nosecone Airways nicht blockiert und das Tier stetig atmet.
- Während der Aufzeichnung überwachen Sie, ob die Maus ausreichend betäubt ist, durch die Beobachtung der Atemfrequenz (ca. 1 Hz in Narkose) und das Fehlen von ein Rückzug Reflex auf leichten Druck. Erhöhen Sie die Isofluran Konzentration manuell, wenn die Narkose nicht tief genug ist.
- Lassen Sie nach den Messungen die Maus, um auf die Heizplatte oder in der Wärme von einer Infrarotlampe zu erholen, bis es ausreichend Bewusstsein um sternalen liegen ca. 2-5 min. halten wiedererlangt hat. Lassen Sie die Maus nicht, unbeaufsichtigt und in der Gesellschaft von anderen Mäusen bis es vollständig aus der Narkose erholt hat.
2. Messung des CMAP Hind und Vorderbeine
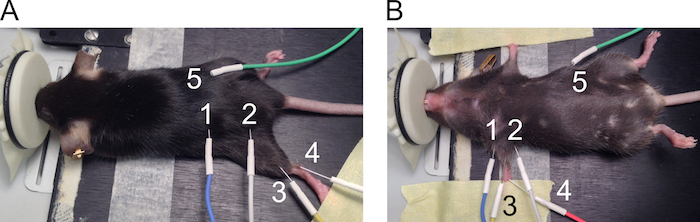
Abbildung 1: Platzierung der Elektroden für CMAP Messungen. Die Position der Elektroden wird für Hind-(A) und Vorderbeine (B) dargestellt. Die Elektroden sind wie folgt nummeriert: 1: Anode und 2: Kathode anregende Elektroden, 3: aktive Aufnahme Elektrode, 4: Bezugselektrode und 5: Erdung-Elektrode. Bitte klicken Sie hier für eine größere Version dieser Figur.
- 27 G Nadelelektroden für Megalosauridae und vordergliedmaße CMAP-Messungen verwendet werden. Siehe Abbildung 1 für empfohlene Orte der Elektrode Positionierung.
- Platzieren Sie Elektroden auf die Megalosauridae wie folgt.
- Platzieren Sie den Mauszeiger auf das Heizkissen in Bauchlage. Verlängern Sie die Megalosauridae am Knie zu und befestigen Sie die Pfote auf der Arbeitsfläche mit Klebeband (Abbildung 1A).
- Platzieren Sie die stimulierenden Elektroden subkutan auf beiden Seiten der sciatic Kerbe mit einem Abstand von ca. 2 cm (1 = Anode und 2 = Kathode) zwischen den Elektroden. Heben Sie die Haut um die Nadel senkrecht durch die Haut und drücken ca. 5 mm von der Nadel unter die Haut eingesetzt ohne Durchbohrung der darunter liegenden Muskeln.
- Ebenso legen Sie die Aufnahme Elektrode (3) den Gastrocnemius Muskel subkutan ausrichten. Legen Sie die Bezugselektrode (4) subkutan neben der Achillessehne in einem Winkel von 30 Grad und lassen Sie 2-5 mm Nadel unter die Haut. Ort der Masseelektrode (5) subkutan an der Seite der Maus in ähnlicher Weise wie die stimulierenden Elektroden, aber die Position dieser Elektrode ist nicht wichtig für die Messung.
- Platzieren Sie Elektroden auf die Vorderbeine wie folgt.
- Positionieren Sie den Mauszeiger auf das Heizkissen in der Rückenlage und Verwendung Klebeband, beide Arme an den Seiten des Körpers (Abbildung 1 b) zu verlängern.
- Platzieren Sie die stimulierenden Elektroden (1 = Anode und 2 = Kathode) subkutan auf beiden Seiten der vordergliedmaße an den Plexus brachialis Nerven ausgerichtet. Heben Sie die Haut um die Nadel senkrecht durch die Haut und drücken ca. 5 mm von der Nadel unter die Haut eingesetzt ohne Durchbohrung der darunter liegenden Muskeln.
- Legen Sie die Aufnahme-Elektrode (3) subkutan auf den Bizeps Brachii Muskel durch Anheben der Haut. Legen Sie die Bezugselektrode (4) auf den Fuß-Pads in 3 mm Tiefe in einem 30-Grad-Winkel. Platzieren Sie die Masseelektrode (5) subkutan an der Seite der Maus.
Hinweis: Die Elektroden sind in der Nähe von einander in diesem Setup. Verhindern Sie, dass Elektroden einander berühren, da dies die Aufnahme verzerrt.
3. Datenerfassung
- Starten Sie die Stimulation durch Knopfdruck wiederkehrenden Reiz in der Controller-Einheit und der Intensität Controller Drehknopf um den Reiz zu erhöhen. Stimulieren Sie alle 0,1 ms Impuls Dauer 1 Impuls/s mit Axone. Wählen Sie die richtige Frequenz und Dauer von Dropdown-Menüs in der Software.
- Supramaximalen Reize zu erreichen (5-20 mA; bei demyelinisierenden Bedingungen bis zu 60 mA), zunehmende Reize anwenden, indem die Intensität Controller Knopf drehen, bis die Amplitude der CMAP Antwort hört auf zu erhöhen. Von dort weiter erhöhen Sie den Reiz von 20 % um sicherzustellen, dass die CMAP-Amplitude die maximale Reaktion erreicht hat. Die Stimulation durch Knopfdruck wiederkehrenden Reiz wieder zu beenden.
- Das Marker-Tool verwenden, um die folgenden Punkte in der Aufnahme anzugeben: Einleitung eines Anregung, Einleitung der Reaktion, maximale positive Peak und maximale negative Peak (Abbildung 2).
- Bestimmen Sie die Latenz (in ms) als eine Verzögerung von der Anbahnung des Reizes auf die Einleitung der Reaktion (Abbildung 2). Definieren Sie die Einleitung der Reaktion als der früheste Zeitpunkt die Amplitude beginnt zu erhöhen. Verwenden Sie die Latenz, um Demyelinisierung in die Axone zu bewerten.
- Messen Sie die Amplitude (mV) von der maximalen negativen maximale positive Peak (Abbildung 2). Verwenden Sie die Größenordnung der Amplitude, um die Anzahl der funktionellen Axone korrelieren.
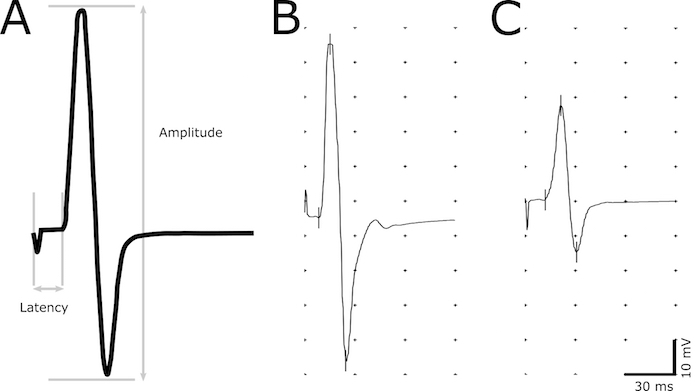
Abbildung 2: Repräsentatives Bild der CMAP Antwort. Eine beschreibende CMAP Antwort unter Angabe der Punkte, die für die Berechnung der Amplitude und Latenz (A). Wartezeit wird durch die Verzögerung von der Anregung zum Ausbruch der CMAP Antwort bestimmt. Spitze-Spitze-Amplitude wird von der maximalen negativen bis die maximale positive Höhepunkt der biphasischen gemessen. Repräsentative Aufnahmen von einem gesunden nicht-transgenen Tier (B) und einem erkrankten Tier mit längerer Wartezeit und reduzierter Amplitude (C). Bitte klicken Sie hier für eine größere Version dieser Figur.
- Da die genaue Platzierung der Elektroden den Ergebnis-Wert der Aufnahme beeinträchtigen kann, ersetzen Sie die Elektroden und den gleichen Nerv dreimal Messen mit supramaximalen Reiz um sicherzustellen, dass die größte Reaktion gewonnen wird. Verwenden Sie den Durchschnittswert der Aufnahmen.
Ergebnisse
Elektrophysiologische Messungen der CMAPs mit Nadelelektroden ist eine minimal-invasive und sehr empfindliche Methode neuromuskuläre Funktion im Laufe der Zeit zu folgen. Die beschriebene Technik kann hier die Beurteilung der vordergliedmaße Nervenleitgeschwindigkeit bei Mäusen und so Einblicke in die Funktionalität des Nervus.
Die CMAP Amplituden und Latenzen wurden von Hind und Vorderbeine während Krankheitsverlauf in zwei Mausmodellen Alsen SOD1-G93A9 und PrP-hFUS-WT310 (Abbildung 3), und in einem Mausmodell der CMT, C61-PMP2211,12 gemessen. (Abbildung 4). ALS Maus-Modellen entstanden durch Überexpression von ALS-menschlichen Genen, nämlich entweder SOD1 oder Wildtyp FUSmutierte. In beiden Modellen entwickeln Mäuse ALS ähnlich progressive Motor Neuron Degeneration führt zu Lähmungen. In nicht-transgenen stellt Steuerelemente änderte sich die CMAP-Amplitude der Hind und Vorderbeine nicht im Laufe der Zeit (Abbildung 3A). Auf der anderen Seite die CMAP Amplitude des Nervus ischiadicus aus der Megalosauridae war dramatisch gesunken in die SOD1-G93A Mäuse, auch vor Symptombeginn etwa im Alter von 60 Tagen (wobei die ersten motorischen Symptome in der Regel im Alter von drei Monaten eingehalten werden)13 . Die Amplitude war 90 mV in diesem Alter in nicht-transgenen (tg) wurfgeschwistern in SOD1-G93A Mäuse war es nur 30 mV. Gab es nur minimale weitere Abnahme der Amplitude mit fortschreitender Erkrankung zu symptomatisch spät im Alter von 150 Tagen. Der Rückgang der CMAP Amplitude und somit verzögerte sich die Degeneration der Axone, in den Plexus brachialis Nerven der Vorderbeine im Vergleich zu den Ischiasnerv aus der Hintergliedmaßen. In die Vorderbeine, das Fortschreiten der Krankheit war auch auffälliger als die CMAP Amplitude sank von 70 mV bis 30 mV wenn vor und nach der Manifestation der motorischen Defizite in diesen Mäusen gemessen.
Im Mausmodell PrP hFUS WT3 Alsen beginnt das Auftreten von motorischen Defizite etwa im Alter von 28 Tagen10, die mit dem Beginn des Niedergangs der CMAP-Amplitude zusammenfällt. Dies ist eine beschleunigte Krankheitsmodell wie die Mäuse Endstadium ungefähr im Alter von 65 Tagen erreichen. Der Rückgang der CMAP-Amplitude ereignete sich schneller in den Ischiasnerv die Megalosauridae im Vergleich zu den Plexus brachialis Nerven in der vordergliedmaße, einer früher axonalen Degeneration in den Hintergliedmaßen (Abbildung 3D) gibt an. Diese Beobachtung unterstützt die klinische Beobachtung beider diese Maus-Modellen vor allem früher als die Vorderbeine die Hinterbeine gelähmt sind, die bis zu den späten Stadien des Krankheitsverlaufs funktionsfähig bleibt.
Im Allgemeinen war die Latenz von Impulse zur Einleitung des Aktionspotentials kürzer in die Vorderbeine, die im Vergleich zu Hintergliedmaßen (Abb. 3 b, E). Dies ist einfach aufgrund der kürzeren Abstand zwischen die anregende und die Aufnahme Elektroden. Die Latenz bietet Aufschluss über die Myelinisierung der Axone. Unsere Beobachtung ist, dass CMAP Latenzen beim Fortschreiten Erkrankung in Mausmodellen Alsen, verlängert werden, obwohl ALS keine demyelinisierende Krankheit ist. Dies wird wahrscheinlich durch den Verlust der größere, schnellere Durchführung von motorischen Axone.
Die C61-PMP22 Mäusen überexprimiert 3-4 Kopien der menschlichen PMP22 und Heterozygote Mäuse rekapitulieren einen sehr milden CMT1A Krankheit Phänotyp mit milden Demyelinisierung und reduzierte CMAPs, aber keine sichtbaren Phänotyp11,12. In 1,5-2 Jahre Alter C61-PMP22-Mäuse die CMAP-Amplituden reduziert und Latenzen verlängert sowohl in den Hintergliedmaßen und Vorderbeine (Abbildung 4). Repräsentative Aufnahmen anzeigen, verminderte Amplitude und verzögerte Reaktion im Vergleich zu einer Aufnahme von eines gesunden Probanden sind in Abbildung 2B, bzw. vorgestellt. Die CMAP-Latenzen in die Vorderbeine sind nicht so viel wie in den hinteren Gliedmaßen betroffen. Dies steht im Einklang mit CMT1A Patienten, da immer häufiger Patienten stark reduziert oder nicht nachweisbar CMAPs an den unteren Extremitäten aufgrund der pathophysiologischen CMT als eine Länge-abhängige Störung14. Darüber hinaus ist der Grad der Schwere der Erkrankung korreliert mit CMAP Amplitude, anstatt Latenz oder Wärmeleitung Geschwindigkeit als Amplituden mit dem Grad der axonalen Integrität14,15 korreliert. Dennoch zeigen die Ergebnisse, dass diese Methode empfindlich genug, um die Schaltfläche erkennen demyelinisierenden Prozesses wie diejenigen in CMT1A beobachtet.
Variation in Amplitude und Latenz war am niedrigsten in nicht-transgenen Gruppen (Koeffizient der Variante 2-15 % und 1-13 %, beziehungsweise). In allen Fällen transgenen gab es mehr Variation in den Messungen (Variationskoeffizient für 8-51 % der Amplitude und Latenz 1-21 %), die am ehesten durch die Unterschiede in der Progression der Erkrankung unter den Tieren verursacht wird. In allen Fällen war die Variation in Hind und Vorderbeine ähnlich. Die Variation in der Verwendung der Nadel und Oberflächenelektroden wurde berichtet, ähnlich16sein.
Die erforderlichen Impulse Intensitäten nicht stark variieren, zwischen nicht-transgenen und ALS Modelle (Abbildung 3, F). Ebenso die erforderlichen Impulse supramaximalen Reiz in diesen Fällen zu erreichen war ähnlich für Vorder- und Hinterbeine und variiert zwischen 5 und 12 mA. In CMT die Forderung nach erhöhter Reiz Intensitäten anerkannten17 und der gleichen Phänotyp galt bei Mäusen C61-PMP22 (Abbildung 4). Das Phänomen wurde durch erhöhte elektrische Impedanz von hypertrophen Endoneurial Änderungen17erläutert.
Um sicherzustellen, dass die CMAP-Amplitude, aufgenommen von der Vorderbeine durch Nervenstimulation und nicht Muskelstimulation war, führten wir einseitige teilweise Axotomie auf dem Plexus brachialis Nerven bei 5 Monate alten nicht-transgenen C57BL/6Jax Mäusen (männlich und weiblich) ( Abbildung 5). Axotomie reduziert die CMAP-Amplitude von 90 mV bis 20 mV, darauf hinweist, dass die meisten der Axone im Betrieb getrennt wurden. Es gab keine Veränderung der Amplitude in der kontralateralen vordergliedmaße oder in den Hintergliedmaßen. Dies deutet stark, dass die Antwort in der Bizeps Brachii erkannt durch Nervenstimulation wurde und nicht von Muskelstimulation.
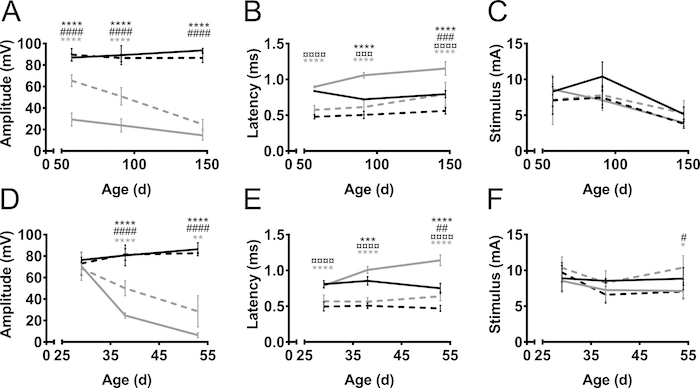
Abbildung 3. CMAP Amplitude, Latenz und erforderlichen Impulse über den Krankheitsverlauf in die Hinterbeine- und Vorderbeine in ALS Maus Modelle. SOD1-G93A (A–C) und PrP-hFUS-WT3 (D–F) transgenen (tg) Mäuse und nicht-transgenen wurfgeschwistern (tg) wurden zu Beginn der motorischen Symptome, gemessen in der symptomatischen Phase und in der späten symptomatische Phase der Krankheit verarbeiten, im Alter von 57, 91 und 147 Tage (d) oder 29, 38 und 53 Tage für SOD1-G93A und PrP-hFUS-WT3 Mäuse, beziehungsweise. Schwarz: Nicht-transgenen Megalosauridae, schwarz gestrichelt: nicht-transgenen vordergliedmaße, grau: transgene Megalosauridae, grau gestrichelt: transgene Vorderbein. Ergebnisse werden als ± SD Amplituden bedeuten (A, D) wurden im Laufe der Zeit in den nicht-transgenen Tieren sowohl in Hind und Vorderbeine stabil. Bei transgenen Tieren sank Amplituden während des Krankheitsverlaufs. Latenzen (B, E) waren weniger von der Krankheit betroffen und große Unterschiede zwischen Hind und Vorderbeine, unabhängig von der Genotyp beobachtet wurden. Variation in den erforderlichen Impuls (C, F) war in allen Gruppen minimal. Für SOD1-G93A N = 4 in allen Gruppen mit Ausnahme der tg 147 d, N = 3. Für PrP hFUS WT3 Mäuse in Altersgruppen 29, 38 und 53 ist N für nicht-tg 4, 5 und 4 und 7, 5 und 3 tg. Symbole kennzeichnen den Unterschied zwischen den Gruppen wie folgt: *:-tg Megalosauridae vs. tg Megalosauridae, #:-tg vordergliedmaße vs. tg vordergliedmaße ¤:-tg Megalosauridae vs. nicht-tg vordergliedmaße, grau *: tg Megalosauridae vs. tg Vorderbein. Zwei-Wege-ANOVA mit Tukey's multiple Vergleiche-Test *: p < 0,05 **: p < 0,01 ***: p < 0,001 ***: p < 0,0001. #: p < 0,05, ##: p < 0,01, ###: p < 0,001, ### : p < 0,0001. ¤: p < 0,05, ¤¤: p < 0,01 ¤¤¤: p < 0,001, ¤¤¤: p < 0,0001. Bitte klicken Sie hier für eine größere Version dieser Figur.
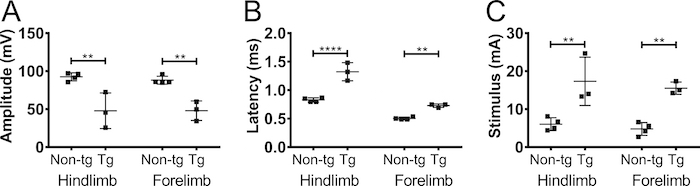
Abbildung 4. CMAP Amplitude, Latenz und erforderliche Reiz in der Hind- und Vorderbeine in CMT1A Mäuse. C61-PMP22 transgenen (tg) Mäuse und nicht-transgenen (tg) wurfgeschwistern wurden mit 1,5-2 Jahren gemessen. Amplitude (A) wurde sowohl in Hind und Vorderbeine in transgenen Mäusen verringert. Latenz (B) wurde in allen Gliedern bei CMT Mäusen verlängert und auch subtile Änderung der Vorderbeine mit dieser Messung erkannt wurde. Voraussetzung für die Reizintensität (C) wurde C61-PMP22 Mäuse, erhöht die erkannten Phänotyp in CMT1A Patienten ähnelt. Ergebnisse werden als ± SD bedeuten für nicht-tg N = 4 und tg N = 3. Zwei-Wege-ANOVA mit Sidak ist multiple Vergleiche-Test, **: p < 0,01 ***: p < 0,0001. Bitte klicken Sie hier für eine größere Version dieser Figur.
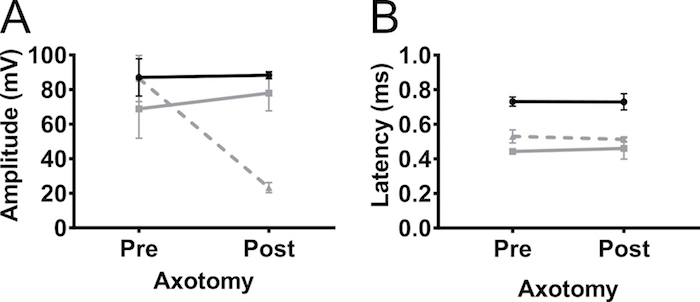
Abbildung 5. Vordergliedmaße Aktionspotentiale entstehen durch Nervenstimulation. Um die Möglichkeit auszuschließen, die die beobachteten CMAP-Reaktion durch Muskelstimulation verursacht wurde, erfolgte (Teil-) Axotomie auf dem Plexus brachialis Nerven. CMAP Amplitude (A) und (B) Latenz verzeichneten vor (Pre) und 4 Tage nach (post) die Axotomie von den Plexus brachialis bei Erwachsenen nicht-transgenen Mäusen. Axotomie vermindert die CMAP Amplitude darauf hinweist, dass die Reaktion durch Nervenstimulation. Schwarz: Megalosauridae, grau: kontralaterale vordergliedmaße, grau gestrichelt: ipsilateral Vorderbein. Ergebnisse werden als Mittelwert ± SD, N = 2. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Sensible Aufnahmemethoden sind wesentlich für die Beurteilung der Progression der Erkrankung und vor allem die Wirksamkeit einer Therapie in Tiermodellen der neuronalen Erkrankungen. Bestimmung der CMAPs ist eine minimal-invasive elektrophysiologische Technik, die routinemäßig in Kliniken und in Versuchsaufbauten verwendet wird, um zu beurteilen, Nervenleitgeschwindigkeit in neuromuskulären und neuropathischen Störungen3,18. Hier beschreiben wir eine neuartige Anwendung für CMAP Aufnahme bei Mäusen um Messung der Nervenleitgeschwindigkeit in den Plexus brachialis Nerven von der vordergliedmaße. Die vorgestellte Methode ermöglicht eine vielseitige und detaillierter längs-Bewertung der neuronalen Funktion in Maus Modelle der Neurodegeneration.
Die Nadelelektroden sind etwas mehr invasiv als Ring-Elektroden und vor allem in Längsschnittstudien muss darauf geachtet werden, Gewebeschäden zu minimieren. Einen möglichen Nachteil der Methode ist die daraus resultierende Verletzungen durch piercing ein Nerv oder Muskel. Jedoch können nach sorgfältiger subkutane Platzierung der Elektroden, die Verletzungen und Störungen der Muskeln und Nerven verhindert werden. Im Gegensatz zu der Methode mit Ringelektroden erfordert die hier vorgestellte Methode nicht rasieren des Fells aus weiten Teilen des Körpers. Infolgedessen gibt es keine Beschwerden oder Beeinträchtigung der Thermoregulation für das Tier.
Die Positionierung der Elektroden ist entscheidend für die korrekte und einheitliche Erfassung der CMAP Amplituden und Latenzen. Es ist ratsam, die Elektroden neu zu positionieren und um zwei bis drei Messungen an jedem Standort zu bestätigen, dass die maximale Stimulation durchzuführen und Antworten erreicht. Korrekte Aufnahmen soll biphasischen Kurven wie in Abbildung 2gezeigt. Um die Methode zu standardisieren, werden nicht-transgenen Mäuse ohne Nervenverletzung die besten Modelle, die korrekte und konsistente Elektrode Positionierung für optimale Stimulation zu etablieren. Wiederverwendbare Nadelelektroden sind für Mehrfachverwendung geeignet, wenn sie regelmäßig, z.B. mit Glutaraldehyd für 20 Minuten zwischen den Tieren sterilisiert werden, und für die Schärfe geprüft.
Bei gesunden Erwachsenen Mäusen sind die CMAP-Amplituden aufgezeichnet mit der vorgestellten Methode in der Regel 80-100 mV nach Stimulierung der Ischiasnerv und den Plexus brachialis. Dies ist vor allem größer als die Antworten mit Ring-Elektroden gemessen, da gibt es eine höhere Impedanz, verursacht durch die Haut für die Ringelektroden, die Ergebnisse von 20-40 mV8,19,20hervorbringt. ALS Maus-Modellen Abnahme der CMAP-Amplituden nach Stimulation der Ischiasnerv oder den Plexus brachialis in gelähmten Gliedmaßen, 10-30 mV. Das Ausmaß der CMAP Amplitude ist kleiner bei Jungtieren, da die CMAP-Amplitude während Entwicklung21erhöht.
Die Methode, die wir hier beschreiben, ist besonders nützlich in Mausmodellen Alsen, in denen Denervation und spätere motorische Defizite, früher in den Hintergliedmaßen als in der Vorderbeine13auftreten. Neben der Denervierung konnte die Methode Reinnervation erkennen, die als verhindert oder verzögert Rückgang der CMAP-Amplitude bestimmt wird. Die dramatische Abnahme der CMAP-Amplitude in den Muskeln der Hinterbeine bereits im Alter von Symptombeginn behindert das Follow-up weitere Fortschreiten der Krankheit; wie die CMAP-Amplituden im frühen Stadium der Krankheit sehr niedrige Werte erreichen, sie nicht während des Krankheitsverlaufs weiter zurückgehen. Im Gegensatz dazu axonalen Verlust schreitet in einem langsameren Tempo in den Plexus brachialis Nerven der Vorderbeine und präsentiert eine empfindlichere Option zur Messung der Progression der Erkrankung über eine längere Dauer der Krankheit. Darüber hinaus könnten die weniger degenerierte Vorderbeine eine potentere Website für die Beurteilung der therapeutischen Ansätze, die darauf abzielen, Verbesserung der axonalen Funktion.
Es ist klar, dass die vorgestellte Technik neue Möglichkeiten für die Charakterisierung der Maus Modelle der neuromuskulären Erkrankungen bietet. CMAP Aufnahmen mit Nadelelektroden aus den Ischiasnerv und den Plexus brachialis ist eine schnelle und reproduzierbare Methode zu bewerten axonalen Verlust und demyelination in Hind-ebenso wie die Vorderbeine. Die Empfindlichkeit der Methode ermöglicht eine Erfassung der axonalen Defizite auch bevor bemerkenswerte motorische Defizite können aufgezeichnet werden und ermöglicht so die frühzeitige Quantifizierung dieser Defekte. Darüber hinaus die Möglichkeit der wiederholten Prüfung reduziert die Anzahl der benötigten Tiere und bietet eine detaillierte Übersicht über das Fortschreiten der neuromuskulären und neuropathischen Erkrankungen an unterschiedlichen Standorten in ein einzelnes Tier.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Forschung wurde unterstützt durch KU Leuven ("Öffnung der Zukunft" und C1), den Fonds für wissenschaftliche Forschung Flandern (FWO-Vlaanderen), Fondation Thierry Latran Association Belge Contre Les Maladies Neuro-Musculaires (ABMM), der Muskeldystrophie Association (MDA), der und ALS Association und der ALS Liga (Belgien). PVD-Beschichtung hält ein senior Investigatorship der FWO-Vlaanderen. RP wurde unterstützt durch Zuschüsse aus der Sanierungsmaßnahmen Klinik (CRC) Irland und wird derzeit unterstützt der National University of Ireland (NUI) und der FWO.
Materialien
| Name | Company | Catalog Number | Comments |
| Resuable subdermal needle electrode, Pl/Ir | Technomed | TE/S61-434 | The Needle is 13 mm (0.51") in length, 0.4 mm (27G) in diameter |
| Natus electrodiagnostic system | Natus Neurology | UltraPro S100 | EMG device |
| Synergy | Natus Neurology | version 20.1.0.100 | EMG software for UltraPro S100 |
| Physitem Controller | Rothacher-Medical GmbH | TCAT-2LV | Heating pad |
| combi-vet Base Anesthesia System Digital Flowmeter with TEC 3 Vaporize | Rothacher & Partner | CV 30-301-D | Isoflurane Vaporizer and flowmeter |
| Iso-Vet 1000 mg/g | Piramal Healthcare UK Limited | AP/DRUGS/220/96 | Isoflurane |
| SOD1-G93A mice | The Jackson Laboratory | #002726 | ALS tg and non-tg control littermates, only females |
| PrP-hFUS-WT3 mice | The Jackson Laboratory | #017916 | ALS tg and non-tg control littermates, all groups balanced for males and females |
| C57BL/6Jax mice | The Jackson Laboratory | #000664 | Non-tg mice for axotomy, male and female |
| C61-PMP22 mice | Mouse line was generously donated by Prof. M. Sereda (The Max Planck Institute of Experimental Medicine, Göttingen, Germany). | CMT tg and non-tg control littermates, all groups balanced for males and females |
Referenzen
- Brown, R. H., Al-Chalabi, A. Amyotrophic Lateral Sclerosis. N Engl J Med. 377 (2), 162-172 (2017).
- Prior, R., Van Helleputte, L., Benoy, V., Van Den Bosch, L. Defective axonal transport: A common pathological mechanism in inherited and acquired peripheral neuropathies. Neurobiol Dis. , 300-320 (2017).
- de Carvalho, M., et al. Electrodiagnostic criteria for diagnosis of ALS. Clin Neurophysiol. 119 (3), 497-503 (2008).
- Krajewski, K. M., et al. Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A. Brain. 123 (Pt 7), 1516-1527 (2000).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18 (4), 402-408 (1995).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19 (8), 946-952 (1996).
- Arnold, W. D., et al. Electrophysiological Motor Unit Number Estimation (MUNE) Measuring Compound Muscle Action Potential (CMAP) in Mouse Hindlimb Muscles. J Vis Exp. (103), (2015).
- Schulz, A., Walther, C., Morrison, H., Bauer, R. In vivo electrophysiological measurements on mouse sciatic nerves. J Vis Exp. (86), (2014).
- Gurney, M. E., et al. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Mitchell, J. C., et al. Overexpression of human wild-type FUS causes progressive motor neuron degeneration in an age- and dose-dependent fashion. Acta Neuropathol. 125 (2), 273-288 (2013).
- Robertson, A. M., et al. Comparison of a new pmp22 transgenic mouse line with other mouse models and human patients with CMT1A. J Anat. 200 (4), 377-390 (2002).
- Huxley, C., et al. Correlation between varying levels of PMP22 expression and the degree of demyelination and reduction in nerve conduction velocity in transgenic mice. Hum Mol Genet. 7 (3), 449-458 (1998).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Manganelli, F., et al. Nerve conduction velocity in CMT1A: what else can we tell. Eur J Neurol. 23 (10), 1566-1571 (2016).
- Cornett, K. M., et al. Phenotypic Variability of Childhood Charcot-Marie-Tooth Disease. JAMA Neurol. 73 (6), 645-651 (2016).
- Jacobson, W. C., Gabel, R. H., Brand, R. A. Surface vs. fine-wire electrode ensemble-averaged signals during gait. J Electromyogr Kinesiol. 5 (1), 37-44 (1995).
- Parker, V., Warman Chardon, J., Mills, J., Goldsmith, C., Bourque, P. R. Supramaximal Stimulus Intensity as a Diagnostic Tool in Chronic Demyelinating Neuropathy. Neurosci J. 2016, 6796270 (2016).
- Benoy, V., et al. Development of Improved HDAC6 Inhibitors as Pharmacological Therapy for Axonal Charcot-Marie-Tooth Disease. Neurotherapeutics. 14 (2), 417-428 (2017).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41 (6), 850-856 (2010).
- Srivastava, A. K., et al. Mutant HSPB1 overexpression in neurons is sufficient to cause age-related motor neuronopathy in mice. Neurobiol Dis. 47 (2), 163-173 (2012).
- Arnold, W. D., et al. Electrophysiological Biomarkers in Spinal Muscular Atrophy: Preclinical Proof of Concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten