Method Article
一种基于管尖的液滴微流化平台种子细胞的方法
摘要
本文提出了一种利用管道尖头对液滴微流体装置播种稀缺细胞群体的方案, 以提供更高的液滴细胞封装效率。
摘要
在各种常用于细胞分析的微流体平台设计中, 液滴微流体技术通过消除外部因素对细胞的影响, 为在单细胞水平上分离和分析细胞提供了一个强大的工具微。液滴中细胞的封装是由泊松分布决定的, 它是每个液滴中存在的细胞数量和每个液滴体积的平均细胞数的函数。原代细胞, 尤其是免疫细胞, 或临床标本可能稀缺, 无损失的细胞包封仍然具有挑战性。本文提出了一种新的方法, 利用管道提示称重传感器到基于液的微流体设备, 而不会造成细胞的重大损失。对于不同类型的细胞, 我们在液滴中展示了与泊松分布预测的封装效率密切相关的高效细胞封装。我们的方法可确保细胞在微流体平台上的负载不受损失, 并可轻松适应下游单细胞分析,例如,解码不同细胞类型之间的细胞相互作用。
引言
近年来, 微流体作为单细胞级细胞分析的强大和多功能平台的使用迅速增加1。这些平台使用非常小的样品体积 2,3, 4,提供高精度和灵敏度的单个细胞和生物分子的高通量筛选。在不同类型的微流体设计中, 基于液滴的平台能够通过在水相滴中分离单个细胞, 从而实现对单个细胞的高通量分析, 这种液相被一个不混溶的相包围, 可以精确和准确地控制细胞微环境5,6。液滴基微流体提供了在水溶液和水凝胶液滴中分离单个或多细胞的灵活性, 并在探索复杂的细胞行为, 如蛋白质分泌或细胞相互作用方面很有价值7,8,9. 免疫细胞之间的信号和交叉对话可能受到微环境中与其他细胞相互作用的影响10。在液滴中分离单个细胞提供了一个有效的无噪音分析实验室, 不受外部环境因素的影响, 从而获得更高效、更准确的结果11,12。通过修改具有多个入口的液滴微流体平台的设计, 可以封装多个细胞类型,通过细胞配对12, 13 来研究细胞相互作用。
细胞在液滴中的包封过程是随机的, 可以用泊松分布的公式 14,15 进行统计确定细胞的包封率。这种封装率可以通过考虑细胞到达液滴结的平均速率来估计, 并假定每个细胞的到达与其他细胞16的到达无关。尽管不能保证独立细胞到达, 但在细胞稀疏分布的情况下, 可以考虑独立的假设, 包含一个或多个细胞的液滴的概率可以预测为细胞数量的函数存在于每个液滴和每个液滴的平均细胞数16,17。由于这种对液滴中细胞封装的估计取决于每个液滴中存在的细胞数量, 人们可以认为, 增加入口的细胞浓度会增加每个液滴中存在的平均细胞数量16. 因此, 为了确保单细胞封装, 必须降低细胞浓度, 但这往往导致大量空液滴18。
在装载过程中由于连接、沉淀和 (或在注射器、管道或生产设备中) 结块而造成的细胞丢失是一个常见的缺点, 这是造成实际封装值偏离预测的封装值19的常见缺点.当播种罕见的免疫细胞或临床标本时, 这个问题会被进一步夸大, 因为它们在种群中已经很少, 只有少数细胞的封装, 远远低于预期, 不能为实验分析提供足够的数据。浆细胞树突状细胞 (pdc) 是免疫细胞的一个罕见的子集, 仅占整个白细胞群20的 0.2-0.6%.这些细胞在激活时分泌大量的 i 型干扰素, 从而在免疫反应21中起着至关重要的作用.在研究这种罕见细胞在液滴中的细胞行为时, 必须防止细胞在播种和包封过程中的丢失.有几个设计相关的发展, 确保了封装在液滴中的单个细胞使用主动封装方法, 利用不同的物理力, 如声学或电力产生的液滴单细胞23,24。然而, 这些方法在液滴生产方面有其自身的局限性 16。
在这项研究中, 我们建立了一个稳健和直接的方法, 规避了传统方法的缺点, 加载单个或多个细胞到微流体设备。我们的方法, 灵感来自 rho等人, 利用不同大小的移液器吸头播种少量的稀有免疫细胞, 在没有明显样品损失的情况下液滴微流体平台, 并产生与理论一致的结果预测25。这种方法可以很容易和成功地适应涉及液滴微流体的几种应用, 并应用于各种细胞类型甚至微粒子。
研究方案
1. 3-入口聚二甲基硅氧烷 (pdms) 装置制造
- 在调理搅拌器杯中测量40克 pdms 基座, 并在杯中的基部试剂中添加4克 pdms 固化剂, 小心使用滴管。
- 将杯子放入调理搅拌机的支架中, 并与托架测量杯子的总重量。在调理搅拌机上相应地设置离心机平衡重量的值。
- 在 2, 000 转/分的时间将基剂和固化剂混合在调理搅拌机中, 时间为 2分钟, 然后在 2, 000 转/分的情况下除发泡2分钟。
- 准备一艘直径与100毫米硅片差不多的铝船。将为仿制成型工艺而制造的硅片放入铝船中, 并将此设置放入 petri 培养皿中 (直径 = 120 毫米, 高度 = 20 mm)。
注: 培养皿的大小取决于硅片的大小。 - 将杯子从支架上取下, 并小心地将预固化的 pdms 混合物 (杯内装物) 倒入硅片上。
- 将含有硅晶片的硅晶片与预先固化的 pdms 混合物放在干燥器中大约 20分钟, 以去除所有气泡。
- 20分钟后取出培养皿, 检查是否有任何剩余的气泡可以被取出。
- 将培养皿放在烤箱中, 设置在 65°c, 至少3小时。
- 3小时后将培养皿从烤箱中取出, 并小心地将固化后的 pdms 从硅片上剥离。
- 使用刀或手术刀沿切割线切割 pdms 设备。使用1.2 毫米的冲孔器在每个设备的入口和出口打孔。用苏格兰胶带清洁每个 pdms 设备, 以清除任何灰尘或 pdms 的残余部分。
- 或者, 用氮气吹气, 去除残留的 pdms 碎片。
- 用肥皂水清洗玻璃滑梯, 然后用异丙醇和氮气干燥。
- 将一个干净的 pdms 装置与一个干净的玻璃滑块在等离子上, 以关闭流线。使用以下设置: 功率:50 w, 时间: 45秒, 出血延迟时间: 2 秒, 过程气体: 气体 1 (空气), 通风口: 两个阀门, 限制通风时间: 60秒, 泵旋转停机时间: 10秒, 通风口保持时间: 0秒, 气体关闭时间: 1 s, 涡轮泵浦启用: 0. 断开所有其他燃气管道。
注: 用于等离子清洗机的设置可能因使用的等离子设备的品牌而异。 - 在950μl 含氟油中加入50μl 的硅烷 (1h, 2h-2h-全氟辛烷基), 制备硅烷溶液。
注: 硅烷有毒。请在通风罩下操作。 - 将准备好的硅烷溶液绘制在注射器中, 注射器连接到特氟龙管材上。
- 通过设备的出口冲洗准备好的硅烷溶液, 使设备保持不足。
- 将设备放在设置在65°c 的烤箱中30分钟。
- 从烤箱中取出盐化装置, 用氟化油将多余的硅烷冲洗出设备。
- 将设备放回烤箱中, 设置为 65°c, 至少1小时即可完成粘接过程。
注意: 协议可以在此处暂停。
2. 少损细胞封装
-
细胞采集
- 在 roswell park 纪念研究所 (rpmi) 中重新悬浮 jurkat t 细胞, 浓度为 1.0 x10 6 cellss/ml、2.0x106 cells/mL、4.0x10 6 cells/ml 和 8.0x10 6 cells/mL;造血无血清培养培养基 (例如 x-vvo 15) 中的 pdc浓度为 1.3 x10 6 cellsl、3.0x106 cellss/ml 和 13.0x106 cellsl;dulbecco 的修饰鹰培养基 (dmem) 中的 a549 细胞浓度为 1.0 x10 6 细胞 。
注: 细胞的类型和细胞浓度可能因实验而异。细胞的标签也可以在实验的基础上完成。
- 在 roswell park 纪念研究所 (rpmi) 中重新悬浮 jurkat t 细胞, 浓度为 1.0 x10 6 cellss/ml、2.0x106 cells/mL、4.0x10 6 cells/ml 和 8.0x10 6 cells/mL;造血无血清培养培养基 (例如 x-vvo 15) 中的 pdc浓度为 1.3 x10 6 cellsl、3.0x106 cellss/ml 和 13.0x106 cellsl;dulbecco 的修饰鹰培养基 (dmem) 中的 a549 细胞浓度为 1.0 x10 6 细胞 。
-
用于水滴生成的拉链加载
- 在氟化油中加入3毫升的表面活性剂, 用3% 生物相容性表面活性剂混合物制备氟化油。
注: 添加到含氟油中的表面活性剂的浓度决定了不同潜伏期乳液的稳定性。表面活性剂的浓度因特定细胞类型所使用的介质而异。 - 在注射器 (1 毫升) 中绘制油相混合物。从注射器中取出气泡, 并将其连接到适当长度的特氟龙管。
- 通过在注射器中提取与生物相容性的矿物油, 准备样品注射器。取下气泡, 并将注射器连接到适当长度的特氟龙管。
- 从固化的 pdms 板上打一个直径为5毫米的 pdms 插头。
注: 固化后的 pdms 板可以使用步骤1.1 至1.9 进行制备。使用普通的硅片, 而不是制造的硅片。 - 用1毫米的打孔器在插头中央打另一个洞。
- 从较大的端插入200μl 移液器尖端的插头, 使其紧密贴合。
注: 对于较大的样品体积和较大的电池, 请使用 1, 000μl 移液器尖端。对于 1, 000μl 移液器尖端, 可使用直径在5毫米至7毫米之间的插头。插头直径为 5 mm, 可在移液器吸头中吸入约400μl 的样品量。如果使用直径较大的插头 (7 毫米), 则可以吸入更多的样品体积 (约 900μl)。 - 将连接到注射器上的管道插入已插入移液器尖端的 pdms 插头中。慢慢地推注射器柱塞, 将连接的移液器尖端填充矿物油。从移液器尖端推出所有剩余的空气。
- 在样品溶液中降低与注射器连接的移液器尖端, 并在液头中吸气约150μl 的样品。
- 重复步骤 2.2.4 2.2.8 准备第二个样品注射器。
- 小心地将三个准备好的注射器放在注射器泵上。
- 在 pdms 芯片的两个内入口插入包含样品的两个移液器吸头。将含有油相混合物的管子插入外入口。
- 将注射器泵的流量值设置如下: 连续相位溶液: 600μlh, 细胞样品: 100μlh, 每个。输入并设置注射器的尺寸。
注: 直径设置将根据注射器的类型而有所不同。 - 启动泵, 通过设备的内通道冲洗样品溶液, 通过设备的外部通道冲洗油相。
- 在液滴形成稳定时, 将适当长度的管道插入出口, 开始收集液滴。收集时间因实验而异。
- 收集锁管中的液滴。在收集的液滴上加入 200μl rpmi 培养基 (不含血清), 并孵育样品。
注: 收集的液滴的孵化时间因实验而异。当流式细胞仪的分析或分离是在通过打破乳状液从液滴中取出细胞后进行的, 液滴就会被收集到锁管中。如果实验需要液滴内显微分析, 可以在玻璃室收集液滴。
- 在氟化油中加入3毫升的表面活性剂, 用3% 生物相容性表面活性剂混合物制备氟化油。
-
流式细胞仪分析用破乳剂和细胞检索
- 在含氟油中加入2毫升的 pfo, 制备20% 的 1h·2h-二 h-全氟-1-辛醇 (pfo) 溶液 (v/v)。
- 使用注射器从收集管底部取出多余的油, 其中含有液滴。
- 在乳液中加入100μl 的 20% pfo 溶液, 以破坏乳液并将包封的细胞释放到水相中。点击并短暂混合。在这一点上不要涡流。孵化1-2分钟。
注: 添加的 pfo 量取决于生产的液滴数量。继续添加额外的 pfo, 直到油层完全溶解。请记住, pfo 对细胞有毒, pfo 中的 pfo 浓度过高或孵育时间过长可能会导致细胞死亡增加。 - 将解决方案在尽可能低的 rcf 上旋转30秒。
- 制备100毫升冷磷缓冲盐水 (pbs) 溶液, 辅以2% 的胎儿小牛血清 (fcs) (在98毫升的 pbs 中的 fcs 为2毫升)。
- 移液器550μl 的水分数, 离心后立即将其转移到一个新的锁管含有500μl 的冷 pbs 溶液补充2% 的 fcs, 在步骤2.3.5 准备。让任何剩余的油下沉到底部的新锁管。
- 仔细吸吸950μl 含锁管中细胞的水相, 无需吸油并将溶液转移到新的锁管。
- 将新锁管中的细胞向下旋转10分钟。
- 在300μl 的冷 pbs 溶液中重新悬浮细胞, 并辅以2% 的 fcs, 步骤2.3.5 制备。
注: 细胞也可以重新悬浮在任何其他合适的解决方案, 如介质, 具体取决于实验。在实验的基础上, 对细胞进行染色, 以便使用流式细胞术进行分析。
3. 细胞配对
-
细胞采集和染色
- 计数 jurkat t 细胞, 从培养瓶, 并旋转下来的细胞在 1, 500 转/分5分钟。
- 去除上清液, 在1毫升 pbs 中重新悬浮 0x10 6 细胞, 得到 0x106 细胞的浓度。添加的 pbs 量取决于单元格计数。
- 重复步骤 3.1.1 3.1.2 以制备具有相同细胞浓度的 jurkat t 细胞的第二个样本。
- 在 1500 rpm 处用1毫升的 pbs 清洗两个样品两次, 每次5分钟。
- 用1.25 μm 羧荧光素琥珀酰亚胺酯 (cfse) 染料和另一个细胞样品在 1.0x10 6 细胞浓度下, 用1.25 微米远的红色染料或1.25 微米细胞增殖染料重新悬浮一个细胞样品。1.0x106细胞的总染色溶液为1毫升。
注: 根据流式细胞仪或荧光显微镜中可用的过滤器, 细胞可以用不同的染料标记。 - 在37°c 条件下, 用染料将细胞样品加氢10分钟。
- 10分钟后加入1毫升冰凉 fcs, 停止染色反应。
- 在 1500 rpm 处用1毫升的 pbs 清洗细胞样本两次, 每次5分钟。
- 每种颜色以 10.0x10 6 cellsl 的浓度在 rpmi介质中重新悬浮细胞样品。
-
用于生产琼脂糖水凝胶液滴的滴装液
注: 对于使用琼脂糖水凝胶液滴的细胞配对, 在整个液滴生成和收集过程中保持系统温度在27°c 至37°c 之间, 以防止水凝胶的凝胶和保证细胞的活力9。- 在 pbs 中加热高达75°c 的浓度为 4% (w/v), 搅拌混合物 20分钟, 从而溶解超低胶凝温度琼脂糖。
- 将琼脂糖溶液与标记的 jurkat t 细胞混合, 产生 2% (w v) 的琼脂糖浓度。对具有不同标记的单元格的其他示例重复此操作。
- 在含氟油 (油相混合物) 的30毫升中加入20毫升表面活性剂, 用2% 表面活性剂混合物制备氟化油。
- 按照 2.2.2 2.2.14 的步骤操作。
注: 由于低熔融琼脂糖的粘性质, 并为确保稳定的液滴生产, 将注射器泵的流速值设置如下: 油相混合物, 电池样品: 200μlh. 进入并设置注射器的尺寸。 - 将液滴收集在锁管中, 在4°c 下孵育液滴60分钟。
-
用于流式细胞仪分析的乳化液断裂和琼脂糖珠回收
- 孵育液液60分钟后, 用注射器从锁管中取出多余的油, 其中含有液滴。
- 加入200μl 的 pfo, 从液滴中去除油的中间相。
注: 添加到试管中的 pfo 量取决于产生的液滴数量。继续添加额外的 pfo, 直到油层完全溶解。 - 用1毫升冷 pbs 清洗收集到的琼脂糖珠两次, 以 1, 500 转/分的离心方式完全去除油, 时间为10分钟。
- 用流式细胞仪分析收集到的琼脂糖珠。
注: 也可以在荧光显微镜下观察珠子。
结果
在我们的实验中, 我们使用了一个基于3口 pdms 的微流体装置, 高度为25微米 (图 1)。在此装置设置中, 我们使用外入口用表面活性剂冲洗油, 使用两个内入口用细胞悬浮液或介质冲洗水相。在生成和收集后, 液滴在使用流式细胞仪进行下游分析之前, 会从芯片上孵育几个小时。在潜伏期, 培养基中的血清成分可与表面活性剂相互作用, 导致液滴变得不稳定和解体。因此, 在含氟油中添加最佳浓度的表面活性剂是非常重要的。我们测试了含造血无血清培养介质的单分散液滴的稳定性, 并以2% 的人血清为补充, 在氟化油中添加不同浓度的表面活性剂。从图 2可以推断, 当至少3% 的表面活性剂添加到油相中时, 这些单分散液滴在24小时内非常稳定。rpmi 介质在添加和不添加 10% fcs 的情况下也得到了类似的结果 (未显示数据)。因此, 在处理不同来源的培养基和血清成分时, 液滴稳定性在很大程度上取决于最佳表面活性剂的浓度。
为了证明我们的方法的封装效率, 我们首先使用连接到注射器的管道对细胞进行播种, 这是播种细胞最传统的方法 (图 3a)。我们在不同浓度的 00x106 cellsl、 00x10 6 cellss/ml和4.0x106 cells ml 的不同浓度下采集了 jurkat t 细胞, 得到了低于预测值的封装效率 (图 3b)。在 1.0 x106 细胞中, 含有单个细胞的液滴比例为 2.5%, 即使使用较高的细胞浓度, 这一比例也没有增加。为了提高细胞加载效率, 我们修改了以前的方法, 将管道的长度保持在高架三脚架上的一半, 并将电池悬架装入连接到 pdms 设备的一半 (图 4a)。利用这种方法, 我们将 jurkatt 细胞封装在不同浓度的 00x10 6 cells/mL、00x106 cells/mL 和 4.0x106 cellsl, 以及不同浓度的 00x106 cellsl 的罕见 pdc,2.0 x106 cells/mL 和 12.0x106 cellse/ml。我们期望通过这种方法防止细胞沉淀来提高包封率。然而, 在所有测试的浓度下, 实验结果远远低于预测的泊松值 (图 4b和图 4c)。
使用我们的提示加载方法, 我们优化了我们的细胞封装速率, 以获得与统计预测值一致的实验结果 (图 5a)。对于不同浓度的 jurkat t 细胞, 所获得的封装效率与我们在所有浓度下的计算值相匹配 (图 5b)。值得注意的是, 即使像 a549 肿瘤细胞这样的粘附细胞倾向于聚集, 我们也观察到在细胞浓度为 1.0x106细胞的情况下, 包封效率略有提高 (图 5c)。我们还评估了我们的系统的有效性, 以封装较少可用和稀缺的 pdc在不同的细胞浓度 00x10 6 cellsl, 3.0x106 cellsl 和 13.0x106 cellsl (图 5d)。为了便于加载可能超过200μl 的较大体积,例如, 在处理细胞系或更丰富的原代免疫细胞时, 我们还使用1000μl 尖端 (蓝色) 研究了细胞包封效率。我们证明, 与200μl 尖端 (黄色) 相比, 这些1000μl 尖端具有类似的封装效率 (图 5e)。
根据现有的芯片设计和研究问题, 我们的尖端加载技术可用于通过一个入口称重传感器, 用于探测细胞异质性, 或并行处理多个入口, 用于解码细胞交互。我们比较了 jurkat t 细胞的负载 (浓度为 10.0x10 6 cellss/ml)从一个入口到两个不同标记的 jurkat t 细胞群 (总浓度为 10.0 x10 6 cells/mLml ) 从两个入口 (图 6 )a和图 6b)。在封装过程中, 液滴是使用超低胶凝温度琼脂糖产生的, 生产后会形成凝胶凝胶珠, 从而通过显微镜和流式细胞仪进行后续下游分析 (图 6)。 c和图 6d)。显微分析显示, 细胞配对是在不同的组合下实现的, 表明高通量细胞配对 (图 6c)。此外, 流式细胞术对相同数量的水凝胶珠进行分析后发现, 根据不同的前向 (fsc, 大小) 和侧向 (ssc, 粒度) 散射模式, 可以将没有细胞的珠子与带细胞的珠子分离出来 (图 6) d)。对没有细胞的珠子群体进行分证, 证实由于没有荧光信号, 细胞包封不足。此外, 在带有细胞的珠子群上的门控显示存在多个亚群, 表明不同标记的 jurkat t 细胞的封装。我们的结果表明, 在微观和流式细胞仪分析的基础上, 可以实现高效的细胞配对, 并显示与泊松预测 (图 6e)相比, 封装效率略有提高。
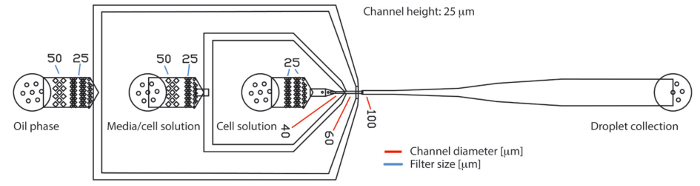
图 1.基于 pdms 的液滴微流体装置, 有三个入口和一个出口.该装置分别由连续油相、细胞培养介质和细胞悬浮液三个入口组成。生成的液滴收集在出口。样品层流到流动聚焦结, 在那里他们被封装在液滴。在入口, 过滤结构容纳大颗粒, 如蛋白质或细胞聚集回来。过滤结构中缝隙的直径用蓝线表示。生产喷嘴上的通道直径由红线表示。整个芯片上的通道高度为 25μm,请点击这里查看这个数字的较大版本.

图 2.液滴稳定性超过 24小时.图表显示了含有造血无血清培养介质的液滴面积 + 2% 的人血清, 随着时间的推移, 三种不同浓度的表面活性剂a) 0.5% b ) 3% c) 5%. 请点击这里查看此图的较大版本.
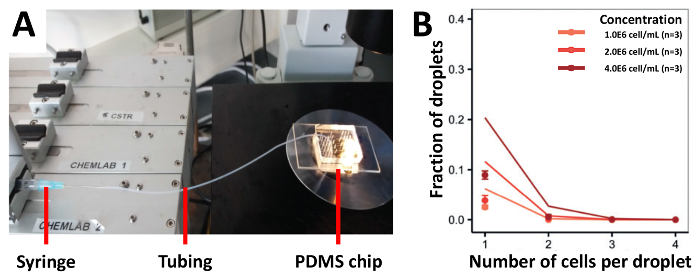
图 3.基于管材的电池加载方法。jurkat-t 细胞使用连接到管道的注射器以不同浓度加载到设备上。a)图显示了实验设置b)光显微镜确定的细胞封装速率。点: 实验确定的值;闭合线: 泊松分布。错误栏表示平均值的标准错误。请点击这里查看此图的较大版本.

图 4.采用垂直管加载方法, 在不同浓度下封装不同浓度的不同细胞类型.对不同浓度的 jurkat t 细胞和 pdc 进行包封, 以确定细胞包封的效率。a)图显示了垂直管加载方法的实验设置。b)该图显示了 jurkat t 细胞的封装效率。c)该图显示了 pdc 的封装效率。点: 实验确定的值;闭合线: 泊松分布。错误栏表示平均值的标准错误。请点击这里查看此图的较大版本.
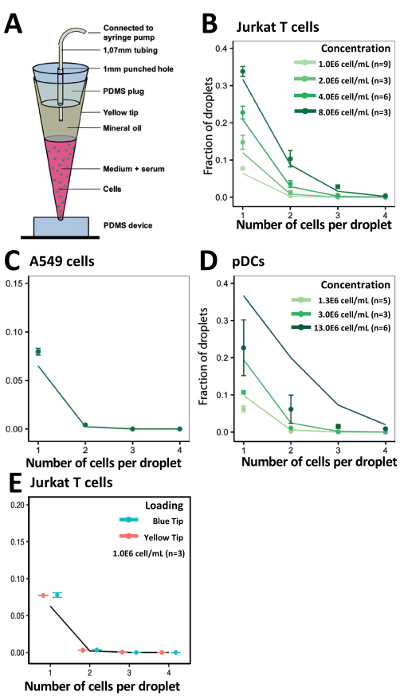
图 5.用于封装不同单元格类型的提示加载方法。a)尖端加载技术示意图。b)该图显示了 jurkat 细胞的包封效率。c)该图显示了 a549 电池的封装效率。d)该图显示了 pdc 的封装效率。e)该图显示了 jurkat t 细胞使用200μl 移液器吸头 (黄色) 和 1, 000μl 移液器吸头 (蓝色) 的封装效率。点: 实验确定的值;闭合线: 泊松分布。错误栏表示平均值的标准错误。请点击这里查看此图的较大版本.
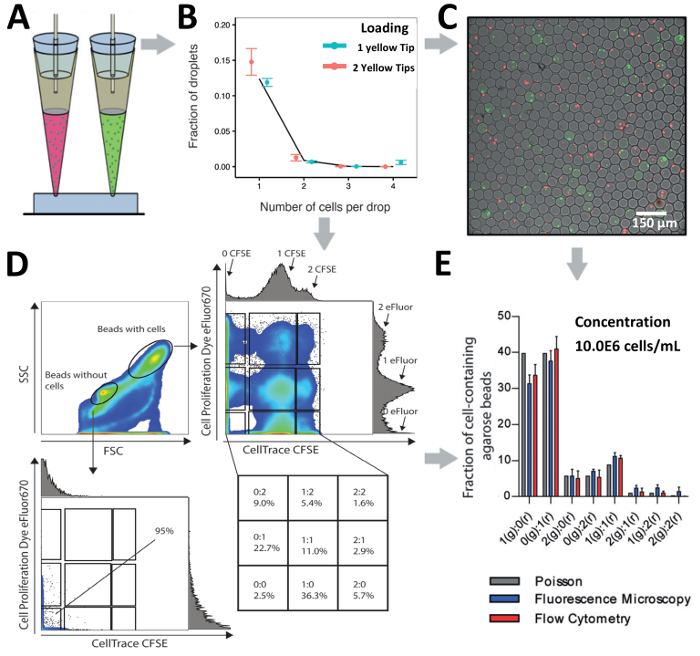
图 6.在液滴中配对细胞。a)示意图说明了将来自2个入口的不同细胞配对的尖端加载方法。b)该图显示了 jurkat t 细胞使用一个或两个平行入口的封装情况。一个尖端的细胞浓度为 2.0 x106 cellsl, 两个尖端的细胞浓度均为 1.0 x106 cells ml。点: 实验确定的值;闭合线: 泊松分布。c)水凝胶微珠和标记的 jurkat t 细胞的荧光显微镜覆盖。d)该图显示了琼脂糖水凝胶微珠中配对细胞的流式细胞仪分析。该图显示了正向散射和侧向散射。e)用荧光显微镜和流式细胞仪检测琼脂糖水凝胶珠细胞数量的比较。条形图: 平均值;威士忌: 平均值的标准误差, n≥4。错误栏表示平均值的标准错误。请点击这里查看此图的较大版本.
讨论
在该协议中, 我们展示了一种高效、直接的技术, 用于在液滴中加载和封装细胞, 以实现高通量、单细胞分析, 并执行控制细胞配对, 用于细胞相互作用研究。此外, 我们还比较了几种传统的称重传感器方法和微流体器件, 并表明与其他方法相比, 我们的尖端加载方法是一种更有效的技术。
研究临床标本或罕见细胞类型稀缺的液滴基微流体具有一些固有的挑战。正如我们所证明的那样, 细胞倾向于在注射器和管道表面沉积, 从而阻止细胞封装符合预测值。为了避免这个问题, 一些团体使用注射器中的搅拌棒。然而, 当使用罕见和有限的细胞群, 细胞的总体积也是有限的, 从而限制了使用大型注射器和搅拌棒。此外, 我们还更换了更常用的油管与特氟龙涂层油管, 以防止细胞附件, 但这种方法并没有改善的结果, 如果油管太长, 细胞附件的问题恶化 (数据未显示)。或者, 我们使用垂直管加载方法, 其中细胞加载在管中, 而不是在注射器中, 以防止在大注射器量的细胞丢失。使用此技术, 可以加载样本量较小的单元格,例如,很少和有限的 pdc。此外, 从油管的样品被垂直加载到设备, 以防止细胞沉淀。用于电池播种的管材尺寸较小, 可与微通道进行比较。油管中的流量是压力驱动的, 遵循抛物线速度分布26。这意味着最大流速在油管的中心, 最小流速在油管27的边缘.当通过管道冲洗细胞群时, 速度梯度会导致细胞被推向它们沉淀下来的边缘, 因为边界上的速度接近于零。在实验数据与预测模型不匹配的情况下, 管道中细胞的沉降或沉降降低了封装效率, 如代表性结果所示。
科学家使用的另一个常用的解决方案, 与液滴微流体, 是通过添加密度匹配试剂, 如碘沙克索, 以防止细胞沉淀在注射器19增加细胞培养介质的密度, 增加细胞培养介质的密度。然而, 密度匹配试剂会影响细胞行为, 并对细胞的细胞分泌产生不利影响 (数据未显示)28。
尽管对传统的电池加载技术进行了一些小的和大的修改, 但在封装效率方面稍有提高, 所得到的实验结果仍然与理论计算不符。然而, 通过提示加载方法, 我们可以克服以前方法的局限性和泊松统计所要求的封装效率。该技术不仅有利于加载悬浮细胞, 而且还可用于加载粘附细胞, 如原代角质形成细胞和 a549 微流体芯片。当使用丰富的细胞系, 例如 a549、A549等, 可以使用更大的样本量。因此, 根据样品的体积, 也可以使用不同大小的移液头, 这种简单的技术可以适用于单细胞封装和多细胞封装。
虽然需要低细胞浓度来确保单个细胞在液滴中的封装, 但需要更高的细胞浓度来增加每个液滴中的平均细胞数量, 以便进行与细胞配对有关的研究。有几种单细胞方法, 以前已经被描述, 配对免疫细胞上的微流体芯片或微制造纳米孔29,30,31。在液滴微流体中, 泊松统计要求在最佳细胞浓度下, 可以实现两种不同细胞类型的1:1 细胞配对。根据泊松预测, 液滴也有可能包含其他组合。1: 1 细胞配对可以研究单个细胞水平的细胞相互作用, 并提高细胞的理解, 多细胞配对也有很大的优势。它允许理解一种细胞类型的多个细胞对另一种细胞类型的影响。不同免疫细胞之间的交叉对话有助于对几种感染和病原体产生有效的免疫反应, 也增加了我们免疫系统的鲁棒性32。因此, 在不同的上下文中, 例如, 1: 1、2: 1、1:1、2:1、3:1 等, 可以对蜂窝通信进行高精度的审讯。提高对单个或对细胞如何控制免疫反应诱导的认识。这是特别有趣的研究, 例如自然杀伤细胞或细胞毒性 t 细胞的能力, 连续杀死各自的目标细胞。
正如所讨论的, 对于细胞在液滴中的多重包封, 需要更高的细胞浓度。然而, 当从一个入口加载细胞进行细胞封装时, 较高浓度的细胞样本会导致细胞在入口聚集。这导致较低的封装速率和更高的偏差与理论值。为了避免此问题, 也可以从两个单独的入口加载单元格。从理论上讲, 有可能开发具有多个入口的其他微流体器件, 以实现更高水平的细胞封装, 同时保证平均 x 倍的细胞数量。在本研究中, 我们研究了 jurkat t 细胞在使用相同的总浓度从一个入口和两个入口加载时的封装效率, 并获得了类似的封装效率。这种修改使研究人员能够在芯片上配对不同的细胞类型。
虽然这种方法有助于将细胞加载到微流体设备上, 而不会造成细胞的重大损失, 但有一定的预防措施需要牢记。在用矿物油填充注射器并在移液器前吸头中吸入细胞样本时, 应避免加入气泡, 整个系统应无空气。同样重要的是要记住, 矿物油不应该与样品混合。含有样品的移液器尖端应牢固地插入微流体装置的入口, 并采取最大的预防措施, 以防止泄漏和进一步加入气泡。总之, 提示加载是一种简单、可靠的技术, 它允许通过细胞封装对细胞行为进行高通量分析, 而不会以经济高效的方式显著丢失细胞。当在入口使用最佳的样品浓度时, 这种用移液头加载细胞的方法非常灵活, 可以适用于不同的细胞类型, 特别是罕见的原代免疫细胞, 以获得更高的封装效率, 接近预测的模型。
披露声明
我们没有什么可透露的。
致谢
我们感谢埃因霍温技术大学的慷慨支持。
材料
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 171468-5G | |
| 1H,1H,2H,2H-Perfluorooctyltriethoxysilane | Fluorochem/UK | S13150 | Silane (toxic) |
| Agarose (Ultra-low Gelling Temperature) | Sigma-Aldrich | 9012-36-6 | |
| BD Wegwerpspuiten met Luer-Lok-punten | Fisher Scientific | 10630694 | Syringe |
| Biopsy Punch 1.2 mm | Harris Uni-Core | ||
| Cell Proliferation Dye eFluro 670 | eBioscience | 65-0840-85 | |
| CellTrace CFSE | Invitrogen | C34554 | |
| CellTrace Far Red Cell | Invitrogen | C34564 | |
| Eppendorf Tubes | Eppendrof Tubes | Safe-Lok tubes 1 mL and 2 mL | |
| Glass Slide | Sigma Aldrich | CLS294775X38-72EA | Corning microscope slides, plain L × W 75 mm × 38 mm |
| Harvard Pumps | Harvard Apparatus | C-400750; C-400727 | Syringe pumps |
| HFE-7500 3M Novec Engineered fluid | Fluorochem/UK | 51243 | Flourinated oil |
| Kai Biopsy Punch 5 mm | Amstel Medical | 1980130 | |
| Luer stub | Instechlabs/USA | LS20S | Luer stub, 20ga (pink) x 0.5in (12mm), non-sterile |
| Mineral oil (Light) | Sigma Aldrich | M8410-1L | |
| Phosphate buffered saline | Sigma-Aldrich | P4417-50TAB | Tablets |
| Pico-Surf 1 (5%in Novec 7500) | Sphere Fluidics | 020317-09 | Surfactant |
| Plasma Asher | Emitech | K1050X | Plasma asher |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Silicone Elastomer Base 184 | Sylgard | 9355218 | PDMS base |
| Silicone Elastomer Curing Agent | Sylgard | 9355218 | Curing Agent |
| Stainless steel catheter coupler | Instechlab/USA | SC20/15 | 20ga x 15mm, non-sterile |
| TFE Teflon Tubing | Sigma-Aldrich | 58696-U | PTFE Tubing L × O.D. × I.D. 50 ft × 1/16 in. × 0.031 in. |
| Thinky mixer ARE-250 | EX-4025F | Conditioning mixture |
参考文献
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Current Opinion in Biotechnology. 23 (1), 110-119 (2012).
- Meyvantsson, I., Beebe, D. J. Cell Culture Models in Microfluidic Systems. Annual Review of Analytical Chemistry. 1, 423-429 (2008).
- Yi, C., Li, C. W., Ji, S., Yang, M. Microfluidics technology for manipulation and analysis of biological cells. Analytica Chimica Acta. 560, 1-23 (2006).
- Wang, H. Y., Bao, N., Lu, C. A microfluidic cell array with individually addressable culture chambers. Biosensors and Bioelectronics. 24, 613-617 (2008).
- Zhang, Y., et al. A programmable microenvironment for cellular studies via. microfluidics-generated double emulsions. Biomaterials. 34 (19), 4564-4572 (2013).
- Teh, S. -. Y., Lin, R., Hung, L. -. H., Lee, A. P. Droplet microfluidics. Lab on a chip. 8 (2), 198-220 (2008).
- Hu, H., et al. Efficient cell pairing in droplets using dual-color sorting. Lab Chip. 15 (20), 3989-3993 (2015).
- Brouzes, E., et al. Droplet microfluidic technology for single-cell high-throughput screening. Proceedings of the National Academy of Sciences. 106 (34), 14195-14200 (2009).
- Chokkalingam, V., et al. Probing cellular heterogeneity in cytokine-secreting immune cells using droplet-based microfluidics. Lab on a Chip. 13 (42), 4740 (2013).
- den Haan, J. M. M., Arens, R., van Zelm, M. C. The activation of the adaptive immune system: Cross-talk between antigen-presenting cells, T cells and B cells. Immunology Letters. 162 (2), 103-112 (2014).
- Shah, G. J., Ohta, A. T., Chiou, E. P. -. Y., Wu, M. C., Kim, C. -. J. EWOD-driven droplet microfluidic device integrated with optoelectronic tweezers as an automated platform for cellular isolation and analysis. Lab on a Chip. 9 (12), 1732 (2009).
- Griffiths, A. D., Tawfik, D. S. Miniaturising the laboratory in emulsion droplets. Trends in Biotechnology. 24 (9), 395-402 (2006).
- Lagus, T. P., Edd, J. F. High-throughput co-encapsulation of self-ordered cell trains: cell pair interactions in microdroplets. RSC Advances. 3, 43 (2013).
- Moon, S., Ceyhan, E., Gurkan, U. A., Demirci, U. Statistical modeling of single target cell encapsulation. PLoS ONE. 6 (7), (2011).
- Abate, A. R., Chen, C. -. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628 (2009).
- Collins, D. J., Neild, A., deMello, A., Liu, A. -. Q., Ai, Y. The Poisson distribution and beyond: methods for microfluidic droplet production and single cell encapsulation. Lab Chip. 15 (17), 3439-3459 (2015).
- Kemna, E. W. M., et al. High-yield cell ordering and deterministic cell-in-droplet encapsulation using Dean flow in a curved microchannel. Lab on a Chip. 12 (16), 2881 (2012).
- Köster, S., et al. Drop-based microfluidic devices for encapsulation of single cells. Lab on a Chip. 8 (7), 1110 (2008).
- Mazutis, L., et al. Single-cell analysis and sorting using droplet-based microfluidics. Nature Protocols. 8 (5), 870-891 (2013).
- Sun, P., et al. Functional characterization of ex vivo. blood myeloid and plasmacytoid dendritic cells after infection with dengue virus. Virology. 383 (2), 207-215 (2009).
- Tel, J., et al. The chemotherapeutic drug oxaliplatin differentially affects blood DC function dependent on environmental cues. Cancer Immunology, Immunotherapy. 61 (7), 1101-1111 (2012).
- Wimmers, F., et al. Single-cell analysis reveals that stochasticity and paracrine signaling control interferon-alpha production by plasmacytoid dendritic cells. Nature Communications. 9 (1), 3317 (2018).
- Gong, J., Kim, C. -. J. All-electronic droplet generation on-chip with real-time feedback control for EWOD digital microfluidics. Lab on a Chip. 8 (6), 898 (2008).
- Demirci, U., Montesano, G. Single cell epitaxy by acoustic picolitre droplets. Lab on a Chip. 7 (9), 1139 (2007).
- Rho, H. S., Yang, Y., Veltkamp, H. -. W., Gardeniers, H. Direct Delivery of Reagents from a Pipette Tip to a PDMS Microfluidic Device. Chips and Tips. , (2015).
- Paul, P. H., Garguilo, M. G., Rakestraw, D. J. Imaging of Pressure- And Electrokinetically Driven Flows through Open Capillaries. Analytical Chemistry. 70 (13), 2459-2467 (1998).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Physics Today. 54, 42 (2001).
- Mita, A., et al. Anti-proinflammatory Effects of Iodixanol (OptiPrep)-Based Density Gradient Purification on Human Islet Preparations. Cell Transplant. 19 (12), 1537-1546 (2013).
- Dura, B., et al. Profiling lymphocyte interactions at the single-cell level by microfluidic cell pairing. Nature Communications. 6 (1), 1-13 (2015).
- Dura, B., et al. Longitudinal multiparameter assay of lymphocyte interactions from onset by microfluidic cell pairing and culture. Proceedings of the National Academy of Sciences. 113 (26), 3599-3608 (2016).
- Yamanaka, Y. J., et al. Single-cell analysis of the dynamics and functional outcomes of interactions between human natural killer cells and target cells. Integrative Biology. 4 (10), 1175 (2012).
- Satija, R., Shalek, A. K. Heterogeneity in immune responses: From populations to single cells. Trends in Immunology. 35 (5), 219-229 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。