Method Article
Méthode fondée sur un embout de la Pipette pour semis de cellules aux plateformes microfluidiques Droplet
Dans cet article
Résumé
Cet article présente un protocole pour l’amorçage rare population de cellules à l’aide de pointes de pipette à dispositifs microfluidiques gouttelette afin d’offrir une plus grande efficacité d’encapsulation des cellules en gouttelettes.
Résumé
Parmi les diverses conceptions de la plate-forme microfluidique fréquemment utilisées pour l’analyse cellulaire, goutte-microfluidics fournit un outil robuste pour isoler et analyser des cellules au niveau de single-cell en éliminant l’influence des facteurs externes sur le cellulaire microenvironnement. Encapsulation de cellules dans les gouttelettes est dictée par la distribution de Poisson en fonction du nombre des cellules présentes dans chaque goutte et le nombre moyen de cellules de par le volume de la goutte. Les cellules primaires, spécialement les cellules immunitaires, ou les échantillons cliniques peuvent être rares et sans perte encapsulation des cellules reste difficile. Dans cet article, nous présentons une nouvelle méthodologie qui utilise pointes de pipette pour charger les cellules aux dispositifs microfluidiques axée sur les gouttelettes sans perte significative des cellules. Avec divers types de cellules, nous démontrons l’encapsulation de cellules efficace dans les gouttelettes qui correspond étroitement à l’efficacité de l’encapsulation prévue par la distribution de Poisson. Notre méthode assure le chargement sans perte des cellules aux plateformes microfluidiques et peut être facilement adapté pour l’analyse de cellule unique en aval, par exemple, pour décoder les interactions cellulaires entre différents types de cellules.
Introduction
Ces dernières années, l’utilisation de la microfluidique comme une plate-forme robuste et polyvalente pour analyse cellulaire au niveau de la cellule unique a rapidement accru1. Ces plates-formes fournissent criblage à haut débit des cellules et des molécules biologiques avec haute précision et une sensibilité à l’aide de très petits échantillons volume2,3,4. Parmi les différents types de conceptions de microfluidique, plates-formes gouttelette activer l’analyse du haut débit de cellules individuelles en les isolant dans une gouttelette de phase aqueuse entouré d’une phase non miscible qui permet un contrôle précis et exact sur le cellulaire microenvironnement5,6. Axée sur les gouttelettes microfluidics donne la flexibilité d’isoler unique ou multiple-cellules dans, deux, aqueuse et gouttelettes d’hydrogel et est utile dans la détection de comportement cellulaire complexe, tels que les protéines cellulaires ou sécrétion des interactions7, 8 , 9. signalisation et diaphonie entre cellules immunitaires peuvent être influencées par des interactions avec d’autres cellules dans le microenvironnement10. Isolement des cellules individuelles dans les gouttelettes fournit un laboratoire d’analyse sans bruit efficace, exempt de l’influence des facteurs environnementaux externes pour plus efficace et plus précise des résultats11,12. Modifier la conception d’une plateforme de gouttelettes-microfluidique à entrées multiples permet l’encapsulation de plusieurs types de cellules à étudier les interactions cellulaires par appariement cellule12,13.
Le processus d’encapsulation des cellules dans les gouttelettes est aléatoire et le taux d’encapsulation des cellules peut être déterminé statistiquement à l’aide de la formule pour la distribution de Poisson14,15. Ce taux d’encapsulation peut être estimé en prenant en considération le taux moyen de l’arrivée des cellules à la jonction de gouttelettes et en supposant que l’arrivée de chaque cellule est indépendante de l’arrivée d’autres cellules16. Même si l’arrivée de la cellule indépendante ne peut être garantie, en cas de cellules clairsemées, on peut considérer l’accession à l’indépendance et la probabilité d’une gouttelette contenant une ou plusieurs cellules peut être prévus en fonction du nombre de cellules présents dans chaque gouttelette et le nombre moyen de cellules par gouttelettes16,17. Puisque cette estimation d’encapsulation cellulaire dans les gouttelettes repose sur le nombre de cellules présentes dans chaque goutte, on peut suggérer que l’augmentation de la concentration des cellules à l’entrée augmentera le nombre moyen de cellules présentes dans chaque goutte 16. par conséquent, pour assurer l’encapsulation de cellules du même, les concentrations cellulaires doivent être réduites mais souvent conduit à un grand nombre de gouttelettes vide18.
Perte des cellules pendant le chargement par attachement, sédimentation, et/ou s’agglutiner dans la seringue, tubulure ou appareil de production est un inconvénient commun responsable de la déviation des valeurs réelles d’encapsulation de l’encapsulation prédit valeurs19 . Ce problème obtient plus exagéré lors de l’ensemencement des échantillons cliniques ou des cellules immunitaires rares car elles sont déjà rares dans la population et l’encapsulation de seulement quelques cellules, beaucoup plus faibles que prévu, ne fournit pas suffisamment de données pour l’analyse expérimentale. Les cellules dendritiques Plasmacytoides (PDC) sont un sous-ensemble rare des cellules immunitaires qui ne constitue qu’environ 0,2 - 0,6 pour cent de l’ensemble blanc sang cellule population20. Ces cellules sécrètent des quantités massives d’interférons lors de l’activation de type I et ainsi jouer un rôle essentiel dans la réponse immunitaire21. Lorsque l'on étudie le comportement cellulaire de telles cellules rares dans les gouttelettes, il est impératif d’empêcher la perte de cellules pendant cellule ensemencement et encapsulation22. Il y a plusieurs développements connexes qui ont assuré l’encapsulation des cellules individuelles à l’aide de méthodes d’encapsulation active qui utilisent différentes forces physiques comme les forces acoustiques ou électriques pour la production de gouttelettes contenant des gouttelettes de conception single-cellules23,24. Cependant, ces méthodes ont leurs propres limitations en termes de production de gouttelettes16.
Dans cette étude, nous avons mis en place une méthode simple et robuste qui contourne les lacunes des méthodes traditionnelles pour le chargement des cellules simples ou multiples dispositifs microfluidiques. Notre méthode, inspirée de Rho et al., utilise des embouts taille différemment pour les semis de petits volumes de rares cellules immunitaires pour plateformes microfluidiques gouttelettes sans perte d’échantillon significatif et a donné des résultats qui soient cohérentes avec théorique 25de prédictions. Cette méthodologie peut être facilement et avec succès adapté pour pomper plusieurs axée sur les gouttelettes microfluidique et appliquée pour une grande variété de types de cellules ou même des microparticules.
Protocole
1. 3-inlet Fabrication de dispositifs de polydiméthylsiloxane (PDMS)
- Mesurer 40 g de base PDMS dans un mélangeur de conditionnement tasse et ajoutez 4 g de salaison PDMS au réactif base dans la coupe, avec soin, à l’aide d’un compte-gouttes.
- Placez le récipient dans le support de la table de mixage conditionné et mesurer le poids total de la coupe avec le titulaire. Définir la valeur de la masse centrifuge sur la table de mixage conditionné en conséquence.
- Mélanger l’agent base et durcissement dans le mélangeur de conditionnement à 2 000 tr/min pendant 2 min, suivie de moussage à 2 000 tr/min pendant 2 min.
- Préparer un bateau en aluminium, avec un diamètre environ la même taille que celui d’une plaquette de silicium de 100 mm. Placer la tranche de silicium, fabriquée pour le réplica de moulage, le bateau d’aluminium et mettre cette configuration dans une boîte de pétri (diamètre = 120 mm, hauteur = 20 mm).
Remarque : La taille de la boîte de pétri dépend de la taille de la plaquette de silicium. - Retirez la tasse du support et verser le mélange préalablement durci de PDMS (contenu de la tasse), soigneusement, sur la plaquette de silicium.
- Placez la boîte de pétri, contenant la plaquette de silicium avec le mélange préalablement durci de PDMS, dans un dessiccateur pendant environ 20 min pour enlever toutes les bulles d’air.
- Supprimer la boîte de pétri après 20 min et recherchez les bulles d’air restante pouvant être supprimés.
- Placez la boîte de pétri dans un four, réglé à 65 ° C, pendant au moins 3 h.
- Retirer le plat de pétri du four après 3 h et peler soigneusement le PDMS durci de la plaquette de silicium.
- Dispositifs PDMS coupées le long des lignes de coupe, à l’aide d’un couteau ou un scalpel. Percer des trous dans les entrées et la sortie de chaque appareil à l’aide d’un perforateur de 1,2 mm. Nettoyer chaque dispositif PDMS avec du scotch pour enlever toute poussière ou résiduelle des morceaux de PDMS.
- Éventuellement, souffler avec de l’azote pour enlever les morceaux PDMS résiduelle.
- Préparer des lames de verre en les nettoyant avec l’eau de savon, suivie d’isopropanol et sec avec de l’azote.
- Un dispositif PDMS propre avec une lame de verre propre dans un plasma de liaison asher pour fermer les conduites d’écoulement. Utilisez les paramètres suivants : puissance : 50 W, durée : 45 s, temps de retard de purge : 2 s, les gaz de procédé : gaz 1 (Air), Vent : les deux valves, Restricted vent temps : 60 s, rotation de la pompe le temps : 10 s, le temps de maintien d’évacuation : 0 s, temps d’arrêt de gaz : 1 s, Turbo pompage activé : 0. déconnecter toutes les autres lignes de gaz.
Remarque : Les paramètres utilisés pour le plasma qu'asher peut varier selon la marque du plasma asher utilisés. - Préparer la solution de silane en ajoutant 50 µL de silane (1H, 1H, 2H, 2H-Perfluorooctyltriethoxysilane) à 950 µL de fluorés huile.
NOTE : Silane est toxique. S’il vous plaît fonctionnent sous hotte aspirante. - Dessiner la solution préparée silane dans une seringue, qui est reliée à un tube téflon.
- Salinize le dispositif de rinçage de la solution de silane préparés par le biais de la sortie de l’appareil.
- Placez l’appareil dans un four, réglé à 65 ° C, pendant 30 min.
- Retirer le dispositif salinisée du four et rincer silane excédentaire hors de l’appareil avec de l’huile fluorés.
- Remettre l’appareil dans un four, réglé à 65 ° C, pendant au moins 1 h terminer le processus d’attachement.
Remarque : Le protocole peut être suspendu ici.
2. sans perte cellulaire Encapsulation
-
Récolte des cellules
- Remettre en suspension les cellules Jurkat T au milieu de Roswell Park Memorial Institute (RPMI) à des concentrations de 1.0x106 cellules/mL, 2,0.106 cellules/mL, 4.0x106 cellules/mL et 8.0x106 cellules/mL ; PDC dans hématopoïétiques sans sérum milieux de culture (par exemple, X-VIVO 15) à des concentrations de 1.3x106 cellules/mL, 3.0x106 cellules/mL et 13.0x106 cellules/mL ; Cellules A549 dans les moyen de l’aigle de la modification de Dulbecco (DMEM) à une concentration de 1.0x106 cellules/mL.
NOTE : Le type de cellules et de la concentration des cellules peut varier selon l’expérience. Étiquetage des cellules peut également être fait basé sur l’expérience.
- Remettre en suspension les cellules Jurkat T au milieu de Roswell Park Memorial Institute (RPMI) à des concentrations de 1.0x106 cellules/mL, 2,0.106 cellules/mL, 4.0x106 cellules/mL et 8.0x106 cellules/mL ; PDC dans hématopoïétiques sans sérum milieux de culture (par exemple, X-VIVO 15) à des concentrations de 1.3x106 cellules/mL, 3.0x106 cellules/mL et 13.0x106 cellules/mL ; Cellules A549 dans les moyen de l’aigle de la modification de Dulbecco (DMEM) à une concentration de 1.0x106 cellules/mL.
-
Astuce-chargement pour la production de gouttelettes aqueux
- Préparer l’huile fluoré avec mélange de surfactant biocompatible de 3 % en ajoutant 3 mL d’agent tensio-actif à 2 mL d’huile fluorés.
Remarque : La concentration de l’agent tensio-actif ajouté à l’huile fluorés détermine la stabilité de l’émulsion pour les périodes d’incubation différentes. La concentration de l’agent de surface varie selon le support utilisé pour les types de cellules spécifiques. - Dessiner le mélange de phase huile dans une seringue (1 mL). Retirer les bulles d’air de la seringue et le connecter à un tube téflon de longueur appropriée.
- Préparez une seringue d’échantillon en dessin biocompatible huile minérale dans une seringue. Enlever les bulles d’air et raccorder la seringue à un tube téflon de longueur appropriée.
- Perforez une fiche PDMS avec un diamètre de 5 mm d’une dalle PDMS durcie.
Remarque : La dalle PDMS durcie peut être préparée en procédant de 1,1 à 1,9. Utiliser une plaquette de silicium ordinaire au lieu d’une plaquette de silicium fabriqué. - Percer un autre trou au centre du bouchon avec un perforateur de 1 mm.
- Insérer la fiche dans un cône de pipette 200 µL, de l’extrémité la plus grande, telle qu’elle s’adapte étroitement.
Remarque : Utiliser un embout de pipette µL 1 000 pour le plus grand volume de l’échantillon et des cellules plus grandes. Pour 1 000 de pipette µL, bouchons de diamètre compris entre 5 et 7 mm peuvent être utilisés. Avec un bouchon de diamètre 5 mm, un volume d’échantillon d’environ 400 µL peut être aspiré dans l’embout de la pipette. Si une fiche de plus grand diamètre est utilisé (7 mm), plus volume de l’échantillon peut être aspirée (autour de 900 µL). - Insérer le tuyau, qui est relié à la seringue, dans la fiche PDMS, qui a été insérée dans l’embout de la pipette. Pousser le piston de la seringue lentement pour remplir la pipette connecté avec l’huile minérale. Pousser l’air résiduel de l’embout de la pipette.
- Abaissez l’embout de la pipette, relié à la seringue, de la solution échantillon et aspirer environ 150 µL de l’échantillon dans la pointe.
- Répétez les étapes 2.2.4 à 2.2.8 pour préparer une deuxième seringue d’échantillon.
- Placer soigneusement tous les trois seringues préparées sur le pousse-seringue.
- Insérez les deux les pointes de pipette, contenant l’échantillon, à l’intérieures deux arrivées de la puce PDMS. Insérer le tube contenant le mélange de phase huile dans la périphérie de l’inlet.
- Définissez la valeur des débits sur le pousse-seringue comme suit : solution de phase continue : 600 échantillons de cellules µL/h, : 100 µL/h, chaque. Entrez et définissez les dimensions de la seringue.
NOTE : Le diamètre paramètres variera selon le type de seringue. - Démarrer la pompe pour vider la solution de l’échantillon à travers les canaux intérieurs de la phase de périphérique et de l’huile à travers le canal externe de l’appareil.
- Brancher un tuyau d’une longueur appropriée pour la prise de commencer à collecter les gouttelettes lors de la formation de gouttelettes est stable. Moment de la collecte varie selon l’expérience.
- Recueillir les gouttelettes en suspension dans un tube de verrouillage. Ajouter 200 µL de milieu RPMI (sans sérum) sur le dessus les gouttes recueillies et incuber l’échantillon.
Remarque : L’Incubation varie de temps des gouttelettes recueillies basé sur l’expérience. Gouttelettes sont recueillis dans un tube de verrouillage lors de l’analyse axée sur la cytométrie en flux ou l’isolement est effectuée après avoir récupéré les cellules de gouttelettes par la rupture de l’émulsion. Il est possible de recueillir les gouttes dans une enceinte de verre si l’expérience nécessite l’analyse au microscope en gouttelettes.
- Préparer l’huile fluoré avec mélange de surfactant biocompatible de 3 % en ajoutant 3 mL d’agent tensio-actif à 2 mL d’huile fluorés.
-
Emulsion de rupture et cellule de récupération pour cytométrie
- Préparer 20 % 1H, 1H, 2H, 2H-Perfluoro-1-octanol solution de (PFO) (v/v) dans de l’huile fluorés en ajoutant 2 mL d’un FOP dans 10 mL d’huile de flourinated.
- Enlever l’excédent d’huile par le bas du tube collection, contenant les gouttelettes, à l’aide d’une seringue.
- Ajouter 100 µL de solution PFO de 20 % à l’émulsion de briser l’émulsion et libérer les cellules encapsulées dans la phase aqueuse. TAP et mélanger brièvement. Ne pas vortexer à ce stade. Incuber pendant 1-2 min.
Remarque : La quantité de PFO ajoutée dépend de la quantité de gouttelettes produites. Continuez à ajouter PFO supplémentaire jusqu'à dissolution complète de la couche d’huile. N’oubliez pas que le FOP est toxique pour les cellules et que des concentrations trop élevées de PFO ou trop longue incubation dans PFO pourrait conduire à augmente la mort cellulaire. - Faites tourner la solution prochainement à la rcf le plus bas possible pendant 30 s.
- Préparer 100 mL de solution de Phosphate-Buffered Saline (PBS) froide additionné de 2 % sérum de veau foetal (FCS) (2 mL de FCS en 98 mL de PBS).
- Distribuer des 550 µL de la fraction aqueuse, immédiatement après centrifugation et le transférer dans un nouveau tube de verrouillage contenant 500 µL de solution de PBS froide additionnée de 2 % FCS, tel qu’établi à l’étape 2.3.5. Laissez l’huile résiduelle évier au fond du nouveau tube de verrouillage.
- Aspirer 950 µL de la phase aqueuse contenant les cellules de ce tube de verrouillage, avec précaution, sans aspirer toute l’huile résiduelle et transvaser la solution dans un nouveau tube de verrouillage.
- Tournez en bas les cellules dans le nouveau tube de verrouillage pendant 10 min.
- Remettre en suspension les cellules dans 300 µL de solution de PBS froide additionnée de 2 % FCS, tel qu’établi à l’étape 2.3.5.
Remarque : Les cellules peuvent être également remis en suspension dans toute autre solution appropriée comme les médias selon l’expérience. Colorer les cellules, basés sur l’expérience, pour l’analyse à l’aide de cytométrie en flux.
3. cellule appariement
-
Cellule de récolte et de coloration
- Compter les cellules Jurkat T, du flacon de culture et tournez en bas des cellules à 1 500 tr/min pendant 5 min.
- Retirez le surnageant et remettre en suspension les cellules6 1.0x10 dans 1 mL de PBS pour obtenir une concentration de 1.0x106 cellules/mL. Le montant de PBS a ajouté dépend du nombre d’éléments.
- Répétez les étapes 3.1.1 à la 3.1.2 pour préparer un second échantillon de cellules T Jurkat avec la même concentration de cellules.
- Lavez les deux échantillons deux fois avec 1 mL de PBS à 1 500 tr/min pendant 5 min.
- Réactiver un échantillon cellulaire avec 1,25 µM carboxyfluorescéine succinimidyl ester (CFSE) colorant et l’autre échantillon cellulaire avec 1,25 colorant rouge sombre µM ou 1,25 colorant de prolifération cellulaire µM à une concentration de cellules de 1.0x106 cellules/mL. Le total solution de coloration est de 1 mL pour 1.0x106 cellules.
Remarque : Les cellules peuvent être étiquetés colorants différents selon les filtres disponibles dans le cytomètre en flux ou dans le microscope de fluorescence. - Incuber les échantillons de cellules avec des teintures pendant 10 min à 37 ° C.
- Arrêter la réaction de coloration en ajoutant 1 mL de glace FCS froid après 10 min.
- Laver les échantillons de cellules deux fois avec 1 mL de PBS à 1 500 tr/min pendant 5 min.
- Remettre en suspension les échantillons de cellules en milieu RPMI à une concentration de 10.0x106 cellules/mL, pour chaque couleur.
-
Chargement de pointe pour la production de gouttelettes hydrogel d’agarose pour le couplage de la cellule
Remarque : Pour cellule appariement à l’aide d’agarose hydrogel gouttelettes, maintenir la température du système entre 27 ° C et 37 ° C au cours des gouttelettes génération et collection pour empêcher la gélification des hydrogels et pour justifier la viabilité cellulaire9.- Dissoudre l’agarose gélifiant ultra faible de la température en le chauffant jusqu'à 75 ° C dans du PBS à une concentration de 4 % (p/v) et agiter le mélange pendant 20 min.
- Mélanger la solution de gel d’agarose avec marqué T Jurkat cellules pour produire une concentration d’agarose de 2 % (p/v). Répétez cette opération pour l’autre échantillon avec cellules marquées différemment.
- Préparer de l’huile avec 2 % mélange de surfactant fluorés en ajoutant 20 mL d’agent tensio-actif dans 30 mL d’huile fluorés (mélange de phase huile).
- Suivez les étapes 2.2.2 - 2.2.14.
Remarque : En raison de la nature visqueuse d’agarose fusion faible et pour assurer une production stable de gouttelettes, définissez la valeur des débits sur les pompes à seringue comme suit : phase de mélange : 2 000 échantillons de cellules µL/h, : 200 µL/h. Entrez et définissez les dimensions de la seringue. - Récupérer les gouttelettes dans un tube de verrouillage et incuber les gouttelettes à 4 ° C pendant 60 min.
-
Emulsion de rupture et agarose récupération de perle pour l’analyse des FACS
- Après une incubation de gouttelettes pendant 60 min, enlever l’excédent d’huile dans le tube de verrouillage, contenant les gouttelettes, à l’aide d’une seringue.
- Ajouter 200 µL de PFO pour enlever l’interphase huile de gouttelettes.
Remarque : La quantité de PFO ajouté au tube dépend de la quantité de gouttelettes produites. Continuez à ajouter PFO supplémentaire jusqu'à dissolution complète de la couche d’huile. - Laver les billes d’agarose prélevés deux fois avec 1 mL de PBS froide pour enlever l’huile complètement par centrifugation à 1 500 tr/min pendant 10 min.
- Analyser les perles agarose recueillies à l’aide de cytométrie en flux.
Remarque : Il est également possible d’observer les perles sous un microscope à fluorescence.
Résultats
Nos expériences, nous avons utilisé un dispositif de microfluidique base de PDMS 3-entrée avec la hauteur de 25 microns (Figure 1). Dans cette configuration de l’appareil, nous avons utilisé l’entrée externe pour le rinçage de l’huile avec l’agent de surface et l’intérieures deux arrivées pour rincer les phases aqueuses avec suspensions cellulaires ou des médias. Après la génération et de la perception, les gouttelettes sont incubés pendant quelques heures de repos puce avant à l’aide de l’analyse en aval de cytométrie. Au cours de la période d’incubation, sérum composants présents dans les médias peuvent interagir avec le surfactant et gouttelettes deviennent instables et se désintègrent. Il est donc important d’ajouter une concentration optimisée d’agent tensio-actif à l’huile fluorés. Nous avons testé la stabilité des gouttelettes monodisperses contenant hématopoïétique milieux de culture sans sérum additionné de 2 % de sérum humain avec différentes concentrations d’agent tensio-actif fluoré huile. Il peut être déduit de la Figure 2 que ces gouttelettes monodisperses sont hautement stable pendant 24 heures, lorsqu’au moins 3 % agent tensio-actif est ajouté à la phase huileuse. Des résultats similaires ont été obtenus avec médias RPMI avec et sans addition de 10 % de FCS (données non présentées). Stabilité des gouttelettes est donc fortement dépendante des concentrations optimales agent tensio-actif lorsque vous travaillez avec différentes sources des milieux de culture et de composants de sérum.
Pour démontrer l’efficacité de l’encapsulation de notre approche nous avons semé tout d’abord les cellules à l’aide de tubes reliés aux seringues, qui est l’approche plus classique pour l’ensemencement des cellules (Figure 3A). Nous avons récoltés cellules Jurkat T à diverses concentrations de 1.0x106 cellules/mL, 2,0.106 cellules/mL et 4.0x106 cellules/mL et obtenu une efficacité d’encapsulation qui était inférieure aux valeurs prédites (Figure 3B). 1.0x106 cellules/ml, la fraction des gouttelettes contenant une seule cellule était de 2,5 %, qui ne relève pas encore sur l’utilisation des concentrations plus élevées de cellule. Pour augmenter l’efficacité de la cellule de chargement, nous modifié notre approche antérieure et monté le tube à la moitié de la longueur d’un trépied surélevé et chargé la suspension cellulaire au cours du semestre qui était joint à l’appareil PDMS (Figure 4A). En utilisant cette approche, nous encapsulé cellules Jurkat T à différentes concentrations de 1.0x106 cellules/mL, 2,0.106 cellules/mL et 4.0x106 cellules/mL et aussi rares PDC à différentes concentrations de 1.0x106 cellules/mL, 2,0.106 cellules/mL et 12.0x106 cellules/mL. Nous nous attendions encapsulation meilleur taux en empêchant la sédimentation de la cellule avec cette méthode. Cependant, à toutes les concentrations testées, les résultats expérimentaux ont été beaucoup plus faibles que le Poisson prévu valeurs (Figure 4B et 4 de la FigureC).
À l’aide de notre approche de chargement de pointe, nous avons optimisé nos tarifs d’encapsulation de cellules pour obtenir des résultats expérimentaux cohérentes avec les valeurs statistiquement prédites (Figure 5A). Pour différentes concentrations de cellules Jurkat T, l’efficacité obtenue encapsulation correspondants à nos valeurs calculées à toutes les concentrations (Figure 5B). Fait remarquable, même avec des cellules adhérentes comme cellules A549 tumeur, qui ont tendance à s’agglutiner, nous avons observé une efficacité d’encapsulation légèrement améliorée à une concentration cellulaire de 1.0x106 cellules/mL (Figure 5C). Nous avons également évalué l’efficacité de notre système pour encapsuler des PDC moins disponibles et rares à des concentrations cellulaires de 1.0x106 cellules/mL, 3.0x106 cellules/mL et 13.0x106 cellules/mL (Figure 5D). Pour faciliter le chargement de probablement de plus grands volumes dépassant 200 µL, par exemple, lorsque vous travaillez avec des lignées de cellules ou plus abondantes cellules immunitaires primaires, nous avons étudié aussi l’efficacité d’encapsulation de cellules par utilisation de 1000 µL conseils (en bleu). Nous avons démontré que ces 1 000 conseils µL a donné une efficacité similaire d’encapsulation en comparaison avec les 200 conseils µL (jaune) (Figure 5E).
Dépend de la puce design et recherche question à portée de main, notre conseil technique de chargement peut être utilisé pour charger les cellules via une entrée, pour sonder la hétérogénéité cellulaire, ou des entrées multiples en parallèle, pour le décodage des interactions cellulaires. Nous avons comparé le chargement de cellules Jurkat T (à une concentration de 10.0x106 cellules/mL) d’une entrée à deux populations marquées différemment des cellules Jurkat T (à une concentration totale de 10,0 x106 cellules/mL) de deux entrées (Figure 6 A et Figure 6B). Au cours de l’encapsulation, les gouttelettes ont été générés à l’aide d’agarose gélifiant ultra faible de la température et gélifié après production de forme d’agarose hydrogel perles qui a permis une analyse ultérieure en aval via microscopie et écoulement cytometry (Figure 6 C et Figure 6D). L’analyse au microscope a révélé que cellule appariement a été réalisé aux différentes combinaisons indiquant pour cellulaire à haut débit, appariement (Figure 6C). En outre, l’analyse de la même population d’hydrogel perles par cytométrie en flux a révélé que perles sans cellules peuvent être distingués des perles avec cellules basées sur le forward distinct (FSC, taille) et latéralement (SSC, granularité) modèle de dispersion (Figure 6 D). Blocage sur la population de perles sans cellules confirmé un manque d’encapsulation des cellules par l’absence de signaux fluorescents. En outre, blocage sur la population de billes avec cellules a révélé l’existence de multiples indicatif de sous-populations pour l’encapsulation de cellules de T Jurkat différemment étiquetées. Nos résultats montrent que l’appariement efficace cellule peut être réalisé, basé sur les deux microscopiques et analyse par cytométrie en flux d’écoulement et a montré une efficacité d’encapsulation légèrement augmenté par rapport à la prévision de Poisson (Figure 6E).
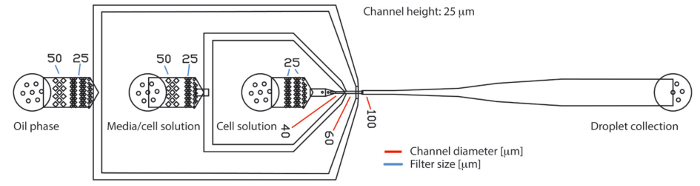
Figure 1 . Dispositif de microfluidique de gouttelettes PDMS basé avec trois entrées et une sortie. Le dispositif se compose de trois entrées pour la phase huileuse continue, milieux de culture cellulaire et suspension de cellules, respectivement. Les gouttelettes générées sont recueillies à la sortie. Les échantillons de débit laminarly à la jonction de flux de mise au point où ils sont encapsulés dans les gouttelettes. Les bras de mer, filtre structures tenir les grosses particules comme protéine ou agrégats cellulaires en arrière. Le diamètre des trous dans la structure du filtre sont indiquées par des lignes bleues. Le diamètre des canaux au niveau du bec de production sont indiqués par des lignes rouges. La hauteur du canal sur la puce toute était de 25 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 . Stabilité de gouttelettes plus de 24 heures. Les graphiques montrent la zone des gouttelettes contenant des milieux de culture sans sérum hématopoïétique + 2 % de sérum humain, au fil du temps pour trois différentes concentrations d’agent tensio-actif A) 0,5 % B) 3 % C) 5 %. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
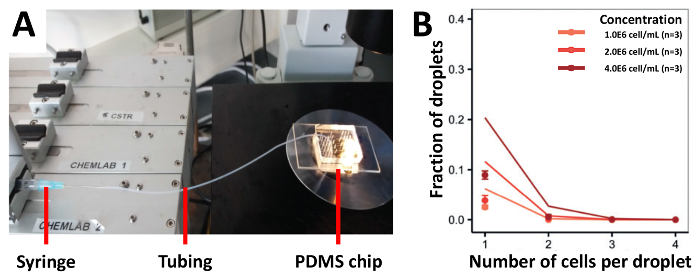
Figure 3 . Tube basé cell approche de chargement. Cellules Jurkat-T sont chargés à différentes concentrations à l’appareil à l’aide d’une seringue reliée à un tube. A) l’illustration montre le montage expérimental B) le taux d’encapsulation de cellules tel que déterminé par microscopie photonique. Points : déterminé expérimentalement les valeurs ; Fermé les lignes : distribution de Poisson. Barre d’erreur représente écart-type de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 . Encapsulation de divers types de cellules à différentes concentrations, à l’aide d’un tube vertical chargement approche. Les cellules T Jurkat et PDC (de différentes concentrations) était encapsulés pour déterminer l’efficacité de l’encapsulation de cellules. A) l’illustration montre le montage expérimental pour le tube vertical chargement approche. B) le graphique montre l’efficacité de l’encapsulation de T Jurkat cellules. C) le graphique montre l’efficacité de l’encapsulation du PDC. Points : déterminé expérimentalement les valeurs ; Fermé les lignes : distribution de Poisson. Barre d’erreur représente écart-type de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
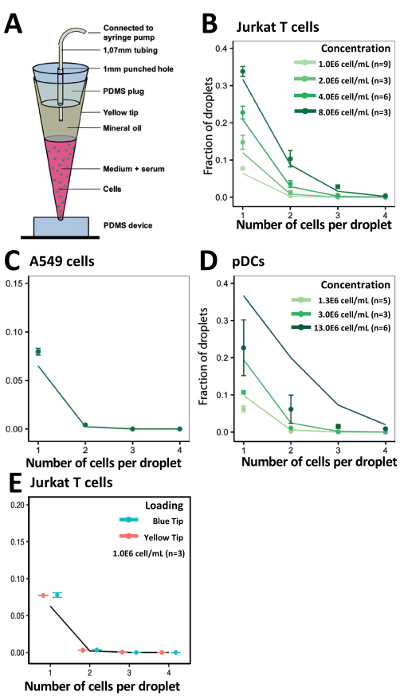
Figure 5 . Conseil chargement approche pour contenir des types de cellules différentes. A) illustration schématique de la pointe technique de chargement. B) le graphique montre l’efficacité de l’Encapsulation des cellules Jurkat. C) le graphique montre l’efficacité de l’encapsulation des cellules A549. D) le graphique montre l’efficacité de l’encapsulation du PDC. E) le graphique montre l’efficacité de l’encapsulation de T Jurkat cellules à l’aide de pointes de pipette de 200 µL (jaunes) et 1 000 pointes de pipette µL (bleu). Points : déterminé expérimentalement les valeurs ; Fermé les lignes : distribution de Poisson. Barre d’erreur représente écart-type de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
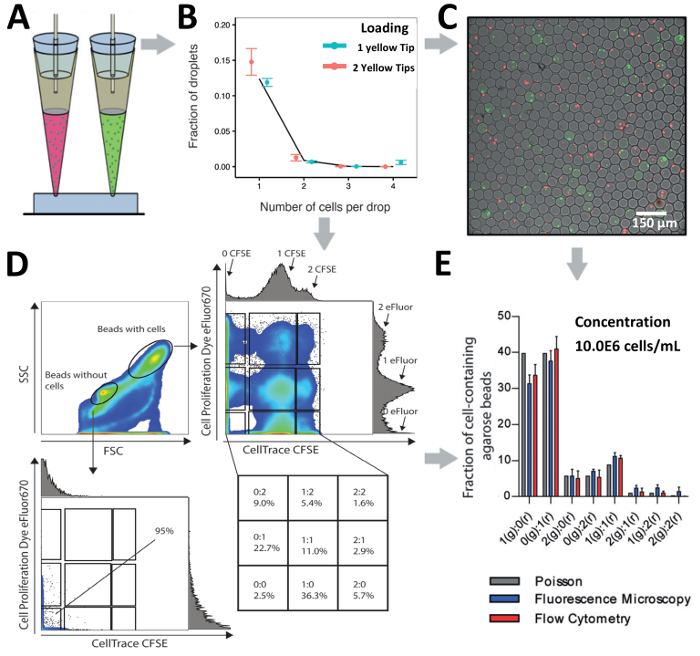
Figure 6 . Cellule appariement en gouttelettes. A) illustration schématique de la pointe à l’approche pour l’appariement des cellules distinctes de 2 entrées dans les gouttelettes de chargement. B) le graphique montre l’encapsulation of T Jurkat cellules à l’aide d’une entrée ou deux arrivées en parallèle. La concentration de cellules pour une astuce est 2,0.106 cellules/mL et la concentration en cellules pour deux conseils les deux 1.0x106 cellules/mL. Points : déterminé expérimentalement les valeurs ; Fermé les lignes : distribution de Poisson. C) la Fluorescence microscopique des superpositions de hydrogel perles et cellules T Jurkat marquées. D) Le graphique montre la cytométrie de cellules appariées en gel d’agarose hydrogel perles. L’intrigue démontre avant dispersion et scatter latéralement. E) comparaison du nombre de cellules en gel d’agarose hydrogel perles tel que détecté par fluorescence microscopie et écoulement cytometry. Barres : moyenne ; Moustaches : erreur-type de la moyenne, n ≥ 4. Barre d’erreur représente écart-type de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Dans ce protocole, nous avons démontré une technique simple et efficace de charger et d’encapsuler des cellules dans les gouttelettes d’analyse haut-débit, unicellulaires et faire une cellule contrôlée appariement pour les études d’interactions cellulaires. En outre, nous avons comparé plusieurs approches conventionnelles pour charger les cellules aux dispositifs microfluidiques et a montré que notre Conseil approche de chargement est une technique plus efficace par rapport aux autres méthodes.
Etudier des échantillons cliniques ou types de rares cellules limitées en nombre par microfluidique axée sur les gouttelettes possèdent certains défis inhérents. Comme nous l’avons aussi démontré, cellules ont tendance à sédiment de surface de la tuyauterie, seringues et ainsi, prévenir l’encapsulation cellulaire pour se conformer aux valeurs prédites. Pour contourner ce problème, certains groupes utilisent des barres de l’agitation dans les seringues. Toutefois, lors de l’utilisation de populations cellulaires rares et limitées, le volume total de cellules est également limité, ainsi, limitant l’utilisation de seringues grands et en remuant les barres. En outre, nous avons remplacé aussi tubes plus couramment utilisées avec téflon tuyauterie afin d’éviter la fixation des cellules, mais cette méthode n’a pas amélioré les résultats et si le tuyau est trop long, le problème de la fixation des cellules aggrave (données non présentées). Par ailleurs, nous avons utilisé un tube vertical chargement approche où les cellules ont été chargées dans le tube et non dans la seringue pour éviter la perte de cellules dans des volumes de grande seringue. En utilisant cette technique, cellules avec le volume de l’échantillon peut être chargé, par exemple, les PDC qui sont rares et limitées. En outre, l’échantillon de la tubulure est chargé à l’appareil verticalement pour éviter la sédimentation de cellule. Les tubes utilisés pour l’ensemencement de cellule a de petites dimensions et peuvent être comparé à microcanaux. L’écoulement dans la tuyauterie est piloté par la pression et suit un profil de vitesse parabolique26. Ceci implique que la vitesse d’écoulement maximal est au centre du tuyau et la vitesse minimale est sur les bords du tube27. Lors du rinçage une population de cellules par l’intermédiaire de la tubulure, le gradient de vitesse entraîne les cellules d’être poussé vers les bords, où ils s’installent parce que la vitesse à la limite est proche de zéro. La sédimentation ou le règlement de cellules dans la tubulure, réduit ainsi, l’efficacité de l’encapsulation, comme le montre les résultats représentatifs où les données expérimentales ne correspondait pas avec le modèle prédit.
Une autre solution adaptée couramment utilisée par les scientifiques, qui travaillent avec les gouttelettes microfluidique, est d’augmenter la densité des milieux de culture cellulaire par addition de densité correspondant à des réactifs tels que Iodinaxol pour empêcher la sédimentation de la cellule en seringues19. Cependant, la densité correspondant à réactifs peut influencer le comportement cellulaire et négativement affecte la sécrétion de cytokines par les cellules (données non présentées),28.
Même si plusieurs petites et grandes modifications dans la cellule classique, techniques de chargement a montré légères améliorations dans l’efficacité de l’encapsulation, les résultats expérimentaux obtenus encore ne correspondent pas les calculs théoriques. Cependant, avec l’extrémité approche de chargement, nous pourrions surmonter les limitations des méthodes précédentes et l’efficacité de l’encapsulation régies par la statistique de Poisson. Cette technique n’est pas seulement avantageuse pour le chargement des cellules en suspension, mais peut également être appliquée pour le chargement des cellules adhérentes, tels que les kératinocytes primaires et A549 à puces microfluidiques. Lors de l’utilisation de lignées de cellules abondantes, A549, K562, etc., par exemple plus grand volume de l’échantillon peut être utilisé. Par conséquent, selon le volume de l’échantillon, différentes pointes de pipette tailles peuvent également être utilisés, et cette technique simple peut être adaptée pour encapsulation de cellules individuelles et multiples encapsulation de cellules.
Alors que la concentration cellulaire faible est nécessaire pour assurer l’encapsulation des cellules individuelles dans les gouttelettes, des concentrations plus élevées de cellules sont souhaitées pour augmenter le nombre moyen de cellules encapsulées dans chaque goutte des études relies au couplage de la cellule. Il existe plusieurs méthodes de cellules individuelles qui ont été décrits précédemment aux cellules immunitaires paire sur puces microfluidiques ou microfabriques nanowells29,30,31. En gouttelettes microfluidique, Poisson statistiques dicte cette cellule de 1:1 pairing pour deux types différents de cellules peut être réalisée à des concentrations de la cellule optimale. Basé sur la prédiction de Poisson, il y a également une probabilité que les gouttelettes peuvent contenir d’autres combinaisons. Tandis que 1:1 cellule appariement peut être souhaitable d’étudier les interactions cellulaires au niveau de la cellule unique et résultats dans l’amélioration de la compréhension cellulaire, appariement de multiples cellules dispose également d’atouts majeurs. Il permet de comprendre l’influence de plusieurs cellules d’un type de cellule à l’autre type de cellule. La diaphonie entre les différentes cellules immunitaires aident à générer une réponse immunitaire efficace contre plusieurs infections et des pathogènes et ajoute également la robustesse de notre système immunitaire32. Par conséquent, la communication cellulaire peut être interrogée avec une grande précision dans les contextes distincts, par exemple, 1:1, 2:1, 1:2, 2:2, 3:1, etc.. rendement à une meilleure compréhension sur la façon dont seul ou paires de cellules contrôlent l’induction des réponses immunitaires. Ceci est particulièrement intéressant d’étudier par exemple la capacité des cellules tueuses naturelles ou les cellules T cytotoxiques pour tuer en série leurs cellules cibles respectifs.
Tel que discuté, pour plusieurs d’encapsulation des cellules dans les gouttelettes, des concentrations plus élevées de cellule sont souhaitées. Cependant, lors du chargement des cellules d’une entrée pour l’encapsulation de cellules, des concentrations plus élevées d’échantillon cellulaire peuvent causer des cellules à s’agréger à l’entrée. Cela se traduit par des taux plus faibles d’encapsulation et de déviation supérieure de valeurs théoriques. Pour contourner ce problème, les cellules peuvent être chargés de deux entrées séparées aussi bien. Théoriquement, il serait possible de développer d’autres dispositifs microfluidiques à entrées multiples pour atteindre des niveaux plus élevés de l’encapsulation de cellules où une moyenne sur x nombre de cellules est justifiée. Dans cette étude, nous avons étudié l’efficacité de l’encapsulation des cellules T Jurkat lorsqu’elles sont chargées à la fois une entrée et deux entrées à l’aide de la même concentration totale et obtenu semblable efficacité d’encapsulation. Cette modification permet aux chercheurs de types de cellules différents couples sur puce.
Bien que cette méthode aide à cellules de dispositifs microfluidiques sans perte significative des cellules de charge, il y a certaines précautions qu’il faut garder à l’esprit. Lors du remplissage des seringues avec huile minérale et en aspirant l’échantillon cellulaire en pointes de pipette, incorporation de bulles d’air doit être évitée et l’ensemble du système devrait être sans air. Il est également important de garder à l’esprit que l’huile minérale ne devrait pas mélanger avec l’échantillon. Pointes de pipette, contenant des échantillons, doivent être insérés fermement dans les criques du dispositif microfluidique, avec la plus grande précaution, pour éviter les fuites et outre l’incorporation de bulles d’air. Pour résumer, astuce-chargement est une technique simple, pourtant, robuste qui permet pour analyse de haut-débit du comportement cellulaire grâce à l’encapsulation de cellules sans perte significative des cellules de façon rentable. Lorsqu’il est utilisé avec des concentrations d’échantillon optimale à l’entrée, cette approche de cellules avec des pointes de pipette de chargement est très flexible et peut être adaptée pour différents types de cellules, en particulier pour les rares cellules immunitaires primaires, afin d’obtenir une plus grande efficacité de l’encapsulation, près de modèles prévus.
Déclarations de divulgation
Nous n’avons rien à divulguer.
Remerciements
Nous remercions l’Université technique d’Eindhoven, de généreux soutien.
matériels
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 171468-5G | |
| 1H,1H,2H,2H-Perfluorooctyltriethoxysilane | Fluorochem/UK | S13150 | Silane (toxic) |
| Agarose (Ultra-low Gelling Temperature) | Sigma-Aldrich | 9012-36-6 | |
| BD Wegwerpspuiten met Luer-Lok-punten | Fisher Scientific | 10630694 | Syringe |
| Biopsy Punch 1.2 mm | Harris Uni-Core | ||
| Cell Proliferation Dye eFluro 670 | eBioscience | 65-0840-85 | |
| CellTrace CFSE | Invitrogen | C34554 | |
| CellTrace Far Red Cell | Invitrogen | C34564 | |
| Eppendorf Tubes | Eppendrof Tubes | Safe-Lok tubes 1 mL and 2 mL | |
| Glass Slide | Sigma Aldrich | CLS294775X38-72EA | Corning microscope slides, plain L × W 75 mm × 38 mm |
| Harvard Pumps | Harvard Apparatus | C-400750; C-400727 | Syringe pumps |
| HFE-7500 3M Novec Engineered fluid | Fluorochem/UK | 51243 | Flourinated oil |
| Kai Biopsy Punch 5 mm | Amstel Medical | 1980130 | |
| Luer stub | Instechlabs/USA | LS20S | Luer stub, 20ga (pink) x 0.5in (12mm), non-sterile |
| Mineral oil (Light) | Sigma Aldrich | M8410-1L | |
| Phosphate buffered saline | Sigma-Aldrich | P4417-50TAB | Tablets |
| Pico-Surf 1 (5%in Novec 7500) | Sphere Fluidics | 020317-09 | Surfactant |
| Plasma Asher | Emitech | K1050X | Plasma asher |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Silicone Elastomer Base 184 | Sylgard | 9355218 | PDMS base |
| Silicone Elastomer Curing Agent | Sylgard | 9355218 | Curing Agent |
| Stainless steel catheter coupler | Instechlab/USA | SC20/15 | 20ga x 15mm, non-sterile |
| TFE Teflon Tubing | Sigma-Aldrich | 58696-U | PTFE Tubing L × O.D. × I.D. 50 ft × 1/16 in. × 0.031 in. |
| Thinky mixer ARE-250 | EX-4025F | Conditioning mixture |
Références
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Current Opinion in Biotechnology. 23 (1), 110-119 (2012).
- Meyvantsson, I., Beebe, D. J. Cell Culture Models in Microfluidic Systems. Annual Review of Analytical Chemistry. 1, 423-429 (2008).
- Yi, C., Li, C. W., Ji, S., Yang, M. Microfluidics technology for manipulation and analysis of biological cells. Analytica Chimica Acta. 560, 1-23 (2006).
- Wang, H. Y., Bao, N., Lu, C. A microfluidic cell array with individually addressable culture chambers. Biosensors and Bioelectronics. 24, 613-617 (2008).
- Zhang, Y., et al. A programmable microenvironment for cellular studies via. microfluidics-generated double emulsions. Biomaterials. 34 (19), 4564-4572 (2013).
- Teh, S. -. Y., Lin, R., Hung, L. -. H., Lee, A. P. Droplet microfluidics. Lab on a chip. 8 (2), 198-220 (2008).
- Hu, H., et al. Efficient cell pairing in droplets using dual-color sorting. Lab Chip. 15 (20), 3989-3993 (2015).
- Brouzes, E., et al. Droplet microfluidic technology for single-cell high-throughput screening. Proceedings of the National Academy of Sciences. 106 (34), 14195-14200 (2009).
- Chokkalingam, V., et al. Probing cellular heterogeneity in cytokine-secreting immune cells using droplet-based microfluidics. Lab on a Chip. 13 (42), 4740 (2013).
- den Haan, J. M. M., Arens, R., van Zelm, M. C. The activation of the adaptive immune system: Cross-talk between antigen-presenting cells, T cells and B cells. Immunology Letters. 162 (2), 103-112 (2014).
- Shah, G. J., Ohta, A. T., Chiou, E. P. -. Y., Wu, M. C., Kim, C. -. J. EWOD-driven droplet microfluidic device integrated with optoelectronic tweezers as an automated platform for cellular isolation and analysis. Lab on a Chip. 9 (12), 1732 (2009).
- Griffiths, A. D., Tawfik, D. S. Miniaturising the laboratory in emulsion droplets. Trends in Biotechnology. 24 (9), 395-402 (2006).
- Lagus, T. P., Edd, J. F. High-throughput co-encapsulation of self-ordered cell trains: cell pair interactions in microdroplets. RSC Advances. 3, 43 (2013).
- Moon, S., Ceyhan, E., Gurkan, U. A., Demirci, U. Statistical modeling of single target cell encapsulation. PLoS ONE. 6 (7), (2011).
- Abate, A. R., Chen, C. -. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628 (2009).
- Collins, D. J., Neild, A., deMello, A., Liu, A. -. Q., Ai, Y. The Poisson distribution and beyond: methods for microfluidic droplet production and single cell encapsulation. Lab Chip. 15 (17), 3439-3459 (2015).
- Kemna, E. W. M., et al. High-yield cell ordering and deterministic cell-in-droplet encapsulation using Dean flow in a curved microchannel. Lab on a Chip. 12 (16), 2881 (2012).
- Köster, S., et al. Drop-based microfluidic devices for encapsulation of single cells. Lab on a Chip. 8 (7), 1110 (2008).
- Mazutis, L., et al. Single-cell analysis and sorting using droplet-based microfluidics. Nature Protocols. 8 (5), 870-891 (2013).
- Sun, P., et al. Functional characterization of ex vivo. blood myeloid and plasmacytoid dendritic cells after infection with dengue virus. Virology. 383 (2), 207-215 (2009).
- Tel, J., et al. The chemotherapeutic drug oxaliplatin differentially affects blood DC function dependent on environmental cues. Cancer Immunology, Immunotherapy. 61 (7), 1101-1111 (2012).
- Wimmers, F., et al. Single-cell analysis reveals that stochasticity and paracrine signaling control interferon-alpha production by plasmacytoid dendritic cells. Nature Communications. 9 (1), 3317 (2018).
- Gong, J., Kim, C. -. J. All-electronic droplet generation on-chip with real-time feedback control for EWOD digital microfluidics. Lab on a Chip. 8 (6), 898 (2008).
- Demirci, U., Montesano, G. Single cell epitaxy by acoustic picolitre droplets. Lab on a Chip. 7 (9), 1139 (2007).
- Rho, H. S., Yang, Y., Veltkamp, H. -. W., Gardeniers, H. Direct Delivery of Reagents from a Pipette Tip to a PDMS Microfluidic Device. Chips and Tips. , (2015).
- Paul, P. H., Garguilo, M. G., Rakestraw, D. J. Imaging of Pressure- And Electrokinetically Driven Flows through Open Capillaries. Analytical Chemistry. 70 (13), 2459-2467 (1998).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Physics Today. 54, 42 (2001).
- Mita, A., et al. Anti-proinflammatory Effects of Iodixanol (OptiPrep)-Based Density Gradient Purification on Human Islet Preparations. Cell Transplant. 19 (12), 1537-1546 (2013).
- Dura, B., et al. Profiling lymphocyte interactions at the single-cell level by microfluidic cell pairing. Nature Communications. 6 (1), 1-13 (2015).
- Dura, B., et al. Longitudinal multiparameter assay of lymphocyte interactions from onset by microfluidic cell pairing and culture. Proceedings of the National Academy of Sciences. 113 (26), 3599-3608 (2016).
- Yamanaka, Y. J., et al. Single-cell analysis of the dynamics and functional outcomes of interactions between human natural killer cells and target cells. Integrative Biology. 4 (10), 1175 (2012).
- Satija, R., Shalek, A. K. Heterogeneity in immune responses: From populations to single cells. Trends in Immunology. 35 (5), 219-229 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon