Method Article
Пипетки Tip на основе метода для заполнения клеток капелька Microfluidic платформ
В этой статье
Резюме
Эта статья представляет собой протокол для посева дефицитных популяция клеток с помощью пипетки советы для капли microfluidic приборы для того, чтобы обеспечить более высокую эффективность инкапсуляции клеток в капельки.
Аннотация
Среди различных microfluidic платформа конструкции часто используются для клеточного анализа капелька микрофлюидика обеспечивает надежный инструмент для изоляции и анализа клеток на уровне одной ячейки, устраняя влияние внешних факторов на сотовых микроокружения. Инкапсуляция клеток в капельках диктуется распределение Пуассона как функция количество клеток в каждой капли и среднее количество клеток на объем капли. Главные ячейки, особенно иммунные клетки, или клинические образцы могут быть скудными и потери менее инкапсуляции клеток остается сложным. В этой статье мы представляем новую методологию, которая использует пипетки советы для загрузки клетки для устройств на базе капелька microfluidic без значительной потери клеток. С различных типов клеток мы демонстрируем эффективный клетки инкапсуляции в капельках, который близко соответствует эффективности инкапсуляции, предсказано распределение Пуассона. Наш метод обеспечивает загрузку без потерь клеток microfluidic платформ и может быть легко адаптирована для анализа течению одной ячейки, например, для декодирования сотовой взаимодействия различных типов клеток.
Введение
В последние годы использование микрофлюидика как надежная и универсальная платформа для клеточного анализа на уровне отдельной ячейки имеет быстро увеличение1. Эти платформы обеспечивают высокопроизводительного скрининга одиночных клеток и биологических молекул с высокой точностью и чувствительностью, используя очень небольшой выборки том2,3,4. Среди различных типов конструкций microfluidic капелька-платформ включить анализ высок объём одиночных клеток, их изоляции в водной фазе капли, окруженный несмешивающихся фазы, которая позволяет точное и точный контроль над сотовых микроокружения5,6. На основе капелька микрофлюидика дает гибкость, чтобы изолировать одну или несколько ячеек в оба, водный и капельки гидрогеля и ценным в зондирующего комплекс клеточных поведение, например белок секрета или сотовой связи взаимодействия7, 8 , 9. сигнализации и кросс talk среди иммунные клетки могут зависеть от взаимодействия с другими клетками микроокружения10. Изоляции единичных клеток в капельках обеспечивает эффективное бесшумное аналитической лаборатории, свободный от влияния внешних факторов окружающей среды для более эффективной и точные результаты11,12. Изменение дизайна капелька microfluidic платформа с несколькими входами позволяет инкапсуляции нескольких типов клеток для изучения клеточных взаимодействия через ячейки сопряжения12,13.
Процесс инкапсуляции клеток в капельках случайных и инкапсуляции клеток может быть статистически определена скорость используя формулу для распределения Пуассона14,15. Этот уровень инкапсуляции можно оценить, учитывая средний уровень прибытия клеток на стыке капли и предполагая, что прибытие каждой ячейки является независимым от прибытия других клеток16. Даже несмотря на то, что независимые ячейки прибытия не может быть гарантирована, в случаях малонаселенных распределенных клеток, может считаться предположение о независимости и вероятность капли, содержащие одну или несколько ячеек могут быть предсказаны как функция количество клеток в каждой капли и среднее количество клеток на капли16,17. Так как эта оценка клеточного инкапсуляции в капельках зависит количество клеток в каждой капли, можно предположить, что увеличение концентрации клеток на входе будет увеличить среднее число ячеек в каждой капли 16. Таким образом, для обеспечения инкапсуляции одну ячейку, концентрации клеток необходимо сократить но это часто приводит к большое количество пустых капельки18.
Потеря клеток во время загрузки вложений, седиментации, и/или слипания в шприц, трубы, или устройства производства — это общий недостаток, ответственных за отклонение фактической инкапсуляции значений из значений прогнозируемого инкапсуляции19 . Эта проблема получает далее преувеличены при посеве редких иммунные клетки или клинические образцы, как они уже мало в области народонаселения и инкапсуляцию только несколько клеток, намного ниже, чем ожидалось, не содержится достаточных данных для экспериментального анализа. Плазмоцитарная дендритных клеток (PDC) являются подмножеством редких иммунных клеток, только составляет примерно 0,2 - 0,6% всей белой крови клеток населения20. Эти клетки секретируют огромное количество типа интерферонов при активации и тем самым играют важнейшую роль в иммунной реакции21. При изучении клеточного поведения таких редких клеток в капельки, крайне важно для предотвращения потери клеток во время заполнения ячейки и инкапсуляции22. Есть несколько дизайн связанные события, которые обеспечил инкапсуляции единичных клеток в капельки, используя активные инкапсуляции методы, которые используют различные физические силы, такие как акустической или электрической силы для поколения капель содержит Одноместный клетки23,24. Однако эти методы имеют свои собственные ограничения с точки зрения производства капли16.
В этом исследовании мы создали надежный и простой метод, который обходит недостатки традиционных методов для загрузки одного или нескольких клеток microfluidic приборы. Наш метод, вдохновленный Ро et al., использует по-разному размера наконечники для заполнения небольших объемов редких иммунных клеток капелька microfluidic платформ без потерь значительный образец и дали результаты, которые согласуются с теоретическими предсказания25. Эта методология может быть легко и успешно адаптирован для нескольких приложений с участием на основе капелька микрофлюидика и применяется для широкого спектра типов клеток или даже микрочастиц.
протокол
1. 3-входе полидиметилсилоксан (PDMS) устройства изготовления
- Измерить 40 g PDMS базы в смесителе принадлежности чашку и добавить 4 g отвердителя PDMS базовый реагента в чашке, тщательно, с помощью капельницы.
- Кубок в держатель принадлежности смеситель и измерить общий вес Кубка с держателем. Значение веса баланс центрифуги на принадлежности смеситель соответственно.
- Смешать базы и Вулканизирующий агент в смеситель принадлежности при 2000 об/мин на 2 мин следуют де пены при 2000 об/мин на 2 мин.
- Подготовьте Алюминиевая лодка, с диаметром приблизительно того же размера, что и 100 мм кремниевой пластины. Поместите кремниевой пластины, сфабрикованы для реплики, формования, в алюминиевой лодке и положить эту настройку в чашке Петри (диаметр = 120 мм, высота = 20 мм).
Примечание: Размер Петри зависит от размера кремниевой пластины. - Выньте из держателя чашки и залить предварительно засветить PDMS смесь (содержимое чашки), тщательно, на кремниевой пластины.
- Поместите чашку Петри, содержащий кремниевой пластины с предварительно засветить PDMS смеси, в эксикатор для около 20 минут, чтобы удалить все пузырьки воздуха.
- Удаление Петри блюдо после 20 мин и проверить наличие любых оставшихся воздушных пузырьков, которые могут быть удалены.
- Место на Петри блюдо в духовке, на 65 ° C, по крайней мере 3 часа.
- После 3 h удалить Петри блюдо из духовки и тщательно очистить вылечить PDMS из кремниевой пластины.
- Вырежьте PDMS устройств вдоль линии разреза, используя ножом или скальпелем. Пробейте отверстия на входы и выход каждого устройства, с помощью панчер 1,2 мм. Очистите каждое устройство PDMS скотчем, чтобы удалить любые пыль или остаточной части PDMS.
- При необходимости удар с азотом для удаления остаточного PDMS штук.
- Подготовка стекла слайды, очищая их с мылом вода, изопропиловый спирт и сухим азотом.
- Бонд чистой PDMS устройство с чистой стеклянное скольжение в плазме Ашер закрыть линии потоков. Используйте следующие параметры: мощность: 50 Вт, время: 45 s, время задержки выпуска за обрез: 2 s, технологического газа: 1 газа (воздуха), вентиляционные: оба клапана, ограниченный выход время: 60 s, насос спина вниз время: 10 s, вентиляционные время: 0 s, время отключения газа: 1 s, турбо, насосные включен : 0. Отключите все другие газовой линии.
Примечание: Параметры, используемые для плазмы Ашер могут варьироваться в зависимости от марки плазмы Ашер используется. - Приготовляют раствор силана, добавляя 50 мкл силана (1H, 1 Ч, 2 Ч, 2H-Perfluorooctyltriethoxysilane) до 950 мкл фторсодержащих нефти.
Примечание: Силана является токсичным. Пожалуйста, работать под зонт. - Нарисуйте решения подготовлен силана в шприц, который подключен к тефлоновой трубопровода.
- Salinize устройство, перемещая подготовленных силана решения через выход устройства.
- Поместите устройство в духовке, на 65 ° C, 30 мин.
- Засоленных выньте из духовки и промойте фторированные нефти избыток силана из устройства.
- Поместите устройство обратно в духовку, на 65 ° C, по крайней мере 1 h завершить процесс связывания.
Примечание: Протокол может быть приостановлена здесь.
2. потери менее клеток Инкапсуляция
-
Клетки для сбора урожая
- Вновь приостановить Jurkat Т-клеток в среде Розуэлл парк Мемориальный институт (RPMI) в концентрациях 1.0x106 клеток/мл, 2.0x106 клеток/мл, 4.0x106 клеток/мл и 8.0x106 клеток/мл; pDCs в гемопоэтических сыворотки свободной культуры средств массовой информации (например, X-VIVO 15) при концентрации 1.3x106 клеток/мл, 3.0x106 клеток/мл и 13.0x106 клеток/мл; A549 клетки в средних Дульбекко изменение орла (DMEM) в концентрации 1.0x106 клеток/мл.
Примечание: Тип клеток и концентрации клеток может различаться в зависимости от эксперимента. Маркировки клеток также может быть сделано на основании эксперимента.
- Вновь приостановить Jurkat Т-клеток в среде Розуэлл парк Мемориальный институт (RPMI) в концентрациях 1.0x106 клеток/мл, 2.0x106 клеток/мл, 4.0x106 клеток/мл и 8.0x106 клеток/мл; pDCs в гемопоэтических сыворотки свободной культуры средств массовой информации (например, X-VIVO 15) при концентрации 1.3x106 клеток/мл, 3.0x106 клеток/мл и 13.0x106 клеток/мл; A549 клетки в средних Дульбекко изменение орла (DMEM) в концентрации 1.0x106 клеток/мл.
-
Подсказка загрузки для поколения водные капельки
- Подготовьте фторированные масло с 3% поверхностно-активное вещество биосовместимого смесь, добавив 3 мл сурфактанта в 2 мл масла фторированные.
Примечание: Концентрация добавляется масло фторсодержащих поверхностно определяет стабильность эмульсии для различных инкубационных периодов. Концентрация поверхностно варьируется в зависимости от средств массовой информации, используемых для конкретных типов клеток. - Нарисуйте масляной фазы смеси в шприц (1 мл). Удаления пузырьков воздуха из шприца и подключить его к тефлоновой трубопровода соответствующей длины.
- Подготовки шприц образец рисования биосовместимых минерального масла в шприц. Удаление пузырьков воздуха и подключить шприц к тефлоновой трубопровода соответствующей длины.
- Пунш PDMS вилка с диаметром 5 мм от вылечить PDMS slab.
Примечание: Вылечить PDMS плиты может быть подготовлен с помощью шагов 1,1 до 1,9. Вместо простой кремниевой пластины изготовлены кремниевой пластины. - Пунш другое отверстие в центре вилки с 1 мм нокаутером.
- Вставьте вилку в 200 мкл наконечник пипетки, от конца больше, таким образом, чтобы он плотно.
Примечание: Используйте 1000 мкл наконечник пипетки для большего объема выборки и более крупных клеток. Для 1000 мкл кончиком пипетки может использоваться втулок диаметром от 5 мм до 7 мм. С вилкой диаметром 5 мм, объем образца около 400 мкл могут быть атмосферный в наконечник пипетки. Если вилка большего диаметра используется (7 мм), больше объем образца могут быть атмосферный (около 900 мкл). - Вставьте трубку, который подключен к шприцу, PDMS разъем, в который был вставлен в наконечник пипетки. Толкать поршень шприца медленно, чтобы заполнить подсказка подключенной пипетку с минеральным маслом. Выдвиньте остаточного воздуха от кончика пипетки.
- Опустите кончик пипетки, подключенных к шприцу, в пример решения и аспирационная около 150 мкл пример в кончик.
- Повторите шаги 2.2.4 для 2.2.8 для подготовки шприц второй пример.
- Осторожно поместите все три подготовленных шприцы на шприцевой насос.
- Вставьте оба наконечники, содержащий образец, в двух внутренних бухтах PDMS чипа. Вставьте трубку, содержащие смесь масла фазы в наружной входе.
- Установите значение скорости потока на шприцевый насос следующим: раствора непрерывной фазой: 600 мкл/ч, образцы клетки: 100 мкл/ч, каждый. Введите и задать размеры шприца.
Примечание: Диаметр настройки будет меняться на основе типа шприца. - Запустите насос для сброса образец решения через внутренние каналы этапа устройства и нефти через внешние устройства.
- Подключите труб соответствующей длины, на выходе, чтобы начать сбор капель, когда капли формирование стабильной. Время сбора зависит от эксперимента.
- Сбор капель в трубки блокировки. 200 мкл RPMI среднего (без сыворотки) поверх собраны капли и инкубации образца.
Примечание: Инкубации время собраны капли изменяется на основе эксперимента. Капельки собираются в трубки блокировки, когда на основе cytometry анализ потока или изоляции осуществляется после получения клетки от капель, нарушая эмульсии. Это позволяет собирать капельки в камере стекла, если эксперимент требует микроскопического анализа в капли.
- Подготовьте фторированные масло с 3% поверхностно-активное вещество биосовместимого смесь, добавив 3 мл сурфактанта в 2 мл масла фторированные.
-
Эмульсия взлома и ячейки поиска для анализа потока гранулярных
- Подготовка 20% 1H, 1 час, 2 Ч, 2H-перфтор-1-октанол (PFO) раствор (v/v) в масле фторированные, добавив 2 мл PFO в 10 мл масла flourinated.
- Удалите излишки масла из нижней части трубки коллекции, содержащие капельным путем, с помощью шприца.
- Добавьте 100 мкл раствора PFO 20% эмульсии сломать эмульсии и выпустить инкапсулированные клетки в водной фазе. Коснитесь и перемешать кратко. На данный момент сделать не вихря. Инкубируйте 1-2 мин.
Примечание: Количество PFO добавил зависит от количества капель производства. Продолжайте добавлять дополнительные PFO до тех пор, пока слой масла полностью не растворится. Имейте в виду, что PFO токсичны для клеток и что слишком высокие концентрации PFO или слишком долго инкубации в PFO может привести к смерти клетки. - Спиновые решение вскоре на низком возможных РПРС для 30 s.
- Подготовка 100 мл холодного Phosphate-Buffered солевой (PBS) раствора с 2% сыворотки крови плода теленка (FCS) (2 мл FCS в 98 мл PBS).
- Пипетка 550 мкл водной фракции, сразу же после центрифугирования и перенести его на новый замок трубка, содержащая 500 мкл раствора холодной PBS с 2% FCS, подготовленные на шаге 2.3.5. Пусть любой остаточной нефти раковина в нижней части новой трубки блокировки.
- Аспирационная 950 мкл водной фазы, содержащие клетки от этой трубки блокировки, осторожно, без аспирационных любой остаточной нефти и передать решение новой трубки блокировки.
- Спин вниз ячейки в новой трубки блокировки за 10 мин.
- Вновь приостановите клетки в 300 мкл раствора холодной PBS с 2% FCS, подготовленные на шаге 2.3.5.
Примечание: Клетки может быть также вновь приостановлено в другие подходящие решения, например СМИ в зависимости от эксперимента. Пятно клетки, на основании эксперимента, для анализа с помощью проточной цитометрии.
3. клетки сопряжения
-
Клетки для сбора урожая и окрашивания
- Подсчитать ячейки Jurkat T, от культуры колбу и спина вниз клетки на 1500 об/мин за 5 мин.
- Удалить супернатант и вновь приостановить 1.0x106 клеток в 1 мл PBS для получения концентрации 1.0x106 клеток/мл. Количество PBS добавил зависит число ячеек.
- Повторите шаги 3.1.1 до 3.1.2 подготовить второй образец Jurkat Т-клеток с такой же концентрации клеток.
- Вымойте оба образцы дважды с 1 мл раствора PBS на 1500 об/мин за 5 мин.
- Вновь приостановить один образец клеток с 1,25 мкм Карбоксифлуоресцеина succinimidyl эфира (CFSE) краска и другие образец клеток с 1,25 мкм далеко красный краситель или 1,25 мкм клеток распространения красителя в концентрации клеток 1.0x106 клеток/мл. Общая окрашивание раствора составляет 1 мл раствора для 1.0x106 ячеек.
Примечание: Клетки могут быть маркированы с разными красками в зависимости от фильтров, доступных в проточный цитометр или флуоресцентным микроскопом. - Проинкубируйте образцы клетки с красителями в течение 10 минут при 37 ° C.
- Остановите окрашивание реакции, добавив 1 мл холодной FCS льда после 10 мин.
- Стирайте образцы клетки дважды с 1 мл раствора PBS на 1500 об/мин за 5 мин.
- Вновь приостановите образцы клетки в RPMI СМИ в концентрации 10.0x106 клеток/мл, для каждого цвета.
-
Подсказка загрузки для производства капель гидрогеля агарозы для сопряжения клеток
Примечание: Для ячейки сопряжения с помощью агарозы гидрогеля капельки, поддерживать температуру системы между 27 ° C и 37 ° C на протяжении процесса генерации и сбора капель для предотвращения гелеобразующего гидрогелей и гарантируете клеточной жизнеспособности9.- Распустить сверхнизкие гелеобразующего агарозы температуры путем нагревать его до 75 ° C в PBS на 4% (w/v) концентрации и размешать смесь для 20 мин.
- Mix решение агарозы с маркировкой T Jurkat клетки приносить агарозы концентрации 2% (w/v). Повторите эту процедуру для других образца с по-разному маркированных клеток.
- Подготовьте фторированные масла с 2% ПАВ смесь, добавив 20 мл сурфактанта в 30 мл масла фторированные (фаза смесь масла).
- Выполните 2.2.2 - 2.2.14.
Примечание: Поскольку вязкой низких плавления агарозы и обеспечить стабильные капелька производства, установите значение скорости потока на шприц насосы следующим: Масляная смесь этап: 2000 мкл/ч, образцы клетки: 200 мкл/ч ввести и установить размеры шприца. - Сбор капель в трубки блокировки и инкубировать капель на 4 ° C для 60 мин.
-
Эмульсия взлома и агарозы шарик поиска для анализа СУИМ
- После инкубации капель для 60 мин удалите излишки масла из трубки блокировки, содержащий капельным путем, с помощью шприца.
- 200 мкл PFO для удаления нефти интерфаза из капель.
Примечание: Количество PFO добавил к трубе зависит от количества капель производства. Продолжайте добавлять дополнительные PFO до тех пор, пока слой масла полностью не растворится. - Вымойте собранных агарозы бусины дважды с 1 мл холодного PBS, чтобы полностью удалить масла центрифугированием при 1500 об/мин за 10 мин.
- Анализ собранных агарозы бусины с помощью проточной цитометрии.
Примечание: Это также можно наблюдать бусины под флуоресцентным микроскопом.
Результаты
Для наших экспериментов мы использовали устройство на основе microfluidic PDMS 3-вход с высотой 25 мкм (рис. 1). В этом устройстве мы использовали внешний вход для промывочное масло с ПАВ и две внутренние отверстия для промывки водной фазы с клеточных суспензий или средств массовой информации. После генерации и сбора капли инкубируют на пару часов чип перед течению анализ с использованием проточная цитометрия. В инкубационный период сыворотки компоненты присутствуют в СМИ может взаимодействовать с ПАВ и вызывает капельки становятся нестабильными и разрушаться. Поэтому важно добавить оптимизированной концентрации ПАВ фторированные нефти. Мы протестировали стабильности монодисперсными капель, содержащих гемопоэтических сыворотки свободной культуры СМИ с 2% сыворотку крови человека с различных концентрациях ПАВ в масле фторированные. Он может быть выведен из Рисунок 2 , эти капельки монодисперсными являются весьма стабильной до 24 часов, когда по крайней мере 3% ПАВ добавляется к масляной фазы. Аналогичные результаты были получены с RPMI СМИ с и без добавления 10% FCS (данные не показаны). Таким образом стабильность капельки сильно зависит от концентрации оптимального сурфактанта при работе с различными источниками культуры средств массовой информации и компонентов сыворотки.
Чтобы продемонстрировать инкапсуляции эффективности нашего подхода мы сначала посеян клетки с помощью трубы соединен шприцы, который является наиболее традиционным подходом для заполнения клеток (рис. 3А). Мы собрали Jurkat Т-клеток в различных концентрациях 1.0x106 клеток/мл, 2.0x106 клеток/мл и 4.0x106 клеток/мл и получил инкапсуляции эффективность, которая была ниже, чем прогнозируемые значения (рис. 3B). В 1.0x106 клеток/мл часть капельки, которые содержали одну ячейку был 2,5%, который не увеличивается даже при использовании более высокие концентрации клеток. Для увеличения эффективности клетки загрузки, мы изменил наш предыдущий подход и монтажа труб на половину длины для повышенных штатив и загружен суспензию клеток в половине, которая была прикреплена к PDMS устройства (рис. 4A). Используя этот подход, мы инкапсулированные Jurkat Т-клеток в различных концентрациях 1.0x106 клеток/мл, 2.0x106 клеток/мл, и 4.0x106 клеток/мл, а также редких pDCs при различных концентрациях 1.0x106 клеток/мл, 2.0x106 клеток/мл и 12.0x106 клеток/мл. Мы ожидали повышения инкапсуляции ставки путем предотвращения оседания ячейки с помощью этого метода. Однако в концентрациях, тестирование, результаты экспериментов были намного ниже, что предсказал Пуассона значения (Рисунок 4B и рис. 4C).
Используя наш подход подсказка загрузки, мы оптимизировали наши тарифы инкапсуляции ячейки для получения экспериментальные результаты согласуются с статистически вычисленные значения (рис. 5A). Для различных концентраций Jurkat Т-клеток полученные инкапсуляции эффективность соответствует нашей вычисленные значения на всех концентраций (рис. 5B). Удивительно даже с адэрентных клеток как A549 опухолевых клеток, которые склонны комок, мы наблюдали несколько улучшилась инкапсуляции эффективность в клеточном концентрации 1.0x106 клеток/мл (рис. 5C). Мы также оценили эффективность нашей системы для инкапсуляции менее доступны и скудные pDCs в концентрации различных клеточных 1.0x106 клеток/мл, 3.0x106 клеток/мл и 13.0x106 клеток/мл (рис. 5D). Для облегчения загрузки возможно больший объем, превышающий 200 мкл, например, при работе с клеточных линий или более обильные первичной иммунных клеток, мы также исследовали инкапсуляции фотоэлементов, используя 1000 мкл советы (синий). Мы показали, что эти 1000 мкл советы дал аналогичные инкапсуляции эффективность по сравнению с 200 мкл советы (желтый) (Рисунок 5E).
Зависит от чип дизайн и исследований вопрос на руку, наш Совет загрузки техника может использоваться для загрузки клетки через один вход, для зондирования в клеточных неоднородность, или несколько заливов параллельно, для декодирования сотовой взаимодействий. Мы сравнили загрузки Jurkat Т-клеток (при концентрации 10.0x106 клеток/мл) от одной до двух по-разному помечены населения Jurkat Т-клеток (в комбинированных концентрации 10,0 x106 клеток/мл) с двумя вводами (рис. 6 A и 6 РисунокB). Во время инкапсуляции капли были созданы с использованием ультра-низким гелеобразующего температуры агарозы и загущенное после производства формы агарозы гидрогеля бисером, позволяющих анализировать вниз по течению через микроскопии и потока цитометрии (Рисунок 6 C и рис. 6D). Микроскопический анализ показал, что сопряжения клеток было достигнуто в различных комбинациях, указав для высокой пропускной способности клеток сопряжения (рис. 6C). Кроме того, анализ же населения гидрогеля бисера подачей cytometry показали, что шарики без клетки могут быть отделены от бусины с ячеек, основанных на собственный вперед (FSC, размер) и боком (SSC, гранулярность) точечные шаблон (Рисунок 6 D). Стробирования на население бисера без клетки отсутствие клеток инкапсуляции подтверждается отсутствие флуоресцентные сигналов. Кроме того стробирования на население шарик с клетками выявлено существование нескольких подгрупп населения свидетельствует для инкапсуляции по-разному помечены Jurkat Т-клеток. Наши результаты показывают, что сопряжения эффективный клетки может быть достигнуто, в основе обоих микроскопические и гранулярных анализ потока и показал немного увеличенный инкапсуляции эффективность по сравнению с предсказания Пуассона (Рисунок 6E).
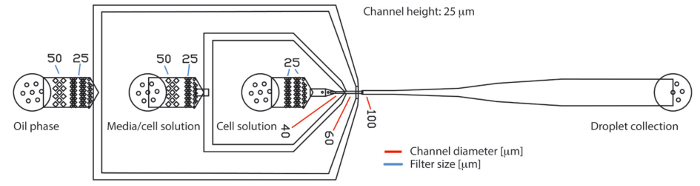
Рисунок 1 . PDMS основе капелька microfluidic устройство с трех входов и один выход. Устройство состоит из трех входов для непрерывной масляной фазы, средства массовой информации культуры клеток и суспензии клеток, соответственно. Сгенерированный капельки собираются на выходе. Образцы потока ламинарным для потока упором перекрестка, где они инкапсулируются в капельки. В отверстия фильтр структур провести крупные частицы как белка или ячейки агрегатов обратно. Диаметр пробелов в структуре фильтра обозначаются синими линиями. Диаметр каналов на производство сопла обозначаются красными линиями. Высота канала на всей чип был 25 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 . Капелька стабильность за 24 часа. Графики показывают области капель, содержащих гемопоэтических сыворотки свободной культуры СМИ + 2% сыворотки крови человека, со временем для трех разных концентрациях ПАВ A) 0,5% B) 3% C) 5%. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
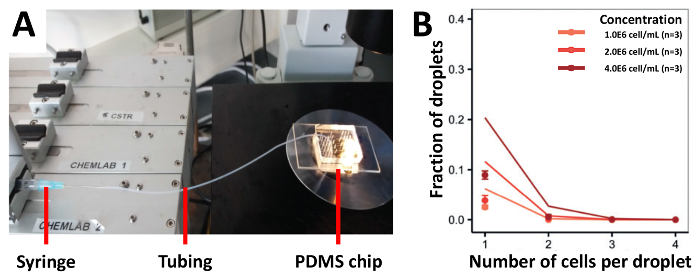
Рисунок 3 . Трубы на основе клеток, Загрузка подход. Jurkat-Т-клетки загружаются в различных концентрациях на устройство, с помощью шприца подключен к труб. A) на рисунке экспериментальной установки B) уровень инкапсуляции ячейки определяется световой микроскопии. Точки: Экспериментально определены значения; Закрытые линии: распределение Пуассона. Ошибка бар представляет Среднеквадратичная ошибка среднего. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 . Инкапсуляции различных типов клеток в различных концентрациях, с помощью вертикальные трубки загрузки подход. Для определения эффективности ячейки инкапсуляции были инкапсулированные клетки Jurkat T и pDCs (различных концентраций). A) на рисунке экспериментальной установки для вертикальных труб, загрузки подход. B) график показывает эффективность инкапсуляции Jurkat T клетки. C) график показывает эффективность инкапсуляции pDCs. Точки: Экспериментально определены значения; Закрытые линии: распределение Пуассона. Ошибка бар представляет Среднеквадратичная ошибка среднего. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
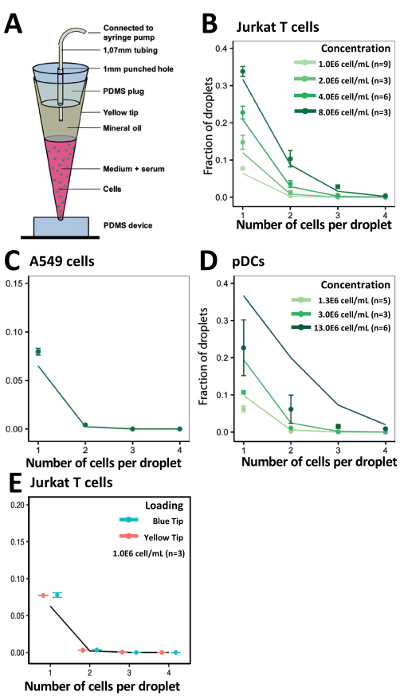
Рисунок 5 . Совет загрузки подход для инкапсуляции типов различных клеток. A) схематическое изображение кончика, погрузка техники. B) график показывает эффективность инкапсуляции Jurkat клеток. C) график показывает эффективность инкапсуляции A549 клеток. D) график показывает эффективность инкапсуляции pDCs. E) график показывает эффективность инкапсуляции Jurkat T клетки, используя 200 мкл наконечники (желтый) и 1000 мкл наконечники (синий). Точки: Экспериментально определены значения; Закрытые линии: распределение Пуассона. Ошибка бар представляет Среднеквадратичная ошибка среднего. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
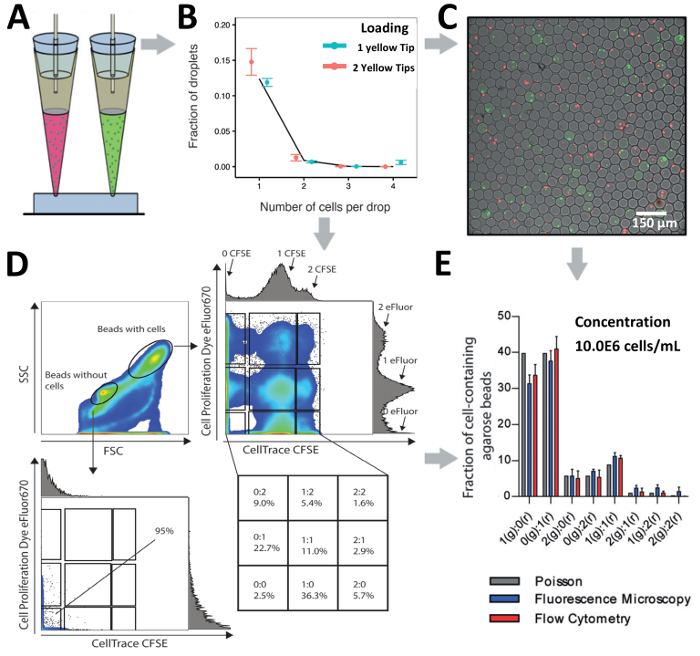
Рисунок 6 . Ячейка, спаривания в капельки. A) схематическая иллюстрация кончик загрузки подход для сопряжения различных клеток от 2 отверстия в капельки. B) график показывает инкапсуляции Jurkat T клетки, с помощью одной или двух заливов параллельно. Концентрация клеток для один подсказки 2.0x106 клеток/мл и концентрации клеток для двух советы как 1.0x106 клеток/мл. Точки: Экспериментально определены значения; Закрытые линии: распределение Пуассона. C) флуоресценции микроскопические оверлеи гидрогеля бусины и помечены Jurkat Т-клеток. D) График показывает поток гранулярных анализ парных клеток в агарозном гидрогеля бусины. Участок демонстрирует вперед точечной и сбоку скаттер. E) сравнение числа клеток в агарозном гидрогеля бисер, как определяется флуоресцентной микроскопии и потока цитометрии. Бары: среднее значение; Усы: Стандартная ошибка означает, n ≥ 4. Ошибка бар представляет Среднеквадратичная ошибка среднего. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В этом протоколе мы продемонстрировали эффективный и простой метод загрузки и инкапсулировать клетки в капельки для высокой пропускной способности, одноклеточных анализа для выполнения и контролируемых клеток сопряжения для исследования клеточного взаимодействия. Кроме того мы по сравнению несколько обычных подходов к Тензодатчики microfluidic приборы и показал, что наш Совет загрузки подход является более эффективным методом по сравнению с другими методами.
Изучение клинических образцов или мало в номер по на основе капелька микрофлюидика типы редких клеток обладают некоторые проблемы, присущие. Как мы также показали, клетки имеют тенденцию отложений в шприцы и поверхность трубы, таким образом, предотвращая сотовой инкапсуляции в соответствие с прогнозируемыми значениями. Чтобы избежать этой проблемы, некоторые группы используют перемешивания баров в шприцы. Однако, при использовании редких и ограниченные клеточных популяций, ячейке объем ограничен также, таким образом, ограничение использования больших шприцов и помешивая баров. Кроме того мы также заменили более часто используемых труб с тефлоновым покрытием труб для предотвращения клетки вложений, но этот метод не улучшить результаты и если трубопровод слишком длинный, проблема клеток вложения усугубляет (данные не показаны). Кроме того мы использовали вертикальные трубки загрузки подход, где клетки были загружены в трубку и не в шприц для предотвращения гибели клеток в большой шприц томах. Используя эту технику, клетки с небольшой образец тома могут быть загружены, например, pDCs, которые являются редкими и ограниченные. Кроме того образец из труб загружается на устройство вертикально для предотвращения оседания клеток. Трубы, используемые для заполнения ячейки имеет небольшие размеры и можно сравнить с микроканалов. Поток в трубе давление приводом и следует параболическая скорость профиль26. Это означает, что максимальная скорость потока в центре труб и минимальная скорость по краям трубки27. При промывке популяция клеток через трубку, градиент скорости вызывает клетки для толкания к краям где они располагаются, потому что скорость на границе близка к нулю. Осаждения или урегулирования клеток в трубки, таким образом, снижает эффективность инкапсуляции, как показано в результатах представительных, где экспериментальные данные не совпали с прогнозируемой модели.
Другой часто адаптировано решение, используемые учеными, работа с капли микрофлюидика, является увеличить плотность носителей культуры клеток путем добавления плотности соответствующие реагенты, такие как Iodinaxol для предотвращения оседания клеток в шприцы19. Однако плотность соответствия реагентов может повлиять на поведение сотовой и отрицательно влияют на секрецию цитокинов, клетки (данные не показаны)28.
Даже несмотря на то, что несколько маленьких и больших изменений в обычные ячейки загрузки методы показали незначительные улучшения в эффективность инкапсуляции, экспериментальные результаты по-прежнему не соответствует теоретических расчетов. Однако с наконечником, Загрузка подход мы могли бы преодолеть ограничения предыдущих методов и эффективности инкапсуляции регулируется Пуассона статистики. Эта техника выгодно не только для загрузки подвеска клетки, но может также применяться для загрузки адэрентных клеток, таких как первичный кератиноцитов и A549 microfluidic фишки. При использовании обильные клеточных линий, например A549, K562 и т.д., могут использоваться большего объема выборки. Таким образом в зависимости от объема выборки, различных размеров-наконечники могут также использоваться и этой простой техники могут быть адаптированы для инкапсуляции одноклеточных и несколько клеток инкапсуляции.
В то время как концентрация низкая ячейки требуется для обеспечения инкапсуляции единичных клеток в капельки, более высокие концентрации клеток желательны увеличить среднее количество клеток, инкапсулированные в каждой капли для исследований, связанных с сопряжения клеток. Существует несколько методов одной ячейки, которые были ранее описаны для пары иммунные клетки на microfluidic фишки или microfabricated nanowells,2930,31. В капли микрофлюидика Пуассона статистика диктует 1:1 ячейка сопряжения для двух различных типов клеток может быть достигнуто при концентрациях оптимальное ячейки. Основываясь на предсказание Пуассона, есть также вероятность, что капельки могут содержать другие комбинации. В то время как 1:1 клетка сопряжения может быть желательным изучить сотовой взаимодействия на уровне одной ячейки и приводит к пониманию сотовой, несколько спаривания клетки также имеет основные преимущества. Она позволяет понять влияние нескольких ячеек в одну ячейку типа на тип ячейки. Кросс talk между различными иммунные клетки помогают генерировать эффективного иммунного ответа против нескольких инфекций и патогенов и также добавляет надежности нашей иммунной системы32. Таким образом сотовой связи может быть допрошен с высокой точностью в различных контекстах, например, 1:1, 2:1, 1:2, 2:2, 3:1, и т.д. пар клеток или уступая повышение понимания как единого управления индукции иммунной реакции. Это особенно интересно учиться например естественных клеток-киллеров и цитотоксических Т-клеток способность последовательно убить их соответствующих целевых ячеек.
Как уже говорилось, для инкапсуляции нескольких клеток в капли, желательны более высокие концентрации клеток. Однако, при загрузке клеток из одной входе для инкапсуляции ячейки, более высокие концентрации ячейки выборки может вызвать клеток для агрегата на входе. Это приводит к более низкие ставки инкапсуляции и выше отклонение от теоретической ценности. Чтобы избежать этой проблемы, клетки могут быть загружены с двумя независимыми вводами а. Теоретически можно было бы разработать другие microfluidic устройств с несколькими входами для достижения еще более высоких уровней клеток инкапсуляции где среднем на x количество клеток является оправданным. В этом исследовании мы исследовали эффективность инкапсуляции Jurkat Т-клеток при загрузке из одной и двух заливов, используя такой же общей концентрации и получены аналогичные инкапсуляции эффективности. Это изменение позволяет исследователям пара различных типов клеток на чипе.
Хотя этот метод помогает загрузке клетки microfluidic приборы без значительной потери клеток, есть некоторые меры предосторожности, которые необходимо иметь в виду. При заполнении шприцы с минеральным маслом и аспирационных образец клеток в наконечники, следует избегать включения воздушных пузырьков и вся система должна быть свободной от воздуха. Это также важно иметь в виду, что минеральное масло не следует смешивать с образцом. Наконечники, содержащие образцы, следует вставить твердо в бухтах microfluidic устройства с максимальной меры предосторожности для предотвращения утечки и дальнейшего включения воздушных пузырьков. Подводя итог, подсказка Загрузка — это простой, но надежный метод, который позволяет для высокой пропускной способности анализа клеточного поведения путем инкапсуляции ячейки без значительной потери клеток в экономически эффективным образом. При использовании с оптимальной образца концентрации на входе, этот подход погрузки клетки с пипеткой советы является очень гибкой и может быть адаптирована для различных типов клеток, особенно для редких первичной иммунные клетки, чтобы получить более высокую эффективность инкапсуляции, близко к предсказано моделей.
Раскрытие информации
У нас есть ничего не разглашать.
Благодарности
Мы благодарим университет Эйндховена за щедрую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 171468-5G | |
| 1H,1H,2H,2H-Perfluorooctyltriethoxysilane | Fluorochem/UK | S13150 | Silane (toxic) |
| Agarose (Ultra-low Gelling Temperature) | Sigma-Aldrich | 9012-36-6 | |
| BD Wegwerpspuiten met Luer-Lok-punten | Fisher Scientific | 10630694 | Syringe |
| Biopsy Punch 1.2 mm | Harris Uni-Core | ||
| Cell Proliferation Dye eFluro 670 | eBioscience | 65-0840-85 | |
| CellTrace CFSE | Invitrogen | C34554 | |
| CellTrace Far Red Cell | Invitrogen | C34564 | |
| Eppendorf Tubes | Eppendrof Tubes | Safe-Lok tubes 1 mL and 2 mL | |
| Glass Slide | Sigma Aldrich | CLS294775X38-72EA | Corning microscope slides, plain L × W 75 mm × 38 mm |
| Harvard Pumps | Harvard Apparatus | C-400750; C-400727 | Syringe pumps |
| HFE-7500 3M Novec Engineered fluid | Fluorochem/UK | 51243 | Flourinated oil |
| Kai Biopsy Punch 5 mm | Amstel Medical | 1980130 | |
| Luer stub | Instechlabs/USA | LS20S | Luer stub, 20ga (pink) x 0.5in (12mm), non-sterile |
| Mineral oil (Light) | Sigma Aldrich | M8410-1L | |
| Phosphate buffered saline | Sigma-Aldrich | P4417-50TAB | Tablets |
| Pico-Surf 1 (5%in Novec 7500) | Sphere Fluidics | 020317-09 | Surfactant |
| Plasma Asher | Emitech | K1050X | Plasma asher |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Silicone Elastomer Base 184 | Sylgard | 9355218 | PDMS base |
| Silicone Elastomer Curing Agent | Sylgard | 9355218 | Curing Agent |
| Stainless steel catheter coupler | Instechlab/USA | SC20/15 | 20ga x 15mm, non-sterile |
| TFE Teflon Tubing | Sigma-Aldrich | 58696-U | PTFE Tubing L × O.D. × I.D. 50 ft × 1/16 in. × 0.031 in. |
| Thinky mixer ARE-250 | EX-4025F | Conditioning mixture |
Ссылки
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Current Opinion in Biotechnology. 23 (1), 110-119 (2012).
- Meyvantsson, I., Beebe, D. J. Cell Culture Models in Microfluidic Systems. Annual Review of Analytical Chemistry. 1, 423-429 (2008).
- Yi, C., Li, C. W., Ji, S., Yang, M. Microfluidics technology for manipulation and analysis of biological cells. Analytica Chimica Acta. 560, 1-23 (2006).
- Wang, H. Y., Bao, N., Lu, C. A microfluidic cell array with individually addressable culture chambers. Biosensors and Bioelectronics. 24, 613-617 (2008).
- Zhang, Y., et al. A programmable microenvironment for cellular studies via. microfluidics-generated double emulsions. Biomaterials. 34 (19), 4564-4572 (2013).
- Teh, S. -. Y., Lin, R., Hung, L. -. H., Lee, A. P. Droplet microfluidics. Lab on a chip. 8 (2), 198-220 (2008).
- Hu, H., et al. Efficient cell pairing in droplets using dual-color sorting. Lab Chip. 15 (20), 3989-3993 (2015).
- Brouzes, E., et al. Droplet microfluidic technology for single-cell high-throughput screening. Proceedings of the National Academy of Sciences. 106 (34), 14195-14200 (2009).
- Chokkalingam, V., et al. Probing cellular heterogeneity in cytokine-secreting immune cells using droplet-based microfluidics. Lab on a Chip. 13 (42), 4740 (2013).
- den Haan, J. M. M., Arens, R., van Zelm, M. C. The activation of the adaptive immune system: Cross-talk between antigen-presenting cells, T cells and B cells. Immunology Letters. 162 (2), 103-112 (2014).
- Shah, G. J., Ohta, A. T., Chiou, E. P. -. Y., Wu, M. C., Kim, C. -. J. EWOD-driven droplet microfluidic device integrated with optoelectronic tweezers as an automated platform for cellular isolation and analysis. Lab on a Chip. 9 (12), 1732 (2009).
- Griffiths, A. D., Tawfik, D. S. Miniaturising the laboratory in emulsion droplets. Trends in Biotechnology. 24 (9), 395-402 (2006).
- Lagus, T. P., Edd, J. F. High-throughput co-encapsulation of self-ordered cell trains: cell pair interactions in microdroplets. RSC Advances. 3, 43 (2013).
- Moon, S., Ceyhan, E., Gurkan, U. A., Demirci, U. Statistical modeling of single target cell encapsulation. PLoS ONE. 6 (7), (2011).
- Abate, A. R., Chen, C. -. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628 (2009).
- Collins, D. J., Neild, A., deMello, A., Liu, A. -. Q., Ai, Y. The Poisson distribution and beyond: methods for microfluidic droplet production and single cell encapsulation. Lab Chip. 15 (17), 3439-3459 (2015).
- Kemna, E. W. M., et al. High-yield cell ordering and deterministic cell-in-droplet encapsulation using Dean flow in a curved microchannel. Lab on a Chip. 12 (16), 2881 (2012).
- Köster, S., et al. Drop-based microfluidic devices for encapsulation of single cells. Lab on a Chip. 8 (7), 1110 (2008).
- Mazutis, L., et al. Single-cell analysis and sorting using droplet-based microfluidics. Nature Protocols. 8 (5), 870-891 (2013).
- Sun, P., et al. Functional characterization of ex vivo. blood myeloid and plasmacytoid dendritic cells after infection with dengue virus. Virology. 383 (2), 207-215 (2009).
- Tel, J., et al. The chemotherapeutic drug oxaliplatin differentially affects blood DC function dependent on environmental cues. Cancer Immunology, Immunotherapy. 61 (7), 1101-1111 (2012).
- Wimmers, F., et al. Single-cell analysis reveals that stochasticity and paracrine signaling control interferon-alpha production by plasmacytoid dendritic cells. Nature Communications. 9 (1), 3317 (2018).
- Gong, J., Kim, C. -. J. All-electronic droplet generation on-chip with real-time feedback control for EWOD digital microfluidics. Lab on a Chip. 8 (6), 898 (2008).
- Demirci, U., Montesano, G. Single cell epitaxy by acoustic picolitre droplets. Lab on a Chip. 7 (9), 1139 (2007).
- Rho, H. S., Yang, Y., Veltkamp, H. -. W., Gardeniers, H. Direct Delivery of Reagents from a Pipette Tip to a PDMS Microfluidic Device. Chips and Tips. , (2015).
- Paul, P. H., Garguilo, M. G., Rakestraw, D. J. Imaging of Pressure- And Electrokinetically Driven Flows through Open Capillaries. Analytical Chemistry. 70 (13), 2459-2467 (1998).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Physics Today. 54, 42 (2001).
- Mita, A., et al. Anti-proinflammatory Effects of Iodixanol (OptiPrep)-Based Density Gradient Purification on Human Islet Preparations. Cell Transplant. 19 (12), 1537-1546 (2013).
- Dura, B., et al. Profiling lymphocyte interactions at the single-cell level by microfluidic cell pairing. Nature Communications. 6 (1), 1-13 (2015).
- Dura, B., et al. Longitudinal multiparameter assay of lymphocyte interactions from onset by microfluidic cell pairing and culture. Proceedings of the National Academy of Sciences. 113 (26), 3599-3608 (2016).
- Yamanaka, Y. J., et al. Single-cell analysis of the dynamics and functional outcomes of interactions between human natural killer cells and target cells. Integrative Biology. 4 (10), 1175 (2012).
- Satija, R., Shalek, A. K. Heterogeneity in immune responses: From populations to single cells. Trends in Immunology. 35 (5), 219-229 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены