需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠骨髓 Oligopotent 和世系髓样祖细胞的鉴定与分离
摘要
我们展示了如何用磁性和荧光分选 (mac 和流动力学) 相结合的方法, 从小鼠骨髓中识别和分离出6个髓样祖细胞。本协议可用于体外培养测定 (纤维素或液体培养),体内移植实验, RNA/蛋白质分析。
摘要
产生中性粒细胞、单核细胞和树突状干细胞 (DCs) 的髓祖原体可以在小鼠骨髓中发现并分离, 用于血液和免疫学分析。例如, 对髓祖种群的细胞和分子特性的研究可以揭示白血病转化的机制, 或者证明免疫系统对病原体暴露的反应。以前描述的流式细胞术策略, 为髓质祖鉴定已在许多领域取得了重大进展, 但他们确定的分数是非常异构的。最常用的浇口策略定义了为所需种群丰富的骨髓成分, 但也含有大量的 "污染" 祖细胞。我们最近的研究已经解决了这种异质性的大部分问题, 我们在这里提出的协议允许从2以前描述的骨髓分数中分离出6亚 oligopotent 和沿袭的髓样祖细胞。该协议描述了3个阶段: 1) 骨髓细胞的分离, 2) 通过磁活化细胞分选 (互连法) 对造血祖体细胞进行浓缩, 3) 流式细胞仪识别髓祖亚群 (包括荧光活化细胞分类, 如有需要, 则进行。这种方法允许祖细胞的数量和分离的各种体外和体内应用, 并已产生了新的洞察力的途径和机制的中性粒, 单核细胞和 DC 分化。
引言
单核细胞, 中性粒细胞和树突状干细胞 (DCs) 是由造血祖, 主要是在骨髓中, 由一个称为 myelopoiesis 的过程中产生的髓体细胞。常见的髓样祖细胞 (中医) 有可能产生髓体细胞, 以及巨和红细胞, 而不是淋巴细胞。粒细胞-单核细胞祖 (GMPs) 是由中医衍生而成的, 其产生的是颗粒和单核细胞, 但失去了巨和红细胞电位。单核细胞和经典和浆 DCs (招揽/pDCs) 也被认为是由一般的祖细胞-DC 祖 (mdp 以) 产生的, 这是由中医生产的. 世系势的逐步限制最终导致沿袭前身: 粒细胞祖, 单核细胞祖, 树突状体细胞祖 (图 1)。
魏斯曼和同事报告说, 中医是在林 c-试剂盒+ Sca-1- (LKS) CD34+ FcγR 的小鼠骨髓部分, 而 GMPs 包含在 LKS CD34 + FcγR嗨分数1。然而, 这些 "CMP" 和 "GMP" 分数是非常异构的。例如, "GMP" 分数也包含血统承诺粒细胞祖和单核细胞祖1,2。mdp 以分别被报告为 CX3CR1+ Flt3+ CD115+祖细胞也表达 CD34 和 FcγR3,4。mdp 以产生了 cDC/pDC 产生的共同 DC 祖 (CDPs), 据报道, 它表示较低水平的 c 套件 (CD117), 并没有包括在 LKS 分数5.
以前假定单核细胞是通过单一途径产生的 (CMP-GMP-MDP 单核细胞)。与这个模型相一致的是, 由 GMPs (命名的单核细胞祖, MPs)2和 mdp 以 (命名的共同单核细胞祖, cMoPs) 产生的单核细胞的祖细胞,6在共享表面标记表达式的基础上似乎是同一单元格.然而, 我们最近证明单核细胞是由 GMPs 和 mdp 以独立产生的, 并且能够通过单细胞 RNA 测序7区分 MPs 和 cMoPs。
我们最近修改了魏斯曼 "CMP" 和 "GMP" 浇口战略, 以确定6脂蛋白亚组分的 C57BL/6J 小鼠骨髓含有不同的 oligopotent 和血统承诺髓祖亚群。我们首次报告说, Ly6C 和 CD115 染色允许隔离 oligopotent GMPs, 以及粒细胞祖 (GPs) 和单核细胞祖 (我们目前无法分离的 MPs 和 cMoPs) 从 "GMP" 分数2 (LKS-CD34+ FcγRhi门;图 1)。我们随后证明, mdp 以主要见于 "CMP" 分数 (LKS- CD34+ FcγRlo门), 其中还包含 Flt3+ CD115lo和 Flt3-子集7 (图1).CMP-Flt3+ CD115 的 GMPs 和 mdp 以在收养转移时产生。CMP-Flt3 子集包含的祖细胞似乎是中间体之间的 CMP-Flt3+ CD115 和 GMPs。与 mdp 以不同, CMP-Flt3+ CD115 和 CMP-Flt3 分数也具有巨和红细胞电位。
然而, 必须指出的是, 目前尚不清楚 "CMP" 分数是否包含真正 oligopotent 的祖细胞 (例如, CMP-Flt3+ CD115 中的单个单元, 它拥有中性粒细胞,单核细胞、DC、巨和红细胞电位), 或二者择一地, 构成了一个具有更限制性血统潜能的祖先的混合物。菌落形成检测 (纤维素培养) 揭示了粒细胞 (中性粒细胞), 红细胞, 单核和巨电位 (GEMM 细胞) 在 "CMP", CMP-Flt3+ CD115lo和 CMP-Flt3-分数1 ,7、但不允许对直流电位进行评估。与此相反, 菌落形成检测表明, 在 "GMP" 分数1,2, oligopotent GMPs (祖细胞和单核细胞潜能) 的存在, 这是支持的最近单细胞transcriptomic 分析8。然而, 目前还不知道这些 oligopotent GMPs 是否也产生其他粒细胞 (嗜酸性粒、嗜碱性细胞和肥大的干细胞)。
在这些研究的基础上, 我们现在展示了7表面标记 (c 套件, Sca-1, CD34, FcγR, Flt3, Ly6C 和 CD115) 可以用来识别和分离这6个子集的 oligopotent 和血统承诺的髓细胞祖细胞。这里描述的协议可以应用于体外培养试验 (纤维素或液体培养), 在小鼠体内移植实验, 分子分析 (块状和单细胞 RNA 测序, 西方印迹, 等)。
该协议由3个阶段组成: 1) 制备骨髓细胞单细胞悬浮液, 2) 对造血祖 (磁性活化细胞分选) 和 3) 进行富集鉴定, 并根据需要隔离祖子集, 通过流动细胞术 (根据需要使用分析仪或分拣机)。第一步是从安乐死小鼠的股骨和胫骨中分离骨髓细胞, 类似于先前描述的9项协议。接下来, 通过对红细胞、中性粒细胞、单核细胞、淋巴细胞等细胞表面标志物的抗体, 对茎和祖细胞进行浓缩, 以耗尽分化的细胞。这不是强制性的, 但强烈建议优化检测的祖子集, 并减少所需的抗体数量的祖鉴定和流式细胞术所需的时间。下面的沿袭损耗协议描述了磁活化细胞分类 (mac) 使用鼠标谱系细胞耗尽套件 (其中包含生物素化抗体对 CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/C), 7-4 和 Ter-119, 外加抗生物素微珠) 和自动磁选机。最后一步是流式细胞术对祖子集的识别 (和排序, 如果需要的话)。下面描述的抗体面板 (另见表 1) 已设计用于流式细胞仪 (分析仪或分拣机) 与4激光器 (405 nm, 488 nm, 561 nm, 640 nm)。
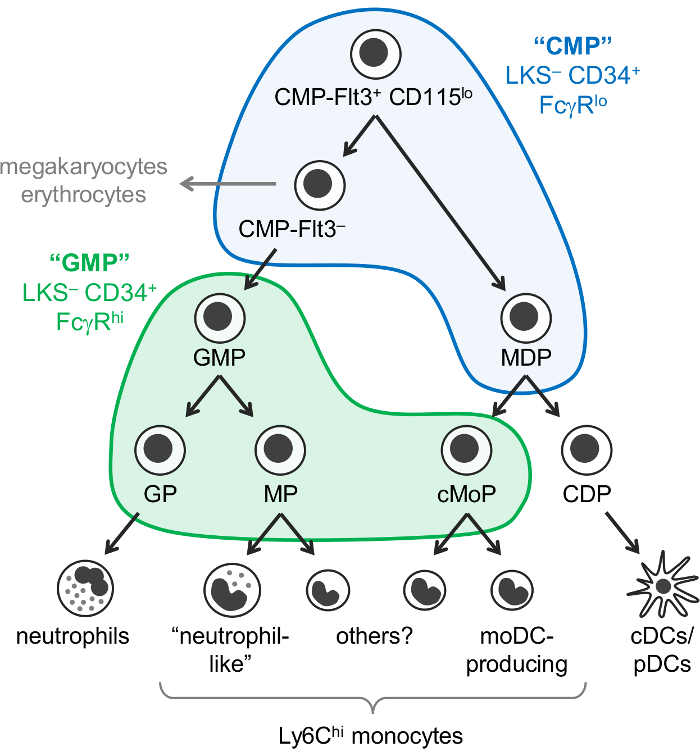
图 1: 中性粒细胞、单核细胞、DC 祖和分化通路.最近修订的 myelopoiesis7模型被说明, 魏斯曼门为 "中医" (蓝色) 和 "GMPs" (绿色)1覆盖。这一数字已从亚涅斯等20177修改。请单击此处查看此图的较大版本.
研究方案
这里描述的所有方法都是由雪松-西奈医疗中心的机构动物护理和使用委员会 (IACUC) 批准的。
1. 小鼠骨髓的分离和单细胞悬浮液的制备
- 按照机构指南弄死鼠标。
- 将安乐死的老鼠放在背部, 用70% 乙醇 (乙醇) 喷洒。用锋利的尖剪刀在脚踝的每个后肢上做一个小 (3-5 毫米) 切口, 然后将皮肤拉向身体, 从腿部取出, 露出肌肉和骨骼。
- 从骨骼中取出肌肉 (四头肌, 腿筋等), 用剪刀修剪, 跟随骨骼的方向。小心不要损坏骨头。
- 把股骨从髋关节上脱臼, 切断结缔组织和肌肉, 把腿分开, 小心不要切成骨头。
- 通过脱臼脚踝从胫骨中取出脚, 将骨骼放在不育的 PBS 或培养基管中, 然后将它们运到组织培养室。
注: 对于其他一些应用 (例如,从总骨髓细胞中提取大鼠), 可以将骨骼留在冰上一段时间, 但对于祖细胞来说, 要尽快进行, 以避免下调重要的表面标记 (特别是 CD115)。 - 在生物安全柜中, 用纸巾擦拭骨头中残留的软组织。
注: 本议定书应在生物安全柜内进行, 如果细胞培养或体内化验后需要无菌样本进行分类。如果不需要无菌细胞, 整个过程就可以在实验室的工作台上进行。 - 简单地浸泡在70% 乙醇的骨骼, 以消毒他们, 然后在无菌 PBS 洗。
- 将股骨从胫骨和腓骨分开, 通过膝盖切开, 并丢弃腓骨。
- 用锋利的剪刀切断骨头的末端。
- 用冷不育 PBS 采集骨髓, 直至骨骼呈白色:
- 用镊子夹住每根骨头, 并插入一个26G 针连接到一个10毫升的注射器, 其中含有冷不育 PBS 到骨轴一端。
- 把骨头放在50毫升离心管上面, 通过骨头冲洗 2-5 毫升的 PBS 以收获骨髓。
- 每只老鼠 (2 股骨和2胫骨) 从所有4块骨头中收获骨髓。
- 用1毫升的吸管轻轻地吸管, 将骨髓分解成细胞悬浮。
- 通过30微米尼龙网过滤骨髓悬浮物, 消除骨块和细胞团聚体, 从而产生单个细胞悬浮。
- 离心机的单细胞悬浮在 280 x g 5 分钟, 并并用重悬细胞颗粒在无菌染色缓冲 (PBS + 0.5% 血清 + 2 毫米 EDTA), 使用5毫升染色缓冲器每只老鼠 (例如, 10 毫升的细胞汇集从股骨和胫骨2小鼠)。
- 采取 10 ul 整除的样品, 混合它与 10 ul 台盼蓝, 并加载 10 ul 的结果, 台盼蓝标记的样品上的 hemocytometer。用光显微镜计算细胞数。
注: 如果单元格过于集中以进行可靠计数, 请在添加台盼蓝之前稀释样品。
2. 磁活化细胞分选 (mac) 的前驱富集
- 离心机整个单细胞悬浮 (或尽可能多的细胞, 以获得期望的产量) 在 280 x g 5 分钟在4°c 和并用重悬细胞颗粒在 40 ul 染色缓冲 (PBS + 0.5% 血清 + 2 毫米 EDTA) 每 107细胞。
注意: 还可以使用来自沿袭损耗套件制造商 (见材料表) 的 mac 缓冲器作为染色缓冲器的替代品。 - 按照沿袭损耗套件提供的说明执行沿袭损耗。下面的说明是在材料表中看到的套件。如果使用了不同的工具包, 请按照制造商的说明进行操作, 然后继续执行步骤2.3。
- 添加 10 ul 生物素抗体鸡尾酒每 107细胞, 混合吹打和孵化10分钟在4摄氏度。
- 添加 30 ul 染色缓冲/mac 缓冲每 107细胞和混合。
- 添加 20 ul 抗生物素微珠每 107细胞。混合好, 孵化15分钟, 在4摄氏度。
注: 在将微珠加入到细胞中之前, 将其涡流, 以确保它们完全分散。 - 添加1毫升染色缓冲/mac 缓冲每 107细胞, 离心细胞在 280 x g 为5分钟, 并并用重悬细胞颗粒在 500 ul 染色缓冲/mac 缓冲区多达 108个细胞。对于超过 108细胞, 相应地放大染色缓冲器/mac 缓冲器的体积。
- 根据制造商的说明准备自动磁选机。
- 将包含标记单元格的管放置到分隔符中, 然后选择负选择程序。
- 收集负分数, 其中包含祖丰富的血统阴性 (林) 细胞.放弃正分数, 其中包含磁性标记的谱系阳性细胞。
- 将林细胞在 280 x g 上离心为5分钟, 并用重悬每只老鼠的2毫升染色缓冲/mac 缓冲液中的细胞颗粒 (例如,如果骨髓从2只老鼠中汇集, 则4毫升)。
注: 颗粒现在应该是白色的而不是红色的, 因为红细胞已经耗尽。 - 采取 10 ul 整除的林细胞,混合它与 10 ul 台盼蓝, 并加载 10 ul 的结果, 台盼蓝标记的样品上的 hemocytometer。用光显微镜计算细胞数。
注: 如果单元格过于集中以进行可靠计数, 请在添加台盼蓝之前稀释样品。
3. 用荧光活化细胞分类法进行髓样祖鉴定和分离
- 标签9离心 (1.5 或2毫升) 管: 1) 无瑕细胞, 2-8) 细胞单一染色荧光共轭抗体对 FcγR (CD16/32), c 套件, Sca-1, CD34, Flt3 (CD135), Ly6C 和 CD115 的电压选择和颜色补偿, 和 9)样本细胞被染色的所有7抗体的祖鉴定和排序。
- 将10万个细胞分配给每个控制管 (管 1-8), 所有剩余的细胞 (或更少如果需要) 到样品管 (管 9)。
注: 如果样品体积大于 1.5-2 毫升, 可能需要将样品细胞分布到15毫升管中, 将其离心并并用重悬颗粒 (步骤 3.3), 然后将细胞转移到离心管中, 随后染色步骤。 - 将细胞在 1500 x g 处离心5分钟, 并并用重悬 100 ul 染色缓冲器 (PBS + 0.5% 胎体 + 2 毫米 EDTA) 和样品管颗粒在 100 ul 染色缓冲器每 5 x 106个细胞 (如200 x 1 10 细胞的 ul) 控制管丸 。
- 添加2微克/毫升 anti-CD16/CD32-APC-Cy7 到 FcγR 单染色管和样品管。涡旋轻轻地混合, 在4摄氏度孵育10分钟。
注意: 重要的是要染色样品细胞与 FcγR (CD16/32) 抗体之前添加其他抗体, 以防止竞争由于非特定 Fc 介导的抗体结合。不要用 FcγR 阻断试剂孵化细胞。 - 将其他抗体添加到相应的单一染色管 (每1抗体) 和取样管 (所有6抗体):10 微克/毫升 c 套件-太平洋蓝, 2 微克/毫升 Sca-1-PE-Cy7, 25 微克/毫升 CD34-FITC, 10 微克/毫升 Flt3-APC, 2 微克/毫升 Ly6C PerCP-Cy5.5, 4 微克/毫升 CD115-PE。轻轻地涡旋, 在4摄氏度孵育15分钟。
- 将 900 ul 染色缓冲器添加到控制管中, 将每 107个细胞的1毫升染色缓冲到样品管。离心细胞在 1500 x g 5 分钟和并用重悬细胞颗粒在染色缓冲: 200 ul 每控制管和 500 ul 每 25 x 106细胞在样品管。将悬浮细胞转移到5毫升的流管。
注: 如果样品体积大于 1.5-2 毫升, 则可能需要将细胞转移到15毫升管中进行离心。 - 根据制造商的指示, 准备流式细胞仪 (分析仪或分拣机)。
- 通过流式细胞仪运行无瑕和单染色控制单元, 设置电压和颜色补偿。
- 运行示例单元格, 浇下下面概述的祖子集, 并在图 2中进行总结, 如果需要, 则执行该操作的分类以隔离相关的祖子集。
注意: 通常需要获得大约20万个细胞, 以获得至少1000个事件在每个祖门。- 创建所有单元格的点图, 显示 FSC a (x 轴) 和 SSC a (y 轴) 和门, 以排除碎片和死细胞 = > "活" 细胞。
- 创建一个 "活" 单元格的点图, 显示 fsc H (x 轴) 和 fsc W (y 轴) 和门, 以排除双峰 = > 活/单线 (FSC) 门。
- 创建活/单线 (FSC) 单元格的点图, 显示 ssc H (x 轴) 和 ssc W (y 轴) 和门, 以排除双峰 = > 活/单线 (FSC)/单线 (SSC) 门。
- 创建活/单线 (FSC)/单线 (SSC) 单元格的点图, 显示 Sca-1 (x 轴) 和 c 套件 (y 轴), 以及选择 c 套件+ Sca-1 细胞 = > LKS 单元格的门.
- 创建 LKS 单元格的点图, 显示 CD34 (x 轴) 和 FcγR (y 轴) 和门以选择 CD34+ FcγRlo细胞 = > "中医", CD34+ FcγRhi细胞 = > "GMPs"。
注意: 必须尽可能准确地将 "中医" 和 "GMPs" 门。使用假彩色密度图或轮廓图来精确的浇口是有帮助的。 - 创建一个 "中医" 点图, 显示 CD115 (x 轴) 和 Flt3 (y 轴) 和门, 以选择:
Flt3+ CD115螺细胞 = > CMP-Flt3+ CD115lo细胞,
Flt3 CD115螺细胞 = > CMP-Flt3 细胞 ,
Flt3+ CD115hi细胞 = > mdp 以. - 创建一个 "GMPs" 的点图, 显示 Ly6C (x 轴) 和 FcγR (y 轴) 和门, 以选择 Ly6C 细胞 => "GMP-Ly6C 细胞", Ly6C+细胞 = > "GMP-Ly6C+细胞"。
- 创建 "GMP-Ly6C 单元格" 的点图, 显示 CD115 (x 轴) 和 Flt3 (y 轴) 和门以选择:
Flt3 CD115螺细胞 = > GMPs. - 创建 "GMP-Ly6C+单元格" 的点图, 显示 CD115 (x 轴) 和 Flt3 (y 轴) 和门以选择:
Flt3- CD115螺细胞 = > GPs,
Flt3- CD115hi细胞 = > MPs + cMoPs.
结果
使用上述协议, 有可能获得1亿细胞 (包括红细胞, 或5000万有核细胞) 的股骨和胫骨 (2 条腿) 的一个 C57BL/6J 鼠 (6-8 周, 男性或女性)。1-200万林细胞可以被孤立的每只老鼠的林+细胞耗竭。
6髓系祖群中的每一个都构成了 1- 4% 的林细胞。血统耗尽是有效的消耗分化细胞和丰富的祖细胞, 但林分包含了很...
讨论
小鼠髓质祖细胞魏斯曼门策略1已经是位免疫学家和 hematologists 的黄金标准近20年, 但现在明显的是, "CMP" 和 "GMP" 门是非常异构和更精确需要浇口策略。我们在这里描述的协议允许在 C57BL/6J 小鼠中识别 oligopotent 和沿袭所承诺的子集, 以便更精确地定量化特定的髓样祖细胞和 myelopoiesis 通路的映射, 以及调查在髓系分化的特定阶段运作的分子机制。祖子集可以被排序, 如果需要的话, ?...
披露声明
作者没有什么可透露的。
致谢
这项议定书是利用在雪松-西奈医学中心的理事会再生医学研究所 (HSG) 的资金, 在美国位免疫学家协会 (HSG) 的免疫学奖学金的职业生涯, 以及学者奖美国血液学学会 (哎)。我们感谢雪松-西奈医疗中心的流式细胞术核心, 以协助进行外地分类。
材料
| Name | Company | Catalog Number | Comments |
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
参考文献
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。