A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי ובידוד של Oligopotent, ביצע לשושלת אבות מיאלואידית ממח העצם העכבר
In This Article
Summary
נדגים כיצד לזהות ולבודד 6 קבוצות משנה של אבות מיאלואידית ממח העצם מאתר באמצעות שילוב של מגנטי קרינה פלואורסצנטית מיון (מקינטוש ו- FACS). פרוטוקול זה יכול לשמש in vitro לקשרי תרבות מבחני (תרבויות methylcellulose או נוזל), ויוו המאמצת העברת הניסויים של RNA/חלבון ניתוחים.
Abstract
אבות מיאלואידית כי תשואות נויטרופילים ומונוציטים, תאים דנדריטים (Dc) יכול להיות מזוהה ב והיא מבודדת ממח העצם של עכברים עבור ניתוחים hematological ו. לדוגמה, מחקרים של המאפיינים תאית ומולקולרית של אוכלוסיות קדמון מיאלואידית ניתן לחשוף את המנגנונים שבבסיס הטרנספורמציה לוקמיה או להדגים כיצד המערכת החיסונית מגיבה לחשיפה הפתוגן. בעבר אסטרטגיות cytometry זרימה שתואר עבור זיהוי קדמון מיאלואידית אפשרו התקדמות משמעותית בתחומים רבים, אך שברים שהם מזהים הטרוגנית מאוד. אסטרטגיות המגביל הנפוצות ביותר מגדירים מח העצם שברים מועשר עבור האוכלוסיות הרצוי, אך גם להכיל מספרים גדולים של אבות "מזהם". מחקרים אחרונים שלנו פתרו את רוב זה הטרוגניות, פרוטוקול שאנו מציגים כאן מתירה את ניתוקה של 6 subpopulations של oligopotent, ביצע לשושלת אבות מיאלואידית 2 שתואר קודם לכן מח העצם שברים. הפרוטוקול מתאר 3 שלבים: 1) בידוד של מח העצם תאים, 2) העשרה עבור אבות hematopoietic על-ידי מגנטי תא לפעיל על-מיון (דלדול שושלת היוחסין מאת מקינטוש) ולאחר 3) זיהוי של קדמון מיאלואידית קבוצות משנה על-ידי cytometry זרימה (כולל קרינה פלואורסצנטית תא לפעיל על-מיון, FACS, במידת הצורך). גישה זו מאפשרת כימות קדמון ובידוד למגוון רחב של יישומי בתוך חוץ גופית וויוו , כבר הניב תובנות הרומן משעולים, מנגנונים של נויטרופילים, מונוציט DC בידול.
Introduction
ומונוציטים, נויטרופילים, תאים דנדריטים (Dc) הם התאים מיאלואידית הנובעים מן אבות hematopoietic, בעיקר במח העצם, על ידי תהליך הנקרא myelopoiesis. אבות מיאלואידית משותף (CMPs) יש פוטנציאל לייצר התאים מיאלואידית, כמו גם megakaryocytes, אריתרוציטים, אבל בתאי הלימפה לא. גרנולוציט-מונוציט אבות (Gmp), אשר נגזרות CMPs, להפיק גרנולוציטים ומונוציטים, אך איבדו מגקריוציט של כדוריות דם אדומות פוטנציאליים. ומונוציטים הקלאסית plasmacytoid בקרי קבוצת מחשבים (cDCs/שיתפקדו) הם גם חשבו נובעים אבות נפוץ הידוע בשם אבות מונוציט-DC (MDPs), המיוצרים על ידי הדרגתי ההגבלה של פוטנציאל שושלת היוחסין בסופו של דבר התוצאה ביצע השושלת CMPs. אבות: אבות גרנולוציט מונוציט אבות, אבות תא דנדריטי (איור 1).
וייסמן ועמיתיו דיווחו כי CMPs נמצאים בערכה לין– c-+ Sca-1– (ביירד–) CD34+ FcγRהלאו שבר של העכבר מח העצם, ואילו Gmp הכלולים CD34 ביירד– + FcγR היי חלק1. עם זאת, אלו שברים "CMP" ו- "GMP" הם מאוד הטרוגנית. למשל, השבר "GMP" מכיל גם גרנולוציט ביצע לשושלת אבות מונוציט אבות1,2. MDPs דווחו בנפרד כדי להיות CX3CR1+ Flt3+ CD115+ אבות כי גם אקספרס CD34 ו FcγR3,-4. MDPs להצמיח cDC/pDC-הפקת נפוצות DC אבות (CDPs), אשר דווחו לבטא רמות נמוכות יותר של c-Kit (CD117), לא נכללות שבר ביירד– 5.
בעבר והונח ומונוציטים להיווצר באמצעות נתיב יחיד (CMP-GMP-MDP-מונוציט). בקנה אחד עם זה אבות מודל, ביצע מונוציט מתוצרת Gmp (על שם אבות מונוציט, MPs)2 ו- MDPs (על שם נפוץ מונוציט אבות, cMoPs)6 שנראה אותם התאים על בסיס משותף סמן משטח ביטוי . עם זאת, אנחנו לאחרונה הוכיח כי ומונוציטים מיוצרים באופן עצמאי על ידי Gmp ו MDPs, היו מסוגלים להבחין בין MPs cMoPs על ידי רצפי RNA בתא יחיד7.
אנחנו ששינה לאחרונה את ויסמן "CMP" ואסטרטגיה "GMP" חסימה כדי לזהות subfractions 6 של מח העצם של העכבר C57BL/6J המכילה oligopotent שונים, ביצע שושלת היוחסין קדמון מיאלואידית קבוצות משנה. קודם דיווחנו כי צביעת עבור Ly6C ו- CD115 מתירה את ניתוקה של oligopotent Gmp, וכן גרנולוציט אבות (GPs) של אבות מונוציט (MPs והן cMoPs, אשר כעת אין אפשרות להפריד) שבר "GMP"2 (ביירד - CD34+ FcγRהיי שער; איור 1). לאחר מכן להדגים MDPs מצויים בעיקר השבר "CMP" (CD34 ביירד– + FcγRהלאו שער), אשר מכיל גם Flt3+ CD115הלאו , Flt3– קבוצות משנה7 (איור 1 ). CMP-+ CD115הלאו שבר Flt3 התשואות Gmp והן MDPs בעת העברה המאמצת. המשנה CMP-Flt3– מכיל אבות כי נראה ביניים בין CMP-Flt3+ CD115הלאו תאים Gmp. בניגוד MDPs, CMP-Flt3+ CD115הלאו והן שברים CMP-Flt3– גם בעלי מגקריוציט כדוריות דם אדומות פוטנציאליים.
חשוב לציין, עם זאת, כי זה כרגע לא ברור אם השברים "CMP" מכילים אבות כי הם באמת oligopotent (למשל, תאים בודדים בתוך CMP-+ CD115הלאו שבר Flt3 שקיימים נויטרופילים, מונוציט, DC, מגקריוציט, פוטנציאל כדוריות דם אדומות), או לחלופין, מהווים תערובת של אבות עם פוטנציאל שושלת היוחסין מוגבל יותר. המושבה ויוצרים מבחני (methylcellulose תרבויות) חשפה תאים עם גרנולוציט (נויטרופילים), כדוריות דם אדומות, מונוציט מגקריוציט פוטנציאליים (תאי GEMM) ב- "CMP," CMP-Flt3+ CD115הלאו ושברים CMP-Flt3– 1 ,7, אך אינן מתירות את ההערכה של פוטנציאל DC. לעומת זאת, המושבה ויוצרים מבחני הוכיחה את קיומו של oligopotent Gmp (אבות נויטרופילים וגם מונוציט פוטנציאליים)1,שבר "GMP"2, זה נתמך על ידי תא בודד לאחרונה ניתוח transcriptomic8. לא כיום ידוע, עם זאת, בין אם אלה Gmp oligopotent גם לייצר אחרים גרנולוציטים (אאוזינופילים, בזופילים, ו תאי פיטום).
בהתבסס על מחקרים אלה, עכשיו נדגים איך פני השטח 7 סמנים (c-Kit, Sca-1, CD34, FcγR, Flt3, Ly6C ו CD115) יכול לשמש לזיהוי ולבידוד אלה 6 קבוצות משנה של oligopotent, ביצע לשושלת אבות מיאלואידית. הפרוטוקול המתואר כאן יכול להיות מיושם עבור in vitro לקשרי תרבות מבחני (תרבויות methylcellulose או נוזל), ויוו העברה המאמצת ניסויים עכברים, אנליזה מולקולרית (רצפי RNA בתפזורת, תא בודד, סופג המערבי, וכו).
הפרוטוקול מורכב 3 שלבים: 1) הכנת השעיה תא בודד של מח העצם תאים, 2) העשרה עבור אבות hematopoietic (מגנטי תא לפעיל על-מיון), ו- 3) זיהוי ובידוד במידת הצורך, של קבוצות משנה קדמון על ידי זרימת cytometry (באמצעות מנתח או סדרן, לפי הצורך). הצעד הראשון הוא בידודו של תאים במח העצם עצמות הירך ואת tibias של עכברים לאללה, והוא דומה לזה שתואר לעיל פרוטוקולים אחרים9. בשלב הבא, המדגם הוא מועשר עבור תאי גזע וקדמון באמצעות קוקטייל של נוגדנים נגד סמני פני שטח התא של אריתרוציטים, נויטרופילים ומונוציטים, לימפוציטים, וכו ', כדי לרוקן את התאים הבדיל. זו אינה חובה, אבל מומלץ בחום כדי למטב את הזיהוי של ערכות המשנה קדמון, וכדי להפחית את כמות נוגדנים לצורך זיהוי קדמון ולא את הזמן הנדרש עבור cytometry זרימה. פרוטוקול דלדול שושלת היוחסין להלן מתאר מיון תא Magnetic-Activated (מקינטוש) באמצעות ערכת דלדול העכבר תא השושלת (אשר מכיל biotinylated נוגדנים נגד CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/ג), 7-4, וטר-119, בנוסף אנטי ביוטין . גרגרי) ומפריד ממוכנת מגנטי. השלב האחרון הוא הזיהוי (ומיון, במידת הצורך) של ערכות המשנה קדמון על ידי cytometry זרימה. לוח נוגדן המתוארים להלן (ראה גם לוח 1) תוכנן כדי לשמש cytometer זרימה (מנתח או סדרן) עם לייזרים 4 (405 ננומטר, 488 ננומטר, 561 nm, 640 ננומטר).
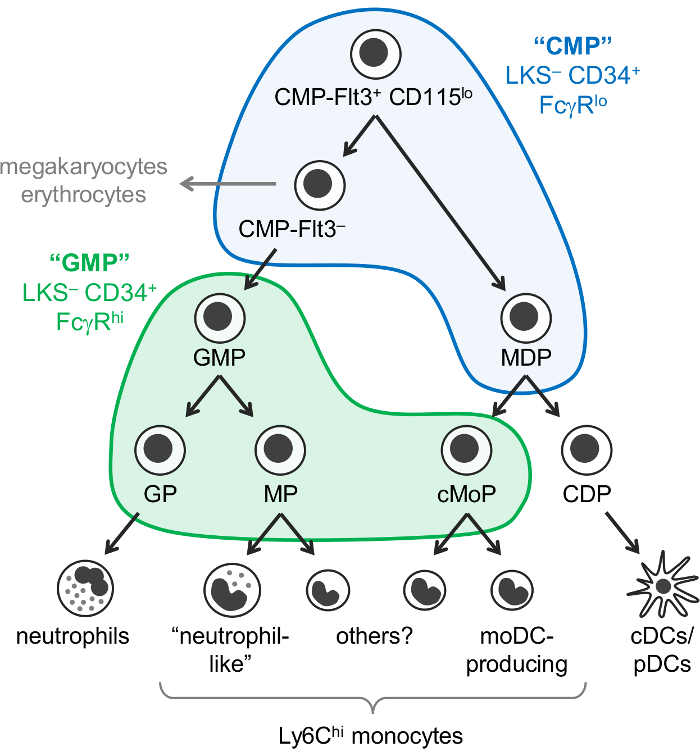
איור 1: אבות נויטרופילים, מונוציט, DC מסלולים בידול. המודל לאחרונה המתוקן של myelopoiesis7 מודגם, עם השערים וייסמן "CMPs" (כחול) ו- "Gmp" (ירוק)1 בשכבות. איור זה השתנה. ואח 2017 Yáñez7. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
כל השיטות המתוארות כאן אושרו על ידי טיפול בעלי חיים מוסדיים ועל שימוש הוועדה (IACUC) של Cedars-Sinai Medical Center.
1. בידוד של מח העצם העכבר והכנה של השעיה תא בודד
- המתת חסד את העכבר בהתאם להנחיות מוסדיים.
- הנח את העכבר לאללה על גבו, תשפריץ עם 70% אתנול (EtOH). עושים חתך קטן (3-5 מ מ) בכל איבר הינד-הקרסול רמת באמצעות מספריים, מחודד, ומשוך את העור למעלה לכיוון הגוף כדי להסיר אותו הרגליים ולחשוף את השרירים והעצמות.
- הסר את השרירים (הארבע ראשי, מיתרי הברך, וכו ') העצמות באמצעות קיטום אותם עם מספריים, עם כיוון של העצם. יש להיזהר לא לגרום נזק לעצמות.
- לנקוע את עצמות הירך של מפרקי הירך, לחתוך משם את רקמת השריר כדי לנתק את הרגליים, נזהר לא לחתוך לתוך העצמות.
- להסיר את הרגליים על ידי נקע לקרסוליים של tibias, מניחים את העצמות שפופרת של PBS סטרילי או מדיה, להעביר אותם על קרח לחדר תרביות רקמה.
הערה: בשביל כמה יישומים אחרים (למשל, שתנבע מקרופאגים מתאי מח עצם סה כ) זה אפשרי להשאיר את העצמות על הקרח לזמן מה, אך לבידוד קדמון חשוב להמשיך במהירות האפשרית כדי למנוע downregulation של חשוב משטח סמנים (במיוחד CD115). - באבטחה הקבינט, הסר כל רקמות רכות הנותרים העצמות על ידי שפשוף אותם עם נייר טישו.
הערה: הפרוטוקול צריכה להתבצע ב- cabinet אבטחה אם דגימה סטרילית נדרשת עבור מבחני תרבות או ויוו תא לאחר מיון FACS. אם תאים סטרילי אינם נדרשים, כל התהליך יכול להתבצע על הספסל מעבדה. - בקצרה לטבול את העצמות ב 70% EtOH לחטא אותם, ולאחר מכן ב- PBS סטרילי לרחוץ אותם.
- להפריד את עצמות הירך tibias, קטועת דרך הברך, ולמחוק את קטועת.
- חותכים את הקצוות את העצמות עם מספריים חדות.
- הקציר מח עצם עם PBS קר סטרילי כדלקמן עד העצמות נראים לבנים:
- אחיזה כל עצם עם מלקחיים והוסף מחט 26 גרם מחובר 10 מ"ל המזרק המכיל PBS סטרילי קר לתוך הצינור עצם בקצה אחד.
- . תחזיק את העצם מעל שפופרת צנטרפוגה 50 מ ל ומורידים 2-5 מ ל PBS דרך העצם כדי לקצור את מח העצם.
- לקצור את מח העצם. מהעצמות 4 כל לכל העכבר (2 עצמות הירך ו- 2 tibias).
- בעדינות פיפטה למעלה ולמטה עם פיפטה 1 מ"ל כדי disaggregate מח העצם כדי ליצור השעיה התא.
- לסנן את המתלים מח העצם דרך פיסת רשת ניילון μm 30 כדי לחסל את חתיכות עצם וסלולרי אגרגטים, ובכך יוצר השעיה תא בודד.
- צנטריפוגה התליה תא בודד ב g 280 x 5 דקות, resuspend בגדר תא במאגר מכתימים סטרילי (PBS + 0.5% FBS + 2 מ מ EDTA), באמצעות 5 מ"ל מכתים מאגר לכל העכבר (למשל, 10 מ עבור תאים איחדו עצמות הירך, tibias של עכברים 2).
- . קח μL 10 aliquot של המדגם, ערבב את זה עם 10 μL Trypan Blue, טען 10 μL של המדגם התווית על-ידי Trypan Blue המתקבלת על hemocytometer. לספור את התאים באמצעות מיקרוסקופ אור.
הערה: אם התאים נמצאים גם מרוכזים לספירת אמין, לדלל את הדגימה לפני הוספת Trypan Blue.
2. קדמון העשרה על ידי מגנטי תא לפעיל על-מיון (מקינטוש)
- Centrifuge המתלה כולו תא בודד (או תאים רבים נדרשים להשיג את התשואה הרצוי) ב g 280 x דקות 5-4° C ו resuspend בגדר תא ב 40 μL מכתים מאגר (PBS + 0.5% FBS + 2 מ מ EDTA) לכל 107 תאים.
הערה: זה גם ניתן להשתמש MACS מאגר מהיצרן ערכת דלדול השושלת (ראה טבלה של חומרים) כחלופה למאגר מוכתמים. - לבצע דלדול שושלת היוחסין לפי ההוראות שסופקו עם ערכת דלדול השושלת. ההוראות הבאות הן עבור ערכת ראה את הטבלה של חומרים. אם ערכת שונים, בצע הוראות היצרן ולאחר מכן המשך לשלב 2.3.
- להוסיף 10 קוקטייל ביוטין-נוגדן μL לכל 107 תאים, לערבב על-ידי pipetting, תקופת דגירה של מינימום 10-4 מעלות צלזיוס.
- להוסיף 30 μL מכתים מאגר/מקינטוש מאגר לכל 107 תאים ומערבבים.
- הוסף 20 גרגרי אנטי ביוטין μL לכל 107 תאים. מערבבים היטב, תקופת דגירה של 15 דקות נוספות ב 4 º C.
הערה: מערבולת גרגרי לפני הוספתן על התאים כדי לוודא כי הם מפוזרים לגמרי. - להוסיף 1 מ"ל מכתים מאגר/מקינטוש מאגר לכל 107 תאים, centrifuge את התאים ב g x 280 5 דקות, resuspend בגדר תא ב- 500 μL מכתימים מאגר/מקינטוש מאגר עבור עד 108 תאים. עבור יותר מ-108 תאים, לשנות את עוצמת הקול של צביעת מאגר/מקינטוש מאגר בהתאם.
- להכין את המפריד מגנטי אוטומטית על פי הוראות היצרן.
- למקם את הצינור המכילות את התאים שכותרתו לתוך המפריד ובחרו את תוכנית הבחירה שלילי.
- לאסוף את השבר שליליים, אשר מכיל את התאים מועשרים קדמון (לין–) שושלת היוחסין-שלילי. למחוק את השבר חיובית, אשר מכיל את התאים שושלת היוחסין-חיובית עם התווית מגנטית.
- לין– תאים ב g 280 x במשך 5 דקות, centrifuge, resuspend בגדר תא ב 2 מ"ל מכתים מאגר/מקינטוש מאגר לכל העכבר (למשל, 4 מ"ל אם מח העצם היה איחדו בין שני עברים).
הערה: בגדר עכשיו להיות לבן במקום אדום כי אריתרוציטים התרוקן. - קח את μL 10 aliquot של התאים לין– , ערבב את זה עם 10 μL Trypan Blue, טען 10 μL של המדגם התווית על-ידי Trypan Blue המתקבלת על hemocytometer. לספור את התאים באמצעות מיקרוסקופ אור.
הערה: אם התאים נמצאים גם מרוכזים לספירת אמין, לדלל את הדגימה לפני הוספת Trypan Blue.
3. מיאלואידית קדמון זיהוי ובידוד על ידי תא לפעיל על-ידי קרינה פלואורסצנטית מיון (FACS)
- תווית 9 צינורות microcentrifuge (1.5 או 2 מ"ל) עבור: 1) מוכתם תאים, 2-8) תאים יחיד מוכתם fluorophore מצומדת נוגדנים נגד FcγR (CD16/32), c-Kit, Sca-1, CD34, Flt3 (CD135), Ly6C ו- CD115 לקבלת פיצוי הבחירה וצבע מתח, ו- 9) דגימת תאים כדי להיות מוכתם כל 7 נוגדנים קדמון זיהוי ומיון.
- פזר 100,000 תאים לכל אחד הצינורות שליטה (צינורות 1-8), ואת כל התאים הנותרים (או פחות אם תרצה) לשם ברכבת התחתית מדגם (הצינור 9).
הערה: אם אמצעי האחסון מדגם גדול מ- 1.5-2 מ"ל, ייתכן צורך להפיץ את דגימת התאים לתוך צינור 15 מ"ל, centrifuge אותם, resuspend בגדר (שלב 3.3 להלן), ולאחר מכן להעביר את התאים לרכבת התחתית microcentrifuge עבור צביעת והשלבים הבאים. - Centrifuge התאים ב g 1,500 x למשך 5 דקות ולאחר resuspend כדורי צינור שליטה ב- 100 μL מכתים מאגר (PBS + 0.5% FBS + 2 מ מ EDTA) ולא בגדר צינור לדוגמה ב- 100 μL מכתים מאגר לכל 5 x 106 תאים (למשל, 200 μL עבור 1 x 107 תאים).
- להוסיף 2 μg/mL anti-CD16/CD32-APC-Cy7 הצינור FcγR הכתם יחיד, הצינור מדגם. מערבולת בעדינות כדי לערבב, תקופת דגירה של מינימום 10-4 מעלות צלזיוס.
הערה: חשוב להכתים את דגימת התאים עם הנוגדן FcγR (CD16/32) לפני הוספת נוגדנים אחרים כדי למנוע תחרות בגלל שאינם ספציפיים בתיווך fc של הנוגדן מחייב. לא תדגור התאים עם FcγR חסימת ריאגנט - להוסיף נוגדנים אחרים המתאימים כתם אחד הצינורות (1 נוגדן כל) של הצינור מדגם (כל 6 נוגדנים): μg/mL 10 c-Kit-פסיפיק בלו, 2 μg/mL Sca-1-PE-Cy7, 25 μg/mL CD34-FITC, 10 μg/mL Flt3-APC, 2 μg/mL Ly6C-PerCP-Cy5.5 ו- 4 μg/mL CD115-PE. מערבולת בעדינות, דגירה למשך 15 דקות ב 4 º C.
- הוסף 900 μL מאגר מכתימים את הצינורות שליטה מאגר מכתימים 1 מ"ל לכל7 10, לתאים הצינור הדגימה. Centrifuge התאים ב g x 1,500 במשך 5 דקות, resuspend בגדר תא בצביעת מאגר: μL 200 למחזור בקרת ולאחר μL 500 לכל 25 x 10 תאים6 בצינור הדגימה. העבר את התאים resuspended צינורות 5 מ"ל FACS.
הערה: אם אמצעי האחסון מדגם גדול מ- 1.5-2 מ"ל, ייתכן צורך להעביר את התאים לרכבת התחתית 15 mL עבור צנטריפוגה. - הכינו את cytometer זרימה (מנתח או סדרן) על פי הוראות היצרן.
- הפעל את מוכתם יחיד צבעונית תאים שליטה דרך הזרימה cytometer כדי להגדיר את המתחים ואת צבע פיצויים.
- להפעיל את התאים לדוגמה, שער תת-קבוצות קדמון וגם מחולקת לרמות מתחת מסוכמים באיור2, ולבצע במידת הצורך, FACS מיון כדי לבודד תת-קבוצות קדמון הרלוונטיים.
הערה: יש בדרך כלל צורך לרכוש כ 200,000 תאים כדי לקבל לפחות 1,000 אירועים כל שער קדמון.- ליצור חלקת נקודה כל התאים, הצגת FSC-A (x) וציר האס-A (ציר y), ואת שער להוציא פסולת ותאים מתים = > "חי" תאים.
- יצירת מגרש נקודה של תאים "חי", הצגת FSC-H (ציר x) ו- FSC-W (ציר y), ואת שער כדי לא לכלול doublets = > שער חי/גופיה (FSC).
- ליצור חלקת נקודה לחיות/גופיה תאים (FSC), הצגת האס-H (ציר x), האס-W (ציר y), ואת שער כדי לא לכלול doublets = > לחיות/גופיה (FSC) / שער גופיה (האס).
- ליצור חלקת נקודה לחיות/גופיה (FSC) / תאים גופיה (האס), הצגת Sca-1 (ציר x) ו- c-Kit (ציר y), ושער לבחירת c-Kit+ Sca-1– תאים = > תאים ביירד– .
- יצירת מגרש נקודה של תאים ביירד– , הצגת CD34 (ציר x) FcγR (ציר y) ואת השער כדי לבחור CD34+ FcγRהלאו תאים = > "CMPs", ואת CD34+ FcγR תאיםשלום = > "Gmp".
הערה: חשוב לשער את "CMPs" ואת "Gmp" כמו במדויק ככל האפשר. זה עוזר להשתמש מגרש צפיפות מדומה או מגרש מתאר עבור gating מדויק. - ליצור חלקת נקודה "CMPs", הצגת CD115 (ציר x), Flt3 (ציר y), ושער כדי לבחור:
Flt3+ CD115הלאו תאים = > CMP-Flt3+ CD115הלאו תאים,
Flt3– CD115הלאו תאים = > Flt3-CMP– תאי,
Flt3+ CD115 תאיםשלום = > MDPs. - ליצור חלקת נקודה "Gmp", הצגת Ly6C (ציר x) FcγR (ציר y) ואת שער לבחירת Ly6C תאים–= > "תאים GMP-Ly6C– ", Ly6C+ תאים = > "GMP-Ly6C+ תאים".
- ליצור חלקת נקודה "GMP-Ly6C– תאים", הצגת CD115 (ציר x), Flt3 (ציר y), ושער כדי לבחור:
Flt3– CD115הלאו תאים = > Gmp. - ליצור חלקת נקודה "GMP-Ly6C+ תאים", הצגת CD115 (ציר x), Flt3 (ציר y), ושער כדי לבחור:
Flt3– CD115הלאו תאים = > GPs,
Flt3– CD115היי תאים = > MPs + cMoPs.
תוצאות
באמצעות פרוטוקול המתואר לעיל, זה אפשרי להשיג ~ 100 מיליון תאים (כולל תאי דם אדומים, או תאים nucleated ~ 50 מיליון) של עצמות הירך והן tibias (2 רגליים) של עכבר C57BL/6J אחד (6-8 שבועות ישנים, זכר או נקבה). 1-2 מיליון תאים לין– ניתן לבודד לכל העכבר על ידי MACS דלדול תאי לין+ .
Discussion
ויסמן gating אסטרטגיה עבור זיהוי קדמון מיאלואידית העכבר1 כבר את תקן זהב עבור immunologists ו ההמטולוגים במשך כמעט 20 שנה, אבל עכשיו זה לכאורה כי השערים "CMP" ו- "GMP" הם מאוד הטרוגנית יותר מדויק אסטרטגיות המגביל נחוצים. בפרוטוקול כי שתיארנו כאן מאפשר הזיהוי של oligopotent ושל קבוצות משנה ביצע שושל?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
פרוטוקול זה פותחה באמצעות קרנות ממכון לוח של המושלים הרגנרציה לרפואה במרכז הרפואי Cedars-Sinai (כדי HSG), קריירות ב מלגת אימונולוגיה של האגודה האמריקאית של Immunologists (כדי AY HSG), ו פרס מלומד האגודה האמריקנית של המטולוגיה (כדי AY). אנו מודים הליבה Cytometry זרימה בבית Cedars-Sinai Medical Center על סיוע עם FACS מיון.
Materials
| Name | Company | Catalog Number | Comments |
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
References
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved