Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выявление и изоляция Oligopotent и Lineage, совершенные миелоидного предшественники костного мозга мыши
В этой статье
Резюме
Мы показали, как идентифицировать и изолировать 6 подмножеств миелоидного прародителей из мышиных костного мозга с помощью комбинации магнитных и флуоресценции, сортировка (MACS и СУИМ). Этот протокол может использоваться для в vitro assays культуры (метилцеллюлоза или жидкости культуры), в естественных условиях приемных передачи экспериментов и РНК/белка анализа.
Аннотация
Миелоидные прародителей, которые дают нейтрофилов, моноцитов и дендритных клеток (DCs) могут быть определены в и изолированы от костного мозга мышей для гематологических и иммунологические анализы. Например исследования клеточном и молекулярном свойств миелоидного progenitor населения можно выявить механизмы, лежащие в основе лейкозных преобразования, или продемонстрировать, как иммунная система реагирует на патогенные воздействия. Ранее описанных потока цитометрии стратегии для идентификации миелоидного progenitor позволили значительных успехов во многих областях, но фракций, которые они определяют весьма неоднородны. Наиболее часто используемые стробирования стратегии определить костного фракций, которые обогащаются для желаемого населения, но и содержат большое количество «заражая» прародителей. Наши недавние исследования решили большую часть этой неоднородности и протокол, который мы представляем здесь позволяет изоляции 6 субпопуляции oligopotent и совершенные линии миелоидного прародителей от 2 ранее описанных костного дробей. Протокол описывает 3 этапа: 1) изоляции костного клеток, 2) обогащения гемопоэтических прародителями сортировки магнитные активации клеток (линии истощение, MACS), и 3) идентификация миелоидного progenitor подмножеств подачей cytometry (включая флуоресценции активированный ячейку Сортировка, FACS, при необходимости). Этот подход позволяет прародитель квантификации и изоляции для различных приложений в пробирке и в естественных условиях и уже принесли Роман понимание путей и механизмов нейтрофилов, моноцитов и DC дифференциации.
Введение
Моноциты, нейтрофилов и дендритных клеток (DCs) являются миелоидных клеток, возникающих от гемопоэтических прародителями, главным образом в костном мозге, этот процесс называется myelopoiesis. Общие миелоидного прародителями (CMPs) имеют потенциал для производства миелоидных клеток, а также megakaryocytes и эритроцитов, но не лимфоидных клеток. Предшественники гранулоцитов и моноцитов (ГИП), которые являются производными от CMPs, производят гранулоцитов и моноцитов, но потеряли мегакариоцитов и эритроцитов потенциал. Моноциты и классические и плазмоцитарная DCs (cDCs/PDC) также считается вытекают из общих прародителей, известный как предшественники Моноцит DC (MDPs), которые производятся CMPs. постепенное ограничение потенциал линии в конечном итоге приводит родословную, совершенные прародители: предшественники гранулоцитов, моноцитов прародителями и Предшественники дендритных клеток (рис. 1).
Вайсман и коллеги сообщили, что CMPs находятся в Линь– c комплект+ Sca-1– (ЛКС–) CD34 FcγRЛо часть костного мозга мыши, в то время как ГИП содержатся в CD34 ЛКС– + + FcγR Привет часть1. Однако эти «КПВ» и «GMP» фракции являются весьма разнородными. Например «GMP» фракции также содержит восходящей линии, совершенные гранулоцитов и моноцитов прародителями1,2. MDPs отдельно сообщается CX3CR1+ Flt3+ CD115+ прародителей, которые также выразить CD34 и FcγR3,4. MDPs привести к cDC/pDC производство общих DC прародителями (CDP), сообщившие выразить более низкие уровни c-Kit (CD117) и не включаются в ЛКС– часть5.
Ранее предполагалось, что моноциты возникают по одной дорожке (CMP-GMP-MDP-Моноцит). В соответствии с этой модели, совершенные Моноцит прародителями, производимые ГИП (названный Моноцит прародителями, м/с)2 и MDPs (названный общих Моноцит прародителями, cMoPs)6 , по-видимому, те же клетки на основе общей поверхности маркер выражения . Однако мы недавно продемонстрировали, что моноциты производятся независимо ГИП и MDPs и были в состоянии провести различие между депутаты и cMoPs сингл клеточной РНК последовательности7.
Мы недавно изменен Вайсман «КПВ» и «GMP» стробирования стратегии для выявления 6 подфракций костного C57BL/6J мыши, содержащих различные oligopotent и совершенные линии миелоидного progenitor подмножеств. Мы впервые сообщили, что окрашивание для Ly6C и CD115 позволяет изоляции oligopotent ГИП, так как предшественники гранулоцитов (GPs) и Моноцит прародителями (MPs и cMoPs, который мы в настоящее время не в состоянии отделить) от «GMP» часть2 (ЛКС - CD34+ FcγRПривет ворота; Рисунок 1). Впоследствии мы показали, что MDPs преимущественно находятся в «КПВ» фракции (CD34 ЛКС– + FcγRЛо ворота), который также содержит Flt3+ CD115Ло и Flt3– подмножеств7 (Рисунок 1 ). CMP-Flt3+ CD115Ло фракция дает ГИП и MDPs после приемных передачи. CMP-Flt3– подмножество содержит прародителей, которые представляются промежуточные между CMP-Flt3+ CD115Ло клетки и ГИП. В отличие от MDPs CMP-Flt3+ CD115Ло и CMP-Flt3– фракции также обладают мегакариоцитов и эритроцитов потенциал.
Важно отметить, однако, что это в настоящее время неясно ли «КПВ» фракции содержат прародителей, которые действительно oligopotent (например, отдельных ячеек в CMP-Flt3+ CD115Ло фракции обладают нейтрофилов, Моноцит, DC, мегакариоцитов и потенциальных эритроцитов), или альтернативно, составляют смесь прародителями с более ограниченным потенциалом линии. Колонии, формируя assays (метилцеллюлоза культуры) показали клетки с гранулоцитарный (нейтрофилов), эритроцитов, моноцитов и мегакариоцитов потенциальных (ГЭММ клетки) в «СС», CMP-Flt3+ CD115Ло и фракции CMP-Flt3– 1 ,7, но не позволяют оценку потенциала постоянного тока. В отличие от колонии, формируя assays продемонстрировал существование oligopotent ГИП (предшественники нейтрофилов и моноцитов потенциальных) в «GMP» часть1,2, и это подтверждается недавно одноклеточного транскриптомики анализ8. Это не известно в настоящее время, однако, является ли эти oligopotent ГИП также производить другие гранулоцитов (эозинофилов, базофилов и тучных клеток).
На основании этих исследований, мы теперь продемонстрировать как 7 поверхности маркеры (c комплект Sca-1, CD34, FcγR, Flt3, Ly6C и CD115), может использоваться для идентифицировать и изолировать эти 6 подмножества oligopotent и совершенные линии миелоидного прародителями. Протокол, описанные здесь может применяться для анализов в vitro культуры (метилцеллюлоза или жидкости культуры), в естественных условиях приемных передачи эксперименты в мышей и молекулярный анализ (насыпных и одноклеточного последовательности РНК, Западный blotting, и т.д.).
Протокол состоит из 3 этапов: 1) подготовка подвески одной клетки костного мозга клетки, 2) обогащения гемопоэтических прародителями (сортировки) магнитные активации клеток и 3) выявления и изоляции, при желании, прародитель подмножеств потоком цитометрии (с использованием анализатора или сортировщик, в соответствующих случаях). Первым шагом является изоляция клетки костного мозга от бедра и tibias Усыпленных мышей и похож на другие ранее описанные протоколы9. Затем образец обогащен для стволовых и прогениторных клеток с помощью коктейль антител против клеток поверхностных маркеров эритроцитов, нейтрофилы, моноциты, лимфоциты и т.д., чтобы истощить дифференцированных клеток. Это не является обязательным, но настоятельно рекомендуется оптимизировать обнаружения подмножеств прародителю и уменьшить количество антител, необходимых для идентификации прародителем и время, необходимое для проточной цитометрии. Родословная истощения протокол ниже описывает Magnetic-Activated ячейку Сортировка (ПДК) с помощью мыши Lineage ячейки истощение Kit (который содержит биотинилированным антитела CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/C), 7-4 и тер-119, плюс анти биотин микрошарики) и автоматизированных магнитный сепаратор. Последним шагом является идентификация (и сортировки, если это необходимо) Прародитель подмножеств подачей cytometry. Группа антител, описанных ниже (см. также таблицу 1) была разработана для использования в проточный цитометр (анализатор или Сортировщике) с 4 лазеры (405 нм, 488 нм, 561 Нм, 640 Нм).
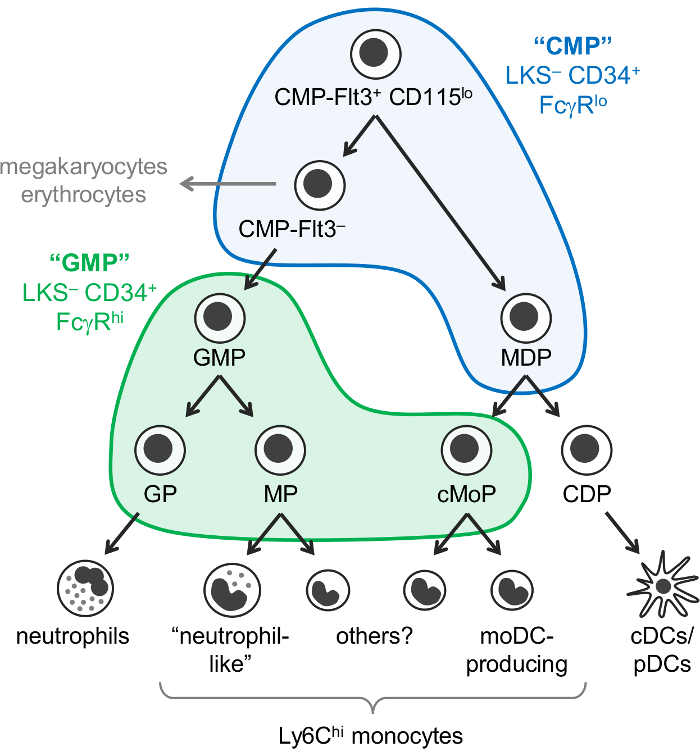
Рисунок 1: нейтрофилов, моноцитов и DC прародителями и дифференциация путей. Недавно пересмотренная модель myelopoiesis7 иллюстрирован, Вайсман ворота для «CMPs» (синий) и «ГИП» (зеленый)1 обложил. Эта цифра была изменена Яньес et al. 20177. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
Все методы, описанные здесь были утверждены институциональный уход животных и использование Комитет (IACUC) от Медицинский центр Седарс-Синай.
1. изоляция костного мозга мыши и приготовление суспензии одну ячейку
- Усыпить мыши институциональных руководящих принципов.
- Место Усыпленных мышь на его спине и распылить его с 70% этанола (EtOH). Сделайте разрез маленьких (3-5 мм) в каждой задние конечности на лодыжки уровня используя острый, острые ножницы и подтянуть кожу к телу, чтобы удалить его из ноги и разоблачить мышц и костей.
- Удалите мышцы (четырехглавой мышцы, бедра и т.д.) из костей, обрезки их ножницами, после направления кости. Будьте осторожны, чтобы не повредить кости.
- Вывихнуть бедра от тазобедренных суставов и отрезать соединительной ткани и мышцы, чтобы отсоединить ноги, стараясь не нарезать кости.
- Удалите ноги, лодыжки от tibias отводе, место кости в трубке стерильных PBS или средства массовой информации и транспортировать их на льду в зале культуры ткани.
Примечание: Для некоторых других приложений (например, вытекающие макрофагов из клеток всего костного) можно оставить кости на льду на некоторое время, но для изоляции прародитель важно действовать быстро, как можно избежать Даунрегуляция из важные поверхностных маркеров (особенно CD115). - В области биобезопасности кабинета удалите любые оставшиеся мягких тканей из костей, потерев их папиросной бумаги.
Примечание: Протокол должен выполняться в биобезопасности кабинета если образец стерильных требуется для клеток культуры или vivo анализов после сортировки СУИМ. Если стерильные ячейки не требуется, весь процесс может выполняться на стенде лаборатории. - Кратко погружать костей в 70% EtOH вылечить их, а затем в стерильных PBS мыть их.
- Отделить бедра от tibias и фибулы, проходящем через колено и отбросить фибулы.
- Отрежьте концы офф кости с острыми ножницами.
- Урожай костного мозга с холодного стерильного PBS следующим до костей появляются белые:
- Захват каждой кости с щипцами и вставьте иголку 26G, подключенных к шприц 10 мл, содержащих холодного стерильного PBS в кости вала на одном конце.
- Держите кости выше 50 мл пластиковых пробирок и очистить 2-5 мл PBS через кость урожай костного мозга.
- Урожай костного мозга от всех 4 кости на мышь (2 бедра и 2 tibias).
- Осторожно, Пипетка вверх и вниз, с 1 мл пипетки дезагрегировать костного мозга в форме суспензии клеток.
- Фильтр костного подвеска через кусок 30 мкм нейлоновая сетка для ликвидации части кости и мобильных агрегатов, создавая тем самым одну ячейку подвеска.
- Центрифуга одноклеточного подвеска на 280 x g 5 мин, и Ресуспензируйте Пелле клеток в стерильных окрашивание буфера (PBS + 0.5% FBS + 2 мм ЭДТА), используя 5 мл, окрашивание буфера на мышь (например, 10 мл для ячеек, объединения от бедра и tibias 2 мышей).
- Возьмите 10 мкл аликвота образца, смешать его с 10 мкл Трипановый синий и нагрузки 10 мкл результате Трипановый синий-меченых образца на Горяева. Подсчет количества ячеек с использованием световой микроскоп.
Примечание: Если клетки слишком сосредоточены для надежной подсчета, разбавляют образца перед добавлением Трипановый синий.
2. прародитель обогащение магнитные активации клеток, сортировка (Mac)
- Центрифуга для подвески всего одну ячейку (или столько же ячеек как требуются для получения желаемой доходности) на 280 x g 5 мин при 4° C и Ресуспензируйте Пелле клеток в 40 мкл, окрашивание буфера (PBS + 0.5% FBS + 2 мм ЭДТА) за 107 клеток.
Примечание: Это также можно использовать MACS буфер от производителя комплект истощения линии (см. Таблицу материалы) как альтернативу окрашивание буфер. - Выполните линии истощение согласно инструкции, поставляется с комплектом истощения линии. Следующие инструкции предназначены для комплекта видно в Таблице материалов. Если используется другой набор, следуйте инструкциям производителя и затем перейдите к шагу 2.3.
- Добавить 10 мкл биотин антитела коктейль за 107 клеток, смешивать, закупорить и проинкубируйте втечение 10 мин при 4 ° C.
- Добавить 30 мкл пятнать буфера/MACS буфер за 107 клеток и перемешать.
- Добавьте 20 мкл анти биотина микрошарики за 107 клеток. Хорошо перемешайте и инкубировать еще 15 мин при 4 ° C.
Примечание: Vortex микрошарики перед их добавлением в клетках чтобы убедиться, что они полностью рассеяны. - Добавьте 1 mL, окрашивание буфера буфера/Маки на 107 клеток, центрифуга клетки на 280 x g за 5 мин и Ресуспензируйте Пелле клеток в 500 мкл окрашивание буфера/Маки буфера для до 108 клеток. Для более чем 108 клеток наращивать объем пятнать буфера буфера/MACS соответственно.
- Подготовьте автоматизированных магнитный сепаратор согласно инструкциям производителя.
- Поместите трубка, содержащая помеченные клетки в сепаратор и выберите негативный выбор программы.
- Соберите негативные фракция, которая содержит клетки предшественники обогащенный (Лин–) линии отрицательных. Отказаться от положительных фракция, которая содержит магнитно меченых линии положительных клеток.
- Центрифуга Линь– клетки на 280 x g 5 минут и Ресуспензируйте Пелле клеток в 2 мл, окрашивание буфера буфера/Маки на мышь (например, 4 мл, если костный мозг был пул от 2 мышей).
Примечание: Гранулы теперь должен быть белым вместо красного потому что были истощены эритроцитов. - Возьмите 10 мкл аликвота Линь– клеток, смешать его с 10 мкл Трипановый синий и нагрузки 10 мкл результате Трипановый синий-меченых образца на Горяева. Подсчет количества ячеек с использованием световой микроскоп.
Примечание: Если клетки слишком сосредоточены для надежной подсчета, разбавляют образца перед добавлением Трипановый синий.
3. миелоидного Progenitor выявление и изоляция по активации флуоресценции клеток, сортируя (FACS)
- Этикетка 9 microcentrifuge (1,5 или 2 мл) трубы для: 1) незапятнанное клетки, 2-8) одной клетки окрашивали Флюорофор конъюгированных антител против FcγR (CD16/32), c комплект, Sca-1, CD34, Flt3 (CD135), Ly6C и CD115 для выбора и цвет компенсации напряжения и 9) образец клеток к быть запятнано с все 7 антитела для прародителя идентификации и сортировки.
- Распространить образец трубки (трубки 9) 100000 клеток для каждого элемента управления труб (трубы 1-8) и все остальные ячейки (или меньше, по желанию).
Примечание: Если объем образца больше чем 1,5-2 мл, это может быть необходимо распространять образец клеток в 15 мл трубку, центрифуга их Ресуспензируйте Пелле (шаг 3.3 ниже) и затем передать клетки пробки microcentrifuge для последующего окрашивания шагов. - Центрифуга клетки на 1500 x g 5 минут и Ресуспензируйте управления пробки гранул в 100 мкл окрашивание буфера (PBS + 0.5% FBS + 2 мм ЭДТА) и образец трубки Пелле в 100 мкл пятнать буфера за 5 х 106 клеток (например, 200 мкл для клетки 1 x 10-7 ).
- Добавьте 2 мкг/мл анти CD16/CD32-БТР-Cy7 трубка FcγR одно пятно и образец трубки. Вихревой мягко для микширования и проинкубируйте втечение 10 мин при 4 ° C.
Примечание: Важно, чтобы пятно образец клеток с FcγR (CD16/32) антитела до добавления других антител, чтобы предотвратить конкуренцию за неспецифической Fc опосредованной антитела связывая. Не инкубировать клетки с FcγR, блокирование реагента. - Добавьте другие антитела соответствующие трубы одного пятна (по 1 антител) и образец трубки (все 6 антитела): 10 мкг/мл c комплект-Тихоокеанский синий, 2 мкг/мл Sca-1-PE-Cy7, 25 мкг/мл CD34-FITC, 10 мкг/мл Flt3-APC, 2 мкг/мл Ly6C-PerCP-Cy5.5 и 4 мкг/мл CD115-PE. Вихревой мягко и Инкубируйте 15 мин при 4 ° C.
- Добавьте 900 окрашивание мкл буфера для управления трубы и окрашивание буфера 1 мл на 107 клеток в образец трубки. Центрифуга клетки на 1500 g x 5 мин и Ресуспензируйте Пелле клеток в пятнать буфера: 200 мкл за управления трубки и 500 мкл за 25 х 106 клеток в пробирку образца. Передача ресуспензированы клетки до 5 мл СУИМ трубы.
Примечание: Если объем образца больше чем 1,5-2 мл, это может быть необходимо перевести клетки 15 мл трубки для центрифугирования. - Подготовьте проточный цитометр (анализатор или Сортировщике) согласно инструкциям производителя.
- Запустите безупречный и одного окрашенные клетки управления через проточный цитометр напряжений и цвет компенсаций.
- Запустите образец клеток, ворота прародитель подмножеств как говорится ниже и кратко на рисунке 2и при желании выполнить СУИМ, сортировка изолировать подмножества соответствующих прародитель.
Примечание: Это обычно необходимо приобрести приблизительно 200.000 клетки, чтобы получить по крайней мере 1000 события в каждом прародитель ворот.- Создайте точку участок всех клеток, отображая FSC-A (ось x) и SSC-A (ось y) и ворота для исключения мусор и мертвые клетки = > «живут» клетки.
- Создайте точку участка «живой» клеток, отображая FSC-H (ось x) и FSC-W (ось y) и ворота исключить Дуплеты = > ворота жить/синглетно (FSC).
- Создайте точку участок жить/синглетно (FSC) клетки, отображая SSC-H (ось x) и SSC-W (ось y) и ворота исключить Дуплеты = > жить/синглетно (FSC) / ворота синглетно (SSC).
- Создайте точку участок жить/синглетно (FSC) / синглетно (SSC) клетки, отображая Sca-1 (ось x) и c комплект (ось y) и ворота выбрать c комплект+ Sca-1– клетки = > ЛКС– клетки.
- Создайте точку участок ЛКС– клетки, отображение CD34 (ось x) и FcγR (ось y) и ворота для выбора CD34+ FcγRЛо клетки = > «CMPs» и CD34+ FcγRПривет клетки = > «ГИП».
Примечание: Важно ворот «CMPs» и «ГИП» как точно как можно скорее. Это полезно использовать для точного стробирования участке плотность псевдоцветном или контурное. - Создайте точку участка «CMPs», отображение CD115 (ось x) и Flt3 (ось y) и ворота для выбора:
Flt3+ CD115Ло клеток = > CMP-Flt3+ CD115Ло клетки,
Flt3Ло клетки– CD115 = > CMP-Flt3– клетки,
Flt3+ CD115Привет клеток = > MDPs. - Создайте точку участок «ГИП», отображение Ly6C (ось x) и FcγR (ось y) и ворота для выбора Ly6C–клетки = > «GMP-Ly6C– клетки» и Ly6C+ клеток = > «GMP-Ly6C+ клетки».
- Создайте точку участка «GMP-Ly6C– клетки», отображение CD115 (ось x) и Flt3 (ось y) и ворота для выбора:
Flt3Ло клетки– CD115 = > ГИП. - Создайте точку участка «GMP-Ly6C+ клетки», отображение CD115 (ось x) и Flt3 (ось y) и ворота для выбора:
Flt3Ло клетки– CD115 = > GPs,
Flt3Привет клетки– CD115 = > м/с + cMoPs.
Результаты
Используя протокол, описанных выше, можно получить от бедра и tibias (2 ноги) одной C57BL/6J мыши (6-8 недель старый, мужчина или женщина) ~ 100 миллионов клеток (включая красные кровяные клетки, или ~ 50 миллионов ядерных клеток). 1-2 миллионов Линь– клетки могут быть изолирован?...
Обсуждение
Вайсман, стробирование стратегия для мыши миелоидного progenitor идентификации1 был золотым стандартом для иммунологов и гематологи почти 20 лет, но сейчас очевидно, что «КПВ» и «GMP» ворота являются весьма разнородными и более точные шлюзовые стратегии необходимы. Протокол, кот?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Этот протокол был разработан с использованием средств от Совета управляющих регенеративной медицины института в медицинский центр Седарс-Синай (HSG), карьеру в иммунологии стипендий от Американской ассоциации иммунологов (Ай и HSG) и ученый награду от Американского общества гематологии (для AY). Мы благодарим основной поток Cytometry в медицинский центр Седарс-Синай для помощи с СУИМ сортировки.
Материалы
| Name | Company | Catalog Number | Comments |
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
Ссылки
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены