Method Article
如何稳定蛋白质: 病毒 x 项目中热移检测和纳米差动扫描荧光测量的稳定性筛选
摘要
提出了一种通过热移分析和纳米差动扫描荧光法快速测试蛋白质在各种条件下的热稳定性的方案。缓冲系统、盐和添加剂, 包括三个独特的稳定屏幕, 与蛋白质一起进行检测, 以确定适合功能和结构研究的缓冲液。
摘要
地平线2020病毒 x 项目成立于 2015年, 旨在探索选定的极端群落生境的病毒场, 并发现新的病毒蛋白。为了评估这些蛋白质的潜在生物技术价值, 分析蛋白质结构和功能是本计划的核心挑战。蛋白质样品的稳定性对于提供有意义的检测结果和提高目标的结晶性至关重要。热移位分析 (tsa) 是一种基于荧光的技术, 是优化高通量蛋白质稳定性条件的常用方法。在 tsa 中, 使用的荧光剂是外部的、对环境敏感的染料。另一种类似的技术是纳米差动扫描荧光法 (nanoDSF), 它依赖于蛋白质的原生荧光。我们在这里提出了一个新的渗透物筛网, 一个96条件的有机添加剂屏幕, 旨在指导结晶试验通过初步的 tsa 实验。这三个屏幕与以前开发的 ph 值和盐屏一起, 全面分析了各种缓冲系统和添加剂中的蛋白质稳定性。这些屏幕的效用在对溶菌酶和病毒 x 项目的目标蛋白 x 的 tsa 和纳米 dsf 分析中得到了证明。
引言
许多生物技术上有用的酶来源于病毒来源, 如烟草蚀刻病毒 (tev) 蛋白酶1和人类鼻病毒类型 3c (hrv 3c) 蛋白酶2。地平线2020病毒-x 项目 (图 1)3。该方案的目的是: (a) 扩大已知酶家族的特性范围, (b) 描述功能未知的新型酶 (酶 x)。晶体结构的测定在目标蛋白表征中起着关键作用, 特别是在蛋白质序列进化到超出认知范围的情况下。蛋白质稳定性是结晶过程中的关键因素;样品必须在一段时间内具有均匀性和结构性, 才能形成高质量的衍射晶体。此外, 对活性检测蛋白质存在于其活性构象中至关重要, 这也可以通过良好的分子环境来促进。
尽管晶体学家可以利用的技术有了发展, 但蛋白质结晶仍然是一个耗时和劳动密集型的经验过程5。初步的生物物理实验, 以提高蛋白质的稳定性, 在溶液中提供了一个更好的起点, 蛋白质结晶和消耗通常只有相对较少的蛋白质样本6,7, 8,9。在这个项目中, 大量的目标蛋白质需要进行可扩展的、高吞吐量的稳定性检测。最流行的蛋白质预结晶生物物理表征方法之一是热转移法 (也称为 tsa 或差动扫描荧光法, dsf)10,11。
tas 采用对环境敏感的荧光染料来跟踪蛋白质样品的热变性。许多常用染料根据其环境的极性具有可变的荧光活性, 在疏水环境中往往显示出较高的荧光输出, 但在极性环境中经历快速淬火 12.蛋白质通常会导致染料荧光的显著增加, 因为它们的疏水核心在变性过程中暴露出来, 在非常高的温度下, 随着蛋白质开始聚集, 染料荧光通常会减少 (图 2)。
虽然疏水性敏感染料通常是一般用途 tsa 染料的理想选择, 但它不适合具有大的、暴露于溶剂的疏水区域的蛋白质, 这些蛋白质通常会显示高背景荧光。具有替代作用模式的荧光体存在 (见讨论), 但它可能是可取的, 通过固有的蛋白质荧光与纳米 dsf 跟踪变性。
埋在蛋白质荧光的非极性区域的色氨酸残留物, 最大排放量为330纳米。当蛋白质样品展开, 这些残留物暴露在极性溶剂中时, 它们的最大排放会发生浴缸变色转移到 350 nm 13.nanodsf 利用排放最大值的这一变化来探测蛋白质样本的展开, 而不需要外部荧光 14.
通过将数据拟合玻尔兹曼乙状结肠模型, 可以分析显示单一变性步骤的熔融曲线。展开过渡 (tm) 拐点处的温度被用作蛋白质热稳定性的定量测量和比较不同条件的有利度的基准。
同一蛋白质在不同条件下的熔融曲线有时具有一定程度的非均质性, 这可能使玻尔兹曼乙状结肠拟合不可行。要从偏离经典曲线拓扑的数据中识别 tm 值, 可以使用诸如开源 tsa 数据分析程序 nami 中使用的数值方法.替代热力学框架也可用于分析具有多个变性步骤的更复杂的曲线, 如蛋白质 plex 方法15。
稳定屏幕设计用于 tsa 和纳米 dsf 实验, 以快速确定目标蛋白的有利条件 (图 3, 屏幕成分可在补充信息中找到)。与屏幕收集的信息可用于晶体管道的许多阶段, 包括: 样品储存;净化, 通过在纯化过程中展开的蛋白质最大限度地减少产量损失;分析设计, 通过热稳定缓冲液和最终结晶来增强活性检测中的蛋白质功能, 指导合理设计的结晶试验。
为蛋白质样品选择合适的缓冲系统基础至关重要;不兼容的 ph 值可能导致蛋白质失活或变性。然而, 在大量 x 射线晶体结构中解析的共结晶缓冲分子的存在 (表 1) 也可能表明一种稳定作用, 这种效应与简单的 ph 调节是分开的, 而是源于化学物质。缓冲分子的特征。
ph 滤与其他通常与生物兼容的缓冲系统一起使用了一些 good 的缓冲液 17、18、19 , 旨在消除缓冲分子对蛋白质稳定性从实际 ph 值的结果溶液。通过为每个缓冲系统提供三个 ph 值, 并在不同系统之间加入 ph 值冗余, ph 屏幕可以识别出有利的 ph 值和目标蛋白的有利缓冲系统。
盐屏通常含有实验室盐以及链状物、螯合剂、重金属和还原剂。屏幕可以给出蛋白质样本与离子强度高的环境的亲和力的一般指示, 但每个亚群的化合物也可以提供有关蛋白质潜在结构的信息。例如, 对蛋白质有显著破坏稳定的螯合剂可能表明样品中的重要结构金属。如果样品也被屏幕内的金属阳离子强烈稳定, 这可以为进一步的结构实验提供一个有希望的起点。
奥姆菌是影响其环境渗透特性的可溶性化合物。在自然界中, 它们可以作为 "化学伴侣", 强制折叠无序蛋白质并稳定它们, 特别是在压力条件20、21、22 下.这些特性使它们在蛋白质晶体学中具有吸引力的添加剂;可作为低温保护剂在晶体采集、安装和储存过程中使用23。奥斯莫尔的潜在用途也延伸到蛋白质的纯化。在大肠杆菌中表达的重组蛋白的很大一部分可以不溶于本机状态, 并且难以在本机状态下使用标准的纯化方法进行恢复。奥姆菌可用于稳定和挽救蛋白质从不溶性分数, 增加纯化产量24.
渗透物筛网是使用蛋白质数据库条目 25和 osmo污染关联路径 (deop)26数据库中存在的既定化合物设计的, 并使用标准蛋白质进行迭代优化。该屏幕围绕八个亚类的渗透石: 甘油, 糖和多元醇, 非洗涤剂磺胺类 (ndsb), 甜菜碱及其类似物, 有机磷, 二肽, 氨基酸及其衍生物和最后的杂项组。每个渗透石都存在于多个浓度, 基于其溶解度和有效浓度范围进行比较。
研究方案
1. 蛋白质样品的制备
- 将稳定筛配作为96个井块中的 500μl aliquots, 并密封储存。使用多通道移液器将稳定屏的每个条件的10μl 传输到96孔板的相应井中, 以节省时间 (图 4a)。
- 在适当的缓冲系统中制备约1毫克 ml-1 蛋白溶液的1毫升.虽然适当的缓冲液的组成因每个蛋白质样本而异, 但尝试的好的第一个缓冲液是 10 mm 磷酸钠与 100 mm 氯化钠, ph 值7.2。
注: 可接受的蛋白质浓度因情况而异, 但 0.5-5 毫克 ml-1的浓度范围通常会产生可分析的曲线。建议将稀释缓冲液与稳定屏幕一起使用, 以避免掩盖每个条件的效果。典型的缓冲液组成约为 10 mm 缓冲液, 约为 100 mm 氯化钠。 - 如果进行 tsa 实验, 请将 sypro 橙色染料添加到蛋白质样品中, 最终浓度为20x。混合要么反转或短暂的涡流。
- 将10μl 的蛋白质溶液输送到步骤1.1 中制备的96孔板的每一口井 (图 4b)。
- 在 600 x克的情况下, 将96孔板密封和离心 2分钟, 以确保蛋白质样品和屏幕成分混合在一起 (图 4c)。
- 重新密封稳定屏幕深井块, 并将屏幕存储在4°c 下长达4个月。将盐幕存放在黑暗中, 因为某些组件是光敏的。
- 如果执行纳米 dsf 实验, 请继续执行步骤2。如果执行 tsa 实验, 请跳到步骤4。
2. 准备纳米 dsf 实验
- 确保设备清洁, 特别注意样品架附近的灰尘。如果系统有背散射镜, 请使用乙醇和无绒毛组织对其进行清洁。
- 按下 "打开抽屉"按钮打开示例抽屉。(图 5a)。
- 通过将毛细管的一端接触到溶液中, 用96孔板的每口井装入约10μl 的毛细血管, 然后将其放入样品架的相应毛细管中 (图 5b)。请注意, 不要用指纹等污染毛细血管的中间, 因为这可能会干扰整个实验过程中的荧光读数。
- 用磁性密封条固定毛细血管 (图 5c)。
3. 纳米 dsf 实验的编程
- 通过按"发现扫描"选项卡中的"开始发现扫描" 按钮, 启动初步扫描, 以检测每个毛细管的位置和强度. 将入射激发强度从最初的10% 提高或降低到每次毛细管扫描的峰值在4000-12000 单位之间 (图 5d)。
- 为确保样品折叠和充分浓缩, 建议采用具有陡峭温度梯度的初始熔体扫描。在"熔融扫描" 选项卡中, 通过将"温度坡度"选项设置为7.0°c 最小值-1、将 "开始温度" 设置为25°c 和 "结束温度" 设置为95°c 来对熔融扫描进行编程, 然后通过按下启动融化按钮。如果生成的熔体曲线没有显示可检测的拐点, 请考虑进一步浓缩样品或检查蛋白质是否正确折叠。
- 重复步骤 2.1-2.4, 为完整的实验准备样品。
- 在"熔融扫描" 选项卡中, 通过将"温度坡度"选项设置为1.0°c 分钟-1、启动温度设置为25°c 和 "结束温度" 设置为95°c 来对熔融扫描进行编程, 然后通过按下"开始融化"按钮。
4. 执行 tsa 实验
- 通过牢固地按下抽屉右侧的缩进来打开样品抽屉。将96孔托盘放置在带有 a1 井的 rt-pcr 系统中 (图 4d)。
- 单击 "新建实验" 按钮开始设置 tsa 实验。
- 在 "实验属性"选项卡中, 当询问要设置哪种类型的实验时, 单击 "熔融曲线"选项, 当询问您要使用哪种试剂来检测目标序列时,单击 "其他" 选项?
- 在"板块设置/定义目标和示例" 选项卡中, 输入目标名称, 然后将"报告者" 设置为rox , 将 " quencher " 设置为"无"。
- 在"板板板"/"分配目标和样本" 选项卡中, 将96孔板中的每口井分配给在上一步中输入的目标名称。在同一选项卡中, 将"选择要用作被动引用的染料" 设置为 " 无"。
- 在 "运行方法" 选项卡中, 删除步骤, 直到总共有三个步骤。将第一步设置为 25.0, 坡道率 100%, 时间 00:05;第二步至 950°c, 坡道率 1%, 时间 01:00;第三步到 950°c, 坡道率 100%, 时间 00:05。选择使用"收集数据" 下拉菜单或按 "数据收集" 图标收集数据 (图 6)。
- 将每口井的反应量设置为20μl。
- 按"开始运行"按钮开始 tsa 实验。
5. 数据分析
- 选择一个波长来绘制熔体曲线。在纳米 dsf 实验中, 通常使用的荧光强度为330纳米和350纳米 (分别相当于非极性和极性环境中的色氨酸) 13.对于大多数 tsa, 染料最大排放值适用于熔体曲线绘制 (sypro 橙色的最大排放最大值为 569 nm)12。
- 通过确定每个熔体曲线的拐点来计算每个条件的 tm 值。大多数纳米 dsf 系统在数据采集后通过熔体曲线的数值微分自动计算 tm 值。如果所使用的软件不自动计算 tm值, 免费的、替代 gui 驱动的软件 (如 nami11)可以自动进行数据分析和下游处理, 从而提供生成总结 tm 的热图的选项值 (随附的参考为使用 nami 进行数据处理提供了指导和资源)。
- 比较所测量的所有条件的 tm 值。稳定屏幕在每个屏幕 (a1 和 a2) 中包含两口井, 其中仅包含水。以水专用值作为基准, 可以计算t m 值, 解决系统错误, 并可以轻松比较稳定效果。较高的 tm值表示建议下游使用的热稳定条件。有希望的条件往往表现出浓度依赖性在他们的稳定。
结果
用稳定性筛网检测溶菌酶, 用 osmolyte 筛网检测病毒 x 项目中的目标蛋白蛋白 x。在 tsa 和 nanodsf 实验中, 这两种蛋白质通常都会产生具有明确定义的变性转换的熔体曲线 (代表性曲线见随附图)。在少数情况下, 如果未生成具有定义变性转换的可解释曲线的样本被解释为变性, 而不包括在 tm 比较中。
图 7显示了盐屏的样品结果, 说明了氯化铵对溶菌酶的热稳定特性。如上面所示的浓度依赖关系通常表明有希望的条件, 但将离子浓度增加的结果与几种不同的盐进行比较, 看看热稳定是否一般来自增加缓冲离子强度, 或者如果特定离子的存在赋予额外的稳定性。
溶菌酶的 tm 值与 ph 滤值的比较 (图 8) 揭示了两条信息。首先, 随着 ph 值的降低, 稳定性普遍呈增加趋势。其次, 使用 ph 值相同的不同缓冲系统获得的 tm 值范围可能很大。
图8中的数据表明, tsa 和 nanodsdf 在本实验中的协议总体上是好的, 但 nanodsdf 显示出一种倾向, 即识别稍高的 t m 值和稍大的 t m 移动比 tsa。然而, 一些 ph 值超过8.5 的油井在从 tsa 和 nanodsf 获得的 tm 值之间存在很大差异。差异可能归因于蛋白质在不同 ph 值下的变性机制;例如, 如果蛋白质的疏水区域暴露于溶剂的速度明显快于环境中色氨酸残留物在极性上的变化, 则对疏水性敏感染料可能会产生相对较低的 tm 读数。
图 9显示了使用溶菌酶使用渗透石屏幕获得的 tm 值的热图。与控制井 (含有去离子水的井 a1 井和 a2 井) 相比, tm 增加最多的条件是深蓝色的。图 9中确定的特别稳定的条件包括甘油、1 m d-山梨醇、100 mm 低根和 10 mm ala-gly (分别为 a4-a6、a9、e7 和 f8 井)。
图 10显示了用蛋白质 x. tsa 和 osmolte 屏幕进行的纳米 dsf 实验获得的 tm 值的热图显示, 所测试的大多数渗透体要么在 tm ( 1°c 内) 略有增加, 要么产生不利影响对蛋白质 x 的稳定性。特别是, 浓度为 10 mm (d1 井) 的二皮酸似乎会使样品在室温下变平。tsa 和纳米 dsf 的结果很快就将二甲苷酸确定为蛋白质 x 的不兼容添加剂, 在使用蛋白质时应避免这种添加剂。然而, 高浓度的 d-山梨醇和阿拉伯糖 (a9 和 b9 井, 均为 1 m) 以及甘油和 tmao (分别为 a4-a6 井和 e1 井) 被确定为热稳定。
对于溶菌酶, 对每个稳定筛中产生最高 tm值的条件组合进行了测试, 以寻找协同联合效应。图 11显示, 随着缓冲系统的更多成分 (ph 值、盐和渗透物) 的添加,t m 值普遍增加。在 mes、硫酸铵和 d-山梨醇的情况下, 与 mes 相比, 当所有成分都存在时, 可以观察到 t m增加到10°c。图 11显示, 当缓冲区的各个组件进行优化并与稳定性屏幕结合使用时, 可能会产生明显的协同效果。
更一般地说,图 11还说明了在 tsa 和纳米 dsdf 实验中可以观察到的 tm 值的大小。根据蛋白质系统的不同, 可以实现的 tm 的大小有很大的不同, 但5°c 前后的任何 t m 值往往都表明具有有益的稳定效应。

图 1: 生物勘探.从病毒-x 项目中的极端环境中收集的示例。请点击这里查看此图的较大版本.
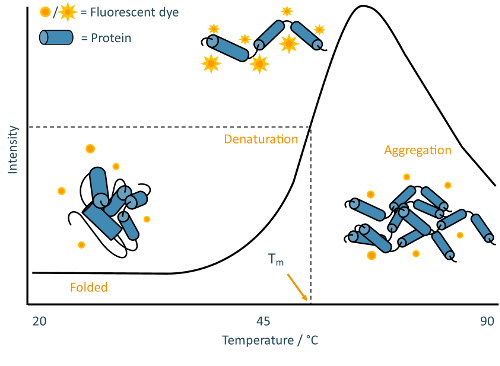
图 2: tsa 原理图.从 tsa 实验中获得的典型熔体曲线的注释示例。这条曲线是经典的 "双态" 蛋白展开的特征, 样本群体从折叠过渡到变性, 而没有可检测到的部分折叠中间体。请点击这里查看此图的较大版本.
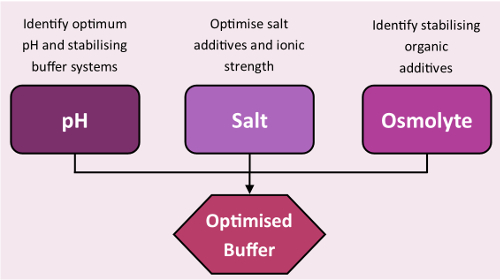
图 3: 稳定屏幕工作流.使用稳定屏幕优化缓冲区的标准工作流程。请点击这里查看此图的较大版本.

图 4: 具有稳定性屏幕的标准 tsa 实验的工作流程.从左到右: (a) 将稳定屏幕的移液物进入96孔板。(b) 将荧光染料的蛋白质样品放入板中。(c) 离心前密封板材。(d) 将板材放入 rt-pcr 系统。请点击这里查看此图的较大版本.

图 5:标准纳米 dsf 实验的工作流.(a) 打开毛细管装载架。(b) 将毛细血管装进机架。(c) 将毛细血管与磁密封条固定在一起。(d) 编程实验。请点击这里查看此图的较大版本.
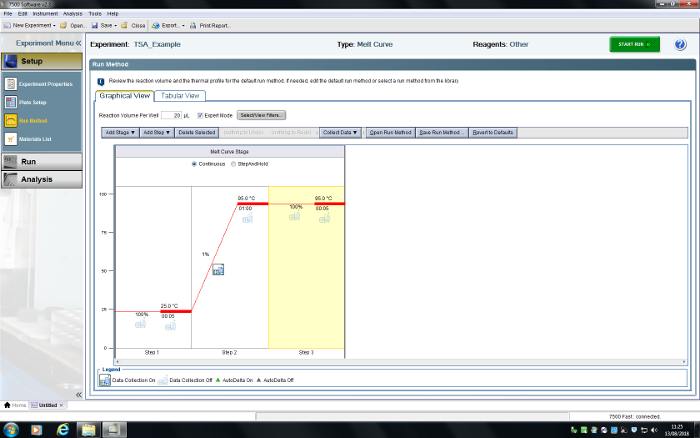
图 6: rt-pcr 系统的用户界面.一个 tsa 实验已经被编程。请点击这里查看此图的较大版本.
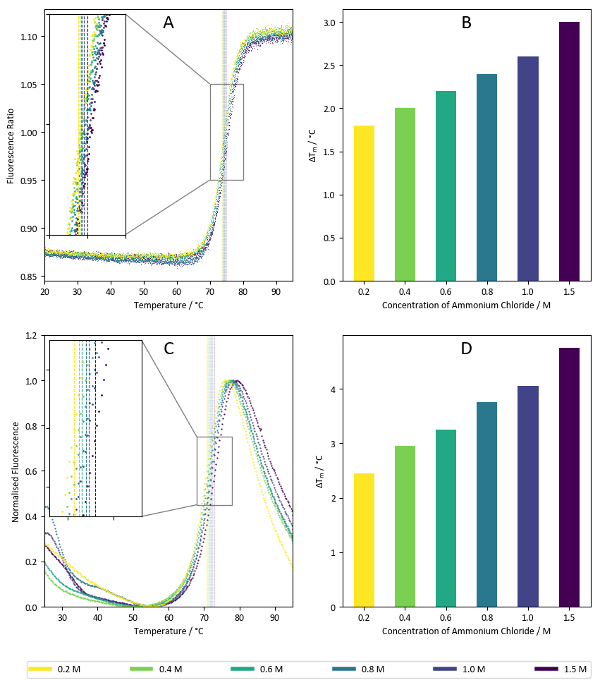
图 7: 盐屏样本数据.(a) 使用溶菌酶进行无标签纳米 dsf 实验时, 荧光强度为350纳米与330纳米的比率。样品对应于盐筛 c7-c12 的井 (1.5 m-0.2 m 氯化铵)。每个条件的计算 tm值都叠加在绘图上。(b) 根据图 7a 所示数据计算的 tm 值摘要。(c) tsa 实验的荧光强度为590纳米, 使用溶菌酶和疏水性记者染料。如图 7a 所示, 样品对应于盐屏的 c7-c12 井。计算的 tm值叠加在图形上。(d) 根据图 7c 中的数据计算的 tm 值摘要。请点击这里查看此图的较大版本.
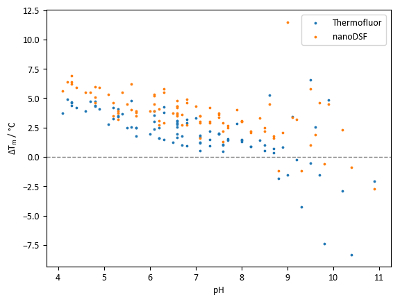
图 8: ph 屏样品数据.溶菌酶和 ph 滤得到的 tm 转移的总结。每个点表示一个独立的条件; 每个点表示一个独立的条件。相同 ph 值下的点是相同 ph 值下的不同缓冲系统。tm 位移是相对于控制 t m 68.0 的 tsa实验和71.9°c 纳米 dsf 实验计算。请点击这里查看此图的较大版本.
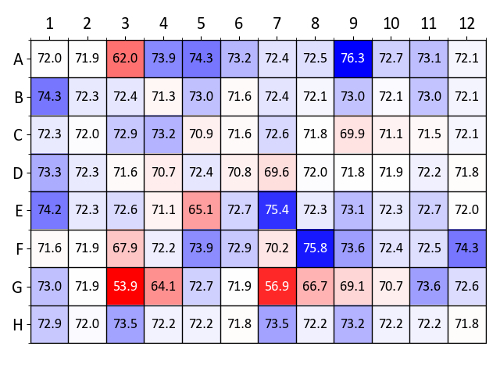
图 9: 奥斯莫利特筛查样本数据 (溶菌酶).用溶菌酶和渗透筛的每口井进行的无标签纳米 dsf 实验中获得的 tm 值摘要。tm 值(°c) 与包含水作为控制的 a1 井和 a2 井进行了比较。根据比较的t m 值生成了热图 (蓝色表示 tm 增加, 红色表示 t m减少)。请点击这里查看此图的较大版本.
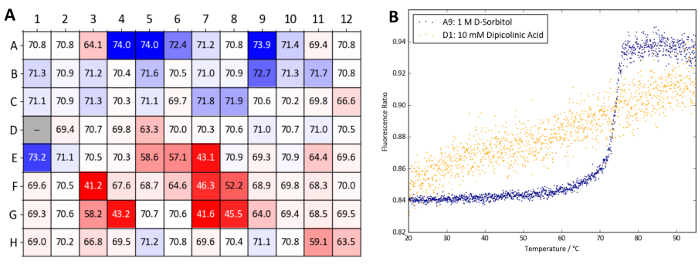
图 10:osmolyte 屏幕样本数据 (蛋白质 x).(a) 从蛋白质 x 和渗透物筛网的无标签纳米 dsf 实验中获得的 tm 值摘要。tm 值与包含水作为控制的井 a1 和 a2 进行了比较。根据比较的t m 值生成了热图 (蓝色表示 tm 增加, 红色表示 t m减少)。(b) 从 a9 井 (1 m d-山梨醇, 稳定条件) 和 d1 井 (10 mm 二吡咯烷磺酸, 破坏稳定条件) 获得的纳米 dsdf 曲线。请点击这里查看此图的较大版本.
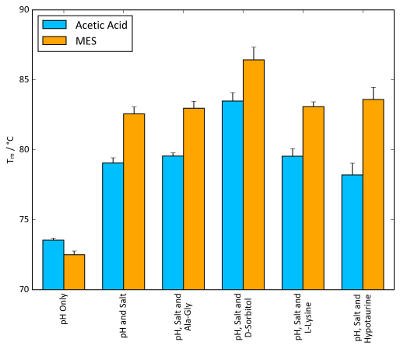
图 11: 缓冲区优化对 tm 的影响.溶菌酶的 tsat m 值与每个屏幕的条件相结合, 使 tm 的增加最大。选择 100 mm 醋酸、ph 4.2 和 100 mm mes、ph 5.6 作为缓冲系统, 同时选择 1.5 m 硫酸铵作为盐。奥司体的浓度与渗透石筛网中的浓度相同:10 mm ala-gly、1 m d-山梨醇、50 mm l-赖氨酸和 100 mm 的低血糖素。误差线表示六个副本的标准偏差。请点击这里查看此图的较大版本.
| 分子 | pdb 代码 | 共结晶的频率 |
| 磷 | po4 | 5132 |
| 醋酸 | 行为 | 4521 |
| 2-(n-吗啡)-乙醇磺酸 (mes) | Mes | 1334年 |
| 三 (羟基甲基) 氨基甲烷 (三丁基) | Trs | 1155 |
| 甲酸 | Fmt | 1072 |
表 1: 蛋白质数据库 (pdb) 条目中缓冲分子共结晶频率摘要.通过 pdbsum16获得的数据来自总共 44, 868 项 (截至 12-5-18 项)。
补充资料. 请点击此处下载此文件。
补充表 1. 请点击此处下载此文件。
补充表 2. 请点击此处下载此文件。
补充表 3. 请点击此处下载此文件。
讨论
协议中的关键方面包括为 tsa 实验而对96孔板进行离心步骤和适当密封 (步骤 1.5)。离心可确保蛋白质样品和筛分条件接触和混合。此外, 如果未密封的板材用于 tsa 实验, 则在整个实验过程中, 溶剂蒸发的风险很大, 从而导致样品浓度增加, 并增加过早聚集蛋白质的可能性。
tsa 和纳米 dsf 适用于广泛的蛋白质样品;绝大多数样品可以用基于疏水的记者染料或通过无染料纳米 dsf 产生可解释的熔体曲线。如果标准荧光源不适合您的蛋白质, 则可以探索的协议最简单的修改是荧光粉的选择。几种替代染料可适用于 tsa 实验。这方面的例子包括 n-[4-(7-二乙基氨基-4-甲基-3-香豆素) 苯 (cpm), 一种与硫醇27反应后荧光的化合物, 以及 4-(二亚诺烷基) 氯洛胺 (dcvj), 一种根据其环境的刚性, 增加其荧光作为一个蛋白质样品展开28,29 (后一种染料往往需要高浓度的样品)。
如果仪器软件不能自动计算 tm,则可采用其他熔融曲线分析方法。如果数据是同质的, 并且在熔体曲线中只有一个变性步骤是可见的, 则可以在具有以下公式的 boltzmann sigmoid 上安装一个截断的数据集:
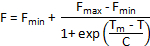
其中 f 是 t 温度下的荧光强度, f最小值和 f最大值分别是变性过渡前后的荧光强度, tm 是变性转变和 c 的中点温度是 tm 处的斜率。虽然此方法适用于简单的两步变性过程, 但不适用于具有多个过渡的复杂熔体曲线。
tsa 的主要优点之一是它的可访问性;tsa 实验可以在任何 rt-pcr 系统中进行, 该系统的光谱具有合适的波长, 用于所使用的荧光染料。再加上耗材成本低、操作方便、所需蛋白质含量相对较低, tsa 成为工业和学术界广泛项目规模的宝贵技术。
除了表明良好的缓冲条件外, 屏幕还包含一些井, 这些井可能会为样品蛋白中存在结构金属提供线索。在盐屏中可能特别感兴趣的井是 g6 和 g7, 分别含有 5 mm edta 和 5 mm egta。这些井的热不稳定严重可能表明蛋白质中存在着被螯合剂隔离的重要金属离子。渗透石筛网内的化合物也有可能为蛋白质的功能提供线索。屏幕上的许多化合物属于一类分子, 是酶的常见底物。例如, 糖类 (在井 a11-b10 中) 为溶菌酶提供的一般稳定性可归因于它们的结构与已确定的酶----n-乙酰氨基低聚物 30----底物相似。
上述 tsa 和 nanodsf 协议也可用于研究蛋白质配体相互作用。专门与蛋白质结合的配体可以通过在复合体中引入新的相互作用来提高蛋白质的热稳定性。蛋白质 tm 的剂量依赖性正转变是蛋白质配体相互作用成功的一个有希望的迹象。用 tsa 筛选复合库的速度、吞吐量和低成本使其成为早期药物发现中非常流行的方法。
优化目标蛋白及其配体复合物的缓冲条件对于项目的成功至关重要, 许多文献示例都证明了31、32、33、34。在需要2小时以下的典型测试中, tsa 和 nanodsf 与稳定屏幕相结合, 是一种快速、廉价的缓冲优化技术。
披露声明
作者没有什么可透露的。
致谢
该项目在欧洲联盟 "地平线 2020" 研究和创新方案下获得了欧洲研究理事会 (erc) 的资助 (授予协议) (685778 号赠款协议)。这项工作得到了生物技术和生物科学研究理事会 (bbsrc, 赠款编号 bbp/m011186)、bb/j01412过来) 的支持。db 感谢 bbsrc 博士培训合作伙伴: 纽卡斯尔-利物浦-达勒姆, 感谢他们的学生和杜伦大学生物科学系为这项工作提供的资金。我们感谢伊恩·爱德华兹的帮助, 感谢杜伦大学化学质谱系对蛋白质 x 的仪器分析。我们感谢 arnthor etervarsson 在 viuls-x 项目方面所做的工作, 并感谢 claire hatty 和 nanotemper gmbh 为该项目提供的贷款和协助。最后, 感谢弗朗西丝·加斯罗普和托策种子公司的支持, 作为 bbsrc iccase 奖的一部分。
材料
| Name | Company | Catalog Number | Comments |
| Lysozyme | Melford Laboratories | L38100 | Crystallised and lyophilised chicken egg white lysozyme. |
| The Durham pH Screen | Molecular Dimensions | MD1-101 | 96-well protein stability screen. See above for contents. |
| The Durham Salt Screen | Molecular Dimensions | MD1-102 | 96-well protein stability screen. See above for contents. |
| The Durham Osmolyte Screen | Various | #N/A | 96-well protein stability screen, not commercially available at the time of publication. See above for contents. |
| SYPRO Orange | Invitrogen | S6651 | Widely used fluorescent dye for protein staining in gels and DSF. |
| 96-well PCR Plate | Starlab | 1403-7700 | Semi-skirted clear plastic for use with AB 7500 Fast RT-PCR System. |
| 7500 Fast Real-time PCR System | Applied Biosystems | 4362143 | 96-well format RT-PCR system. Alternative systems can be used. Analysis of data performed using free, open-access software NAMI. AB software tailored to DSF experiments using the 7500 Fast available at additional cost. |
| Prometheus NT.48 | NanoTemper Technologies | #N/A | Label-free DSF system with up to 48-sample capacity. Can calculate unfolding temperatures (Tm and Tonset), critical denaturant concentrations (Cm), free folding energy (ΔG and ΔΔG), and aggregation results (Tagg) using built-in software. |
| Prometheus NT.48 Series nanoDSF Grade Standard Capillaries | NanoTemper Technologies | PR-C002 | Prometheus NT.48 Series nanoDSF Grade Standard Capillaries. "High sensitivity" variants are available at a higher cost for use with low-concentration samples (<200 µg ml-1). |
参考文献
- Kapust, R. B., Waugh, D. S. Controlled intracellular processing of fusion proteins by TEV protease. Protein Expression and Purification. 19 (2), 312-318 (2000).
- Cordingley, M. G., Register, R. B., Callahan, P. L., Garsky, V. M., Colonno, R. J. Cleavage of small peptides in vitro by human rhinovirus 14 3C protease expressed in Escherichia coli. Journal of Virology. 63 (12), 5037-5045 (1989).
- Hjorleifsdottir, S., Aevarsson, A., Hreggvidsson, G. O., Fridjonsson, O. H., Kristjansson, J. K. Isolation, growth and genome of the Rhodothermus RM378 thermophilic bacteriophage. Extremophiles. 18 (2), 261-270 (2014).
- Alva, V., Nam, S. Z., Söding, J., Lupas, A. N. The MPI bioinformatics Toolkit as an integrative platform for advanced protein sequence and structure analysis. Nucleic Acids Research. 44, 410-415 (2016).
- McPherson, A. Protein Crystallization. Methods in molecular biology. 1607, 17-50 (2017).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Analytical Biochemistry. 357 (2), 289-298 (2006).
- Reinhard, L., Mayerhofer, H., Geerlof, A., Mueller-Dieckmann, J., Weiss, M. S. IUCr Optimization of protein buffer cocktails using Thermofluor. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 69 (2), 209-214 (2013).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Kozak, S., Lercher, L., Karanth, M. N., Meijers, R., Carlomagno, T., Boivin, S. Optimization of protein samples for NMR using thermal shift assays. Journal of Biomolecular NMR. 64 (4), 281-289 (2016).
- Semisotnov, G. V., Rodionova, N. A., Razgulyaev, O. I., Uversky, V. N., Gripas', A. F., Gilmanshin, R. I. Study of the "molten globule" intermediate state in protein folding by a hydrophobic fluorescent probe. Biopolymers. 31 (1), 119-128 (1991).
- Grøftehauge, M. K., Hajizadeh, N. R., Swann, M. J., Pohl, E. Protein-ligand interactions investigated by thermal shift assays (TSA) and dual polarization interferometry (DPI). Acta Crystallographica Section D: Biological Crystallography. 71, 36-44 (2015).
- Steinberg, T. H., Jones, L. J., Haugland, R. P., Singer, V. L. SYPRO Orange and SYPRO Red Protein Gel Stains: One-Step Fluorescent Staining of Denaturing Gels for Detection of Nanogram Levels of Protein. Analytical biochemistry. 239, 223-237 (1996).
- Burstein, E. A., Vedenkina, N. S., Ivkova, M. N. Fluorescence and the location of tryptophan residues in protein molecules. Photochemistry and Photobiology. 18 (4), 263-279 (1973).
- Haffke, M., Rummel, G., Boivineau, J., Münch, A., Jaakola, V. -. P. nanoDSF: label-free thermal unfolding assay of G-protein-coupled receptors for compound screening and buffer composition optimization. Application Note NT-PR-008. , (2016).
- Chari, A., et al. ProteoPlex: stability optimization of macromolecular complexes by sparsematrix screening of chemical space. Nature Methods. 12 (9), 859-865 (2015).
- Laskowski, R. A. PDBsum: summaries and analyses of PDB structures. Nucleic Acids Research. 29 (1), 221-222 (2001).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical biochemistry. 104 (2), 300-310 (1980).
- Welch, W. J., Brown, C. R. Influence of molecular and chemical chaperones on protein folding. Cell stress & chaperones. 1 (2), 109-115 (1996).
- Diamant, S., Eliahu, N., Rosenthal, D., Goloubinoff, P. Chemical chaperones regulate molecular chaperones in vitro and in cells under combined salt and heat stresses. The Journal of biological chemistry. 276 (43), 39586-39591 (2001).
- Yancey, P. H. Organic osmolytes as compatible, metabolic and counteracting cytoprotectants in high osmolarity and other stresses. Journal of Experimental Biology. 208 (15), 2819-2830 (2005).
- Garman, E. F., Owen, R. L. Cryocooling and radiation damage in macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 62 (1), 32-47 (2006).
- de Marco, A., Vigh, L., Diamant, S., Goloubinoff, P. Native folding of aggregation-prone recombinant proteins in Escherichia coli by osmolytes, plasmid- or benzyl alcohol- overexpressed molecular chaperones. Cell Stress & Chaperones. 10 (4), 329 (2005).
- Berman, H. M., et al. The protein data bank. Nucleic acids research. 28 (1), 235-242 (2000).
- Bougouffa, S., Radovanovic, A., Essack, M., Bajic, V. B. DEOP: A database on osmoprotectants and associated pathways. Database. 2014, 1-13 (2014).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Kung, C. E., Reed, J. K. Fluorescent molecular rotors: a new class of probes for tubulin structure and assembly. Biochemistry. 28 (16), 6678 (1989).
- Iio, T., Itakura, M., Takahashi, S., Sawada, S. 9-(Dicyanovinyl)julolidine binding to bovine brain calmodulin. Journal of biochemistry. 109 (4), 499-502 (1991).
- Veros, C. T., Oldham, N. J. Quantitative determination of lysozyme-ligand binding in the solution and gas phases by electrospray ionisation mass spectrometry. Rapid Communications in Mass Spectrometry. 21 (21), 3505-3510 (2007).
- Kean, J., Cleverley, R. M., O'Ryan, L., Ford, R. C., Prince, S. M., Derrick, J. P. Characterization of a CorA Mg2+ transport channel from Methanococcus jannaschii using a Thermofluor-based stability assay. Molecular membrane biology. 25 (8), 653-661 (2008).
- Geders, T. W., Gustafson, K., Finzel, B. C. Use of differential scanning fluorimetry to optimize the purification and crystallization of PLP-dependent enzymes. Acta Crystallographica Section F. 68 (5), 596-600 (2012).
- Morgan, H. P., Zhong, W., McNae, I. W., Michels, P. A., Fothergill-Gilmore, L. A., Walkinshaw, M. D. Structures of pyruvate kinases display evolutionarily divergent allosteric strategies. Royal Society open science. 1 (140120), (2014).
- Moretti, A., Li, J., Donini, S., Sobol, R. W., Rizzi, M., Garavaglia, S. Crystal structure of human aldehyde dehydrogenase 1A3 complexed with NAD+ and retinoic acid. Scientific reports. 6 (35710), (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。