Method Article
Protein dengelemek nasıl: istikrar ekranlar için termal kayması deneyleri ve Nano diferansiyel Fluorimetry virüs-X projede tarama
Bu Makalede
Özet
Bir iletişim kuralı hızla termal kayması deneyleri ve nano fluorimetry tarama fark koşulları çeşitli proteinler termal kararlılığını sınamak için sunulmaktadır. Tampon sistemleri, tuzları ve katkı maddeleri, birlikte üç benzersiz istikrar ekran, oluşan uygun işlevsel ve yapısal çalışmalar arabelleklerini tanımlamak için protein ile denetlesinler.
Özet
Horizon2020 virüs-X Projesi seçilen aşırı Habitat virosphere keşfetmek ve yeni viral proteinler keşfetmek için 2015 yılında kurulmuştur. Bu proteinler, protein analizi potansiyel biyoteknik değerini değerlendirmek için yapıları ve işlevleri olan bu programda merkezi bir meydan okuma. Protein örnek kararlılığını hedeflerinden crystallizability artırmak ve anlamlı tahlil sonuçları sağlamak için önemlidir. Termal üst karakter tahlil (TSA), bir floresan tabanlı teknik koşullar protein istikrar içinde yüksek üretilen iş için en iyi duruma getirme için popüler bir yöntem olarak kurulur. TSAs, meslek fluorophores dışsal, çevreye duyarlı boyalar vardır. Alternatif, nano protein yerli floresans dayanır fluorimetry (nanoDSF), tarama fark benzer tekniğidir. Burada bir roman osmolyte ekran, organik katkı kristalizasyon denemeler ön TSA deneyler yoluyla rehberlik için tasarlanmış bir 96-koşul ekran mevcut. Daha önce geliştirilen pH ve tuz ekranlar ile birlikte üç ekran dizi protein istikrar tampon sistemleri ve katkı maddeleri geniş bir alanda kapsamlı bir çözümleme sağlar. Belgili tanımlık yarar ekranlar lizozim ve Protein X, virüs-X projenin hedef protein TSA ve nanoDSF analizinde gösterilmiştir.
Giriş
Birçok biotechnologically yararlı enzimler viral kaynaklardan gibi tütün etch virüs (TEV) proteaz1 ve insan rhinovirus 3 C (HRV 3 C) proteaz2yazın kaynağı. Horizon2020 virüs-X (Şekil 1) projesi3. Bu program (a) bilinen enzim aileler özelliklerini aralığı genişletmek için ve (b) henüz bilinmeyen işlev (enzim X) roman enzimler karakterize etmek için amaçtır. Crystallographic yapı belirlenmesi hedef protein karakterizasyonu, çok önemli bir rol özellikle protein sequences tanıma4nerede geliştiğini bu durumlarda çalış. Protein istikrar kristalizasyon sürecinde önemli bir faktördür; örnekleri formu yüksek-nitelik, kristaller diffracting için bir süre doğurmak homojen ve yapısal olarak sağlam olması gerekir. Ayrıca, bu da olumlu bir moleküler ortamı tarafından kolaylaştırılabilir aktif onların biçimsel proteinler mevcut aktivitesi deneyleri için esastır.
Crystallographers için mevcut teknoloji geliştirmede rağmen protein kristalizasyon zaman alıcı ve emek yoğun ampirik işlemi5kalır. Ön biyofiziksel deneyler protein istikrar çözüm geliştirmek için açıkça daha iyi başlangıç noktası protein kristalizasyon için vermek ve genellikle nispeten az miktarda protein örnek6,7tüketmek, 8,9. Bu projede belirlenmesi için hedef proteinler çok sayıda da ölçeklenebilir, yüksek üretilen iş istikrar deneyleri gerektirir. Proteinler öncesi kristalizasyon biyofiziksel karakterizasyonu için en popüler yöntemlerden biri termal üst karakter tahlil (TSA veya diferansiyel fluorimetry, DSF tarama olarak da bilinir)10,11.
TSAs protein örneklerinin termal denatürasyon izlemek için bir çevreye duyarlı floresan boya istihdam. Birçok yaygın olarak kullanılan boyalar değişken floresans etkinliğe bağlı olarak sık sık hidrofobik ortamlarda yüksek floresans çıktısını görüntüleme ama hızlı kutup ortamları12' Şoklama geçiren çevrenin polarite sahip. Hidrofobik onların göbek denatürasyon, proteinler (Şekil 2) toplamak için Başlarken genellikle boya floresans çok yüksek sıcaklıklarda düşüş takip sırasında maruz olur gibi proteinler belirgin artışlar boya floresans genellikle neden.
Bir hydrophobicity duyarlı boya kez bir genel kullanımlı TSA boya için iyi bir seçim olsa da, proteinler ile çoğunlukla yapmayacaktır yüksek arka plan floresans görüntüler büyük, solvent maruz hidrofobik bölgeler için uygun olabilir. Eylem alternatif modları ile fluorophores (konuya bakın) vardır, ancak bunun yerine denatürasyon içsel protein floresan nanoDSF ile üzerinden izlemek için arzu olabilir.
Bir protein, nonpolar bölgelerinde gömülü olan triptofan artıkları belli bir emisyon en fazla 330 ile nm. Protein örnek yaşanıyor ve bu polar bir çözücü maruz olur gibi kendi emisyon en fazla 350 nm13bathochromic shift uğrar. nanoDSF emisyon bir protein örnek dışsal fluorophores14gerek kalmadan unfolding soruşturma için en fazla bu vardiyada patlatır.
Gösteren tek denatürasyon adımları-ebilmek var olmak çözümlemek veri Boltzmann sigmoidal modeline yaklaştırarak eğrileri eritebilir. Açılım geçiş (Tm) dönüm noktası sıcaklığında niceliksel ölçüsüdür protein termal kararlılık ve bir kriter farklı koşullar favorability karşılaştırmak için kullanılınır.
Erime eğrileri farklı koşullarda aynı proteinin bazen sigmoidal uygun bir Boltzmann olanaksız yapabilirsiniz heterojenite derecesine sahip. Klasik eğrisi çoğaltmasından sapma veri Tm değerleri ayırt etmek, sayısal yöntemler namı, bir açık kaynak TSA veri analiz programı11çalışan gibi kullanılabilir. Alternatif termodinamik çerçeveler de ProteoPlex metodoloji15gibi birden çok denatürasyon adımlarla daha karmaşık eğriler analiz etmek için kullanılabilir.
İstikrar ekranlar TSA ve nanoDSF deneylerde kullanmak için hızla bir hedef protein için uygun koşulları tanımlamak için tasarlanmıştır (Şekil 3, ekran besteleri vardır ek bilgi kullanılabilir). Ekranları ile toplanan bilgi-ebilmek var olmak kullanılmış crystallographic boru hattı da dahil olmak üzere birçok aşamalarında: örnek depolama; Arıtma, arıtma işlemi sırasında unfolding protein ile verim kaybını en aza; Tasarım, termal arabellekleri ve nihayet mantıklı bir şekilde tasarlanmış kristalizasyon denemeler rehberlik kristalizasyon, sabitleme ile faaliyet deneyleri işlevindeki protein takviye tahlil.
Protein örnek için uygun arabellek sistem temel seçimi çok önemlidir; uyumsuz pH değerlerini devre dışı bırakma veya bir proteini denatürasyon yol açabilir. Ancak, çok sayıda X-ray kristal yapıları (Tablo 1) çözüldü Co kristalize arabellek molekülleri varlığını da göstergesi teskin etkisinin, basit pH yönetmeliğine ayrıdır ve bunun yerine kimyasal kaynaklanıyor olabilir şekil-in tampon molekül.
Birkaç iyi'nın arabellekleri17,18,19 yanında diğer yaygın olarak biyolojik olarak uyumlu arabellek sistemleri kullanarak formüle, pH ekran üzerinde bir arabellek molekülünün kimyasal etkisi deconvolute için tasarlanmıştır protein istikrar üzerinden elde edilen çözüm gerçek pH. Her tampon sistemi için üç pH değerleri sağlama ve pH değeri artıklık farklı sistemler arasında birleştiren, pH ekran olumlu tampon sistemleri için bir hedef protein ve uygun pH değerleri tanımlayabilirsiniz.
Tuz ekran sık laboratuvar tuzları yanı sıra chaotropes, chelants, ağır metaller ve azalan bakiyeli aracıları içerir. Ekranda yüksek iyonik güçlü ile ortamlara benzeşme protein örneği genel bir göstergesi verebilir ama her alt grup bileşikler de potansiyel bir protein yapısını temel bilgiler sağlayabilir. Örneğin, önemli ölçüde bir protein istikrarsızlaştırma bir chelant örnek içinde önemli yapısal metallerin göstergesi olabilir. Örnek da güçlü bir metal ba * ekran içinde tarafından stabilize, bu daha fazla yapısal deneyler için umut verici bir başlangıç noktası sağlar.
Osmolytes çevreleri ozmotik özelliklerini etkileyen çözünür bileşiklerdir. Doğa, onlar "kimyasal chaperones düzensiz protein katlama ve onları, özellikle stres koşulları20,21,22sabitleme uygulayan", olarak kullanılabilir. Bu özellikleri onları protein kristalografisi çekici katkı yapmak; Kristal hasat sırasında cryoprotectants olarak kullanılabilir, montaj ve depolama işler23. Osmolytes potansiyel kullanım de proteinlerin saflaştırılması uzatır. Rekombinant proteinlerin E. coli içinde önemli bir bölümünü çözünmez ve standart arıtma yöntemleri kullanarak yerel durumunu kurtarmak zor olabilir. Osmolytes stabilize ve proteinler çözünmez kesirler gelen kurtarma için kullanılabilir, artan arıtma24verimleri.
Osmolyte ekran kurulan bileşikler Protein veri Bankası girişleri25 ve Dragon Explorer of Osmoprotection-Associated yolları (DEOP)26 veritabanı mevcut kullanılarak tasarlanmış ve yinelemeli olarak standart proteinler kullanarak optimize edilmiştir. Ekran osmolyte sekiz alt sınıflarını inşa edilmiştir: gliserol, şeker ve polyols, deterjan sulfobetaines (NDSBs), betaines ve kendi analogları Organofosfatlar, dipeptides, amino asit ve türevleri ve son çeşitli grup. Her osmolyte çözünürlük ve etkili konsantrasyon aralıkları ürününü karşılaştırma listesine göre birden fazla konsantrasyonlarda bulunur.
Protokol
1. Protein örnek hazırlanması
- 96-şey bloklar halinde 500 µL aliquots olarak istikrar ekranlar formüle ve depolama için mühür. Her durumun bir istikrar ekranın 10 µL zaman (Şekil 4A) kazanmak için bir çok kanallı pipet kullanarak iyi bir 96-şey tabak karşılık gelen içine aktarın.
- 1 mL yaklaşık 1 mg mL-1 protein çözeltisi bir uygun tampon sistemi hazırlamak. Her protein örneği ile uygun bir arabellek bileşimi değişir, denemek için iyi bir ilk arabellek 10 mM sodyum fosfat ile 100 mM NaCl, pH 7.2 iken.
Not: Kabul edilebilir protein konsantrasyonları duruma göre değişir, ancak 0,5 - 5 mg mL-1 konsantrasyon aralığı genellikle analyzable eğrileri üretmek. Seyreltik arabellekleri istikrar ekranları kullanılmak üzere her koşul etkileri maskeleme önlemek için tavsiye edilir. Tipik arabellek besteleri yaklaşık 100 mM NaCl ile yaklaşık 10 mM tampon vardır. - TSA deneme gerçekleştirme, SYPRO Orange boya 20 x son bir konsantrasyon protein örneğine ekleyin. İnversiyon veya kısa vortexing karıştırın.
- Adım 1.1 (Şekil 4B) hazırlanan 96-şey plaka her kuyuya protein çözüm 10 µL aktarın.
- Mühür ve 96-şey plaka için protein örnek ve ekran bileşeni (Şekil 4C) karıştırılır emin olmak için 600 x g , 2 dk santrifüj kapasitesi.
- İstikrar ekran derin kuyu blok yeniden mühürle ve 4 aya kadar ekran 4 ° C'de depolayın. Bazı bileşenler ışığa duyarlı tuz ekranın karanlıkta, depolamalısınız.
- NanoDSF deneme gerçekleştirme, adım 2 devam. TSA deneme gerçekleştirme, adım 4'e geçin.
2. bir nanoDSF deneme hazırlanması
- Ekipman herhangi bir toz örnek raf yakınındaki özel önem temiz olduğundan emin olun. Sistem backscattering bir ayna varsa, etanol ve hav bırakmayan bir doku kullanarak temizleyin.
- Örnek çekmece Açık çekmece düğmesine basarak açın. (Şekil 5A).
- Yaklaşık 10 µL ile kılcal 96-şey plaka her kuyudan kılcal dokunaklı bir ucunu tarafından çözüm içine yüklemek, sonra onları örnek raf (Şekil 5B) karşılık gelen kılcal sahipleri yerleştirin. Orta parmak, vbkapiller kirletmek değil dikkatli olun., bu deney boyunca floresans okuma ile engelleyebilir.
- Manyetik mühürleme şeridi (Şekil 5C) ile kılcal hareketsiz.
3. bir nanoDSF deneme programlama
- Bulmak belgili tanımlık konum ve Keşif tarama sekmesini artış Keşif tarama Başlat düğmesine basarak her kılcal yoğunluğu veya bir ilk güç kadar % 10 dan olay uyarma gücü azaltmak için bir ön tarama Başlat kapiller her tarama 4.000-12.000 adet (Şekil 5D) tepedir.
- Örnek katlanmış ve yeterince konsantre emin olmak için bir ilk eritebilir tarama dik bir sıcaklık değişimi ile önerilir. Erime tarama sekmesinde bir erime 7.0 ° C min-1, Başlatmak sıcaklık 25 ° c ve Son sıcaklığı 95 ° c Sıcaklık yamaç seçeneği ayarlayarak inceden inceye gözden geçirmek o zaman nanoDSF denize indirmek program deneme basarak Erime başlar düğmesi. Çıkan eritmek Eğer eğriler tespit dönüm noktası göstermek değil, örnek daha fazla konsantre veya protein düzgün katlanmış kontrol düşünün.
- 2.1-2.4 örnekleri için tam bir deneme hazırlamak için adımları yineleyin.
- Erime tarama sekmesinde bir erime 1.0 ° C min-1, Başlatmak sıcaklık 25 ° c ve Son sıcaklığı 95 ° c Sıcaklık yamaç seçeneği ayarlayarak inceden inceye gözden geçirmek o zaman nanoDSF denize indirmek program deneme basarak Erime başlamak düğme.
4. bir TSA deneme gerçekleştirme
- Örnek çekmece çekmece sağ tarafındaki Girintiyi sıkıca basarak açın. 96-şey tepsi RT-PCR sistemi geri soldaki (Şekil 4D) de A1 ile yerleştirin.
- TSA deney ayarlamadan için Yeni deneme düğmesini tıklatın.
- Deneme özellikleri sekmesindeki sorulduğunda Eritmek eğrisi seçeneği tıklatın ne tür bir deney kurmak istiyor musunuz? ve sorulduğunda diğer seçenek hangi reaktifler hedef sıra algılamak için kullanmak istiyor musunuz?
- İçinde plaka Kur / hedefleri tanımlamak ve örnekleri sekme, bir hedef ad girin sonra muhabir ROX ve içki noneolarak ayarlayın.
- İçinde plaka Kur / hedefleri ve örnekleri atamak sekmesinde, her şey 96-şey plaka önceki adımda girdiğiniz hedef adı atayın. Aynı sekmede Pasif referans olarak kullanmak üzere boya seçin Noneayarlayın.
- Kadar toplam üç Yöntem çalıştırma sekmede adımları silin. İlk adım 25,0 ° C'ye, rampa oranı % 100, saat 00:05 ayarla; 95.0 ° C, rampa oranı % 1, saat 01:00 ikinci adıma; 95.0 ° c, rampa oranı % 100, üçüncü adım zaman 00:05. Veri topla aşağı açılan menüsünü kullanarak veri toplamak seçin veya Veri toplama simgesi (Şekil 6) basarak.
- Tepki birim başına iyi 20 µL için ayarlayın.
- TSA deney başlamak için Başlat Çalıştır düğmesine basın.
5. veri analizi
- Bir erime eğrisi ile çizilecek bir dalga boyu seçin. NanoDSF deneyleri, 330 koyulukları floresans oranı için nm ve 350 nm (Triptofan nonpolar ve kutup ortamlarda sırasıyla karşılık gelen)13 sık kullanılan. Çoğu TSAs için maksimum boya emisyon eritebilir eğriyi çizmek için uygundur (569 emisyon maksimum SYPRO portakal olduğunu nm)12.
- Her koşul Tm değerleri her eritebilir eğrinin dönüm noktalarının belirlenerek hesaplayın. En nanoDSF sistemleri Tm değerleri sayısal farklılaşma eritebilir eğrileri sonra veri toplama tarafından otomatik olarak hesaplayın. Kullanılan yazılım otomatik olarak Tm değerleri hesaplamıyorsa, ücretsiz, alternatif GUI tabanlı yazılım namı11 gibi otomatikleştirebilirsiniz veri analizi ve aşağı akım işleniyor, bir heatmap özetleme Tm üretmek için seçenek vermek tüm değerleri (eşlik eden başvuru sağlar rehberlik ve kaynakları için veri işleme namı ile) 96-iyi deneme.
- İncelenen tüm koşullardan Tm değerleri karşılaştırın. İstikrar ekranlar sadece su içeren iki kuyu içinde her perde (A1 ve A2) içerir. Bir kriter olarak sadece su değerleri alarak sistematik hatalar adresleme ve etkileri sabitleme kolay karşılaştırma izin ΔTm değerleri, hesaplama sağlar. Daha yüksek Tm değerleri aşağı akım kullanım için önerilen termal teskin koşulları belirtin. Gelecek vaat eden koşulları kez onların sabitleme bir konsantrasyon bağımlılığı göster.
Sonuçlar
Lizozim kararlılık perde ile denetlesinler ve Protein X, virüs-X projede hedef protein osmolyte ekran ile denetlesinler. Genellikle üretilen her iki proteinler eğrileri TSA, nanoDSF deneyleri (bkz: temsilcisi eğrileri rakamlarını eşlik eden) açıkça tanımlanmış denatürasyon geçişler ile eritin. Nerede değil üretmek yorumlanabilir eğrileri ile tanımlanmış denatürasyon geçiş yaptım örnekleri denatüre ve eklenmemiş Tm karşılaştırmaları yorumlanır birkaç durumda.
Şekil 7 örnek sonuçlarını tuz ekranından, amonyum klorür lizozim doğru termal dengelenmekte özelliklerini örnekli gösterir. Konsantrasyon bağımlılıklar gibi yukarıda gösterilen kez gelecek vaat eden koşulları göstergesi olmakla birlikte, termal istikrar genellikle kaynaklanmaktadır Eğer görmek için birkaç farklı tuzları ile iyonu konsantrasyonu artırmak sonuçları karşılaştırmak yararlı olabilir bir arabellek iyonik gücü artış veya belirli iyonları varlığı ek istikrar confers.
Tm değerleri ile pH perde (Şekil 8) lizozim, karşılaştırma iki bilgi parçasına ortaya koymaktadır. İlk olarak, azalan pH değerleri ile istikrar artan genel bir eğilim vardır. İkinci olarak, farklı tampon sistemleri aynı pH değerlerinde elde edilen aralığı Tm değerler önemli olabilir.
Şekil 8 verilerde TSA ve nanoDSF Bu denemede genellikle iyidir ama nanoDSF biraz daha yüksek Tm değerleri tanımlayan eğilimi gösterir ve biraz daha büyük Tm TSA vardiya öneriyor. Ancak, bazı kuyular üzerindeki 8.5 pH değerleri ile TSA ve nanoDSF elde edilen Tm değerler arasında büyük farklılıklar göstermektedir. Farklılıklar potansiyel olarak farklı pH değerlerinde proteini denatürasyon mekanizmasının atfedilen olabilir; Örneğin, bir hydrophobicity duyarlı boya bir protein hidrofobik bölgeler için solvent triptofan artıkları değişiklikleri ortamının daha önemli ölçüde daha hızlı polarite içinde maruz olur Eğer okuma bir nispeten düşük Tm verebilir.
Şekil 9 bir heatmap lizozim osmolyte ekran kullanarak elde Tm değerleri gösterir. Denetim wells (deiyonize su içeren wells A1 ve A2,) göre en yüksek Tm artar koşullarla koyu mavi renkte görünür. Şekil 9 ' da tanımlanan özellikle teskin koşulları gliserol, 1 M D-sorbitol, 100 mM hypotaurine ve 10 mM Ala-Gly (A4-A6, A9, E7 ve F8, sırasıyla kuyuları) içerir.
Şekil 10 Tm Protein X. TSA ile elde edilen değerler bir heatmap gösterir ve test osmolytes çoğunluğu ya küçük bir artış Tm (içinde 1 ° C) vermek veya zararlı bir etkisi var nanoDSF deneyler Osmolyte ekran ile ortaya Protein x'nin istikrarı. Özellikle, dipicolinic asit konsantrasyonu 10 mM (iyi D1) adlı örnek oda sıcaklığında denatüre görünüyor. TSA ve nanoDSF sonuçları hızlı bir şekilde dipicolinic asit protein ile çalışırken kaçınılması gereken Protein X için uyumsuz bir katkı tanımlayın. D-sorbitol ve arabinoz (kuyu A9 ve B9, her ikisi de 1 M) yine de, yüksek konsantrasyonda yanı sıra gliserol ve TMAO (kuyuları A4-A6 ve E1, sırasıyla) termal-sabitleme olarak tespit edilmiştir.
Lizozim için en yüksek Tm değerleri her istikrar ekrandan oluşturan koşullar kombinasyonları bir sinerjik Birleşik etkisi için soruşturma için test edildi. Şekil 11 daha fazla arabellek sistem bileşenlerinin Tm değerleri genel bir artış gösterir (pH, tuz ve osmolyte) eklenir. MES söz konusu olduğunda, amonyum sülfat ve D-sorbitol, Tm büyüklüğünde 10 ° C tüm bileşenleri mevcut olduğunda MES yalnız göre gözlenen gibi artırın. Şekil 11 bir arabellek bileşenleri tek tek en iyi duruma getirilmiş ve kararlılık perde ile kombine göze çarpan bir sinerjik etkisi oluşabilir gösterir.
Daha genel bir kayda göre Şekil 11 da TSA ve nanoDSF deneyler gözlenen ΔTm değerleri büyüklüğünü göstermektedir. Önemli ölçüde protein sistemi temelinde ΔTm ulaşılabilir büyüklüğü değişir ama herhangi bir ΔTm değer etrafında ve 5 ° C üzerindeki kez yararlı bir teskin etkisini göstergesidir.

Resim 1 : Bioprospecting. Virüs-X Proje aşırı bir ortamda örnek koleksiyonundan. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
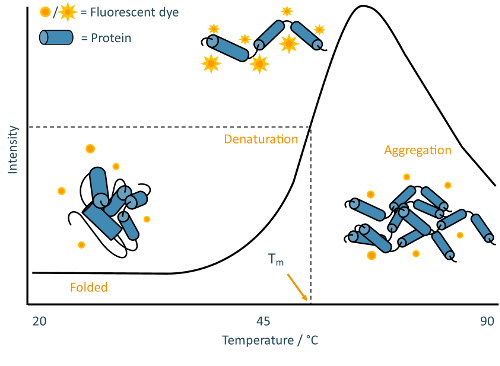
Resim 2: TSA şematik. Ek açıklama eklenen örnek bir TSA deneyden elde edilen bir tipik eritebilir eğrisi. Bu eğri klasik "iki devletli" protein unfolding özelliğidir, nerede üzerinden örnek nüfus geçişler için denatüre olmadan tespit kısmen katlanmış ara ürün katlanmış. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
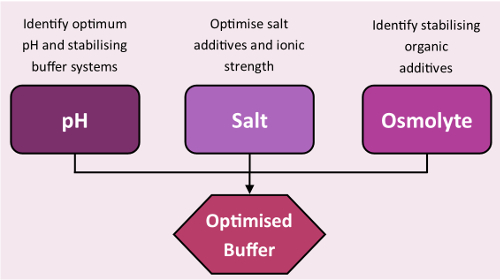
Şekil 3 : İstikrar iş akışı ekranları. Standart iş akışı arabelleği istikrar ekranları kullanarak en iyi duruma getirme. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4 : İş akışı TSA deneme kararlılık perde ile bir standart. Soldan sağa: 96-şey plaka içine istikrar ekranlarının (A) Pipetting aliquots. (B) protein örnek plaka içine floresan boya ile pipetting. (C) sızdırmazlık Santrifüjü önce plaka. (D) plaka bir RT-PCR sistemi yerleştirerek. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 5: iş akışını bir standart nanoDSF deneyi,. (A) raf yükleme kılcal açılıyor. (B) kılcal raf yükleniyor. (C) manyetik mühürleme şeridi ile kılcal immobilizing. (D) programlama bir deney. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
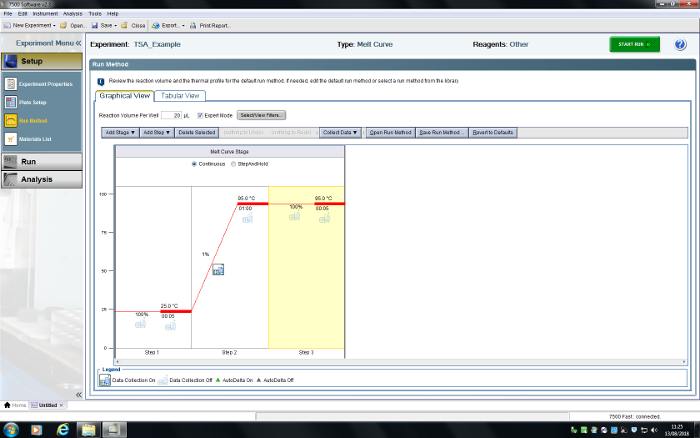
Şekil 6 : RT-PCR sistemi kullanıcı arabirimdeki. TSA deney programlandı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
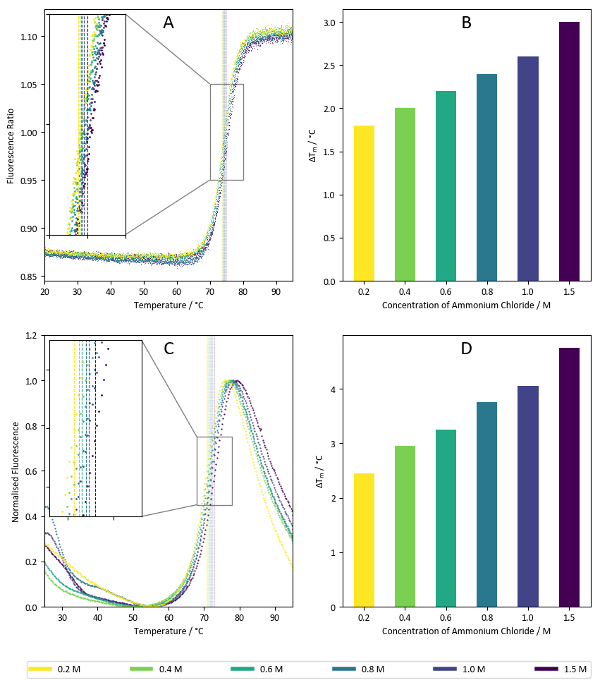
Şekil 7 : Tuz ekran örnek verileri. (A) 350 nm vs 330 nm Lizozim ile nanoDSF etiket ücretsiz deneme için koyulukları floresans sayısına oranı. Örnekleri kuyu C7-C12 tuz ekran (1.5 M - 0.2 M amonyum klorür) için karşılık gelir. Hesaplanan Tm değerleri her koşul için arsa üzerinde üst üste. (B) Tm değerlerinin özeti Şekil 7içindeAsunulan veri hesaplanan. (C) Floresan koyulukları 590 nm lizozim hydrophobicity duyarlı muhabir boya ile kullanarak bir TSA deney. Şekil 7gibiA, örnekleri kuyu C7-C12 tuz ekran için karşılık gelir. Hesaplanan Tm değerleri grafik üzerinde üst üste. (D) Tm değerlerinin özeti Şekil 7' deCmevcut verilerden hesaplanan. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
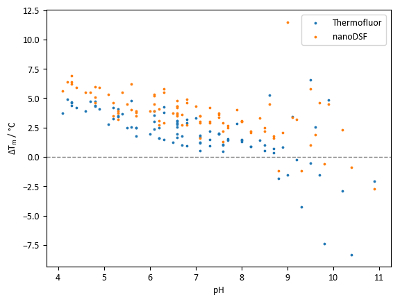
Şekil 8: pH ekran örnek verileri. Tm vardiya lizozim ve pH ekran ile elde edilen özetini. Her noktası bağımsız bir durumu temsil eder; farklı tampon sistemleri aynı pH noktalarda aynı pH değeri vardır. Tm vardiya TSA deneyler için 68.0 ° C ve 71.9 ° C nanoDSF deneyler için bir denetim Tm göre hesaplanır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
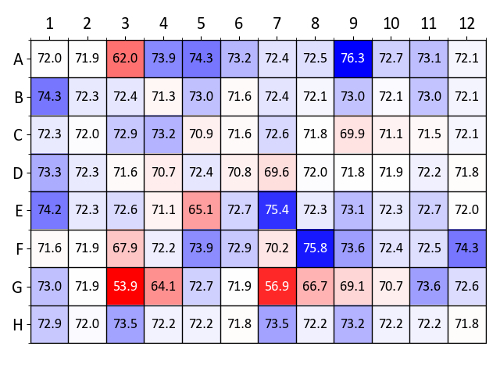
Şekil 9 : Osmolyte ekran örnek verileri (lizozim). Lizozim ve her şey osmolyte ekran ile bir etiket içermeyen nanoDSF deneme elde Tm değerlerinin özeti. Tm değerlerde (° C) içeren bir denetim olarak su kuyuları A1 ve A2 karşılaştırılır. Bir heatmap karşılaştırıldığında ΔTm değerlere göre oluşturulan (mavi gösterir Tm artış ve kırmızı Tm azalma). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
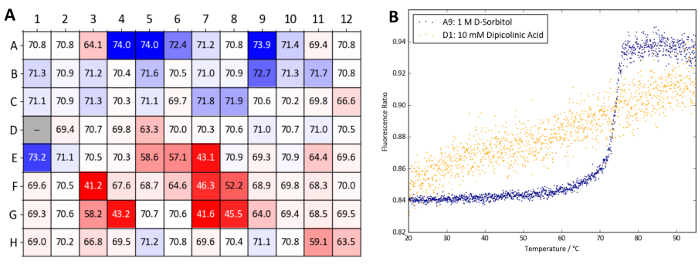
Şekil 10: Osmolyte ekran örnek verileri (Protein X). (A) Protein X ve osmolyte ekran ile bir etiket içermeyen nanoDSF deneme elde Tm değerlerinin özeti. Tm değerleri içeren bir denetim olarak su kuyuları A1 ve A2 karşılaştırılır. Bir heatmap karşılaştırıldığında ΔTm değerlere göre oluşturulan (mavi gösterir Tm artış ve kırmızı Tm azalma). (B) nanoDSF eğriler elde edilen iyi A9 (1 M D-sorbitol, teskin bir durum) ve D1 (10 mM dipicolinic asit, destabilizing durumu). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
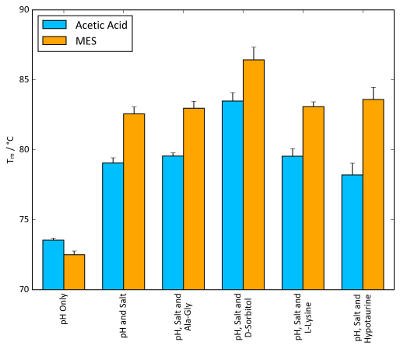
Şekil 11 : Arabellek Tmen iyi duruma getirme etkisi. TSA Tm değerleri Tmen büyük artış sağladığı her ekran şartları ile birlikte lizozim. 100 mM asetik asit, pH 4.2 ve 100 mM MES, pH 5.6, 1.5 M amonyum sülfat tuzu olarak yanında tampon sistemleri olarak seçildi. Osmolyte konsantrasyonları osmolyte ekran bulunanlara benzer: 10 mM Ala-Gly, 1 M D-sorbitol, 50 mM L-lizin ve 100 mM hypotaurine. Hata çubukları temsil eden altı çoğaltır standart sapması. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Molekül | PDB kodu | Co kristallendirme sıklığı |
| Fosfat | PO4 | 5132 |
| Asetat | YASASI | 4521 |
| 2-(N-Morpholino)-Ethanesulfonic asit (MES) | MES | 1334 |
| Tris (hydroxymethyl) aminomethane (tris) | TRS | 1155 |
| Formiat | FMT | 1072 |
Tablo 1: Özet arabellek molekül ortak kristalizasyon frekans Protein veri Bankası (PDB) katılım hakkı. PDBsum16 ' dan 144,868 girişlerinin (12-5-18 aynı derecede-in doğru) toplamı üzerinden alınan veri.
Tamamlayıcı bilgiler. Bu dosyayı indirmek için buraya tıklayınız.
Ek tablo 1. Bu dosyayı indirmek için buraya tıklayınız.
Ek tablo 2. Bu dosyayı indirmek için buraya tıklayınız.
Ek tablo 3. Bu dosyayı indirmek için buraya tıklayınız.
Tartışmalar
İletişim kuralına kritik yönleri Santrifüjü adım ve 96-şey plaka TSA deneyler (adım 1.5) için uygun sızdırmazlık içerir. Santrifüjü sağlar bu protein örnek ve ekran durum kişiye gel ve karıştırın. Ayrıca, bir mühürsüz plaka kullanılırsa TSA deneme için deney boyunca buharlaşan bir artışa neden örnek konsantrasyon ve erken protein toplama şansımızın artması solvent önemli bir riski yoktur.
TSAs ve nanoDSF protein örnekleri geniş bir mükellef bulunmaktadır; örnekleri büyük çoğunluğu yorumlanabilir eritebilir eğrileri veya boya-Alerjik nanoDSF bir muhabir hydrophobicity-esaslı boya ile üretebilir. Standart Floresan kaynakları, protein için uygun değilse, basit değişiklik keşfedilmeyi iletişim kuralına fluorophore seçimdir. Birkaç alternatif boyalar TSA deneyleri için uygun olabilir. N-[4-(7-diethylamino-4-methyl-3-coumarinyl)phenyl]maleimide (CPM), thiol27ve 4 - ile tepki sonra fluoresces bir bileşik örnekler (dicyanovinyl) julolidine (DCVJ), temel, floresans değişir bir bileşik Onun floresan bir protein örnek olarak artan çevresine sertlik (ikinci boya örnek yüksek konsantrasyonda kez gerektirir)28,29 izlerken.
Tm araç yazılım tarafından otomatik olarak hesaplanmamışsa eritebilir eğrisi Analizi alternatif yöntemler kullanılabilir. Veri homojen ve tek bir denatürasyon adım eritebilir eğrileri belirgin ise, kesilmiş bir veri kümesi Boltzmann Aşağıdaki denklemle sigmoid ile donatılmış:
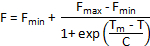
F T sıcaklığında floresan yoğunluğu, Fmin ve Fmax nerede floresans yoğunluklarda önce ve denatürasyon geçişten sonra sırasıyla, Tm orta sıcaklık denatürasyon geçiş ve C olduğunu. Tmviraj gibidir. Bu yöntem de basit iki aşamalı denatürasyon işlemleri için çalışırken, karmaşık eritebilir eğrileri ile birden çok geçiş için uygun değildir.
Erişilebilirlik TSA önemli avantajlarından biridir; TSA deneylerin herhangi bir RT-PCR sisteminde istihdam floresans boya için uygun dalga boylarında, filtreler ile gerçekleştirilebilir. Bu düşük maliyetli sarf malzemeleri, işlem ve nispeten düşük miktarda protein, TSA proje ölçekleri, sanayi ve Akademi hem de geniş bir yelpazesi için değerli bir teknik yapmak gerekli kolaylığı ile birleştiğinde.
Olumlu arabellek koşulları belirten yanı sıra, ekranları ipuçları için bir örnek protein içinde yapısal metallerin varlığını verebilir bazı kuyular içerir. Tuz ekranında özel ilgi olabilir wells G6 ve G7, 5 mM EDTA ve 5 mM EGTA, sırasıyla içeren vardır. Bu kuyu önemli termal istikrarsızlık tarafından chelants münzevi önemli metal iyonları proteini içerisinde göstergesi olabilir. Bileşikleri osmolyte ekranı da potansiyel bir protein işlevine ipuçları sağlayabilir. Birçok ekranında bileşiklerin olan enzimlerin ortak yüzeylerde sınıflara molekülünün ait. Örneğin, genel istikrar lizozim enzim, N-peptidoglikan reaksiyonlar30kurulan yüzeylerde yapısal onların benzerlik atfedilen olabilir için saccharides (kuyu A11-B10 mevcut) tarafından tanınan.
Yukarıda özetlenen TSA ve nanoDSF iletişim kuralları da protein-ligand etkileşimleri çalışmaya adapte edilebilir. Özellikle bir protein için bağlama ligandlar termal istikrarı kompleksi içinde yeni etkileşimler tanıtarak artırabilir. Protein Tm pozitif vardiya bir doz bağımlı bir başarılı protein-ligand etkileşim gelecek vaat eden bir işaretidir. Hız, performans ve TSAs bileşik kitaplıklarıyla tarama düşük maliyet yaptı çok popüler bir yöntem aşamasındaki ilaç keşfi.
31,32,33,34birçok edebiyat örnek göstermek gibi hedef proteinler ve onların ligand komplekslerinin arabellek koşullarını optimize bir projenin başarı için gerekli olabilir. Altında 2 Kurulum süresi de dahil olmak üzere h alarak tipik bir tahlil ile arabellek en iyi duruma getirmeleri için hızlı, ucuz teknik TSAs ve kararlılık perde ile birleştiğinde nanoDSF temsil eder.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu proje Avrupa Birliği'nin ufuk 2020 araştırma ve yenilik programı (Hibe Sözleşmesi n ° 685778) altında Avrupa Araştırma Konseyi (ERC) üzerinden fon aldı. Bu eser Biyoteknoloji ve Biyolojik Bilimler Araştırma Konseyi tarafından desteklenmiştir (BBSRC, grant numaraları 1/M011186/BB, BB/J014516/1). DB BBSRC doktora eğitimi ortaklık Newcastle-Liverpool-Durham için bir öğrencilik ve Durham Üniversitesi bölümü olan bu eser finansman doğru katkıda bulunmak için Biosciences teşekkür. Ian Edwards için onun yardım etmek ve Protein X Durham Üniversitesi bölümü Kimya kütle spektrometresi bölümü onların Enstrümantal analiz için teşekkür ederiz. Borç verme ve bu proje için Prometheus NT.48 sistemi ile yardımcı olmak için Arnthor Ævarsson için virüs-X Proje ve sayesinde de Claire Hatty ve NanoTemper GmbH ile yaptığı çalışmalarla için sana şükrediyoruz. Son olarak, Frances Gawthrop ve Tozer tohum BBSRC iCASE ödül bir parçası olarak verdikleri destek için teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Lysozyme | Melford Laboratories | L38100 | Crystallised and lyophilised chicken egg white lysozyme. |
| The Durham pH Screen | Molecular Dimensions | MD1-101 | 96-well protein stability screen. See above for contents. |
| The Durham Salt Screen | Molecular Dimensions | MD1-102 | 96-well protein stability screen. See above for contents. |
| The Durham Osmolyte Screen | Various | #N/A | 96-well protein stability screen, not commercially available at the time of publication. See above for contents. |
| SYPRO Orange | Invitrogen | S6651 | Widely used fluorescent dye for protein staining in gels and DSF. |
| 96-well PCR Plate | Starlab | 1403-7700 | Semi-skirted clear plastic for use with AB 7500 Fast RT-PCR System. |
| 7500 Fast Real-time PCR System | Applied Biosystems | 4362143 | 96-well format RT-PCR system. Alternative systems can be used. Analysis of data performed using free, open-access software NAMI. AB software tailored to DSF experiments using the 7500 Fast available at additional cost. |
| Prometheus NT.48 | NanoTemper Technologies | #N/A | Label-free DSF system with up to 48-sample capacity. Can calculate unfolding temperatures (Tm and Tonset), critical denaturant concentrations (Cm), free folding energy (ΔG and ΔΔG), and aggregation results (Tagg) using built-in software. |
| Prometheus NT.48 Series nanoDSF Grade Standard Capillaries | NanoTemper Technologies | PR-C002 | Prometheus NT.48 Series nanoDSF Grade Standard Capillaries. "High sensitivity" variants are available at a higher cost for use with low-concentration samples (<200 µg ml-1). |
Referanslar
- Kapust, R. B., Waugh, D. S. Controlled intracellular processing of fusion proteins by TEV protease. Protein Expression and Purification. 19 (2), 312-318 (2000).
- Cordingley, M. G., Register, R. B., Callahan, P. L., Garsky, V. M., Colonno, R. J. Cleavage of small peptides in vitro by human rhinovirus 14 3C protease expressed in Escherichia coli. Journal of Virology. 63 (12), 5037-5045 (1989).
- Hjorleifsdottir, S., Aevarsson, A., Hreggvidsson, G. O., Fridjonsson, O. H., Kristjansson, J. K. Isolation, growth and genome of the Rhodothermus RM378 thermophilic bacteriophage. Extremophiles. 18 (2), 261-270 (2014).
- Alva, V., Nam, S. Z., Söding, J., Lupas, A. N. The MPI bioinformatics Toolkit as an integrative platform for advanced protein sequence and structure analysis. Nucleic Acids Research. 44, 410-415 (2016).
- McPherson, A. Protein Crystallization. Methods in molecular biology. 1607, 17-50 (2017).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Analytical Biochemistry. 357 (2), 289-298 (2006).
- Reinhard, L., Mayerhofer, H., Geerlof, A., Mueller-Dieckmann, J., Weiss, M. S. IUCr Optimization of protein buffer cocktails using Thermofluor. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 69 (2), 209-214 (2013).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Kozak, S., Lercher, L., Karanth, M. N., Meijers, R., Carlomagno, T., Boivin, S. Optimization of protein samples for NMR using thermal shift assays. Journal of Biomolecular NMR. 64 (4), 281-289 (2016).
- Semisotnov, G. V., Rodionova, N. A., Razgulyaev, O. I., Uversky, V. N., Gripas', A. F., Gilmanshin, R. I. Study of the "molten globule" intermediate state in protein folding by a hydrophobic fluorescent probe. Biopolymers. 31 (1), 119-128 (1991).
- Grøftehauge, M. K., Hajizadeh, N. R., Swann, M. J., Pohl, E. Protein-ligand interactions investigated by thermal shift assays (TSA) and dual polarization interferometry (DPI). Acta Crystallographica Section D: Biological Crystallography. 71, 36-44 (2015).
- Steinberg, T. H., Jones, L. J., Haugland, R. P., Singer, V. L. SYPRO Orange and SYPRO Red Protein Gel Stains: One-Step Fluorescent Staining of Denaturing Gels for Detection of Nanogram Levels of Protein. Analytical biochemistry. 239, 223-237 (1996).
- Burstein, E. A., Vedenkina, N. S., Ivkova, M. N. Fluorescence and the location of tryptophan residues in protein molecules. Photochemistry and Photobiology. 18 (4), 263-279 (1973).
- Haffke, M., Rummel, G., Boivineau, J., Münch, A., Jaakola, V. -. P. nanoDSF: label-free thermal unfolding assay of G-protein-coupled receptors for compound screening and buffer composition optimization. Application Note NT-PR-008. , (2016).
- Chari, A., et al. ProteoPlex: stability optimization of macromolecular complexes by sparsematrix screening of chemical space. Nature Methods. 12 (9), 859-865 (2015).
- Laskowski, R. A. PDBsum: summaries and analyses of PDB structures. Nucleic Acids Research. 29 (1), 221-222 (2001).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical biochemistry. 104 (2), 300-310 (1980).
- Welch, W. J., Brown, C. R. Influence of molecular and chemical chaperones on protein folding. Cell stress & chaperones. 1 (2), 109-115 (1996).
- Diamant, S., Eliahu, N., Rosenthal, D., Goloubinoff, P. Chemical chaperones regulate molecular chaperones in vitro and in cells under combined salt and heat stresses. The Journal of biological chemistry. 276 (43), 39586-39591 (2001).
- Yancey, P. H. Organic osmolytes as compatible, metabolic and counteracting cytoprotectants in high osmolarity and other stresses. Journal of Experimental Biology. 208 (15), 2819-2830 (2005).
- Garman, E. F., Owen, R. L. Cryocooling and radiation damage in macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 62 (1), 32-47 (2006).
- de Marco, A., Vigh, L., Diamant, S., Goloubinoff, P. Native folding of aggregation-prone recombinant proteins in Escherichia coli by osmolytes, plasmid- or benzyl alcohol- overexpressed molecular chaperones. Cell Stress & Chaperones. 10 (4), 329 (2005).
- Berman, H. M., et al. The protein data bank. Nucleic acids research. 28 (1), 235-242 (2000).
- Bougouffa, S., Radovanovic, A., Essack, M., Bajic, V. B. DEOP: A database on osmoprotectants and associated pathways. Database. 2014, 1-13 (2014).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Kung, C. E., Reed, J. K. Fluorescent molecular rotors: a new class of probes for tubulin structure and assembly. Biochemistry. 28 (16), 6678 (1989).
- Iio, T., Itakura, M., Takahashi, S., Sawada, S. 9-(Dicyanovinyl)julolidine binding to bovine brain calmodulin. Journal of biochemistry. 109 (4), 499-502 (1991).
- Veros, C. T., Oldham, N. J. Quantitative determination of lysozyme-ligand binding in the solution and gas phases by electrospray ionisation mass spectrometry. Rapid Communications in Mass Spectrometry. 21 (21), 3505-3510 (2007).
- Kean, J., Cleverley, R. M., O'Ryan, L., Ford, R. C., Prince, S. M., Derrick, J. P. Characterization of a CorA Mg2+ transport channel from Methanococcus jannaschii using a Thermofluor-based stability assay. Molecular membrane biology. 25 (8), 653-661 (2008).
- Geders, T. W., Gustafson, K., Finzel, B. C. Use of differential scanning fluorimetry to optimize the purification and crystallization of PLP-dependent enzymes. Acta Crystallographica Section F. 68 (5), 596-600 (2012).
- Morgan, H. P., Zhong, W., McNae, I. W., Michels, P. A., Fothergill-Gilmore, L. A., Walkinshaw, M. D. Structures of pyruvate kinases display evolutionarily divergent allosteric strategies. Royal Society open science. 1 (140120), (2014).
- Moretti, A., Li, J., Donini, S., Sobol, R. W., Rizzi, M., Garavaglia, S. Crystal structure of human aldehyde dehydrogenase 1A3 complexed with NAD+ and retinoic acid. Scientific reports. 6 (35710), (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır