Method Article
通过流动细胞测定检测和描述 Vivo 中的蛋白质自组装
摘要
本文介绍了一种基于FRET的流式细胞测定方案,用于量化S.cerevisae和HEK293T细胞中的蛋白质自组装。
摘要
蛋白质自组装控制蛋白质功能,并在空间和时间上划分细胞过程。目前研究它的方法具有低灵敏度、间接读出、吞吐量有限和/或总体水平而非单单元分辨率。我们设计了一种基于流式细胞学的单一方法,解决了所有这些限制:分布式反源性FRET或DAmFRET。DAmFRET 通过体内的敏感排放 FRET 检测和量化蛋白质自组装,支持跨模型系统(从酵母到人体细胞)进行部署,并实现灵敏的单细胞、高通量读出,而与蛋白质无关本地化或溶解性。
引言
研究同质蛋白相互作用或"自组装"的测定很重要,因为蛋白质的寡聚状态和溶解度决定了它们的功能。蛋白质组比比皆是,同种多子1,2,3,4,而相对较少的蛋白质作为单体功能。蛋白质也可能由于压力、年龄或调节不当而异常地聚集,从而导致活动的病理变化。确定调整此类事件的因素,甚至组件的物理性质,通常具有异常困难。
越来越多的蛋白质现在被承认以非凡的协同性和不确定的化学测量自组装,导致它们从其他细胞成分中混合,作为蛋白质密集阶段。这些形式为无序的冷凝水,如液滴和凝胶,或高度有序的细丝,如淀粉样纤维。与后者相关的构象波动使其初始形成,或成核,在分子级5,6中固有的概率。由于成核的概率随体积而缩放,因此在活细胞7、8的空间范围内,这种组件的形成可能是高度随机的。在随机成核有限相分离的极端是prion,高度有序的蛋白质组件,很少是自发成核,但一旦形成,模板自己的增长无限期。其中一种蛋白质,称为ASC,在哺乳动物先天免疫细胞的活性中执行一种类似数字的病毒状开关。ASC 自组装通过它与特定蛋白质的相互作用而成核,这些蛋白质在结合病原体或危险相关分子模式时自行被排斥。ASC组件依次成核procaspase-1自组装和激活,导致细胞因子成熟和细胞9,10的丙酮化。负责其组装的ASC区域属于死亡域超级家族,由人类蛋白酶中的一百多个成员组成。尽管死亡领域在先天免疫和程序化细胞死亡中起着关键作用,但大多数尚未在自我组装方面得到特征。通过直接的单细胞读出蛋白质自组装,将大大促进具有此类行为的其他蛋白质的发现和表征。
研究蛋白质自组装的经典蛋白质生物化学方法,如尺寸排除色谱和超离心,主要限于种群水平评估。但是,不能用这种详细级别对成核限制相变产生的细胞对细胞异质性进行建模。基于荧光显微镜的单细胞方法重新获得这一能力,但缺乏准确量化成核或检测稀有组件所需的吞吐量。此外,可溶性自组装,如大多数酶和淀粉样蛋白寡聚物,太小,流动性小,无法通过标准光显微镜解决。它们可以通过更复杂的方法(如荧光相关光谱法)进行检测,但这些在细胞数量和吞吐量方面非常有限。
基于邻近性的蛋白质组装测定,如FRET和裂解荧光酸补性,为这些问题提供了潜在的解决方案。然而,它们通常要求使用两种不同的结构来表达与互补标记融合的兴趣蛋白——在FRET的情况下,供体和受体荧光量。这损害了实验吞吐量,也降低了由于供体和受体相对水平的细胞到细胞的变化而降低灵敏度。为了规避这种情况,我们设计了一种采用光可转换荧光荧光团(mEos3.111)的测定方法,它允许单个结构来表达供体和受体标记的蛋白质。未转换的 mEos3.1(类似 GFP 的供体)的发射光谱与光转换 mEos3.1(dsRed 样受体)的激发光谱充分重叠,使 FRET 在分子接近时发生(<10 nm)。因此,通过将细胞暴露于经验确定的剂量为 405 nm 光,该光束将总 mEos3.1 的最佳分数转换为受体形式,我们实现了多个样本中供体和受体的一致且可重复的相对水平,表达水平和实验。当使用 561 nm 光直接激发时,或者间接(通过来自捐赠者的能量传递)使用 488 nm 光(即敏感发射 FRET)测量受体荧光。我们报告蛋白质组装是这两个值的比例,并称之为非交响FRET或AmFRET。
为了按流式细胞测量计算蛋白质浓度,我们首先计算用mEos3.1标记的Spc42的平均荧光强度。由于酵母细胞含有大约1000个Spc42分子,我们然后计算单个荧光绿色mEos3.1分子的荧光强度。通过利用所有细胞浓度的均匀光转换(图1E),我们再关联光转换后所有接受器强度的总mEos3.1荧光值。然后,我们能够将荧光蛋白的摩尔总数除以近似的细胞体积(根据使用成像流细胞测定法确定),以获得感兴趣的蛋白质的总细胞浓度。如获得准确计算,请参阅原稿8。
通过表达酵母中2+质粒中的mEos3.1融合蛋白,我们在每个样品8中探讨大约千倍的蛋白质浓度范围。我们在HEK293T细胞中通过在转染过程中质粒的变异而达到同样的结果,因此,复印数也可变。
AmFRET,或DAmFRET对数千个细胞的分布揭示了任何感兴趣的蛋白质在细胞醇中自我组装的浓度依赖性。总体而言,DAmFRET 是一种能够发现和描述蛋白质自组装的方法,具有前所未有的灵敏度、吞吐量和可重复性组合。
虽然使用成像细胞仪使我们能够获得体内蛋白质浓度测量,但大多数研究机构尚未提供此类细胞计。然而,DAmFRET甚至可以在典型的非成像细胞仪中运行,以获得蛋白质表达范围内的蛋白质组装分布。
研究方案
1. 为DAmFRET测定准备糖精
- 使用2μ乳酸诱导质粒,用2μ乳酸诱导质粒改造实验性相关的酵母菌株,使用标准醋酸锂协议12,在C或N终点用mEos3.1标记感兴趣的蛋白质8。
- 在液体培养中生长酵母。
- 对于每个查询蛋白,接种酵母菌群(转化),在三联体中,每个成200μL的适当非诱导生长介质(即含有2%德克斯罗、酵母氮碱和氨基酸的培养基),在96孔板中(图 1C.
- 在板摇杆上摇动时孵育细胞(参见材料表),在 1200 rpm 的转速下以 1200 rpm 运行 1.5 mm 轨道,在 30°C 下孵育细胞,为期 16 小时。
- 诱导感兴趣的基因的表达(16 h-某些蛋白质的代表性协议可能需要或多或少的时间)。
- 感应 16 小时后,在室温下以 2200 x g旋转板 2 分钟(RT0 对样品进行颗粒测试)。
- 通过强制反转去除介质。用200μL的适当诱导介质(即含有2%乳糖、酵母氮碱和氨基酸的培养基,用于选择质粒)的细胞重新悬浮细胞。参见图1C。
- 在30°C下摇动12小时,孵育细胞。
- 离心机(见材料表),在RT处以2200 x g的板2分钟对样品进行颗粒。通过强制反转去除介质。用200μL的诱导介质重新悬浮细胞。
- 在 30°C 下以 1200 rpm 的速度摇动细胞,再孵育 4 小时。此在新的介质中重新悬浮应在运行 DAmFRET 前 4 小时发生,以减少自荧光。
2. 哺乳动物质粒的产生
- 构造具有构成启动子和 mEos3.1 的哺乳动物载体,该载体具有占位符,用于在感兴趣的基因和它们之间的链接器中插入。
注:我们从公开提供的质粒(参见材料表)中构建了一个金门兼容的载体M1,并作了如下修改:现有的BsaI位点被点突变G移除到A(位置3719,根据沉积序列)。mEos3.1是使用I157V的荧光酸的场位定向诱变获得的。在CMV启动子和mEos3.1之间插入了反向BsaI站点,然后是4x(EAAAR)链接器,以产生最终的M1矢量。蛋白质表达由CMV增强剂和促进剂驱动;和转录终止SV40聚化信号。 - 创建与构造的矢量兼容的插入库。
注:我们订购金门组件的插入件作为合成线性碎片(见材料表),由BsaI站点侧翼,用于在CMV启动子和4x(EAAAR)-mEos3.1之间结扎到M1中。
3. 哺乳动物细胞培养和转染
- 在 DMEM 中培养 HEK293T 细胞 = 10% FBS = 1x PenStrep 介质,在 37°C 下,在 5% CO2下。
- 在转染前一天,种子5 x 105细胞在6孔板与2mL的介质。
- 使用转染试剂(参见材料表)使用2μg质粒DNA转染细胞,比例为3:1(转染试剂:DNA)。将成分混合在150 μL减少的血清介质(见材料表),并在RT孵育15分钟,将混合物加入每个井中,孵育48小时,用于蛋白质表达。
- 通过荧光显微镜(488 nm 激发,515 nm 发射)在 24 小时后确认蛋白质表达。
4. 制备哺乳动物细胞,用于DAmFRET测定
- 在48小时蛋白质表达后,从每个井中取出培养基,用1mL的37°C磷酸盐缓冲盐水(PBS)仔细清洗细胞。洗涤后,吸气。
- 加入0.5 mL的胰蛋白酶-乙二胺四乙酸(EDTA) (0.25%)并在37°C孵育5分钟。
- 向每个井中添加 0.5 mL 的完整 DMEM 介质,重新悬浮单元并确保看不到大块。
- 将每个井的整个体积转移到 1.5 mL 管中。
- 在室温 (RT) 下,在 1000 x g下旋转电池 5 分钟。
- 去除上清液,并在PBS = 10 mM EDTA的1 mL中重新悬浮细胞颗粒。
- 在 RT 处以 1000 x g的速度旋转细胞 5 分钟。
- 在PBS中去除上清液并重新悬浮在1 mL 4%甲醛(PFA)+ 10 mM EDTA中的细胞颗粒中。
- 在不断移动的摇摇台上固定细胞 5 分钟。
- 在 RT 处,在 1000 x g下旋转电池 5 分钟。
- 去除上清液,在PBS = 10 mM EDTA的1 mL中重新悬浮细胞颗粒。
- 在 RT 处,在 1000 x g下旋转电池 5 分钟。
- 取出上清液,并在足够的缓冲液中重新悬浮细胞,以便进行细胞测量运行(对于 96 孔板的 1 孔,使用 200 μL 的 PBS = 10 mM EDTA)。
- 将重新悬浮的细胞转移到圆底 96 孔板的一个孔。
5. 酵母和哺乳动物细胞的测定光转换
- 使用带有 320-500 nm(紫色)过滤器和光束准直器的没有盖的微孔板中的光转换样品(参见材料表),在摇动时可放置 45 厘米,持续时间为 25 分钟。当板的光束功率为11.25 mW/cm2时,这些条件是合适的,总光子剂量8约为17,000 mJ/cm2。
6. DAmFRET数据收集
- 使用具有非线性 488/561 激光的细胞仪对细胞进行测定。以下数据是 FRET 计算的最低要求。
- 使用 488 nm 激发/515 nm 发射通道收集供体荧光。
- 使用 488 nm 激发/595 nm 发射通道收集 FRET 信号的荧光。
- 使用 561 nm 激发/595 nm 发射通道(与 488/595 通道非线性)收集接受器荧光。
- 使用405纳米激发/457nm发射通道收集自荧光8。
- 利用亮场图像通道进行体积计算。
注:S.cerevisae的成像细胞仪设置如下:60x物位低流速和高灵敏度;激光功率设置为405nm,在15mW时,488nm在15mW,561nm在20mW。激光功率设置为 405 nm,功率为 15 mW,488 nm 以 15 mW,561 nm 在 20 mW 下。 还请注意,我们的成像细胞仪经过定制设计,具有空间分离的 488 nm 和 561 nm 激光器(即在不同的摄像机上),以便从接受荧光器中获得 FRET 的清晰分辨率Ce。
- 收集荧光正门内每个样品20,000-50,000个单细胞的数据。
- 门单细胞由高纵横比和小细胞面积,而不是块状细胞或碎片,这将具有低纵横比和大或非常小的细胞区域。
注: 非成像细胞仪中的等效参数为近似细胞大小的 FSC(正向散射)和用于细胞粒度的 SSC(侧散射)。此外,使用 FSC 脉冲高度与脉冲宽度作为单单元门控的代理。此外,不要收集荧光值超过细胞仪灵敏度上限的事件,这一点至关重要。在我们的成像细胞仪中,我们将事件收集限制为原始最大像素值 1 小于我们收集的每个荧光通道的饱和度限制。同样,对于传统的流式细胞仪,不应分析最高强度箱中的数据点(包括超出动态检测范围的事件)。
- 门单细胞由高纵横比和小细胞面积,而不是块状细胞或碎片,这将具有低纵横比和大或非常小的细胞区域。
7. 数据分析
- 使用非光转换的mEos3.1样本对纯供体信号和单体DsRed2进行补偿,后者的光谱与mEos3.1的红色形式相似,对于纯受体信号13。为了获得更大的灵敏度,请确保 FRET 检测器通道在分析程序中也被视为溢出目标。
- 门样本只选择荧光阳性的单个细胞(如图2所示)。
- 将 AmFRET 参数计算为 FRET 信号总值 (488ex/595em) 除以 FRET 接受器 (561ex/595em) 信号的总比率。
- 使用流式细胞测定软件可视化数据(参见材料表)。
注:本研究中S.cerevisae的细胞浓度是按照以下设置计算的,如Khan等人8。使用流式细胞测定软件进行数据分析(参见材料表)。
结果
检测不形成双核的寡聚物
我们以前曾应用 DAmFRET 来鉴定蛋白质相分离,这通常会导致形成大型蛋白质组,也可以通过荧光显微镜检测出来。为了证明DAmFRET对衍射受限蛋白质组件的适用性,我们分析了一种生物化学特征良好的蛋白质,这种蛋白质形成离散的同质七分体,其体积太小,无法用光显微镜来可视化:人类共同查佩罗宁, HSPE114.我们比较了仅表达mEos3.1或HSPE1-mEos3.1的酵母细胞的DAmFRET配置文件。后者表现出均匀的正AmFRET值,而前者表现出微不足道的AmFRET(图3A)。成像流细胞仪获取的细胞图像(见材料表)显示,mEos3.1和HSPE1-mEos3.1表达细胞(图3B)在所有通道(FRET和受体)中具有漫反射荧光。为了在更高的光学分辨率下确认这一发现,我们使用共聚焦显微镜捕获多个细胞场的z堆栈。事实上,荧光均匀地分布在整个细胞醇中,没有可检测的双光,无论细胞是否表示HSPE1-mEos3.1或仅荧光素(图3C)。请注意,HSPE1的特征Kd约为3 μM,略低于我们系统的灵敏度,因此,我们未观察到FRET与浓度的西格莫多关系,这种离散的同质寡聚物的预期。然而,我们得出结论,DAmFRET以单细胞分辨率在体内可靠检测可溶性同质性。
检测限核组件
为了展示DAmFRET区分离散同质核子与成核有限组件(如普里昂)的能力,我们分析了人类发炎蛋白ASC。而WT ASCPYD在体内形成细丝,ASCPYD的非活性R41E突变体不9,10。我们在酵母细胞中表达,要么仅mEos3.1,要么mEos3.1融合到WT或R41E ASCPYD中。单独表达荧光素或ASCPYD突变形式的酵母细胞在整个浓度范围内表现出可忽略不计的AmFRET,表明无法自我相互作用。相比之下,WT ASCPYD展示了具有两个种群的 DAMFRET 配置文件:一个具有可忽略不计的 AmFRET,另一个具有高 AmFRET(图 4A)。正如荧光图像(图4B)所证实的,这些群体分别代表只含有可溶性蛋白质或主要含有自组装蛋白质的细胞。种群之间的不连续关系,以及它们以重叠浓度发生的事实表明,成核屏障稳定了蛋白质的单体形式,并可以阻止它在实验期间组装8.两个种群之间的AmFRET差距表明,一旦发生成核,它几乎瞬间将其他单体模板到组装形式,并达到AmFRET新的稳定状态水平。DAmFRET证实了以前的结构数据,即点突变ASCPYD R41E扰乱了该表达系统可实现的浓度的成核(图4A)。
DAmFRET在哺乳动物细胞中的适用性
虽然酵母细胞是DAmFRET的理想宿主细胞,但我们希望将DAmFRET的适用范围扩大到哺乳动物细胞。为了避免功能性ASC聚合物导致细胞死亡,我们在HEK293T细胞中测试了DAmFRET,这些细胞缺乏caspase-1表达。我们在HEK293T细胞中表达的蛋白质与图4A中的酵母细胞相同。HEK293T细胞中产生的DAmFRET型材在质量上与酵母细胞中的相似(图4A,C)。因此,DAmFRET 是功能最广泛、最通用的体内方法,可检测和量化单细胞分辨率下具有高通量的单细胞自组装核蛋白自组装,无论是否存在微观可见的双核和细胞类型。
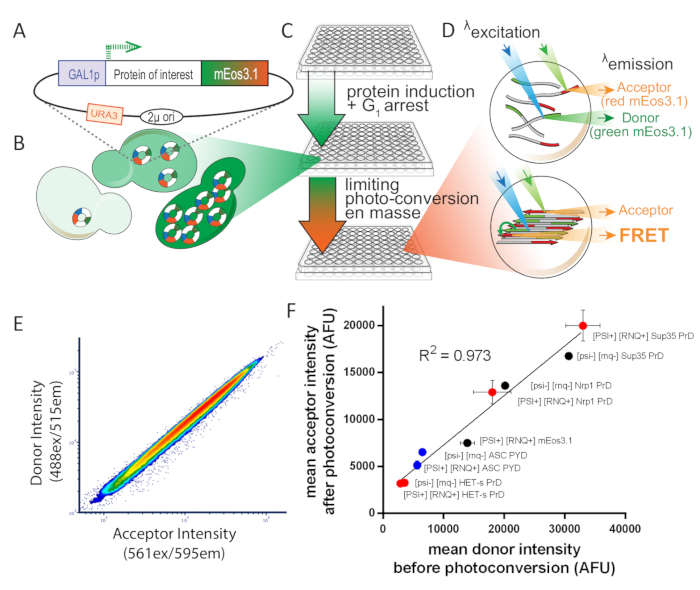
图 1: 实验设计概述塞雷维西亚.这一数字经许可后,已由Khan等人8号改编。(A) 2+ 质粒图,显示感兴趣的蛋白质的开放读取框架,标记有光可转换 mEos3.1,并由诱导启动子驱动。(B) 当转化为酵母细胞时,2μ复制系统会导致细胞之间的拷贝数变异性高。这种变异,加上来自GAL1启动子的转录噪声,导致细胞群中蛋白质表达的广泛分布。(C) 酵母DAmFRET测定的实验概述。为了确保用于测定的健康细胞,首先在含有非诱导碳源dextrose的合成介质中接种了16小时以上的增殖菌落。增殖后,细胞被转移到含有诱导碳源的合成介质中,在16小时内。感应后,细胞通过暴露于405nm光部分和均匀地光转换。(D) 然后使用成像流细胞仪分析样品.绿色和红色 mEos3.1 的光谱和强度使它们分别非常适合 FRET 捐赠者和接受者。当彼此接近时(如底部细胞中描述的聚合物中所示),红色分子在激发绿色分子(FRET)时会荧光。(E) 图解图与受体强度图在光转换时呈紧密线性关系,表明光转换效率不受表达水平影响。(F) 平均受体与供体强度的散射图,来自表达多种 mEos 标记蛋白的细胞群,以可溶性和淀粉样蛋白的形式,表明光转化的效率不受融合的影响伙伴或溶解度(误差条表示生物三元位的标准偏差)。请点击此处查看此图的较大版本。
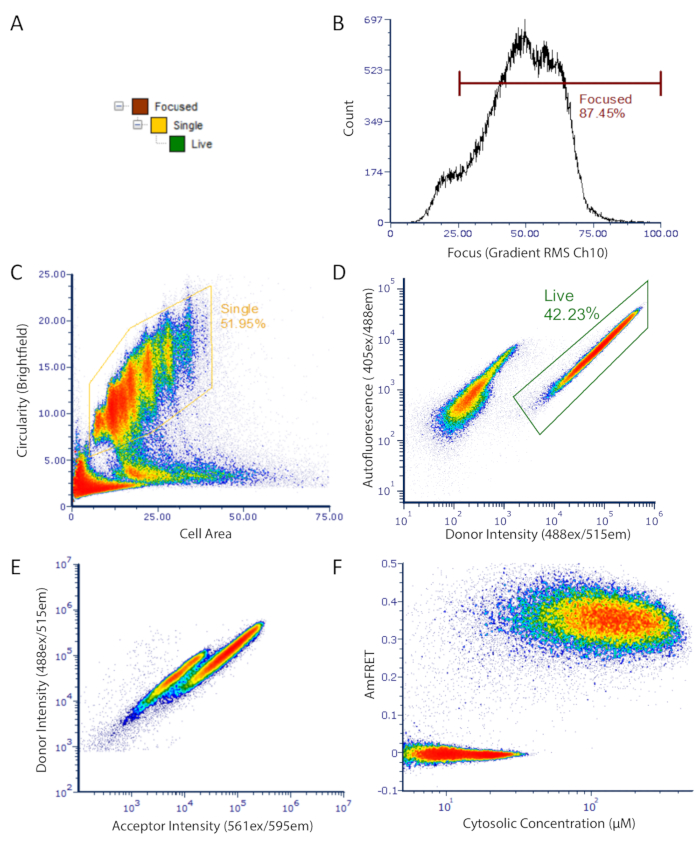
图 2:用于成像流式细胞测量数据的 DAmFRET 门控策略。门控策略用于分析仅集中、未布解的单个细胞,这些细胞具有低自荧光和表达荧光蛋白。(A) 门的层次结构,以获得重点良好的、活的、单的单元进行分析。(B) 明场通道梯度 RMS 的直方图.这种测量允许选择在透射光下正确聚焦的细胞。(C) 圆形的密度图与表示未布状球形单细胞的封闭总体的区域。(D) 密度图显示自荧光 (Ch07) 与供体荧光 (Ch02) 强度,显示表达细胞(门控)和暗细胞的单独群体。(E) 供体与受体强度的散射图,显示供体和受体荧光之间的FRET在细胞的一个子集中明显丧失。(F) 最终 DAmFRET 情节.含有未组装蛋白质的细胞以零AmFRET为中心,而含有自组装蛋白的细胞则表现出积极的AmFRET值。图中的两个重叠种群表明,将蛋白质入微到高阶组件(如淀粉样蛋白)的有限屏障。请点击此处查看此图的较大版本。
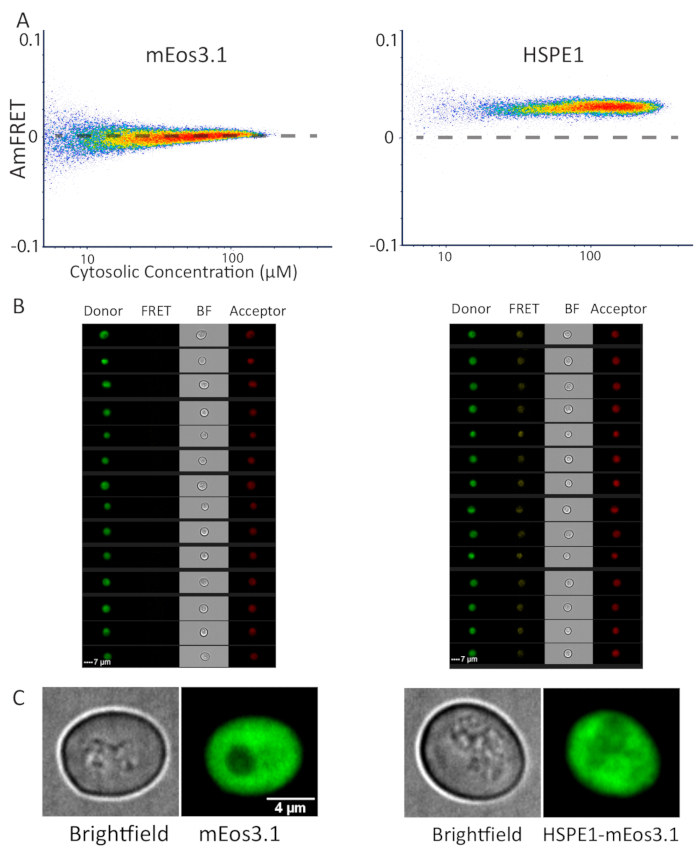
图 3:通过流式细胞学和显微镜对单体蛋白和半球蛋白的代表性数据。(A) 单体 mEos3.1 蛋白(左)和半球 HSPE1 的 DAmFRET 配置文件,标有 mEos3.1(右),显示由同质性程序集导致的比指标 FRET 增加。(B) 来自细胞仪的图像,表达 mEos3.1(左)和 HSPE1(右)的细胞,显示在所有捕获的通道中。(C) 表达单体 mEos3.1(左)和 HSPE1(右)的酵母细胞的代表性图像。图像是共聚焦切片的总和投影。至少有50个细胞被成像,以证实这一观察。请点击此处查看此图的较大版本。
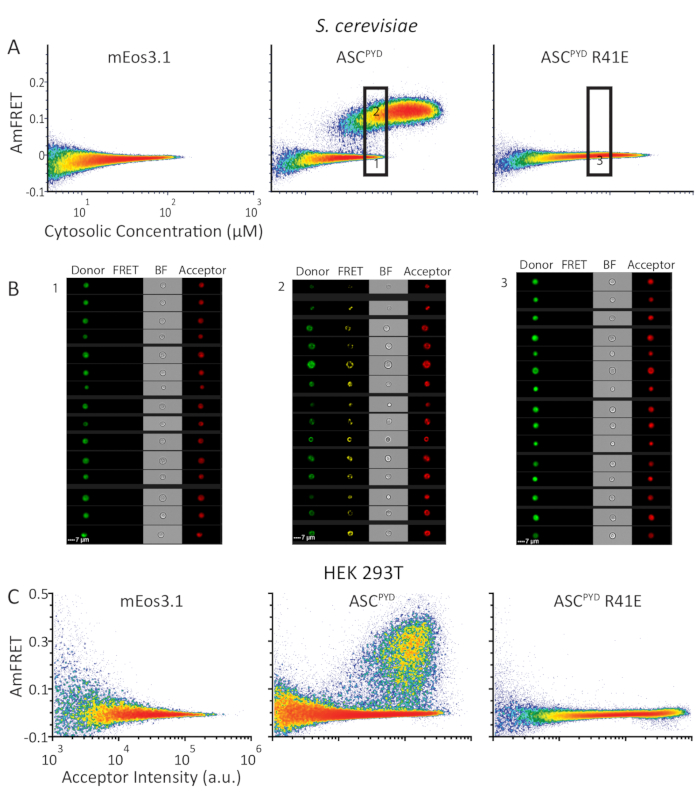
图 4: DAmFRET 配置文件显示人类 ASCPYD的类似自组装行为蛋白质在S. 塞雷维西亚和 HEK293T 细胞。(A) 密度图显示 AmFRET 与细胞浓度(在 μM 中)的 mEos3.1 (左), 或 mEos3.1 融合到 WT (中心) 或单卵变突变体 ASCPYD (右) 在S. cerevisa.。(B) 来自细胞仪的图像,来自下门和上门的细胞(分别左和中面板)表示 WT ASCPYD的图像;表示指示门的 ASCPYD R41E 的细胞(右侧面板)。(C) 密度图显示与 (A) 中相同系列的蛋白质的 AmFRET 与接受者强度,但以 HEK293T 细胞表示。请点击此处查看此图的较大版本。
讨论
DAmFRET 是检测体内蛋白质自组装的最全面的方法。DAmFRET 将高浓度、单细胞分辨率和高通量蛋白相互作用的直接读出相结合。直接读取 DAmFRET 和融合蛋白不需要特定的亚细胞定位或不溶性状态,消除了误报,并将其适用性扩展到其原生亚细胞位置的各种蛋白质。值得注意的是,通过标记细胞器与荧光团3.1在光谱上相容的荧光团,如T-蓝宝石和mCardinal,可以确定可溶性和组装形式的蛋白质的亚细胞定位与DAmFRET。
使用此处所述的成像流细胞仪,需要 8 小时分析每孔约 20,000 个门控单元的 96 孔板。但是,我们还定期使用标准(非成像)细胞仪执行 DAmFRET,以实现更高的吞吐量(每分钟最多 20 个样本)。事实上,任何具有空间分离的 488 和 561 nm 激光器的流式细胞仪,这些激光器没有对数和伪影,并且具有适当的 PMT 和滤波器来检测供体、FRET 和受体信号,足以执行 DAmFRET。目前,吞吐量的这种增加是以本地化信息和体积确定为代价的,因此,必须将自组装分析为蛋白质表达的函数,而不是浓度。这不是定性分析的问题。此外,通过将光谱上独特的荧光荧光酸熔融到内源性"内生"内生"内生"管理"蛋白质,其表达与细胞体积密切相关,可以估计细胞体积。
正如我们在酵母和哺乳动物细胞中部署DAmFRET所证明的那样,DAmFRET可以很容易地适应不同的表达系统。这使得蛋白质的自组装可以在其原生细胞环境中被研究。此外,它还能够比较不同细胞培养模型的蛋白质组装,以研究控制蛋白质自组装的机制的保存。
披露声明
作者声明没有相互竞争的利益。
致谢
我们要感谢杰夫·兰格、杰伊·恩鲁、吴建正、塔里克·汗和埃伦·凯特为开发测定所做的工作。这项工作的部分原因是,作为分别在英国开放大学和美国斯托尔斯医学研究所研究生院注册的学生,T.S.K.和A.R.G的博士博士理论研究要求。其他与测定相关的信息可在https://doi.org/10.1016/j.molcel.2018.06.016中找到。本手稿的原始数据可以从 http://www.stowers.org/research/publications/libpb-1372 的 Stowers 原始数据存储库访问。这项工作由NIH主任的早期独立奖DP5-OD009152、Dimes基金会第5-Fy17-32期赠款和斯塔斯医学研究所资助。
作者贡献如下。概念化:T.S.K.、S.V.和R.H.;方法:T.S.K.、S.V.、A.R.G.和A.B;调查:S.V.、T.S.K.和A.R.G.;正式分析:S.V.和T.S.K.;数据整理:T.S.K.;可视化:T.S.K 和 S.V.,写作(原稿):S.V.和 T.S.K.;写作(审阅、编辑):R.H.、S.V.和T.S.K.;和融资收购:R.H.
材料
| Name | Company | Catalog Number | Comments |
| 96 Well Plate | Axygen | P96-450R-C-S | |
| ASC 2-92 (mammalian plasmid) | rhm1.0095 | Available on request | |
| ASC 2-92 (R41E) (mammalian plasmid) | rhm1.0096 | Available on request | |
| ASC 2-92 (R41E) (yeast plasmid) | rhx2432 | Available on request | |
| ASC 2-92 (yeast plasmid) | rhx2431 | Available on request | |
| Centrifuge | Eppendorf | 5430R | "centrifuge" in text |
| CSM -Ura | Sunrise Science Products | 1004-100 | |
| Dextrose | EMD Millipore | DX0145-5 | |
| DMEM | Gibco | 11966025 | |
| EDTA | Sigma-Aldrich | EDS-500G | |
| FCS Express 6 | DeNovo | FCS Express 6 Flow | "flow cytometry software" in text |
| Fetal Bovine Serum | VWR Life Science | 45001-108 | |
| Flow Cytometer | BioRad | ZE5 | Non-imaging flow cytometer |
| FUGENE HD | Promega | E2311 | "transfection reagent" in text |
| Galactose | VWR Life Science | 0637-500g | |
| HSPE1 (yeast plasmid) | rhx1531 | Available on request | |
| Imaging Flow Cytometer | EMD Millipore | ImageStream X Mark II | "imaging flow cytometer" in text |
| Mammalian Cells | HEK293T | ||
| mEos3.1 (mammalian plasmid) | rhm1 | Available on request | |
| mEos3.1 (yeast plasmid) | rhx0935 | Available on request | |
| optiMEM | Gibco | 31985062 | "reduced serum media" in text |
| PBS | VWR Life Science | 45000-446 | |
| PenStrep | Gibco | 15070063 | |
| PFA | Sigma-Aldrich | P6148-1KG | |
| Photoconversion Lamp | OmniCure | S1000 | |
| Plasmid #54525 | Addgene | #54525 | "publicly available plasmid" in text |
| Titramax 1000 Plate Shaker | Heidolph Instruments | 1000 | "plate shaker" in text |
| Trypsin-EDTA | Gibco | 25200056 | |
| Yeast Strain | rhy1713 | Available on request- S288c (MATα lyp1Δ can1Δ::STE2pr_SpHIS5 his3Δ1 leu2Δ0 ura3Δ0 met15Δ0 cln3Δ0::GAL1pr_WHI5_hphMX) |
参考文献
- Krissinel, E., Henrick, K. Inference of macromolecular assemblies from crystalline state. Journal of Molecular Biology. 372 (3), 774-797 (2007).
- Kühner, S., van Noort, V., et al. Proteome organization in a genome-reduced bacterium. Science. 326 (5957), 1235-1240 (2009).
- Marianayagam, N. J., Sunde, M., Matthews, J. M. The power of two: protein dimerization in biology. Trends in Biochemical Sciences. 29 (11), 618-625 (2004).
- Matthews, J. M., Sunde, M. Dimers, oligomers, everywhere. Advances in Experimental Medicine and Biology. 747, 1-18 (2012).
- Glover, J. R., Kowal, A. S., Schirmer, E. C., Patino, M. M., Liu, J. J., Lindquist, S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell. 89 (5), 811-819 (1997).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Michaels, T. C. T., Dear, A. J., Knowles, T. P. J. Stochastic calculus of protein filament formation under spatial confinement. New journal of physics. , (2018).
- Khan, T., Kandola, T. S., et al. Quantifying Nucleation In Reveals the Physical Basis of Prion-like Phase Behavior. Molecular Cell. 71 (1), 155-168 (2018).
- Cai, X., Chen, J., et al. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation. Cell. 156 (6), 1207-1222 (2014).
- Lu, A., Magupalli, V. G., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Zhang, M., Chang, H., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nature Methods. 9 (7), 727-729 (2012).
- Gietz, D., Jean, A., Woods, R. A., Schiestl, R. H. Improved method for high efficiency transformation of intact yeast cells. Nucleic Acids Research. 20 (6), 1425(1992).
- Nishizawa, K., Kita, Y., Kitayama, M., Ishimoto, M. A red fluorescent protein, DsRed2, as a visual reporter for transient expression and stable transformation in soybean. Plant Cell Reports. 25 (12), 1355-1361 (2006).
- Luke, K., Apiyo, D., Wittung-Stafshede, P. Dissecting homo-heptamer thermodynamics by isothermal titration calorimetry: entropy-driven assembly of co-chaperonin protein 10. Biophysical Journal. 89 (5), 3332-3336 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。