Method Article
Algılama ve ölçme protein Self-montaj In vivo tarafından akış sitometri
Bu Makalede
Özet
Bu makalede, her iki S. cerevisiae ve HEK293T hücrelerinde protein kendinden montajı ölçmek için fret tabanlı akış sitometri Protokolü açıklanır.
Özet
Proteinli Self-montaj protein fonksiyonunu yönetir ve uzay ve zamanda hücresel süreçleri bölümlere ayırarak. Düşük hassasiyet, dolaylı okuma-çıkışları, sınırlı verim ve/veya tek hücreli çözünürlük yerine nüfus düzeyinde etkilenmesini incelemek için geçerli Yöntemler. Tüm bu sınırlamaları ele alan bir akış sitometri tabanlı tek metodoloji tasarladık: dağıtılmış Amphifluoric FRET veya DAmFRET. DAmFRET algılar ve hassasiyetli emisyon FRET in vivo tarafından protein kendinden montajları nicelik, model sistemleri arasında dağıtım sağlar-Maya insan hücrelerine-ve hassas elde, tek hücreli, yüksek verim okuma-çıkışları ne olursa olsun protein Yerelleştirme veya çözünürlüğe.
Giriş
Homotipik protein etkileşimlerini incelemek için, ya da "kendi kendine montaj" önemlidir çünkü Oligomerik devlet ve proteinlerin çözünürlüğünü işlevlerini dikte. Proteom homo-multimers1,2,3,4ile doludur, nispeten az protein monomerler olarak işlev ancak. Proteinler ayrıca stres, Yaş veya yanlış düzenleme nedeniyle, Faaliyetteki patolojik değişikliklere yol açan bir şekilde birleştirilebilir. Bu tür olaylar, hatta montajların fiziksel doğası modüle faktörleri tanımlamak, genellikle son derece zordur.
Protein artan sayıda artık kendi kendine olağanüstü kooperatiflik ve belirsiz stoichiometri ile birleştirmek için tanınır, diğer hücresel bileşenlerden kendi demixing sonuçlanan, proteinin yoğun faz olarak. Bunlar, damlacıklar ve jeller gibi düzensiz yoğuşanlar veya amiloid lifleri gibi yüksek sipariş edilen filam formları alır. İkincisi ile ilgili Konformasyonel dalgalanmalar ilk oluşumu, veya nükle, doğal olarak moleküler düzeyde5,6olasılıksal render. Çünkü çekirdeklenme olasılığı hacim ile ölçekler, bu tür montajların oluşumu son derece Stokastik yaşam hücrelerinin uzamsal sınırlar içinde olabilir7,8. Stokastik nüklinin aşırı-sınırlı faz ayrımı Prions, sadece nadiren kendiliğinden nükstür yüksek sipariş protein meclisleri, ancak bir kez oluşmuş, sonsuza kadar kendi büyüme şablonu. ASC olarak bilinen bu tür bir protein, memelinin doğuştan gelen bağışıklık hücrelerinin aktivitesinde dijital prion benzeri bir anahtar yürütür. ASC Self-montajı, bağlayıcı patojen veya tehlikeyle ilişkili moleküler desenler üzerine oligomerize olan spesifik proteinlerle etkileşimi ile çekirdeklenmiş. ASC derlemeleri sırayla nüksleme procaspase-1 kendi kendine birleştirmek ve etkinleştirmek için, hücrenin sitokin olgunlaşma ve pyroptosis yol9,10. ASC 'in montajdan sorumlu bölgesi, insan proteomunda 100 ' den fazla üyeden oluşan ölüm alanı süper ailesine aittir. Doğuştan gelen bağışıklık ve programlanmış hücre ölümü ölüm etki alanlarının önemli rolleri rağmen, çoğu henüz kendi kendine saygı ile karakterize değil-montaj. Bu tür davranışlara sahip ek proteinlerin keşfi ve karakterize edilmesi, protein kendi kendine montajının doğrudan, tek hücreli bir okunmasıyla büyük ölçüde kolaylaştırılır.
Boyut-dışlama Kromatografi ve ultrakentüklasyon gibi protein kendi kendine montajını incelemek için klasik protein biyokimyası yaklaşımlar büyük ölçüde nüfus düzeyi değerlendirmelerini sınırlıdır. Ancak, çekirdekleme sınırlı Faz geçişleri kaynaklanan hücre-hücre heterojenlik bu ayrıntı düzeyi ile modellenemez. Floresan mikroskopiye dayanan tek hücreli yaklaşımlar bu yeteneği yeniden kazanmaktadır, ancak çekirdekleri doğru şekilde ölçmek veya nadir montajları tespit etmek için gerekli verim eksikliği. Dahası, çoğu enzimler ve önceden amiloid oligomers gibi çözünür Self-montajlar, standart ışık mikroskobu ile çözülmesi için çok küçük ve mobil. Floresan korelasyon spektroskopisi gibi daha sofistike yaklaşımlar ile tespit edilebilir, ancak bunlar hücre numarası ve verimi ile çok sınırlıdır.
FRET ve bölünmüş fluorophore complementation gibi protein montajında yakınlık tabanlı asder, bu sorunlara potansiyel bir çözüm sunar. Ancak, genellikle iki farklı yapıları tamamlayıcı etiketleri için erimiş faiz protein ifade kullanımı gerektirir-donör ve FRET durumunda alıcı fluorophores. Bu, deneysel verimi tehlikeye atmakta ve aynı zamanda, donör ve alıcısı göreli düzeylerde hücre-hücre varyasyonu nedeniyle duyarlılık azaltır. Bunu aşmak için, biz bir photoconvertible fluorophore istihdam bir tahlil tasarlanmış, mEos 3.111, tek bir yapı hem donör ve Acceptor etiketli protein ifade sağlar. Dönüştürülmüş mEos 3.1 (GFP-benzeri donör) emisyon spektrumunu yeterli fotodönüştürülmüş mEos 3.1 (dsRed-gibi Acceptor) uyarma spektrum ile çakışıyor moleküller yakın olduğu zaman FRET gerçekleşmesi için izin (< 10 Nm). Böylece, 405 nm ışık bir ampirik olarak belirlenen dozda hücreleri göstererek, hangi fotodönüştürür toplam mEos 3.1 optimum fraksiyonu alıcı formu içine, biz birden fazla numune boyunca donör ve Acceptor tutarlı ve tekrarlanabilir göreli seviyeleri elde, ifade düzeyleri ve deneyler. 561 nm ışık veya dolaylı olarak (donörden enerji transferiyle) 488 nm ışık (yani, hassaslaştırılmış emisyon FRET) ile doğrudan heyecanlı olduğunda alıcı floresans ölçmek. Protein montajını bu iki değerin oranı ve amphifluorik FRET veya Ayfret terimi olarak bildiriyoruz.
Akış sitometrisi ile protein konsantrasyonunu hesaplamak için, ilk olarak mEos 3.1 ile etiketlenmiş Spc42 ortalama floresan yoğunluğunu hesaplıyoruz. Maya hücreleri Spc42 yaklaşık 1000 molekülleri içerdiğinden, daha sonra tek bir floresan yeşil mEos 3.1 molekül floresan yoğunluğu hesaplamak. Tüm hücresel konsantrasyonlarda bile photoconversion yararlanarak (Şekil 1E), biz daha sonra fotodönüşüm aşağıdaki tüm Acceptor yoğunlukları Için toplam MEOS 3.1 floresans değerleri ilişkilendirir. Daha sonra yaklaşık sitosolik hacim (görüntüleme akışı sitometrisi kullanılarak belirlendiği gibi) ile floresan proteinlerin toplam sayısını bölebiliyoruz ve bu da faiz proteininin toplam siterik konsantrasyonunu elde eder. Tam hesaplamalar için lütfen orijinal makalenin8' ine bakın.
MEos 3.1-Fused protein Maya bir 2Μ plazmid ifade ederek, her örnek8protein konsantrasyonu yaklaşık bin kat aralığı prob. Biz transfeksiyon sırasında Plasmid Alım varyasyon nedeniyle HEK293T hücrelerde aynı elde, ve bu nedenle değişken kopya numarası.
En fazla binlerce hücre için, Ayfret veya DAmFRET dağılımı, her türlü ilgi proteini için siterin kendi kendine montajının konsantrasyonu-bağımlılığını ortaya çıkarır. Genel olarak, DAmFRET bulmak ve duyarlılık, verim ve yeniden Üretilebilirlik görülmemiş bir kombinasyonu ile protein Self-montajı karakterize etmek için bir etkinleştirme metodolojisi temsil eder.
Bir görüntüleme sitometresi kullanırken bizim vivo protein konsantrasyonu ölçümleri elde etmek için bize sağlar, bu tür sitometreler henüz çoğu araştırma kurumlarında mevcut değildir. Yine de, damfret protein ifadesi aralığında protein montajı dağıtımları almak için tipik olmayan bir görüntüleme sitometresi bile çalıştırılabilir.
Protokol
1. DAmFRET tahlil için Saccharomyces cerevisiae hazırlanması
- Faiz proteini ifade eden 2Μ galaktoz indüklenebilir Plasmid ile deneysel olarak ilgili maya suşları Transform8 ya da C veya N Terminus Ile MEOS 3.1 standart bir lityum asetat Protokolü12 kullanarak Tagged.
- Sıvı kültüründe Maya büyümek.
- Her sorgu proteini için, aşılamak Maya kolonileri (dönüştürülmüş), triplicate içinde, her biri 200 μL uygun olmayan İndükleme büyüme medya (yani,% 2 dekstroz içeren medya, Maya azot tabanı ve amino asitler Plasmid seçimi için) bir 96-kuyu plaka ( Şekil 1C).
- 1,5 mm yörüngesinde 1200 rpm 'de 16 h için 30 °C ' de bir plaka çalkalayıcı ( malzeme tablosunabakın) üzerine sallayarak hücreleri inkük.
- Faiz gen ifade (16 h için temsilci protokol-bazı proteinler daha fazla veya daha az zaman alabilir).
- 16 indüksiyon h sonra, oda sıcaklığında 2 dakika için 2200 x g plaka spin (örnekleri Pelet için RT0.
- Ortamı güçlü Inversion ile kaldırın. 200 μL uygun indüksiyon medyası ile resuspend hücreleri (örn.,% 2 galaktoz, Maya nitrojen tabanı ve plazmid seçimi için amino asitler içeren medya). Bkz. Şekil 1C.
- 12 h için 30 °C ' de sallayarak hücreleri inkük.
- Santrifüjden ( malzeme tablosunabakın) 2200 x g 'de plaka, RT 'de 2 dk. örnekleri Pelet 'e kadar Ortamı güçlü Inversion ile kaldırın. 200 μL indüksiyon medyası ile resuspend hücreler.
- 1200 rpm 'de 30 °C ' de daha fazla 4 saat sallayarak hücreleri inkük. Taze medyada bu Resuspension 4 h önce DAmFRET çalıştırmak için olmalıdır, amacıyla autofluorescence azaltmak için.
2. mammalin Plasmid oluşumu
- Bir kurucu organizatör ve MEOS 3.1 olan bir memeli vektör oluşturmak için bir yer tutucu ile ilgi geni ve aralarında bir bağlayıcı eklemek için.
Not: Biz bir altın kapı uyumlu vektör, M1, bir halka Açık Plasmid ( malzeme tablosunabakın) aşağıdaki değişikliklerle inşa: mevcut bir bsai site bir nokta mutasyon G tarafından kaldırıldı a (pozisyon 3719 olarak yatırılan göre sıra). MEOS 3.1, I157V adresinde fluorophore tarafından siteye yönlendirilmiş mutagenez kullanılarak elde edilmiştir. 4 x (eaaar) bağlayıcı tarafından izlenen ters bsai siteleri, Gibson montaj tarafından, CMV organizatör ve MEOS 3.1 arasında çerçeve içinde son M1 vektörü üretmek için eklenmiştir. Protein ifadesi CMV arttırıcı ve promotör tarafından tahrik edilir; bazılarında SV40 Poliadenilasyon sinyali ile transkripsiyon sonlandırma. - Oluşturulan vektör ile uyumlu ekler kitaplığı oluşturun.
Not: Biz, CMV organizatör ve 4X (eaaar)-MEOS 3.1 arasında M1 içine ligasyon için bsai siteleri tarafından çevrelenmiş sentetik doğrusal parçalar (bkz. malzeme tablosu) olarak altın kapı montaj için bizim ekler sipariş.
3. mammalin hücre kültürü ve transfeksiyon
- Kültür HEK293T hücrelerinde DMEM + 10% FBS + 1x PenStrep medyada 37 °C ' de 5% CO2.
- Transfeksiyon öncesinde gün, 2 mL medya ile 6-kuyu plakasında 5 x 105 hücreli tohum.
- 3:1 (transfeksiyon reaktif: DNA) oranındaki transfeksiyon reaktif ( malzeme tablosunabakın) kullanılarak 2 μg PLASMID DNA ile transfect hücreleri. 150 içinde bileşenleri karıştırın azaltılmış serum medya μL (bkz. malzeme tablosu) ve RT 15 dakika boyunca Inkük, her kuyu için mix eklemek ve protein ifadesi için 48 h için inküserat.
- Epifluorescence mikroskobu (488 nm uyarma, 515 nm emisyonu) ile 24 saat sonra protein ifadesini onaylayın.
4. DAmFRET tahlil için memelinin hücrelerinin hazırlanması
- Protein ifadesinin 48 h sonra, her iyi ve dikkatle 1 mL 37 °C fosfat-tamponlu tuz (PBS) ile hücreleri yıkayın medya çıkarın. Yıkamayı takiben, PBS 'i Aspire.
- Ekle 0,5 mL tripsin-etylenediaminetetraacetic asit (EDTA) (0,25%) 37 °C ' de 5 dakika boyunca inkübe edilir.
- Her iyi, pelletini hücreler ve hiçbir büyük kümeleri görünür sağlamak için tam dmem medya 0,5 ml ekleyin.
- Her iyi 1,5 mL tüpler içine tüm hacmi aktarın.
- 1000 x g 'de Oda SıCAKLıĞıNDA (RT) 5 dakika boyunca hücreleri döndürün.
- PBS + 10 mm EDTA 1 ml süpernatant ve pelletini hücre Pelet çıkarın.
- 1000 x g 'de 5 dakika boyunca hücreleri RT 'de döndürün.
- Süpernatant kaldırmak ve 1 ml 4% civarında formaldehite (PFA) + 10 mm EDTA PBS içinde hücre Pelet pelletini.
- Sabit hareket ile bir sarsıntı tablosunda 5 dakika hücreleri düzeltin.
- 1000 x g de RT 'de 5 dk için hücreler döndürün.
- Süpernatant kaldırmak ve PBS 1 ml hücre Pelet pelletini + 10 mm EDTA.
- 1000 x g de RT 'de 5 dk için hücreler döndürün.
- Süpernatant çıkarın ve cytometri çalıştırmak için tampon yeterli hacimli hücreleri pelletini (1 iyi bir 96-kuyu plaka kullanımı 200 μL PBS + 10 mm EDTA).
- Bir yuvarlak alt 96-Well plaka bir kuyu için resuspended hücreleri aktarın.
5. tahlil için Maya ve memelinin hücrelerinin photoconversion
- Bir UV lambası kullanarak hiçbir kapak ile bir Mikroplaka örnekleri photoconvert ( malzeme tablosunabakın) ile donatılmış bir 320-500 Nm (menekşe) filtre ve bir kiriş Kolimatör, yerleştirilmiş 45 cm plaka üzerinde, bir süre için 25 dakika sallayarak. Bu koşullar, plakanın ışın gücü 11,25 mW/cm2olduğunda, yaklaşık 17.000 MJ/cm2 toplam foton dozunun8olduğu zaman uygundur.
6. DAmFRET veri toplama
- Tahlil hücreleri olmayan collinear 488/561 lazerler ile bir sitometresi kullanarak. Aşağıdaki veriler FRET hesaplaması için minimum gereksinimlere sahiptir.
- Donör floresans toplanması için 488 nm uyarma/515 nm Emisyon kanalı kullanın.
- FRET sinyalinin floresans toplanması için 488 nm uyarma/595 nm Emisyon kanalı kullanın.
- Bir 561 nm uyarma/595 nm Emisyon kanalı kullanın (488/595 kanal ile collinear olmayan) alıcı floresan toplanması için.
- Otofloresans8koleksiyonu için 405 nm uyarma/457 nm Emisyon kanalını kullanın.
- Hacim hesaplaması için bir aydınlık alan görüntü kanalı kullanın.
Not: S. cerevisiae için görüntüleme sitometresi ayarları aşağıdaki gibidir: düşük akış hızında ve yüksek hassasiyette 60x objektif; Lazer güçleri 15 MW 405 Nm, 15 MW 488 Nm, 20 MW 'da 561 Nm. HEK293T hücreler için görüntüleme sitometresi ayarları aşağıdaki gibidir: düşük debi ve yüksek hassasiyette 40X objektif; Lazer güçleri 15 MW 'da 405 Nm, 15 MW 'da 488 Nm, 20 MW 'da 561 Nm. Ayrıca, bizim görüntüleme sitometresi özel-uzamsal ayrılmış olması için tasarlanmış olduğunu unutmayın 488 nm ve 561 nm lazerler (yani, farklı kameralar) böylece Acceptor florcen gelen fret net çözünürlüğü elde etmek Ce.
- Bir floresan pozitif kapı içinde örnek başına 20000-50000 tek hücreler için veri toplayın.
- Üst boy oranı ve düşük boy oranı ve büyük ya da çok küçük hücre alanları sırasıyla olurdu yığınlı hücreler veya enkaz aksine küçük bir hücre alanı ile tek hücreler kapısı.
Not: görüntü olmayan bir sitometresi eşdeğer parametreler FSC (ileri dağılım) yaklaşık hücre boyutu ve SSC (yan dağılım) için hücre parçalı yapı vardır. Ayrıca, tek hücre gating için bir proxy olarak FSC darbe yüksekliği karşı darbe genişliğini kullanın. Ayrıca, cytometer duyarlılık üst sınırını aşan floresan değerleri olan olayları toplamak için çok önemlidir. Bizim görüntüleme cytometer, biz topladığımız her floresan kanal için Doygunluk sınırı daha az bir ham maksimum piksel değerine olayların toplanması kısıtlayın. Benzer şekilde, geleneksel akış sitometreler için, en yüksek yoğunluklu depo gözü (dinamik algılama aralığının ötesinde olayları içeren) veri noktaları analiz edilmemelidir.
- Üst boy oranı ve düşük boy oranı ve büyük ya da çok küçük hücre alanları sırasıyla olurdu yığınlı hücreler veya enkaz aksine küçük bir hücre alanı ile tek hücreler kapısı.
7. veri analizi
- Saf bağış sinyali ve saf alıcı sinyali13Için MEOS 3.1 'in kırmızı formuna benzer bir spektruma sahip olan monomerik DsRed2 için Photodönüştürülen MEOS 3.1 örneğini kullanarak tazminat gerçekleştirin. Daha fazla hassasiyet için, fret Dedektör kanalının da analiz programında bir yayılma hedef olarak kabul edildiğinden emin olun.
- Sadece floresan pozitif olan tek hücreleri seçmek için kapı örnekleri ( Şekil 2' de olduğu gibi).
- Total fret sinyalinin (488ex/595em) Toplam frekans Acceptor (561ex/595em) sinyaline bölünmesiyle Ayfret parametresini hesaplayın.
- Akış sitometri yazılımını kullanarak verileri görselleştirin ( malzeme tablosunabakın).
Not: Bu çalışmada S. cerevisiae Için Sitosolik konsantrasyonlar, Khan ve al.8' de olduğu gibi aşağıdaki ayarlarla hesaplanmıştır. Veri Analizi akış sitometri yazılımı kullanılarak yapılmıştır (bkz. malzeme tablosu).
Sonuçlar
Puan oluşturmaz oligomerlerin tespiti
Daha önce protein faz ayrımı karakterizasyonu için DAmFRET uyguladım, genellikle Floresan Mikroskobu da tespit edilebilir büyük protein montajları oluşumunda sonuçlanır. DAmFRET 'in uygulanabilirliğini göstermek için-sınırlı protein montajları, biz bir biyokimyasal olarak iyi karakterize protein, çok çok küçük ışık mikroskobu tarafından görselleştirilemeyecek şekilde ayrık homo-heptamers formları analiz: insan Co-chaperonin, HSPE114. Biz mEos 3.1 tek başına, ya da HSPE1-mEos 3.1 ifade Maya hücrelerinin DAmFRET profilleri karşılaştırıldı. İkincisi, üniforma pozitif Ayfret değerleri sergilenirken, eski sergilenen ihmal edilebilir olan Ayfret (Şekil 3A). Görüntüleme akışı sitometresi tarafından elde edilen hücrelerin görüntüleri (bkz. malzeme tablosu) her Iki MEOS 3.1-ve HSPE1-MEOS 3.1-ifade hücreleri (Şekil 3B) için tüm kanallar-donör, fret ve Acceptor differi floresan ortaya çıktı. Daha yüksek optik çözünürlükte bu bulgu onaylamak için, biz hücre birden fazla alan için z-yığınları yakalamak için Konfokal microkopi kullandık. Gerçekten de, floresan, hiçbir algılanamayan puncta ile, hücreler HSPE1-mEos 3.1 ya da tek başına fluorophore (Şekil 3c) ifade olup olmadığını, Siton boyunca eşit şekilde dağıtılır. HSPE1 karakterize Kd yaklaşık 3 μM hangi sistem duyarlılığı biraz altında olduğunu ve bu nedenle biz bu ayrık homo oligomer için beklenen olacaktır konsantrasyon fret sigmoidal ilişki gözlemlemek yok unutmayın. Yine de, biz damfret sağlam çözünür homo-oligomerizasyon içinde vivo tek hücreli çözünürlükte algılar sonuçlandırmak.
Nüklasyon-sınırlı montajların tespiti
DAmFRET 'un ayrık homo-oligomerleri Nükleler gibi sınırlandırılmış Montajlara göre ayırt etme yeteneğini göstermek için, insan inflammasom proteini ASC 'i analiz ettik. WT ASCPYD , in vivo olarakfilamat formları iken, ASCPYD 'nin etkin olmayan R41E mutant9,10değildir. Biz Maya hücreleri ya MEOS 3.1 tek başına veya MEOS 3.1 ya WT veya R41E ASCPYDiçin erimiş ifade. Tek başına fluorophore ya da ASCPYD mutant formu ifade Maya hücreleri tüm konsantrasyon aralığı üzerinde Ihmal edilebilir Ayfret sergilenmektedir, kendi kendine etkileşim için bir yetersizlik gösteren. Buna karşılık, WT ASCPYD iki nüfus Ile bir damfret profili sergiledi: bir Ihmal edilebilir ayfret ve yüksek ayfret ile diğer (Şekil 4A). Floresans görüntüleri (Şekil 4b) tarafından teyit edilen bu nüfus, yalnızca çözünür protein içeren hücreleri temsil eder veya bunun yerine çoğunlukla kendinden monte edilmiş protein içerir. Nüfus arasındaki kesintisiz ilişki ve çakışan konsantrasyonlarda ortaya çıkan gerçek, bir çekirdeklenme bariyerinin proteinin monomerik formunu sabitleyen ve deney süresi boyunca montajdan saklayabileceği anlamına gelir. 8. iki nüfus arasındaki ayıdaki boşluk, bir kez nükl oluştuğunda, yakın anında diğer monomerleri monte edilmiş forma şablonlar ve yeni bir istikrarlı devlet seviyesi elde eder. DAmFRET önceki yapısal verileri doğrulayarak mutant ASCPYD R41E bu ifade sistemi tarafından ulaşılabilen konsantrasyonlarda çekirdeklenme bozulur (Şekil 4A).
Meme hücrelerinde DAmFRET uygulanabilirlik
Maya hücreleri DAmFRET için ideal bir konak hücreleri olmasına rağmen, biz memeli hücrelere DAmFRET uygulanabilirliğini uzatmak için istenen. Fonksiyonel ASC polimerlerin neden olduğu hücre ölümü önlemek için, biz HEK293T hücrelerinde DAmFRET test caspase-1 ifade eksikliği. Biz Şekil 4AMaya hücrelerinde YAPTıĞıMıZ gibi HEK293T hücrelerinde aynı proteinlerin ifade. HEK293T hücrelerinde elde edilen DAmFRET profilleri niteliksel Maya hücrelerinde bu benzer (rakamlar 4A,C). Damfret, böylece, mikroskopik olarak görünür puan varlığı hem de hücre türü ne olursa olsun yüksek verim ile tek hücreli çözünürlükte çekirdekli protein Self-montajlar algılamak ve ölçmek için en çok yönlü in vivo yöntemi olarak hizmet vermektedir.
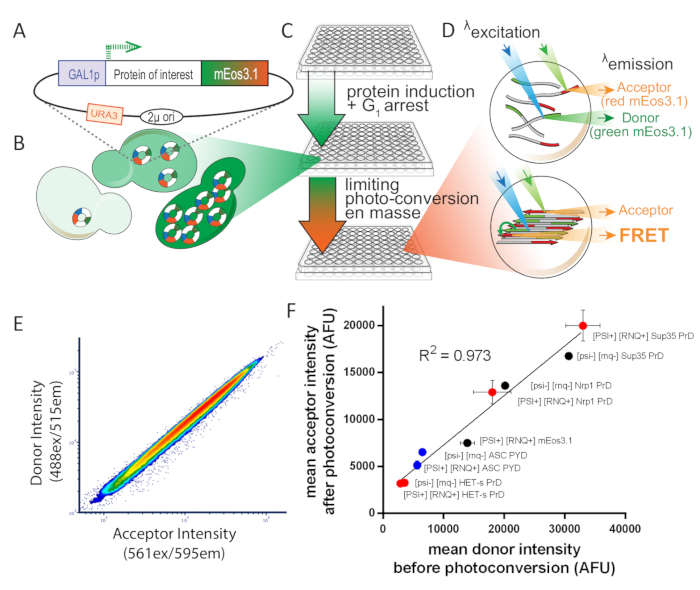
Şekil 1 : Deneysel tasarıma genel bakış S. cerevisiae. Bu rakam, Khan ve al.8 ' den izniyle uyarlanmıştır. (A) 2Μ Plasmid harita ilgi protein için açık okuma çerçevesi gösteren, Photoconvertible MEOS 3.1 ile etiketlenmiş ve bir indüklenebilir promotör tarafından tahrik. (B) maya hücrelerine dönüştürüldüğünde, 2Μ çoğaltma sistemi hücreler arasında yüksek kopya numarası değişkenliğini açar. Bu varyasyon, GAL1 Promoter transkripsiyon gürültü ile birlikte, hücrelerin bir nüfusu içinde protein ifadesi geniş bir dağılım sonuçlanır. (C) Maya DAmFRET tahlil için deneysel genel bakış. Tahlil için sağlıklı hücreler sağlamak için, koloniler ilk olarak proliferasyon için aşı 16 h sentetik medyada İndükleme olmayan karbon kaynağı içeren, dekstroz. Proliferasyon sonrasında, hücreler 16 h için İndükleme karbon kaynağı, galaktoz içeren sentetik ortama aktarılır. İndüksiyon aşağıdaki, hücreler kısmen ve eşit 405 nm ışık pozlama ile Photo, dönüştürülmüş. (D) numuneler daha sonra görüntüleme akışı sitometrisi kullanılarak analiz edilir. Yeşil ve kırmızı mEos 3.1 spektrumları ve yoğunlukları, sırasıyla bir FRET donör ve alıcı için iyi uygun hale. Birbirlerine yakın olduğunda, alt hücrede tasvir polimerde meydana gelen gibi, kırmızı moleküller yeşil moleküllerin uyarılması üzerine floresans olacaktır (FRET). (E) fotoğraf dönüşümü üzerine sıkı bir doğrusal ilişki gösteren alıcı yoğunlukları karşı donör arsa, fotodönüşüm verimliliği ifade düzeyine göre etkilenmez gösterir. (F), hem çözünür ve amiloid formları, her ikisi de çözülebilir ve amiloid formlar, çeşitli ifade hücrelerin nüfusu gelen donör yoğunlukları karşı ortalama Acceptor karşı Dağılım Arsa, fotodönüşüm verimliliği füzyon etkilenmez gösteren ortak veya çözünürlük (hata çubukları biyolojik triplicates standart sapmasını gösterir). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
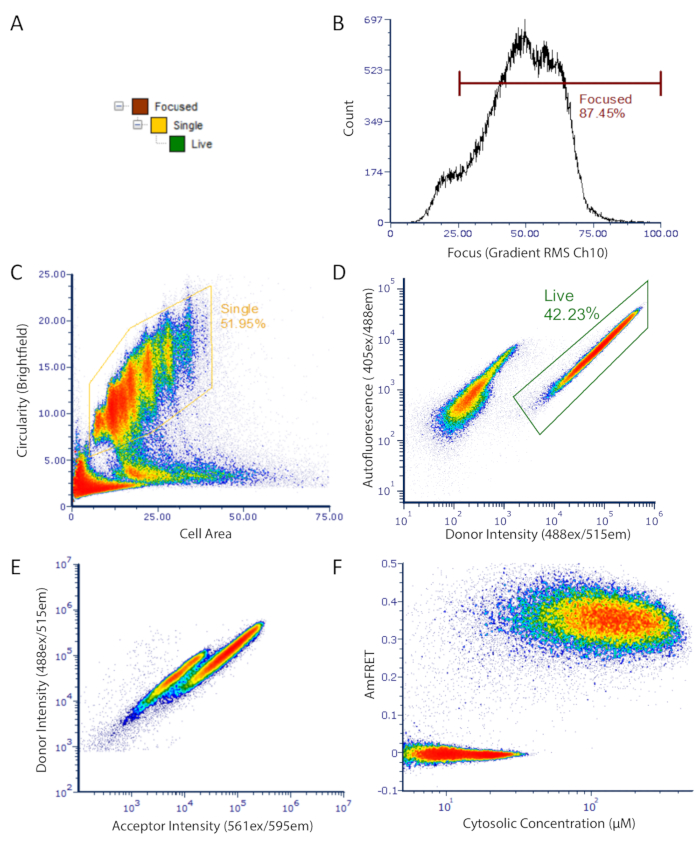
Şekil 2 : Görüntüleme akışı sitometri verileri için damfret gating stratejisi. Sadece odaklanmıştır analiz etmek için kullanılan gating stratejisi, düşük otofloresans olan ve floresan protein ifade unbudded tek hücreler. (A) analiz için iyi odaklı, canlı, tek hücreler elde etmek için kapıların hiyerarşisi. (B) aydınlık alan kanal gradyan RMS histogram. Bu ölçüm, iletilen ışık altında düzgün odaklanmıştır hücrelerin seçimi için izin verir. (C) unbudded küresel tek hücrelerin Gated nüfus gösteren bölgeye karşı döngüslik yoğunluğu arsa. (D) yoğunluk Arsa (Ch07) karşı donör Floresan (CH02 direksiyon) yoğunluğu ifade hücreler (gated) ve karanlık hücreler ayrı nüfus gösteren, otofloresans gösteren. (E) alıcı ve alıcı fluorophores arasında fret kaynaklanan, hücrelerin bir alt kümede donör floresan net bir kayıp gösteren alıcısı yoğunlukları karşı donör dağılım arsa. (F) final DAmFRET arsa. Monte edilmemiş protein içeren hücreler sıfır Ayfret etrafında ortalanır, kendi kendine montajlı protein içeren hücreler pozitif bir Ayfret değeri sergiler. Arsa içindeki iki çakışan nüfus, bu proteinin amiloid gibi daha yüksek sıralı Montajlara nükte etmesi için sınırlı bir bariyer göstergesidir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
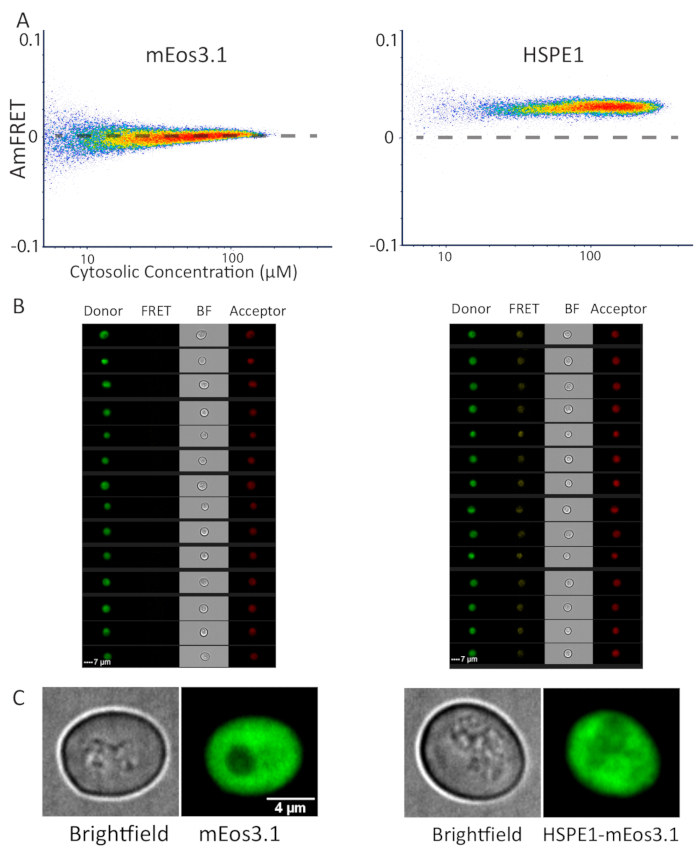
Şekil 3 : Akış sitometri ve mikroskobu ile monomerik ve heptamerik proteinlerin temsili veri. (A) monomerik MEOS 3.1 proteinin damfret profili (sol) ve HEPTAMERIK HSPE1 Ile etiketlenmiş MEOS 3.1 (sağda), homotipik montajdan kaynaklanan daha fazla RATIOMETRIK fret gösteriliyor. (B) tüm yakalanan kanallarda gösterilen MEOS 3.1 (sol) ve HSPE1 (sağda) ifade eden hücrelerin cytometer görüntüleri. (C) monomerik MEOS 3.1 (sol) ve HSPE1 (sağda) ifade Maya hücrelerinin temsilcisi görüntüleri. Görüntüleri Konfokal dilimleri toplamı projeksiyonları vardır. En az 50 hücre bu gözlem doğrulamak için görüntülenmiş. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
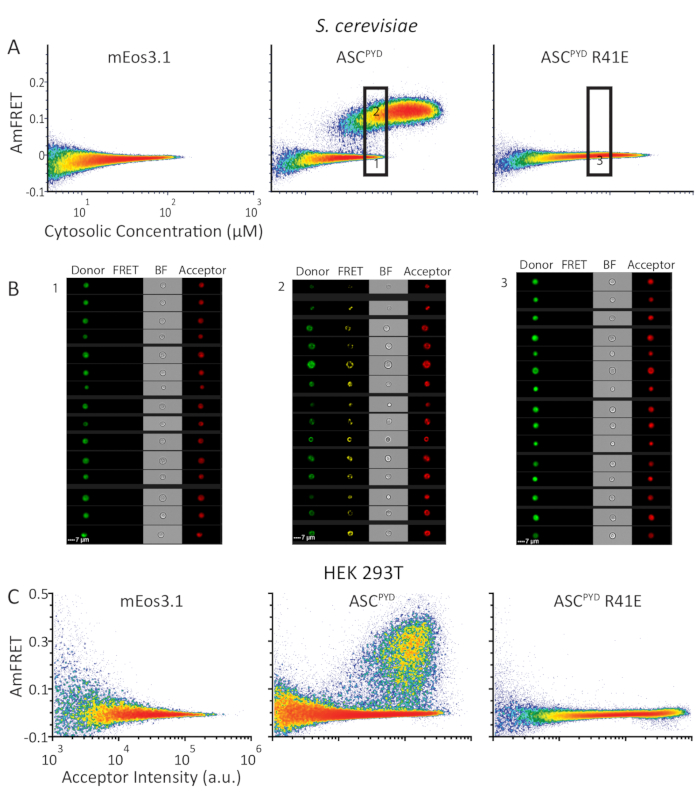
Şekil 4 : Damfret profilleri ınsan ASCPYD benzer kendi kendine montaj davranışını gösterir protein içinde S. cerevisiae ve HEK293T hücreler. (A) S. cerevisiae'de, MEOS 3.1 (sol) veya WT (merkez) veya MONOMERIZING mutant ASCPYD (sağda) ' nin (sağ) Sitosolik konsantrasyonu (μM cinsinden) Ile Ilgili olarak, asfret gösteren yoğunluk grafikleri. (B) WT ASCPYD'yi ifade eden, alt ve üst kapılardan (sırasıyla sol ve orta paneller) gelen hücrelerin cytometer 'dan görüntüleri; ve belirtilen kapı (sağ panel) ASCPYD R41E ifade hücreler. (C) (A) gibi aynı protein serisi için Alýcý yoğunluğunu gösteren ve HEK293T hücrelerinde ifade edilen yoğunluk grafikleri. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
DAmFRET, protein kendi kendine montajı içinde vivo algılamak için en kapsamlı yöntemdir. DAmFRET, tek hücreli çözünürlük ve yüksek verim ile geniş bir konsantrasyon yelpazesi üzerinde homotipik protein-protein etkileşimlerini doğrudan okuma-dışarı birleştirir. Damfret doğrudan okuma-out ve erimiş proteinler belirli bir hücre altı lokalizasyonu veya çözünmez devlet gerektirmez gerçeği yanlış pozitifleri ortadan kaldırır ve kendi yerel alt hücresel konumlarda proteinlerin geniş bir yelpazede uygulanabilirliğini genişletir. Özellikle, T-Sapphire ve mcardinal gibi MEOS 3.1 ile ışıksal uyumlu fluorophores ile organelleri etiketleme ile, çözünür ve Proteinler montajlı formları hücre altı lokalizasyonu damfret ile birlikte tespit edilebilir.
Burada açıklandığı gibi görüntüleme akışı sitometresi kullanarak, yaklaşık 20.000 Gated hücreleri ile bir 96-kuyu plaka analiz etmek için 8 h alır iyi. Ancak, ayrıca rutin olarak çok daha yüksek verim (dakikada 20 numunelere kadar) elde standart (olmayan görüntüleme) cytometre ile DAmFRET gerçekleştirin. Aslında, herhangi bir akış sitometresi ile dağınık olarak ayrılmış 488 ve 561 nm lazerler günlük amfi eserler ücretsiz ve uygun Pmts ve filtre donör algılamak için vardır, fret, ve Acceptor sinyalleri damfret gerçekleştirmek için yeterlidir. Şu anda, verimlilik bu kazanç yerelleştirme bilgi ve hacim belirlenmesi pahasına gelir, kendi kendine montaj daha sonra konsantrasyon yerine protein ifadesi bir fonksiyon olarak analiz edilmelidir gibi. Bu niteliksel analizler için bir sorun değildir. Ayrıca, ışıksal farklı bir fluorophore ile ifade sıkıca sitenik hacim ile ilişkilendirir endojen "temizlik" proteini eritme sitosolik hacminin tahmin etmek mümkün olabilir.
Hem Maya ve memelide hücrelerde DAmFRET bizim dağıtım aracılığıyla göstermiştir gibi, DAmFRET kolayca farklı ifade sistemlerine adapte edilebilir. Bu da kendi doğal hücresel bağlamlarında incelenecek proteinlerin kendi kendine montajını sağlar. Ayrıca, protein kendi kendine montajı yöneten mekanizmaların korunmasını incelemek için yaygın olarak farklı hücre-kültür modelleri arasında protein montajı karşılaştırmak için yeteneği sunuyor.
Açıklamalar
Yazarlar hiçbir rakip ilgi bildirir.
Teşekkürler
Biz Jeff Lange, Jay Unruh, Jianzheng Wu, Tarique Khan ve Ellen Ketter tahlil gelişimi yönünde çalışmaları için teşekkür etmek istiyorum. Bu iş, kısmen, T.S.K. ve A. R. G için doktora tezi araştırmaları için açık üniversite, INGILTERE ve Stowers Enstitüsü Tıp araştırma lisansüstü Okulu, ABD, sırasıyla kayıtlı olarak ihtiyaçlarını yerine getirmek için yapıldı. Ek tahlil ile ilgili bilgiler https://doi.org/10.1016/j.molcel.2018.06.016 adresinde bulabilirsiniz. Bu yazıda temel alınan orijinal veriler http://www.stowers.org/research/publications/libpb-1372 adresinde bulunan Stowers Original veri deposundan erişilebilir. Bu çalışma NıH yönetmen erken bağımsızlık Ödülü DP5-OD009152, Mart Dimes Vakfı Grant No 5-FY17-32 ve Stowers Enstitüsü tıbbi araştırma tarafından finanse edildi.
Yazar Katkıları aşağıdaki gibidir. Kavramsallaşma: T.S.K., SV ve bağıl nem; Metodoloji: T.S.K., SV, A.R.G., ve A. B; Soruşturma: SV, T.S.K. ve A.R.G.; Resmi analiz: SV ve T.S.K.; Veri Kürasyonu: T.S.K.; Görselleştirme: T. S. K ve SV, yazma (orijinal Draft): SV ve T.S.K.; Yazma (Inceleme, düzenleme): bağıl nem, SV ve T.S.K.; ve finansman edinme: bağıl
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96 Well Plate | Axygen | P96-450R-C-S | |
| ASC 2-92 (mammalian plasmid) | rhm1.0095 | Available on request | |
| ASC 2-92 (R41E) (mammalian plasmid) | rhm1.0096 | Available on request | |
| ASC 2-92 (R41E) (yeast plasmid) | rhx2432 | Available on request | |
| ASC 2-92 (yeast plasmid) | rhx2431 | Available on request | |
| Centrifuge | Eppendorf | 5430R | "centrifuge" in text |
| CSM -Ura | Sunrise Science Products | 1004-100 | |
| Dextrose | EMD Millipore | DX0145-5 | |
| DMEM | Gibco | 11966025 | |
| EDTA | Sigma-Aldrich | EDS-500G | |
| FCS Express 6 | DeNovo | FCS Express 6 Flow | "flow cytometry software" in text |
| Fetal Bovine Serum | VWR Life Science | 45001-108 | |
| Flow Cytometer | BioRad | ZE5 | Non-imaging flow cytometer |
| FUGENE HD | Promega | E2311 | "transfection reagent" in text |
| Galactose | VWR Life Science | 0637-500g | |
| HSPE1 (yeast plasmid) | rhx1531 | Available on request | |
| Imaging Flow Cytometer | EMD Millipore | ImageStream X Mark II | "imaging flow cytometer" in text |
| Mammalian Cells | HEK293T | ||
| mEos3.1 (mammalian plasmid) | rhm1 | Available on request | |
| mEos3.1 (yeast plasmid) | rhx0935 | Available on request | |
| optiMEM | Gibco | 31985062 | "reduced serum media" in text |
| PBS | VWR Life Science | 45000-446 | |
| PenStrep | Gibco | 15070063 | |
| PFA | Sigma-Aldrich | P6148-1KG | |
| Photoconversion Lamp | OmniCure | S1000 | |
| Plasmid #54525 | Addgene | #54525 | "publicly available plasmid" in text |
| Titramax 1000 Plate Shaker | Heidolph Instruments | 1000 | "plate shaker" in text |
| Trypsin-EDTA | Gibco | 25200056 | |
| Yeast Strain | rhy1713 | Available on request- S288c (MATα lyp1Δ can1Δ::STE2pr_SpHIS5 his3Δ1 leu2Δ0 ura3Δ0 met15Δ0 cln3Δ0::GAL1pr_WHI5_hphMX) |
Referanslar
- Krissinel, E., Henrick, K. Inference of macromolecular assemblies from crystalline state. Journal of Molecular Biology. 372 (3), 774-797 (2007).
- Kühner, S., van Noort, V., et al. Proteome organization in a genome-reduced bacterium. Science. 326 (5957), 1235-1240 (2009).
- Marianayagam, N. J., Sunde, M., Matthews, J. M. The power of two: protein dimerization in biology. Trends in Biochemical Sciences. 29 (11), 618-625 (2004).
- Matthews, J. M., Sunde, M. Dimers, oligomers, everywhere. Advances in Experimental Medicine and Biology. 747, 1-18 (2012).
- Glover, J. R., Kowal, A. S., Schirmer, E. C., Patino, M. M., Liu, J. J., Lindquist, S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell. 89 (5), 811-819 (1997).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Michaels, T. C. T., Dear, A. J., Knowles, T. P. J. Stochastic calculus of protein filament formation under spatial confinement. New journal of physics. , (2018).
- Khan, T., Kandola, T. S., et al. Quantifying Nucleation In Reveals the Physical Basis of Prion-like Phase Behavior. Molecular Cell. 71 (1), 155-168 (2018).
- Cai, X., Chen, J., et al. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation. Cell. 156 (6), 1207-1222 (2014).
- Lu, A., Magupalli, V. G., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Zhang, M., Chang, H., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nature Methods. 9 (7), 727-729 (2012).
- Gietz, D., Jean, A., Woods, R. A., Schiestl, R. H. Improved method for high efficiency transformation of intact yeast cells. Nucleic Acids Research. 20 (6), 1425(1992).
- Nishizawa, K., Kita, Y., Kitayama, M., Ishimoto, M. A red fluorescent protein, DsRed2, as a visual reporter for transient expression and stable transformation in soybean. Plant Cell Reports. 25 (12), 1355-1361 (2006).
- Luke, K., Apiyo, D., Wittung-Stafshede, P. Dissecting homo-heptamer thermodynamics by isothermal titration calorimetry: entropy-driven assembly of co-chaperonin protein 10. Biophysical Journal. 89 (5), 3332-3336 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır