Method Article
フローサイトメトリーによる生体内におけるタンパク質自己集合体の検出と特性特性
要約
本稿では、S.セレビシエ細胞とHEK293T細胞の両方でタンパク質自己集合を定量するFRETベースのフローサイトメトリープロトコルについて説明する。
要約
タンパク質の自己組立は、タンパク質機能を制御し、空間と時間の細胞プロセスを区分します。それを研究する現在の方法は、単一細胞分解能ではなく、低感度、間接的な読み出し、限られたスループット、および/または母集団レベルに苦しんでいます。分散型フルーロ性FRETまたはDAmFRETというこれらの制限に対処するフローサイトメトリーベースの単一方法論を設計しました。DAmFRETは、生体内で感知された発光FRETによってタンパク質自己アセンブリを検出および定量化し、酵母からヒト細胞に至るモデルシステム間での展開を可能にし、タンパク質に関係なく、感度の高い単一細胞、高スループットの読み出しを実現します。ローカリゼーションまたは溶解性。
概要
同質性タンパク質相互作用を研究するアッセイ、または「自己組織化」は、タンパク質のオリゴマー状態および溶解性が機能を決定するので重要である。プロテオームはホモマルチマー1、2、3、4が豊富ですが、比較的少数のタンパク質がモノマーとして機能します。タンパク質はまた、ストレス、年齢、または誤った調節のために異常に組み立てることができ、活動の病理学的変化につながります。このようなイベントを調節する要因、またはアセンブリの物理的性質を特定することは、多くの場合、非常に困難です。
タンパク質の数が増えるにつれて、異常な協調性と不確定な組織学で自己集合化が認められ、その結果、タンパク質密度の高い相として他の細胞成分からそれらの分解が起こり得ます。これらは、液滴やゲルなどの無秩序な凝縮物、またはアミロイド繊維などの高度に順序付けされたフィラメントの形態をとる。後者に関連する立体構造の変動は、その初期形成、または核形成を、分子レベル5、6で本質的に確率的にレンダリングする。核形成の確率は体積に合わせて拡大するので、このようなアセンブリの形成は、生細胞7、8の空間的限界において非常に確率的であり得る。確率的核系の限られた相分離の極端には、プリオン、自発的に核を作ることはめったにないが、一度形成されると、無期限に独自の成長をテンプレート化する高度に順序付けされたタンパク質アセンブリである。ASCと呼ばれるそのようなタンパク質の1つは、哺乳類の自然免疫細胞の活性においてデジタルプリオン様スイッチを実行する。ASC自己組織化は、病原体または危険関連分子パターンとの結合時にオリゴマー化された特定のタンパク質との相互作用によって核化される。ASCアセンブリは、自己組織化して活性化するためにプロカスパーゼ-1を自ら核化し、細胞9、10のサイトカイン成熟およびピロプトシスにつながる。その組み立てを担当するASCの領域は、人間のプロテオームの100人以上のメンバーで構成される死ドメインスーパーファミリーに属しています。生来の免疫とプログラムされた細胞死における死ドメインの重要な役割にもかかわらず、それらのほとんどは、自己組織化に関してまだ特徴付けられていない。このような挙動を伴う追加タンパク質の発見と特徴付けは、タンパク質自己組織化の直接的な単細胞読み出しによって大いに促進される。
サイズ排除クロマトグラフィーや超遠心分離などのタンパク質自己組織化を研究する古典的なタンパク質生化学のアプローチは、主に集団レベルの評価に限定されます。しかし、核化制限相遷移に起因する細胞間不均一性は、この詳細レベルではモデル化できません。蛍光顕微鏡に基づく単一細胞アプローチは、この能力を取り戻しますが、核生成を正確に定量化したり、まれなアセンブリを検出するために必要なスループットが欠けています。さらに、ほとんどの酵素やアミロイド前オリゴマーなどの可溶性自己アセンブリは、標準的な光顕微鏡では解決するには小さすぎて移動性が高すぎる。蛍光相関分光法などのより高度なアプローチによって検出できますが、細胞数とスループットは非常に限られています。
FRETやスプリット蛍眼補体などのタンパク質アセンブリの近接ベースのアッセイは、これらの問題に対する潜在的な解決策を提供します。しかし、それらは一般に、FRETの場合にはドナーおよびインセプター蛍煙管の相補タグに融合した目的のタンパク質を発現する2つの異なる構造体の使用を必要とする。これは実験のスループットを損なうし、またドナーおよび受入者の相対的なレベルの細胞間変動による感受性を低下させる。これを回避するために、我々は、単一の構造がドナーと受入者タグ付きタンパク質の両方を発現することを可能にする光変換性蛍光体質素子、mEos3.111を採用したアッセイを設計しました。未変換mEos3.1(GFP様ドナー)の発光スペクトルは、光変換されたmEos3.1(dsRed様インセプター)の励起スペクトルと十分に重なり合い、分子が近接しているときにFRETが発生することを可能にします(<10 nm)。したがって、405nm光の経験的に決定された用量に細胞をさらすことによって、総mEos3.1の最適な割合を受け入れ器の形態に変換し、我々は複数のサンプルにわたってドナーおよび受入器の一貫した、再現可能な相対レベルを達成し、表現レベル、および実験。561 nm光で直接励起した場合、または488nm光(すなわち感光放出FRET)で間接的に(ドナーからのエネルギー伝達によって)励起すると、受け入れ器蛍光を測定します。タンパク質集合をこれら2つの値の比率として報告し、フルーロリックFRETまたはAmFRETという用語を提供します。
フローサイトメトリーでタンパク質濃度を計算するために、まずmEos3.1でタグ付けされたSpc42の平均蛍光強度を計算します。酵母細胞にはSpc42の約1000分子が含まれているため、単一の蛍光緑色mEos3.1分子の蛍光強度を計算します。すべての細胞濃度で均一な光変換を利用することにより(図1E)、我々は、光変換後のすべてのアクセプタ強度の合計mEos3.1蛍光値を相関させる。その後、蛍光タンパク質のモルの総数を近似細胞質体積(イメージングフローサイトメトリーを用いて決定)で除算し、目的とするタンパク質の総細胞細胞濃度を得ることができる。正確な計算については、原稿8を参照してください。
酵母の2μプラスミドからmEos3.1融合タンパク質を発現させることにより、サンプル8毎に約千倍のタンパク質濃度をプローブします。我々は、トランスフェクション中のプラスミド取り込みの変動によりHEK293T細胞で同じことを達成し、したがって可変コピー数を達成する。
何千もの細胞に対するAmFRET(DAmFRET)の結果として得られた分布は、目的のタンパク質に対する細胞内の自己組織化の濃度依存性を明らかにする。全体的に、DAmFRETは、感度、スループット、再現性の前例のない組み合わせでタンパク質自己組立を発見し、特徴付けることを可能にする方法論を表します。
イメージングサイトメーターを用いることで、生体内タンパク質濃度測定を行うことができましたが、このようなサイトメーターは、ほとんどの研究機関ではまだ利用できません。それにもかかわらず、DAmFRETは典型的な非イメージングサイトメーターでも実行することができ、タンパク質発現の範囲にわたってタンパク質アセンブリの分布を得ることができます。
プロトコル
1. DAmFRETアッセイに対するサッカロマイセスセレビシエの調製
- 標準的な酢酸リチウムプロトコル12を用いてmEos3.1を有するCまたはN終端のいずれかでタグ付けされた目的のタンパク質を発現する2μガラクトース誘導プラスミドを用いて実験的に関連する酵母株を変換する。
- 液体培養で酵母を成長させます。
- すべてのクエリタンパク質について、イノキュレート酵母コロニー(形質転換)、三量体中、それぞれ200μLの適切な非誘導成長培地(すなわち、2%デキストロースを含む培地、酵母窒素塩基およびアミノ酸を含む培地)を96ウェルプレート(プラスミドの選択用)に含む(図 1C)
- プレートシェーカー(材料の表を参照)で振りながら細胞をインキュベートし、1.5mmの軌道を1200rpmで16時間30°Cで回ります。
- 目的の遺伝子の発現を誘導する(16h-一部のタンパク質に対する代表的なプロトコルは、多かれ少なかれ時間がかかることがある)。
- 誘導の16時間に続いて、室温で2分間2200 x gでプレートを回転させます(RT0を試料をペレットします。
- 強制的な反転によってメディアを削除します。適切な誘導培地の200μLで細胞を再中断する(すなわち、2%ガラクトース、酵母窒素塩基およびアミノ酸を含む培地はプラスミドの選択用)。図 1Cを参照してください。
- 30°Cで12時間振りながら細胞をインキュベートします。
- 遠心分離機(材料の表を参照)は、サンプルをペレットするためにRTで2分間2200 x gのプレートを参照してください。強制的な反転によってメディアを削除します。誘導媒体の200 μLで細胞を再中断する。
- さらに4時間30°Cで1200rpmで振りながら細胞をインキュベートする。新鮮なメディアでのこのリサスペンションは、自己蛍光を低減するために、DAmFRETを実行する4時間前に行われるべきです。
2. 哺乳類プラスミドの作成
- 構成プロモーターとmEos3.1を持つ哺乳類ベクターを、目的の遺伝子とリンカーをそれらの間に挿入するプレースホルダを持つ構築する。
注:我々は、以下の変更で公的に利用可能なプラスミド(材料の表を参照)からゴールデンゲート互換ベクトル、M1を構築しました:既存のBsaIサイトは、ポイント変異GからA(堆積した位置3719)によって除去されました。シーケンス)。mEos3.1は、I157Vにおける蛍色素の部位指向変異体を用いて得られた。反転BsaI部位に続いて4x(EAAAR)リンカーが挿入され、ギブソンアセンブリにより、CMVプロモーターとmEos3.1の間のフレーム内に挿入され、最終的なM1ベクトルを生成した。タンパク質発現は、CMVエンハンサーとプロモーターによって駆動されます。SV40ポリアデニル化信号による転写終了。 - 構築されたベクトルと互換性のある挿入のライブラリを作成します。
注:私たちは、CMVプロモーターと4x(EAAAR)-mEos3.1の間のM1へのライゲーションのためのBsaIサイトによって側面された合成線形断片(材料の表を参照)としてゴールデンゲートアセンブリのインサートを注文します。
3. 哺乳類細胞培養とトランスフェクション
- DMEM+10%FBS+1xペンストレップ培養剤で培養HEK293T細胞を37°Cで5%CO2で培養した。
- トランスフェクションの前日に、2mLの培地を含む6ウェルプレートに種子5 x 105細胞を入れた。
- トランスフェクション試薬を用いて2μgのプラスミドDNAを持つトランスフェクト細胞(材料の表を参照)を3:1の比率で(トランスフェクション試薬:DNA)。還元された血清培地の150 μL(材料表参照)で成分を混合し、RTで15分間インキュベートし、各ウェルにミックスを加え、タンパク質発現のために48時間インキュベートします。
- エピ蛍光顕微鏡(488nm励起、515nm発光)により24時間後のタンパク質発現を確認する。
4. DAmFRETアッセイ用哺乳類細胞の調製
- タンパク質発現の48時間後、各ウェルから培温物を取り出し、37°Cのリン酸緩衝生理食生(PBS)の1mLで細胞を慎重に洗浄します。洗浄後、PBSを吸引する。
- トリプシン-エチレン科ミネテトラセチン酸(EDTA)の0.5 mLを追加 (0.25%)37 °Cで5分間インキュベートします。
- 各ウェルに0.5 mLの完全なDMEMメディアを追加し、セルを再サスペンドし、大きな塊が見えないようにします。
- 各井戸の全容積を1.5 mLチューブに移します。
- 室温(RT)で1000 x gで5分間セルをスピンします。
- PBS + 10 mM EDTAの1 mLで上清を取り出し、細胞ペレットを再中断します。
- RTで1000 x gで5分間細胞を回転させます。
- 上清を取り出し、1 mL 4% パラホルムアルデヒド(PFA)+10 mM EDTAで細胞ペレットを再中断します。
- 一定の動きでシェイクテーブル上で5分間セルを固定します。
- RTで1000 x gで5分間セルをスピンします。
- 上清を取り出し、1mLのPBS+10mM EDTAで細胞ペレットを再中断する。
- RTで1000 x gで5分間セルをスピンします。
- 上清を取り除き、サイトメトリー実行のための十分な量のバッファーで細胞を再中断します(96ウェルプレートの1ウェルはPBS+ 10 mM EDTAの200 μLを使用します)。
- 再懸濁した細胞を丸い底部96ウェルプレートの1つの井戸に移します。
5. アッセイに対する酵母細胞および哺乳動物細胞の光変換
- 320-500 nm(バイオレット)フィルターとビームコリメーターを装着したUVランプ(材料の表を参照)を使用してカバーのないマイクロプレート内のサンプルを、振りながら25分間プレートの上に45cm上に配置します。これらの条件は、プレートのビームパワーが11.25 mW/cm2で、総光子線量8の約17,000 mJ/cm2である場合に適しています。
6. ダンフレットデータ収集
- 非共線488/561レーザーを用いて細胞計を用いてアッセイ細胞を測定する。FRET の計算の最小要件は、以下のデータです。
- ドナー蛍光の収集には、488 nm励起/515nm発光チャネルを使用します。
- FRET信号の蛍光の収集には、488 nm励起/595nm発光チャネルを使用してください。
- 561 nm 励起/595 nm 発光チャネル(488/595 チャネルとの非同一線形)を使用して、受容者の蛍光を収集します。
- 自己蛍光8のコレクションのための405 nm励起/457 nm放出チャネルを使用する。
- ボリューム計算には、ブライトフィールド画像チャンネルを使用します。
注:S.セレビシエのイメージングサイトメーター設定は、低流量と高感度での目標の60倍です。15 mWで405 nm、15mWで488nm、20mWで561nmに設定されたレーザーパワーは、HEK293T細胞のイメージングサイトメーター設定は、低流量と高感度で40倍の目的です。レーザーパワーは15mWで405nm、15mWで488nm、20mWで561 nmに設定されています。Ce。
- 蛍光陽性ゲート内のサンプルあたり20,000~50,000個の単一細胞のデータを収集します。
- 単一細胞を高いアスペクト比と小さな細胞面積でゲートし、それぞれアスペクト比が低く、大きいまたは非常に小さい細胞領域を有する集束細胞または破片とは対照的に、
注: 非イメージングサイトメーターの同等のパラメータは、近似セルサイズのFSC(前方散乱)と細胞粒度のSSC(サイドスキャッタ)です。さらに、単一セルゲーティングのプロキシとして、FSC パルスの高さとパルス幅を使用します。さらに、サイトメーターの感度の上限を超える蛍光値を持つ事象を収集しないことが重要です。イメージングサイトメーターでは、収集するすべての蛍光チャネルの飽和限界より1未満の生の最大ピクセル値にイベントの収集を制限します。同様に、従来のフローサイトメーターの場合、最も強度の高いビン内のデータポイント(検出の動的範囲を超えるイベントを含む)は分析すべきではありません。
- 単一細胞を高いアスペクト比と小さな細胞面積でゲートし、それぞれアスペクト比が低く、大きいまたは非常に小さい細胞領域を有する集束細胞または破片とは対照的に、
7. データ分析
- 純粋なドナー信号に対して非光変換mEos3.1サンプルを使用して補正を行い、純粋なインセプター信号13に対してmEos3.1の赤色のスペクトルと同様のスペクトルを有するモノメリックDsRed2を使用して補正を行います。より感度を高めるには、分析プログラムで FRET 検出器チャネルがスピルオーバー ターゲットと見なされることを確認します。
- ゲートサンプルは、蛍光陽性である単一の細胞のみを選択する(図2のように)。
- AmFRETパラメータを、全FRETインセプタ(561ex/595em)信号で割った総FRET信号(488ex/595em)の比率として計算します。
- フローサイトメトリーソフトウェアを使用してデータを視覚化する(材料の表を参照)。
注:本研究におけるS.セレビシエの細胞細胞濃度は、カーンら8.のように以下の設定で計算された。データ分析は、フローサイトメトリーソフトウェアを用いて行った(「材料の表」参照)。
結果
パンクタを形成しないオリゴマーの検出
我々は以前にタンパク質相分離の特性形成にDAmFRETを適用しており、これは通常、蛍光顕微鏡で検出できる大きなタンパク質アセンブリの形成をもたらす。DAmFRETが回折制限されたタンパク質アセンブリに適用可能であることを実証するために、光顕微鏡で視覚化するにはあまりにも小さすぎる離散的なホモヘプタマーを形成する生化学的に特徴付けられたタンパク質を分析しました: ヒトコシャペロン、 HSPE114.mEos3.1単独で発現する酵母細胞のDAmFRETプロファイル、またはHSPE1-mEos3.1を比較した。後者は均一な正のAmFRET値を示し、前者は無視できるAmFRET(図3A)を示した。イメージングフローサイトメーター(材料表参照)によって得られた細胞の画像は、mEos3.1-およびHSPE1-mEos3.1発現細胞(図3B)の両方について、ドナードナー、FRETおよびアセプターの拡散蛍光を明らかにした。この知見を高い光学分解能で確認するために、共焦点顕微鏡を用いて、細胞の複数の分野のZスタックを捕捉した。実際、蛍光はサイトゾル全体に均一に分布し、検出可能な穿孔はなく、細胞がHSPE1-mEos3.1または蛍光素単独で発現したかどうか(図3C)。HSPE1の特徴的なKdは、我々のシステムの感度をわずかに下回る約3μMであり、したがって、我々はこの離散的なホモオリゴマーのために期待される濃度にFRETのシグモイド関係を観察しないことに注意してください。それにもかかわらず、我々は、DAmFRETが単一細胞分解で生体内の可溶性ホモオリゴマー化を強く検出すると結論付けた。
核化制限アセンブリの検出
DAmFRETが離散ホモオリゴマーとプリオンなどの核系限定アセンブリを区別する能力を示すために、ヒト炎症性タンパク質ASCを解析した。WT ASCPYDは生体内でフィラメントを形成するのに対し、ASCPYDの不活性R41E変異体は9、10ではない。我々は酵母細胞でmEos3.1単独で、またはmEos3.1をWTまたはR41E ASCPYDのいずれかに融合して発現した。蛍石球単独またはASCPYDの変異型を発現する酵母細胞は、濃度範囲全体にわたってごくわずかなAmFRETを示し、自己相互作用ができないことを示した。対照的に、WT ASCPYDは、2つの集団を持つDAmFRETプロファイルを示しました:1つは無視できるAmFRETと高AmFRETを持つもう1つ(図4A)。蛍光画像(図4B)によって確認された通り、これらの集団は可溶性タンパク質のみを含む細胞、または主に自己組織化されたタンパク質をそれぞれ含有する細胞を表す。集団間の不連続な関係と、それらが重なり合う濃度で起こるという事実は、核形成障壁がタンパク質の単質形態を安定させ、実験の期間中に組み立てられないようにできることを示している。8.2つの集団間のAmFRETのギャップは、核形成が起こると、他のモノマーを組み立てた形態に瞬時にテンプレート化し、AmFRETの新しい定常状態レベルを達成することを示している。DAmFRETは、ポイント変異体ASCPYD R41Eがこの発現系によって達成可能な濃度全体の核生成を破壊した以前の構造データを裏付けた(図4A)。
哺乳類細胞におけるDAmFRETの適用性
酵母細胞はDAmFRETにとって理想的な宿主細胞であるが、我々は哺乳動物細胞へのDAmFRETの適用性を拡張することを望んだ。機能性ASCポリマーによる細胞死を避けるために、カスパーゼ-1発現を欠くHEK293T細胞でDAmFRETを試験した。HEK293T細胞で同じタンパク質を表述した図4Aの酵母細胞と同じ。HEK293T細胞における得られたDAmFRETプロファイルは、酵母細胞のそれらに質的に似ている(図4A、C)。したがって、DAmFRETは、顕微鏡的に見えるパンクタの存在と細胞タイプの両方に関係なく、高いスループットを持つ単一細胞分解能で核タンパク質自己アセンブリを検出し、定量化する生体内で最も汎用性の高い方法として機能します。
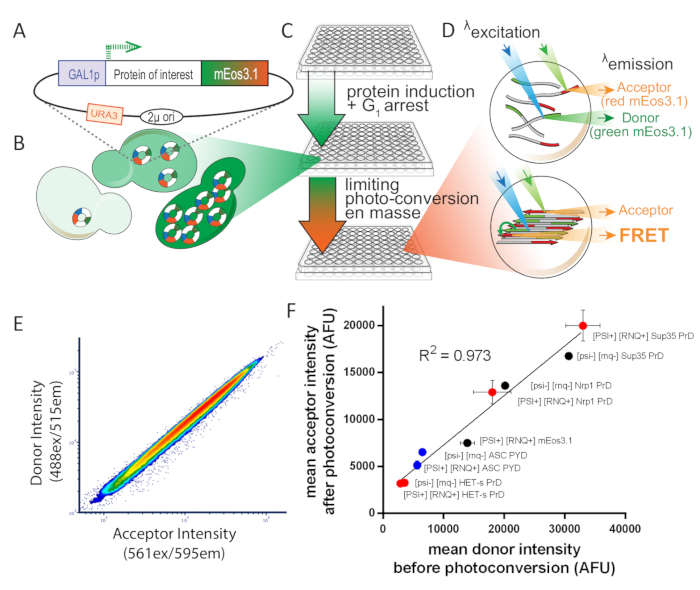
図 1: 実験設計の概要S. セレビシエ.この図は、許可を受けてカーンら8から適応されています。(A) 目的のタンパク質に対する開度読み取りフレームを示す2μプラスミドマップを、フォトコンバーチブルmEos3.1でタグ付けし、誘導性プロモーターによって駆動する。(B)酵母細胞に形質転換すると、2μ系の複製は細胞間のコピー数の変動性が高くなります。その変動は、GAL1プロモーターからの転写ノイズと組み合わせることで、細胞集団におけるタンパク質発現の広範な分布をもたらす。(C) 酵母DAmFRETアッセイの実験概要アッセイのための健康な細胞を確保するために、コロニーは、非誘導炭素源、デキストロースを含む合成培養培中で16時間以上増殖するために最初に接種される。増殖後、細胞は誘導炭素源、ガラクトースを含む合成培養剤に16時間送り込まれる。誘導後、細胞は405nm光への曝露によって部分的かつ均一に光変換される。(D) サンプルは、イメージングフローサイトメトリーを用いて分析されます。緑と赤のmEos3.1のスペクトルと強度は、それぞれFRETドナーと受け入れに適しています。互いに近接しているとき、底部細胞に描かれたポリマーで起こるように、赤色分子は緑色分子(FRET)の励起時に蛍光を行う。(E)光変換時に密接な線形関係を示すドナー対受入器強度のプロットは、光変換の効率が発現レベルの影響を受けないものではないことを示す。(F) 様々なmEosタグ付きタンパク質を発現する細胞集団からの平均受入者対ドナー強度の散乱プロットは、可溶性およびアミロイド形態の両方において、光変換の効率が融合の影響を受けないものではないことを示す。パートナーまたは溶解度(誤差バーは、生物学的三量体の標準偏差を示します)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
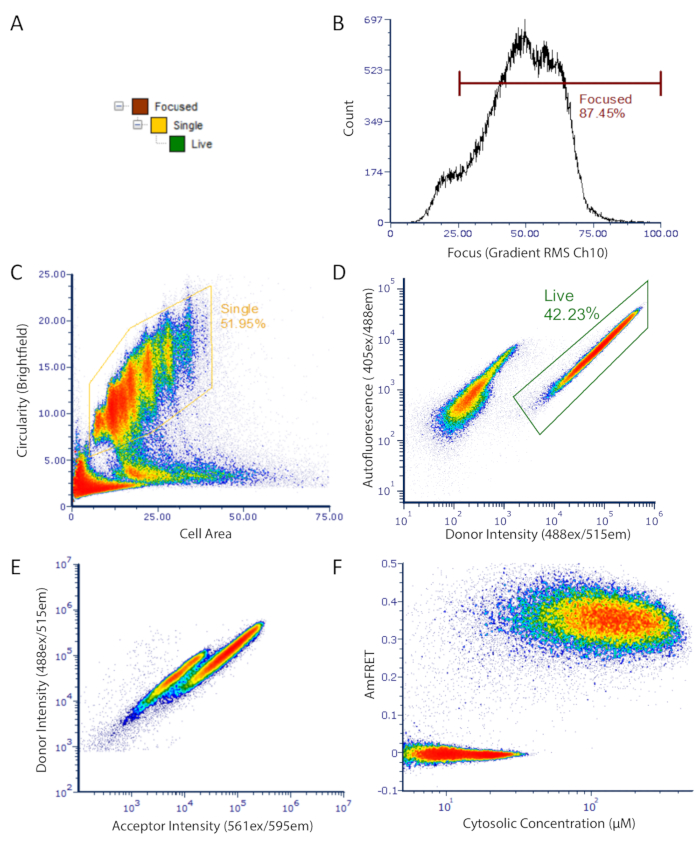
図 2: DAmFRET のイメージングフローサイトメトリーデータに対するゲーティング戦略。ゲーティング戦略は、自己蛍光が低く、蛍光タンパク質を発現する、焦点を絞った未発芽の単一細胞のみを分析するために使用される。(A) ゲートの階層は、分析のためによく焦点を当てた、ライブ、単一の細胞を得るために。(B) ブライトフィールドチャネルのグラデーションRMSのヒストグラム。この測定は透過光の下で適切に焦点を合わせている細胞の選択を可能にする。(C) 未発芽球状単一細胞のゲート集団を示す円形対領域の密度プロット。(D)自己蛍光(Ch07)対ドナー蛍光(Ch02)強度を示す密度プロットは、発現細胞(ゲート)および暗色細胞の別個の集団を示す。(E)ドナーと受入器蛍光体との間のFRETに起因する細胞のサブセットにおけるドナー蛍光の明らかな損失を示すドナー対受入器強度の散乱プロット。(F) 最終ダンフレットプロット。未組み立てタンパク質を含む細胞はAmFRETを中心とし、自己組み立てタンパク質を含む細胞は正のAmFRET値を示します。プロット内の2つの重なり合う集団は、そのタンパク質をアミロイドなどの高次アセンブリに核化する有限の障壁を示しています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
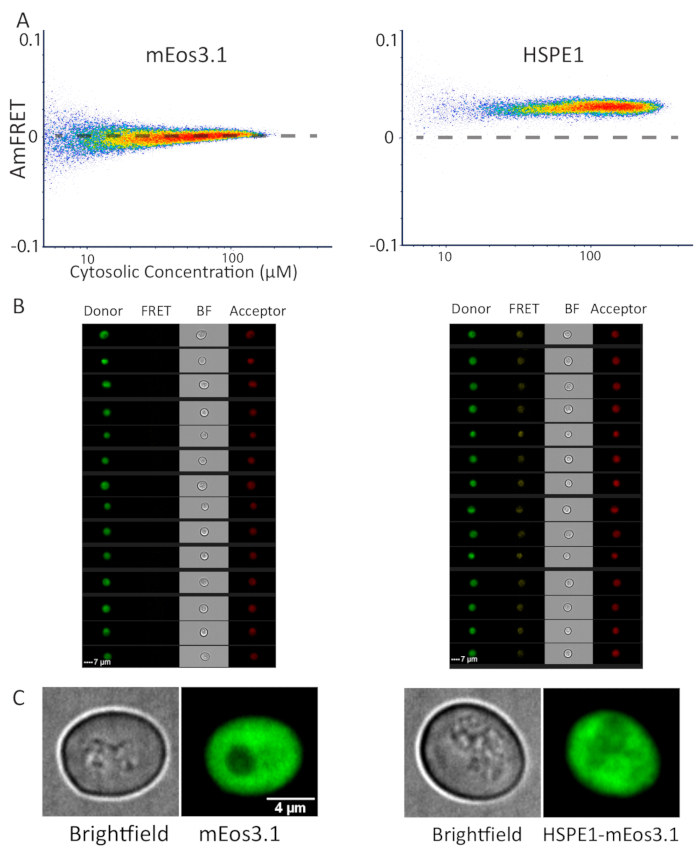
図 3: フローサイトメトリーおよび顕微鏡検査による単量体およびヘプタメリックタンパク質の代表的なデータ。(A) 単量体mEos3.1タンパク質のDAmFRETプロファイル(左)とmEos3.1(右)でタグ付けされたヘプタメリックHSPE1は、同種アセンブリに起因する比比FRETの増加を示す。(B) 細胞計からの画像、mEos3.1を発現する細胞(左)とHSPE1(右)を全ての捕捉チャネルに示す。(C) モノマーmEos3.1(左)とHSPE1(右)を発現する酵母細胞の代表的な画像。イメージは、共焦点スライスの合計投影です。少なくとも50個の細胞を画像化し、この観察を裏付けた。この図のより大きなバージョンを表示するには、ここをクリックしてください。
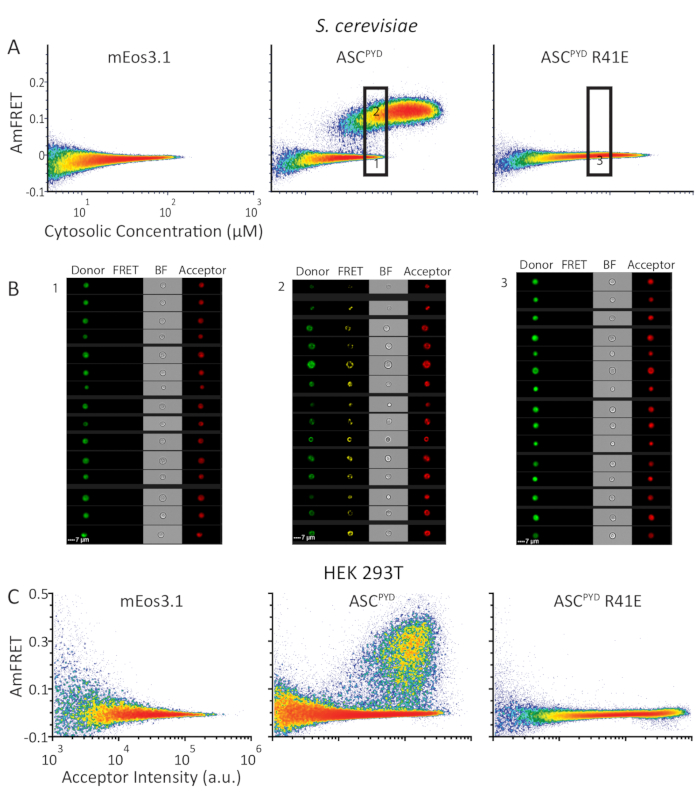
図 4: DAmFRET プロファイルは、人間の ASCPYDの同様の自己組み立て動作を示します。タンパク質でS. セレビシエおよび HEK293T 細胞.(A) MEos3.1(左)のAmFRET対サイトソリック濃度(μM)を示す密度プロット(左)、またはmEos3.1をWT(中央)またはS.セレビシアにおけるASCPYDの単化変異体に融合させた。(B) サイトメーターからの画像は、WT ASCPYDを表す下部ゲートと上部ゲート(それぞれ左および中央パネル)からの細胞の画像;示されたゲートのASCPYD R41Eを発現する細胞(右パネル)。(C) HEK293T細胞で発現した同一一連のタンパク質に対するAmFRET対受入器強度を示す密度プロット。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
DAmFRETは生体内のタンパク質自己集合を検出する最も包括的な方法である。DAmFRETは、単一細胞分解能と高いスループットを持つ幅広い濃度で同質タンパク質タンパク質相互作用の直接読み出しを組み合わせたものです。DAmFRETの直接読み出しと融合タンパク質が特定の細胞内局在化または不溶性状態を必要としないという事実は、偽陽性を排除し、その適用性をネイティブ細胞下の場所で広範囲のタンパク質に拡張します。特に、T-サファイアやmCardinalなどのmEos3.1とスペクトル的に互換性のある蛍光体を持つオルガネラをタグ付けすることにより、可溶性および組み立てられたタンパク質の細胞内局在化をDAmFRETと共に決定することができます。
ここで説明するイメージングフローサイトメーターを用いて、ウェル当たり約20,000個のゲート状細胞を有する96ウェルプレートを分析するのに8時間かかります。しかし、我々はまた、はるかに高いスループット(毎分20サンプルまで)を達成する標準的な(非イメージング)細胞計でDAmFRETを定期的に実行します。実際には、空間的に分離された488と561 nmレーザーを持つフローサイトメーターは、ログアンプアーティファクトから解放され、ドナー、FRET、およびインセプタ信号を検出するための適切なPMTとフィルタを持っており、DAmFRETを実行するのに十分です。現在のところ、このスループットの向上は、ローカリゼーション情報と体積決定を犠牲にして、自己組織化を濃度ではなくタンパク質発現の関数として分析する必要があります。これは定性的分析の問題ではありません。さらに、発現がサイトソリック体積と密接に相関する内因性の「ハウスキーピング」タンパク質にスペクトル別の蛍光素を融合することにより、細胞質体積を推定することができる。
酵母細胞と哺乳動物細胞の両方にDAmFRETを導入した結果、DAmFRETは異なる発現系に容易に適応できます。これにより、タンパク質の自己組織化をネイティブの細胞コンテキストで研究することが可能になります。さらに、広く異なる細胞培養モデル間でタンパク質アセンブリを比較し、タンパク質の自己組織化を制御するメカニズムの保全を研究する機能を提供します。
開示事項
著者は、競合する利益を宣言しません。
謝辞
私たちは、ジェフ・ランゲ、ジェイ・アンルー、ジャンツェン・ウー、タリック・カーン、エレン・ケッターに、アッセイの開発に向けた取り組みに感謝します。この研究は、T.S.K.とA.R.Gの博士課程研究の要件の一部を、英国オープン大学、および米国のスタワーズ医学研究所大学院に登録した学生としての要件を満たすために行われました。追加のアッセイ関連情報は、https://doi.org/10.1016/j.molcel.2018.06.016で見つけることができます。この原稿の根底にある元のデータは、http://www.stowers.org/research/publications/libpb-1372のスタワーズ元データリポジトリからアクセスできます。この作品は、NIHディレクターの早期独立賞DP5-OD009152、ダイムズ財団助成金第5-FY17-32のマーチ、およびスタワーズ医学研究所によって資金提供されました。
著者の投稿は以下の通りです。概念化:T.S.K.、S.V.、およびR.H.;方法論:T.S.K.、S.V.、A.R.G.、A.B;調査:S.V.、T.S.K.、A.R.G.正式な分析:S.V.、およびT.S.K.データキュレーション: T.S.K.ビジュアライゼーション:T.S.K、S.V.、ライティング(原案):S.V.、T.S.K.ライティング(レビュー、編集):R.H.、S.V.、およびT.S.K.資金調達取得:R.H.
資料
| Name | Company | Catalog Number | Comments |
| 96 Well Plate | Axygen | P96-450R-C-S | |
| ASC 2-92 (mammalian plasmid) | rhm1.0095 | Available on request | |
| ASC 2-92 (R41E) (mammalian plasmid) | rhm1.0096 | Available on request | |
| ASC 2-92 (R41E) (yeast plasmid) | rhx2432 | Available on request | |
| ASC 2-92 (yeast plasmid) | rhx2431 | Available on request | |
| Centrifuge | Eppendorf | 5430R | "centrifuge" in text |
| CSM -Ura | Sunrise Science Products | 1004-100 | |
| Dextrose | EMD Millipore | DX0145-5 | |
| DMEM | Gibco | 11966025 | |
| EDTA | Sigma-Aldrich | EDS-500G | |
| FCS Express 6 | DeNovo | FCS Express 6 Flow | "flow cytometry software" in text |
| Fetal Bovine Serum | VWR Life Science | 45001-108 | |
| Flow Cytometer | BioRad | ZE5 | Non-imaging flow cytometer |
| FUGENE HD | Promega | E2311 | "transfection reagent" in text |
| Galactose | VWR Life Science | 0637-500g | |
| HSPE1 (yeast plasmid) | rhx1531 | Available on request | |
| Imaging Flow Cytometer | EMD Millipore | ImageStream X Mark II | "imaging flow cytometer" in text |
| Mammalian Cells | HEK293T | ||
| mEos3.1 (mammalian plasmid) | rhm1 | Available on request | |
| mEos3.1 (yeast plasmid) | rhx0935 | Available on request | |
| optiMEM | Gibco | 31985062 | "reduced serum media" in text |
| PBS | VWR Life Science | 45000-446 | |
| PenStrep | Gibco | 15070063 | |
| PFA | Sigma-Aldrich | P6148-1KG | |
| Photoconversion Lamp | OmniCure | S1000 | |
| Plasmid #54525 | Addgene | #54525 | "publicly available plasmid" in text |
| Titramax 1000 Plate Shaker | Heidolph Instruments | 1000 | "plate shaker" in text |
| Trypsin-EDTA | Gibco | 25200056 | |
| Yeast Strain | rhy1713 | Available on request- S288c (MATα lyp1Δ can1Δ::STE2pr_SpHIS5 his3Δ1 leu2Δ0 ura3Δ0 met15Δ0 cln3Δ0::GAL1pr_WHI5_hphMX) |
参考文献
- Krissinel, E., Henrick, K. Inference of macromolecular assemblies from crystalline state. Journal of Molecular Biology. 372 (3), 774-797 (2007).
- Kühner, S., van Noort, V., et al. Proteome organization in a genome-reduced bacterium. Science. 326 (5957), 1235-1240 (2009).
- Marianayagam, N. J., Sunde, M., Matthews, J. M. The power of two: protein dimerization in biology. Trends in Biochemical Sciences. 29 (11), 618-625 (2004).
- Matthews, J. M., Sunde, M. Dimers, oligomers, everywhere. Advances in Experimental Medicine and Biology. 747, 1-18 (2012).
- Glover, J. R., Kowal, A. S., Schirmer, E. C., Patino, M. M., Liu, J. J., Lindquist, S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell. 89 (5), 811-819 (1997).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Michaels, T. C. T., Dear, A. J., Knowles, T. P. J. Stochastic calculus of protein filament formation under spatial confinement. New journal of physics. , (2018).
- Khan, T., Kandola, T. S., et al. Quantifying Nucleation In Reveals the Physical Basis of Prion-like Phase Behavior. Molecular Cell. 71 (1), 155-168 (2018).
- Cai, X., Chen, J., et al. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation. Cell. 156 (6), 1207-1222 (2014).
- Lu, A., Magupalli, V. G., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Zhang, M., Chang, H., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nature Methods. 9 (7), 727-729 (2012).
- Gietz, D., Jean, A., Woods, R. A., Schiestl, R. H. Improved method for high efficiency transformation of intact yeast cells. Nucleic Acids Research. 20 (6), 1425(1992).
- Nishizawa, K., Kita, Y., Kitayama, M., Ishimoto, M. A red fluorescent protein, DsRed2, as a visual reporter for transient expression and stable transformation in soybean. Plant Cell Reports. 25 (12), 1355-1361 (2006).
- Luke, K., Apiyo, D., Wittung-Stafshede, P. Dissecting homo-heptamer thermodynamics by isothermal titration calorimetry: entropy-driven assembly of co-chaperonin protein 10. Biophysical Journal. 89 (5), 3332-3336 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved