Method Article
单分子Fürster共振能量传递方法,用于GEN1对霍利迪结分辨率进行实时调查
摘要
这里介绍的是一个执行单分子Fürster共振能量转移以研究HJ分辨率的协议。双色交替激励用于确定解离常数。然后,在实时裂解测定中应用单色时移smFRET,以获得HJ分辨率前的沉思时间分布。
摘要
散装方法测量分子的整体行为,其中基本步骤的个体反应率在整个总体中平均。单分子Fürster共振能量转移(smFRET)提供单个分子实时发生的构象变化的记录。因此,smFRET在结合和催化过程中能够测量酶或基质的结构变化。这项工作提出了一个单分子成像四向霍利迪结(HJ)和间隙内分泌酶I(GEN1),一个细胞同源重组酶的相互作用的协议。还介绍了单色和双色交替激励(ALEX)smFRET实验协议,以遵循GEN1实时的HJ分辨率。GEN1 二聚能的动力学在 HJ 中确定,该动力学被建议在 HJ 的解析中发挥关键作用,但直到现在仍然难以捉摸。此处描述的技术可以广泛应用,以获得许多酶-DNA系统的宝贵机械见解。
引言
基于荧光检测的单分子方法提供高信噪比1。FRET是一种光谱技术,可以测量1~10nm范围内的距离,使该技术成为测量纳米范围2、3距离的分子标尺。受体的吸收光谱在较短的波长端与供体发射光谱有部分光谱重叠。FRET由供体和接受方对之间的无辐射能量转移进行调节,而能量传递的效率取决于接受者4的距离和方向。
已经实施了多种方法,以尽量减少背景,提高荧光信号5,6的检测效率。一种方法是共聚焦显微镜,其中针孔将激发点限制在衍射极限7以下。另一种方法是全内部反射荧光(TIRF),这是一种广场照明技术,其中光在临界角度8上方被定向离轴。然后,光线在玻璃和水溶液之间的界面上完全内部反射,产生一个消逝波,仅照亮附着在玻璃表面的荧光团,并防止从玻璃表面其余部分的荧光团中产生背景。解决方案。
在共聚焦显微镜中,分子可以自由扩散或表面固定。所达到的时间分辨率可以在微秒到几毫秒9之间。单个分子的共聚焦检测由单光子雪崩二极管(SPAD)和感兴趣的区域10逐点扫描执行。在 TIRF 中,位置敏感的二维电荷耦合探测器 (CCD) 记录了固定在表面上的数百个分子的时间序列。CCD 通过增强的荧光屏和微通道板或片上光电子乘法 (EMCCD) 放大荧光信号。时间分辨率取决于CCD的读出速度和量子效率,通常在几十毫秒6。
HJ是DNA修复和重组的中央中间体,11,12,13,14。HJ 有两个连续和两个交叉线,在连续股之间连接,而不会相互相交。HJ作为X堆叠构成体存在于溶液中,通过连续绞线交叉和交叉线在其他conformer15中连续进行连续的构同化。HJ的Isomer偏好取决于核心序列和离子环境,并已由FRET16,17,18,19广泛研究。
GEN120是溶液21中的单体蛋白,需要二聚体来分离HJ,从而允许正确分离重组的链22,23。HJ的堆叠扭曲偏好通过HJresolvases24设置分辨率的方向来影响基因重组的结果。了解 GEN1 如何结合 HJ、协调两个切口并确保其完整分辨率都在深入研究中 21、22、23、25、26 ,27,28,29 ,30.
在这项研究中,使用基于目标的TIRF设置,如前面31所述。应用双色交替激励(ALEX)来确定GEN1与标有HJ的荧光素相互作用时的构象变化。ALEX基于两个比率参数FRET效率E(供体接受方距离依赖)和化学计量参数S(测量供体受体-化学计量学32)生成2D直方图。ALEX 能够根据荧光草的血吸虫对荧光物种进行分类,包括仅供体、仅接受和混合亚种群。ALEX可以将FRET的使用扩展到全范围,并能检测荧光素亮度和寡聚物的差异,以及监测大分子-配体相互作用33。
研究发现,GEN1在GEN1-HJ复合物的寿命内始终成功地解决了HJ问题。时间相关构象变化来自单个分子的时间轨迹,而直方图表示基础种群的分布。使用延时单色 FRET,演示了 GEN1 二分器的快速开率和慢速离差,提高了装配的 GEN1 二分器在第一个切口产品中的亲和力。
研究方案
1. 表面功能化盖玻片的制备
-
清洗
- 将五个盖玻片(24 毫米 x 60 毫米)放入可克林罐内的乙醇中。在乙醇中声波,然后在1M氢氧化钾中30分钟3倍。用丙酮3x洗涤,然后去皮。
-
锡兰化
- 在丙酮中制备2.8%3-氨基丙酸二甲烷(APTES)溶液。用石蜡薄膜密封 APTES 瓶,并储存在 4°C。
注:使用安全护目镜并在烟罩下工作。硅烷溶液的容器应在将硅烷溶液倒入罐中之前和之后,立即用丙酮完全干燥并冲洗。 - 将 2.8% APTES 溶液的 70 mL 倒入包含盖玻片的 Coplin 罐中。在轨道摇摇器中摇动罐子 4 分钟。
- 让罐子在长凳上站立5分钟,隔音1分钟,最后将罐子放在长凳上10分钟,让硅烷与玻璃表面的羟基组发生反应。
- 将水直接倒入罐中,以快速换溶剂,加入1L的去离子水,使反应淬火。将罐子侧身摇动,在平坦的表面上将滑轨在水中冲洗 3 倍。
- 从罐子中取出盖玻片,放在铝箔托盘上。在 110°C 的烤箱中烘烤盖玻片 30 分钟,干燥盖玻片并固化硅烷。将托盘放在工作台上,让盖玻片冷却至室温。
- 在丙酮中制备2.8%3-氨基丙酸二甲烷(APTES)溶液。用石蜡薄膜密封 APTES 瓶,并储存在 4°C。
-
佩吉格
- 加热生物素化 PEG 和 PEG,储存在 -20°C 至室温 (RT), 以防止打开容器时水分凝结。
- 将五个盖玻片与硅化表面朝上放在一个盒子上。沿硅化盖板的边缘放置两个盖玻璃滑片(22 mm x 22 mm)。
- 一旦预热,通过在1.5 mL管中加入1.5毫克生物浸化PEG和150mgPEG,在1mL的新鲜、0.1M碳酸氢钠溶液中,以±1:100的比例制造生物浸化PEG和PEG溶液。
- 涡旋管溶解PEG并向下旋转以去除气泡。
注:从此步骤开始,要快速进行,因为 PEG 在最小时间范围内在溶液中水解。 - 快速将 PEG 溶液的 100 μL 应用于每个盖玻片。取另一个烤盖玻片,并将其上部硅化表面面朝下放在带有 PEG 解决方案的盖玻片顶部,从而形成玻璃溶液玻璃夹层,其中 22 mm x 22 mm 非硅化盖玻片允许两个功能化盖玻片容易分离。
- 在黑暗中和RT处孵育覆盖物过夜(16小时)。孵育完成后,将盖玻片拆开,然后用去离子水冲洗10倍,用喷瓶从侧面清洗。
- 在干氮流下干燥盖玻片。将干盖玻片存放在真空下。
注:幻灯片可以使用 1 个月,而不会降低质量。
2. 流动单元的制备
-
单通道流单元
- 在石英滑梯的中间部分(50 mm x 20 mm)钻两个直径为 1.22 mm 的孔,中心与滑轨边缘相距 37 毫米,距滑道边缘 6.5 mm(图 1A)。
- 使用电子切割机将 41 mm x 2.25 mm 通道切割成 50 mm x 20 mm 的双粘合片。
- 剥下保护盖的塑料侧,将件的边缘与石英滑动的边缘对齐。用一对聚四氟乙烯钳轻轻压住的气泡,清除被困的气泡。
- 剥去粘合件的纸面。将件安装到盖玻片的功能化表面上。
- 将聚乙烯管(I.D. 1.22 mm)切成 11 厘米的长度,用于入口,将出口切至 25 厘米。将管插入先前钻孔,作为流单元的入口和出口。
- 使用 5 分钟环氧胶密封石英盖玻片界面的边缘以及入口和出口的管周围。
- 一旦流电池干燥或在干真空下储存,立即使用,以便以后使用。
- 在PBS中溶解阿金,浓度为0.03mg/mL。过滤通过0.2μm注射器过滤器。
- 使用 1 mL 注射器将阿维金流入流细胞。使用另一个装满缓冲液的注射器来洗掉多余的阿丁。更换注射器时,小心不要引入气泡。
-
多通道流单元
- 在石英滑梯的长边(76 mm x 25 mm)上钻出六个直径为 1.22 mm 的孔(图 1B)。使孔距滑轨边缘 4.5 mm,将孔分开 9.3 mm。确保每个孔对的中心之间的距离为 15 mm。
- 使用电子切割机将 6 个通道(20 mm x 2.25 mm)切割成 76 mm x 25 mm 的双胶带。
- 剥下保护盖的塑料侧,将粘合件的边缘与石英滑动的边缘对齐。使用一对聚四氟乙烯钳子轻轻按压,清除任何被困的气泡。
- 剥下粘合件的纸张侧,并安装在盖玻片的功能化表面上。
注:有时剥离纸张侧并附着在石英滑块上,在多通道流单元中工作良好。 - 切割六个通道的进气管(11 厘米)和出口管(25 厘米)。如步骤 2.1.6_2.1.9 所述准备流单元。
- 将第一个通道的插座连接到泵。使用 OSS 将入口放入 0.5 mL 管中。
注:选择入口管的长度,通过酶进入流细胞的同步时间和成像的开始,使连续流下进行的裂解实验中的事件数最大化,从而减少荧光。 - 通过断开已用通道的插座,移动到新通道。用用塑料部分用胶水密封的注射器针制成的插头关闭出口。关闭已用通道的入口。
3. 准备氧气清除系统(OSS)
- 在800μL甲醇中溶解0.2克(+)-6-羟基-2,5,7,8-四甲基铬-2-碳水化合物酸(三重状态淬火,以尽量减少荧光量闪烁)。
- 加入6 mL的去离子化H2O,并添加1个N NaOH滴落,直到它溶解。过滤通过注射器过滤器,成1 mL等分,并储存在-80°C。库存浓度为 ±100 μM。
- 通过在 4 mL ddH2O 中溶解 61 mg PCA 粉末,制备 3,4-二氧基苯甲酸 (PCA) 的新鲜溶液。库存浓度为 ±100 nM。
- 滴滴加入 58 μL 的 10 N NaOH,确保每次滴落后涡流,直到 PCA 完全溶解(pH = 9)。
- 在7 mL的PCD储存缓冲液中溶解5.3毫克原醇3,4-二氧酶(3,4-PCD)(表1)。3,4-PCD通过催化原酸34的氧化,从结合/裂解缓冲液中去除氧气。
- 将 PCD 溶液划分为 1 mL 等分。库存浓度为±1 μM.将液氮中的等分物冷冻在-80°C,用于长期储存或-20°C储存,用于短期储存。
- 准备一个新的绑定缓冲区 (表 1.将 2 mM CaCl2替换为 2 mM MgCl2,用于 smFRET 裂解实验。
- 准备1 mL的成像缓冲液 (表 1)。将成像缓冲液保存在冰上,直到它被引入流单元以保持氧气清除系统的活性。
4. 制备荧光标记的HJs
- 在Tris-EDTA缓冲液(表1)中重组冻干寡聚子(表2)至浓度为100μM。
- 通过混合表 1中列出的每个 X0寡聚物的等值部分 #3 μL 来制备合成结。
- 在 95°C 加热 5 分钟,然后以 1 °C/min 的速度缓慢冷却到 RT。使用热块或 PCR 热循环器达到所需的冷却速率。
- 将混合物加载到 8 厘米 x 8 厘米的 10% Tris-硼酸盐-EDTA 聚丙烯酰胺凝胶上。应用 100 V 并运行凝胶 ±2 小时。带子的眼睛清晰可见,颜色是紫色的。
- 用干净的刀片去除退火基板的带。将凝胶片转移到高压灭1.5 mL管中。
- 用干净的柱塞粉碎管内的凝胶片,然后加入100 μL的TE100缓冲液(表1)。
- 在热混合器中以 1,500 rpm 在 20°C 下摇动管,在 ±2 h 处或在 4°C 下孵育过夜,从而提取 HJ。
- 对含有基材的溶液35执行乙醇沉淀。
- 在 TE100 缓冲液的 20 μL 中重新悬浮基板 (表 1)。最终浓度为1~3μM.Aliquote 2 μL,储存在-20°C。
5. GEN1的蛋白质表达和纯化
- 用输入向量的PCR在C-总站20处用六角体异氨酸标记,构造被截断的人类GEN111、2、3、4、5的表达质粒。
注: N 终端标记将导致 GEN1 停用。非结构化的 C 尾使全长度 GEN1 的纯化更加困难。此外,据报道,全长GEN1表现出的活动比截断版本23少。 - 将表达载体转化为大肠杆菌BL21-CodonPlus(DE3) -RIPL菌株。
- 在 37°C 下,将转化后的细胞接种成两个 6 L 烧瓶,每个烧瓶在 37°C 下含有 2 L 的 Luria 肉汤介质,在 180 rpm 下摇动,直到达到 OD600的 0.8。
- 冷却至16°C,诱导GEN1表达与0.1 mM等丙基-β-d-硫丙酮(IPTG)48小时。
- 在离心机中,在1000 x g下,在4°C下旋转细胞,收获细胞。每升培养的颗粒可产生 5~6 克的颗粒。
- 丢弃上清液,并使用4 mL/g的细胞重新悬浮在赖舍缓冲液中的颗粒细胞(表1)。
- 在30 kPsi下使用细胞干扰器进行细胞分解,然后在10,000 x g下在4°C下旋转1小时。使用 0.45 μm 过滤器收集上清液并将其过滤在冰上。
- 使用FPLC使用滤液以2.5ml/min流速通过5mL Ni-NTA柱,使用缓冲液A(表1)。执行蛋白质纯化。
- 用 15 列卷 (CV) 洗涤。具有缓冲器 A 和 500 mM Imidazole 的线性梯度,在 5 mL 分数中超过 20 CV。GEN1 在大约 100 mM Imidazole 的柱中洗脱。
- 移液器 10 μL 等分从收集的馏分,添加相等体积的 2x SDS 加载染料到每个等分。通过在 90°C 加热 5 分钟、冷却和旋转样品来使样品变性。
- 将样品加载到 10% 比斯-特里斯凝胶上。使用库马西亮蓝色,在 200 V. 染色处运行凝胶 30-45 分钟,然后脱色。收集包含纯化 GEN1 的分数。
- 使用缓冲液C(表1)稀释,将组合馏分的盐浓度降低至100 mM。
- 使用缓冲液B(表1),以3 mL/min的流速将低盐蛋白通过5 mL肝素柱。
- 使用 20 CV 的梯度与缓冲器 B 和 1 M NaCl 一起使用 10 CV 洗涤。收集 5 mL 分数,其中 GEN1 在 360 mM NaCl 周围洗脱。
- 检查纯化的 GEN1 分数的洗脱分数,如步骤 5.8 中所述。结合这些分数,并使用缓冲液C稀释至100 mM NaCl。
- 使用缓冲器 B 以 1 mL/min 流速将较低的盐蛋白加载到阳离子交换柱上。
- 使用缓冲器 B 和 1 M NaCl 的 40 CV 梯度洗取。收集 1.7 mL 分数,其中 GEN1 在 300 mM NaCl 周围洗脱。
- 检查步骤 5.8 中描述的洗脱分数中的 GEN1 纯度。
- 将最纯净的分数在 4°C 下与存储缓冲器结合 (表 1)。在透析期间至少进行一次缓冲液的交换。
- 测量蛋白质浓度 ±0.5±1 mg/mL。将透析蛋白在小管中10~15μL体积中与分,在液氮中闪冻,储存在-80°C。
6. 单分子FRET实验
注:smFRET实验在基于定制目标的TIRF设置(图1C)上执行,前面描述的31。
- 单色 FRET 实验
- 在 100x TIRF 目标上涂抹一滴浸入油。将 EMCCD 设置为适当的增益,以将信号优化到背景并防止饱和。
注:对齐激光时,不要直视激光束并佩戴护目镜。 - 小心地将流动单元放在样品架上。使用粗调节逐渐提高目标,直到机油接触盖玻片。
- 打开绿色激光 (532 nm)。切换到目标精细调整模式。将发射定向到摄像机端口以观察监视器上的图像。
- 调整目标的高度,直到盖玻片的功能化表面对焦,并可在监视器上观察。
注: EMCCD 采集的图像通过光通可调滤波器 (AOTF) 触发激光激发,以防止在未采集图像时样品光漂白。 - 在荧光标记的 HJ 中流动之前,检查盖玻片功能化表面的背景是否不超过几个点。
- 在 TE100 缓冲液中稀释库存基板约 1000 倍(表 1),最终浓度为 1~5 nM。用OSS将稀释的基板0.2±0.5μL移液到120μL的成像缓冲液中,并放入0.5 mL管中。
- 将流动单元的出口连接到注射器泵。将流动细胞的进气管插入 1.5 mL 管中,以 30*50 μL/min 的流速操作注射器泵,以从管中取出溶液。
- 通过使用绿色激光进行简要成像,经常检查表面的覆盖率(100~300均匀分布、间隔良好的基板)。
- 如果表面覆盖仍然不足,请等待几分钟,等待溶液中带有荧光标记的 HJ 沉降到表面上或重复流动步骤。
- 以30~50μL/min流下另外120μL的成像缓冲液(表1),以清洗未结合的荧光标记HJ。然后让流动单元坐5分钟,让OSS耗尽溶解氧。在成像开始时,荧光团的光漂白应是最小的。
- 设置曝光时间(+60毫秒),周期时间将由软件根据数据传输速度(±104 ms)自动设置,并指定所需的周期数或帧数(+400)。来自捐赠者 (Cy3) 和受体 (Alexa Fluor 647) 的发射通过图像分路器设备分裂成两个颜色通道。
- 在曲面上找到合适的区域,通过调整目标的高度对焦图像并记录,并将影片保存为 16 位 TIFF 格式。
- 移动到新区域。
注:始终仅朝一个方向移动(即,从出口到入口),以避免对同一区域成像两次。 - 在 120 μL 的成像缓冲液中一次制备 1、2、5、10、25、50、75 和 100 nM GEN1。以 30-50 μL/min 的流速流溶液。
注: 如果在稳定状态下完成所需的测量,如 GEN1 对 HJ 的绑定或游免费 HJ 的等同化,则在流量停止后等待 3-5 分钟以录制影片。为每个 GEN1 浓度从新区域获取三到四部电影。 - 如果在 GEN1 的 HJ 裂解下连续流下进行测量,则在 GEN1 进入流单元之前开始记录 5-10 s。通过移动到六通道流单元中的新通道来重复测量。
- 最后,使用固定荧光珠滑块在图像分割装置中将供体和受体颗粒彼此映射。
- 将直径为 1 μm 的 0.2 μL 荧光珠加入 500 μL 的 1 M Tris(pH = 8.0),使珠子粘附在表面。
- 在 22 mm x 22 mm 的双面粘合密封件内切割方形(18 mm x 18 mm)。剥下,将件子粘在 76 mm x 25 mm 石英滑块的中间。
- 将 50 μL 的稀释珠溶液放置,并放置 5-10 分钟以稳定。在方形件的顶部安装 22 mm x 22 mm 盖玻片。用纸巾干燥多余的珠子溶液,然后用环氧胶密封腔室。
- 在 60 ms 曝光时获取 100 帧的珠子滑动。
注意:将激光功率和 EMCCD 增益降至最低,以避免探测器饱和。 - 安装软件包(例如,双音),并打开其中的电影,如用户手册36所示。选择供体和接受器通道中单个珠子的位置。生成如手册中所述的转换矩阵。
注:本软件使用变换矩阵来匹配粒子在供体和接受器通道中的位置,并纠正图像分割装置中任何轻微的错位。 - 转到文件,按加载影片,然后选择影片文件,然后按打开。在文件菜单中,按Load TFORM并选择从珠子幻灯片生成的转换矩阵。调整供体和接受者通道的阈值,直到不包含误报。
- 在"通道"筛选器菜单中,选择"D&Amp"选项,以选择同时标有供体和接受方标记的粒子。检查最近邻限制字段以排除彼此非常接近的分子。检查最大椭圆度以排除非常偏心的分子,并检查宽度限制以排除非常宽或非常窄的分子。
- 按双音手册中的指示键入图解,以构造直方图。
注: "明显"FRET 效率由程序计算,方法是将接受方的排放除以供方和接受方的总排放量。双色使用 100 个间隔将分子状态的分布与 FRET 效率进行比。 - 按双音手册中的指示,键入图解时间跟踪CW,以生成每个分子的时间跟踪。
注: vbFRET37可以进一步分析时间跟踪,以识别不同的 FRET 状态、各自的住用时间和不同状态之间的转换速率。
- 在 100x TIRF 目标上涂抹一滴浸入油。将 EMCCD 设置为适当的增益,以将信号优化到背景并防止饱和。
- 双色交替激励FRET(ALEX)实验
- 用绿色和红色激光直接激发,分别记录由连续帧的供体和受体发射组成的电影,每个时间为80毫秒。
- 打开两个色调的获取的 ALEX 电影。将三个通道的适当检测阈值设置为+300:由于供体激发(DexDem)引起的供体排放;供体激发引起的接受物排放(DexAem);和接受器发射由于直接激发(AexAem)。
- 应用通道过滤器 DexDem&DexAem,为同时具有供体和接受体的粒子进行选择。将粒子在三个通道中链接 [200]300。
- 使用绘图组 MATLAB 代码生成 ALEX 直方图。使用原点软件38将直方图中的不同峰值拟合到高斯函数,并确定曲线下每个总体区域的百分比。
注: 绑定测定中的峰值对应于绑定的 GEN1-HJ 复合体,而在空闲 HJ 中,峰值表示互交等构体。 - 使用绘图TimetraceALEX MATLAB代码为每个分子生成时间跟踪,通过直接激发显示供体发射,以及由于FRET和直接激发而接受的发射。
注:ALEX 时间跟踪独立显示供体和受体的排放量,但时间分辨率低于单色 FRET。与单色 FRET 类似,vbFRET 可以进一步分析 ALEX 时间轨迹,以识别不同的 FRET 状态及其各自的活动时间。 - 通过将绑定总体与 GEN1 浓度的百分比拟合到双曲函数,确定解散常数。
- 时移单色 FRET
- 根据观测到的动态速度,将绿色激光的曝光时间设置为 60 ms,将循环时间设置为 624 ms 或更低。
- 在六通道流单元的一个通道中,将流速设置为 110 μL/min。在 GEN1 进入流单元之前,先短暂开始记录。
注:连续流动会导致荧光团的快速光漂白,因此同步成像和蛋白质输入的启动可最大化捕获事件的数量。最佳注射器泵读数取决于用于组装流细胞的死体积和精确管材;在我们的例子中,它是 +25 μL。 - 以 78 秒的总采集时间获得 125 帧的影片。在录制结束时,将样品暴露在红色激光中,每个50帧,曝光时间为25毫秒,以探测接受者。
注:该方法通过减少激励周期数,延长了裂解实验中的观察窗口。通过将分布拟合到双指数模型30、38来派生动力学参数,如二分化的k开和k。
7. 电泳移动移位测定(EMSA)
- 在 50 μL 总体积中,在 EMSA 结合缓冲液(表 1) 中,用 50 pM Cy5 标记 HJ 在 RT 孵育所需的 GEN1 浓度 30 分钟。
- 将样品加载到 8 厘米 x 8 厘米的 6% 三聚物-EDTA 凝胶上。在 RT 处使用 100 V 在 1x TBE 缓冲液中运行凝胶 1 小时 + 20 分钟。
- 确定GEN1浓度的带束基板的百分比,从其相对于其对相应通道的总荧光强度的贡献。
注:GEN1单体-HJ(波段I)通过其尺寸与GEN1单体与刻有HJ21、30的皮卡莫拉尔结合的协议确定。GEN1-dimer-HJ被分配到波段II,因为GEN1单体逐步结合到HJ21,23。 - 使用公式计算明显绑定常量Kd 单体应用-EMSA和Kd-dimer-app-EMSA:

其中:最大值是相应物种达到最大结合的浓度(单体或二分体);n 是希尔系数;Kd-app-EMSA是相应物种的明显结合常数,表示存在半最大值单体或二聚体的 GEN1 浓度。
结果
HJ 的共性偏差和等位化
FRET通过标记17、18、39号交界处的两个相邻臂,对HJ的电离性进行了广泛的调查。供体(Cy3)和受体(Alexa Fluor 647)分别位于两个相邻臂上,R(第2股)和X(第3节)(图2A)。堆叠X等体由它们的两个连续链(即Iso(1,3)或Iso(2,4)]分配。相邻标签 X0的 ALEX FRET 直方图显示两个峰值,对应于更丰富的 Iso(1,3) (E =0.75) 和不太丰富的 Iso(2,4) (E =0.40) 的交错(图 2B)。
单色 FRET 用于通过减小 EMCCD2 摄像机的使用面积,获取时间跟踪,以高时态分辨率 ±10 ms 记录自由 HJ 中快速构象变化。X0结的代表性单色 FRET 时间跟踪显示了高和低 FRET 等体之间的过渡(图2B)。从Iso(1,3)和Iso(2,4)(图2C)的驻点时间直方图中获得的等位化率kIso(1,3)-Iso(2,4)和kIso(2,4)和k Iso(2,4)与之前报告的第17次一致。
SMFRET 显示 GEN1 对 HJ 的主动失真
HJ在绑定到GEN122后进行结构重组。因此,在 Iso(1,3) 和 Iso(2,4) (图 3A) 中,供体和接受者之间的间距相似。smFRET 结合测定在 Ca2+存在的情况下进行,以防止 HJ 的裂解。ALEX 获取了不同 GEN1 浓度的相邻标签 X0结的 FRET 直方图(图 3B)。直方图适合两个高斯函数:一个对应于自由高 FRET Iso (1,3),另一个对应于从低 FRET 峰值中减去 Iso(2,4) 的 Iso(2,4) 后绑定 GEN1-HJ 总体。
在饱和GEN1浓度时,X0的FRET直方图只有一个低FRET峰值,对应于GEN1绑定到HJ的或同型器,如模型22所预测。明显的单体解离常数(Kd-单体应用)是由GEN1结合总体的百分比作为GEN1浓度的函数的倍曲线拟合决定的(图3C)。相邻标签 nk-X0表示一个单独刻痕的版本 HJ,在第一次切口反应后模仿产品。由于模拟刻痕对堆叠应变的缓解,nk-X0是一种非异构结构40,从 E ±0.40 处的单基板峰值中可见,与 X0不同(图 3D 与图 3B)。GEN1-nk-X0复合体的结构与 GEN1-X0复合体的结构相似,如 FRET 效率的相似性(e =0.25 表示 nk-X0,X 0为 0.32)(图 3D 与图 3B.GEN1单体与nk-X0的强结合通过比X0低40倍的Kd单体应用值(图3E与图3C)来证明。这种紧密结合可以作为一种保护机制,防止在 GEN1 二聚体或其单体分离的情况下,HJ 的不完全分辨率。
GEN1 单体与 HJ 的逐步结合
GEN1单体与HJ结合后,再结合二聚体形成是真核HJ再溶酶GEN1与原核子重溶体相比的独特特征,后者以二元体形式存在于溶液21、23、41中。50 pM X0处的 GEN1 EMSA 显示 GEN1 的逐步关联到高阶复合物中,如上面板中的罗马数字所示(图 4A)。由 EMSA(Kd-单体-EMSA) 确定的 GEN1 单体解离常数与 smFRET 结合测定 K d单体应用的解离常数重合(图 4A和图 3C),分别)。波段II的定量用于计算GEN1二聚体(K-d-二聚体-EMSA)的平衡解散常数。50 pM nk-X0时的 GEN1 EMSA 显示了突出的单体绑定,如极低的 Kd 单体应用-EMSA所示,该比 X 0 低 30倍,而其Kd-二代 EMSA是与 X0 (图 4B) 的相媲美。
进一步证据表明,GEN1单体结合和扭曲HJ是观察大量未清洁的粒子的痕迹,在低GEN1浓度下,在Mg2+的存在下,具有稳定的低FRET状态(图4C)。随着GEN1浓度的增加,这些痕迹的数量减少。HJ 的分辨率由 GEN1 单体紧密绑定驱动,该单体支持二脚板形成。在Mg2+中不洁的nk-X0的时间轨迹中观察到单体结合,直到很少的纳米摩尔浓度(图4D)。GEN1 单体紧密结合以保护 nk-X0,最终通过二角器形成确保全分辨率。
SMFRET 分辨率测定 HJ
smFRET 测定中的术语"裂解"与 HJ 的"分辨率"交替使用,因为在此检测中仅检测到第二个裂解事件之后的产品版本。事件通过延时单色激发进行记录,以尽量减少感光型接受器在 ±1.3 分钟的采集时间内的光漂白。
图 5A中的示意图说明了 X0 Iso(1,3)的 1 号股和 3 股的切口,这些绞线在连接到功能化玻璃上的 X0的 GEN1 进行结合和变形后。捐助者和接受国都进入解决方案,导致在HJ决议后失去其信号。第一和第二切口在nk-X0中分离,这是部分解析的HJ的原型。在结合 GEN1 时,nk-X0采用与 X0相似的结构。分辨率通过第 1 股中的单个切口进行,如图5B所示。
在已解析的 X0的痕迹中出现稳定的低 FRET 状态后,供体和接受者同时离开,而没有出现中间 FRET (E = ±0.40),表明完全分辨率发生在 GEN1-HJ 的寿命期内复杂 (图 5C)因此,这些结果表明,HJ分辨率发生在GEN1-HJ复合寿命期内。nk-X0的分辨率在结构重新排列后也继续进行,最后是双面携带两个荧光道(图5D)与X0相似的双面结构离开。
GEN1 单体绑定 HJ 上的 GEN1 二分化动力学
延时 smFRET 测量 =前裂解,主要包括 GEN1 单体失真后二聚体形成和 HJ 分辨率所需的时间。应用这一技术,提供了直接证据来支持二聚体形成需要X0和nk-X0的分辨率的说法,因为β前裂解的分布是GEN1浓度依赖的。
HJ 分辨率(k应用)的表观速率定义为在相应的 GEN1 浓度下对 β前裂解的平均值的反向。术语"明显"用于描述 HJ 分辨率的速率,因为不能排除在 HJ 分辨率之后 GEN1 仍与产品绑定的可能性。
X0的β 前裂解分布的概率密度函数 (PDF) 反映二聚体形成的时间,在低 GEN1 浓度下,二角形成时间较长,在较高的 GEN1 浓度下更短。二聚者、k上二聚者和k离二聚器的关联和解离率分别由双指数模型30确定。此外,nk-X0的 PDF(图 6B) 显示了与 X0相似的分布,指示对二聚苯并发器形成的要求。
k应用与 GEN1 浓度的图图适用于双曲函数。X0和 nk-X0的表观催化速率常数(kMax-app)分别为 0.107 ± 0.011 s-1和 0.231 = 0.036s-1(图 6C)。 X0和 nk-X0结的k应用图在 GEN1 浓度 ±5.6 nM 处相交,因为与完整的连接。
总之,相对快速的k上二聚器和慢k离二聚器会导致在二聚器形成后对 HJ 分辨率的正向反应。GEN1 单体与 nk-X0结的强结合构成一种故障安全机制,可抵御任何不太可能中止的第二个裂解,或有助于拾取细胞中主要分辨率路径留下的任何未完全未解决的 HJ。
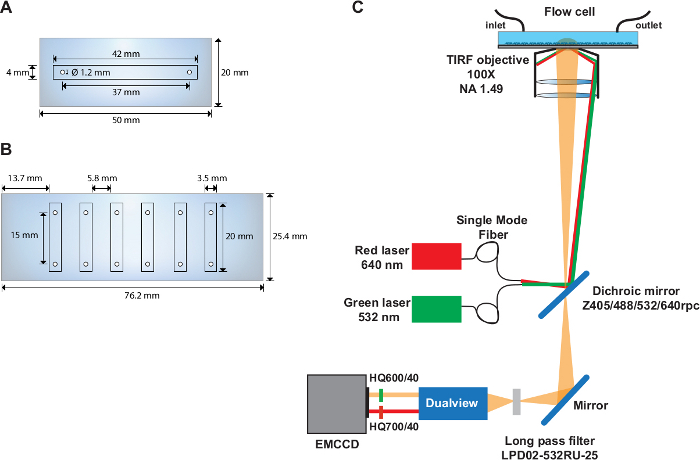
图1:单通道和多通道流单元和光学设置布局。
(A) 单通道流单元的原理图.(B) 六通道流单元的原理图.(C) 光学设置的布局,描绘了光源、TIRF 物镜、安装在滤波器立方体内的二色镜以及图像分路器设备中使用的发射滤波器。请点击此处查看此图的较大版本。

图2:FRET观察到的HJ的扭曲偏差和等同。
(A) 相邻标签 X 堆叠 HJ 构合器的电离化,以两条连续线命名。股是编号的,而手臂用字母表示。切口点位由箭头显示。指出了供体(绿色)和接受者(红色)的位置以及FRET在等体化时的变化。(B) 右侧面板:FRET 时间跟踪(黑色)和理想化 FRET 跟踪(红色)X0在 50 mM Mg2+时。左侧面板:在 50 mM Mg2+时,FRET 直方图为 X0。供体(绿色)和接受方(红色)的荧光强度如下所示。(C) 相邻标签 X0 Iso(1,3)和 Iso(2,4) 的点位直方图被安装到单指数函数中,以确定等地化速率。不确定性表示拟合的 95% 置信区间。这个数字是从以前出版的文献30修改。
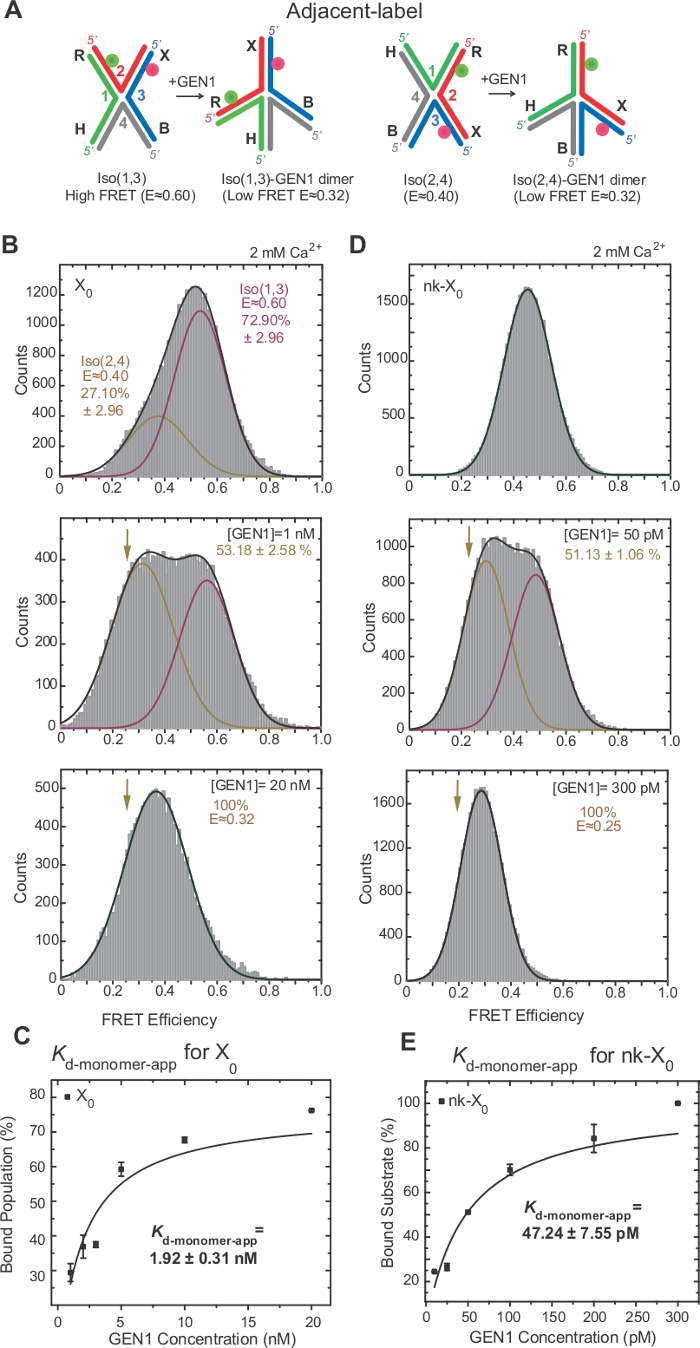
图 3:GEN1 对 HJ 的主动失真。
(A) 根据建议的模型22,对相邻标签HJ进行结构修改。(B) 相邻标签 X0的 ALEX FRET 直方图具有与 Iso(1,3) 对应的主要高 FRET 峰值 (E = ±0.6)和 Iso(2,4)的下 FRET 峰值 (E = ±0.4)。整个直方图适合两个高斯函数:一个对应于自由高 FRET Iso(1,3),另一个对应于绑定总体减去 Iso(2,4) 对总人口的初始贡献。(C) 明显的单体解离常数 (Kd-单体应用) 是由 GEN1 结合的百分比的倍增拟,作为 GEN1 浓度的函数来确定的。(D) 不同GEN1浓度的相邻标签nk-X0的FRET直方图。低 FRET (E = ±0.25) 高斯下的区域对应于绑定人口的百分比。(E) nk-X0的Kd-单体应用是由 GEN1 结合总体的倍曲线拟合决定的。误差条表示两个或多个实验的标准偏差。这个数字是从以前出版的文献30修改。请点击此处查看此图的较大版本。

图 4:GEN1 与 HJ 的逐步结合。
(A) 在 50 pM X0时,GEN1 的电泳移动移位测定 (EMSA)上面板:罗马数字表示复合体中的 GEN1 单体数。下面板:将 GEN1 单体绑定到 X0。明显的解离常数是从各自物种的点小拟合中获得的,代表了两个实验的平均值。(B) GEN1 的 EMSA 在 50 pM nk-X0时显示了突出的单体绑定,如非常低的Kd 单体应用-EMSA所示。(C) FRET 在 Mg2+中绑定但未清除的相邻标签 X0的时间跟踪。进行+1.3分钟的捐赠者激励,然后直接接受器激励(呈色粉红色区域)。(D) FRET 在 Mg2+中绑定但未清除的相邻标签 nk-X0的时间跟踪。这个数字是从以前出版的文献30修改。请点击此处查看此图的较大版本。

图5:HJ的SMFRET分辨率测定。
(A) GEN1 变形后相邻标签 X0 Iso(1,3) 的架构图。基材通过生物锡/阿维丁连杆连接到功能化表面。在两次切口后GEN1的分离导致进入溶液的供体和受体的损失。(B) 通过开裂链 1 来设计相邻标签 nk-X0的分辨率。(C) Iso (1,3) 裂解 2 mM Mg2+的时间跟踪 (黑色)。GEN1 绑定的开始形成稳定的低 FRET 状态,直到 FRET 信号因裂解而突然丢失。相应地,在GEN1结合时,供体增加和接受荧光强度降低,随后两种染料在裂解时同时消失。(D) 同样,nk-X0的时间跟踪在 GEN1 绑定时显示稳定的低 FRET 状态,该状态由 FRET 信号的突然丢失得出。这个数字是从以前出版的文献30修改。请点击此处查看此图的较大版本。

图6:GEN1单体绑定HJ上的GEN1二分化动力学。
(A) X0的 -前裂解分布的概率密度函数 (PDF) 图说明了其对 GEN1 浓度的依赖性。低 FRET 状态(=前裂解)在相应的 GEN1 浓度的驻点时间是从两个或两个以上实验中获得的,并用于获得平均速率(k应用)。列出的k应用速率根据均值 =前裂解的反向确定,其浓度为相应的 GEN1 浓度。二指形成中的关联(kon-dimer)和解离(k离二分)速率由双指数模型38计算。错误表示 k应用程序的SEM。(B) nk-X0的- 前裂解分布的 PDF 图和相应的k应用速率。(C) k应用与 GEN1 浓度的图与安装在双曲函数上的 GEN1 浓度,以确定明显的催化速率(kMax-app)。X0和 nk-X0的k应用图说明了 X0的更快初始k应用,然后由高于 [GEN1] ±5.6 nM 的 nk-X0超越。这个数字是从以前出版的文献30修改。请点击此处查看此图的较大版本。
| 缓冲区 | 组成 | ||
| 绑定缓冲区 | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 2 mM CaCl2,1 mM DTT, 0.1% BSA 和 5% (v/v) 甘油 | ||
| 缓冲区 A | 20 mM Tris-HCl pH 8.0、1 mM DTT 和 300 mM NaCl | ||
| 缓冲区 B | 20 mM Tris-HCl pH 8.0、1 mM DTT 和 100 mM NaCl | ||
| 缓冲区 C | 20 mM Tris-HCl pH 8.0 和 1 mM DTT | ||
| 裂解缓冲器 | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 2 mM MgCl2,1 mM DTT, 0.1% BSA 和 5% (v/v) 甘油 | ||
| EMSA 绑定缓冲区 | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 1 mM DTT, 2 mM CaCl2, 0.1 毫克/毫升 BSA, 5% (v/v) 甘油和 5 纳克/μl 多-dI-dC | ||
| 成像缓冲区(绑定) | 40 μL (+)-6-羟基-2,5,7,8-四甲基铬酸-2-甲氧基酸(4 μM),60 μL PCA(6 nM),60 μL PCD (60 nM) 和 840 μL 结合缓冲液 | ||
| 成像缓冲液(裂解) | 40 μL (+)-6-羟基-2,5,7,8-四甲基铬-2-碳水化合物酸(4 μM),60 μL PCA (6 nM),60 μL PCD (60 nM) 和 840 μL 的裂解缓冲液 | ||
| 莱西斯缓冲器 | 20 mM Tris-HCl pH 8.0、10 mM +-mercapto 乙醇、300 mM NaCl 和 2 mM PMSF | ||
| PCD 存储缓冲区 | 100 mM Tris-HCl pH 7.5, 1 mM EDTA, 50 mM KCl 和 50% 甘油 | ||
| 存储缓冲区 | 20 mM Tris-HCl pH 8.0, 1 mM DTT, 0.1 mM EDTA, 100 mM NaCl 和 10% 甘油 | ||
| TBE 缓冲区 | 89 mM Tris-HCl、89 mM 硼酸和 2 mM EDTA | ||
| TE100 缓冲器 | 10 mM Tris.HCl pH 8.0 和 100 mM NaCl | ||
| 特里斯-EDTA缓冲器 | 50 mM Tris-HCl pH 8.0 和 1 mM EDTA pH 8.0 | ||
表1:本研究中使用的缓冲区及其组成列表。
| 奥利戈 | 序列 | ||
| X0-st1 | ACGCTGCCATCTATCTCTCTCTCTCTCTCATCTCCCCCCC | ||
| X0-st2 | GGGAGAGGGGG/iCy3/AAAGATCTCTTATATATCTATATATATATATATATATATATATATATATTATCTATCTCTATCTCTATCTCTCTCTCTCTCTATCTCTCTCTCTCTCTCTCTCTCTCTATCTCTCTCTCTATCTCTATCTCTCTCTCTCTATCTCTCTCTATCTTATCTCTCTCTCTCTCTCTTATCTTG | ||
| X0-st3 | ACGGATAAGATTCGA/iAF647-dT/TACAACAATATGGATATATATATATATATATATATATATATATATATATATATATG | ||
| X0-st4 | 5'生物卫星,包括"技术",包括"公约" | ||
| X0-Adj | X0-st1, X0-st2, X0-st3 和 X0-st4 | ||
| X0in_st2 | GGGTGAAGGGGAGAAGATCTCTATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATTATTTTTTGTATGATATATTATTGTGTATGATATATATATATATATTATGTATGT | ||
| X0in_st4 | 5'生物卫星,包括"技术",CTCATGGGGAGGCA/iCy3/TGGATATTCGGGCGT | ||
| Nk-X0 | X0-st1, X0-st2, X0-nk3a, X0-nk3b & X0-st4 | ||
| X0-nk3a | ACGGCATAAGCTTCGA/iAF647-dT/TACAACAGATC | ||
| X0-nk3b | ATGGGCTCTATATATATATATATATATCG | ||
表2:SMFRET和EMSA HJ基板。用于制备用于 smFRET 和 EMSA 的荧光标记 HJ 的寡核苷酸列表。寡头是商业上获得的。荧光标记的寡聚物经过HPLC纯化,如果可能,60bp的寡聚物被PAGE纯化。
讨论
在这项研究中,通过GEN130,采用了不同的smFRET技术来确定HJ分辨率的动力学。类似的smFRET方法被用来遵循双片DNA构象要求和裂解通过DNA复制和修复皮瓣内切酶1 42,43,44。在这里,将讨论此协议中的关键步骤。硅化反应应无任何湿度痕迹。PEG溶解后,应迅速将钉化溶液涂在硅化玻璃上,以避免水解。在多通道流单元中,应清除粘合板中的任何滞留空气,以避免相邻通道之间的泄漏。PCA 溶液应新鲜制备,因为它会随着时间的推移而氧化。添加 10 N NaOH 应该是滴落的,中间有涡旋。在流动荧光标记的 HJ 之前,盖玻片中的荧光背景应最小。流单元中的成像应朝一个方向进行,以避免成像漂白区域。在ALEX实验中,应降低红色激光的功率,以避免接受器的快速漂白。在延时实验中,循环时间必须短于最快的事件。
smFRET 是一种敏感技术,可在生物分子反应中提供有价值的实时见解。然而,这种方法有几个技术挑战,其中包括在生化反应期间实现FRET的可测量变化。这是在直方图和时间跟踪中可区分状态中获得良好分离的特征所必需的。在许多情况下,smFRET需要仔细设计基板,选择荧光对及其位置,并放大由于基底结构变化不大的DNA基质中的FRET变化45。执行FRET的另一种方法是使用标记的蛋白质46。FRET 中的观察窗口受到接受者(如 Cy5 或 Alexa Fluor 647)的稳定性的限制,后者的漂白速度比供体快(本例中为 Cy3)。因此,FRET 需要持续寻找稳定的荧光,以延长实验持续时间,并努力开发氧气清除系统,以延长荧光信号并最大化信噪比47、48.
smFRET 中故障排除的技巧包括平衡成像中涉及的几个参数,如激光功率、曝光时间、循环时间和循环次数,以最大化荧光发射,延长实验持续时间,实现酶动力学的适当采样间隔。更长的观察时间和光漂白的最小效果对于获得代表酶动力学的高保真停留时间分布至关重要。ALEX 产生更好的直方图,因为与单色 FRET 相比,这种方法受到光漂白粒子的贡献较低。但是,ALEX 中的时态分辨率低于单色 FRET 中的时态分辨率。
最后,smFRET强调实时检测单个分子的构象/结构变化,从而弥补了高分辨率结构技术(即X射线晶体学、核磁共振、电子显微镜)之间的鸿沟,它提供原子分辨率结构细节在静态条件和批量方法,产生可测量属性的整体平均值。在许多方面,smFRET 已被证明是实时研究生物系统的强大技术。
披露声明
作者声明没有相互竞争的经济利益。
致谢
这项工作得到了阿卜杜拉国王科技大学通过核心资金和竞争研究奖(CRG3)对S.M.H.的支持。
材料
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
参考文献
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。