Method Article
Одномолекулярная Фюрстерская резонная передача энергии Методы для реального времени Исследование Холлидей Джанкшн Резолюция GEN1
* Эти авторы внесли равный вклад
В этой статье
Резюме
Представлен протокол для выполнения одномолекулярной рецензной передачи энергии Фюрстера для изучения разрешения HJ. Двухцветные переменные возбуждения используется для определения констант диссоциации. Одноцветный промежуток времени smFRET затем применяется в анализах расщепления в режиме реального времени, чтобы получить распределение времени пребывания до разрешения HJ.
Аннотация
Массовые методы измеряют ансамбльное поведение молекул, в которых индивидуальные показатели реакции основных шагов усредняются по всей популяции. Одномолекулярная ремолекула Фюрстерской рецензной передачи энергии (smFRET) обеспечивает запись конформанформивальных изменений, происходящих отдельными молекулами в режиме реального времени. Таким образом, smFRET является мощным в измерении структурных изменений в ферменте или субстрате во время связывания и катализа. Эта работа представляет собой протокол для одномолекулярной визуализации взаимодействия четырехсторонней коллидейской развязки (HJ) и зазорной эндонуклеазы I (GEN1), цитосоликического гомолегаричного фермента рекомбинации. Также представлены одноцветные и двухцветные переменные возбуждения (ALEX) smFRET экспериментальных протоколов следовать резолюции HJ GEN1 в режиме реального времени. Кинетика димеризации GEN1 определяется в HJ, который, как было предложено, играет ключевую роль в разрешении HJ и остается неуловимым до сих пор. Описанные здесь методы могут быть широко применены для получения ценных механистических идей многих ферментно-ДНК-систем.
Введение
Одномолекулярные методы, основанные на обнаружении флуоресценции, обеспечивают высокое соотношение сигнала к шуму1. FRET является спектроскопической техникой, которая может измерять расстояния в диапазоне 1-10 нм, делая этот метод молекулярным линейкой для измерения расстояний в диапазоне нанометров2,3. Спектр поглощения принимает частичное спектральное совпадение со спектром выбросов донора на более коротком конце волны. FRET опосредовано передачей энергии без излучения между парой донора и принимающего, в то время как эффективность передачи энергии зависит от расстояния и ориентации принимающего4.
Было реализовано несколько подходов, чтобы свести к минимуму фон и повысить эффективность обнаружения сигнала флуоресценции5,6. Одним из подходов является конфокальная микроскопия, в которой пинхол ограничивает место возбуждения размером ниже предела дифракции7. Другим подходом является тотальная внутренняя флуоресценция отражения (TIRF), которая представляет собой широкополевой метод освещения, в котором свет направлен вне оси выше критического угла8. Свет затем полностью внутренне отражается на интерфейсе между стеклом и водным раствором, генерируя эвакуационную волну, которая освещает флюорофоры, прикрепленные к стеклянной поверхности, и предотвращает фон от флюорофоров в остальной части решение.
В конфокальной микроскопии молекулы могут быть либо свободно рассеяны, либо обездвижены на поверхности. Достигнутое временное разрешение может быть в пределах микросекунд до нескольких миллисекунд9. Конфоккодное обнаружение для одной молекулы осуществляется однофотональным лавинным диодом (SPAD) и точечное сканирование области, представляющим интерес10. В TIRF, временные ряды из нескольких сотен молекул, обездвиженных на поверхности, регистрируется позиционно-чувствительным двухмерным детектором заряда (CCD). CCD усиливает сигнал флуоресценции либо за счет усиленного фосфорного экрана и микроканальной пластины, либо помножения фотоэлектронов на чипе (EMCCD). Временное разрешение зависит от скорости считывания и квантовой эффективности CCD и обычно на порядка нескольких десятков миллисекунд6.
HJ является центральным промежуточным в реабире ДНК и рекомбинации11,12,13,14. HJ имеет две непрерывные и две пересекающиеся нити, которые соединяются между непрерывными нитями, не пересекаясь друг с другом. HJ существует в решении как X-штабированные конформисты, которые проходят непрерывную изомеризацию непрерывными стренгами, становясь скрещиваниями, а стыковки становятся непрерывными в другом конформате15. Изомер предпочтения HJ зависит от основной последовательности и ионной среды и был широко изучен FRET16,17,18,19.
GEN120 является мономерным белком в растворе21 и требует димеризации, чтобы расщеплять HJ, что позволяет правильное разделение рекомбинированных нитей22,23. Укладка конформат предпочтения HJ влияет на результат генетической рекомбинации, установив ориентацию резолюции HJ resolvases24. Понимание того, как GEN1 связывает HJ, координирует два разреза, и обеспечивает его полное разрешение все были в интенсивномисследовании21,22,23,25,26 ,27,28,29,30.
В этом исследовании используется объективная настройка TIRF, как описано ранее31. Двухцветные переменные возбуждения (ALEX) применяется для определения конформационных изменений при взаимодействии GEN1 с флюорофором помечены HJ. ALEX производит 2D гистограммы на основе двух соотношений FRET эффективности E, которая является донором-приемщиком расстояния зависит, и stoichiometry параметр S, который измеряет донора-приемного stoichiometry32. ALEX позволяет сортировать флуоресцентные виды на основе стоихиометрии флюорофоров, включая только донора, только принимать, и смешанные субпопуляции. ALEX может расширить использование FRET в полном диапазоне и может обнаружить различия в яркости флюорофора и олигомеризации, а также контролировать макромолекулы-лиганд взаимодействия33.
Установлено, что GEN1 последовательно успешно решает Проблему HJ в течение всего срока службы комплекса GEN1-HJ. Зависящие от времени конформационные изменения происходят из временных следов отдельных молекул, в то время как гистограммы представляют распределение основных популяций. С использованием замедленного одноцветного FRET, быстрые на-ставки и медленные off-тарифы для GEN1 димер продемонстрированы, которые увеличивают сродство собранного GEN1 dimer на первом продукте разреза.
протокол
1. Подготовка поверхностно-функциональных крышки
-
Очистки
- Поместите пять покрывало (24 мм х 60 мм) в этанол внутри банки Коплина. Соникат в этаноле затем в 1 М гидроксид калия в течение 30 мин в течение 3x. Вымойте в ацетон 3x затем decant.
-
Силанизация
- Подготовьте раствор 2,8% 3-аминопропилтриэтитоксилана (APTES) в ацетоне. Печать бутылку APTES с парафина пленкой и хранить при 4 градусах Цельсия.
ПРИМЕЧАНИЕ: Используйте защитные очки и работать под дымом капот. Контейнер силанного раствора должен быть полностью сухим и промыть ацетоном непосредственно перед и после заливки силанного раствора в банку. - Налейте 70 мл раствора 2,8% APTES в банку Coplin, содержащую крышки. Встряхните банку в течение 4 минут в орбитальном шейкере.
- Пусть банку стоять на скамейке в течение 5 минут, sonicate в течение 1 мин, и, наконец, держать банку на скамейке еще 10 минут для силана реагировать с гидроксиловых групп на стеклянной поверхности.
- Утолить реакцию добавлением 1 л деионизированной воды, наливая воду прямо в банку для быстрого обмена растворителями. Промыть слайды 3x в воде боком встряхивания банку на плоской поверхности.
- Возьмите крышки из банки и поместите их на лоток алюминиевой фольги. Выпекать крышки в духовке при температуре 110 градусов по Цельсию в течение 30 минут, чтобы высушить крышки и вылечить силан. Оставьте поднос на скамейке для крышки, чтобы остыть до комнатной температуры.
- Подготовьте раствор 2,8% 3-аминопропилтриэтитоксилана (APTES) в ацетоне. Печать бутылку APTES с парафина пленкой и хранить при 4 градусах Цельсия.
-
ПЕГилис
- Разогрейте биоинтинилатированные ПЭГ и ПЭГ, хранящиеся при температуре в комнате (RT) при температуре в ней до температуры воздуха (RT), чтобы предотвратить конденсацию влаги при открытии контейнера.
- Поместите пять покрывало с исилифицированной поверхностью вверх на коробку. Поместите два крышки стеклянные скольжения (22 мм х 22 мм) в качестве прокладки по краям силанизированных крышки.
- После разогрева, сделать биоинтинилапотированные РЕШЕНИЯ PEG и PEG в соотношении 1:100 в 1 мл свежего, 0,1 М бикарбонат натрия раствор, добавив 1,5 мг биотинилатированного ПЭГ и 150 мг ПЭГ в 1,5 мл трубки.
- Vortex трубки для растворения PEG и спина вниз, чтобы удалить пузырьки воздуха.
ПРИМЕЧАНИЕ: Идя вперед от этого шага, быть быстрым, потому что PEG гидролизов в решении в сроки мин. - Быстро нанесите 100 зл на решение PEG к каждому крышке. Возьмите еще один запеченный coverslip и поместите его верхней илонами поверхности лицом вниз на верхней части крышки с решением PEG, следовательно, образуя стеклянный раствор стекла бутерброд, в котором 22 мм х 22 мм не силанизированных крышки позволяют два функционализированных coverslips быть разделены легко.
- Инкубировать крышки на ночь (16 ч) в темноте и на RT. После того, как инкубация завершена, принять coverslips друг от друга, а затем промыть 10x с помощью деионизированной воды путем мытья со стороны с брызг бутылку.
- Высушите крышки под потоком сухого азота. Храните сухие крышки под вакуумом.
ПРИМЕЧАНИЕ: Слайды могут быть использованы в течение 1 месяца без ухудшения качества.
2. Подготовка клеток потока
-
Одноканальная ячейка потока
- Просверлите два отверстия диаметром 1,22 мм в средней части кварцевой горки (50 мм х 20 мм) с центрами, расположенными на глубине 37 мм друг от друга и 6,5 мм от края слайда(рисунок 1А).
- Вырежьте канал 41 мм х 2,25 мм на 50 мм х 20 мм куска двойного клея листа с помощью электронного резака.
- Очистите пластиковую сторону защитной крышки и выровнять края кусок с краями кварцевой горки. Удалите захваченных пузырьков воздуха, нажав осторожно с парой политетрафтотроэтилена пинцета.
- Очистите от бумажной стороны клей кусок. Установите кусок на функционализованную поверхность крышки.
- Нарежьте полиэтиленовые трубки (I.D. 1.22 мм) длиной 11 см для входе и 25 см для розетки. Вставьте трубку в ранее просверленные отверстия в качестве впуска и выхода для ячейки потока.
- Используйте 5 мин эпоксидный клей для уплотнения по краям кварца-coverslip интерфейса и вокруг труб для входе и розетки.
- Используйте ячейку потока сразу же, как только она высыхает или хранить под сухим вакуумом для последующего использования.
- Растворите айдин в PBS до концентрации 0,03 мг/мл. Фильтр через фильтр шприца 0,2 мкм.
- Поток avidin в ячейку потока с помощью шприца 1 мл. Используйте другой шприц, наполненный буфером, чтобы вымыть избыток авидина. Будьте осторожны, чтобы не ввести пузырьки воздуха при обмене шприцев.
-
Многоканальная ячейка потока
- Просверлите шесть отверстий диаметром 1,22 мм на каждой из длинных сторон кварцевой горки (76 мм х 25 мм)(рисунок 1B). Сделайте отверстия 4,5 мм от края слайда и 9,3 мм друг от друга. Убедитесь, что расстояние между центрами каждой пары отверстия составляет 15 мм.
- Вырежьте шесть каналов (20 мм х 2,25 мм) в 76 мм х 25 мм кусок двойной клейкой ленты с помощью электронного резака.
- Очистите пластиковую сторону защитной крышки и выровнять края клей кусок с краями кварцевой слайд. Удалите все захваченные пузырьки воздуха, нежно нажав с помощью пары политетрафториленовых пинцетов.
- Очистите бумажную сторону клейкой части и смонтировать на функционализованной поверхности coverslip.
ПРИМЕЧАНИЕ: Иногда пилинг с стороны бумаги и крепления к кварцевой горке хорошо работает в многоканальной ячейке потока. - Вырезать впускные трубки (11 см) и розетки (25 см) для шести каналов. Подготовьте ячейку потока, описанную в шагах 2.1.6-2.1.9.
- Подключите розетку Первого канала к насосу. Поместите входе в трубку 0,5 мл с OSS.
ПРИМЕЧАНИЕ: Длина впускной трубки выбрана для максимального количества событий в экспериментах по расщеплению, выполняемых при непрерывном потоке путем синхронизации времени входа фермента в ячейку потока и начала визуализации, тем самым уменьшая преждевременное фотоотбеление флюорофоры. - Перейдите на новый канал, отключив выход используемого канала. Закройте розетку штепсельной вилкой из шприцовой иглы, запечатанной клеем в пластиковой части. Закройте впускной канал.
3. Подготовка системы очистки кислорода (OSS)
- Растворите 0,2 г (к)-6-гидрокси-2,5,7,8-тетраметилхромане-2-карбоксиловая кислота (тройной утопление состояния, которое сводит к минимуму мигание флюорофоров) в 800 л метанола.
- Добавьте 6 мл деионизированного H2O и добавьте 1 N NaOH dropwise, пока он не растворится. Фильтр через фильтр шприца, сделать в 1 мл aliquots, и хранить при -80 градусов по Цельсию. Концентрация запасов составляет 100 мкм.
- Приготовьте свежий раствор 3,4-дихроксибензойной кислоты (PCA), растворив 61 мг порошка ПХА в 4 мл дДГ2O. Концентрация запасов составляет 100 нм.
- Добавьте 58 кЛ из 10 N NaOH dropwise, убедившись, что вихрь после каждой капли, пока PCA полностью растворяется (pH No 9).
- Растворите 5,3 мг протокатчуата 3,4-диоксигеназы (3,4-PCD) в 7 мл буфера хранения PCD (таблица 1). 3,4-PCD удаляет кислород из связывающих/ расщепляющихся буферов путем катализации окисления протокатчуйской кислоты34.
- Разделите раствор PCD на 1 мл aliquots. Концентрация запасов составляет 1 евро. Snap-заморозить аликвоты в жидком азоте и хранить на -80 градусов по Цельсию для долгосрочного хранения или на -20 градусов по Цельсию для кратковременного хранения.
- Подготовьте свежий связывающий буфер(таблица 1). Замените 2 mM CaCl2 с 2 мМ MgCl2 для экспериментов по расщеплению smFRET.
- Подготовьте 1 мл буфера изображения(таблица 1). Держите буфер изображения на льду до тех пор пока он не ввести в клетку потока для поддержания деятельности системы очистки кислорода.
4. Подготовка флуоресцентно помеченных HJs
- Восстановите лиофилизированные олиго(таблица 2) в буфере Tris-EDTA(Таблица 1) до концентрации 100 мкм.
- Подготовка синтетического соединения путем смешивания эквимолярных порций 3 зл и каждого из олиго X0, перечисленных в таблице 1.
- Аннеал при нагревании при температуре 95 градусов по Цельсию в течение 5 мин с последующим медленным охлаждением на RT со скоростью 1 кв/мин. Используйте либо теплоблок, либо термоциклор ПЦР для достижения желаемой скорости охлаждения.
- Загрузите смесь на 8 см х 8 см 10% Tris-borate-EDTA полиакриламимид гель. Нанесите 100 В и запустите гель для 2 ч. Полосы хорошо видны на глаз, и их цвет фиолетовый.
- Акциз полосы annealed субстрата с чистым лезвием. Перенесите кусок геля в автоматическую трубку 1,5 мл.
- Измельчите кусок геля внутри трубки с чистым поршенем, затем добавьте 100 злитрового буфера TE100(таблица 1).
- Извлекайте HJ путем встряхивая пробку на 20 c на 1.500 rpm в thermomixer для 2 h или инкубировать всю ночь на 4 c.
- Выполните осадки в этаноле на растворе, содержащем субстрат35.
- Повторное увеличение субстрата в 20 кЛ буфера TE100(таблица 1). Окончательная концентрация составляет от 1до3 мкм. Аликот 2 л в каждой трубке и хранить при -20 градусов по Цельсию.
5. Выражение белка и очищение GEN1
- Постройте плазмид для выражения усеченного человека GEN11,2,3,4,5 с гекса гистидин-тегом на C-терминах20 по ПЦР вектора входа.
ПРИМЕЧАНИЕ: N-терминал пометки приведет к инактивации GEN1. Неструктурированный C-хвост значительно усложняет очистку полной длины GEN1. Кроме того, в сятворный GEN1 в полной длине, как сообщается, проявляет меньшую активность, чем усеченная версия23. - Преобразуйте вектор экспрессии в E. coli BL21-CodonPlus (DE3)-RIPL штамм.
- Прививать преобразованные клетки в две 6 l колбы каждый, содержащий 2 L люрии бульон ампрессов на 37 градусов с встряхиванием при 180 об/мин до тех пор, пока OD600 0,8 достигается.
- Охладите культуру до 16 градусов по Цельсию и нависните экспрессией GEN1 с 0,1 мМ изопропил-и-д-тиогалактопиранозид (IPTG) в течение 48 ч.
- Урожай клетки, вращая их вниз при 4 градусах по Цельсию при 1000 х г в центрифуге. Каждый литр культуры дает 5-6 г гранул.
- Откажитесь от супернатанта и resuspend гранулированных клеток в буфере лиза(Таблица 1) с помощью 4 мл/г клеток.
- Выполните лизис клетки с помощью клеточного разрушителя на 30 kPsi затем спина вниз на 10000 х г в течение 1 ч при 4 c. Соберите супернатант и отфильтруйте его на льду с помощью фильтров 0,45 мкм.
- Выполните очистку белка с помощью FPLC, проходя фильтрат через 5 мл Ni-NTA колонки на 2,5 мл / мин скорость потока с помощью буфера A (Таблица 1).
- Вымойте 15 объемов столбцов (CV). Elute с линейным градиентом буфера И имидазола и 500 мМ более 20 CV в 5 мл фракций. GEN1 высажывается из колонны на уровне около 100 мМ Имидазол.
- Pipette 10 qL aliquots из собранных фракций, добавить равный объем 2x SDS загрузки красителя для каждого aliquot. Денатурная образцы, нагревая при 90 градусах по Цельсию в течение 5 минут, охладите и скрутите образцы.
- Загрузите образцы на 10% гель Bis-Tris. Выполнить гель в течение 30-45 минут на 200 В. Пятно с помощью Coomassie Brilliant Blue, а затем destain. Соберите фракции, содержащие очищенный GEN1.
- Уменьшите концентрацию соли комбинированных фракций до 100 мМ путем разбавления с помощью буфера C(Таблица 1).
- Передайте белок с низким содержанием соли через столбец гепарина 5 мл при скорости потока 3 мл/мин с помощью буфера B(Таблица 1).
- Вымойте с 10 CV. Elute с помощью градиента 20 CV с буфером B и 1 M NaCl. Соберите 5 мл фракций, в которых GEN1 elutes около 360 мМ NaCl.
- Проверьте eluted фракций для очищенных gen1 фракций, как описано в шаге 5.8. Объедините эти фракции и разбавьте до 100 мМ NaCl с помощью Buffer C.
- Загрузите нижний белок соли на столбобмена обмена катиона на 1 мл/мин скорость потока с помощью буфера B.
- Elute градиентом 40 CV с использованием буфера B и 1 M NaCl. Соберите 1,7 мл фракций, в которых GEN1 щелкает около 300 мМ NaCl.
- Проверьте чистоту GEN1 в неприглядных фракциях, описанных в шаге 5.8.
- Объедините чистейшие фракции и диализ при 4 градусах по Цельсию против буфера хранения(таблица 1). Выполните по крайней мере один обмен буфера во время диализа.
- Измерьте концентрацию белка 0,5-1 мг/мл. Aliquot диализированного белка в 10-15 мл объемов в небольших трубках, флэш-заморозки в жидком азоте, и хранить при -80 градусов по Цельсию.
6. Одномолекулярные эксперименты ФРЕТ
ПРИМЕЧАНИЕ: SmFRET эксперименты выполняются на специально построенной объективной настройки TIRF (Рисунок 1C), описанные ранее31.
- Одноцветные эксперименты FRET
- Нанесите одну каплю масла погружения на цель 100x TIRF. Установите EMCCD для подходящей прибыли для оптимизации сигнала на задний план и предотвращения насыщения.
ПРИМЕЧАНИЕ: Не смотрите прямо в лазерный луч и носить защитные очки при выравнивании лазера. - Тщательно поместите ячейку потока на держатель образца. Постепенно повышайте цель, используя грубую регулировку до тех пор, пока масло не коснется крышки.
- Включите зеленый лазер (532 нм). Переключитесь на режим тонкой настройки цели. Направьте выброс в порт камеры, чтобы наблюдать за изображением на мониторе.
- Отрегулируйте высоту цели до тех пор, пока функционализированная поверхность крышки не будет приведена в фокус и не может наблюдаться на мониторе.
ПРИМЕЧАНИЕ: Приобретение изображения EMCCD вызывает лазерное возбуждение через acousto-оптический tunable фильтр (AOTF), чтобы предотвратить фотоотраблирование образца, когда изображения не приобретаются. - Убедитесь, что фон от функционализованной поверхности крышки не превышает нескольких пятен, прежде чем течет в флуоресцентно помечены HJ.
- Разбавить запас субстрата примерно 1000 раз в буфере TE100(таблица 1) до конечной концентрации 1-5 нм. Пипетка 0,2-0,5 л разбавленного субстрата в 120 л буфера изображения с OSS в трубку 0,5 мл.
- Подключите розетку ячейки потока к насосу шприца. Вставьте впускную трубку в трубу 1,5 мл и управляйте шприц-насосом со скоростью потока 30-50 л/мин, чтобы вывести раствор из трубки.
- Часто проверяйте поверхность на наличие хорошего покрытия (100–300 однородно распределенного, хорошо расставленного субстрата) путем краткого изображения с помощью зеленого лазера.
- Если поверхностного покрытия все еще недостаточно, либо подождите несколько минут, чтобы флуоресцентно помеченный HJ из раствора осесть на поверхность или повторите протекающий шаг.
- Поток еще 120 л буфера изображения (Таблица 1) на 30-50 л / мин для мытья несвязанных флуоресцентно помечены HJ. Затем пусть поток ячейки сидеть в течение 5 минут, чтобы позволить OSS истощать растворенный кислород. Фотоотбеление флюорофоров должно быть минимальным в начале визуализации.
- Установите время экспозиции (60 мс), время цикла будет автоматически устанавливаться программным обеспечением на основе скорости передачи данных (104 мс) и указывать нужное количество циклов или кадров (400 евро). Выброс от донора (Cy3) и принимает (Alexa Fluor 647) делится на два цветовых канала устройством сплиттера.
- Найдите подходящую область на поверхности, сфокусируйте изображение, регулируя высоту цели и запишите и сохраните фильм в 16-битном формате TIFF.
- Перемещение в новую область.
ПРИМЕЧАНИЕ: Всегда двигайтесь только в одном направлении (т.е. от розетки до входного), чтобы избежать изображения одной и той же области дважды. - Подготовьте 1, 2, 5, 10, 25, 50, 75 и 100 нм GEN1 в 120 зЛ буфера изображения по одному. Поток раствора на скорости потока 30-50 л/мин.
ПРИМЕЧАНИЕ: Если требуемое измерение выполняется в стабильном состоянии, как в связке HJ gen1 или изомеризации свободного HJ, то подождите 3-5 минут после того, как поток останавливается, чтобы записать фильм. Приобретите от трех до четырех фильмов из новых областей для каждой концентрации GEN1. - Если измерение выполняется под непрерывным потоком, как в расщеплении HJ GEN1, то начните запись 5-10 с перед входом GEN1 в ячейку потока. Повторите измерение, перейдя на новый канал в шестиканальной ячейке потока.
- В конце используйте фиксированную флуоресцентную горку из биса, чтобы сопоставить частицы донора и принимать друг с другом в устройстве расщепления изображения.
- Добавьте 0,2 л флуоресцентных бусин диаметром 1 мкм в 500 л. 1 М Трис (рН и 8,0), чтобы шарики прилипли к поверхности.
- Вырежьте квадрат (18 мм х 18 мм) внутри 22 мм х 22 мм кусок двустороннего клейого уплотнения. Очистите и приклеите кусок к середине 76 мм х 25 мм кварцевой слайд.
- Поместите 50 зл и несколько разбавленного раствора бисера и оставьте на 5-10 мин. Прикрепите 22 мм х 22 мм coverslip на верхней части квадратной части. Сухой лишний раствор шариков раствор с тканью, затем запечатать камеру эпоксидным клеем.
- Приобретите 100 кадров из бисера слайд на 60 мс время экспозиции.
ВНИМАНИЕ: Снижение мощности лазера и EMCCD получить до минимума, чтобы избежать насыщения детектора. - Установите пакет программного обеспечения (например, TwoTones) и откройте фильмы в них, как указано в руководстве пользователя36. Выберите положение отдельных бусин в каналах донора и приемотеля. Создайте матрицу преобразования, описанную в руководстве.
ПРИМЕЧАНИЕ: Это программное обеспечение использует матрицу преобразования, чтобы соответствовать положениям частиц в каналах донора и принимает и исправить для любого небольшого несоответствия в устройстве расщепления изображения. - Перейти к файлу,нажмите Загрузить фильм, а затем выберите файл фильма и нажмите Открыть. В меню файлов нажмите кнопку «Нагрузка TFORM» и выберите матрицу преобразования, генерируемую из слайда бисера. Отрегулируйте порог для каналов донора и принимающего государства до тех пор, пока не будут включены ложные срабатывания.
- В меню фильтра канала выберите вариант D и A, который можно выбрать для частиц, помеченных как донором, так и принимающим. Проверьте ближайшее поле ограничения соседа, чтобы исключить молекулы, которые находятся очень близко друг к другу. Проверьте эллиптивность Макса, чтобы исключить очень эксцентричные молекулы и проверьте пределы ширины, чтобы исключить очень широкие или очень узкие молекулы.
- Введите plotHistCW, как указано в руководстве Twotones, чтобы построить гистограммы.
ПРИМЕЧАНИЕ: "Очевидная" эффективность FRET рассчитывается по программе путем деления выбросов принимающего на общий объем выбросов от донора и принимающего. Twotones использует 100 интервалов для того чтобы bin распределение положений молекул против эффективности FRET. - Введите plotTimetraceCW, как указано в руководстве Twotones для генерации временных следов для каждой молекулы.
ПРИМЕЧАНИЕ: Временные следы могут быть дополнительно проанализированы vbFRET37 для определения различных состояний FRET, их соответствующих времен пребывания, и скорость перехода между различными государствами.
- Нанесите одну каплю масла погружения на цель 100x TIRF. Установите EMCCD для подходящей прибыли для оптимизации сигнала на задний план и предотвращения насыщения.
- Двухцветные чередующиеся эксперименты FRET (ALEX)
- Запись фильма, состоящего из последовательных кадров донора и принимает выбросов путем прямого возбуждения с зелеными и красными лазерами, соответственно, каждый 80 мс в продолжительности.
- Откройте приобретенные фильмы ALEX в Twotones. Установить подходящий порог обнаружения в размере 300 евро для трех каналов: выброс донора из-за возбуждения донорами (DexDem); эмиссии, принимая в результате возбуждения донорами (DexAem); и принятие выбросов из-за прямого возбуждения (AexAem).
- Примените фильтр канала DexDem и DexAem и AexAem, чтобы выбрать для частиц, которые имеют как донора, так и принимающего. Свяжите частицы 200-300 в трех каналах.
- Используйте код plotHistALEX MATLAB для генерации гистограмм ALEX. Fit различных пиков в гистограммах на gaussian функции и определить процент каждой популяции области под кривой с помощью программного обеспечения происхождения38.
ПРИМЕЧАНИЕ: Пики в связывающем асссе соответствуют связанного комплекса GEN1-HJ, в то время как в свободном HJ пики представляют собой меняющиеся изомеры. - Используйте код plotTimetraceALEX MATLAB для создания временной трассы для каждой молекулы, показывающей выбросдонора путем прямого возбуждения, и принимающих выбросов из-за FRET и прямого возбуждения.
ПРИМЕЧАНИЕ: ALEX временные следы независимо, чтобы показать выбросы как донора и принимающего, но при более низком временном разрешении, чем одноцветный FRET. Подобно одноцветному FRET, alex time-traces можно дополнительно проанализировать vbFRET для выявления различных состояний FRET и их соответствующих времен. - Определите постоянную диссоциацию, приспособив проценты концентрации связанного населения к концентрации GEN1 к гиперболической функции.
- Промежуток времени одноцветный FRET
- Установите время экспозиции зеленого лазера до 60 мс и время цикла до 624 мс или ниже, в зависимости от скорости наблюдаемой динамики.
- Установите скорость потока до 110 л/мин в одном канале шестиканальной ячейки потока. Начните запись кратко перед входом GEN1 внутри ячейки потока.
ПРИМЕЧАНИЕ: Непрерывный поток приводит к быстрому фотоотбелению флюорофоров, поэтому синхронизация начала визуализации и ввода белка максимизирует количество захваченных событий. Оптимальное считывание шприцевого насоса зависит от мертвого объема и точного тюбингов, используемых для сборки ячейки потока; в нашем случае это 25 евро. - Приобретите фильм в размере 125 кадров на общую сумму 78 с. В конце записи, подвергать образец красный лазер для 50 кадров каждый с 25 мс время экспозиции для зонда приемного.
ПРИМЕЧАНИЕ: Этот метод продлевает окно наблюдения в эксперименте расщепления за счет уменьшения числа циклов возбуждения. Кинетические параметры как kon и koff dimerization выводятся путем установки распределения на двухэкспоненциальную модель30,38.
7. Электрофоретические переплеты подвижности (EMSA)
- В 50 мл общего объема, инкубировать желаемую концентрацию GEN1 с 50 pM Cy5-маркированных HJ на RT в течение 30 минут в EMSA связывающий буфер (Таблица 1).
- Загрузите образцы на 8 см х 8 см 6% tris-borate-EDTA гель. Выполнить гель, используя 100 V в течение 1 ч 20 мин в 1x буфер TBE на RT.
- Определить процент связанного субстрата в концентрации GEN1 от его относительного вклада в общую интенсивность флуоресценции соответствующей полосы движения.
ПРИМЕЧАНИЕ: GEN1 мономер-HJ (группа I) определяется по соглашению его размера с пиколярной привязкой gen1gen GEN1 к nicked HJ21,30. GEN1-dimer-HJ присваивается в группу II из-за поэтапной привязки мономера GEN1 к HJ21,23. - Рассчитайте кажущуюся связующую константу Kd-monomer-app-EMSA и Kd-dimer-app-EMSA с помощью уравнения:

Где: Макс – это концентрация, при которой соответствующий вид достиг своей максимальной связывания (мономер или димер); n является коэффициентом Хилла; K d-app-EMSA является очевидной связывающей константой соответствующего вида, обозначающей концентрацию GEN1, при которой присутствует полумаксимум мономера или димера.
Результаты
Конформа смещения и изомеризации HJ
Изомеризация HJ была широко исследована FRET через маркировку двух смежных рук соединения17,18,39. Донор (Cy3) и принимающий (Alexa Fluor 647) расположены на двух соседних руках, R (strand 2) и X (strand 3), соответственно(рисунок 2A). Изомеры сложены-X были назначены двумя непрерывными нитями (т.е. Iso (1,3) или Iso (2,4). В гистограмме ALEX FRET соседней метки X0 показаны два пика, которые соответствуют обмену более обильного Изо (1,3) (E 0,75) и менее обильной Изо (2,4) (E 0.40) (Рисунок 2B).
Одноцветный FRET используется для получения временных следов для записи быстрых конформанзидальных изменений в свободном HJ с высоким временным разрешением 10 мс за счет уменьшения используемой области камеры EMCCD2. Представитель одноцветный ФРЕТ-метки X0 соединения показывает переходы между высоким и низким изомерителями FRET(рисунок 2B). Изомеризация ставки kIso (1,3)-Iso (2,4) и kIso (2,4)-Iso (1,3), полученные из пребывания время гистограммы Iso (1,3) и Iso (2,4) (Рисунок 2C) согласуются с теми, о которых сообщалось ранее17.
SMFRET демонстрирует активное искажение HJ GEN1
HJ подвергается структурной перестройке при привязке к GEN122. Таким образом, расстояние между донором и принимающим является одинаковым как в Iso (1,3) и Iso (2,4)(рисунок 3A). SmFRET связывания анализы были проведены в присутствии Ca2 "для предотвращения расщепления HJ. Гистограммы ФРЕТ смежного перекрестка X0 в различных концентрациях GEN1 были приобретены ALEX(рисунок 3B). Гистограмма подходит для двух гауссианских функций: одна, соответствующая свободному высокому FRET Iso (1,3), а другая, соответствующая связанной популяции GEN1-HJ после вычитания вклада Iso (2,4) из низкого пика FRET.
При насыщении концентрации GEN1, гистограмма FRET X0 имеет только один низкий пик FRET, соответствующий GEN1, связанный с либо изомером HJ, как и предсказывала модель22. Явная мономерная диссоциация постоянной(Kd-мономер-приложение) определяется из гиперболического припадка процентов популяции GEN1 в зависимости от концентрации GEN1(рисунок 3C). Соседняя этикетка nk-X0 представляет собой познавательную nicked версию HJ, которая имитирует продукт после первой реакции разреза. Из-за рельефа укладки деформации смоделированным ник, nk-X0 является неизомерисвая структура40, как видно из одного пика субстрата на E 0,40, в отличие от X0 (Рисунок 3D против Рисунок 3B). Структура комплекса GEN1-nk-X0 аналогична структуре комплекса GEN1-X0, о чем свидетельствует сходство эффективности FRET (E 0,25 для nk-X0 и 0,32 для X0)(рисунок 3D против. Рисунок 3B). Сильная привязка мономера GEN1 к nk-X0 демонстрируется в 40-кратно более низким значением Kd-monomer-app, чем значение X0 (рисунок 3E против рисунка 3C). Эта жесткая привязка может выступать в качестве защитного механизма против неполного разрешения HJ в маловероятном случае диссоциации GEN1 dimer или одного из его мономеров.
Пошаговая привязка мономера GEN1 к HJ
Привязка gen1-мономера GEN1 к HJ, за которым следует димер образование, является уникальной особенностью для эукариотического HJ resolvase GEN1 по сравнению с прокариотическими резолвазами, которые существуют в димерической форме в растворе21,23,41. EMSA GEN1 на 50 pM X0 показывает пошаговую ассоциацию GEN1 в комплексы более высокого порядка, о чем свидетельствуют римские цифры в верхней панели (рисунок 4A). Диссоциация константы gen1 мономера определяется EMSA(Kd-мономер-EMSA) совпадает с диссоциацией постоянной от smFRET связывающей асссы Kd-monomer-app (Рисунок 4A и Рисунок 3C , соответственно). Количественная оценка группы II используется для расчета равновесной диссоциации константы GEN1 dimer(Kd-dimer-EMSA). EMSA GEN1 на 50 pM nk-X0 демонстрирует видный мономер связывания, как указано на очень низкий Kd-мономер-приложение-EMSA, который в 30 раз ниже, чем у X0, в то время как его Kd-dimer-EMSA является сопоставимы с X0 (рисунок 4B).
Еще одним доказательством того, что gen1mer GEN1 связывает и искажает HJ является наблюдение значительное количество следов дядежных частиц со стабильным низким состоянием FRET(Рисунок 4C) в присутствии Mg2 "при низких концентрациях GEN1. Количество этих следов уменьшилось после увеличения концентрации GEN1. Разрешение HJ обусловлено жесткой связывания gen1mer GEN1, который поддерживает образование димера. Привязка мономеров наблюдается во времени-следы дяди nk-X0 в Mg2 ",который простирается до нескольких наномоллярной концентрации (Рисунок 4D). Мономер GEN1 плотно связывается, чтобы защитить nk-X0, в конечном итоге обеспечивая полное разрешение через димер формирования.
SMFRET резолюции асссе HJ
Термин "расщепление" в smFRET анализы используется взаимозаменяемо с "разрешение" HJ, так как в этом анализе только релиз продукта, который следует за вторым событием расщепления обнаруживается. События регистрируются замедленной одноцветной возбуждением, чтобы свести к минимуму фотоотбеление фоточувствительного приемителя в течение времени приобретения в размере 1,3 мин.
Схема на рисунке 5A иллюстрирует разрезы прядей 1 и 3 X0 Iso (1,3) после связывания и искажения GEN1 x0, прикрепленного к функционализированному стеклу. И донор, и принимающий идут в решение, приводящее к потере их сигналов после разрешения HJ. Первый и второй разрезы разъединяются в nk-X0, что является примером прототипа частично разрешенного HJ. После связывания GEN1, nk-X0 принимает аналогичную структуру x0. Резолюция действует одним разрезом в ните 1, как показано на рисунке 5B.
Одновременное отъезд донора и принимающего после стабильного низкого состояния FRET в следах разрешенного X0 произошло без появления промежуточного FRET (E q 0.40) указывает на то, что полное разрешение происходит в течение срока службы GEN1-HJ комплекс(рисунок 5C). Таким образом, эти результаты позволяют предположить, что разрешение HJ происходит в течение срока службы комплекса GEN1-HJ. Разрешение nk-X0 также продолжается после структурной перестройки и завершается отъездом дуплекса, перевозящего два флюорофора(рисунок 5D),похожий на X0.
Кинетика gen1 димеризации на GEN1 мономер связанH
Тайм-лап smFRET меры -до расщепления, который в основном включает в себя время, необходимое для димера формирования и разрешения HJ после искажения GEN1 мономер. Применяя этот метод, прямые доказательства предоставляются в поддержку утверждения о том, что димер формирования требуется для разрешения как X0 и nk-X0, так как распределение дорасщепления GEN1 концентрации зависит.
Очевидная скорость разрешения HJ(kapp)определяется как обратная середина среднего значения дорасщепления при соответствующей концентрации GEN1. Термин "видимый" используется для описания скорости резолюции HJ, поскольку возможность того, что GEN1 остается привязанным к продукту после разрешения HJ, не может быть исключена.
Функции плотности вероятности (PDF)распределения X 0 X0 (рисунок 6A)отражают время образования димера, которое длиннее при низких концентрациях GEN1, а затем короче при более высоких концентрациях GEN1. Коэффициенты ассоциации и диссоциации для димера, kon-dimer и koff-dimer,соответственно, определяются по двухэкспоненциальной модели30. Кроме того, PDF-файлы nk-X0 (рисунок 6B)показывают аналогичное распределение x0, что указывает на требование к образованию димера.
Сюжет k-приложения по сравнению с концентрацией GEN1 был приспособлен к гиперболической функции. Явный констант скорости катализа(kMax-app) X0 и nk-X0 0 0.107 и 0.011 s-1 и 0.231 s-1, соответственно(Рисунок 6C). Сюжеты kприложение для X0 и nk-X0 переходы пересекаются на концентрации GEN1 5,6 нм из-за более быстрого kMax-app и медленнее kon-dimer из nicked по сравнению с нетронутой соединения.
Таким образом, относительно быстрый kon-dimer и медленный koff-dimer приводят к прогрессированию передовой реакции к разрешению HJ после того, как димер формируется. Сильная привязка мономера GEN1 к перекрестку nk-X0 представляет собой механизм безотказного отказа против любого маловероятного прерванного второго расщепления или помогает подобрать неполнонерешенные HJ, оставленные первичными путями разрешения в ячейке.
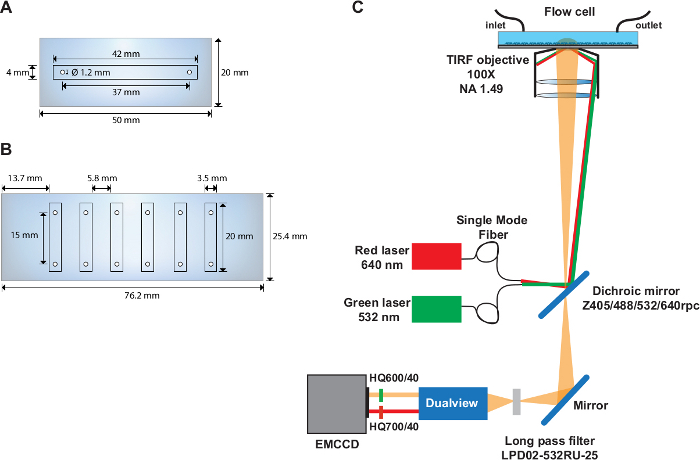
Рисунок 1: Одно- и многоканальные ячейки потока и макет оптической настройки.
(A) Схема одноканальной ячейки потока. (B) Схема шестиканальной ячейки потока. (C) Layout оптической настройки с изображением источников возбуждения, TIRF цель, дихроическое зеркало, установленное внутри фильтра куба, и фильтры выбросов, используемые в устройстве сплиттер изображения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Conformer смещения и изомеризации HJ наблюдается FRET.
(A) Изомеризация смежных этикетки X-штабелированные HJ конформии назван в честь двух непрерывных нитей. Нити пронумерованы, а руки обозначаются буквами. Места разреза показаны стрелками. Указаны позиции донора (зеленый) и принимающего (красный) и изменения в FRET после изомеризации. (B) Правая панель: FRET след времени (черный) и идеализированный след FRET (красный) X0 на 50 mM Mg2 " Левая панель: гистограмма FRET X0 на 50 мМ Мг2 " Интенсивность флуоресценции донора (зеленый) и ректора (красный) показаны ниже. (C) Гистограммы времени смежного ярлыка X0 Iso (1,3) и Iso (2,4) были приспособлены к одноэкспоненциальным функциям для определения показателей изомеризации. Неопределенности указывают на 95% доверительный интервал пригонки. Эта цифра была изменена из ранее опубликованной литературы30.
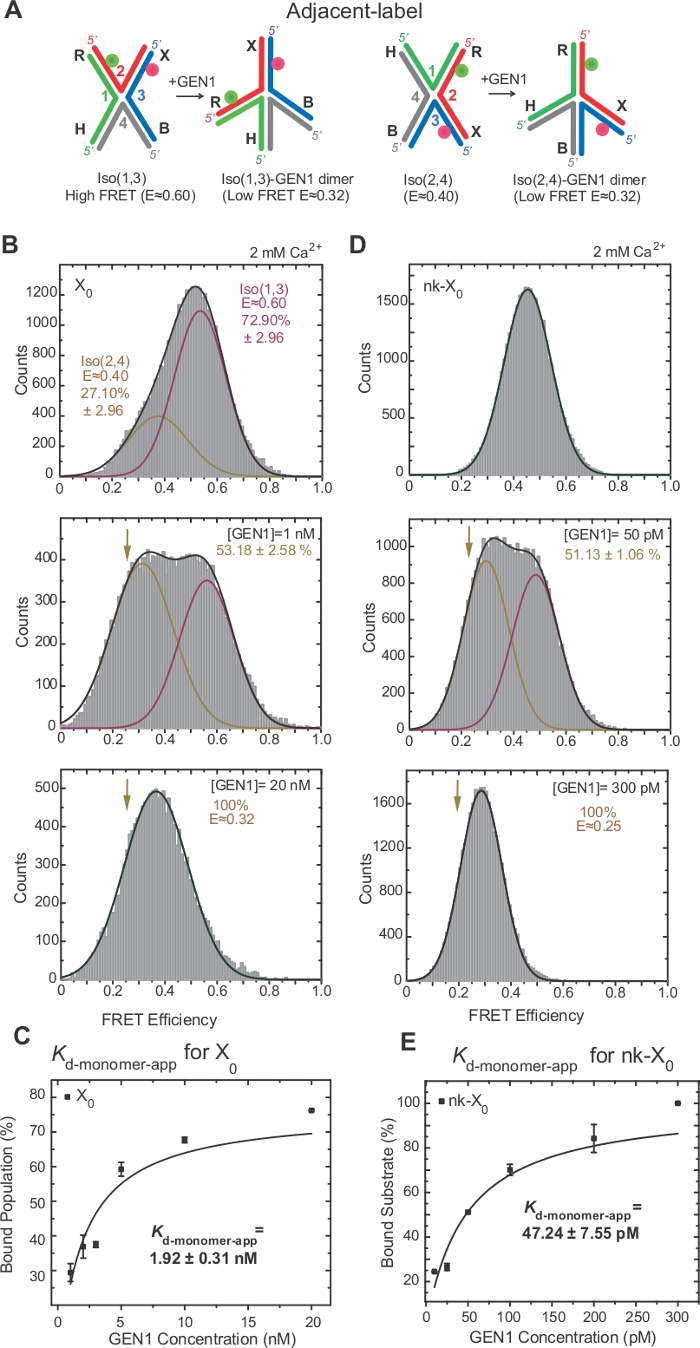
Рисунок 3: Активное искажение HJ GEN1.
(A) Структурная модификация смежного лейбла HJ на основе предлагаемой модели22. (B) АЛЕКС ФРЕТ гистограмма соседней этикетки X0 имеет большой высокий пик FRET (E q 0.6), соответствующий Iso (1,3) и более низкий пик FRET (E q 0.4) для Iso (2,4). Вся гистограмма подходит для двух гауссианских функций: одна соответствует свободному высокому ФРЭО Изо (1,3), а другая соответствует связанной популяции минус первоначальный вклад Изо (2,4) в общую популяцию. (C) Явная мономерная диссоциация постоянной (Kd-мономер-приложение) определяется от гиперболического припадка процентов популяций, связанных GEN1, как функция концентрации GEN1. (D) ФРЕТ гистограммы соседней этикетки nk-X0 при различных концентрациях GEN1. Область под низким FRET (E q 0.25) Гауссиан соответствует проценту связанного населения. (E) Kd-мономер-приложение nk-X0 определяется из гиперболического припадка популяции GEN1. Бары ошибок представляют собой стандартные отклонения от двух или более экспериментов. Эта цифра была изменена из ранее опубликованной литературы30. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Пошаговая привязка GEN1 к HJ.
(A) Электрофоретический перепад подвижности асссеи (EMSA) GEN1 на 50 pM X0. Верхняя панель: римские цифры указывают количество мономеров GEN1 в комплексе. Нижняя панель: привязка мономера GEN1 к X0. Явные константы диссоциации были получены из сигмоидального припадка соответствующих видов и представляют собой в среднем два эксперимента. (B) EMSA GEN1 на 50 pM nk-X0 демонстрирует видный мономер связывания, как указано на очень низком Kd-мономер-приложение-EMSA. (C) FRET временной след связаны, но дяди смежных этикетке X0 в Mg2 ". Донорское возбуждение в течение 1,3 мин было выполнено, за которым последовало прямое возбуждение приемки (затененный розовый регион). (D) FRET временной след связаны, но дяди смежных этикетке nk-X0 в Mg2 ". Эта цифра была изменена из ранее опубликованной литературы30. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: SMFRET резолюции асссе из HJ.
(A) Схема смежного ярлыка X0 Iso (1,3) после искажения GEN1. Субстрат крепится к функционализованной поверхности через связь биотин/авидина. Диссоциация GEN1 после двух разрезов приводит к потере как донора, так и принимающего, которые идут в решение. (B) Схема разрешения соседней этикетки nk-X0 путем расщепляя прядь 1. (C) Временной след (черный) на 2 мМ Мг 2 "расщепления Изо (1,3). Начало связывания GEN1 формирует стабильное низкое состояние FRET до тех пор, пока сигнал FRET не будет внезапно потерян из-за расщепления. Соответственно, увеличение донора и уменьшение интенсивности флуоресценции приемки при связке GEN1 сопровождается одновременным исчезновением флуоресценции от обоих красителей при расщеплении. (D) Аналогичным образом, временной след nk-X0 показывает стабильное низкое состояние FRET на связывании GEN1, которое завершается резкой потерей сигнала FRET. Эта цифра была изменена из ранее опубликованной литературы30. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Кинетика GEN1 димеризации на GEN1 мономер связан HJ.
(A) Функция плотности вероятности (PDF) участок распределения X0 до расщепления иллюстрирует его зависимость от концентрации GEN1. Время ожидания низкого состояния FRET (дорасщепления)при соответствующей концентрации GEN1 было получено из двух или более экспериментов и использовано для получения средних ставок(kapp). Перечисленные ставки kприложения определяются на основе обратного среднего значения -до расщепления при соответствующей концентрации GEN1. Ассоциация(kon-dimer)и диссоциация(koff-dimer) тарифы для димер-образования рассчитываются из двухэкспоненциальной модели38. Ошибки представляют SEMприложения k. (B) График PDF распределения nk-X0 и соответствующих курсовприложений k. (C) Участок kприложение по сравнению с концентрацией GEN1 установлены на гиперболические функции для определения очевидной каталитической скорости(kMax-приложение). Сюжет kприложение для X0 и nk-X0 иллюстрирует более быстрый первоначальный kприложение X0, который затем превзошел nk-X0 выше »GEN1» 5,6 нм. Эта цифра была изменена из ранее опубликованной литературы30. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Буфера | Компостия | ||
| Связывание буфера | 40 мМ Tris-HCl pH 7.5, 40 mM NaCl, 2 mM CaCl2,1 mM DTT, 0.1% BSA и 5% (v/v) глицерол | ||
| Буфер А | 20 мМ Tris-HCl pH 8.0, 1 мМ DTT и 300 мМ NaCl | ||
| Буфер B | 20 мМ Tris-HCl pH 8.0, 1 мМ DTT и 100 мМ NaCl | ||
| Буфер C | 20 мМ Tris-HCl pH 8.0 и 1 mM DTT | ||
| Буфер расщепления | 40 мМ Tris-HCl pH 7.5, 40 mM NaCl, 2 mM MgCl2,1 mM DTT, 0.1% BSA и 5% (v/v) глицерол | ||
| Связывающий буфер EMSA | 40 мм Tris-HCl pH 7.5, 40 mM NaCl, 1 mM DTT, 2 mM CaCl2, 0.1 мг/мл BSA, 5% (v/v) глицерол и 5 нг/л Поли-dI-dC | ||
| Буфер изображения (связывание) | 40 зЛ (к)-6-Гидрокси-2,5,7,8-тетраметилхромане-2-карбоксиловая кислота (4 мл), 60 ЗЛ ПКА (6 нМ), 60 Л ПкД (60 нм) и 840 л связывающего буфера | ||
| Буфер изображения (расщепление) | 40 зЛ (к)-6-Гидрокси-2,5,7,8-тетраметилхромане-2-карбоксиловая кислота (4 мл), 60 ЗЛ ПХА (6 нм), 60 Л ПкД (60 нм) и 840 л буфера расщепления | ||
| Лисис буфер | 20 мМ Tris-HCl pH 8.0, 10 мМ-меркаптоэтанол, 300 мМ NaCl и 2 мМ PMSF | ||
| Буфер хранения PCD | 100 мм Tris-HCl pH 7.5, 1 мМ EDTA, 50 мМ KCl и 50% глицерол | ||
| буфер хранения | 20 мМ Tris-HCl pH 8.0, 1 мМ DTT, 0,1 мМ EDTA, 100 мМ NaCl и 10% глицерол | ||
| Буфер TBE | 89 мМ Tris-HCl, 89 мм Борная кислота и 2 мМ EDTA | ||
| Буфер TE100 | 10 мМ Tris.HCl pH 8.0 и 100 mM NaCl | ||
| Буфер Tris-EDTA | 50 мМ Tris-HCl pH 8.0 и 1 mM EDTA pH 8.0 | ||
Таблица 1: Список буферов и их составы, используемые в данном исследовании.
| Олиго | Последовательности | ||
| X0-st1 | ACGCTGCCGAATCTACCAGTCTCTTGCTAGGACTTGGC | ||
| X0-st2 | GGGTGAACCTGCAGGTGGG/iCy3/AAAGATGTCCATCTGTGTGTGTGTGttGTAATCGTCAAGCTTTTTTGTGTGTGTGTGTGTTTATGCCGTGTGTGTTTTTGTGTGTGTGTGTGTGTGTGTGTGTGTTGTGTTGTGTGTTGTGTTGTGTGTTGTGTGTGTTGTGTTGTGTTGTTGTGTGTTGTGTGTTGTGTGTGTTGTGT | ||
| X0-st3 | ACGGCATAAAGCTTGACGA/iAF647-dT/TACAACAGATGATGGAGCGCTAGAGCGGACTATCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCG | ||
| X0-st4 | 5'BiotinCGATAGTCGGATCCCTCGAGAGCTAGAGCGCAGCACTGGTAGAATTCGGGCGT | ||
| X0-Adj | X0-st1, X0-st2, X0-st3 и X0-st4 | ||
| X0Инст2 | ГГГГГААККТГГГГГГГГГГГГГГГТГТКТКТГТГТГТЦЦАААККТЦТЦААГККТЦКГГГГГГГГГГГГГГГГГГГГГТКТГТГТГТЦАААКТЦКГГГГГГГГГГГГГГГГ | ||
| X0Инст4 | 5'BiotinCGATAGTCGGATCCTCTACAGAGCTATGTAGCAAGGCA/iCy3/TGGTAGAATTCGGCAGCGT | ||
| Nk-X0 | X0-st1, X0-st2, X0-nk3a, X0-nk3b и X0-st4 | ||
| X0-nk3a | ACGGCATAAAGCTTGACGA/iAF647-dT/TACAACAGATC | ||
| X0-nk3b | ATGGAGCTCTAGAGGATCTACTCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCGCG | ||
Таблица 2: Субстраты SMFRET и EMSA HJ. Список олигонуклеотидов, используемых для подготовки флуоресцентно помеченных HJ для smFRET и EMSA. Олиго были получены на коммерческой уровне. Флуоресцентно помеченные олиго были очищены HPLC, и, когда это возможно, олиго с 60 bp были очищены.
Обсуждение
В этом исследовании были внедрены различные методы smFRET для определения кинетики разрешения HJ GEN130. Аналогичные подходы smFRET были использованы для выполнения двойного клапана ДНК конформационного требования и расщепления репликации ДНК и ремонта клапана эндонуклеаза 142,43,44. Здесь обсуждаются критические шаги в этом протоколе. Реакция силанизации должна быть свободна от любых следов влажности. Решение пегилации следует быстро применять к силанизированному стеклу после растворения ПЭГ, чтобы избежать гидролиза. В многоканальной ячейке потока любой захваченный воздух в клейом листе должен быть удален, чтобы избежать утечки между соседними каналами. Раствор PCA должен быть свежеприготовлен, так как он окисляется с течением времени. Добавление 10 N NaOH должно быть dropwise, с вихрем между ними. Фон флуоресценции в крышке должен быть минимальным, прежде чем течь флуоресцентно помечены HJ. Изображение в ячейке потока должно быть выполнено в одном направлении, чтобы избежать отбеленных изображений областей. В экспериментах ALEX, сила красного лазера должна быть уменьшена, чтобы избежать быстрого отбеливания приемного. В экспериментах замедленного времени время цикла должно быть короче, чем самое быстрое событие.
smFRET является чувствительным методом, который может обеспечить ценную информацию в режиме реального времени в биомолекулярных реакциях. Тем не менее, этот метод имеет ряд технических проблем, среди которых является достижение измеримых изменений в FRET во время биохимической реакции. Это необходимо для того чтобы получить well-separated характеристики в гистограммах и различимых положениях в следах времени. Во многих случаях smFRET требует тщательного проектирования субстратов, выбора пар фторофора и их позиций, а также усиления изменений FRET в субстрате ДНК из-за незначительного структурных изменений в субстрате45. Другой подход для выполнения FRET заключается в использовании помеченных белков46. Окно наблюдения в FRET ограничено стабильностью приемного, такого как Cy5 или Alexa Fluor 647, который имеет тенденцию к отбеливанию быстрее, чем донор (Cy3 в данном случае). Таким образом, FRET требует постоянного поиска стабильных фторофоров, чтобы продлить продолжительность эксперимента и усилия по разработке систем очистки кислорода, чтобы продлить сигнал флуоресценции и максимизировать соотношение сигнала к шуму47,48 .
Среди советов по устранению неполадок в smFRET является балансирование нескольких параметров, участвующих в визуализации, таких как мощность лазера, время экспозиции, время цикла, и количество циклов, чтобы максимизировать выброс флуоресценции, продлить продолжительность эксперимента, и достичь соответствующие интервалы отбора проб для динамики ферментов. Более длительное время наблюдения и минимальные эффекты от фотоотбелевания имеют важное значение для получения высокой точности осязать распределение времени, которые представляют динамику фермента. ALEX генерирует лучшие гистограммы, так как этот метод подвергается более низкому вкладу от фотоотраблированных частиц по сравнению с одноцветной FRET. Тем не менее, временное разрешение в ALEX ниже, чем в одноцветных FRET.
Наконец, акцент smFRET на обнаружение конформационных/структурных изменений в отдельных молекулах в режиме реального времени преодолевает разрыв между структурными методами высокого разрешения (т.е. рентгеновская кристаллография, ядерный магнитный резонанс, электронная микроскопия), которая обеспечивает структурное разрешение атомного разрешения в статических условиях и методах, которые дают среднему ансамблю измеримое свойство. Во многих аспектах smFRET зарекомендовал себя как мощный метод изучения биологических систем в режиме реального времени.
Раскрытие информации
Авторы не заявляют о каких-либо конкурирующих финансовых интересах.
Благодарности
Эта работа была поддержана Университетом науки и техники короля Абдаллы через основное финансирование и премию за конкурентные исследования (CRG3) С.М.Х.
Материалы
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
Ссылки
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены