Method Article
Métodos de transferência da energia da ressonância da único-molécula Förster para a investigação tempo real da definição da junção de Holliday por GEN1
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
É apresentado aqui um protocolo para executar a transferência de energia da ressonância da único-molécula Förster para estudar a definição HJ. A excitação alternada de duas cores é usada para determinar as constantes de dissociação. O lapso de tempo da único-cor smFRET é aplicado então em ensaios do clivagem do tempo real para obter a distribuição do tempo de permanência antes da definição de HJ.
Resumo
Os métodos maiorias medem o comportamento do Ensemble das moléculas, em que as taxas individuais da reação das etapas subjacentes são médias durante todo a população. A transferência de energia da ressonância da único-molécula Förster (smfret) fornece uma gravação das mudanças conformacional que acontecem por moléculas individuais no tempo real. Conseqüentemente, smFRET é poderoso em medir mudanças estruturais na enzima ou no substrato durante a ligação e a catálise. Este trabalho apresenta um protocolo para a imagem latente da único-molécula da interação de uma junção de quatro vias de Holliday (HJ) e de endonuclease I da abertura (GEN1), uma enzima homólogo citosólico do recombinação. Também são apresentados são de cor única e dois-cor alternada excitação (ALEX) smFRET protocolos experimentais para seguir a resolução do HJ por GEN1 em tempo real. A cinética da dimerização de GEN1 é determinada no HJ, que tem sido sugerido para desempenhar um papel fundamental na resolução do HJ e permaneceu elusiva até agora. As técnicas descritas aqui podem ser amplamente aplicadas para obter valiosos insights mecanísticos de muitos sistemas de DNA enzimático.
Introdução
Os métodos da único-molécula baseados na deteção da fluorescência fornecem relações sinal-à-ruído elevadas1. A traste é uma técnica espectroscópica que pode medir distâncias na faixa de 1 – 10 nm, tornando esta técnica como uma régua molecular para medir distâncias na faixa de nanômetro2,3. O espectro de absorção do aceitador tem uma sobreposição espectral parcial com o espectro de emissão do doador na extremidade mais curta do comprimento de onda. O FRET é mediado pela transferência de energia sem radiação entre um doador e um par aceitador, enquanto a eficiência da transferência de energia depende da distância e da orientação do aceitador4.
Várias abordagens foram implementadas para minimizar o background e melhorar a eficiência de detecção do sinal de fluorescência5,6. Uma abordagem é a microscopia confocal, na qual um furo de pino restringe o ponto de excitação a um tamanho abaixo do limite de difração7. Uma outra aproximação é fluorescência interna total da reflexão (TIRF), que é uma técnica da iluminação do largo-campo em que a luz é dirigida fora-linha central acima de um ângulo crítico8. A luz é então totalmente refletida internamente na interface entre o vidro e a solução aquosa, gerando uma onda evanescente que só ilumina os fluoróforos ligados à superfície de vidro e previne o fundo dos fluoróforos no resto do a solução.
Na microscopia confocal, as moléculas podem ser livremente difundidas ou superfície imobilizada. A resolução temporal alcançada pode estar dentro de microssegundos para vários milissegundos9. A detecção confocal para uma única molécula é realizada por díodo de avalanche de fóton único (SPAD) e varredura ponto-a-ponto da região de interesse10. Em TIRF, uma série temporal de algumas centenas de moléculas imobilizadas na superfície é gravada por um detector acoplado de carga bidimensional sensível à posição (CCD). O CCD amplifica o sinal de fluorescência, quer pela intensificação da tela de fósforo e placa de microcanal ou na multiplicação de chips de fotoelétrons (EMCCD). A resolução temporal depende da velocidade de leitura e da eficiência quântica do CCD e, geralmente, da ordem de algumas dezenas de milissegundos6.
HJ é um intermediário central no reparo e no recombinação do ADN11,12,13,14. HJ tem dois contínuos e duas vertentes do cruzamento que conectam entre as costas contínuas sem cruzar-se. HJ existe na solução como Conformers X-empilhados, que se submetem a isomerização contínuo pelas costas contínuas que tornam-se cruzar e as costas do cruzamento que tornam-se contínuas nos outros conformer15. A preferência do isômero do hj depende da sequência central e do ambiente iônico e tem sido extensivamente estudada pela traste16,17,18,19.
GEN120 é uma proteína monomérica na solução21 e requer dimerização para Cleave o HJ, permitindo assim a separação adequada das vertentes recombinadas22,23. A preferência do conformer de empilhamento do hj influencia o resultado do recombinação genético ajustando a orientação da definição pelos resolvasos hj24. Entendendo como Gen1 vincula o HJ, coordena as duas incisões, e garante a sua resolução completa foram todos estudo intensivo21,22,23,25,26 ,27,28,29,30.
Neste estudo, um conjunto de TIRF baseado em objetivos é usado como descrito anteriormente31. A excitação alterna da dois-cor (Alex) é aplicada para determinar as mudanças conformacionais em cima da interação de Gen1 com o fluoróforo etiquetado hj. A ALEX produz histogramas 2D com base em dois parâmetros ratiométricos de eficiência FRET e, que é dependente da distância do doador, e o parâmetro de estequiometria S, que mede a estequiometria do doador-aceitador32. ALEX permite a triagem de espécies fluorescentes com base nas estequiometrias dos fluoróforos, incluindo apenas doadores, apenas aceitador, e subpopulações mistas. ALEX pode estender o uso de FRET para a gama completa e pode detectar diferenças no brilho de fluoróforo e oligomerização, bem como monitorar interações macromolécula-ligante33.
Encontra-se que GEN1 consistentemente sucede em resolver o HJ dentro da vida do complexo de GEN1-HJ. As mudanças conformacionais dependentes do tempo são derivadas dos traços temporais das moléculas individuais, enquanto os histogramas representam a distribuição das populações subjacentes. Usando o tempo-lapso único-cor fret, rápido on-Rates e retardar fora-taxas para o dímero Gen1 são demonstrados, que aumentam a afinidade do dímero montado Gen1 no primeiro produto da incisão.
Protocolo
1. preparação de COVERSLIP superfície-functionalized
-
Limpeza
- Coloque cinco coberturas (24 mm x 60 mm) em etanol dentro de um frasco de Coplin. SONICATE em etanol em seguida, em 1 M de hidróxido de potássio por 30 min para 3x. Lave em acetona 3x, em seguida, decantar.
-
Silanização
- Prepare uma solução de 2,8% 3-Aminopropyltriethoxysilane (APTES) na acetona. Selar a garrafa APTES com uma película de parafina e armazenar a 4 ° c.
Nota: Use óculos de segurança e trabalhe uma capa de fumaça. O recipiente da solução do silano deve estar completamente seco e enxaguado pela acetona imediatamente antes e depois de derramar a solução do silano no frasco. - Despeje 70 mL da solução de 2,8% APTES no frasco de Coplin contendo as lamelas. Agitar o jarro por 4 min em um agitador orbital.
- Deixe o pote ficar no banco por 5 min, proceda por 1 min, e, finalmente, manter o pote no banco por mais 10 min para o silano para reagir com os grupos hidroxila na superfície de vidro.
- Saciar a reação pela adição de 1 L de água deionizada derramando água diretamente no frasco para troca rápida de solventes. Enxágüe as corrediças 3x na água pela agitação lateral do frasco em uma superfície plana.
- Tire as coberturas do jarro e coloque-as sobre uma bandeja de alumínio. Assar as coberturas em um forno a 110 ° c por 30 min para secar as lamelas e curar o silano. Deixe a bandeja no banco para que as lamínulas esfriem até a temperatura ambiente.
- Prepare uma solução de 2,8% 3-Aminopropyltriethoxysilane (APTES) na acetona. Selar a garrafa APTES com uma película de parafina e armazenar a 4 ° c.
-
PEGylation
- Aqueça o PEG e o PEG biotinylated, armazenados em-20 ° c à temperatura ambiente (RT) para impedir a condensação da umidade em cima de abrir o recipiente.
- Coloque cinco coberturas com a superfície silanizada voltada para cima em uma caixa. Coloque dois deslizamentos de vidro da tampa (22 milímetros x 22 milímetros) como espaçadores ao longo das bordas dos COVERSLIP SILANIZADOS.
- Uma vez aquecido, fazer soluções PEG e PEG biotinylated em uma proporção de ~ 1:100 em 1 mL de solução de bicarbonato de sódio de 0,1 M fresco, adicionando 1,5 mg de PEG biotinylated e 150 mg de PEG em um tubo de 1,5 mL.
- Vórtice do tubo para dissolver PEG e girar para baixo para remover bolhas de ar.
Nota: indo para a frente a partir desta etapa, ser rápido, porque Peg hidrolisa em solução dentro de uma escala temporal de min. - Aplique rapidamente 100 μL da solução PEG em cada lamínula. Tome um outro lamela cozido e coloc sua superfície SILANIZADOS superior face-para baixo sobre o lamela com a solução do Peg, daqui dando forma a um sanduíche do vidro-solução-vidro em que os 22 milímetros x 22 milímetros não-SILANIZADOS as coberturas permitem que os dois coverdesliza funcionalizados ser separados facilmente.
- Incubar os lamínulas durante a noite (16 h) no escuro e no RT. Uma vez que a incubação está completa, retire as coberturas, em seguida, enxague 10x usando água deionizada por lavagem do lado com uma garrafa de esguicho.
- Seque os lamínulas um fluxo de nitrogênio seco. Guarde os lamínulas secas vácuo.
Nota: os slides podem ser usados por 1 mês sem degradação da qualidade.
2. preparação da célula de fluxo
-
Célula de fluxo de canal único
- Perfure dois furos com 1,22 mm de diâmetro na parte média de uma corrediça de quartzo (50 mm x 20 mm) com os centros situados a 37 mm de distância e 6,5 mm a partir da borda do slide (Figura 1a).
- Corte um canal de 41 mm x 2,25 mm em um pedaço de 50 mm x 20 mm de uma folha de adesivo duplo usando um cortador eletrônico.
- Retire o lado plástico da tampa protetora e alinhe as bordas da peça com as bordas da corrediça de quartzo. Retire as bolhas de ar presas pressionando suavemente com um par de tweezers de politetrafluoroetileno.
- Retire o lado do papel da peça adesiva. Monte a peça na superfície funcionalizada da lamínula.
- Corte o tubo do polietileno (identificação 1,22 milímetro) em um comprimento de 11 cm para a entrada e 25 cm para a tomada. Introduza o tubo nos furos previamente perfurados como a entrada e a tomada para a pilha de fluxo.
- Use a colagem da cola Epoxy de 5 minutos para selar em torno das bordas da relação do quartzo-COVERSLIP e em torno dos tubos para a entrada e a tomada.
- Use a célula de fluxo imediatamente depois de secar ou armazenar vácuo seco para uso posterior.
- Dissolver avidina em PBS a uma concentração de 0, 3 mg/mL. Filtrar por filtro de seringa de 0,2 μm.
- Fluxo avidina na célula de fluxo usando uma seringa de 1 mL. Use uma outra seringa enchida com o amortecedor para lavar para fora o avidin adicional. Tenha cuidado para não introduzir bolhas de ar durante a troca das seringas.
-
Célula de fluxo de múltiplos canais
- Perfurar seis furos com um diâmetro de 1,22 mm em cada um dos lados longos de uma lâmina de quartzo (76 mm x 25 mm) (Figura 1b). Faça os furos 4,5 milímetros da borda da corrediça e de 9,3 milímetros distante. Assegure-se de que a distância entre os centros de cada par de furos é de 15 mm.
- Cortar seis canais (20 mm x 2,25 mm) em um pedaço de fita adesiva dupla de 76 mm x 25 mm usando o cortador eletrônico.
- Retire o lado plástico da tampa protetora e alinhe as bordas da peça adesiva com as bordas da corrediça de quartzo. Remova todas as bolhas de ar prendidas pela pressão delicada usando um par de tweezers do politetrafluoretileno.
- Retire o lado do papel da peça adesiva e monte na superfície funcionalizada da lamínula.
Nota: às vezes descascando o lado do papel e anexando ao slide de quartzo funciona bem na célula de fluxo multicanal. - Corte os tubos de entrada (11 cm) e os tubos de saída (25 cm) para os seis canais. Prepare a célula de fluxo conforme descrito nas etapas 2.1.6 – 2.1.9.
- Ligue a tomada do primeiro canal à bomba. Coloque a entrada no tubo de 0,5 mL com OSS.
Nota: o comprimento do tubo de entrada é escolhido para maximizar o número de eventos nos experimentos de clivagem realizados fluxo contínuo, sincronizando o tempo de entrada da enzima na célula de fluxo e início da imagem, diminuindo assim o fotobranqueamento prematuro do fluoróforos. - Mova para um novo canal desligando a saída do canal usado. Feche a tomada com um plugue feito de uma agulha da seringa selada com a colagem na divisória plástica. Feche a entrada do canal usado.
3. preparação do sistema de eliminação de oxigénio (OSS)
- Dissolver 0,2 g de (±)-5-hidroxi-2,5,7,8-tetrametilchromane-2-carboxílico ácido (trigêmeos estado quencher que minimiza o piscar dos fluoróforos) em 800 μL de metanol.
- Adicionar 6 ml deionizada H2O e adicionar 1 N NaOH gota gota até que se dissolve. Filtre através de um filtro de seringa, faça em alíquotas de 1 mL e armazene a-80 ° c. A concentração de ações é de ~ 100 μM.
- Prepare uma solução fresca do ácido 3,4-dihroxybenzoic (PCA) dissolvendo 61 MGS do pó de PCA em 4 mL de ddH2O. A concentração de ações é de ~ 100 nM.
- Adicionar 58 μL de 10 N NaOH Dropwise, certificando-se de vórtice após cada gota até que o PCA esteja totalmente dissolvido (pH = 9).
- Dissolver 5,3 mg de protocatechuato 3,4-dioxigenase (3,4-PCD) em 7 mL de tampão de armazenamento de PCD (tabela 1). 3,4-PCD remove o oxigênio dos bufferes da ligação/clivagem Catalisando a oxidação do ácido protocatechuic34.
- Divida a solução PCD em alíquotas de 1 mL. A concentração de estoque é ~ 1 μM. encaixe-congele as alíquotas no nitrogênio líquido e armazene-o em-80 ° c para o armazenamento a longo prazo ou a-20 ° c para o armazenamento a curto prazo.
- Prepare uma reserva de ligação fresca (tabela 1). Substitua 2 mM de CaCl2 por 2 mm de MgCl2 para experimentos de clivagem de smfret.
- Prepare 1 mL do tampão de imagem (tabela 1). Mantenha o buffer de imagem no gelo até que ele seja introduzido na célula de fluxo para manter a atividade do sistema de eliminação de oxigênio.
4. preparação de HJS cDNAs etiquetados
- Reconstituir os oligos liofilizados (tabela 2) no tampão Tris-EDTA (tabela 1) para uma concentração de 100 μm.
- Prepare a junção sintética misturando porções equimolares ~ 3 μL de cada um dos X0 oligos listados na tabela 1.
- Anneal por aquecimento a 95 ° c por 5 min seguido de arrefecimento lento para RT a uma taxa de 1 ° c/min. Use um bloco de calor ou termocicer PCR para atingir a taxa de resfriamento desejada.
- Coloque a mistura em 8 cm x 8 cm de 10% de gel de poliacrilamida Tris-borato-EDTA. Aplique 100 V e execute o gel para ~ 2 h. As bandas são claramente vistas por olho, e sua cor é roxa.
- Extirpar a banda do substrato recozido com uma lâmina limpa. Transfira a peça de gel para um tubo de 1,5 mL autoclavado.
- Esmagar a peça de gel dentro do tubo com um êmbolo limpo, em seguida, adicione 100 μL de buffer TE100 (tabela 1).
- Extraia o HJ agitando o tubo no ° c 20 em 1.500 RPM em um no para ~ 2 h ou incubar durante a noite em 4 ° c.
- Realize a precipitação do etanol na solução que contém o substrato35.
- Ressuscitem o substrato em 20 μL de tampão TE100 (tabela 1). A concentração final é de 1–3 ΜM. alíquota 2 μl em cada tubo e armazenar a-20 ° c.
5. expressão protéica e purificação de GEN1
- Construa o plasmídeo para a expressão de Gen1 humanos truncados1,2,3,4,5 com hexa histidine-tag no C-Terminus20 por PCR do vetor de entrada.
Nota: N-terminal tagging resultaria na inactivação de GEN1. A C-cauda não estruturada torna a purificação do comprimento total GEN1 significativamente mais difícil. Além disso, o comprimento total GEN1 foi relatado para exibir menos atividade que truncado versão23. - Transforme o vetor de expressão em E. coli BL21-codonplus (de3)-estirpe ripl.
- Inocular as células transformadas em dois frascos de 6 L contendo 2 L de caldo Luria a 37 ° c com agitação a 180 rpm até atingir um OD600 de 0,8.
- Esfrie a cultura para 16 ° c e induza a expressão de GEN1 com 0,1 mM de isopropílico-β-d-tiogalactopyranoside (IPTG) por 48 h.
- Colha as células girando-as a 4 ° c a 1000 x g em uma centrífuga. Cada litro de cultura rende 5–6 g do pellet.
- Descartar o sobrenadante e ressuscitou as células peletizadas em tampão de lise (tabela 1) usando 4 ml/g de células.
- Realize lise celular usando um disruptor de células a 30 kPsi e, em seguida, gire para baixo em 10.000 x g por 1 h a 4 ° c. Colete o sobrenadante e filtre-o no gelo usando filtros de 0,45 μm.
- Realize a purificação de proteínas utilizando o FPLC passando o filtrado através de uma coluna NI-NTA de 5 mL a 2,5 ml/min de caudal utilizando o tampão A (tabela 1).
- Lave com 15 volumes de coluna (CV). Elute com um gradiente linear de buffer A e 500 mM imidazol acima de 20 CV em frações de 5 mL. Gen1 elutos da coluna em torno de 100 mm imidazol.
- Pipete 10 μL de alíquotas das frações coletadas, adicione um volume igual de 2x corante de carga SDS a cada alíquota. Denature as amostras por aquecimento a 90 ° c por 5 min, cool, e girar para baixo as amostras.
- Carregar as amostras para 10% bis-Tris gel. Funcione o gel para 30–45 min em 200 V. mancha usando o azul brilhante de Coomassie, a seguir Destain. Colete as frações que contêm GEN1 purificadas.
- Reduza a concentração de sal das frações combinadas para 100 mM por diluição utilizando o tampão C (tabela 1).
- Passe a proteína de sal baixo através de uma coluna de heparina de 5 mL a um caudal de 3 mL/min utilizando o tampão B (tabela 1).
- Lave com 10 CV. elute usando um gradiente de 20 CV com tampão B e 1 M NaCl. Colete 5 ml de frações em que Gen1 elutos em torno de 360 mm NaCl.
- Verifique as frações eluída para frações de Gen1 purificadas, conforme descrito na etapa 5,8. Combine essas frações e diluir para 100 mM NaCl usando buffer C.
- Carregue a proteína de sal inferior numa coluna de troca catiónica com 1 mL/min de caudal utilizando o tampão B.
- Elute por um gradiente de 40 CV usando buffer B e 1 M NaCl. Colete 1,7 frações ml em que Gen1 elutos em torno de 300 mm NaCl.
- Verifique a pureza de Gen1 nas frações eluída conforme descrito na etapa 5,8.
- Combine as frações mais puros e Dialize a 4 ° c contra o tampão de armazenamento (tabela 1). Realize pelo menos uma troca do tampão durante a diálise.
- Medir a concentração proteica ~ 0,5–1 mg/ml. Aliquot a proteína diafiltrado em volumes de 10–15 μl em tubos pequenos, Flash-Freeze no nitrogênio líquido, e armazene em-80 ° c.
6. single-molécula FRET experimentos
Nota: os experimentos de smFRET são executados em uma base de TIRF baseada em objetivos personalizado-construído (Figura 1C) descrita previamente31.
- Experimentos de FRET de cor única
- Aplique uma gota de óleo de imersão no objetivo de 100x TIRF. Ajuste o EMCCD ao ganho apropriado para aperfeiçoar o sinal ao fundo e para impedir a saturação.
Nota: não olhe diretamente para o feixe de laser e usar óculos de proteção ao alinhar o laser. - Coloque a célula de fluxo cuidadosamente no suporte da amostra. Levante gradualmente o objetivo usando o ajuste grosseiro até que o óleo toque na lamínula.
- Ligue o laser verde (532 nm). Mude para o modo de ajuste fino do objetivo. Direcione a emissão para a porta da câmera para observar a imagem no monitor.
- Ajuste a altura do objetivo até que a superfície funcionalizada da lamínula seja trazida em foco e possa ser observada no monitor.
Nota: a aquisição da imagem por EMCCD aciona a excitação do laser através do filtro sintonável acousto-ótico (AOTF) para impedir o photobranqueamento da amostra quando as imagens não estão sendo adquiridas. - Verifique se o fundo da superfície funcionalizada dos lamelas não excede alguns pontos antes de fluir no HJ rotulado cDNAs.
- Diluir o substrato de estoque aproximadamente 1000 vezes no tampão TE100 (tabela 1) para uma concentração final de 1 – 5 nm. Pipete 0,2 – 0,5 μL do substrato diluído em 120 μL do tampão de imagem com OSS num tubo de 0,5 mL.
- Ligue a tomada da célula de fluxo à bomba da seringa. Insira o tubo de entrada da célula de fluxo no tubo de 1,5 mL e opere a bomba da seringa a uma vazão de 30 – 50 μL/min para retirar a solução do tubo.
- Verific freqüentemente a superfície para a boa cobertura (100 – 300 do substrato homogeneamente distribuído, bem espaçado) pela imagem latente momentaneamente com o laser verde.
- Se a cobertura de superfície ainda não é suficiente ou esperar por alguns minutos para a cDNAs rotulada hj da solução para resolver sobre a superfície ou repita a etapa de fluxo.
- Flua outro 120 μL de tampão de imagem (tabela 1) em 30 – 50 μL/min para lavar o não acoplado cDNAs rotulado hj. Deixe então a pilha do fluxo sentar-se por 5 minutos para permitir que o OSS esgote o oxigênio dissolvido. O fotobranqueamento dos fluoróforos deve ser mínimo no início da imagem.
- Definir o tempo de exposição (~ 60 MS), o tempo de ciclo será automaticamente definido pelo software com base na velocidade de transferência de dados (~ 104 MS), e especificar o número desejado de ciclos ou quadros (~ 400). A emissão do doador (Cy3) e aceitador (Alexa fluor 647) é dividida em dois canais de cores por um dispositivo divisor de imagem.
- Encontre uma área adequada na superfície, concentre a imagem ajustando a altura do objetivo e registre e salve o filme no formato TIFF de 16 bits.
- Mude para uma nova área.
Nota: Mova-se sempre em uma direção (ou seja, da saída para a entrada) para evitar a imagem da mesma área duas vezes. - Prepare 1, 2, 5, 10, 25, 50, 75 e 100 nM GEN1 em 120 μL de buffer de imagem um de cada vez. Flua a solução a uma taxa de fluxo de 30-50 μL/min.
Nota: se a medida exigida é feita o estado estacionário como na ligação de hj por Gen1 ou o isomerização do hj livre, a seguir Espere 3-5 minutos depois que o fluxo para gravar o filme. Adquira três a quatro filmes de novas áreas para cada concentração de GEN1. - Se a medição é realizada fluxo contínuo como em clivagem de HJ por GEN1, em seguida, começar a gravar 5 – 10 s antes da entrada de GEN1 na célula de fluxo. Repita a medição movendo-se para um novo canal na célula de fluxo de seis canais.
- Na extremidade, use uma corrediça fluorescente fixa do grânulo para mapear as partículas do doador e do Acceptor a se no dispositivo de rachadura da imagem.
- Adicionar 0,2 μL de grânulos fluorescentes de 1 μm de diâmetro em 500 μL de Tris de 1 M (pH = 8,0) para permitir que os grânulos grude na superfície.
- Corte um quadrado (18 mm x 18 mm) dentro de um pedaço de 22 mm x 22 mm de um selo adesivo de dupla face. Descasque e cole a peça no meio de uma corrediça de quartzo de 76 mm x 25 mm.
- Coloque 50 μL da solução de grânulos diluídos e deixe por 5 – 10 min para liquidar. Fixar uma lamínula de 22 mm x 22 mm em cima da peça quadrada. Seque o excesso da solução dos grânulos com tecido, a seguir Sele a câmara pela colagem da cola Epoxy.
- Adquira 100 frames do slide contas em um tempo de exposição 60 ms.
Cuidado: Abaixe a potência do laser e o ganho de EMCCD ao mínimo para evitar a saturação do detector. - Instale o pacote de software (por exemplo, TwoTones) e abra os filmes nele, conforme indicado no manual do usuário36. Selecione as posições dos grânulos individuais nos canais do doador e do aceitador. Gere uma matriz de transformação conforme descrito no manual.
Nota: este software usa a matriz da transformação para combinar as posições das partículas nos canais do doador e do Acceptor e correto para todo o desalinhamento ligeiro no dispositivo de rachadura da imagem. - Vá para arquivo, pressione carregar filme, em seguida, selecione o arquivo de filme e pressione abrir. No menu arquivo, pressione carregar TFORM e selecione a matriz de transformação gerada a partir do slide de contas. Ajuste o limiar para os canais de doador e aceitador até que não sejam incluídos falsos positivos.
- No menu do filtro do canal , escolha a opção D & & a para selecionar para as partículas etiquetadas com o doador e o aceitador. Verifique o campo de limite vizinho mais próximo para excluir moléculas que estão muito próximas umas das outras. Verifique elipticidade Max para excluir moléculas muito excêntricas e verificar limites de largura para excluir moléculas muito largas ou muito estreitas.
- Datilografe Plothistcw como instruído no manual de twotones para construir histogramas.
Nota: a eficiência do FRET "aparente" é calculada pelo programa dividindo a emissão do aceitador pelas emissões totais do doador e do aceitador. Twotones usa 100 intervalos para bin a distribuição dos Estados das moléculas contra a eficiência FRET. - Digite Plottimetracecw conforme instruído no manual do Twotones para gerar os rastreamentos de tempo para cada molécula.
Observação: os rastreamentos de tempo podem ser analisados por vbFRET37 para identificar diferentes Estados de fret, seus respectivos tempos de permanência e taxas de transição entre diferentes Estados.
- Aplique uma gota de óleo de imersão no objetivo de 100x TIRF. Ajuste o EMCCD ao ganho apropriado para aperfeiçoar o sinal ao fundo e para impedir a saturação.
- Dois-cor alternando excitação FRET (ALEX) experimentos
- Grave um filme composto por quadros consecutivos de emissões de doadores e aceitantes por excitações diretas com os lasers verdes e vermelhos, respectivamente, cada ~ 80 MS de duração.
- Abra os filmes adquiridos da ALEX em Twotones. Ajuste o limiar de detecção adequado como ~ 300 para os três canais: emissão de doadores devido à excitação do doador (DexDem); emissão do aceitador devido à excitação fornecedora (DexAem); e a emissão do Acceptor devido à excitação direta (AexAem).
- Aplique o filtro de canal DexDem & & DexAem & & AexAem para selecionar para as partículas que têm o doador e o acceptor. Ligue as partículas ~ 200 – 300 nos três canais.
- Use o código plotHistALEX MATLAB para gerar histogramas ALEX. Ajuste os picos diferentes nos histogramas às funções Gaussian e determine a porcentagem de cada população a área a curva usando o software da origem38.
Nota: os picos no ensaio de ligação correspondem ao complexo GEN1-HJ vinculado, enquanto no HJ livre, os picos representam os isómeros intercambiáveis. - Use o código de Plottimetracealex MATLAB para gerar um tempo-traço para cada molécula que mostra a emissão fornecedora pela excitação direta, e pelas emissões do Acceptor devido ao fret e à excitação direta.
Nota: ALEX tempo-rastreia de forma independente para mostrar as emissões do doador e aceitador, mas em menor resolução temporal do que single-cor FRET. Similar ao FRET da único-cor, o tempo-traços de ALEX pode mais ser analisado por vbFRET para identificar Estados diferentes do FRET e seus tempos de permanência respectivos. - Determine a constante de dissociação ajustando as porcentagens da população acoplada versus a concentração de GEN1 a uma função hiperbólica.
- Lapso de tempo single-cor FRET
- Defina o tempo de exposição do laser verde para 60 MS e tempo de ciclo para 624 MS ou inferior, dependendo da velocidade da dinâmica observada.
- Ajuste a taxa de fluxo a 110 μL/min em um canal da célula de fluxo de seis canais. Inicie a gravação brevemente antes da entrada de GEN1 dentro da célula de fluxo.
Nota: o fluxo contínuo conduz ao fotobranqueamento rápido dos fluoróforos, sincronizando conseqüentemente o começo da entrada da imagem latente e da proteína maximiza o número de eventos capturados. A leitura óptima da bomba da seringa depende do inoperante-volume e da tubulação exata usada para montar a pilha de fluxo; no nosso caso, é ~ 25 μL. - Adquira um filme de ~ 125 frames para um tempo de aquisição total de 78 s. No final da gravação, expor a amostra para o laser vermelho para 50 frames cada um com 25 MS tempo de exposição para sondar o aceitador.
Nota: Este método prolonga a janela de observação no experimento de clivagem, diminuindo o número de ciclos de excitação. Os parâmetros cinéticos como kem e kfora da dimerização são derivados ajustando a distribuição a um modelo bi-exponencial30,38.
7. ensaios de deslocamento de mobilidade electrophoretic (EMSA)
- Em 50 μL de volume total, incubar a concentração desejada de GEN1 com 50 pM Cy5-rotulados HJ em RT por 30 min no tampão de ligação EMSA (tabela 1).
- Carregue as amostras em 8 cm x 8 cm de 6% de gel Tris-borato-EDTA. Executar o gel usando 100 V para 1 h + 20 min em 1x TBE buffer em RT.
- Determine a porcentagem de substrato acoplado em uma concentração de GEN1 de sua contribuição relativa para a intensidade total de fluorescência da respectiva faixa.
Nota: Gen1 monômero-HJ (Band I) é identificado pelo acordo de seu tamanho com a ligação uma de Gen1 monômero para o cortado hj21,30. O Gen1-dimer-HJ é atribuído à faixa II por causa do emperramento Stepwise do monômero Gen1 ao hj21,23. - Calcule as constantes de ligação aparente kd-monomer-app-EMSA e kd-dimer-app-EMSA usando a equação:

Onde: Max é a concentração na qual as respectivas espécies atingiram a sua ligação máxima (monómero ou dímero); n é o coeficiente Hill; K d-app-EMSA é a constante de ligação aparente das respectivas espécies, dentando a concentração de Gen1 em que metade-máximo de monómero ou dímero está presente.
Resultados
Viés de conformer e isomerização do HJ
A isomerização de hj tem sido extensivamente investigada por traste através da rotulagem de dois braços adjacentes da junção17,18,39. O doador (Cy3) e o aceitador (Alexa fluor 647) estão posicionados nos dois braços vizinhos, R (vertente 2) e X (vertente 3), respectivamente (Figura 2a). Os isómeros empilhados-X foram atribuídos por suas duas vertentes contínuas [i.e., ISO (1,3) ou ISO (2,4)]. O histograma ALEX FRET do rótulo adjacente X0 mostra dois picos que correspondem à intermutável do ISO mais abundante (1,3) (e ~ 0,75) e ISO menos abundante (2,4) (e ~ 0,40) (Figura 2b).
O fret da único-cor é usado para adquirir o tempo-traços para gravar as mudanças conformacional rápidas no HJ livre com alta resolução temporal ~ 10 ms através da redução da área usada da câmera EMCCD2. Um representante de tempo único da FRET de cor representativa da junção X0 mostra as transições entre os ISÓMEROS de fret altos e baixos (Figura 2b). As taxas de isomerização k ISO (1,3)-ISO (2,4) e kISO (2,4)-ISO (1,3) obtidas a partir do tempo de permanência histogramas de ISO (1,3) e ISO (2,4) (Figura 2C) são consistentes com as relatadas anteriormente17.
SMFRET demonstra distorção ativa do HJ por GEN1
HJ passa por rearranjo estrutural ao ligar para GEN122. Assim, o espaçamento entre o doador e o aceitador é semelhante tanto em ISO (1,3) quanto em ISO (2,4) (Figura 3a). Os ensaios de ligação de smFRET foram realizados na presença de CA2 + para prevenir a clivagem do hj. Os histogramas de FRET da junção X0 de rótulo adjacente em diferentes concentrações de Gen1 foram adquiridos por Alex (Figura 3B). O histograma é apto para duas funções gaussianas: uma correspondente à alta livre FRET ISO (1,3), e a outra correspondente à população associada GEN1-HJ após subtrair a contribuição da ISO (2,4) a partir do pico de baixa FRET.
Ao saturar a concentração de GEN1, o histograma FRET de X0 tem apenas um pico de baixa fricção correspondente a Gen1 vinculado a qualquer ISÔMERO do hj como previsto pelo modelo22. A constante dissociação aparente do monómero (Kd-monômero-app) é determinada a partir do ajuste hiperbólico das porcentagens da população associada a Gen1 em função da concentração de Gen1 (Figura 3C). O adjacente-etiqueta NK-X0 representa uma versão cortado isoladamente hj que imita o produto após a primeira reação da incisão. Devido ao alívio da estirpe de empilhamento pelo entalhe simulado, NK-X0 é uma estrutura não-isomerizante40 como evidente do pico de substrato único em E ~ 0,40, ao contrário de X0 (Figura 3D versus Figura 3B). A estrutura do complexo GEN1-NK-X0 é semelhante à do complexo Gen1-x0 , como indicado pela similaridade em eficiências de traste (e ~ 0,25 para NK-x0 e 0,32 para x0) (Figura 3D vs. Figura 3B). A forte ligação do monômero Gen1 ao NK-X0 é demonstrada pelo valor de 40 vezes menor Kd-monômero-app do que a de X0 (Figura 3E vs. Figura 3C). Este emperramento apertado pode actuar como um mecanismo de salvaguarda de encontro à definição incompleta do HJ no evento improvável da dissociação do dímero de GEN1 ou de um de seus monómeros.
Emperramento Stepwise do monômero Gen1 ao hj
A vinculação do monômero Gen1 ao hj seguida pela formação de dímero é uma característica única para o eucariótico hj resolvase Gen1 em comparação com resolvasos procarióticos, que existem na forma dimérica na solução21,23,41. EMSA de GEN1 em 50 pM X0 mostra a associação Stepwise de Gen1 em uns complexos mais elevados da ordem, como indicado pelos numerais romanos no painel superior (figura 4a). A constante de dissociação do monômero Gen1 determinada pela EMSA (Kd-monômero-EMSA) coincide com a constante de dissociação do ensaio de ligação smfret Kd-monômero-app (figura 4a e Figura 3C , respectivamente). A quantificação da banda II é utilizada para calcular a constante de dissociação de equilíbrio do dímero GEN1 (Kd-DÍMERO-EMSA). EMSA de Gen1 em 50 PM NK-X0 demonstra a ligação de monómero proeminente como indicado pelo muito baixo Kd-monômero-app-EMSA que é 30 vezes menor do que a de X0, enquanto o seu Kd-dímero-EMSA é comparável à de X0 (Figura 4B).
Outras evidências de que o monômero GEN1 vincula e distorça o HJ é a observação de um número significativo de traços de partículas uncleaved com baixo estado de FRET estável (Figura 4C) na presença de mg2 + em concentrações de Gen1 baixas. O número desses traços diminuiu ao aumentar a concentração de GEN1. A resolução do HJ é impulsionada pelo emperramento apertado do monômero GEN1, que suporta a formação de dímero. A ligação do monómero é observada nos tempos-traços do NK-X0 uncleaved em magnésio2 +, que estende até pouca concentração do nanomolar (Figura 4D). O monômero GEN1 liga-se firmemente para salvaguardar NK-X0, eventualmente assegurando a resolução total através da formação de dímero.
Ensaio de resolução SMFRET do HJ
O termo "clivagem" em ensaios smFRET é usado alternadamente com "resolução" do HJ, uma vez que neste ensaio apenas a liberação do produto que segue o segundo evento de clivagem é detectada. Os eventos são gravados pela excitação de cor única de lapso de tempo para minimizar o fotobranqueamento do aceitador foto-sensível sobre o tempo de aquisição de ~ 1,3 min.
O esquema na Figura 5a ilustra as incisões das vertentes 1 e 3 de x0 ISO (1,3) após a ligação e a distorção por Gen1 de um x0 anexado ao vidro funcionalizado. O doador e o Acceptor entram na solução tendo por resultado a perda de seus sinais após a definição de HJ. A primeira e segunda incisões são dissociadas em NK-X0, o que exemplifica um protótipo para o HJ parcialmente resolvido. Após a vinculação de GEN1, NK-X0 adota uma estrutura semelhante a x0. A resolução prossegue por uma única incisão na vertente 1, como ilustrado na Figura 5b.
A partida simultânea do doador e do aceitador após um estado baixo estável do FRET nos traços de X0 resolvido ocorreu sem o emergence de um fret intermediário (E = ~ 0,40) indica que a definição completa ocorre dentro da vida do Gen1-hj complexo (Figura 5C). Portanto, esses resultados sugerem que a resolução HJ ocorre dentro do tempo de vida complexo GEN1-HJ. A resolução de NK-X0 também prossegue após o rearranjo estrutural e conclui pela partida do duplex transportando dois fluoróforos (Figura 5D) semelhante a X0.
Cinética da dimerização de GEN1 no monômero GEN1 vinculado HJ
O tempo-lapso smFRET mede τbefore-clivagem que inclui principalmente o tempo exigido para a formação do dímero e a definição do hj após a distorção pelo MONOMER Gen1. Aplicando esta técnica, a evidência direta é fornecida para apoiar a reivindicação que a formação do dímero é exigida para a definição de ambos os X0 e NK-x0, desde que a distribuição de τbefore-clivagem é concentração-dependente de Gen1.
A taxa aparente da resolução HJ (Appk) é definida como o inverso da média de τbefore-clivagem na respectiva concentração de Gen1. O termo "aparente" é usado para descrever a taxa da resolução HJ, uma vez que a possibilidade de que GEN1 permaneça vinculado ao produto após a resolução HJ não pode ser excluída.
As funções de densidade de probabilidade (PDF) das distribuições τbefore-clivagem de X0 (Figura 6a) refletem o tempo para a formação de dímero, que é mais longo em concentrações de Gen1 baixas, em seguida, menor em concentrações mais elevadas de Gen1. As taxas de associação e dissociação para o dímero, kon-dimer e koff-dimer, respectivamente, são determinadas a partir de um modelo bi-exponencial30. Também, os PDFs de NK-X0 (Figura 6B) mostram uma distribuição similar a x0 que indica a exigência para a formação do dímero.
A parcela de kapp versus Gen1 concentração foi ajustada para uma função hiperbólica. As constantes da taxa de catálise aparente (kMax-app) de x0 e NK-x0 são 0,107 ± 0, 11 s-1 e 0,231 ± 0, 36 s-1, respectivamente (Figura 6C). As parcelas de kapp para x0 e NK-x0 junções interseccionam a concentração de Gen1 ~ 5,6 Nm por causa da mais rápida kMax-app e mais lento kon-dímero do cortado em comparação com a junção intacta.
Em resumo, o krelativamente rápidoem dímero e lento koff-dímero levam à progressão da reação para a frente para a resolução hj uma vez que o dímero é formado. A forte ligação do monômero GEN1 à junção NK-X0 constitui um mecanismo de segurança contra qualquer falha de segundo abortada improvável ou ajuda a pegar quaisquer HJS incompletamente resolvidos deixados para trás por caminhos de resolução primária na célula.
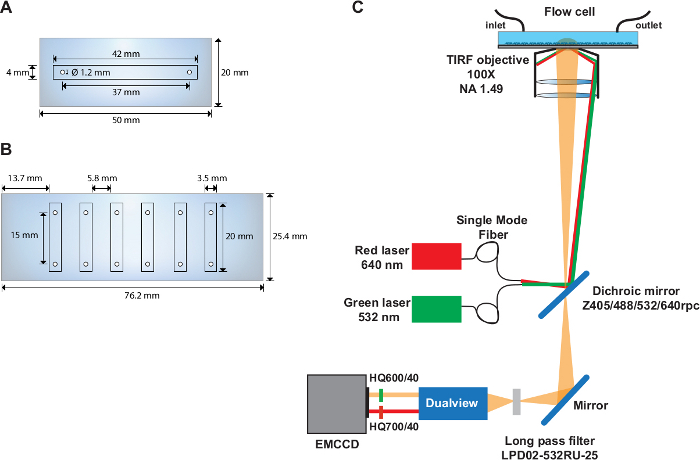
Figura 1: células de fluxo de canal único e múltiplo e layout da set-up óptica.
(A) esquemático da célula de fluxo de canal único. (B) esquemático da célula de fluxo de seis canais. (C) disposição da instalação óptica que descreve as fontes de excitação, objetivo tirf, espelho dichroic instalado dentro do cubo do filtro, e filtros da emissão usados no dispositivo do divisor da imagem. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: viés de conformer e isomerização do HJ observado pela FRET.
(A) isomerization dos confôrmeros hj X-empilhados do adjacente-etiqueta nomeados após as duas vertentes contínuas. Os fios são numerados, enquanto os braços são denotados por letras. Os sítios de incisão são mostrados por setas. São indicadas as posições do doador (verde) e aceitador (vermelho) e a alteração da traste sobre a isomerização. (B) painel direito: fret tempo-Trace (preto) e idealizada fret traço (vermelho) de X0 em 50 mm mg2 +. Painel esquerdo: histograma FRET de X0 a 50 mm mg2 +. As intensidades de fluorescência do doador (verde) e aceptor (vermelho) são mostradas abaixo. (C) os histogramas de tempo de permanência do rótulo adjacente X0 ISO (1,3) e ISO (2,4) foram ajustados para funções exponenciais únicas para determinar as taxas de isomerização. As incertezas indicam o intervalo de confiança de 95% do ajuste. Este número foi modificado da literatura previamente publicada30.
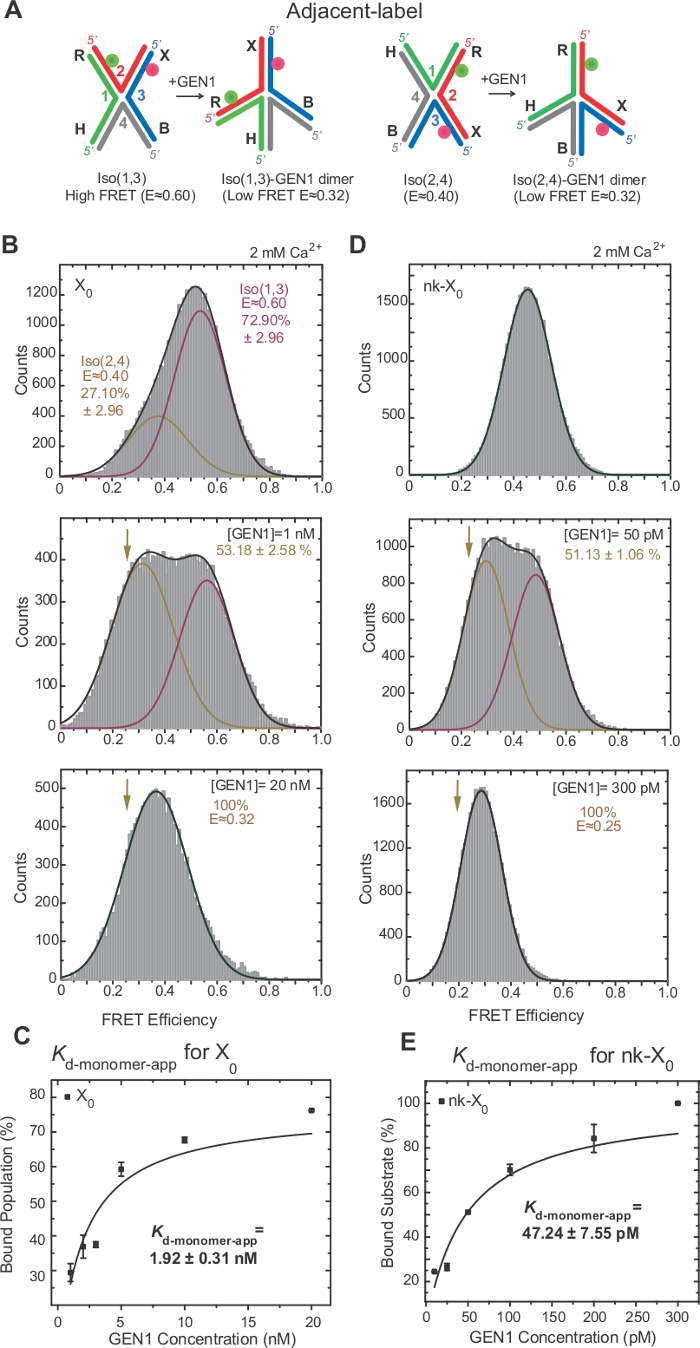
Figura 3: distorção ativa do HJ por GEN1.
(A) modificação estrutural da adjacentlabel hj com base no modelo proposto22. (B) o histograma de Alex fret do adjacente-etiqueta X0 tem um pico elevado principal da fret (e = ~ 0,6) que corresponde ao ISO (1,3) e ao pico mais baixo do fret (e = ~ 0,4) para o ISO (2,4). O histograma inteiro é cabido a duas funções Gaussian: um que corresponde ao ISO elevado livre do FRET (1,3), e o outro que corresponde à população acoplada menos a contribuição inicial de ISO (2,4) à população total. (C) a constante dissociação aparente do monómero (Kd-monômero-app) é determinada a partir de um ajuste hiperbólico das porcentagens de populações associadas a GEN1 em função da concentração de Gen1. D) histogramas de traste do rótulo adjacente NK-X0 em diferentes concentrações de Gen1. A área o baixo FRET (E = ~ 0,25) Gaussian corresponde à porcentagem da população acoplada. (E) o Kd-monomer-app de NK-X0 é determinado a partir do ajuste hiperbólico da população associada a Gen1. As barras de erro representam os desvios padrão de dois ou mais experimentos. Este número foi modificado da literatura previamente publicada30. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: emperramento Stepwise de GEN1 ao HJ.
(A) ensaio de deslocamento de mobilidade electroforética (EMSA) de GEN1 a 50 PM X0. Painel superior: os algarismos romanos indicam o número de monômeros GEN1 no complexo. Painel inferior: ligação do monômero GEN1 a X0. As constantes dissociações aparentes foram obtidas a partir de um ajuste sigmoidal das respectivas espécies e representam a média de dois experimentos. (B) EMSA de Gen1 em 50 PM NK-X0 demonstra a ligação de monómero proeminente como indicado pelo muito baixo Kd-monômero-app-EMSA. (C) fret tempo-traço de encadernado, mas uncleaved adjacente-rótulo X0 em mg2 +. A excitação do doador para o ~ 1,3 min foi executada, seguida pela excitação direta do Acceptor (região cor-de-rosa protegida). (D) fret tempo-traço de encadernado, mas uncleaved adjacente-rótulo NK-X0 em mg2 +. Este número foi modificado da literatura previamente publicada30. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: ensaio de resolução SMFRET do HJ.
(A) esquema do rótulo adjacente X0 ISO (1,3) após distorção por Gen1. A carcaça é unida à superfície funcionalizados através do enlace da biotina/avidin. A dissociação de GEN1 após as duas incisões resulta na perda de doador e aceitador que entram em solução. (B) esquemático da resolução do adjacente-rótulo NK-X0 por clivagem vertente 1. (C) tempo-traço (preto) em 2 milímetros MGS2 + da clivagem de ISO (1,3). O início da Associação de GEN1 forma um estado de FRET baixo estável até que o sinal FRET seja abruptamente perdido devido à clivagem. Correspondentemente, o aumento no doador e a diminuição de intensidades de fluorescência do aceitador em cima da ligação de GEN1 são seguidos pelo desaparecimento simultâneo da fluorescência de ambos os corantes em cima da clivagem. (D) similarmente, o tempo-traço de NK-X0 mostra um estado baixo estável do fret upon a ligação do Gen1 que é concluída pela perda ABRUPTA do sinal do fret. Este número foi modificado da literatura previamente publicada30. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: cinética da dimerização de GEN1 no monômero GEN1 vinculado HJ.
(A) ográfico de função de densidade de probabilidade (PDF) da distribuição τbefore-clivagem de X0 ilustra sua dependência da concentração de Gen1. Os tempos de permanência do baixo estado de FRET (τbefore-clivagem) na respectiva concentração de Gen1 foram obtidos a partir de dois ou mais experimentos e utilizados para obter as taxas médias (kapp). As taxas deaplicativo klistadas são determinadas a partir do inverso da média τbefore-clivagem na respectiva concentração de Gen1. As taxas de associação (kem dímero) e dissociação (kfora-dímero) para formação de dímero são calculadas a partir de um modelo bi-exponencial38. Os erros representam SEM do aplicativok. (B) o gráfico de PDF das distribuições τbefore-clivagem de NK-X0 e as respectivas taxas deaplicativo k. (C) parcela de kapp versus Gen1 concentração ajustada a uma função hiperbólica para determinar a taxa catalítica aparente (kMax-app). O enredo de kapp para x0 e NK-x0 ilustra oaplicativo kinicial mais rápido de x0 , que é então ultrapassado por NK-X0 acima [Gen1] ~ 5,6 Nm. Este número foi modificado da literatura previamente publicada30. Por favor clique aqui para ver uma versão maior desta figura.
| Buffer | Compostion | ||
| Buffer de ligação | 40 mM Tris-HCl pH 7,5, 40 mM NaCl, 2 mM CaCl2, 1 mm dtt, 0,1% BSA e 5% (v/v) glicerol | ||
| Buffer A | 20 mM Tris-HCl pH 8,0, 1 mM DTT e 300 mM NaCl | ||
| Tampão B | 20 mM Tris-HCl pH 8,0, 1 mM DTT e 100 mM NaCl | ||
| Tampão C | 20 mM Tris-HCl pH 8,0 e 1 mM DTT | ||
| Tampão do Cleavage | 40 mM Tris-HCl pH 7,5, 40 mM NaCl, 2 mM MgCl2, 1 mm dtt, 0,1% BSA e 5% (v/v) glicerol | ||
| Buffer de ligação EMSA | 40 mM Tris-HCl pH 7,5, 40 mM NaCl, 1 mM DTT, 2 mM CaCl2, 0,1 mg/ml BSA, 5% (v/v) glicerol e 5 ng/μl poli-di-DC | ||
| Buffer de imagem (ligação) | 40 μL (±) 6-hidroxi-2, 5, 7, 8-tetrametilchromane-2-carboxílico (4 μM), 60 μL PCA (6 nM), 60 μL PCD (60 nM) e 840 μL de tampão de ligação | ||
| Tampão da imagem latente (clivagem) | 40 μL (±) 6-hidroxi-2, 5, 7, 8-tetrametilchromane-2-carboxílico (4 μM), 60 μL PCA (6 nM), 60 μL PCD (60 nM) e 840 μL de tampão de clivagem | ||
| Tampão de Lise | 20 mM Tris-HCl pH 8,0, 10 mM β-Mercaptoetanol, 300 mM NaCl e 2 mM PMSF | ||
| Tampão de armazenamento de PCD | 100 mM Tris-HCl pH 7,5, 1 mM EDTA, 50 mM KCl e 50% glicerol | ||
| buffer de armazenamento | 20 mM Tris-HCl pH 8,0, 1 mM DTT, 0,1 mM EDTA, 100 mM NaCl e 10% glicerol | ||
| Tampão de TBE | 89 mM Tris-HCl, 89 mM de ácido bórico e 2 mM EDTA | ||
| TE100 buffer | 10 mM Tris. HCl pH 8,0 e 100 mM NaCl | ||
| Tampão Tris-EDTA | 50 mM Tris-HCl pH 8,0 e 1 mM EDTA pH 8,0 | ||
Tabela 1: a lista de buffers e suas composições utilizadas neste estudo.
| Oligo | Seqüência | ||
| X0-ST1 | ACGCTGCCGAATTCTACCAGTGCCTTGCTAGGACATCTTTGCCCACCTGCAGGTTCACCC | ||
| X0-ST2 | GGGTGAACCTGCAGGTGGG/iCy3/AAAGATGTCCATCTGTTGTAATCGTCAAGCTTTATGCCGT | ||
| X0-ST3 | ACGGCATAAAGCTTGACGA/iAF647-dT/TACAACAGATCATGGAGCTGTCTAGAGGATCCGACTATCG | ||
| X0-ST4 | 5 ' BiotinCGATAGTCGGATCCTCTAGACAGCTCCATGTAGCAAGGCACTGGTAGAATTCGGCAGCGT | ||
| X0-adj | X0-ST1, x0-ST2, x0-ST3 & x0-ST4 | ||
| X0In_st2 | GGGTGAACCTGCAGGTGGGCAAAGATGTCCATCTGTTGTAATCGTCAAGCTTTATGCCGT | ||
| X0In_st4 | 5 ' BiotinCGATAGTCGGATCCTCTAGACAGCTCCATGTAGCAAGGCA/iCy3/TGGTAGAATTCGGCAGCGT | ||
| NK-X0 | X0-ST1, x0-ST2, x0-nk3a, x0-nk3b & x0-ST4 | ||
| X0-nk3a | ACGGCATAAAGCTTGACGA/iAF647-dT/TACAACAGATC | ||
| X0-nk3b | ATGGAGCTGTCTAGAGGATCCGACTATCG | ||
Tabela 2: substratos SMFRET e EMSA hj. A lista de oligonucleotídeos usado para a preparação do HJS cDNAs etiquetado para smfret e EMSA. Os oligos foram obtidos comercialmente. Os oligos cDNAs etiquetados eram HPLC-purified e, quando possível, os oligos do ≥ 60 BP eram página-purified.
Discussão
Neste estudo, diferentes técnicas de smFRET foram implementadas para determinar a cinética da resolução HJ por GEN130. As aproximações similares de smfret foram usadas para seguir a exigência conformacional do ADN da dobro-aleta e clivagem pela réplica do ADN e pela aleta do reparo endonuclease 142,43,44. Aqui, as etapas críticas neste protocolo são discutidas. A reação de silanização deve estar livre de qualquer vestígio de humidade. A solução de pegylation deve ser aplicada ràpida ao vidro SILANIZADOS uma vez que o PEG é dissolvido para evitar a hidrólise. Na célula de fluxo multicanal, qualquer ar aprisionado na folha adesiva deve ser removido para evitar fugas entre os canais vizinhos. A solução de PCA deve ser preparada recentemente, uma vez que oxida ao longo do tempo. A adição de 10 N NaOH deve ser Dropwise, com vortexing no meio. O fundo da fluorescência no lamela deve ser mínimo antes de fluir o HJ cDNAs etiquetado. A imagem latente na pilha de fluxo deve ser executada em um sentido para evitar áreas descoradas imagem latente. Em experimentos de ALEX, o poder do laser vermelho deve ser reduzido para evitar o clareamento rápido do aceitador. Nos experimentos de lapso de tempo, o tempo de ciclo tem que ser mais curto do que o evento mais rápido.
smFRET é uma técnica sensível que pode fornecer insights valiosos em tempo real em reações biomoleculares. No entanto, este método tem vários desafios técnicos, entre os quais está conseguindo uma mudança mensurável no FRET durante a reação bioquímica. Isto é necessário para obter características bem separadas nos histogramas e nos Estados distinguíveis nos tempos-traços. Em muitos casos, o smFRET requer um design cuidadoso dos substratos, a seleção dos pares de fluoróforo e suas posições, e a amplificação das alterações do FRET no substrato do DNA por causa das pequenas alterações estruturais no substrato45. Outra abordagem para a realização de FRET é usar proteínas rotuladas46. A janela de observação em FRET é limitada pela estabilidade do aceitador como Cy5 ou Alexa fluor 647 que tende a lixívia mais rapidamente do que o doador (Cy3 neste caso). Portanto, o fret requer uma busca contínua por fluoróforos estáveis para estender a duração do experimento e os esforços para desenvolver sistemas de eliminação de oxigênio para prolongar o sinal de fluorescência e maximizar a relação sinal-ruído47,48 .
Entre as pontas para pesquisar defeitos em smFRET está equilibrando os diversos parâmetros envolvidos na imagem latente tal como a potência do laser, o tempo de exposição, o tempo de ciclo, e o número de ciclos para maximizar a emissão da fluorescência, prolongar a duração do experimento, e conseguir intervalos de amostragem adequados para a dinâmica enzimática. Tempos de observação mais longos e efeitos mínimos do fotobranqueamento são essenciais para obter distribuições de tempo de permanência de alta fidelidade que representam a dinâmica enzimática. ALEX gera melhores histogramas, uma vez que este método é submetido a menores contribuições de partículas fotobranqueadas em comparação com o FRET de cor única. No entanto, a resolução temporal em ALEX é menor do que no FRET de cor única.
Finalmente, a ênfase da smFRET na detecção de mudanças conformacionais/estruturais em moléculas individuais em tempo real faz a ponte entre as técnicas estruturais de alta resolução (i.e., cristalografia por raios X, ressonância magnética nuclear, microscopia eletrônica), que fornece detalhes estruturais de resolução atômica em condições estáticas e métodos em massa que produzem a média do Ensemble de uma propriedade mensurável. Em muitos aspectos, a smFRET provou ser uma técnica poderosa para estudar sistemas biológicos em tempo real.
Divulgações
Os autores não declaram interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pela Universidade de ciência e tecnologia do Rei Abdullah através do financiamento principal e do prêmio de pesquisa competitiva (CRG3) para S. M. H.
Materiais
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
Referências
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados