需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
中国仓鼠卵巢细胞培养中高通量自动化微生物反应器工艺优化
摘要
在这里,我们提出了一个详细的过程,在自动化的微生物反应器中运行实验设计,然后使用蛋白质A柱进行细胞收获和蛋白质定量。
摘要
优化生物工艺,提高所需产品的产量,在生物制药行业具有重要意义。这可以通过菌株选择和开发生物工艺参数来实现。摇瓶已用于此目的。然而,它们缺乏控制过程参数的能力,如pH值和溶解氧 (DO)。在自动化微生物反应器的帮助下,可以克服这一限制。这些生物反应器模仿大规模种植。该系统的主要优点之一是实验设计(DOE)在软件中集成。这种集成可以建立一个可以同时改变多个过程参数的设计。可在软件内分析关键工艺参数和最佳生物工艺条件。此处介绍的工作重点是向用户介绍软件中过程设计所涉及的步骤,并将 DOE 纳入培养运行中。
引言
2018年全球生物制药市场价值超过2500亿美元,并不断扩大1.制药公司正在从生产小分子药物转向生物技术产生的治疗药物,如重组蛋白。仅此一项,收入就超过1500亿美元。哺乳动物细胞现在广泛用于这些药物重组蛋白的产生。在目前68种经批准的哺乳动物细胞产品中,有57种是由中国仓鼠卵巢细胞(CHO)2产生的。CHO细胞专门用于生产需要翻译后修饰的重组蛋白。这些细胞是首选,因为它们生长在悬浮液中,从而在无血清化学定义的介质33,44中产生可重复的结果。使用CHO细胞的另一个优点是,该产品的甘油结构类似于人类单克隆抗体(mAb),由于基因扩增5,导致重组蛋白产量和特定生产力提高。
重组性CHO(rCHO)细胞培养的产量在过去二十年中增加了一百倍。这一改进归功于工艺参数的优化、喂养策略以及血清无化学定义的介质6的开发。随着药品需求的增加,生产过程发展的成本和时间效率的压力增加7.为了减轻压力,同时保证产品质量,制药行业的重点已转向设计质量 (QbD)。QbD 用于了解产品生产和流程。ObD 中使用的一个重要工具是实验设计 (DOE)。它通过揭示各种输入变量和结果输出数据之间的关系,帮助增加对流程的理解。在项目早期阶段,应用 DOE 方法优化生物工艺,有利于实现工艺条件,提高数量和质量。与老式策略相比,这种方法是有益的:一次一个因子 (OFAT)。使用经典、沙宁或塔古奇的DOE的统计方法远远优于OFAT8。
过程和介质优化可以在摇瓶中执行。烧瓶相对便宜。但是,无法控制温度、pH 值和溶解氧 (DO) 等参数。为了克服这些缺点,可以使用从工作体积为 0.5 L 到 5 L 的多用途台式生物反应器。这些反应堆提供广泛的在线监测和过程控制。然而,多用途生物反应器的使用是时间和劳动密集型的。为了克服这些缺点,采用了一种新型的一次性生物反应器,它结合了监测台式生物反应器的综合过程和易于处理摇瓶。高吞吐量筛选系统和一次性技术为提高工艺性能和开发效率做出了贡献。
在本文中,列出了在自动微生物反应器 (AMBR) 软件中加载配方的指南。本实验过程中研究了不同搅拌速度和pH值对活细胞浓度(VCC)和滴度的影响。实验软件MODDE12的设计进行了实验结果和分析。产品分析在带有蛋白质 A 柱的高压液相色谱 (HPLC) 系统中进行。它基于mAb的Fc区域与高亲和力10,11,11的蛋白质A结合的原则。使用此方法,可以识别和量化 mAb。定量在280nm的测量洗脱峰区进行。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 前培养程序
注:重组性CHO DG44细胞,其活细胞浓度为1 x 107细胞/mL用于此协议。
- 将含有1.2 mL细胞的小瓶解冻至室温,并立即将细胞悬浮液转移到含有10 mL冷种子介质的15 mL锥形离心管中。
- 在 190 x g和室温下使圆锥式离心管离心 5 分钟,并丢弃上清液。
- 将150mL的种子介质预热至36.8°C。
- 轻轻地将细胞颗粒悬浮在10 mL的预加热种子介质中,并将细胞转移到奶瓶中。
- 使用烧瓶中的 1 mL 样品测量使用细胞计数器的初始 VCC 和可行性。
注:解冻后,成功栽培的生存能力应高于70%。 - 在36.8°C和7.5%CO2下,以120 rpm的振动速率将摇瓶孵育在轨道摇床(振动器直径为19毫米)中。
注:这些条件因细胞应变和介质而异。 - 通过细胞三天后,从摇摇器中取出摇瓶,并将其放在层压流柜下。采集1 mL样品以测量最终细胞浓度。计算要转移到新鲜预热种子介质的体积,使新通道中的初始细胞浓度为 2 x 105细胞/mL。
- 在转移到生物反应器进行主要培养之前,共通过细胞5次。
2. 主要种植
- 测量预培养的最终细胞浓度。计算要转移到生物反应器的体积,使反应器中的初始细胞浓度为3 x 105细胞/mL。
- 在接种前一天向反应器填充生产介质,以平衡反应器,并设置温度、pH 值和 DO 等过程参数。
注:培养条件为36.8°C和60%溶解氧浓度(DO)。我们测试了 1050 rpm 和 1300 rpm 的搅拌器速度以及 6.9、7.1 和 7.3 的 pHs。种植的总持续时间为12天,直到细胞收获。批处理运行 72 小时,之后每 24 小时添加一次进给介质。下一段将详细列出用于培养的协议。
3. 在自动微生物反应器软件中编写配方
注:在 AMBR 细胞培养软件中编写配方有两种方法:它是通过使用向导或手动添加每个步骤创建的。为此协议的目的,将显示使用向导的步骤。
- 创建新实验
- 打开 AMBR 细胞培养软件,并在"简介"选项卡中单击"创建新实验"。
- 加载配方
- 在"新建实验"选项卡中,输入实验的名称以及进行实验的日期。
- 激活养殖站和在栽培过程中使用的容器的检查点。自动添加 DOE 标记也将激活,以便在 DOE 实验编程期间轻松过渡。单击"下一步"以切换到下一个选项卡。
- 将有关在容器中添加介质的信息以及消泡、内毛、饲料和葡萄糖一起设置。
- 激活添加介质板检查点。定义包含介质的板的类型、名称和位置。
注意:根据板的类型和板是否包含盖子,激活"立合"上的检查,以确保液体处理器的平稳运行 - 单击"将媒体添加到容器"。输入要添加到容器中的介质的体积。定义介质从板到容器的传输图。单击"下一步"以切换到下一个选项卡。
- 激活添加介质板检查点。定义包含介质的板的类型、名称和位置。
- 设置反应器中的培养条件。
- 介质信息输入软件后,分配栽培条件。单击条件介质并填充温度、目标 DO、pH 上限和搅拌 RPM(向上搅拌或向下搅拌)。
- 将内库在容器中添加。
- 激活添加单元格板。定义包含介质的板的类型、名称和位置。
- 单击"向容器添加单元格"。输入接种时间和要添加到容器中的介质体积。
- 定义液体处理器在将细胞从板转移到容器的路径。单击"下一步"以切换到下一个选项卡。
注:确保停用回用移液器提示,以避免交叉污染和不正确的初始可行细胞浓度。
- 设置饲料、葡萄糖和消泡的添加。
注:添加饲料、葡萄糖和消泡剂的程序彼此相似。为了此协议,程序列在"Feed"中。这可以复制葡萄糖和消泡。- 激活"添加进料板"并定义板类型、名称和位置。单击"向容器添加进给"并输入要添加到容器的进给量。定义进料从板到容器的传输的映射。
- 根据种植情况,添加饲料添加数量。对于这种培养,反应器每24小时在72小时后喂食。
- 通过将数据输入到添加的单元格中的延迟中,手动添加馈送之间的时间延迟。喂食的第一天是在72小时的接种后,下一天是在96小时后,等等。
注:防泡添加被编程为每天添加,以避免在种植过程中发泡。
- 在栽培过程中设置采样。
- 激活添加样品板并定义板类型、名称和位置。
- 检查从容器中取出样品,然后输入要从容器中取出的样品的体积。定义样品从容器转移到板的映射。确保在整个栽培过程中,体积不会低于 10 mL。
- 添加在种植过程中要采集的样品数量。与进料类似,添加每个输入采样点从容器中取出的样品的时间。
- 保存进程。它现已准备就绪,可以执行。
注:为确保协议的顺利运行,请切换到 AMBR 细胞培养软件中的"过程步骤"选项卡,然后选择"流程步骤"视图以可视化配方的流。
- 在"新建实验"选项卡中,输入实验的名称以及进行实验的日期。
- 自动化微生物反应器实验设计
- 为了运行生物反应器的DOE软件,确保保存主软件中的配方并随时使用。
- 打开AMBR 15 DOE软件,然后单击"调查"并选择"新建"。
- 在"创建调查"对话框中输入新的 DOE 调查的名称。
- 为了给 DOE 调查分配实验,请打开为研究不同参数而创建的配方。单击"浏览"并选择相应的实验。
- 定义 DOE 因子。
- 容器标记已在列中登记。要定义所需的 DOE 因子,请选择参数并单击标记为DOE 因子的列。选择"新建"并添加因子的单位、缩写、下限和上限(例如温度、DO、pH)。
- 定义响应因子。
- 一旦确定了 DOE 因子,根据实验分析的结构定义响应。
- 在"响应"选项卡中,定义用于分析数据时要考虑的值。
- 单击"编辑 DOE 响应"并定义响应的名称、缩写、单位、最小和最大限制(例如,滴定、可行的细胞浓度)。
- 定义响应后,为每个响应选择 AMBR 变量并定义该变量。响应可以自动与微生物反应器变量关联,从下拉列表中选择所需的变量。
- 根据要求更改每个响应的方程。选择在最小、最大、第一、最后和平均数据之间进行。
- 创建设计。
- 使用"开始设计"向导选择实验设计的类型,以添加或删除复制和中心点的数量。
- 选择确定设计和模型选择的目标:
筛选:使用线性和交互模型来查找重要因素
优化 (RSM),使用二次和立方模型进行详细建模和优化
分割目标:可单独选择配方和工艺因子模型 - 确定目标后,选择模型和设计以及中心点和复制的数量。
- 单击"完成"并切换到下一个选项卡。
- 定义实验。
注:DOE 因子列在软件的右侧列中。在选择所需因子时,将突出显示使用所需参数运行该实验的容器。培养站内的船只可以通过右键单击容器并将其移动到所需位置来移动。- 创建可在 AMBR 单元培养软件中导入的工作数据包。根据实验次数,创建并存储不同的工作数据包,以便进一步实现
- 在 AMBR 控制笔记本电脑上创建的工作数据包中执行实验
- 在"实验"选项卡中,单击"创建 DOE 实验"并浏览使用 DOE 软件创建的工作包。
- 通过单击"开始"来初始化进程。
- 实验结果分析
- 执行实验后,使用导出 DOE 结果导出数据。将打开"导出 DOE 结果"窗口,表中列出了指示区域性容器和工作站的行。
- 选择所需的行,然后单击"导出的选定行"或"导出实验数据"以存储所有结果并保存文件以供进一步分析。
- 通过切换到"结果"选项卡并选择"导入结果",将数据导入 AMBR DOE 模块。
- 浏览所需的数据文件,然后单击"分析结果"。
- 进一步分析MODDE中的结果。
4. 自动化微生物反应器中栽培的执行
注:在上述软件中编写的协议的帮助下,用户执行以下步骤。这些步骤由用户执行,除非另有提及。
- 装载容器
- 在层流柜下打开伽马灭菌容器,在培养站中定向,如图2所示。
- 用 70% 乙醇和双蒸馏水清洁夹板。然后,高压板并放置在容器顶部。
- 用搅拌板安装夹板,确保每个销牢固固定。
- 将搅拌板拧紧,将板夹在搅拌组件上。
- 运行微生物反应器软件
- 使用第 3 节中编写的程序运行栽培。
- 在"流程"选项卡中可视化计划或完成的流程步骤。通过首先暂停液体处理程序,然后编辑流程配方,根据需要更改流程运行过程中的培养步骤。
- 在搅拌器开始之前,在容器中加入消泡剂,以确保在栽培过程中不会过度发泡。将定期添加消泡,并直观地检测出泡沫。
- 在容器中添加介质
- 用无菌介质手动填充24个装有微生物反应器的井板,并放置在系统的指定甲板上。确保板放置在书面程序指定的甲板上(第 3 节)。船舶的加注将按照第3.2.2节的设计进行。
注:温度和搅拌器在添加介质和消泡后立即开始。传感器读卡器在容器充满 1 小时后激活(启动监视器步骤)。一旦读取器激活,就会对每艘船进行加气。在 pH 重新校准和接种之前,介质将至少平衡 6 小时。如第 3.2.3 节中所述,可以在软件中更改过程参数。
- 用无菌介质手动填充24个装有微生物反应器的井板,并放置在系统的指定甲板上。确保板放置在书面程序指定的甲板上(第 3 节)。船舶的加注将按照第3.2.2节的设计进行。
- 接种
- 测量第5次通过后可行的细胞浓度。计算要转移到容器的细胞数,以确保所有容器的初始细胞浓度为 3 x 105细胞/mL。
- 将细胞转移到24个深井板,使悬浮液的体积至少是所需体积的1.6倍。对于所需的 2 mL 的鼻孔体积,将 3.2 mL 的细胞悬浮液转移到板中的每个孔中。
- 将 24 个井板放在指定的甲板上。这些船只将接种,如第3.2.4节所述。
- 每日采样和分析
- 使用液体处理器每天从容器中取出 460 μL 样品。用800 μL的过滤1x PBS缓冲液(5倍稀释)稀释样品的200μL,然后放入细胞计数器。
- 在190 x g和室温下将剩余样品离心 5 分钟,并储存上清液以进行进一步分析(葡萄糖、乳酸、谷氨酰胺和谷氨酸)。
- 在-20°C下冷冻100μL的上清液,直到蛋白质定量培养结束。
- 种植结束
- 当过程参数控制(即温度、搅拌、pH 和 DO)终止时,停止对过程的监控。
- 拧下搅拌板和夹板。
- 拆下养殖容器并清洁养殖站。将干燥板放在培养站上,然后拧入。
- 同时,用70%乙醇和双蒸馏水彻底清洁夹板。
- 完成干燥循环后,单击生物反应器软件中的停止。
- 细胞培养收获
- 收获细胞在种植的第12天,通过手动去除容器的含量到50mL离心机管。将细胞汤在 190 x g下离心 30 分钟。
- 丢弃细胞颗粒,并将上清剂储存在-20°C。
5. 测量 mAb 浓度
- 在培养运行期间,使用 1.7 mL 蛋白质 A 柱对蛋白质进行定量。
-
在解冻样品之前,准备平衡和洗脱缓冲液。
- 使用含有0.5 M Na2HPO4的溶液,含有0.5M NaCl,pH值为7.9作为平衡缓冲液,100 mM甘氨酸溶液,含有0.5M NaCl,pH值为2作为洗脱缓冲液。
- 在放置分析之前,通过 0.2 μm 膜和脱气过滤两个缓冲液。
- 使用新鲜配制的平衡缓冲液清除高性能液相色谱系统 (HPLC)。
- 将蛋白质 A 列加载到 HPLC 系统中。
- 以1 mL/min的流速进行色谱,将柱形烤箱温度设置为30°C,在10°C处自动采样器温度
- 在室温下解冻冷冻样品,并通过0.22 μm PVDF膜过滤每个样品的225μL。稀释所需蛋白质浓度较高的样品与平衡缓冲液的1:20比,并在放入自动取样器之前过滤膜。
- 将样品放在自动采样器中。在软件中加载方法和序列并启动序列。
注:该方法由三个阶段组成(参见图 1):在前两分钟将示例注入列;然后是8分钟的洗脱缓冲液和柱再生与平衡缓冲10分钟。
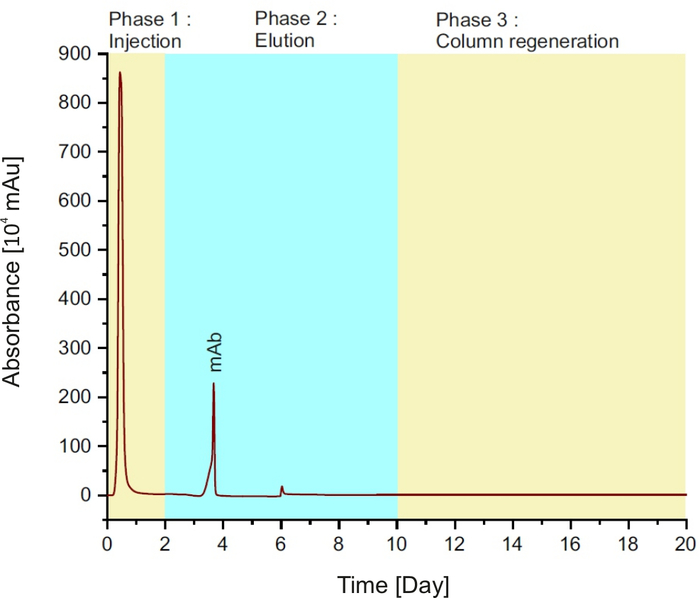
图1:蛋白质A色谱图,表示单次运行中的不同阶段。请点击此处查看此图形的较大版本。
Access restricted. Please log in or start a trial to view this content.
结果
图2概述了本研究中进行的栽培情况。
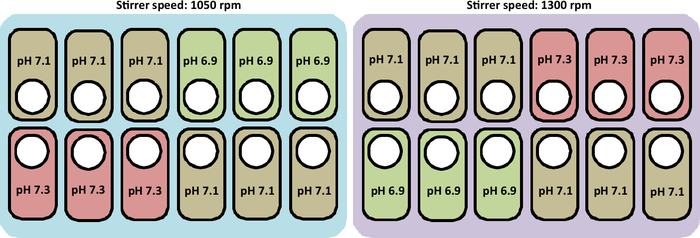
图2:在培养站中测试pH和搅拌器速度曲线的实验条件的原理图表示。该图还表示放置船只的正确布局。请点击此处查看此图形的较大版本。
Access restricted. Please log in or start a trial to view this content.
讨论
优化工艺,提高产量,对生物制药行业至关重要。摇瓶可能用于菌株的筛选;但是,在烧瓶中不监视过程参数(如 pH 和 DO)。微生物反应器具有优势,因为它们允许对过程进行持续监测和控制。微生物反应器中的这些控制回路也提供了与更大规模类似的条件,因此,其结果可与较大规模的生物反应器相媲美。微生物反应器的另一个优点是,与台式生物反应器相比,在时间和人工方面
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
作者感谢德国联邦教育和研究部联邦联邦联邦部长比尔东·福森(BMBF)和德国萨托里乌斯·斯蒂迪姆生物技术有限公司的生物加工团队的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
参考文献
- Langer, E. S. 15th Annual report and survey of Biopharmaceutical Manufacturing Capacity and Production: A study of Biotherapeutical Developers and Contract Manufacturing Organizations. Bioplan Associates. , Available from: http://bioplanassociates.com/wp-content/uploads/2018/07/15thAnnualBiomfgReport_TABLEOFCONTENTS-LR.pdf (2019).
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136(2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, Springer. New York. (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757(2019).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。