Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптимизация процесса с использованием высокой пропускной связи Автоматизированные микро-биореакторы в китайском Хомстер яичников культивирования клеток
В этой статье
Резюме
Здесь мы представляем подробную процедуру для запуска проекта эксперимента в автоматизированном микро-биореакторе с последующим сбором клеток и количественной оценкой белка с помощью столбца Protein A.
Аннотация
Оптимизация биопроцессов для повышения урожайности желаемых продуктов имеет важное значение в биофармацевтической промышленности. Это может быть достигнуто путем выбора штамма и разработки параметров биопроцесса. Для этой цели были использованы встряхивания. Однако у них нет возможности контролировать параметры процесса, такие как рН и растворенный кислород (DO). Это ограничение можно преодолеть с помощью автоматизированного микро-биореактора. Эти биореакторы имитируют культивирование в больших масштабах. Одним из основных преимуществ этой системы является интеграция дизайна эксперимента (DOE) в программное обеспечение. Эта интеграция позволяет создать дизайн, в котором несколько параметров процесса могут изменяться одновременно. Критические параметры процесса и оптимальные условия биопроцесса могут быть проанализированы в рамках программного обеспечения. Основное внимание в работе, представленной здесь, заключается в том, чтобы познакомить пользователя с шагами, участвующими в разработке процесса в программном обеспечении и включении DOE в рамках культивирования перспективе.
Введение
Мировой рынок биофармацевтической продукции в 2018 году составил более 250 миллиардов долларов США, и он постоянно расширяется на1. Фармацевтические компании переходят от производства небольших молекулярных препаратов к биотехнологически милиемым терапевтическим препаратам, таким как рекомбинантные белки. Только они несут ответственность за доход более $ 150 млрд1. Клетки млекопитающих в настоящее время широко используются для производства этих фармацевтических рекомбинантных белков. В текущем периоде, среди 68 утвержденных продуктов, производимых клетками млекопитающих, 57 производятся китайскими клетками яичников хомяка (CHO)2. Клетки CHO специально используются для производства рекомбинантных белков, которые требуют посттрансляционных модификаций. Эти клетки являются предпочтительными, поскольку они растут в подвеске и тем самым позволяют воспроизводимые результаты в сыворотке свободной химически определены среды3,4. Другим преимуществом использования клеток CHO является то, что гликановая структура продукта напоминает структуру моноклональных антител человека (mAb) и приводит к более высокой урожайности рекомбинантного белка и специфической продуктивности благодаря усилению гена5.
Урожайность рекомбинантной культуры клеток CHO (rCHO) за последние два десятилетия увеличилась в сто раз. Это улучшение связано с оптимизацией параметров процесса, стратегией кормления и развитием сыворотки свободной химически определенной среды6. С увеличением требований к фармацевтической продукции повышается нагрузка на стоимость и эффективность времени развития производственного процесса7. Для снижения давления при обеспечении качества продукции переориентируется внимание фармацевтической промышленности на качество по дизайну ( qbD). Для понимания производства продукции, а также процесса используется bD. Важным инструментом, используемым в ObD является дизайн эксперимента (DOE). Это помогает повысить понимание процесса, раскрывая взаимосвязь между различными переменными ввода и полученными выходными данными. Применение подхода МЭ для оптимизации биопроцесса выгодно на ранних стадиях проекта в усвоении условий процесса и повышении количества и качества титра. Такой подход выгоден по сравнению со старомодной стратегией: «один фактор в то время» (OFAT). Статистические подходы к DOE с использованием классических, Shainin или Taguchi намного превосходит OFAT8.
Процесс и оптимизация мультимедиа могут быть выполнены в встряхивания колбы. Фляги относительно недорогие. Однако невозможно контролировать такие параметры, как температура, рН и растворенный кислород (DO). Для преодоления этих недостатков можно использовать многофункциональные биореакторы на скамейке от 0,5 л до 5 л. Реакторы обеспечивают обширный он-лайн мониторинг и контроль процессов. Тем не менее, использование многофункционального биореактора является трудоемким и трудоемким. Для того, чтобы преодолеть эти недостатки, используется новый одноразовый биореактор, который сочетает в себе комплексный процесс мониторинга биореактора на скамейке и простой обработки колбы для встряхивания. Высокая пропускная способность системы скрининга и одноразовые технологии способствовали повышению эффективности производительности процесса и развития9.
В этой статье перечислены рекомендации по загрузке рецепта в автоматизированное программное обеспечение для микробиореактора (AMBR). В ходе этого эксперимента изучается влияние различных скоростей и рН на жизнеспособную концентрацию клеток (VCC) и титр. Экспериментальный результат и анализ проводятся с разработкой экспериментального программного обеспечения MODDE 12. Анализ продукта осуществляется в жидкой хроматографии высокого давления (HPLC) с колонкой Protein A. Он основан на принципе, что FC области mAb связывается с белком А с высоким сродством10,11. С помощью этого метода можно определить и количественно mAb. Количественная оценка проводится в измеренных пиковых зонах элюции на уровне 280 нм.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Процедура предкультуры
ПРИМЕЧАНИЕ: Для этого протокола используются рекомбинантные клетки CHO DG44 с жизнеспособной концентрацией клеток 1 х 107 клеток/мл.
- Оттаиваете флакон, содержащий 1,2 мл клеток, до комнатной температуры и немедленно перенесите клеточную подвеску в коническую центрифугу мощностью 15 мл, содержащую 10 мл холодичной среды семян.
- Центрифуги конической центрифуги трубки в течение 5 минут при 190 х г и комнатной температуры и отбросить супернатант.
- Предварительно нагреть 150 мл семенной среды в колбе 500 мл встряхнуть до 36,8 градусов по Цельсию.
- Аккуратно перенесите клеточную гранулу в 10 мл предварительно разогретой среды семян и перенесите клетки в колбу для встряхивания.
- Используйте 1 мл образца из колбы для измерения первоначального VCC и жизнеспособности с помощью клеточного счетчика.
ПРИМЕЧАНИЕ: Выживаемость должна быть выше 70% после оттаивания для успешного выращивания. - Инкубировать колбу в орбитальный шейкер (диаметр шейкера 19 мм) при 36,8 градуса х с и 7,5% CO2 со скоростью встряхивания 120 об/мин.
ПРИМЕЧАНИЕ: Эти условия варьируются в зависимости от деформации клетки и среды. - Через три дня после прохождения клеток, удалить встряхнуть колбу из шейкера и поместить его под ламинарный шкаф потока. Возьмите 1 мл образца для измерения конечной концентрации клеток. Рассчитайте объем, который будет передан в свежую предварительно разогретую среду семян таким образом, чтобы начальная концентрация клеток в новом проходе составила 2 х 105 клеток/мл.
- Проходя клетки в общей сложности 5 раз перед передачей в биореактор для основного культивирования.
2. Основное культивирование
- Измерьте конечную концентрацию клеток прекультуры. Рассчитайте объем, который будет передан биореактору таким образом, что начальная концентрация клеток в реакторе составляет 3 х 105 ячеек/мл.
- Заполните реактор производственной средой за день до прививки, чтобы уравновесить реактор и установить параметры процесса, такие как температура, рН и DO.
ПРИМЕЧАНИЕ: Условия культивирования 36.8 C и 60% растворенный кислород концентрации (DO). Мы протестировали скорость мешалки 1050 об/мин и 1300 об/мин вместе с рН 6,9, 7,1 и 7,3. Общая продолжительность культивирования составляет 12 дней, пока клетки не будут собраны. Процесс пакетов длится 72 часа, после чего кормовая среда добавляется каждые 24 ч. Протокол, который будет использоваться для выращивания, подробно указан в следующем сегменте.
3. Написание рецепта в автоматизированном программном обеспечении микро-биореактора
ПРИМЕЧАНИЕ: Существует два способа написания рецепта в программном обеспечении культуры клеток AMBR: он создается либо с помощью мастера, либо путем добавления каждого шага вручную. Для целей этого протокола отображаются шаги с использованием мастера.
- Создание нового эксперимента
- Откройте программное обеспечение культуры ячейки AMBR и во вкладке Введение нажмите на Создать новый эксперимент.
- Загрузка рецепта
- Во вкладке «Новый эксперимент» введите название эксперимента вместе с датой его проведения.
- Активируйте контрольно-пропускной пункт для культурной станции и судов, которые будут использоваться во время выращивания. Теги Auto Add DOE также будут активированы для легкого перехода во время программирования эксперимента DOE. Нажмите на Далее, чтобы перейти на следующую вкладку.
- Установите информацию о добавлении носителей в сосуд вместе с антипеном, инокулумом, кормом и глюкозой.
- Активировать контрольно-пропускной пункт Add Media Plate. Определите тип плиты, название и расположение пластины, содержащей среду.
ВНИМАНИЕ: В зависимости от типа пластины и если пластина содержит крышку, активируйте чек на Is Lidded, чтобы обеспечить бесперебойное функционирование жидком обработчика - Нажмите на добавить медиа для судов. Введите объем носителей, которые будут добавлены в сосуды. Определите отображение переноса носителя от пластины к сосудам. Нажмите на Далее, чтобы перейти на следующую вкладку.
- Активировать контрольно-пропускной пункт Add Media Plate. Определите тип плиты, название и расположение пластины, содержащей среду.
- Установите условия культивирования в реакторе.
- После того, как информация о средствах массовой информации была подана в программное обеспечение, назначаем условия культивирования. Нажмите на состояние сми и заполнить температуру, цель DO, верхний предел рН и перемешивания RPM (вверх перемешивания или вниз перемешивания).
- Установите добавление инокулумов в сосуды.
- Активировать Добавить плиту клетки. Определите тип пластины, название и расположение пластины, содержащей среду.
- Нажмите на Добавить клетки для судов. Введите время прививки и объем носителей, которые будут добавлены к сосудам.
- Определите путь, пройденный жидким обработчиком, к передаче ячейки от пластины к сосудам. Нажмите на Далее, чтобы перейти на следующую вкладку.
ПРИМЕЧАНИЕ: Убедитесь, что повторное использование Pipette Советы отключен, чтобы избежать перекрестного загрязнения и неправильной первоначальной жизнеспособной концентрации клеток.
- Установить добавление корма, глюкозы и антипены.
ПРИМЕЧАНИЕ: Процедура добавления корма, глюкозы и антипена похожа друг на друга. Ради этого протокола процедура указана для "Feed". Это может быть воспроизведендля для глюкозы и антипены.- Активируйте feed Plate и определите тип пластины, имя и местоположение. Нажмите на Добавить канал для судов и введите объем корма, который будет добавлен в сосуды. Определите отображение переноса корма с пластины на сосуды.
- В зависимости от культивирования, добавьте количество кормов. Для этого культивирования реактор кормят через 72 часа каждые 24 часа.
- Вручную добавьте задержку во времени между подачей, введя данные в задержку из добавленных ячеек. Первый день кормления после 72 часов прививки, а следующий после 96 часов и так далее.
ПРИМЕЧАНИЕ: Добавление антипены запрограммировано быть добавленным каждый день для того чтобы во избежание пенообразуя во время культивировать.
- Установите выборку во время выращивания.
- Активируйте плиту Add Sample plate и определите тип пластины, имя и местоположение.
- Проверьте take Sample с судов и введите объем образца, который будет удален из судов. Определите отображение переноса образца из сосудов на пластину. Убедитесь, что объем не уменьшается ниже 10 мл в течение всего курса выращивания.
- Добавьте количество образцов, которые необходимо взять во время выращивания. Подобно кормлению, добавьте время удаления образца из сосуда для каждой точки ввода образца.
- Сохранить процесс. Теперь он готов к исполнению.
ПРИМЕЧАНИЕ: Чтобы обеспечить бесперебойную работу протокола, переключитесь на вкладку Process Steps в программном обеспечении культуры ячейки AMBR и выберите представление Process Step, чтобы визуализировать поток рецепта.
- Во вкладке «Новый эксперимент» введите название эксперимента вместе с датой его проведения.
- Разработка эксперимента в автоматизированном микро-биореакторе
- Для того, чтобы запустить программное обеспечение DOE биореактора, убедитесь, что рецепт в основном программном обеспечении сохраняется и готов к использованию.
- Откройте программное обеспечение AMBR 15 DOE и нажмите на исследование и выберите новое.
- Введите название нового расследования DOE в диалоговом окне «Создать расследование».
- Для того, чтобы назначить эксперимент для исследования DOE, откройте рецепт, созданный для изучения различных параметров. Нажмите на просмотр и выберите соответствующий эксперимент.
- Определите фактор МЭ.
- Метки судна уже завербованы в колонне. Чтобы определить желаемый фактор DOE, выберите параметр и нажмите на столбец с пометкой фактор DOE. Выберите новые и добавьте единицы, аббревиатив, нижнюю и верхнюю пределы факторов (например, температура, DO, pH).
- Определите фактор реакции.
- После определения факторов МЭ определите ответ, на основе которого будет структурирован экспериментальный анализ.
- Во вкладке «Ответы» определите значения, которые необходимо учитывать при анализе данных.
- Нажмите на Edit DOE Responses и определите название ответа, аббревиатив, единицы, минимальные и максимальные пределы (например, титр, жизнеспособная концентрация клеток).
- Как только ответы будут определены, выберите переменную AMBR для каждого ответа и определите переменную. Ответ может быть автоматически связан с переменной микро-биореактора, Выберите требуемую переменную из списка выпадающих.
- Измените уравнение для каждого ответа в зависимости от требования. Выбор между минимальными, максимальными, во-первых, последними и средними данными.
- Создайте дизайн.
- Используйте Start Design Wizard для того, чтобы выбрать тип экспериментального дизайна, чтобы добавить или удалить количество репликатов и центральных точек.
- Выберите цель, которая определяет выбор конструкций и моделей:
Скрининг: Использует линейные модели взаимодействия для поиска важных факторов
Оптимизация (RSM), использует квадратные и кубические модели для детального моделирования и оптимизации
Цель разделения: Модели формулирования и технологических факторов могут быть выбраны отдельно - После того, как цель будет определена, выберите модель и дизайн вместе с количеством центральных точек и репликатов.
- Нажмите на финиш и переключитесь на следующую вкладку.
- Определите эксперимент.
ПРИМЕЧАНИЕ: Факторы DOE перечислены в правой колонке программного обеспечения. При выборе желаемых факторов будут выделены сосуды, работающие с желаемым параметром. Суда внутри станции культуры могут перемещаться, нажав на судно правой кнопкой мыши и перемещая его в нужное место.- Создавайте рабочие пакеты, которые могут быть импортированы в программном обеспечении культуры ячейки AMBR. В зависимости от количества экспериментов создаются и хранятся различные рабочие пакеты для дальнейшей реализации
- Выполнение эксперимента в рабочих пакетах, созданных на ноутбуке управления AMBR
- Во вкладке «Эксперимент» нажмите на Create DOE Experiment и просмотрите рабочий пакет, созданный с помощью программного обеспечения DOE.
- Инициализовать процесс, нажав кнопку Start.
- Анализ экспериментальных результатов
- После того, как эксперимент был выполнен, экспортировать данные с помощью экспортных результатов DOE. Открывается окно результатов экспортного МЭ, и строки, указывающие на судно культуры и станцию, указаны в таблице.
- Выберите нужные строки и нажмите на экспортированные выбранные строки или экспериментальные данные экспорта, чтобы сохранить все результаты и сохранить файл для дальнейшего анализа.
- Импортируйте данные в модуль AMBR DOE, переключившись на вкладку «Результаты» и выбрав результаты импорта.
- Просмотрите нужный файл данных и нажмите результаты анализа.
- Проанализируйте результаты в дальнейшем в MODDE.
4. Выполнение культивирования в автоматизированном микро-биореакторе
ПРИМЕЧАНИЕ: Следующие шаги выполняются пользователем с помощью протокола, записанного в вышеупомянутом программном обеспечении. Шаги выполняются пользователем, если не упомянуто иное.
- Загрузка судов
- Откройте гамма-стерилизованные сосуды культуры под ламинарным шкафом потока и ориентируйте в культурной станции, как показано на рисунке 2.
- Очистите зажим ную с помощью 70% этанола и двойной дистиллированной воды. Затем автоклавировать пластину и место на верхней части судна.
- Установите зажим пластины с мешалкой пластины, обеспечивая каждый штифт крепится твердо.
- Затяните как пластины мешалки и зажим пластины на перемешивание сборки.
- Запуск программного обеспечения для микро-биореакторов
- Используйте программу, написанную в разделе 3, для запуска культивирования.
- Визуализируйте этапы процесса, запланированные или завершенные во вкладке Process. Изменить шаги культивирования во время процесса, выполненные по мере необходимости, сначала приощяяв жидкий обработчик, а затем отредактивая рецепт процесса.
- Добавить антипены в сосуды, прежде чем мешалка начинается, чтобы обеспечить нет чрезмерного пены во время выращивания. Антипен будет добавляться регулярно, и пена обнаружена визуально.
- Добавление носителей в судно
- Заполните 24 хорошо пластины при условии микро-биореакторы вручную со стерильными носителями и место в назначенной палубе системы. Убедитесь, что пластина находится в колоде, обозначенном письменной программой (раздел 3). Заполнение судна будет происходить в соответствии с разработанным в разделе 3.2.2.
ПРИМЕЧАНИЕ: Температура и мешалка начинаютсразу после добавления средств массовой информации и антипены. Считыватель датчиков активируется через 1 час после заполнения судна (шаг Start Monitor). Газирование к каждому сосуду начинается после активации считывателя. Средства массовой информации остается уравновесить в течение как минимум 6 часов до рН перекалибровки и прививки. Параметры процесса могут быть изменены в программном обеспечении, как указано в разделе 3.2.3.
- Заполните 24 хорошо пластины при условии микро-биореакторы вручную со стерильными носителями и место в назначенной палубе системы. Убедитесь, что пластина находится в колоде, обозначенном письменной программой (раздел 3). Заполнение судна будет происходить в соответствии с разработанным в разделе 3.2.2.
- Прививки
- Измерьте жизнеспособную концентрацию клеток после5-го прохода. Рассчитайте количество клеток, которые будут переданы в сосуды, чтобы убедиться, что начальная концентрация клеток во всех сосудах составляет 3 х 105 ячеек/мл.
- Перенесите клетки на 24 глубоководные пластины таким образом, чтобы объем подвески был не менее чем в 1,6 раза больше необходимого объема. Для требуемого объема 2 мл инокулума, передача 3,2 мл клеточной подвески в каждую скважину в пластине.
- Поместите 24 пластины хорошо в назначенной палубе. Суда будут привиты в разделе 3.2.4.
- Ежедневная выборка и аналитика
- С помощью жидких обработчика ежедневно снимите образец 460 л из судов. Разбавить 200 л образца с 800 зл и ным 1л фильтрованного буфера PBS (5x разбавления), а затем поместить в клеточный счетчик.
- Centrifuge оставшийся образец в течение 5 мин при температуре 190 х и комнатной температуре и храните супернатант для дальнейшего анализа (глюкоза, лактат, глутамин и глутамат).
- Заморозить 100 л супернатанта при -20 градусов до конца культивирования для количественной оценки белка.
- Конец культивирования
- Когда контроль параметров процесса (т.е. температура, возбуждение, рН и DO) прекращается, прекратите мониторинг процесса.
- Отвинчьте пластину мешалки и зажим пластины.
- Удалите культурные сосуды и очистите культурные станции. Поместите сушильные пластины на культурных станциях и винт их дюйма
- Между тем, очистить зажим пластин тщательно с 70% этанола и двойной дистиллированной воды.
- Нажмите на Stop в программном обеспечении биореактора после завершения цикла сушки.
- Урожай клеточной культуры
- Урожайные клетки на 12 день выращивания вручную удаляя содержимое сосудов в 50 мл центрифуговых труб. Центрифуге клеточный бульон при 190 х г в течение 30 мин.
- Отбросьте пеллеты клетки и храните супернатант при -20 градусах Цельсия.
5. Измерение концентрации mAb
- Используйте 1,7 мл протеина колонки для количественной оценки белка во время культивирования перспективе.
-
Подготовьте буфер равновесия и улюдовимы перед оттаиванием образцов.
- Используйте раствор 0,5 M Na2HPO4, содержащий 0,5 М NaCl с рН 7,9 в качестве буфера равновесия и раствором 100 мМ глицина, содержащего 0,5 М NaCl с рН 2 в качестве буфера elution.
- Фильтр обоих буферов через мембрану 0,2 мкм и дегазы, прежде чем быть помещены для анализа.
- Очистите высокопроизводительную систему жидкой хроматографии (HPLC) свежеприготовленным буфером равновесия.
- Загрузите столбец белка на систему HPLC.
- Проведите хроматографию со скоростью потока 1 мл/мин. Установите температуру колонки в духовке при температуре 30 градусов по Цельсию и автоматическую температуру при температуре 10 градусов по Цельсию
- Оттепель замороженных образцов при комнатной температуре и фильтр 225 л каждого образца через мембрану PVDF 0,22 мкм. Разбавить образцы с более высокой концентрацией желаемого белка в соотношении 1:20 с буфером равновесия и фильтровать через мембрану перед размещением в автосэмпере.
- Поместите образцы в автосэмпере. Загрузите метод и последовательность в программное обеспечение и запустите последовательность.
ПРИМЕЧАНИЕ: Метод состоит из трех этапов (см. рисунок 1):инъекция образца в столбец в течение первых двух минут; затем буфер elution в течение 8 минут и регенерация столбца с буфером равновесия в течение 10 минут.
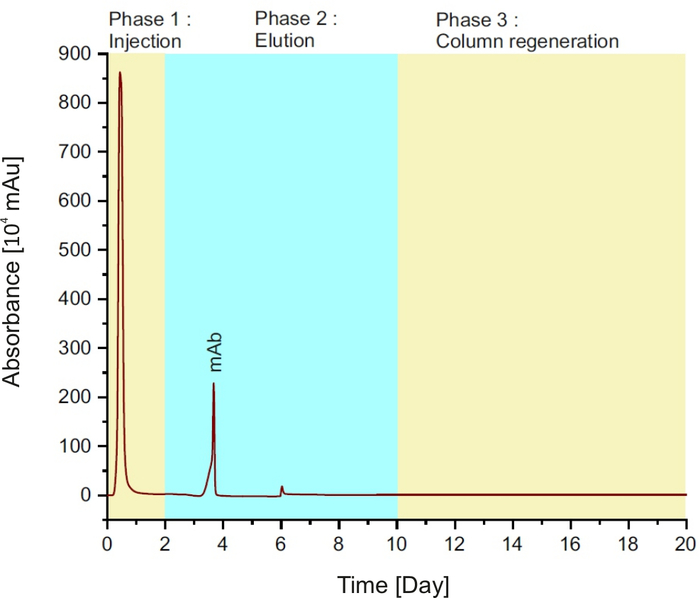
Рисунок 1: Протеин Хроматограмма, представляющий различные фазы в течение одного запуска. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Обзор культивирования, выполненного в данном исследовании, представлен на рисунке 2.
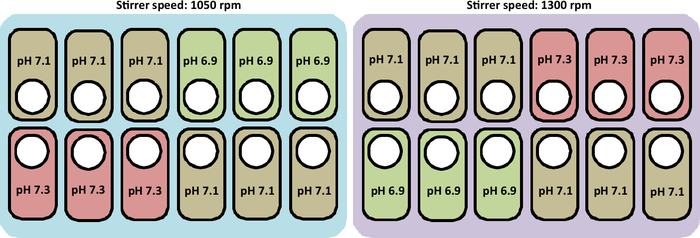
Рисунок 2: Схематическое представление экспериментальных условий для проверки профилей скорости рН ?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Оптимизация процесса повышения урожайности имеет решающее значение в биофармацевтической промышленности. Встряхивание колбы потенциально могут быть использованы для скрининга штамма; однако, мониторинг параметров процесса, таких как рН и DO, недоступен в колбах. Микро-биореакторы им?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Бундесминистриум Фюр Бильдунг и Форшунг (BMBF), Федеральное министерство образования и исследований, Германия, и BioProcessing команды Сарториус Stedim Biotech GmbH, Германия, за их поддержку.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
Ссылки
- Langer, E. S. 15th Annual report and survey of Biopharmaceutical Manufacturing Capacity and Production: A study of Biotherapeutical Developers and Contract Manufacturing Organizations. Bioplan Associates. , Available from: http://bioplanassociates.com/wp-content/uploads/2018/07/15thAnnualBiomfgReport_TABLEOFCONTENTS-LR.pdf (2019).
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136(2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, Springer. New York. (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757(2019).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены