JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
중국 햄스터 난소 세포 재배에서 고처리량 자동화 마이크로 바이오리액터를 사용한 공정 최적화
요약
여기에서, 우리는 단백질 A 열을 사용하여 세포 수확 및 단백질 정량화에 선행된 자동화된 마이크로 bioreactor에 있는 실험의 디자인을 실행하는 상세한 절차를 제시합니다.
초록
원하는 제품의 수율을 높이기 위해 바이오 공정의 최적화는 바이오 제약 산업에서 중요합니다. 이것은 변형 률 선택과 생물 공정 매개 변수를 개발하여 달성 할 수 있습니다. 이 목적을 위해 사용 된 쉐이크 플라스크. 그러나, 그들은 pH 및 용존 산소 (DO)와 같은 공정 파라미터를 제어 할 수있는 능력이 부족합니다. 이러한 한계는 자동화된 마이크로 바이오리액터의 도움으로 극복될 수 있다. 이러한 생물 반응기는 더 큰 규모로 재배를 모방합니다. 이 시스템의 주요 장점 중 하나는 소프트웨어에 실험 설계(DOE)를 통합하는 것입니다. 이러한 통합을 통해 여러 공정 파라미터를 동시에 변경할 수 있는 설계를 수립할 수 있습니다. 중요한 공정 파라미터와 최적의 바이오 공정 조건을 소프트웨어 내에서 분석할 수 있습니다. 여기에 제시된 작업의 초점은 재배 실행 내에서 DOE의 소프트웨어 및 통합에서 프로세스 설계와 관련된 단계를 사용자에게 소개하는 것입니다.
서문
글로벌 바이오 의약품 시장은 2018년에 2,500억 달러 이상의 가치를 지니고 있으며 지속적으로1개사업을 확장하고 있습니다. 제약 회사들은 작은 분자 약물을 생산하는 것에서 재조합 단백질과 같은 생명 공학적으로 생산된 치료제로 옮겨가고 있습니다. 이들 만이 1,500억 달러 이상의 수익을 책임지고있습니다. 포유류 세포는 이제 이러한 약제학적 재조합 단백질의 생산에 광범위하게 사용된다. 현재 포유류 세포에 의해 생산된 68개의 승인된 제품 중 57개는 중국 햄스터 난소 세포(CHO)에 의해 생산된다2. CHO 세포는 특히 번역 후 수정을 필요로 하는 재조합 단백질의 생산에 사용됩니다. 이들 세포는 현탁액에서 성장함에 따라 바람직하며, 이에 따라 화학적으로 정의된 배지3,,4. CHO 세포를 사용하는 또 다른 장점은 생성물의 글리칸 구조가 인간 단일클론 항체(mAb)의 글리칸 구조와 유사하고 유전자 증폭5로 인한 재조합 단백질 수율 및 특이적 생산성을 초래한다는것이다.
재조합 CHO (rCHO) 세포 배양의 수율은 지난 2 년간 백 배 증가했습니다. 이러한 개선은 공정 파라미터의 최적화, 공급 전략 및 화학적으로 정의된 배지6의혈청 자유의 개발에 기인한다. 의약품의 요구 사항의 증가와 함께, 생산 공정의 개발을위한 비용 및 시간 효율에 대한 압력이 증가7. 제품 품질을 보장하면서 압력을 줄이기 위해 설계 품질 (QbD)에 제약 산업의 초점을 리디렉션했습니다. QbD는 제품 생산과 공정을 이해하는 데 사용됩니다. ObD에 사용되는 중요한 도구는 실험 설계(DOE)입니다. 다양한 입력 변수와 결과 출력 데이터 간의 관계를 표시하여 프로세스에 대한 이해를 높이는 데 도움이 됩니다. 생물 공정을 최적화하기 위해 DOE 접근법을 적용하는 것은 공정 조건을 동화하고 적조기 수량 및 품질을 증가시키는 프로젝트의 초기 단계에서 유용합니다. 이 방법은 구식 전략인 한 번에 한 단계(OFAT)와 비교할 때 유용합니다. 고전, 샤인 또는 타구치를 사용하여 DOE에 대한 통계적 접근 방식은 OFAT8보다훨씬 우수합니다.
프로세스 및 미디어 최적화는 쉐이크 플라스크에서 수행할 수 있습니다. 플라스크는 상대적으로 저렴합니다. 그러나 온도, pH 및 용존 산소(DO)와 같은 파라미터를 제어할 수 없습니다. 이러한 단점을 극복하기 위해 0.5L ~ 5L의 작업량에 이르는 다용도 벤치탑 바이오리액터를 사용할 수 있습니다. 반응기는 광범위한 온라인 모니터링 및 공정 제어를 제공합니다. 그러나, 다용도 바이오리액터의 사용은 시간과 노동 집약적이다. 이러한 단점을 극복하기 위해 벤치탑 바이오리액터와 쉐이크 플라스크의 손쉬운 취급을 모니터링하는 포괄적인 공정을 결합한 새로운 일회용 바이오리액터가 사용된다. 높은 처리량 스크리닝 시스템과 일회용 기술은 공정 성능 및 개발의 효율성을 향상시키는 데기여했습니다 9.
이 문서에서는 자동화된 마이크로 바이오리액터(AMBR) 소프트웨어에 레시피를 로드하는 지침이 나열되어 있습니다. 이 실험의 과정에서 상이한 교반기 속도 및 pH가 생존 가능한 세포 농도(VCC) 및 기중기에 미치는 영향이 연구된다. 실험 결과 및 분석은 실험 소프트웨어 MODDE 12의 설계로 수행된다. 제품 분석은 단백질 A 컬럼이 있는 고압 액체 크로마토그래피(HPLC) 시스템에서 수행됩니다. mAb의 Fc 영역이 높은 친화성10,,11을가진 단백질 A에 결합한다는 원리에 기초한다. 이 방법을 사용하면 mAb를 식별하고 정량화할 수 있습니다. 정량화는 280 nm에서 측정된 용출 피크 영역에 걸쳐 수행된다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 사전 배양 절차
참고: 1 x 107 세포/mL의 가능한 세포 농도를 가진 재조합 CHO DG44 세포가 이 프로토콜에 사용된다.
- 1.2 mL의 세포를 함유하는 바이알을 실온으로 해동시키고 즉시 10 mL의 차가운 종자 배지를 함유하는 15 mL 원추형 원심분리관으로 세포 현탁액을 옮김을 옮김.
- 원심분리기 튜브를 190 x g 및 실온에서 5분간 원심분리하고 상온을 버린다.
- 종자 배지의 150 mL을 500 mL 쉐이크 플라스크에서 36.8°C로 예열한다.
- 미리 데운 종자 배지의 10 mL에서 세포 펠릿을 부드럽게 다시 일시 중단하고 세포를 쉐이크 플라스크로 옮김으로 옮김을 옮김으로 옮니다.
- 플라스크에서 샘플의 1 mL을 사용하여 세포 카운터를 사용하여 초기 VCC 및 생존 가능성을 측정합니다.
참고: 생존력은 성공적인 재배를 위해 해동 후 70 % 이상이어야합니다. - 36.8°C및 7.5%CO2에서 궤도 셰이커(셰이커 직경 19 mm)에 쉐이크 플라스크를 120 rpm의 흔들림률로 배양합니다.
참고: 이러한 조건은 세포 변형 및 배지에 따라 다릅니다. - 세포를 통과 한 후 3 일, 쉐이커에서 쉐이크 플라스크를 제거하고 층류 흐름 캐비닛 아래에 놓습니다. 최종 세포 농도를 측정하기 위해 샘플 1 mL을 가져 가라. 새로운 통로의 초기 세포 농도가 2 x 105 세포/mL이되도록 신선한 미리 온화된 종자 배지로 이송될 부피를 계산한다.
- 세포를 총 5회 통과한 후 주요 재배를 위한 생물반응기로 이송한다.
2. 주요 재배
- 배양 전분의 최종 세포 농도를 측정합니다. 반응기내의 초기 세포 농도가 3 x 105 세포/mL이되도록 생물반응기로 이송될 부피를 계산한다.
- 반응기를 접종 하기 하루 전에 생산 매체로 채우고 반응기를 평형화하고 온도, pH 및 DO와 같은 공정 매개 변수를 설정합니다.
참고: 재배 조건은 36.8°C 및 60% 용존 산소 농도(DO)이다. 우리는 6.9, 7.1 및 7.3의 pHs와 함께 1050 rpm 및 1300 rpm의 교반기 속도를 테스트했습니다. 재배의 총 기간은 세포가 수확 될 때까지 12 일입니다. 일괄 처리는 72시간 동안 실행된 후 24시간마다 피드 매체가 추가됩니다. 재배에 사용되는 프로토콜은 다음 세그먼트에 상세히 나열되어 있다.
3. 자동화된 마이크로 바이오리액터 소프트웨어에 레시피 작성
참고: AMBR 셀 배양 소프트웨어에서 레시피를 작성하는 방법에는 마법사를 사용하거나 각 단계를 수동으로 추가하여 작성하는 두 가지 방법이 있습니다. 이 프로토콜을 위해 마법사를 사용하는 단계가 표시됩니다.
- 새 실험 만들기
- AMBR 세포 배양 소프트웨어를 열고 소개 탭에서 새 실험 만들기를클릭합니다.
- 레시피 로드
- 새 실험 탭에서 실험이 수행될 날짜와 함께 실험 이름을 입력합니다.
- 재배 중에 사용되는 배양소 및 선박에 대한 체크포인트를 활성화한다. DOE 실험 프로그래밍 중에 DOE 자동 추가 태그도 쉽게 전환할 수 있습니다. 다음 탭으로 전환하려면 다음을 클릭합니다.
- 항폼, 접종, 사료 및 포도당과 함께 용기에 미디어를 추가하는 것에 대한 정보를 설정합니다.
- 미디어 플레이트 추가 검사점을 활성화합니다. 매질을 포함하는 플레이트 의 플레이트 유형, 이름 및 위치를 정의합니다.
주의: 플레이트 의 종류와 플레이트에 뚜껑이 있는 경우 뚜껑이 있는 지 확인을 활성화하여 액체 처리기의 원활한 작동을 보장합니다. - 선박에 미디어 추가를 클릭합니다. 용기에 추가할 용지의 볼륨을 입력합니다. 플레이트에서 용기로의 미디어 전송 매핑을 정의합니다. 다음 탭으로 전환하려면 다음을 클릭합니다.
- 미디어 플레이트 추가 검사점을 활성화합니다. 매질을 포함하는 플레이트 의 플레이트 유형, 이름 및 위치를 정의합니다.
- 반응기에서 재배 조건을 설정합니다.
- 미디어 정보가 소프트웨어에 공급된 후 재배 조건을 지정합니다. 조건 매체를 클릭하고 온도를 채우고, 대상 DO, 상부 pH 한계 및 교반 RPM (위 교반 또는 아래로 교반).
- 혈관에 접종을 추가합니다.
- 셀 플레이트 추가를 활성화합니다. 매질을 포함하는 플레이트의 플레이트 유형, 이름 및 위치를 정의합니다.
- 혈관에 셀 추가를 클릭합니다. 접종 시간과 용기에 추가할 미디어의 볼륨을 입력합니다.
- 액체 처리기에 의해 플레이트에서 용기로 셀의 전달까지 이동하는 경로를 정의합니다. 다음 탭으로 전환하려면 다음을 클릭합니다.
참고: 교차 오염 및 잘못된 초기 실행 가능한 세포 농도를 방지하기 위해 재사용 파이펫 팁이 비활성화되어 있는지 확인합니다.
- 사료, 포도당 및 항폼을 추가합니다.
참고: 사료, 포도당 및 항폼의 첨가 절차는 서로 유사합니다. 이 프로토콜을 위해 절차는 "피드"에 대해 나열됩니다. 이것은 포도당 및 항폼을 위해 복제될 수 있습니다.- 피드 추가 플레이트를 활성화하고 플레이트 유형, 이름 및 위치를 정의합니다. 용기에 사료 추가를 클릭하고 선박에 추가할 사료의 부피를 입력합니다. 플레이트에서 용기로의 이송 을 정의합니다.
- 재배에 따라 사료 첨가 수를 추가합니다. 이러한 재배를 위해, 반응기는 24시간마다 72시간 후에 공급된다.
- 추가된 셀에서지연에 데이터를 입력하여 공급 사이의 시간 지연을 수동으로 추가합니다. 수유의 첫 날은 72 시간의 접종 후이며 다음 날은 96 시간 이후입니다.
참고: 항폼 첨가제는 재배 중에 발포를 피하기 위해 매일 첨가하도록 프로그램되어 있습니다.
- 재배 중에 샘플링을 설정합니다.
- 샘플 플레이트 추가를 활성화하고 플레이트 유형, 이름 및 위치를 정의합니다.
- 용기에서 샘플을 채취하고 용기에서 제거할 샘플의 부피를 입력합니다. 용기에서 플레이트로의 샘플 전달 매핑을 정의합니다. 재배 과정 내내 부피가 10 mL 이하로 감소하지 않도록 하십시오.
- 재배 중에 채취할 샘플 수를 추가합니다. 공급과 마찬가지로 각 입력 샘플 점에 대해 용기에서 제거되는 샘플의 시간을 추가합니다.
- 프로세스를 저장합니다. 이제 실행 준비가 되었습니다.
참고: 프로토콜의 원활한 실행을 보장하려면 AMBR 셀 배양 소프트웨어의 프로세스 단계 탭으로 전환하고 프로세스 단계 보기를 선택하여 레시피의 흐름을 시각화합니다.
- 새 실험 탭에서 실험이 수행될 날짜와 함께 실험 이름을 입력합니다.
- 자동화된 마이크로 바이오리액터의 실험 설계
- 생물 반응기의 DOE 소프트웨어를 실행하려면 주 소프트웨어의 레시피가 저장되고 사용할 준비가되었는지 확인하십시오.
- AMBR 15 DOE 소프트웨어를 열고 조사를 클릭하고 새을 선택합니다.
- 조사 만들기 대화 상자에 새 DOE 조사의 이름을 입력합니다.
- DOE 조사에 실험을 할당하려면 생성된 레시피를 열어 다른 매개 변수를 연구합니다. 찾아보기를 클릭하고 각 실험을 선택합니다.
- DOE 계수를 정의합니다.
- 선박 태그가 이미 열에 등록되어 있습니다. 원하는 DOE 계수를 정의하려면 매개 변수를 선택하고 DOE 계수로표시된 열을 클릭합니다. 새로 를 선택하고 요인의 단위, 약어, 하한 및 상한(예: 온도, DO, pH)을 추가합니다.
- 응답 계수를 정의합니다.
- DOE 요인이 정의되면 실험 분석이 구조화될 응답을 정의합니다.
- 응답 탭에서 데이터 분석에 대해 고려할 값을 정의합니다.
- DOE 응답 편집을 클릭하고 응답, 약어, 단위, 최소 및 최대 제한(예: 적시, 실행 가능한 세포 농도)의 이름을 정의합니다.
- 응답이 정의되면 각 응답에 대한 AMBR 변수를 선택하고 변수를 정의합니다. 응답은 마이크로 바이오리액터 변수와 자동으로 연관될 수 있으며, 드롭다운 목록에서 필요한 변수를 선택합니다.
- 요구 사항에 따라 각 응답에 대한 방정식을 변경합니다. 선택은 최소, 최대, 첫 번째, 마지막 및 평균 데이터 간에 선택됩니다.
- 설계를 작성합니다.
- 설계 시작 마법사를 사용하여 실험 설계 유형을 선택하고 복제 및 중심점 수를 추가하거나 제거합니다.
- 설계 및 모델의 선택을 결정하는 목표를 선택합니다.
스크리닝: 선형 및 상호 작용 모델을 사용하여 중요한 요소를 찾습니다.
RSM(최적화) - 상세한 모델링 및 최적화를 위해 이차 및 입방 모델을 사용합니다.
분할 목표: 제형 및 공정 요인에 대한 모델을 별도로 선택할 수 있습니다. - 목표가 결정되면 중심점 및 복제 수와 함께 모델과 디자인을 선택합니다.
- 완료를 클릭하고 다음 탭으로 전환합니다.
- 실험을 정의합니다.
참고: DOE 계수는 소프트웨어의 오른쪽 열에 나열됩니다. 원하는 요소를 선택하면 원하는 매개 변수로 실험을 실행하는 용기가 강조 표시됩니다. 배양소 내의 선박은 선박을 마우스 오른쪽 버튼으로 클릭하고 원하는 위치로 이동하여 이동할 수 있습니다.- AMBR 셀 배양 소프트웨어에서 가져올 수 있는 작업 패킷을 만듭니다. 실험 수에 따라 추가 구현을 위해 다른 작업 패킷이 생성되고 저장됩니다.
- AMBR 제어 노트북에서 생성된 작업 패킷에서 실험 실행
- 실험 탭에서 DOE 실험 만들기를 클릭하고 DOE 소프트웨어를 사용하여 만든 작업 패킷을 찾아봅습니다.
- 시작을클릭하여 프로세스를 초기화합니다.
- 실험 결과 분석
- 실험이 실행되면 DOE 내보내기 결과를사용하여 데이터를 내보냅니다. 내보내기 DOE 결과 창이 열리고 문화Vessel 및 스테이션을 나타내는 행이 표에 나열됩니다.
- 원하는 행을 선택하고 내보낸 선택행을 클릭하거나 실험 데이터 내보내기를 클릭하여 모든 결과를 저장하고 추가 분석을 위해 파일을 저장합니다.
- 결과 탭으로 전환하고 결과 가져오기를선택하여 데이터를 AMBR DOE 모듈로 가져옵니다.
- 원하는 데이터 파일을 찾아보고 분석 결과를 클릭합니다.
- MODDE에서 결과를 더 자세히 분석합니다.
4. 자동화된 마이크로바이오리액터재배의실행
참고: 다음 단계는 전술한 소프트웨어에 기록된 프로토콜의 도움으로 사용자가 실행합니다. 단계는 달리 언급되지 않는 한 사용자가 수행합니다.
- 선박 적재
- 도 2에도시된 바와 같이 층류 캐비닛 하에서 감마 멸균 배양 용기를 열고 배양스테이션에서 방향을 지정한다.
- 클램프 플레이트를 70% 에탄올과 이중 증류수로 청소합니다. 그런 다음 접시를 오토 클레이브하고 용기 위에 놓습니다.
- 스트레머 플레이트로 클램프 플레이트를 장착하여 각 핀이 단단히 고정되도록 합니다.
- 교반기 플레이트와 클램프 플레이트를 교반 어셈블리에 조입니다.
- 마이크로 바이오리액터 소프트웨어 실행
- 3절에 기술된 프로그램을 사용하여 재배를 실행합니다.
- 프로세스 탭에서 예약또는 완료된 공정 단계를 시각화합니다.
- 교반기가 시작되기 전에 용기에 안티폼을 첨가하여 재배 중에 과도한 발포가 발생하지 않도록 합니다. 안티 폼은 정기적으로 추가되며, 거품은 시각적으로 검출된다.
- 용기에 용지 추가
- 마이크로 바이오리액터와 함께 제공된 24개의 웰 플레이트를 멸균 매체와 함께 수동으로 채우고 시스템의 지정된 데크에 놓습니다. 플레이트가 서면 프로그램(섹션 3)에 의해 지정된 갑판에 놓여 있는지 확인합니다. 선박의 충전은 섹션 3.2.2에서 설계된 대로 진행됩니다.
참고: 온도 및 교반기는 매체 및 항폼의 첨가 직후에 시작된다. 센서 리더는 용기가 채워진 후 1시간 후에 활성화됩니다(모니터 시작 단계). 판독기가 활성화되면 각 용기에 대한 가스가 시작됩니다. 매체는 pH 재교정 및 접종 전에 최소 6 시간 동안 평형 상태로 남아 있습니다. 프로세스 매개 변수는 섹션 3.2.3에 언급 된 대로 소프트웨어에서 변경할 수 있습니다.
- 마이크로 바이오리액터와 함께 제공된 24개의 웰 플레이트를 멸균 매체와 함께 수동으로 채우고 시스템의 지정된 데크에 놓습니다. 플레이트가 서면 프로그램(섹션 3)에 의해 지정된 갑판에 놓여 있는지 확인합니다. 선박의 충전은 섹션 3.2.2에서 설계된 대로 진행됩니다.
- 접종
- 5번째 대복 후th 생존 가능한 세포 농도를 측정합니다. 모든 혈관의 초기 세포 농도가 3 x 105 셀/mL인지 확인하기 위해 용기로 이송될 셀 수를 계산합니다.
- 셀을 24개의 깊은 웰 플레이트로 옮겨 서스펜션의 부피가 필요한 부피의 1.6배 이상이되도록 한다. 접종의 2 mL의 필요한 부피를 위해, 플레이트의 각 우물에 3.2 mL의 세포 현탁액을 옮김을 옮김.
- 지정된 갑판에 24 개의 우물 판을 놓습니다. 선박은 섹션 3.2.4에서와 같이 접종됩니다.
- 일일 샘플링 및 분석
- 액체 처리기를 사용하여 매일 용기에서 460 μL 샘플을 제거합니다. 여과된 1x PBS 버퍼(5x 희석)의 800 μL로 시료의 200 μL을 희석한 다음 세포 카운터에 놓습니다.
- 190 x g 및 실온에서 5 분 동안 나머지 샘플을 원심 분리하고 추가 분석을 위해 상판액을 저장합니다 (포도당, 젖산염, 글루타민 및 글루타민).
- 단백질 정량화를 위해 재배가 끝날 때까지 상급자의 100 μL을 -20°C에서 동결한다.
- 재배 종료
- 공정 파라미터 제어(즉, 온도, 교반, pH 및 DO)가 종료되면 공정의 모니터링을 중지합니다.
- 교반기 플레이트와 클램프 플레이트를 풀습니다.
- 배양 혈관을 제거하고 배양 스테이션을 청소합니다. 배양 소에 건조 판을 놓고 나사.
- 한편, 클램프 플레이트를 70% 에탄올과 이중 증류수로 철저히 청소하십시오.
- 건조 주기가 완료되면 생물 반응기 소프트웨어에서 중지를 클릭합니다.
- 세포 배양 수확
- 재배 12일째에 세포를 수확하여 용기의 함량을 50 mL 원심분리기 튜브로 수동으로 제거하였다. 세포 국물을 190 x g에서 30 분 동안 원심 분리합니다.
- 세포 펠릿을 버리고 상급체를 -20°C에 보관합니다.
5. mAb 농도 측정
- 재배 실행 동안 단백질의 정량화를 위해 1.7 mL 단백질 A 컬럼을 사용한다.
-
샘플을 해동하기 전에 평형 및 용출 버퍼를 준비합니다.
- 0.5 MNa2HPO4의 용액을 7.9의 pH를 함유하는 0.5 MNa2 HPO4의 용액을 평형 완충제및 용출 완충충제으로서 2의 pH를 함유하는 0.5 MM NaCl을 함유하는 100 mM 의 글리신용액을 사용한다.
- 분석을 위해 배치되기 전에 0.2 μm 멤브레인과 탈가를 통해 두 버퍼를 필터링합니다.
- 갓 준비한 평형 버퍼로 고성능 액체 크로마토그래피 시스템(HPLC)을 제거합니다.
- 단백질 A 컬럼을 HPLC 시스템에 로드합니다.
- 1 mL / min의 유량으로 크로마토그래피를 수행하십시오. 컬럼 오븐 온도를 30 °C로 설정하고 자동 샘플러 온도를 10 °C로 설정하십시오.
- 냉동 시료를 실온에서 해동하고 0.22 μm PVDF 멤브레인을 통해 각 시료의 225 μL을 걸러내다. 원하는 단백질의 높은 농도로 샘플을 희석하는 것은 자동 샘플러에 배치하기 전에 평형 완충액과 멤브레인을 통해 여과 1:20 비율로.
- 샘플을 자동 샘플러에 놓습니다. 소프트웨어에서 메서드 및 시퀀스를 로드하고 시퀀스를 시작합니다.
참고: 이 방법은 3단계로 구성된다(도 1참조): 처음 2분 동안 샘플을 컬럼에 주입; 이어서 8분 동안 용출 버퍼를, 10분 동안 평형 버퍼를 가진 컬럼 재생을 수행합니다.
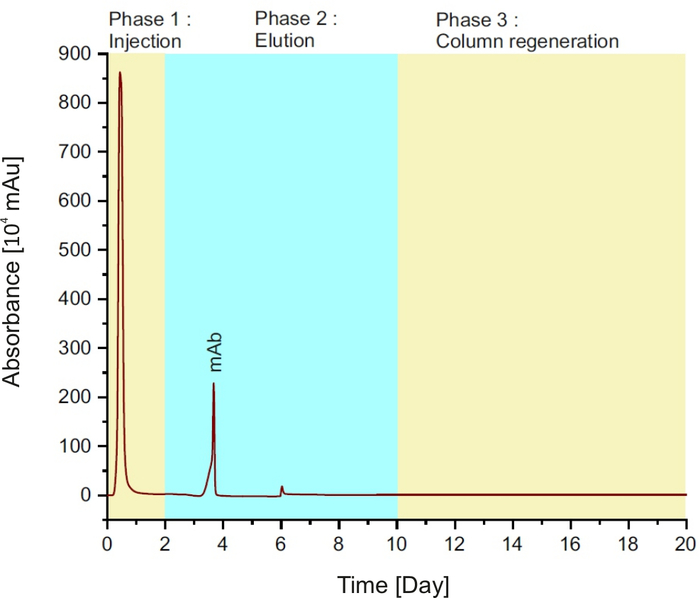
그림 1: 단백질 A 크로마토그램, 단일 실행 동안 상이한 단계를 나타내는. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
본 연구에서 수행된 재배에 대한 개요는 그림 2에제시되어 있습니다.
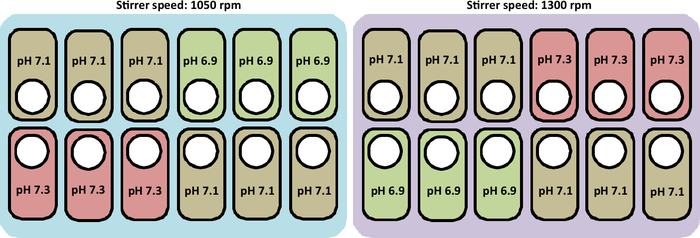
도 2: 배양스테이션에서 pH 및 교반기 속도 프로파일을 시험하기 위한 실험 조건의 개략적 표현. 그림은 또한 선박을 배치하는 올바른 레이아웃을 나타냅니다.
Access restricted. Please log in or start a trial to view this content.
토론
수율을 높이기 위한 공정의 최적화는 바이오 제약 산업에서 매우 중요합니다. 쉐이크 플라스크는 잠재적으로 균주의 스크리닝에 사용될 수 있다; 그러나 pH 및 DO와 같은 공정 파라미터의 모니터링은 플라스크에서 사용할 수 없습니다. 마이크로 바이오리액터는 공정을 지속적으로 모니터링하고 제어할 수 있다는 장점이 있습니다. 마이크로 바이오리액터의 이러한 제어 루프는 또한 더 큰 규모의 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 분데스장관 퓌르 빌둥 und Forschung (BMBF), 교육 및 연구의 연방 정부, 독일, 그리고 사르토리우스 스테딤 생명 공학 GmbH의 바이오 프로세싱 팀에 감사드립니다, 독일, 그들의 지원에 대한.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
참고문헌
- Langer, E. S. 15th Annual report and survey of Biopharmaceutical Manufacturing Capacity and Production: A study of Biotherapeutical Developers and Contract Manufacturing Organizations. Bioplan Associates. , Available from: http://bioplanassociates.com/wp-content/uploads/2018/07/15thAnnualBiomfgReport_TABLEOFCONTENTS-LR.pdf (2019).
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136(2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, Springer. New York. (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757(2019).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유