Method Article
长期纳米材料暴露后体外基因毒性测试的高级 3D 肝脏模型
Erratum Notice
摘要
该程序被确定用于在体外培养先进的3D肝培养物,它可以提供与纳米材料暴露在急性或长期重复剂量制度相关的基因毒性危害的生理相关评估。
摘要
由于各种工程纳米材料 (ENM) 的快速开发和实施,接触 ENM 是不可避免的,开发强大、预测性的体外测试系统至关重要。肝毒学是考虑ENM暴露的关键,因为肝脏在代谢平衡和排毒中起着至关重要的作用,并且是ENM暴露后积累的主要部位。基于这一点和公认的理解,2D肝细胞模型不能准确地模拟复杂的多细胞相互作用和体内观察到的代谢活动的复杂性,因此,人们更加注重开发生理相关的3D肝脏模型,这些模型专为ENM在体外的危险评估目的而定制。根据3R取代、减少和完善动物实验的原则,开发了3D HepG2细胞系肝脏模型,这是一个用户友好、经济高效的系统,可支持延长和重复的ENM暴露制度(≤14天)。这些球形模型(直径为 500 μm ≥)保留了其增殖能力(即分细胞模型),允许它们与"黄金标准"微核测定相结合,以有效评估体外基因毒性。他们报告一系列毒理学终点(如肝功能、(亲)炎症反应、细胞毒性和基因毒性)的能力,在急性(24 h)和长期(120 h)暴露机制中都使用多种ENM。这种 3D 体外肝模型能够用于评估更逼真的 ENM 暴露,从而提供未来的体外方法,以常规且易于访问的方式更好地支持 ENM 危险评估。
引言
由于在大量基于人类的应用(如食品、化妆品、服装、体育器材、电子、运输和医药)中迅速发展和实施了各种工程纳米材料 (ENM),人类不可避免地会定期接触 ENM。由此,人们更加担心,认为这些材料在众多应用中具有优势的新型、尺寸特定的物理化学特性可能会同时对人类健康和环境造成不利影响。目前,许多国际活动正在开展,以积极反映与生理上更相关的接触这些ENM,并评估这些材料在急性、长期和反复的低剂量暴露情况下的潜在毒性。
肝毒学是考虑ENM暴露的关键,因为众所周知,肝脏是ENM积累后暴露1,2的主要部位。此外,肝脏是进入系统循环3的物质代谢和排毒的主要器官系统。基于公认的理解,2D肝细胞模型不能准确地模仿复杂的多细胞相互作用的复杂性或适当代表体内观察到的代谢活动,4、5已确定更注重开发体外替代技术的健壮和生理相关的体外3D肝脏模型。利用先进的3D培养技术可延长体外肝模型的寿命,从而可以研究长期、重复的暴露制度。此外,这种先进的文化形式促进了增强的生理、有机特征的形成,如胆汁管状、活性运输过程和提高CYP450药物代谢能力,从而提高了模型6的预测性。目前由单一培养物(仅限肝细胞)或共生培养(具有非帕伦奇细胞的肝细胞)组成的体外肝模型以多种形式存在, 从超低粘附板中的微质素或球体、悬垂球体、嵌入矩阵和/或脚手架中的细胞以及微流体细胞培养平台,所有这些都被认为是肝毒性评估6、7的有效高级体外模型。然而,这些型号系统大部分是高维护,需要专门设备,而且价格昂贵。此外,这些模型通常是静态的(即非分割细胞模型),防止它们用于危险终点的评估,例如使用量化固定DNA损伤的方法进行基因氧化测试。基因毒性是监管毒理学的核心前提,是任何毒物8的风险评估的重要组成部分。没有单一的检测可以用来量化接触外源性剂后可能出现的所有形式的DNA损伤。然而,体外基因氧化测试电池的核心部件是微核检测,这是一种可靠和多方面的技术,测量总染色体损伤9。这是经合组织测试指南487描述的一种黄金标准技术,用于评估体外DNA损伤和基因毒性,是监管危险评估10,11测试电池要求的一部分。
人类肝细胞癌细胞系,HepG2,被广泛用于初始危险评估筛查,因为细胞是现成的,相对便宜的来源,简单的培养和适应高吞吐量筛查12,13。当培养成3D球形结构时,它们已被证明能够很好地回顾肝脏微环境,并提供具有足够增殖能力的肝模型来支持微核测定3。进一步开发 HepG2 球形模型是为了提高模型的寿命和肝脏样功能,以支持长期重复暴露制度(≤14 天)的基因毒性危害评估。因此,根据3R取代、减少和改进动物实验的原则,本议定书已经建立,以提供先进的3D体外肝模型,能够可靠地评估多种毒理学终点(例如肝脏功能、(亲)炎症标记、细胞毒性和基因毒性),在常规和容易获得的常规和易于接触的化学品和ENM暴露之后。
在这里,我们提出了一种方法,建立一个生理相关的3D肝细胞系为基础的体外模型系统,用于在急性或长期重复ENM暴露后进行基因毒性危害评估。该协议可分为6个关键阶段:培养冷冻保存的HpG2细胞:HepG2 球形制备:HepG2 球形从悬垂转移到高糖悬架;赫普2球形收获:微核测定和评分;和数据分析。
研究方案
1.培养冷冻保存的 HepG2 细胞
注:从美国类型培养系列(ATCC)获得的 HepG2 细胞在 1x 杜尔贝科的改性鹰介质 (DMEM) 中培养,4.5g/L D-葡萄糖和 L-谷氨酰胺补充 10% 胎儿牛血清 (FBS) 和 1% 青霉素/链霉素抗生素。
- 预热 DMEM 细胞培养介质(包括补充剂)在 37 °C 水浴中 30 分钟。
- 从液氮中取出一小瓶 HepG2 细胞,在 37 °C 水浴中解冻 2-3 分钟,同时轻轻旋转小瓶,以实现细胞悬架的均匀解冻。注意不要将小瓶浸入 O 环上方,以减少污染的可能性。
- 解冻后,从水浴中取出小瓶,用70%乙醇慷慨喷洒,以净化小瓶的外表面,然后放入无菌的II类层压组织培养罩下。
- 小心地将 HepG2 细胞的低温内含物放入含有 9 mL 预热 DMEM 细胞培养介质(含补充剂)的离心管中。
- 使用 10 mL 剥离,将 10 mL 的细胞悬浮物转移到 25 厘米2 的一次性细胞培养瓶中,并在 5% CO2 和 37 °C 下孵育培养 3 天(从播种开始),直到达到 +80% 的汇合,然后进行子培养成更大的 75 厘米2 一次性细胞培养瓶。
- 达到80%的结合后,通过在37°C水浴中预热0.05%的trypsin/EDTA溶液进行尝试,在无菌条件下的亚培养细胞进行30分钟预热。在任何时候都不应该允许细胞干涸。
- 当细胞形成粘附的单层时,通过倒入消毒剂废锅来去除介质。然后立即清洗单层,用3mL的无菌1x PBS溶液在室温下冲洗两次烧瓶,去除现有介质的所有痕迹。此外,将PBS丢弃到消毒废物池中。
- 一旦 PBS 洗涤被移除,添加 5 mL 预热 0.05% trypsin-EDTA 溶液,确保覆盖整个细胞表面,并在 37 °C 和 5% CO2下孵化细胞 6-8 分钟。
- 轻轻敲击烧瓶,将细胞从烧瓶底部排出,然后加入 5 mL 的 DMEM 细胞培养介质(带补充剂)以中和 trypsin 酶。
- 将细胞悬架转移到 50 mL 离心管中,并彻底将细胞上下悬架移位,以确保细胞完全分离。
- 将稀释后的细胞悬浮在230 x g 下,在5分钟内进行离心。将超自然分子丢弃到消毒剂中,在 25mL 的 DMEM 细胞培养介质(带补充剂)中重新悬浮细胞颗粒。
- 将细胞悬浮物转移到 75 厘米2 的一次性细胞培养瓶中,在 37 °C 和 5% CO2 中孵育 3 天,然后再进行球形准备。一旦 HepG2 有时间适应并再次达到 +80% 的汇流,确定细胞浓度,为球形播种做准备。
2. HepG2 球形制备
- 重复上述子培养步骤,除离心后外,在 37 °C 水浴预热的 DMEM 培养介质中重新悬浮 1 mL 中的细胞颗粒。派珀特细胞完全上下悬架。
- 使用 Trypan 蓝色排除测定(参见 OSHA SOP 3.21 生殖毒素、突变、色氨基和胚胎毒素 - 安全处理和存储程序 (2019) 用于健康和安全指导)14 与 1:1 的细胞悬架与预过滤的 0.4% Trypan 蓝色解决方案的比例。
- 在细胞计数之前,使用 1 mL 注射器使用 1 mL 的 Trypan 蓝色溶液,并用 0.45μm 滤光单元进行过滤,放入无菌的 1 mL 管中。
- 将 10 μL 的过滤、Trypan 蓝色溶液转移到 0.2 mL 管中,并添加 10 μL 的细胞悬架。剩余的过滤尝试潘蓝色溶液可在室温下存储长达 3 个月,供将来使用。
- 用 70% 乙醇彻底喷洒血细胞仪,用无菌纸巾擦干,然后使用呼吸蒸汽固定顶部的盖片。将盖片滑过呼吸湿润的表面,通过产生牛顿环来产生凝聚力。
- 使用 1000 μL 移液器上下轻轻移液器,然后使用 10 μL 移液器上下悬挂,然后向血细胞计添加 10 μL。确保解决方案分散在盖滑下方,并覆盖整个网格,无气泡。
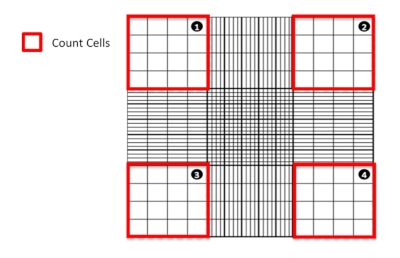
图1:使用血细胞仪计数细胞。血细胞计的图表表示,突出显示从哪个象限来计数细胞。请单击此处查看此图的较大版本。
- 在显微镜下,数一数在四个大角广场(图1)中发现的活细胞(未染色)和死(染色蓝色)细胞。排除任何被发现重叠或位于计数中大角正方形(即线条上的)内部两个边缘的单元格。
- 使用以下计算,计算样本中存在活的、可行细胞(未受污染的)的平均数:
细胞/mL 总数 = 活细胞计数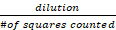 x x 10,000
x x 10,000
稀释是指在 Trypan 蓝色稀释库存溶液的次数(在这种情况下为 2 倍),而计算的正方形的 #是指计算血细胞计的四个大角正方形 - 基于可行的 HepG2 细胞计数并使用以下公式:
C1V1=C2V2
其中C1= 目前可行细胞的浓度,
V1= 当前细胞悬架的体积,
C2= 需要的细胞悬浮浓度,
V2= 需要的细胞悬架体积 - 准备一个10mL库存溶液的 HepG2 细胞悬架与 DMEM 细胞培养介质在浓度为 2.0 x 105 细胞/mL,以实现 4000 HepG2 细胞每 20 μL 悬垂下降。使用 1000 μL 移液器轻轻上下吹笛,将细胞悬架彻底混合,以确保所有细胞均完全悬浮在介质内。
- 在 96 井细胞培养板的井中,加入 100 μL 的无菌室温 PBS,以防止悬垂滴在孵化过程中干燥。
- 取一个标准平底96井细胞培养板的盖子,倒置它,并小心地将20μL滴的细胞悬浮液滴入盖子每个井槽的中心,如 图2所示。使用多通道移液器,但一次只添加 2 - 4 滴,因为多次播种会影响滴的精度和位置。
- 将水滴放在盖子上铺设的井槽内:否则,当板盖被翻过来并有可能掉到井中时,它们不会挂在井中央。轻轻翻转 96 井板的盖子,因此滴水现在悬挂并小心地放在 96 井板的顶部。
- 将整个 96 个带盖子的油井板轻轻放入孵化器中,在球形转移到 agarose 上之前 3 天,在 37 °C 和 5% CO2 中放入孵化器中。
注意:不仅在将板运送到/从孵化器中运输时,而且在打开和关闭孵化器时,必须格外小心,因为过度运动可能导致板体移动,球体要么掉落,要么形成错误。

图2:体外球形模型制备中的3D HepG2。 (A) 20 μL播种的 HepG2 细胞掉到 96 井板的盖子上。(B) HepG2 细胞在悬垂模型中播种后,允许球形形成。请单击此处查看此图的较大版本。
3. Hepg2 球形从悬垂到高糖悬架的转移
注:在第3天,球体被转移到同一96井板的井中,所有油井以前都涂有1.5%的蔗糖凝胶的细层。
- 在板涂层(即播种后的第 3 天)之前准备 agarose 凝胶和高压灭菌板(即第 2 天后播种)。
- 要准备1.5%的蔗糖凝胶,将0.30克的蔗糖放入一个干净的玻璃瓶中,然后加入20毫升无苯酚红色无DMEM介质。在230°C时将蔗糖高压1小时,进行灭菌。agarose 涂层可防止 HepG2 球体粘附在井底并形成蜂窝单层,而不是保留其 3D 球形结构。
- 在第 3 天播种后,将含有 HepG2 悬垂球体的 96 井板从孵化器中取出,并小心地翻转盖子,使球体不再悬挂。
- 使用多通道移液器,拆下并丢弃以前添加到 96 井板底部的 PBS 的 100 μL。让板子通风2-3分钟,同时加热糖,为涂层做准备。
注意:此过程会导致非常热的液体浮油,如果溅到皮肤上可能会灼伤并造成伤害。此外,在处理含有液体的玻璃瓶时,必须小心,因为这个瓶子也可能非常热。 - 使用先前制备的 1.5% 的蔗糖凝胶,在微波炉中将含有 20 mL agarose 凝胶的玻璃瓶加热 30s,最高功率(即 900 W)。涂上两个96井板,一瓶20mL的预制1.5%的蔗糖凝胶应该足够了。
- 熔化后,通过旋转玻璃瓶去除任何气泡,然后将50μL的糖水加入到每口井的底部,轻轻旋转浮子。
注意:添加糖体时,请确保不要将板倾斜 >45°,因为糖体设置得很快,不会形成可破坏球体生长的扁平水平层。在这个阶段,重要的是要有效地工作,以防止在板完全涂层之前凝固。 - 允许板在室温下站立2分钟,然后在每口井的固体高糖层顶部添加100μL预热DMEM细胞培养介质(带补充剂)。
- 翻转 96 井板的盖子,放回 96 井板的顶部,以便球形现在再次悬挂。
- 在 200 x g 下将板分离 3 分钟,以便将悬垂液滴中的球体转移到 96 井板的单独井中。转移后,HepG2球体现在应暂停在细胞培养介质中。允许他们在37°C和5%CO2的孵化器中定居24小时。
- 在第 4 天播种后(即转移到 agarose 涂层板后 24 小时)将这种大小的 HepG2 球体暴露在化学或 ENM 处理中。
- 为了在延长培养期内保持细胞生存能力,每3天刷新一次细胞培养介质。为此,请从井表面轻轻吸气 50 μL 的细胞培养介质,然后替换为新的 50 μL DMEM 细胞培养介质。执行中等变化时,注意不要去除或干扰球体。
4. 纳米材料/化学暴露
注:HepG2 肝球形模型可以支持 ENM 和基于化学的暴露机制,但此协议的主要焦点是 ENM 暴露。在暴露之前,测试 ENM 必须适当分散:这可以按照《纳米基因传播议定书》(第20092101号、2018年)第15号授权协议(第15号)执行。
- 根据 NanoGenoTox 分散协议进行分散后,将 ENM 悬架从 2.56 毫克/mL 的启动浓度稀释到预热 DMEM 细胞培养介质(包括补充剂)中所需的最终浓度。总共需要 5 mL 的体积才能给一个 96 井板剂量。
- 要将 HepG2 球体暴露在化学品或 ENM 中,使用 200 μL 移液器,从每口井表面吸气 50 μL 的细胞培养介质(在井中留下 50 μL,以免干扰球体),然后更换为 50 μL 介质,其中含有所需剂量的测试毒性剂。
- 测试材料应用后,在 37 °C 和 5% CO2的理想暴露时间孵育板。
- 如果进行长期(≥24 h)暴露制度,那么在所需的暴露时间框架过去后,立即收获球体进行微核端点分析,如下所述步骤6.1 - 6.4。
- 然而,使用急性暴露系统(例如,≤24 h),一旦暴露期结束,收获、池和储存50μL的超自然物质从每口井在96井板在-80°C为进一步生化分析以后。用含有6μg/mL细胞茶素B的50微L新鲜介质替换细胞培养介质,并留下孵育1~1.5个细胞周期(即24~26小时为 HepG2),为细胞因子阻断微核测定收获做准备。
注:对于急性(≤24 h)暴露系统,细胞因子块微核检测与细胞链霉素B可以应用,但对于长期(≥24 h)暴露制度,单核版本(无细胞链酶B)的检测必须使用如下图4。
5. HepG2 球形收获
注意:在进行化学或ENM暴露治疗后,可以采集细胞培养介质或球形组织进行多个端点分析。根据终点分析,球体可以单独采集(例如,用于图像分析)或汇集在一起(例如细胞因子阻塞微核检测)。
- 从孵化器中取出 96 井板。
- 使用 200 μL 移液器,吸气 100 μL 的细胞培养介质,包括每口井中的球形组织,并收集在无菌的 15 mL 离心管中。小心避免与阿加罗斯接触。
- 收集后,离心机在230 x g 下悬架5分钟。取出超自然体,储存在-80°C,以供以后进一步的端点分析(例如肝功能测试)。
- 将球体颗粒重新悬浮在 1 mL 的无菌、室温 PBS (1x)中。
- 洗净后,将球形悬架再次以 230 x g 进行 3 分钟。丢弃超自然,在 500 μL 中重新悬浮 0.05% trypsin-EDTA 溶液,在 37 °C 和 5% CO2中孵育 6-8 分钟。
- 孵化后,轻轻将试管状细胞上下移除,以完全分离并重新悬浮 HepG2 细胞,然后用 1 mL 的 DMEM 细胞培养介质中和。
- 将稀释后的细胞悬浮在230 x g 下,在5分钟内进行离心。将超纳特剂丢弃到消毒剂中,在室温 PBS (1x) 的 2mL 中重新悬浮细胞颗粒。
- 将细胞悬浮在230 x g 下5分钟。将超自然剂丢弃到消毒剂中,然后在 2 mL 的冷 PBS (1x) 中再次暂停细胞颗粒。确保细胞被很好地分散,以防止安装在显微镜幻灯片上的细胞团遮挡视野。
6. 微核测定和评分
对于微核检测的手工方法,需要细胞中心在显微镜幻灯片的中心产生细胞点(一个定义的、集中的细胞区域)。此过程支持更高效的幻灯片评分,因为它允许评分员轻松定位感兴趣的单元,而不是评估整个幻灯片,其中可以广泛分布单元。
- 浸磨砂显微镜滑动(每剂量三个)在70%乙醇,其次是ddH2O,并离开空气干燥5分钟。
- 将准备好的显微镜滑入 图 3A中显示的 cuvette 漏斗中,其中玻璃滑梯 (iii) 放置在金属支配(iv) 中,上面有滤芯卡 (ii) 和库维特漏斗 (i)。
- 将小管漏斗排列在细胞中心,漏斗朝上,因此可以直接将 100 μL 的细胞悬浮液添加到每个漏斗中。
- 在 500 x g 下进行 5 分钟的细胞平,以确保细胞均匀地分布在滑梯表面。

图3:细胞素设置,准备在显微镜幻灯片上处理细胞。 (A)显示单个组件,(i) cuvette漏斗,(ii) 滤光卡,(三) 玻璃显微镜幻灯片和(iv) 细胞平 HepG2 细胞到显微镜幻灯片所需的金属支撑。(B) 设置了最后的库维特漏斗。(C) 细胞中心内正确放置小管漏斗。请单击此处查看此图的较大版本。
- 在冰冷、90%甲醇固定10分钟之前,将滑梯留到空气干燥。
- 修复后,让滑梯在室温下通宵干燥,然后储存在 -20 °C 以至多 6 个月。
- 必要时,从 -20 °C 冰柜中取出预先准备好的显微镜滑梯,并允许在进行 Giemsa 染色之前加热至室温。
注意:根据第1272/2008号[CLP]第1272号条例(EC),Giemsa染色溶液是一种高度易燃的液体,如果吞咽并引起与眼睛、皮肤接触或吸入时损坏,可能会有毒。请参阅相关 SDS 表,以便在使用前详细存储、处理以及有关该化学品的健康和安全建议。 - 当幻灯片解冻时,准备一个 20% 的 Giemsa 染色溶液(25 mL 需要弄脏 ~30 幻灯片)在磷酸盐缓冲区稀释(pH 6.8)。使用放置在漏斗中的折叠滤纸进行过滤之前,通过轻轻旋转溶液进行彻底混合。
- 使用巴斯德移液器,在每个幻灯片上的细胞点中加入3-5滴过滤的Giemsa溶液,然后离开8-10分钟。
- 连续洗两次磷酸盐缓冲器清洗滑梯,然后在冷水下短暂冲洗,以去除剩余的任何多余的污渍。将幻灯片晾干。
- 干燥后,在烟罩中,将染色的滑梯浸入二甲苯中10s,然后将一滴安装介质添加到细胞点的中心,并在顶部放置玻璃盖片。
- 在人工评分前将显微镜滑梯留在烟罩中过夜晾干;它们可以在室温下无限期地储存。
7. 数据分析
- 如经合组织测试指南487(2014)11所述,为了评估和量化接触ENM或化学制剂所诱发的DNA损伤,使用光显微镜(100倍目标与浸入油)2000个单核细胞或1000个双核细胞每个生物复制,以得分显微核的存在,如图4所示。
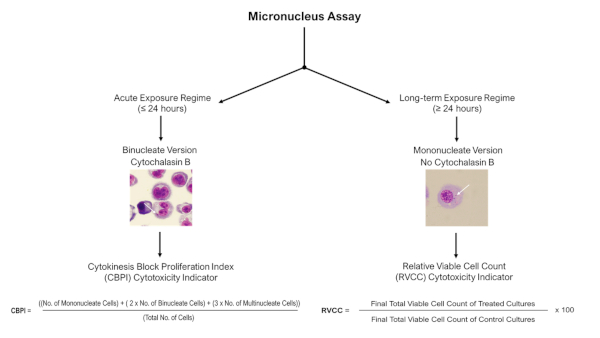
图4:微核测定评分决策树。在采用微核检测与遵循急性或长期暴露制度的 3D 模型时,使用示意图决策树,以突出不同评分和细胞毒性评估程序的必要性。急性(≤24 h)暴露允许使用细胞因子阻塞微核检测,而长期(≥24 h)暴露需要单核版本的检测:这两者都在经合组织测试指南487中描述。请单击此处查看此图的较大版本。
- 根据每数个单核细胞或双核细胞的微核存在比例,计算基因氧化值的百分比。
- 为了评估观测到的DNA损伤不是细胞碎片造成的高比例凋亡细胞,同时测量细胞毒性。在这种情况下,根据细胞链素 B 的存在,使用 CPBI 或 RVCC 计算(如 图 4所述)。基因毒性只能在 OECD 测试指南 48711定义的细胞毒性小于 55% ± 5% 的样本中进行评估。
结果
通过进行基线定性评估,确定该模型在14天培养期内的可行性和肝脏样功能,以及该模型在微核测定中的适用性,评估了该基于细胞系的3D肝球体模型是否适合长期培养和基因毒性危害评估。
3D HepG2 肝球形模型的基线特征
在进行体外毒理学评估之前,在进行胃部转移或化学/ENM处理之前,必须检查 3D HepG2 球体是否已正确形成。使用悬垂滴法产生的 HepG2 球体通常需要 2 - 3 天后播种 (4000 细胞/球形), 形成紧凑的球形球体, 平均直径为 495.52 μm W x 482.69 μm H,如 图 5A-5C所示。HepG2球体已经形成正确,是可以接受的用于体外毒理学评估必须有一个紧凑的,球形结构与光滑的表面,没有视觉投影。 图5 提供了质量好(图5D-F)和质量差(图5G-I)球体的例子。后者应予以丢弃。通常,每个板块形成的球体有90-95%会形成正确,并且可用于进一步实验。
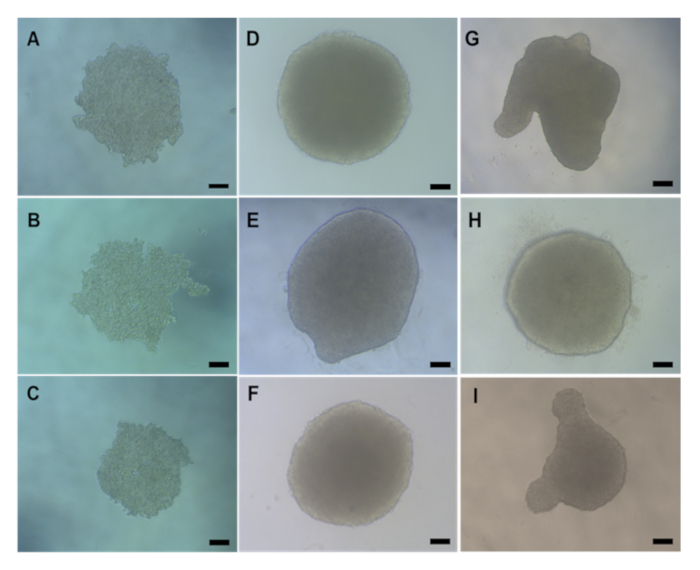
图5:光显微镜图像显示通过悬挂滴法形成的HepG2 球体的自然形态。(A -C) 显示第 2 天和(D - I) 第 4 天 Hepg2 肝球体后播种。(D-F) 是质量良好的 HepG2 球形的例子, 而 (G - I) 显示形成不良的球体.所有图像都是用显微镜在X20目标上拍摄的。比例栏表示 20μm。请单击此处查看此图的更大版本。
为了进一步确认 HepG2 球形的生存能力,可以执行基本的彩色溴化物绿色白蛋白 (BCG) 检测或尿素检测,以评估其肝脏样功能。肝脏样功能在14天的培养期内使用Trypan蓝色排除检测来评估其可行性,以确定肝球体模型的寿命,并确定它是否支持长期或重复的ENM/化学危害评估(图6)。在文化时期,白蛋白浓度保持不变。尿素生产显示尿素产生的浓度在一周内在培养中增加,然后在第7天到达高原。需要注意的是,3D HepG2 球体中产生的白蛋白和尿素水平大大高于以 2D 格式培养的同一细胞系中观察到的水平。事实上,HepG2细胞的2D培养物、峰值白蛋白和尿素水平分别为0.001毫克/mL和0.010 ng/μL。此外,在 Shah 等人之前发表的使用几乎相同的 HepG2 球体系统的作品中,作者强调了与 2D 培养的 HepG2 细胞5相比,3D HepG2 体外模型系统中的代谢活性 (CYP1A1 和 CYP1A2) 显著改善。
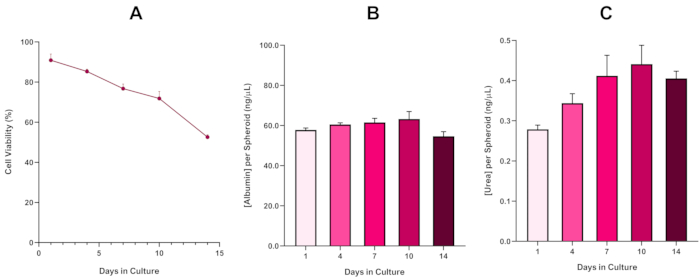
图6: 14天肝球体基线特征数据。从悬垂转移后,(A)突出了 HepG2 球形模型在 14 天内的可行性,而 (B)和 (C)分别突出了肝脏样白蛋白和尿素功能。显示的平均数据± SEM,n = 4。 请单击此处查看此图的较大版本。
随着坏死核心的必然发展,3D肝球形培养物的已知限制,这个基于 HepG2 模型的可行性必须建立,以证明它能够维持长期 (5-10 天) 暴露制度, 同时保持支持微核测定5所需的增殖能力。事实上,这种3D肝球形模型已被证明在10天的培养中保持>70%的生存能力。基于此,并结合在≥14天培养期内观察到的持续肝脏样功能,这种3D肝球形模型可以支持长达10天的长期重复ENM暴露机制(即球体的生存能力降至70%以下)。作为参考,建议在4000个细胞/球体中播种的 HepG2 球体的白蛋白水平应为 ≥20.0 ng/μL, 而尿素生产应≥0.25 ng/μL,然后再使用此模型进行体外毒理学评估。
工程纳米材料的基因毒性评估
对于基因毒性评估,使用微核检测来确定急性(24 h)和长期(120 h)ENM暴露后微核的存在。黄曲霉毒素B1是已知的肝致病原体16,17,是微核检测推荐的阳性控制。优化实验表明,0.1μM的阿尔法托辛B1在3D HepG2肝球体中诱导显著正(≥2.0倍)基因毒性反应,因此用于与此模型进行的每一次微核测定。为确保使用 HepG2 球形模型进行微核检测结果的有效性,此 3D 体外模型中使用的 HepG2 细胞的背景微核频率应在 0.6% - 1.2% 之间。因此,阿尔法托辛B1应诱发基因毒性反应至少比负控制时高2倍:因此,0.1μM的阿尔法托辛B1应诱导1.5%-3.0%之间的微核频率。使用这些控制参数,ENM 相关的体外基因氧化性可以可靠地评估。根据 OECD 测试指南 487,必须注意,在测试 ENM 或化学品时,所选浓度不应诱导超过 55% ± 5% 的细胞毒性(表明 CPBI 或 RVCC 值与负控制相关降低)11。图7说明了在 HepG2 球体中急性和长期暴露后评估黄曲霉毒素 B1 和两个 ENM(二氧化钛 (TiO2)和片状物 (Ag) 时生成的数据,并使用微核检测分析随后的基因氧化潜力。评估的两个 ENM 均在非细胞毒性低剂量 5.00μg/mL 的急性(24 h) 暴露和长期(120 h) 暴露制度下进行测试。在TiO2和Ag ENM中,可以观察到类似的基因毒性趋势,即在长期5天暴露后,24小时暴露后产生的基因毒性反应升高并不明显。尽管在两个时间点的黄曲霉毒素 B1 阳性控制导致持续的基因毒性。
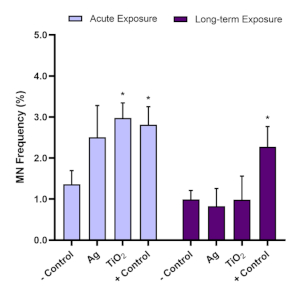
图7:在TiO2和Ag ENM接触肝2肝球体后,基因毒性评估。使用微核检测后(A)急性 (24 小时) 和(B)长期 (120 小时) 暴露在 TiO2和 Ag ENM 的 5.00 μg/mL 中,进行基因氧化(微核频率)评估。负控制仅是介质,而正控制为 0.1 μM 的黄曲霉毒素 B1。平均数据 (n=2) ± SD. 与负控制相关的意义表示: * = p≤ 0.05。请单击此处查看此图的较大版本。
讨论
3D肝模型的应用因特定的生化终点或目标的不良结果途径而有很大差异。每个模型都有其优点和局限性,从原始人类肝细胞 (PHH) 模型的捐赠者变异到基于细胞系模型的细胞色素 p450 活性降低,但所有这些模型本身都是有价值的 6、12、18、19。在评估基因毒性时,模型与监管批准的端点(如体外微核检测)相容性存在限制,因为需要活性增殖。这是必要的,因为基因毒性评估要求在DNA修复有机会纠正瞬态病变时,对固定DNA损伤的量化进行细胞分裂后进行评估。不幸的是,高度分化的肝细胞(即肝素)基球体或PHH微毒素,它们被认为是表现出最生理上相关的肝脏样特征形成静态(非扩散)模型12,19,20。因此,此处介绍的 3D HepG2 球形模型提供了一个合适的替代模型,能够支持基因毒性测试。HepG2细胞系球体在球体外表面有足够的主动分割细胞,同时保持基本的肝脏样特征,如白蛋白和尿素的产生和一些CYP450活性5,12,19。主要是这种体外肝脏模型已经开发,以补充微核检测,因为这是两个体外检测建议在电池中基因氧化测试8,10,11,21之一。然而,该模型可以很容易地应用于DNA测序分析和基因表达(RNA)技术,同时它有可能被进一步调整和用于其他DNA损伤终点,如彗星测定。尽管如此,重要的是要考虑ENM干扰在某些端点分析中的作用。例如,基于流细胞学的分析可能不适合ENM基因毒性评估,特别是由于粒子干扰22。
积极进行细胞分裂的球形模型的一个限制因素是它们的大小。优化播种密度至关重要,因为需要有足够的细胞,使模型继续增殖:但不是太高的细胞数,这导致球体变得过于紧凑,导致坏死核心增加。这种坏死的原因被认为是受限的氧气和营养扩散,因为这种扩散的极限被认为是大约100-150 μm的组织23,24。然而,这确实取决于细胞类型,细胞数量,脚手架相互作用和文化条件25。因为,已经表明,大约700μm直径是避免C3A球体中心过早坏死的极限,播种4000 HepG2细胞每个球体确保模型的直径在暴露时是≤500μm26。此外,Shah等人证实,在培养7天后,在球体外5000个细胞以上播种的 HepG2 细胞的存活率降低了 25%,这可能与平均直径为 680 μm 和 20 μL 悬垂下降5中营养物质的有限供应有关。为了克服这一点,本协议中设计的模型经历了一个关键步骤,即在球体初步形成后,悬垂滴被转移到高糖涂层井中。这确保了存在更多的培养介质,以维持球体中不断增长的细胞数量。因此,HepG2球形模型在培养10天后仍然超过70%的可行性,并可用于体外长期危险评估。
虽然 HepG2 球形模型可以支持急性和长期暴露机制,但该模型在延长培养期内刷新细胞培养介质受到限制,因为由于球体的潜在损失,不建议完全更换介质。据推测,在ENM暴露下,同质ENM分散到聚集体和沉积物的倾向很高。然而,值得注意的是,ENM沉积物的速率可能因粒子参数(如大小、形状和密度)而异,并且可以使用体外沉积、扩散和文量(ISDD)模型或其最近的衍生物(通常是指在 ENM(悬浮)暴露接近27、28时)从理论上确定。有鉴于此,假设只有50%的细胞培养介质被小心地从细胞培养表面移除,那么从理论上讲,ENM剂量的中断和随后的去除应该是最小的。然而,随着布朗的动议发挥作用,这可能并非严格的情况下,并进一步的工作,以沉积和沉积每个特定的ENM测试,以确保正确的剂型保留在整个长期暴露制度27。主要是,在执行重复的给精制度时,这是一个潜在的限制,因为这可能对最终的累积浓度至关重要。另一方面,基于化学的暴露,虽然不是没有自己的限制考虑,提供了一个更简单的方法,因为化学物质往往留在溶液中,因此直接取代原来的化学浓度,除了新增加的浓度,确保任何化学品在媒体茶点期间丢失的相应更换29。未来的应用将包括评估模型是否适合长期培养期间的重复接触制度,因为重复给药策略对于评估特定器官系统改善或克服由异种生物物质生物积累引起的不利影响(如果有的话)的能力至关重要。
总之,这种3D体外肝模型有能力用于评估一系列逼真的暴露方案,从而提供未来的体外方法,以常规和易于访问的方式更好地支持ENM和化学危害评估。
披露声明
作者没有什么可透露的。
致谢
作者希望承认,根据第760813号赠款协议,这项研究已获得欧洲联盟Horizno 2020研究和创新方案的资助,用于SARAS项目
材料
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
参考文献
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -. K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. . OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019)
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Erratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 1/26/2021. Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
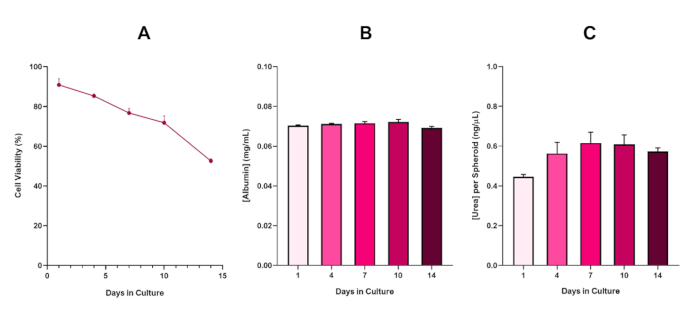
to:

The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。