Method Article
Uzun Süreli Nanomalzeme Maruziyetini Takiben İn vitro Genotoksisite Testi için Gelişmiş 3D Karaciğer Modelleri
Bu Makalede
Erratum Notice
Özet
Bu prosedür, hem akut hem de uzun süreli, tekrarlanan doz rejimleri üzerinde nanomalzeme maruziyetleri ile ilişkili genotoksik tehlikelerin fizyolojik olarak daha ilgili bir değerlendirmesini sağlayabilen ileri 3D hepatik kültürlerin in vitro geliştirilmesi için kullanılmak üzere kurulmuştur.
Özet
Çeşitli mühendislik nanomalzemelerinin (ENM) hızlı gelişimi ve uygulanması nedeniyle, ENM'ye maruz kalmak kaçınılmazdır ve sağlam, tahmine dayalı in vitro test sistemlerinin geliştirilmesi esastır. Karaciğer metabolik homeostaz ve detoksifikasyonda hayati bir rol oynamanın yanı sıra ENM birikimi sonrası maruziyetin önemli bir yeri olduğu için, HEPATIK toksikoloji ENM maruziyeti düşünüldüğünde anahtardır. Buna ve 2D hepatosit modellerinin karmaşıklıkları doğru bir şekilde taklit etmediğinin kabul edilen anlayışına dayanarak, in vivo olarak gözlenen karmaşık çok hücreli etkileşimlerin ve metabolik aktivitenin karmaşıklıklarını taklit etmemektedir, enm tehlike değerlendirme amaçları için uyarlanmış fizyolojik olarak ilgili 3D karaciğer modellerinin geliştirilmesine daha fazla odaklanılmıştır. Hayvan deneylerini değiştirmek, azaltmak ve iyileştirmek için 3R'lerin ilkeleri doğrultusunda, hem genişletilmiş hem de tekrarlanan ENM maruz kalma rejimlerini (≤14 gün) destekleyebilen kullanıcı dostu, uygun maliyetli bir sistem olan 3D HepG2 hücre hattı tabanlı bir karaciğer modeli geliştirilmiştir. Bu küresel modeller (çapı ≥500 μm) proliferatif kapasitelerini korur (yani hücre modellerini böler) genotoksisite in vitro'yu etkili bir şekilde değerlendirmek için 'altın standart' mikronükleus testi ile birleştirilmiş olmalarını sağlar. Bir dizi toksikolojik uç nokta (örneğin, karaciğer fonksiyonu, (pro-)inflamatuar yanıt, sitotoksiklik ve genotoksisite) hakkında rapor verme yetenekleri, hem akut (24 saat) hem de uzun süreli (120 h) maruz kalma rejimlerinde çeşitli ENM'ler kullanılarak karakterize edilmiştir. Bu 3D in vitro hepatik model, daha gerçekçi ENM maruziyetlerini değerlendirmek için kullanılacak kapasiteye sahiptir, böylece ENM tehlike değerlendirmesini rutin ve kolay erişilebilir bir şekilde daha iyi desteklemek için gelecekteki bir in vitro yaklaşım sağlar.
Giriş
İnsan tabanlı çok sayıda uygulama (örneğin, gıda, kozmetik, giyim, spor ekipmanları, elektronik, ulaşım ve tıp) genelinde çeşitli mühendislik nanomalzemelerin (ENM) hızlı gelişimi ve uygulanması nedeniyle, insanların düzenli olarak ENM'ye maruz kalmaları kaçınılmazdır. Bununla birlikte, bu malzemeleri çok sayıda uygulamada avantajlı gören yeni, boyuta özgü fizyoterapi-kimyasal özelliklerin insan sağlığı ve çevre üzerinde yan etkilere neden olabileceğine dair endişeler artmaktadır. Şu anda, bu ENM'lere fizyolojik olarak daha fazla maruziyeti aktif olarak yansıtmak ve bu malzemelerin akut, uzun süreli ve tekrarlanan düşük doz maruz kalma senaryoları üzerindeki potansiyel toksisitesini değerlendirmek için birçok uluslararası faaliyet uygulanmaktadır.
Karaciğerin MARUZ KALMA SONRASI ENM birikiminin önemli bir bölgesi olduğu yaygın olarak bilindiğinden, HEPATIK toksikoloji ENM maruziyeti göz önüne alındığında anahtardır1,2. Ayrıca, karaciğer sistemik dolaşıma giren maddelerin metabolizması ve detoksifikasyonu için birincil organ sistemidir3. 2D hepatosit modellerinin karmaşık çok hücreli etkileşimlerin karmaşıklıklarını doğru bir şekilde taklit etmediğini veya in vivo olarak gözlenen metabolik aktiviteyi uygun şekilde temsil etmediğini kabul eden anlayışa dayanarak, in vivo ikame teknolojileri için sağlam ve fizyolojik olarak ilgili in vitro 3D karaciğer modelleri geliştirmeye daha fazla odaklanılmıştır4,5. Gelişmiş 3D kültür teknolojilerinin kullanılması, uzun süreli, tekrarlanan maruz kalma rejimlerinin araştırılmasını sağlayan in vitro hepatik modellerin uzun ömürlülüğünü artırır. Ek olarak, bu gelişmiş kültür formatı, safra canaliculi, aktif taşıyıcı süreçleri ve geliştirilmiş CYP450 ilaç metabolizasyon yetenekleri gibi gelişmiş fizyolojik, organotipik özelliklerin oluşumunu teşvik eder, böylece modellerin öngörülebilirliğini artırır6. Mono-kültürlerden (sadece hepatositler) veya ortak kültürlerden (nonparenkimal hücreli hepatositler) oluşan mevcut 3D in vitro hepatik modeller çeşitli biçimlerde mevcuttur, ultra yüksek yapışma plakalarındaki mikrotissues veya sferoidlerden, asılı damla sferoidlere, matrislere ve / veya iskelelere gömülü hücrelere ve mikroakışkan hücre kültürü platformlarına kadar, hepsi hepatik toksisite değerlendirmesi için etkili gelişmiş in vitro modeller olarak kabul edilir6,7. Bununla birlikte, bu model sistemlerinin çoğu yüksek bakım gerektirir, özel ekipman gerektirir ve pahalıdır. Ayrıca, bu modeller genellikle sabit DNA hasarını ölçen yöntemleri kullanarak genotoksisite testi gibi tehlike uç noktalarının değerlendirilmesinde kullanılmasını önleyen statiktir (yani bölünmeyen hücre modelleri). Genotoksisite, düzenleyici toksikolojide temel bir ön koşuldur ve herhangi bir toksik edicinin risk değerlendirmesinin hayati bir bileşenidir8. Eksojen bir maddeye maruz kalmadan sonra ortaya çıkabilecek tüm DNA hasarı biçimlerini ölçmek için uygulanabilecek tek bir test yoktur. Bununla birlikte, in vitro genotoksisite test pilinin temel bir bileşeni, brüt kromozomal hasarı ölçen güvenilir ve çok yönlü bir teknik olan mikronükleus testidir9. OECD Test Kılavuzu 487 tarafından açıklanan, in vitro DNA hasarını ve genotoksisiteyi değerlendirmek için kullanılan altın standart bir tekniktir ve düzenleyici tehlike değerlendirmesi10,11için test pili gereksiniminin bir parçasıdır.
İnsan hepatosellüler karsinom hücre hattı, HepG2, hücreler kolayca kullanılabilir, kaynağa nispeten ucuz, kültüre basit ve yüksek verim taramasına uygun olduğu için ilk tehlike değerlendirmesi taraması için yaygın olarak kullanılır12,13. 3D küresel yapılara kültürlendiğinde, karaciğer mikroçevresini iyi bir şekilde yeniden özetledikleri ve mikronükleus testini desteklemek için yeterli proliferatif yeteneklere sahip hepatik bir model sundukları gösterilmiştir3. HepG2 küresel modellerinin daha da geliştirilmesi, uzun süreli, tekrarlanan maruz kalma rejimleri (≤14 gün) üzerinde genotoksisite tehlike değerlendirmesini desteklemek için modelin uzun ömürlülüğünü ve karaciğer benzeri işlevselliğini iyileştirmek için kurulmuştur. Böylece, 3R'lerin değiştirilmesi ilkeleri doğrultusunda, hayvan deneylerini azaltmak ve iyileştirmek için mevcut protokol, akut, uzun süreli ve tekrarlanan kimyasal ve ENM maruziyetlerini rutin ve kolay erişilebilir bir şekilde takip eden birden fazla toksikolojik uç noktayı (örneğin karaciğer işlevselliği, (pro)enflamatuar belirteçler, sitotoksiklik ve genotoksisite) güvenilir bir şekilde değerlendirebilen gelişmiş bir 3D in vitro hepatik model sağlamak için kurulmuştur.
Burada, akut veya uzun süreli, tekrarlanan ENM maruziyetlerini takiben genotoksisite tehlike değerlendirmesi için fizyolojik olarak ilgili 3D hepatosit hücre hattı tabanlı in vitro model sistemi kurmak için bir yöntem sunuyoruz. Protokol 6 temel aşamaya ayrılabilir: kriyoprezer korunmuş HepG2 hücrelerinin kült haline alınması; HepG2 küresel preparat; HepG2 sferoid asılı damladan agarose süspansiyona transfer; HepG2 küresel hasat; mikronükleus tahlil ve puanlama; ve veri analizi.
Protokol
1.Culturing kriyoprezihed HepG2 hücreleri
NOT: Amerikan Tip Kültür Koleksiyonu'ndan (ATCC) elde edilen HepG2 hücreleri, 1x Dulbecco'nun Modifiye Kartal Ortası'nda (DMEM) %10 foetal sığır serumu (FBS) ve %1 penisilin/streptomisin antibiyotik ile desteklenmiş 4.5g/L D-glikoz ve L-glutamin ile kültürlendi.
- 37 °C'lik su banyosunda 30 dakika boyunca önceden ısınan DMEM hücre kültürü ortamı (takviyeler dahil).
- Bir şişe HepG2 hücresini sıvı azottan çıkarın ve 37 °C'lik bir su banyosunda 2-3 dakika boyunca çözün, hücre süspansiyonunun düzgün bir şekilde çözülmesini sağlamak için şişeyi hafifçe döndürün. Kirlenme potansiyelini azaltmak için şişeyi O-halkasının üzerine batırmamaya dikkat edin.
- Çözdükten sonra, şişeyi su banyosundan çıkarın ve steril, Sınıf II laminer doku kültürü başlığının altına yerleştirmeden önce şişenin dış yüzeyini arındırmak için% 70 etanol ile cömertçe püskürtün.
- HepG2 hücrelerinin kriyovyal içeriğini, önceden ısıtılmış DMEM hücre kültürü ortamının 9 mL'sini içeren bir santrifüj tüpüne (takviyelerle) dikkatlice pipetlayın.
- 10 mL'lik bir striptiz kullanarak, hücre süspansiyonunun 10 mL'sini 25 cm2 tek kullanımlık hücre kültürü şişesine aktarın ve alt kültürden daha büyük bir 75cm 2 tek kullanımlık hücre kültürü şişesine geçmeden önce %5 CO2 ve 37 °C'de kültürü 3 gün boyunca (tohumlamadan) kuluçkaya yatırın.
- %80 izdiah sağlandıktan sonra, steril koşullar altında alt kültür hücreleri % 0.05 tripsin/EDTA çözeltisi ile steril koşullarda 37°C su banyosunda 30 dakika önceden ısıtılır. Hücrelerin kurumasına izin verilmemelidir.
- Hücreler yapışan bir monolayer oluştururken, bir dezenfektan atık kabına girerek ortamı çıkarın. Ardından, şişeyi oda sıcaklığında tutulan 3 mL steril 1x PBS çözeltisi ile iki kez durulayarak mevcut ortamın tüm izlerini gidermek için monolayer'ı hemen yıkayın. Ayrıca, PBS'yi dezenfektan atık kabına atın.
- PBS yıkama çıkarıldıktan sonra, 5 mL önceden ısıtılmış% 0.05 tripsin-EDTA çözeltisi ekleyin, hücrelerin tüm yüzeyini kaplamayı ve hücreleri 37 ° C'de 6-8 dakika kuluçkaya yatırmayı ve% 5 CO2.
- Hücreleri şişenin altından çıkarmak için şişeye hafifçe dokunun ve ardından tripsin enzimini nötralize etmek için 5 mL DMEM hücre kültürü ortamı (takviyelerle) ekleyin.
- Hücre süspansiyonu 50 mL santrifüj tüpüne aktarın ve hücrelerin tamamen ilişkisiz olduğundan emin olmak için hücre süspansiyonu iyice yukarı ve aşağı pipet.
- Seyreltilmiş hücre süspansiyonu 5 dakika boyunca 230 x g'da santrifüj edin. Süpernatantı dezenfektana atın ve 25mL DMEM hücre kültürü ortamında (takviyelerle) hücre peletini yeniden askıya alın.
- Hücre süspansiyonu 75 cm2 tek kullanımlık hücre kültürü şişesine aktarın ve küresel hazırlık geçirmeden önce 3 gün daha 37 °C ve% 5 CO2'de kuluçkaya yatırın. HepG2'lerin iklimlendirmek ve bir kez daha ~% 80 izdiah etmek için zamanı olduktan sonra, küresel tohumlama hazırlığındaki hücre konsantrasyonu belirlenir.
2. HepG2 küresel hazırlık
- Santrifüjlemeden sonra hariç, yukarıda belirtilen alt kültür adımlarını tekrarlayın, hücre peletini 37 °C'lik bir su banyosunda önceden ısıtılmış 1 mL DMEM kültür ortamında yeniden askıya alın. Pipet hücresi süspansiyonu iyice yukarı ve aşağı.
- Trypan Blue Exclusion Assay kullanarak hücre canlılığını puanlayın (bkz. OSHA SOP 3.21 Üreme Toksinleri, Mutajenler, Teratojenler ve Embriyotoksinler - Sağlık ve güvenlik rehberliği için Güvenli Kullanım ve Depolama Prosedürleri (2019)14 hücre süspansiyonunun önceden filtrelenmiş% 0.4 Trypan mavisi çözeltisine oranı 1:1 ile.
- Hücre sayımından önce, 1 mL şırınna kullanarak 1 mL Trypan mavi çözeltisi alın ve 0,45 μm filtre ünitesine sahip filtreyi steril, 1 mL tüpe alın.
- 10 μL filtreli, Trypan mavi çözeltisini 0,2 mL'lik bir tüpe aktarın ve 10 μL hücre süspansiyonu ekleyin. Kalan filtrelenmiş Trypan mavisi çözelti, ileride kullanılmak üzere oda sıcaklığında 3 aya kadar saklanabilir.
- Hemocytometreyi % 70 etanol ile iyice püskürtün ve nefes buharı kullanarak kapağı üste sabitlemeden önce steril bir kağıt havlu ile kurulayın. Kapak sapını nefes nemlendirilmiş yüzey boyunca kaydırarak Newton halkaları üreterek uyumlu kuvvetlere neden olur.
- Hemositometreye 10 μL eklemeden önce Trypan mavi hücre süspansiyonu 1000 μL pipet (saf stresi azaltmak için) kullanarak yukarı ve aşağı hafifçe pipetlayın. Çözeltinin kapak fişinin altına dağıldığından ve tüm ızgarayı hava kabarcıkları olmadan kapladığından emin olun.
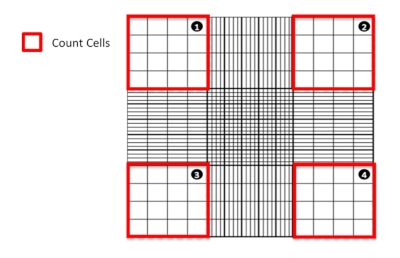
Şekil 1: Hemocytometre kullanarak hücreleri sayma. Hücrelerin hangi çeyrekten sayılmasını vurgulayan bir hemmostemometrenin diyagramsal gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Mikroskop altında, dört büyük köşe karesinde bulunan canlı (lekesiz) ve ölü (lekeli mavi) hücreleri sayın(Şekil 1). Sayımda büyük köşe karelerinin (yani çizgilerde) iki kenarının iç kısmına çakıştığından veya oturduğunda bulunan hücreleri hariç tutun.
- Aşağıdaki hesaplamayı kullanarak, örnekte bulunan ortalama canlı, uygulanabilir hücre sayısını (lekesiz) hesaplayın:
Toplam Hücre/mL Sayısı = Canlı Hücre Sayısı x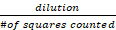 x 10.000
x 10.000
burada seyreltme, stok çözeltisinin Trypan mavisi (bu durumda 2x) ile kaç kez seyreltildiğine ve sayılan karelerin # sayılan hemotirometrenin dört büyük köşe karesine atıfta bulunduğunda - Uygulanabilir HepG2 hücre sayısına ve aşağıdaki formülü kullanmaya dayanır:
C1V1=C2V2
burada C1 = şu anda canlı hücrelerin konsantrasyonu,
V1 = şu anda hücre süspansiyonunun hacmi,
C2 = aranan hücre süspansiyonu konsantrasyonu,
V2 = aranan hücre süspansiyonunun hacmi - 20 μL asılı düşme başına 4000 HepG2 hücresi elde etmek için 2,0 x 105 hücre/mL konsantrasyonda DMEM hücre kültürü ortamına sahip HepG2 hücre süspansiyonunun 10 mL stok çözeltisini hazırlayın. Tüm hücrelerin ortam içinde tamamen askıya alınmasını sağlamak için 1000 μL pipet kullanarak hücre süspansiyonu hafifçe yukarı ve aşağı pipetle karıştırın.
- 96 kuyulu bir hücre kültür plakasının kuyularına, kuluçka sırasında asılı damlaların kurumasını önlemek için 100 μL steril, oda sıcaklığı PBS ekleyin.
- Standart bir düz alt 96 kuyu hücre kültür plakasının kapağını alın, ters çevirin ve Şekil2'de gösterildiği gibi hücre süspansiyonunun 20 μL damlalarını kapağın her kuyu oluğunun ortasına dikkatlice pipetlayın. Çok kanallı bir pipet kullanın, ancak birden fazla tohumlama damlaların doğruluğunu ve yerleşimini etkileyebileceğinden aynı anda sadece 2 - 4 damla ekleyin.
- Damlaları kapağın üzerine serilen kuyuların olukları içinde ortalayın; aksi takdirde, plakanın kapağı ters çevrildiğinde ve tabağa düşme riski altında olduğunda kuyuların ortasına asılmayacaklardır. 96 kuyu plakasının kapağını hafifçe çevirin, böylece damlalar şimdi asılıdır ve 96 kuyu plakasının üzerine dikkatlice yerleştirilir.
- Kapaklı 96 kuyu plakasının tamamını, agarose üzerine küresel transferden önce 3 gün boyunca 37 °C ve% 5 CO2'de bir inkübatöre hafifçe yerleştirin.
NOT: Sadece plakaları kuvözlere taşırken/inkübatörden taşırken değil, genel olarak kuvözü açarken ve kapatırken de ekstra özen göstermelisiniz, çünkü aşırı hareket plakaların kaymasına ve küresellerin düşmesine veya yanlış oluşmasına neden olabilir.

Şekil 2: 3D HepG2 in vitro sferoid model hazırlığı. (A) 20 μL'de tohumlanan HepG2 hücreleri 96 kuyu plakasının kapağına düşer. (B) Küresel oluşuma izin vermek için asılı damla modelinde hepg2 hücreleri tohumlama sonrası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. HepG2 sferoid asılı damladan agarose süspansiyona transfer
NOT: 3. günde, sarkan damlalara tohumlamadan sonra, küreseller aynı 96 kuyu plakasının kuyularına aktarılır ve bunların hepsi daha önce% 1,5 agarose jel ince bir tabaka ile kaplanmıştır.
- Plaka kaplama gününden önce agarose jelleri ve otoklav (yani, tohumlama sonrası 2. gün) hazırlayın (yani, tohumlama sonrası 3. gün).
- % 1,5 agarose jel hazırlamak için, temiz, cam bir şişeye 0,30 g agarose ağırlığında ve ardından 20 mL fenol-kırmızı içermeyen DMEM ortamı ekleyin. Agazozları sterilizasyon için 230 °C'de 1 saat boyunca otoklavlav. Agarose kaplama, HepG2 sferoidlerinin kuyuların tabanına yapışmasını ve 3D küresel yapılarını korumak yerine hücresel bir monolayer oluşturmasını önler.
- Tohumlamadan sonraki 3. günde, HepG2 asılı damla sferoidleri içeren 96 kuyu plakasını inkübatörden çıkarın ve sferoidlerin artık asılı kalmaması için kapağı dikkatlice çevirin.
- Çok kanallı bir pipet kullanarak, daha önce 96 kuyu plakasının tabanına eklenen 100 μL PBS'yi çıkarın ve atın. Kaplamaya hazırlık için agarose'u ısıtırken plakaların 2-3 dakika havalandırmasına izin verin.
DİkKAT: Bu prosedür, cilde dökülürse yanabilecek ve yaralanmaya neden olabilecek çok sıcak, sıvı agarose ile sonuçlanır. Ayrıca, sıvı agarose içeren cam şişeyi kullanırken dikkatli olunmalıdır, çünkü bu da çok sıcak olabilir. - Daha önce hazırlanan% 1,5 agarose jellerini kullanarak, 20 mL agarose jel içeren cam şişeyi mikrodalgada 30 sn maksimum watt 'ta (yani 900 W) ısıtın. İki adet 96 kuyu plakasını kaplamak için, önceden hazırlanmış bir 20 mL şişe% 1,5 agarose jel yeterli olmalıdır.
- Eridikten sonra, herhangi bir kabarcığı çıkarmak için cam şişeyi döndürerek agarose'yi hafifçe döndürün ve ardından her kuyunun tabanına 50 μL agarose ekleyin.
NOT: Agarose eklerken, agarose hızlı bir şekilde ayarlandığında plakayı >45° açılamadığınızdan ve küresel büyümeyi bozabilecek düz, seviyeli bir tabaka oluşturmayacağından emin olun. Plaka tamamen kaplanmadan önce agaroseun katılaşmasını önlemek için bu aşamada verimli bir şekilde çalışmak önemlidir. - Her kuyudaki katı agarose tabakasının üzerine 100 μL önceden ısıtılmış DMEM hücre kültürü ortamı (takviyelerle) eklemeden önce plakanın oda sıcaklığında 2 dakika bekletin.
- 96 kuyu plakasının kapağını çevirin ve 96 kuyu plakasının üzerine geri yerleştirin, böylece küreseller bir kez daha asılıdır.
- Sferoidleri asılı damlacıktan 96 kuyu plakasının bireysel kuyularına aktarmak için plakayı 200 x g'da 3 dakika santrifüj edin. Transferden sonra, HepG2 sferoidleri artık hücre kültürü ortamında askıya alınmalıdır. 37 °C ve% 5 CO 2'de inkübatörde24 saate yerleşmelerine izin verin.
- Bu büyüklükteki HepG2 sferoidlerini tohumlama sonrası 4. günde kimyasal veya ENM tedavilerine maruz bırakmak (yani, agarose kaplı plakalara transfer edildikten sonra 24 saat).
- Uzun kültür dönemlerinde hücre canlılığını korumak için hücre kültürü ortamını her 3 günde bir yenileyin. Bunu yapmak için, kuyunun yüzeyinden 50 μL hücre kültürü ortamını hafifçe epire edin ve taze 50 μL DMEM hücre kültürü ortamı ile değiştirin. Orta bir değişiklik yaparken küreseli çıkarmamaya veya rahatsız etmemeye dikkat edin.
4. Nanomalzeme/Kimyasal maruziyet
NOT: HepG2 karaciğer sferoid modeli hem ENM hem de kimyasal bazlı maruz kalma rejimlerini destekleyebilir, ancak bu protokolün birincil odağı ENM maruziyetleridir. Maruz kalmadan önce, test ENM'i uygun şekilde dağıtılmalıdır; Bu, NanoGenoTokx Dispersion Protokolü (20092101, 2018 Hibe Sözleşmesi)15tarafından yönetildiği şekilde gerçekleştirilebilir.
- NanoGenoToks Dispersiyon Protokolü'ne göre dağılımdan sonra, ENM süspansiyonunu 2,56 mg/mL'lik başlangıç konsantrasyonundan önceden ısıtılmış DMEM hücre kültürü ortamında (takviyeler dahil) son istenen konsantrasyona kadar seyreltin. Bir 96 kuyu plakasını dozlamak için toplam 5 mL hacim gereklidir.
- HepG2 sferoidini bir kimyasala veya ENM'ye maruz bırakmak için, 200 μL pipet kullanarak, her kuyunun yüzeyinden 50 μL hücre kültürü ortamını epire edin (küreselleri bozmamak için kuyuda 50 μL bırakarak) ve gerekli dozda test toksik maddesini içeren 50 μL ortamla değiştirin.
- Test malzemesi uygulandıktan sonra, plakaları 37 °C ve% 5 CO2'deistenen maruz kalma süresi için kuluçkaya yatırın.
- Uzun süreli (≥24 h) bir maruz kalma rejimi yapılırsa, istenen maruz kalma süresi geçtikten hemen sonra, 6.1 – 6.4 adımlarında aşağıda açıklandığı gibi mikronükleus uç nokta analizi için küreselleri hasat edin.
- Bununla birlikte, akut maruz kalma rejimleri (örneğin, ≤24 saat), maruz kalma süresi sona erdiğinde, hasat, havuz ve daha sonra daha fazla biyokimyasal analiz için -80 ° C'deki 96 kuyu plakasındaki her kuyudan 50 μL süpernatant depolayın. Hücre kültürü ortamını 6 μg/mL Cytochalasin B içeren 50 μL taze ortamla değiştirin ve sitokin blok mikronükleus tahlil hasadına hazırlık için 1 – 1,5 hücre döngüsü (yani HepG2 için 24 – 26 saat) kuluçkaya bırakın.
NOT: Akut (≤24 h) maruz kalma rejimleri için, Sitochalasin B ile sitokin blok mikronükleus tahlil uygulanabilir, ancak uzun süreli (≥24 saat) maruz kalma rejimleri için, tahlilin mononükleer versiyonu (Cytochalasin B olmadan) Şekil 4'teaçıklandığı gibi kullanılmalıdır.
5. HepG2 küresel hasat
NOT: Kimyasal veya ENM maruziyet tedavilerini takiben, çoklu uç nokta analizi için hem hücre kültürü ortamı hem de küresel doku toplanabilir. Uç nokta analizine bağlı olarak, küreseller ayrı ayrı (örneğin, görüntü analizi için) toplanabilir veya bir araya toplanabilir (örneğin, sitokinz blok mikronükleus tahlilleri için).
- 96 kuyu plakasını inkübatörden çıkarın.
- 200 μL pipet kullanarak, her kuyudan küresel doku da dahil olmak üzere 100 μL hücre kültürü ortamını aspire edin ve steril, 15 mL santrifüj tüpünde toplayın. Agarose ile temastan kaçınmaya özen edin.
- Toplandıktan sonra, küresel süspansiyonu 5 dakika boyunca 230 x g'da santrifüj edin. Daha sonra daha fazla uç nokta analizi (örneğin, karaciğer fonksiyon testleri) için süpernatant'ı çıkarın ve -80 °C'de saklayın.
- Küresellerin peletini 1 mL steril, oda sıcaklığı PBS 'de (1x) yeniden askıya alın.
- Yıkandıktan sonra, küresel süspansiyonu 3 dakika boyunca 230 x g'da tekrar santrifüj edin. Süpernatantı atın, % 0.05 tripsin-EDTA çözeltisinin 500 μL'sinde yeniden askıya alın ve 37 °C ve% 5 CO2'de6-8 dakika kuluçkaya yatırın.
- Kuluçkadan sonra, 1 mL DMEM hücre kültürü ortamı ile nötralize etmeden önce HepG2 hücrelerini tamamen ayırmak ve yeniden askıya almak için trypnized hücrelerini yavaşça yukarı ve aşağı borulayın.
- Seyreltilmiş hücre süspansiyonu 5 dakika boyunca 230 x g'da santrifüj edin. Süpernatantı dezenfektana atın ve hücre peletini 2mL oda sıcaklığı PBS'de (1x) yeniden askıya alın.
- Hücre süspansiyonu 5 dakika boyunca 230 x g'da santrifüj edin. Süpernatant dezenfektan içine atın ve sonra soğuk PBS (1x) 2 mL hücre pelet bir kez daha askıya alın. Mikroskop slaytlarına monte edildiğinde görüş alanını gizleyen hücre kümelerini önlemek için hücrelerin iyi dağıldığından emin olun.
6. Micronükleus tahlil ve puanlama
Mikronükleus testinin manuel yöntemi için, mikroskop slaytının ortasında bir sitot (hücrelerin tanımlanmış, konsantre bir bölgesi) üretmek için bir sitosantrifüj gereklidir. Bu işlem, skorerin, hücrelerin yaygın olarak yayılabileceği tüm slaydı değerlendirmenin aksine, ilgi çekici hücreleri kolayca bulmasını sağladığından slaytın daha verimli puanlamasını destekler.
- %70 etanolde buzlu mikroskop slaytlarını (doz başına üç) ddH2O ile batırın ve 5 dakika boyunca kurumaya bırakın.
- Hazırlanan mikroskop slaytlarını, cam kaydırağın (iii) metal desteğe (iv) filtre kartı (ii) ve cuvette hunisinin (i) üstüne sabitlenmiş olarak yerleştiği Şekil 3A'dagösterildiği gibi cuvette huninine yerleştirin.
- Cuvette huni hunisini yukarı bakacak şekilde sitosantrifüjde düzenleyin, böylece her birine doğrudan 100 μL hücre süspansiyonu eklenebilir.
- Hücrelerin slaytın yüzeyine eşit olarak dağıtılmasını sağlamak için 500 x g'da 5 dakika boyunca Sitospin.

Şekil 3: Mikroskop slaytlarında tedavi edilen hücreleri hazırlamak için Sitospin kurulumu. (A) Mikroskop slaytlarına cytospin HepG2 hücreleri için gereken tek tek bileşenleri, (i) cuvette hunisini, (ii) filtre kartını, (iii) cam mikroskop slaydını ve (iv) metal desteğini görüntüler. (B) Son cuvette hunisi kuruldu. (C) Cuvette hunisinin sitosantrifüj içinde doğru yerleştirilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Buz gibi, 10 dakika boyunca% 90 metanol sabitlemeden önce kaydıraları havaya kuru bırakın.
- Sabitlendikten sonra, 6 aya kadar -20 °C'de saklamadan önce slaytları oda sıcaklığında gece boyunca kurumaya bırakın.
- Gerektiğinde, önceden hazırlanmış mikroskop slaytlarını -20 °C dondurucudan çıkarın ve Giemsa boyama işleminden önce oda sıcaklığına ısınmaya bırakın.
DİkKAT: 1272/2008 sayılı Yönetmeliğe (EC) göre [CLP], Giemsa boyama çözeltisi yutulduğunda toksik olabilen ve göz, cilt veya solunan temasta hasara neden olabilen oldukça yanıcı bir sıvıdır. Kullanmadan önce bu kimyasal hakkında ayrıntılı depolama, taşıma ve sağlık ve güvenlik tavsiyeleri için ilgili SDS sayfasına bakın. - Slaytlar buzları çözülürken, fosfataz tamponunda (pH 6.8) seyreltilmiş % 20 Giemsa boyama çözeltisi (~30 slaytı boyamak için 25 mL) hazırlayın. Huni içine yerleştirilmiş katlanmış filtre kağıdı kullanarak filtrelemeden önce çözeltiyi hafifçe döndürerek iyice karıştırın.
- Pasteur pipet kullanarak, her slayttaki sitot içine 3 - 5 damla filtrelenmiş Giemsa çözeltisi ekleyin ve 8 - 10 dakika bekletin.
- Fazla leke artıklarını gidermek için soğuk su altında kısa bir süre durulamadan önce iki ardışık fosfataz tampon yıkamasında slaytları yıkayın. Slaytları kuru havaya bırakın.
- Kuruduktan sonra, dumanlı bir başlıkta, sitodotun ortasına bir damla montaj ortamı eklemeden önce 10 s boyunca ksilen lekeli slaytları daldırın ve üzerine bir cam kapak.
- Mikroskop slaytlarını, manuel puanlamadan önce kuruması için gece boyunca duman başlığında bırakın; oda sıcaklığında süresiz olarak saklanabilirler.
7. Veri analizi
- OECD Test Kılavuzları 487 (2014)11'de açıklandığı gibi, bir ENM veya kimyasal maddeye maruz kalma sonucu indüklenen DNA hasarını değerlendirmek ve ölçmek için, Şekil 4'tegösterildiği gibi mikronüklei varlığını puanlamak için biyolojik olarak 2000 mononükle edilmiş veya biyolojik olarak 1000 binüklelenmiş hücre (daldırma yağı ile 100x hedefi) hafif bir mikroskop kullanın.
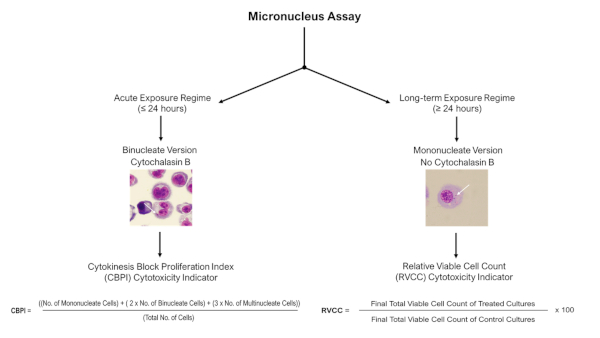
Şekil 4: Micronükleus tahlil puanlama karar ağacı. Akut veya uzun süreli maruz kalma rejimlerini takip eden 3D modellerle mikronükleus testini kullanırken farklı puanlama ve sitotoksiklik değerlendirme prosedürlerinin gerekliliğini vurgulamak için şematik karar ağacı. Akut (≤24 h) maruziyetler sitokin tıkalı mikronükleus tahlili kullanımına izin verirken, uzun süreli (≥24 h) maruziyetler tahlilin mononükleer versiyonunu gerektirir; her ikisi de OECD Test Kılavuzu 487'de açıklanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Puanlanan mononükleli veya binükleated hücre sayısı başına mevcut mikronüklei oranına bağlı olarak, genotoksisite değerinin bir yüzdesini hesaplayın.
- Gözlenen DNA hasarını değerlendirmek için, yüksek oranda apoptotik hücrenin neden olduğu hücre kalıntılarının bir sonucu değildir, yanında bir sitotoksiklik ölçüsü alın. Bu durumda, Cytochalasin B varlığına bağlı olarak, CPBI veya RVCC hesaplamasını kullanın (Şekil 4'teaçıklandığı gibi). Genotoksisite, OECD Test Kılavuzu 48711'detanımlandığı gibi sitotoksikliğin %55 ± %5'ten az olduğu örneklerde değerlendirilmelidir.
Sonuçlar
Bu hücre hattı bazlı 3D karaciğer sferoid modelinin uzun süreli kültür ve genotoksik tehlike değerlendirmesi için uygunluğu, modelin kültürde 14 gün boyunca uygulanabilirliğini ve mikronükleus testine uygulanabilirliğini belirlemek için temel karakterizasyon yapılarak değerlendirildi.
3D HepG2 Karaciğer Küresel Modelinin Temel Karakterizasyonu
Herhangi bir in vitro toksikolojik değerlendirmeden önce, agarose transferi veya kimyasal / ENM tedavisini gerçekleştirmeden önce 3D HepG2 sferoidlerinin düzgün bir şekilde oluşmuş olup olmadığını kontrol etmek önemlidir. Asılı bırakma yöntemi kullanılarak üretilen HepG2 küresellerinin, Şekil 5A-5C'degösterildiği gibi ortalama çapı 495,52 μm W x 482,69 μm H olan kompakt, küresel şekilli küresel sferoidler oluşturması genellikle tohumlama sonrası 2 - 3 gün sürer (4000 hücre/küresel). Doğru oluşmuş ve in vitro toksikolojik değerlendirmede kullanılması kabul edilebilir olan HepG2 sferoidleri, pürüzsüz bir yüzeye sahip ve görsel projeksiyonları olmayan kompakt, küresel şekilli bir yapıya sahip olmalıdır. Şekil 5, kaliteli (Şekil 5D-F) ve düşük kalite (Şekil 5G-I) sferoid örnekleri sağlar. İkincisi atılmalıdır. Tipik olarak, plaka başına oluşan küresellerin% 90-95'i doğru şekilde oluşacak ve daha fazla deney için uygun olacaktır.
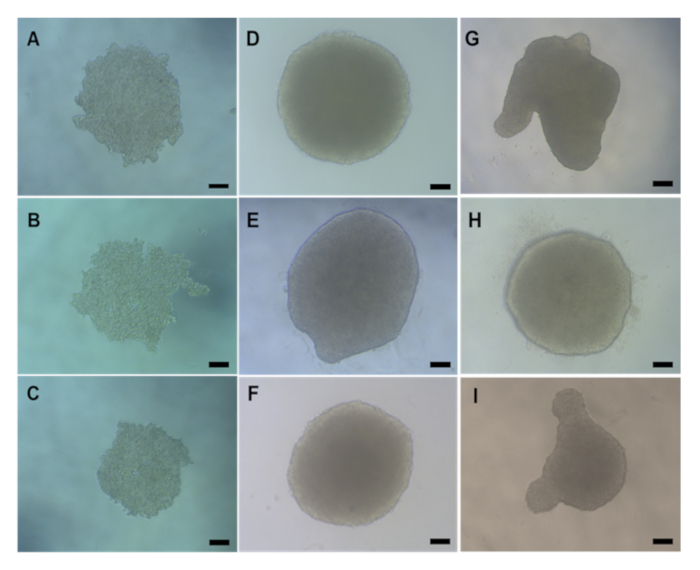
Şekil 5: Asılı bırakma yöntemi ile oluşturulan HepG2 sferoidlerinin doğal morfolojisini gösteren ışık mikroskopi görüntüleri. (A-C) gösteri Gün 2 ve (D-I) Gün 4 HepG2 karaciğer sferoidleri tohumlama sonrası. (D-F) kaliteli HepG2 küresellerine örnektir, (G-I) ise kötü biçimlendirilmiş küreseller gösterir. Tüm görüntüler mikroskop kullanılarak X20 hedefiyle çekildi. Ölçek çubuğu 20 μm'yi temsil eder.
HepG2 küresel canlılığını daha da doğrulamak için, karaciğer benzeri işlevlerini değerlendirmek için temel bir kolorimetrik Bromocresol Green Albumin (BCG) Tahlil veya Üre Tahlil yapılabilir. Karaciğer benzeri işlevsellik, karaciğer küresel modelinin uzun ömürlülüğünü belirlemek ve uzun süreli veya tekrarlanan ENM/ kimyasal bazlı tehlike değerlendirmesini destekleyip destekleyemeyeceğini belirlemek için 14 günlük bir kültür süresi boyunca Trypan Blue Exclusion Tahlil kullanılarak uygulanabilirlik doğrultusunda değerlendirildi (Şekil 6). Albümin konsantrasyonu kültür dönemi boyunca tutarlı kaldı. Üre üretimi, 7. 3D HepG2 sferoidlerde üretilen albümin ve üre seviyelerinin, 2D formatında kültürlenen aynı hücre hattında gözlemlenenden önemli ölçüde daha yüksek olduğunu belirtmek önemlidir. Nitekim HepG2 hücrelerinin 2D kültürleri, pik albümin ve üre düzeyleri sırasıyla 0.001 mg/mL ve 0.010 ng/μL olarak sıralandı. Ayrıca, Shah ve ark. tarafından neredeyse aynı hepg2 sferoid sistemi kullanılarak yayınlanan önceki çalışmalarında, yazarlar 2D kültürlü HepG2 hücrelerine kıyasla 3D HepG2 in vitro model sistemlerinde metabolik aktivitede (CYP1A1 ve CYP1A2) önemli bir iyileşme olduğunu vurgulamaktadır5.
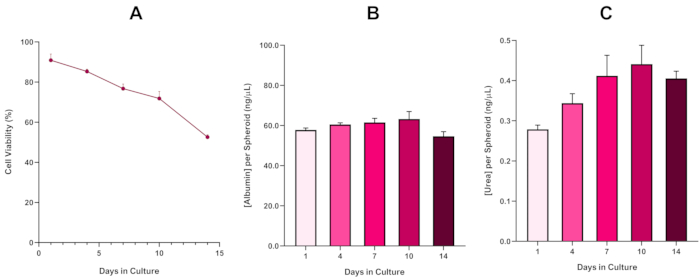
Şekil 6: HepG2 karaciğer sferoidleri için 14 Günlük temel karakterizasyon verileri. Asılı düşüşten transfer edildiktan sonra, (A) HepG2 küresel modelinin 14 günlük bir süre boyunca uygulanabilirliğini vurgularken, (B) ve (C) sırasıyla karaciğer benzeri albümin ve üre işlevselliğini vurgular. SEM'± sunulan ortalama veriler, n = 4. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Nekrotik bir çekirdeğin kaçınılmaz gelişimi, 3D karaciğer sferoid kültürlerinin bilinen bir sınırlaması ile, mikronükleus testini desteklemek için gereken proliferatif yeteneği korurken uzun süreli (5-10 gün) maruz kalma rejimlerini sürdürebildiğini göstermek için bu HepG2 tabanlı modelin uygulanabilirliği oluşturulmalıdır5. Gerçekten de, bu 3D karaciğer sferoid modelinin kültürde 10 gün boyunca %70 canlılığı koruduğu gösterilmiştir. Buna dayanarak ve ≥14 günlük kültür döneminde gözlenen sürekli karaciğer benzeri işlevsellikle birlikte, bu 3D karaciğer küresel modeli böylece 10 güne kadar uzun süreli, tekrarlanan ENM maruz kalma rejimlerini destekleyebilir (yani, küresellerin yaşayabilirliği% 70'in altına düşmeden önce). Referans olarak, 4000 hücrede/sferoidde tohumlanan HepG2 sferoidleri için albümin seviyelerinin 20,0 ng/μL ≥ olması, üre üretiminin ise bu modelle in vitro toksikolojik değerlendirme yapmadan önce 0,25 ng/μL ≥ olması önerilir.
Mühendislik Nanomalzemelerinin Genotoksisite Değerlendirmesi
Genotoksisite değerlendirmesi için mikronükleus tahlili hem akut (24 saat) hem de uzun süreli (120 h) ENM maruziyetlerini takiben mikronüklei varlığını belirlemek için kullanıldı. Aflatoksin B1 bilinen bir karaciğer kanserojenidir16,17 ve mikronükleus tahlil için önerilen bir pozitif kontroldür. Optimizasyon deneyleri, 0.1 μM Alfatoksin B1'in 3D HepG2 karaciğer sferoidlerinde önemli bir pozitif (≥2.0 kat artış) genotoksik yanıt verdiğini ve bu nedenle bu modelle yapılan her mikronükleus testinde kullanıldığını göstermiştir. HepG2 küresel modeli kullanılarak yapılan mikronükleus test sonuçlarının geçerliliğini sağlamak için, bu 3D in vitro modelde kullanılan HepG2 hücreleri için arka plan mikronükleus frekansı% 0.6 –% 1.2 aralığında olmalıdır. Sonuç olarak, Alfatoksin B1, negatif kontrolde görülenden en az iki kat daha yüksek bir genotoksik yanıt vermelidir; böylece, 0.1 μM Alfatoksin B1% 1.5 -% 3.0 arasında bir mikronüklei frekansı indüklemelidir. Bu kontrol parametreleri kullanılarak, ENM ilişkili genotoksisite in vitro daha sonra güvenilir bir şekilde değerlendirilebilir. OECD Test Kılavuzu 487'ye dayanarak, bir ENM veya kimyasalı test ederken, seçilen konsantrasyonların% 55'ten fazla ±% 5 sitotoksisiteye neden olmaması gerektiğini belirtmek önemlidir (negatif kontrol ile ilgili olarak CPBI veya RVCC değerlerinde bir azalma ile gösterilir)11. Şekil 7, Aflatoksin B1 ve iki ENM (titanyum dioksit (TiO2)ve dilimleme (Ag)) HepG2 sferoidlerinde hem akut hem de uzun süreli maruziyetleri takiben değerlendirildiğinde ve daha sonra genotoksik potansiyel mikronükleus tahlili kullanılarak analiz edildiğinde elde edilen verileri göstermektedir. Değerlendirilen her iki ENM de akut (24 saat) maruz kalma ve uzun süreli (120 h) maruz kalma rejimi üzerinden noncytotoxic, düşük dozda 5.00 μg/mL'de test edildi. Hem TiO2 hem de Ag ENM'lerde genotoksisite için benzer bir eğilim gözlenebilir, böylece 24 saat maruz kalmanın ardından ortaya çıkan yüksek genotoksisite yanıtı uzun süreli 5 günlük maruziyet sonrasında belirgin değildi. Bu, her iki zaman noktasında aflatoksin B1 pozitif kontrolünün neden olduğu sürekli genotoksisiteye rağmen oldu.
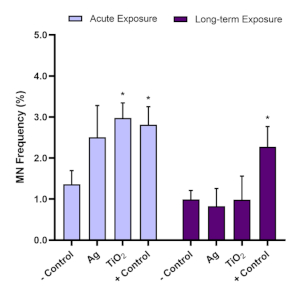
Şekil 7: TiO2 ve Ag ENM maruziyetini takiben Genotoksisite değerlendirmesi HepG2 karaciğer sferoidleriüzerinde. TiO2 ve Ag ENM'nin 5.00 μg/mL'sine uzun süreli (120 saat) maruziyette mikronükleus tahlil direği (A) akut (24 saat) ve(B) kullanılarak genotoksisite (mikronükleus sıklığı) değerlendirmesi. Negatif kontrol sadece bir ortamdır, pozitif kontrol ise 0.1 μM Aflatoksin B1'dir. SD. Negatif kontrolle ilgili olarak belirtilen anlam ± sunulan ortalama veriler (n=2) : * = s≤ 0,05. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
3D hepatik modeller için uygulamalar, hedeflenen belirli biyokimyasal uç noktaya veya olumsuz sonuç yoluna bağlı olarak önemli ölçüde değişir. Her modelin, birincil insan hepatosit (PHH) modellerindeki interdonor varyasyondan hücre hattı tabanlı modellerde azaltılmış sitokrom p450 aktivitesine kadar yararları ve sınırlamaları vardır, ancak hepsi kendi başına değerlidir6,12,18,19. Genotoksisiteyi değerlendirirken, aktif çoğalma gerektiğinden, in vitro mikronükleus testi gibi düzenleyici onaylı uç noktalarla uyumluluk modellerinde sınırlamalar vardır. Genotoksisite değerlendirmesi, DNA onarımının geçici lezyonları düzeltmesi için fırsat olduğunda sabit DNA hasarının hücre sonrası bölünmesinin ölçülmesini gerektirdiğinden, bu gereklidir. Ne yazık ki, son derece farklılaştırılmış hepatosit (yani, HepaRG) bazlı küreseller veya PHH mikrotizeleri, en fizyolojik olarak ilgili karaciğer benzeri özellikleri sergilediği düşünülen statik (proliferatif olmayan) modelleroluşturur 12,19,20. Sonuç olarak, burada sunulan 3D HepG2 küresel model, genotoksisite testini destekleyebilecek uygun, alternatif bir model sağlar. HepG2 hücre hattı bazlı küreseller, albümin ve üre üretimi ve bazı CYP450 aktivitesi5,12,19gibi temel karaciğer benzeri özellikleri korurken, küresellerin dış yüzeyinde yeterince aktif olarak bölünen hücrelere sahiptir. Esas olarak bu in vitro karaciğer modeli mikronükleus testini tamamlamak için geliştirilmiştir, çünkü bu genotoksisite testi için pilde önerilen iki in vitro testlerden biridir8,10,11,21. Bununla birlikte, model DNA dizileme analizi ve gen ekspresyon (RNA) teknolojilerine kolayca uygulanabilirken, kuyruklu yıldız testi gibi diğer DNA hasar uç noktaları için daha fazla uyarlanıp kullanılma potansiyeline sahiptir. Bununla birlikte, ENM parazitinin bazı uç nokta analizlerinde oynadığı rolü göz önünde bulundurmak önemlidir. Örneğin, akış sitometrisi bazlı analizler özellikle partikül paraziti nedeniyle ENM genotoksisite değerlendirmesi için uygun olmayabilir22.
Aktif olarak hücre bölünmesi geçiren küresel modellerin sınırlayıcı faktörlerinden biri boyutlarıdır. Modelin çoğalmaya devam etmesine izin veren yeterli hücre olması gerektiğinden, tohumlama yoğunluğunun optimizasyonu kritik öneme sahiptir; ancak çok yüksek olmayan bir hücre sayısı, bu da küreselin aşırı kompakt hale gelmesine neden olur ve nekrotik çekirdeğin artmasına neden olur. Bu nekrozun nedeninin sınırlı oksijen ve besin difüzyonu olduğuna inanılmaktadır, çünkü bu difüzyonun sınırının yaklaşık 100 – 150 μm doku23,24olduğu düşünülmektedir. Ancak, bu hücre türüne, hücre numarasına, iskele etkileşimlerine ve kültür koşullarına bağlıdır25. O zamandan beri, yaklaşık 700 μm çapının C3A sferoidlerin merkezinde nekrozun erken başlamasını önlemek için sınır olduğu gösterilmiştir, küresel başına 4000 HepG2 hücresinin tohumlaması, maruz kalma sırasında modelin çapının ≤500 μm26olmasını sağlar. Ayrıca, Shah ve arkadaşları, küresel başına 5000 hücrenin üzerinde tohumlanan HepG2 hücrelerinin, kültürde 7 gün sonra canlılıkta% 25'lik bir azalma sergilediğini ve bunun ortalama 680 μm çapına ve 20 μL asılı damla5'tebesinlerin sınırlı mevcudiyetine bağlı olabileceğini tespit etti. Bunun üstesinden gelmek için, mevcut protokolde tasarlanan model, asılan damlanın küreselin ilk oluşumunu takiben agarose kaplı kuyulara aktarıldığı kritik bir adımdan geçer. Bu, küreseller içinde sürekli artan hücre sayısını sürdürmek için daha fazla kültür ortamının mevcut olmasını sağlar. Sonuç olarak, HepG2 küresel modeli kültürde 10 gün sonra% 70'in üzerinde uygulanabilir kalır ve uzun süreli tehlike değerlendirmesi in vitro içinkullanılabilir.
HepG2 küresel modeli hem akut hem de uzun süreli maruz kalma rejimlerini destekleyebilirken, uzun kültür dönemlerinde hücre kültürü ortamının yenilenmesi, sferoidlerin potansiyel kaybı nedeniyle ortamın tamamen değiştirilmesi tavsiye edildiği için bu model için kısıtlanır. ENM maruziyetlerinde, homojen ENM dağılımlarının aglomera ve tortuya eğiliminin yüksek olduğu varsayılmaktadır. Bununla birlikte, bir ENM çökeltilerinin parçacık parametrelerine (örneğin, boyut, şekil ve yoğunluk) bağlı olarak değişebileceği ve entrika sedimansasyonu, difüzyon ve dozimetri (ISDD) modeli veya enm (süspansiyon) maruziyeti ile ilgili olarak sıklıkla atıfta bulunulan son türevleri kullanılarak teorik olarak belirlenebileceği dikkat çekicidir27,28. Bu akılla, hücre kültürü ortamının sadece% 50'sinin hücre kültürünün yüzeyinden dikkatlice çıkarılması durumunda, ENM dozunun bozulması ve daha sonra çıkarılmasının teoride minimum olması gerektiği varsayılıyor. Bununla birlikte, Brownian hareketi söz konusu olduğunda, bu kesinlikle böyle olmayabilir ve test edilecek her bir ENM'nin birikmesi ve tortulması için daha fazla çalışma yapılmalıdır, doğru dozimetrinin uzun süreli maruz kalma rejimleri boyunca korunmasını sağlamak için27. Esas olarak bu, tekrarlanan dosing rejimlerini gerçekleştirirken göz önünde bulundurulacak potansiyel bir sınırlamadır, çünkü bu son, birikmiş konsantrasyon için kritik olabilir. Öte yandan, kimyasal bazlı maruziyetler, dikkate alınması gereken kendi sınırlamaları olmadan olmasa da, kimyasal maddelerin çözeltide kalma eğiliminde olduğu konusunda daha basit bir yaklaşım sunar ve böylece yeni eklenen konsantrasyona ek olarak orijinal kimyasal konsantrasyonun doğrudan değiştirilmesi, medya tazeleme sırasında kaybolan herhangi bir kimyasalın buna göre değiştirilmesini sağlar29. Gelecekteki uygulamalar, modelin uzun süreli kültür dönemlerinde tekrarlanan maruz kalma rejimlerine uygunluğunu değerlendirmeyi içerecektir, çünkü tekrarlanan dosing stratejileri, belirli bir organ sisteminin ksenobiyotik bir maddenin biyoakümülasyonundan kaynaklanan olumsuz etkileri iyileştirme veya üstesinden gelme yeteneğini değerlendirmek için çok önemlidir.
Sonuç olarak, bu 3D in vitro hepatik model, bir dizi gerçekçi maruz kalma senaryosunu değerlendirmek için kullanılacak kapasiteye sahiptir, böylece hem ENM'yi hem de kimyasal tehlike değerlendirmesini rutin ve kolay erişilebilir bir şekilde daha iyi desteklemek için gelecekteki bir in vitro yaklaşım sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, bu araştırmanın 760813 sayılı hibe anlaşması kapsamında AVRUPA Birliği'nin PATROLS projesi için Horizon 2020 araştırma ve yenilik programından fon aldığını kabul etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
Referanslar
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -. K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. . OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019)
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Erratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 1/26/2021. Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
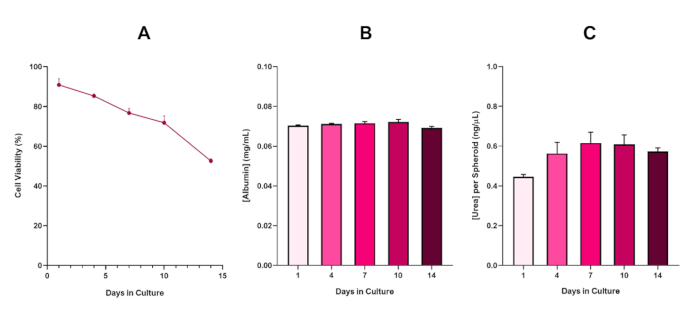
to:

The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır