Method Article
דגמי כבד תלת-ממדיים מתקדמים לבדיקות גנוטוקסיות במבחנה בעקבות חשיפה ננו-חומרית לטווח ארוך
In This Article
Erratum Notice
Summary
הליך זה הוקם כדי לשמש לפיתוח תרבויות חזה 3D מתקדמות במבחנה, אשר יכול לספק הערכה רלוונטית יותר מבחינה פיזיולוגית של הסיכונים genotoxic הקשורים חשיפות ננו חומריים על פני משטרי מינון חריפה או ארוכת טווח, חוזרים ונשנים.
Abstract
בשל ההתפתחות המהירה והיישום של מגוון רחב של ננו-חומרים מהונדסים (ENM), חשיפה ל- ENM היא בלתי נמנעת ופיתוח מערכות בדיקה במבחנה חזקות וחיזוי הוא חיוני. טוקסיקולוגיה בכבד היא המפתח כאשר בוחנים חשיפה ENM, כמו הכבד משמש תפקיד חיוני הומאוסטזיס מטבולית דטוקסיפיקציה, כמו גם להיות אתר מרכזי של הצטברות ENM לאחר חשיפה. בהתבסס על זה ועל ההבנה המקובלת כי מודלים hepatocyte 2D אינם מחקים במדויק את המורכבות של אינטראקציות רב תאיות מורכבות ופעילות מטבולית שנצפו vivo, יש דגש גדול יותר על התפתחות של מודלים כבד 3D רלוונטיים מבחינה פיזיולוגית המותאמים למטרות הערכת סיכון ENM במבחנה. בהתאם לעקרונות של 3Rs להחליף, להפחית ולמקד ניסויים בבעלי חיים, מודל כבד מבוסס קו התא 3D HepG2 פותחה, שהיא ידידותית למשתמש, מערכת חסכונית שיכולה לתמוך הן משטרי חשיפה ENM מורחבים וחוזרים על עצמם (≤14 ימים). מודלים ספירואידיים אלה (קוטר ≥500 מיקרומטר) שומרים על יכולתם המשגשגת (כלומר, חלוקת מודלים של תאים) המאפשרת להם להיות משולבים עם בדיקת מיקרונוקלאוס 'תקן זהב' כדי להעריך ביעילות את הגנוטוקסיות במבחנה. היכולת שלהם לדווח על מגוון של נקודות קצה טוקסיקולוגיות (למשל, תפקודי כבד, (פרו)תגובה דלקתית, cytotoxicity ו genotoxicity) התאפיינה באמצעות מספר ENMs על פני שני אקוטי (24 שעות) ו לטווח ארוך (120 h) משטרי חשיפה. מודל זה 3D במבחנה הכבד יש את היכולת להיות מנוצל להערכת חשיפות ENM מציאותי יותר, ובכך לספק גישה במבחנה בעתיד כדי לתמוך טוב יותר הערכת סכנה ENM באופן שגרתי ונגיש בקלות.
Introduction
בשל ההתפתחות המהירה והיישום של מגוון רחב של ננו-חומרים מהונדסים (ENM) על פני שפע של יישומים מבוססי אדם (למשל, מזון, קוסמטיקה, ביגוד, ציוד ספורט, אלקטרוניקה, תחבורה ורפואה), זה בלתי נמנע כי בני אדם ייחשפו ENM על בסיס קבוע. עם זאת, ישנם חששות מוגברים כי הרומן, גודל ספציפי פיזיותרפיה מאפיינים כימיים המ סבורים חומרים אלה יתרון ביישומים רבים עלול לגרום להשפעות שליליות על בריאות האדם ועל הסביבה בו זמנית. כיום פעילויות בינלאומיות רבות נמצאות במקום כדי לשקף באופן פעיל חשיפות רלוונטיות יותר מבחינה פיזיולוגית ENM אלה ולהעריך את הרעילות הפוטנציאלית של חומרים אלה על פני תרחישי חשיפה חריפים, ארוכי טווח, חוזרים ונשנים במינון נמוך.
טוקסיקולוגיה בכבד היא המפתח כאשר בוחנים חשיפה ENM, כפי שהוא ידוע כי הכבד הוא אתר מרכזי של הצטברות ENM לאחר חשיפה1,2. יתר על כן, הכבד הוא מערכת האיברים העיקרית לחילוף חומרים וניקוי רעלים של חומרים הנכנסים למחזור המערכתי3. בהתבסס על ההבנה המקובלת כי מודלים 2D hepatocyte אינם מחקים במדויק את המורכבות של אינטראקציות רב תאיות מורכבות או מייצגים כראוי פעילות מטבולית שנצפתה vivo, התמקדות גדולה יותר לפתח חזק רלוונטי מבחינה פיזיולוגית במבחנה 3D מודלים הכבד עבור טכנולוגיות תחליף in vivo הוקמה4,5. שימוש בטכנולוגיות תרבות תלת-ממדיות מתקדמות משפר את תוחלת החיים של דגמי הכבד במבחנה ומאפשר לחקור משטרי חשיפה ארוכי טווח וחוזרים ונשנים. בנוסף, פורמט תרבות מתקדם זה מקדם היווצרות של תכונות פיזיולוגיות משופרת, organotypic כגון canaliculi מרה, תהליכי טרנספורטר פעיל ויכולות חילוף חומרים תרופתיות משופרות CYP450, ובכך לשפר את החיזוי של הדגמים6. מודלים נוכחיים של 3D במבחנה בכבד המורכבים מתרבויות מונו (hepatocytes בלבד) או תרבויות משותפות (hepatocytes עם תאים שאינם פרנצ'יליים) קיימים במספר פורמטים, החל microtissues או spheroids בלוחות הידבקות אולטרה, ספירואידים טיפה תלויים, תאים מוטבע מטריצות ו / או פיגומים פלטפורמות תרבות תאים מיקרופלואידיים, כולם נחשבים יעילים מתקדם במבחנה מודלים להערכת רעילות בכבד6,7. עם זאת, רוב מערכות מודל אלה הן תחזוקה גבוהה, דורשים ציוד מיוחד והם יקרים. יתר על כן, מודלים אלה הם לעתים קרובות סטטיים (כלומר, מודלים תאים שאינם מחולקים) המונע את השימוש בהם להערכת נקודות קצה סיכון, כגון בדיקות genotoxicity ניצול שיטות לכמת נזק DNA קבוע. Genotoxicity הוא תנאי מוקדם ליבה בטוקסיקולוגיה רגולטורית, וזה מרכיב חיוני של הערכת הסיכון של כל רעיל8. אין מבחנים בודדים שניתן ליישם כדי לכמת את כל צורות הנזק לדנ"א שעלולות להתעורר בעקבות חשיפה לסוכן אקסוגני. עם זאת, מרכיב הליבה של הסוללה בדיקות genotoxicity במבחנה הוא הבדיקה micronucleus, שהיא טכניקה אמינה ורבת פנים המודדת נזק כרומוזומלי ברוטו9. זוהי טכניקה סטנדרטית זהב המתוארת על ידי ה-OECD מבחן קו מנחה 487, להערכת נזק DNA במבחנה genotoxicity והוא חלק הדרישה סוללת הבדיקה להערכת סיכון רגולטורי10,11.
קו התא קרצינומה hepatocellular האנושי, HepG2, נמצא בשימוש נרחב עבור הקרנת הערכת סכנה ראשונית כמו התאים זמינים, זול יחסית למקור, פשוט לתרבות נוח להקרנת תפוקה גבוהה12,13. כאשר מתורבתים לתוך מבנים כדוריים 3D, הם הוכחו recapitulate את הכבד microenvironment היטב ולהציע מודל כבד עם יכולות שגשוג מספיק כדי לתמוך micronucleus assay3. פיתוח נוסף של מודלים כדוריים HepG2 הוקמה כדי לשפר את תוחלת החיים ואת הפונקציונליות דמוית הכבד של המודל על מנת לתמוך הערכת סכנת genotoxicity על פני משטרי חשיפה ארוכי טווח, חוזרים ונשנים (≤14 ימים). לכן, בהתאם לעקרונות של 3Rs להחליף, להפחית ולמקד ניסויים בבעלי חיים, הפרוטוקול הנוכחי הוקם כדי לספק מודל מתקדם 3D במבחנה הכבד מסוגל להעריך באופן אמין נקודות קצה טוקסיקולוגיות מרובות (למשל, פונקציונליות הכבד, (פרו)סמנים דלקתיים, cytotoxicity ו genotoxicity) בעקבות חשיפות כימיות ו- ENM חריפה, ארוכת טווח וחוזרת על עצמה בשגרה
כאן, אנו מציגים שיטה להקים קו תאים 3D hepatocyte רלוונטי מבחינה פיזיולוגית מבוסס במערכת מודל במבחנה להערכת סכנת genotoxicity בעקבות חשיפות ENM חריפה או ארוכת טווח, חוזרות ונשנות. ניתן לחלק את הפרוטוקול ל-6 שלבים מרכזיים: תאי HepG2 קריאופרדים; הכנת ספרואיד HepG2; העברת ספרואיד HepG2 מירידה תלויה להשעיה agarose; קציר כדורי HepG2; micronucleus מבחנים וניקוד; וניתוח נתונים.
Protocol
1.Culturing תאים HepG2 cryopreserved
הערה: תאי HepG2, שהתקבלו מאוסף תרבות הסוג האמריקאי (ATCC) היו מתורבתים ב-1x Dulbecco's Modified Eagle Medium (DMEM) עם 4.5 גרם/L D-גלוקוז ו-L-גלוטמין בתוספת 10% סרום שור עוברי (FBS) ואנטיביוטיקה 1% פניצילין/סטרפטומיצין.
- מדיום תרבית תאי DMEM חם מראש (כולל התוספים) באמבט מים של 37 מעלות צלזיוס למשך 30 דקות.
- הסר בקבוקון אחד של תאי HepG2 מחנקן נוזלי ולהפשיר באמבט מים 37 מעלות צלזיוס במשך 2-3 דקות, תוך מערבולת בעדינות את הבקבוקון כדי לאפשר הפשרה אחידה של השעיית התא. יש להקפיד לא להטביע את הבקבוקון מעל ה-O-ring על מנת להפחית את פוטנציאל הזיהום.
- לאחר הפשרה, להסיר את הבקבוקון מאמבט המים לרסס בנדיבות עם 70% אתנול כדי לסלק את המשטח החיצוני של הבקבוקון לפני הצבת מתחת למכסה המנוע סטרילי, Class II תרבית רקמה למינארית.
- בזהירות פיפטה התוכן של cryovial של תאי HepG2 לתוך צינור צנטריפוגה המכיל 9 מ"ל של מדיום תרבות תא DMEM מחומם מראש (עם תוספי מזון).
- באמצעות פס 10 מ"ל, להעביר 10 מ"ל של המתלה התא לתוך בקבוק 25 ס"מ2 תרבות תאים חד פעמיים להדגיר את התרבות במשך 3 ימים (מן הזריעה) ב 5% CO2 ו 37 °C (60 °F) עד ~ 80% confluency הוא הגיע לפני שעבר תת תרבות לתוך גדול יותר 75 ס"מ2 בקבוק תרבות תאים חד פעמיים.
- לאחר 80% מפגש הוא הגיע, תת תרבות תאים בתנאים סטריליים על ידי טריפסיניזציה עם 0.05% טריפסין / EDTA פתרון מראש מחומם באמבט מים 37 מעלות צלזיוס במשך 30 דקות. בשום שלב אין לאפשר לתאים להתייבש.
- כאשר התאים יוצרים מונולייר דבק, הסר את המדיה על-ידי הטיה לסיר פסולת חיטוי. ואז מיד לשטוף את monolayer כדי להסיר את כל העקבות של מדיה קיימת על ידי שטיפת הבקבוק פעמיים עם 3 מ"ל של פתרון סטרילי 1x PBS נשמר בטמפרטורת החדר. כמו כן, להשליך PBS לתוך סיר פסולת חיטוי.
- לאחר שטיפת PBS מוסר, להוסיף 5 מ"ל של פתרון 0.05% טריפסין-EDTA מחומם מראש, הבטחת לכסות את כל פני השטח של התאים תאים דגירה במשך 6-8 דקות ב 37 °C (67 °F) ו 5% CO2.
- הקש בעדינות על הבקבוק כדי לעקור את התאים מתחתית הבקבוק ולאחר מכן להוסיף 5 מ"ל של מדיום תרבית התא DMEM (עם תוספי מזון) כדי לנטרל את האנזים טריפסין.
- להעביר את ההשעיה התא לתוך צינור צנטריפוגה 50 מ"ל פיפטה התא השעיה למעלה ולמטה ביסודיות כדי להבטיח כי התאים מנותקים לחלוטין.
- צנטריפוגה השעיית התא מדולל ב 230 x g במשך 5 דקות. להשליך את supernatant לתוך חיטוי להשעות מחדש גלולה התא ב 25mL של מדיום תרבית התא DMEM (עם תוספי מזון).
- העבר את המתלה התא לתוך בקבוק 75 ס"מ2 תרבות תאים חד פעמיים דגירה ב 37 °C (77 °F) ו 5% CO2 במשך 3 ימים נוספים לפני שעבר הכנת ספרואיד. לאחר HepG2s היה זמן להסתגל שוב להגיע ~ 80% confluency, לקבוע את ריכוז התא כהכנה זריעת ספרואיד.
2. הכנת ספרואיד HepG2
- חזור על צעדי תת-תרבות כאמור לעיל, למעט לאחר צנטריפוגה, להשעות מחדש את גלולת התא ב 1 מ"ל של DMEM תרבות בינונית מראש מחומם באמבט מים 37 מעלות צלזיוס. השעיית תא פיפטה למעלה ולמטה ביסודיות.
- ציון הכדאיות של התאים באמצעות מבחני ההדרה הכחולים של Trypan (ראה OSHA SOP 3.21 רעלני רבייה, מוטגנים, טרטוגנים ועוברים – נהלים לטיפול ואחסון בטוחים (2019) להנחיית בריאות ובטיחות)14 עם יחס של 1:1 של השעיית תאים לתמיסה כחולה מסוננת מראש של 0.4% Trypan.
- לפני ספירת תאים, לקחת 1 מ"ל של פתרון כחול Trypan באמצעות מזרק 1 מ"ל ומסנן עם יחידת מסנן 0.45 מיקרומטר לתוך צינור סטרילי, 1 מ"ל.
- העבר 10 μL של פתרון מסונן, כחול Trypan לתוך צינור 0.2 מ"ל ולהוסיף 10 μL של השעיית התא. פתרון כחול Trypan מסונן הנותרים ניתן לאחסן עד 3 חודשים בטמפרטורת החדר לשימוש עתידי.
- מרססים את ההמוקיטומטר ביסודיות עם 70% אתנול ומנגבים יבשים במגבת נייר סטרילית לפני שמבטיחים את העטיפה מלמעלה באמצעות אדי נשימה. החלקת הכיסוי על פני השטח הלחים בנשימה מעוררת כוחות מגובשים על ידי יצירת טבעות ניוטון.
- בעדינות פיפטה התא הכחול Trypan השעיה למעלה ולמטה באמצעות פיפטה 1000 μL (כדי להפחית את הלחץ העצום) לפני הוספת 10 μL למטומטר. ודא כי הפתרון מפוזר מתחת לתעודת הכיסוי ומכסה את הרשת כולה ללא בועות אוויר.
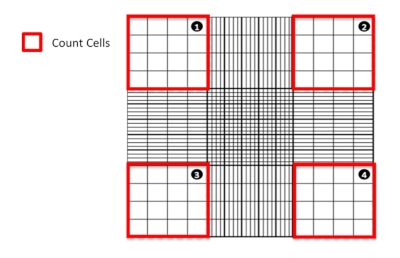
איור 1: ספירת תאים באמצעות מד חום. ייצוג דיאגרמתי של המוציתומטר המדגיש מאין רבע לספור תאים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תחת המיקרוסקופ, ספרו את התאים החיים (הלא מוכתמים) והמתים (כחולים מוכתמים) שנמצאו בארבעת הריבועים הפינתיים הגדולים (איור 1). אל תכלול תאים שנמצאו חופפים או יושבים על שני הקצוות הפנימיים של ריבועי הפינה הגדולים (כלומר, על הקווים) בספירה.
- באמצעות החישוב הבא, חשב את המספר הממוצע של תאים חיים ובת קיימא (לא מוכתמים) הקיימים במדגם:
מספר תאים כולל/מ"ל = ספירת תאים חיים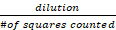 x 10,000
x 10,000
כאשר הדילול מתייחס למספר הפעמים שפתרון המניה היה מדולל בכחול Trypan (2x במקרה זה) ו# הריבועים שנספרו מתייחס לארבעת הריבועים הפינתיים הגדולים של המוציתומטר שנספרו - מבוסס על ספירת התאים הקיימת של HepG2 ושימוש בנוסחה הבאה:
C1V1=C2V2
איפה C1 = הריכוז של תאים קיימא כיום,
V1 = נפח ההשעיה של התא כרגע,
C2 = הריכוז של השעיית התא רצה,
V2 = נפח ההשעיה התא רצה - הכן פתרון מלאי 10 מ"ל של השעיית תא HepG2 עם מדיום תרבות תא DMEM בריכוז של 2.0 x 105 תאים / מ"ל על מנת להשיג 4000 תאי HepG2 לכל 20 μL תלוי טיפה. מערבבים את המתלה התא ביסודיות על ידי צנרת בעדינות למעלה ולמטה באמצעות פיפטה μL 1000 כדי להבטיח את כל התאים מושעים לחלוטין בתוך המדיה.
- לבארות של צלחת תרבית תאים 96-גם, להוסיף 100 μL של סטרילי, טמפרטורת החדר PBS כדי למנוע טיפות תלויות להתייבש במהלך הדגירה.
- קחו את המכסה של צלחת סטנדרטית שטוחה בת 96 בארות של תרבית תאים, הפכו אותה והניחו בזהירות טיפות של פיפט 20 μL של מתלה התא למרכז כל חריץ היטב של המכסה, כפי שמוצג באיור 2. השתמש פיפטה רב ערוצית אבל להוסיף רק 2 - 4 טיפות בבת אחת כמו זריעה מרובה יכול להשפיע על הדיוק והמיקום של טיפות.
- מרכז את הטיפות בתוך החריצים של בארות הניח על המכסה; אחרת הם לא ייתלו במרכז הבארות כאשר המכסה של הצלחת מתהפך והם נמצאים בסיכון ליפול לתוך הצלחת. הופכים בעדינות את המכסה של צלחת ה-96 באר, כך שהטיפות תלויות כעת ומניחות בזהירות על גבי צלחת ה-96 באר.
- מניחים את כל צלחת 96 היטב עם מכסה בעדינות לתוך אינקובטור ב 37 °C (67 °F) ו 5% CO2 במשך 3 ימים לפני העברת ספרואיד על agarose.
הערה: יש לנקוט משנה זהירות לא רק בעת הובלת הצלחות אל / מן האינקובטורים, אבל בעת פתיחה וסגירה של החממה בכלל כמו תנועה מוגזמת יכול לגרום הצלחות לנוע ואת spheroids ליפול או ליצור באופן שגוי.

איור 2: 3D HepG2 בהכנת דגם ספירואידי במבחנה. (A) תאי HepG2 זרעים ב 20 טיפות μL על המכסה של צלחת 96-well. (B)תאי HepG2 לאחר הזריעה במודל טיפה תלוי כדי לאפשר היווצרות ספרואיד. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. העברת כדורי HepG2 מירידה תלויה להשעיית agarose
הערה: ביום 3 פוסט זריעה לתוך טיפות תלויות, spheroids מועברים לתוך בארות של צלחת 96-באר כל אשר כבר מצופה בעבר עם שכבה דקה של 1.5% ג'ל agarose.
- הכן ג'לים agarose אוטוקלאב (כלומר, יום 2 לאחר זריעה) לפני יום של ציפוי צלחת (כלומר, יום 3 לאחר זריעה).
- כדי להכין 1.5% ג'ל agarose, לשקול 0.30 גרם של agarose לתוך בקבוק נקי, זכוכית ולאחר מכן להוסיף 20 מ"ל של פנול אדום ללא DMEM בינוני. אוטוקלאב agarose במשך 1 שעות ב 230 מעלות צלזיוס עבור עיקור. ציפוי agarose מונע את spheroids HepG2 לדבוק בבסיס של בארות ויוצרים monolayer הסלולר במקום לשמור על המבנה ספרואיד 3D שלהם.
- ביום 3 פוסט זריעה, להסיר את צלחת 96-well המכיל את Spheroids טיפה תלוי HepG2 מתוך האינקובטור בזהירות להפוך את המכסה כך spheroids כבר לא תלויים.
- באמצעות פיפטה רב ערוצית, להסיר ולהשליך את 100 μL של PBS שנוספו בעבר לבסיס של צלחת 96-well. אפשר את הצלחות airdry במשך 2-3 דקות תוך חימום agarose כהכנה לציפוי.
התראה: הליך זה גורם חם מאוד, נוזל agarose אשר אם נשפך על העור עלול לשרוף ולגרום לפציעה. יתר על כן, יש להקפיד בעת טיפול בבקבוק הזכוכית המכיל את הנוזל agarose כמו זה גם יכול להיות חם מאוד. - באמצעות 1.5% ג'ל agarose שהוכן בעבר, לחמם את בקבוק הזכוכית המכיל את ג'ל agarose 20 מ"ל עבור 30 s במיקרוגל בוואט המרבי (כלומר, 900 W). כדי לצפות שתי צלחות 96-באר, בקבוק אחד 20 מ"ל של ג'ל agarose מוכן מראש 1.5% צריך להיות מספיק.
- לאחר נמס, בעדינות מערבולת agarose על ידי סיבוב בקבוק הזכוכית כדי להסיר את כל בועות ולאחר מכן להוסיף 50 μL של agarose לתוך הבסיס של כל באר.
הערה: בעת הוספת agarose, הקפד לא זווית הצלחת >45° כמו agarose מגדיר במהירות ולא יהווה שטוח, שכבה ברמה שיכול לשבש את הצמיחה spheroid. חשוב לעבוד ביעילות בשלב זה כדי למנוע את agarose מלהתמצק לפני הצלחת מצופה לחלוטין. - אפשר לצלחת לעמוד במשך 2 דקות בטמפרטורת החדר לפני הוספת 100 μL של מדיום תרבית תא DMEM מחומם מראש (עם תוספי מזון) על גבי שכבת agarose מוצק בכל באר.
- הופכים את המכסה של צלחת ה-96 באר ומניחים בחזרה על גבי צלחת ה-96 באר כך שהספרואידים שוב תלויים.
- צנטריפוגה את הצלחת במשך 3 דקות ב 200 x גרם על מנת להעביר את spheroids מן טיפה תלוי לתוך בארות הפרט של צלחת 96-היטב. לאחר ההעברה, ספירואידי HepG2 צריך להיות מושעה כעת במדיום תרבות התא. אפשר להם להסתפק 24 שעות באינקובטור ב 37 °C (69 °F) ו 5% CO2.
- לחשוף כדורי HepG2 בגודל זה לטיפולים כימיים או ENM ביום 4 לאחר זריעה (כלומר, 24 שעות לאחר ההעברה ללוחות מצופים agarose).
- על מנת לשמור על הכדאיות של התאים לאורך תקופות תרבות ממושכות, יש לרענן את מדיום תרבות התאים כל 3 ימים. כדי לעשות זאת, בעדינות לשאוף 50 μL של מדיום תרבות התא מפני השטח של הבאר ולהחליף עם טרי 50 μL של מדיום תרבות התא DMEM. יש להקפיד לא להסיר או להפריע לספרואיד בעת ביצוע שינוי בינוני.
4. חשיפה ננו חומרית/כימית
הערה: דגם הכדור-כבד HepG2 יכול לתמוך הן במשטרי חשיפה מבוססי ENM והן במשטר חשיפה מבוסס כימי, אך המוקד העיקרי של פרוטוקול זה הוא חשיפות ENM. לפני החשיפה, יש לפזר כראוי את ה-ENM של הבדיקה; זה יכול להתבצע על פי הוראות פרוטוקול פיזור NanoGenoTox (הסכם מענק מס '20092101, 2018)15.
- לאחר פיזור על פי פרוטוקול פיזור NanoGenoTox, לדלל את ההשעיה ENM מן הריכוז ההתחלתי של 2.56 מ"ג / מ"ל לריכוז הרצוי הסופי במדיום תרבות תא DMEM שחומם מראש (כולל תוספי). נפח כולל של 5 מ"ל נדרש למנן צלחת אחת 96 גם.
- כדי לחשוף את הכדורואיד HepG2 או כימי או ENM, באמצעות פיפטה 200 μL, לשאוף 50 μL של מדיום תרבות התא מפני השטח של כל באר (משאיר 50 μL בבאר כדי לא להפריע את spheroids) ולהחליף עם 50 μL בינוני המכיל את רעילות הבדיקה במינון הנדרש.
- לאחר חומר הבדיקה הוחל, דגירה את הצלחות עבור זמן החשיפה הרצוי ב 37 °C (69 °F) ו 5% CO2.
- אם משטר חשיפה ארוך טווח (≥24 שעות) מתנהל, אז מיד לאחר פרק הזמן הרצוי לחשיפה חלף, לקצור את spheroids לניתוח נקודת קצה micronucleus כמתואר להלן בשלבים 6.1 – 6.4.
- עם זאת, עם משטרי חשיפה חריפים (למשל, ≤24 שעות), לאחר שתקופת החשיפה הסתיימה, הקציר, הבריכה, ולאחסן 50 μL של supernatant מכל באר בצלחת 96 גם ב -80 מעלות צלזיוס לניתוח ביוכימי נוסף מאוחר יותר. החלף את מדיום תרבות התא עם 50 μL של מדיום טרי המכיל 6 מיקרוגרם / מ"ל של Cytochalasin B ולהשאיר דגירה עבור 1 – 1.5 מחזורי תאים (כלומר, 24 – 26 שעות עבור HepG2) כהכנה קציר micronucleus בלוק ציטוקינזיס.
הערה: עבור משטרי חשיפה אקוטיים (≤24 שעות), ניתן ליישם את מבחני המיקרונוקלוס של בלוק ציטוקינזיס עם Cytochalasin B, אך עבור משטרי חשיפה ארוכי טווח (≥24 שעות), יש להשתמש בגרסה המונונוקלארית (ללא Cytochalasin B) של ה-assay כמתואר להלן באיור 4.
5. קצירת ספרואידים HepG2
הערה: בעקבות טיפולים כימיים או טיפולי חשיפה ENM, הן תרבית התא בינוני או רקמת ספרואיד ניתן לקצור לניתוח נקודות קצה מרובות. בהתאם לניתוח נקודת הקצה, ניתן לקצור ספרואידים בנפרד (למשל, לניתוח תמונה) או לאגד יחד (למשל, לבדיקת מיקרונוקלאוס בלוק ציטוקינזיס).
- מוציאים את צלחת ה-96 באר מהחממה.
- באמצעות פיפטה 200 μL, לשאוף את 100 μL של מדיום תרבות התא כולל רקמת ספרואיד מכל באר ולאסוף בצינור סטרילי, 15 mL צנטריפוגה. יש להקפיד להימנע ממגע עם ההתעוררות.
- לאחר שנאסף, צנטריפוגה ההשעיה ספרואיד ב 230 x g במשך 5 דקות. הסר את supernatant ולאחסן ב -80 מעלות צלזיוס לניתוח נקודת קצה נוסף (למשל, בדיקות תפקודי כבד) מאוחר יותר.
- להשעות מחדש את גלולה של ספרואידים ב 1 מ"ל של סטרילי, טמפרטורת החדר PBS (1x).
- לאחר שטף, צנטריפוגה ההשעיה ספרואיד שוב ב 230 x g במשך 3 דקות. להשליך את supernatant, להשעות מחדש ב 500 μL של 0.05% פתרון טריפסין-EDTA דגירה במשך 6-8 דקות ב 37 °C (77 °F) ו 5% CO2.
- לאחר הדגירה, בעדינות פיפטה התאים טריפסיניזציה למעלה ולמטה כדי לנתק לחלוטין ולהשעות מחדש את התאים HepG2 לפני נטרול עם 1 מ"ל של מדיום תרבות התא DMEM.
- צנטריפוגה השעיית התא מדולל ב 230 x g במשך 5 דקות. להשליך את supernatant לתוך חיטוי להשעות מחדש גלולה התא ב 2mL של טמפרטורת החדר PBS (1x).
- צנטריפוגה השעיית התא ב 230 x g במשך 5 דקות. להשליך את supernatant לתוך חיטוי ולאחר מכן להשעות מחדש את גלולת התא פעם נוספת ב 2 מ"ל של PBS קר (1x). ודא שהתאים מפוזרים היטב כדי למנוע גושים של תאים המטשטשים את שדה הראייה כאשר הם מותקנים על שקופיות מיקרוסקופ.
6. מיקרונוקלוס מבחנים וניקוד
עבור השיטה הידנית של מבחני המיקרונוקלוס, נדרש ציטוצנטריפוגה כדי לייצר ציטודו (אזור מוגדר ומרוכז של תאים) במרכז שקופית המיקרוסקופ. תהליך זה תומך בניקוד יעיל יותר של השקופית מכיוון שהוא מאפשר למלך לאתר בקלות את התאים המעניינים, בניגוד להערכת שקופית שלמה שבה ניתן להפיץ את התאים באופן נרחב.
- לטבול שקופיות מיקרוסקופ חלבי (שלושה למנה) ב 70% אתנול ואחריו ddH2O ולהשאיר לאוויר יבש במשך 5 דקות.
- מקם שקופיות מיקרוסקופ מוכנות במשפך cuvette כפי שמוצג באיור 3A, שם שקופית הזכוכית (iii) ממוקמת בתמיכה במתכת (iv) עם כרטיס סינון (ii) ומשפך cuvette (i) מאובטח למעלה.
- מסדרים משפכי cuvette ב cytocentrifuge עם משפך פונה כלפי מעלה, כך 100 μL של השעיית התא ניתן להוסיף ישירות לתוך כל אחד.
- ציטוספין במשך 5 דקות ב 500 x g כדי להבטיח תאים מופצים באופן שווה על פני השטח של השקופית.

איור 3: הגדרת ציטוספין להכנת תאים מטופלים בשקופיות מיקרוסקופ. (A) מציג את הרכיבים הבודדים, (i) משפך cuvette, (ii) כרטיס סינון, (iii) שקופית מיקרוסקופ זכוכית ותמיכה (iv) מתכת הנדרשת כדי cytospin HepG2 תאים על שקופיות מיקרוסקופ. (B)המשפך האחרון של הקובטה הוקם. (ג)המיקום הנכון של משפך cuvette בתוך cytocentrifuge. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- השאירו שקופיות לאוויר יבש לפני הקיבעון בקור קרח, 90% מתנול במשך 10 דקות.
- לאחר קבוע, להשאיר את המגלשות לאוויר יבש לילה בטמפרטורת החדר לפני אחסון ב -20 מעלות צלזיוס עד 6 חודשים.
- במידת הצורך, הסירו את מגלשות המיקרוסקופ המוכנות מראש ממקפיא בטמפרטורה של -20 מעלות צלזיוס ואפשרו להתחמם לטמפרטורת החדר לפני שתתחייבו להכתים את גימסה.
התראה: על פי תקנה (EC) מס ' 1272/2008 [CLP], פתרון הכתמת Giemsa הוא נוזל דליק מאוד אשר יכול להיות רעיל אם בלע ולגרום נזק במגע עם העיניים, העור או אם בשאיפה. עיין בגיליון SDS המשויך לקבלת ייעוץ מפורט בנושא אחסון, טיפול ובריאות ובטיחות בכימיקל זה לפני השימוש. - בעוד השקופיות מפשירה, להכין פתרון כתמים 20% Giemsa (25 מ"ל נדרש כתם ~ 30 שקופיות) מדולל מאגר phosphatase (pH 6.8). יש לערבב היטב על-ידי מערבולת עדינה של הפתרון לפני הסינון באמצעות נייר סינון מקופל הממוקם במשפך.
- באמצעות פיפטה פסטר, להוסיף 3 – 5 טיפות של פתרון Giemsa מסונן כדי cytodot על כל שקופית ולהשאיר במשך 8 - 10 דקות.
- לשטוף שקופיות בשני רחיצות חיץ phosphatase רצופות לפני שטיפה קצרה מתחת למים קרים כדי להסיר כל שאריות כתם עודף. השאירו שקופיות לאוויר יבש.
- לאחר יבש, במכסה המנוע אדים, לטבול מגלשות ויטראז ב xylene במשך 10 s לפני הוספת טיפה של מדיום הרכבה למרכז cytodot ומקום כיסויי זכוכית על גבי.
- השאירו שקופיות מיקרוסקופ במכסה המנוע אדים לילה לייבוש לפני ניקוד ידני; ניתן לאחסן אותם ללא הגבלת זמן בטמפרטורת החדר.
7. ניתוח נתונים
- כמתואר בהנחיות הבדיקה של ה-OECD 487 (2014)11, כדי להעריך ולכמת נזקי דנ"א הנגרמים כתוצאה מחשיפה ל- ENM או לחומר כימי, השתמש במיקרוסקופ אור (מטרה של פי 100 עם שמן טבילה) 2000 מונונוקלד או 1000 תאים בונוקלים לכל העתק ביולוגי כדי להבקיע עבור נוכחות של מיקרונוקלי, כפי שמוצג באיור 4.
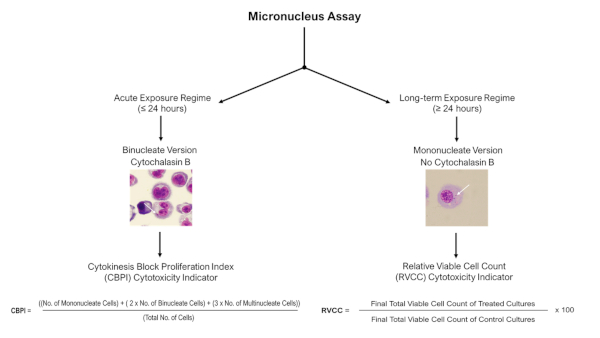
איור 4: מיקרונוקלוס מבחני ניקוד עץ ההחלטות. עץ החלטות סכמטי כדי להדגיש את הצורך בהליכי ניקוד שונים והערכת ציטוקסיות בעת שימוש בפקודת micronucleus עם מודלים תלת-ממדיים בעקבות משטרי חשיפה חריפים או ארוכי טווח. חשיפות אקוטיות (≤24 שעות) מאפשרות שימוש בפקודת הציטוקינזיס החסומה, בעוד שחשיפות ארוכות טווח (≥24 שעות) דורשות את הגרסה המונו-גרעינית של ההסתעפות; שתיהן מתוארות בהנחיית מבחן ה-OECD 487. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- בהתבסס על היחס של micronuclei הנוכחי לכל מספר של תאים mononucleated או binucleated הבקיע, לחשב אחוז של ערך genotoxicity.
- על מנת להעריך את הנזק DNA שנצפה אינו תוצאה של פסולת התא הנגרמת על ידי שיעור גבוה של תאים אפופטיים, לנקוט מידה של cytotoxicity לצד. במקרה זה, בהתאם לנוכחות של Cytochalasin B, השתמש בחישוב CPBI או RVCC (כמתואר באיור 4). Genotoxicity יש להעריך רק בדגימות שבהן cytotoxicity הוא פחות מ 55% ± 5% כהגדרתו ב-OECD מבחן הנחיות 48711.
תוצאות
ההתאמה של מודל ספירואיד כבד תלת-ממדי מבוסס קו תאים זה לתרבות ארוכת טווח והערכת סכנה גנוטוקסית הוערכה על ידי ביצוע אפיון בסיסי כדי לקבוע את הכדאיות ואת הפונקציונליות דמוית הכבד של המודל לאורך משך 14 ימים בתרבות, כמו גם את הישימות שלה עבור מבחני מיקרונוקלוס.
אפיון בסיסי של דגם כדורי כבד HepG2 תלת-ממדי
לפני כל הערכה טוקסיקולוגית במבחנה, חשוב לבדוק כי כדורי HepG2 3D נוצרו כראוי לפני ביצוע העברת agarose או טיפול כימי / ENM. כדורי HepG2 המיוצרים בשיטת הירידה התלויה לוקחים בדרך כלל 2 - 3 ימים לאחר זריעה (4000 תאים / ספרואיד) כדי ליצור ספירואידים קומפקטיים בצורת כדורית בקוטר ממוצע של 495.52 מיקרומטר W x 482.69 מיקרומטר H כפי שמוצג באיור 5A-5C. כדורי HepG2 שנוצרו כראוי והם מקובלים לשמש להערכה טוקסיקולוגית במבחנה חייב להיות מבנה קומפקטי, כדורי בצורת עם משטח חלק ללא הקרנות חזותיות. איור 5 מספק דוגמאות לאיכות טובה (איור 5D-F)וספרואידים באיכות ירודה (איור 5G-I). האחרון שבהם צריך להיות מושלך. בדרך כלל, 90-95% של spheroids נוצר לכל צלחת תיווצר כראוי להיות קיימא לניסויים נוספים.
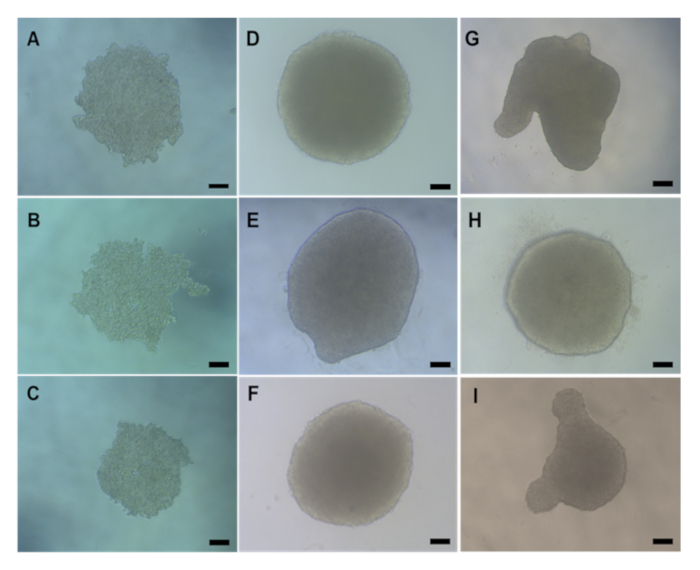
איור 5: תמונות מיקרוסקופיות קלות המציגות את המורפולוגיה הטבעית של הספרואידים HepG2 שנוצרו באמצעות שיטת הטיפה התלויה. (A-C) להראות יום 2 ו (D-I) יום 4 HepG2 כבד spheroids פוסט זריעה. (D-F)הם דוגמאות של ספירואידים HepG2 באיכות טובה בעוד (G-I) מראה ספרואידים בצורה גרועה. כל התמונות צולמו במטרה X20 באמצעות מיקרוסקופ. סרגל קנה המידה מייצג 20 מיקרומטר.
כדי לאשר עוד יותר את הכדאיות הכדורית HepG2, אלבומין ירוק ברומוקרסול צבעוני בסיסי (BCG) Assay או Urea Assay יכול להתבצע כדי להעריך את הפונקציונליות דמוית הכבד שלהם. פונקציונליות דמוית כבד הוערכה בהתאם לכדאיות באמצעות מבחני ההדרה הכחולים של Trypan במשך 14 יום כדי לקבוע את תוחלת החיים של מודל הכדוריד בכבד ולקבוע אם הוא יכול לתמוך בהערכת סיכונים מבוססת ENM/כימית לטווח ארוך או חוזרת ונשנית (איור 6). ריכוז האלבומין נותר עקבי לאורך תקופת התרבות. ייצור אוריאה מציג עלייה בריכוז של אוריאה המיוצר ספרואיד במשך שבוע בתרבות לפני שהגיע לרמה ביום 7. חשוב לציין כי רמות אלבומין ואאוריאה המיוצרים בספרואידים 3D HepG2 גבוהות משמעותית מזו שנצפו באותו קו תאים בתרבית בפורמט דו-ממדי. ואכן, תרבויות דו-מימדיות של תאי HepG2, שיא אלבומין ורמות אוריאה היו 0.001 מ"ג/מ"ל ו-0.010 ננוגרם/μL בהתאמה. יתר על כן, בעבודה קודמת שפורסמה על ידי שאה ואח 'באמצעות מערכת כדורית HepG2 כמעט זהה, המחברים מדגישים שיפור ניכר בפעילות מטבולית (CYP1A1 ו CYP1A2) במערכות מודל 3D HepG2 במבחנה בהשוואה לתאי HepG2 בתרבית דו-ממדית5.
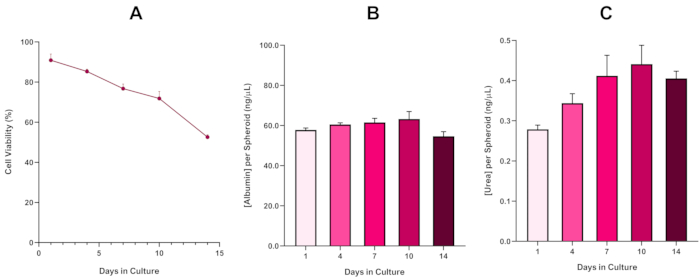
איור 6: נתוני אפיון בסיסי ל-14 יום עבור ספירואידי כבד HepG2. לאחר ההעברה מירידהתלויה,( A ) מדגיש את הכדאיות של דגם הכדורואיד HepG2 על פני תקופה של 14 יום בעוד (B) ו -( C) להדגיש את פונקציונליות אלבומין דמוי כבד אוריאה בהתאמה. נתונים ממוצעים ± SEM שהוצגו, n = 4. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
עם ההתפתחות הבלתי נמנעת של ליבה נמקית, מגבלה ידועה של תרביות ספירואיד כבד 3D, הכדאיות של מודל זה מבוסס HepG2 היה צריך להיות הוקמה כדי להדגים שהוא היה מסוגל לקיים לטווח ארוך (5-10 יום) משטרי חשיפה תוך שמירה על יכולת התפשטות הנדרשת כדי לתמוך micronucleus assay5. ואכן, מודל זה כדורי כבד 3D הוכח לשמור על >70% הכדאיות על פני 10 ימים בתרבות. בהתבסס על זה בשילוב עם פונקציונליות דמוית כבד מתמשכת שנצפתה במהלך תקופת התרבות ≥14 יום, מודל זה של כבד 3D spheroids יכול ובכך לתמוך לטווח ארוך, משטרי חשיפה חוזרת ונשנית ENM עד 10 ימים (כלומר, לפני הכדאיות של spheroids לרדת מתחת 70%). לעיון, מומלץ כי רמות אלבומין עבור כדורי HepG2 זרעים ב 4000 תאים / ספרואיד צריך להיות ≥20.0 ng/μL בעוד ייצור אוריאה צריך להיות ≥0.25 ng/μL לפני ביצוע הערכה טוקסיקולוגית במבחנה עם מודל זה.
הערכת גנוטוקסיות של ננו-חומרים מהונדסים
להערכת genotoxicity, assay micronucleus שימש כדי לקבוע את נוכחותו של micronuclei בעקבות חשיפות אקוטיות (24 שעות) ו לטווח ארוך (120 שעות) ENM. Aflatoxin B1 הוא מסרטן כבד ידוע16,17 והוא שליטה חיובית מומלצת עבור בדיקת micronucleus. ניסויי אופטימיזציה הראו כי 0.1 מיקרומטר של אלפאטוקסין B1 גורם חיובי משמעותית (עלייה ≥2.0 קיפול) תגובה genotoxic ב 3D HepG2 כבד spheroids ולכן משמש בכל micronucleus assay שנערך עם מודל זה. כדי להבטיח את תוקפם של תוצאות בדיקת המיקרו-נוקלוס באמצעות דגם הכדורית HepG2, תדר המיקרו-נוקלוס ברקע לתאי HepG2 המשמשים במודל זה של 3D במבחנה צריך להיות בטווח של 0.6% – 1.2%. כתוצאה מכך, Alfatoxin B1 צריך לגרום לתגובה genotoxic של לפחות פי שניים גבוה יותר מזה שנראה עם שליטה שלילית; לכן, 0.1 מיקרומטר של אלפאטוקסין B1 צריך לגרום לתדר micronuclei בין 1.5% – 3.0%. באמצעות פרמטרי בקרה אלה, ניתן להעריך באופן מהימן את genotoxicity המשויך ל- ENM במבחנה. בהתבסס על הנחיות הבדיקה של ה-OECD 487, חשוב לציין כי בעת בדיקת ENM או כימיקל, הריכוזים שנבחרו לא צריכים לגרום ליותר מ -55% ± 5% ציטוקסיות (המצוין על ידי ירידה בערכי CPBI או RVCC ביחס לשליטה השלילית)11. איור 7 ממחיש את הנתונים שנוצרו כאשר Aflatoxin B1 ושני ENMs (טיטניום דו-חמצני (TiO2)ורסיס (Ag)) הוערכו בעקבות חשיפות חריפות וארוכות טווח בספרואידים של HepG2, והפוטנציאל הגנוטוקסי הבא נותח באמצעות מבחני המיקרו-נוקלוס. שני ENMs העריכו נבדקו במינון לא ציטוקסי, נמוך של 5.00 מיקרוגרם / מ"ל על חשיפה חריפה (24 שעות) ומשטר חשיפה לטווח ארוך (120 שעות). מגמה דומה עבור genotoxicity על פני שני TiO2 ו Ag ENMs ניתן לראות, לפיה תגובת genotoxicity מוגבהת שהביאה לאחר חשיפה 24 שעות לא היה ניכר לאחר חשיפה לטווח ארוך 5 ימים. זאת למרות גנוטוקסיות מתמשכת הנגרמת על ידי השליטה החיובית Aflatoxin B1 בשתי נקודות הזמן.
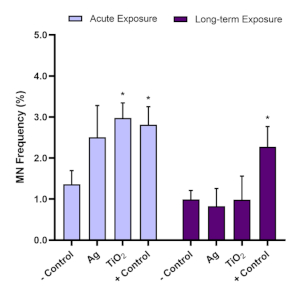
איור 7: הערכת Genotoxicity בעקבות חשיפה TiO2 ו Ag ENM על כדורי כבד HepG2. הערכת Genotoxicity (תדר מיקרונוקלוס) באמצעות הפוסט micronucleus assay (A) חריפה (24 שעות) ו -( B) לטווח ארוך (120 שעות) חשיפה ל 5.00 מיקרוגרם / מ"ל של TiO2 ו Ag ENM. שליטה שלילית היא מדיה בלבד, בעוד השליטה החיובית היא 0.1 מיקרומטר של Aflatoxin B1. נתונים ממוצעים (n = 2) שהוצגו ± SD. Significance מצוין ביחס לבקרה השלילית: * = p≤ 0.05. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
יישומים עבור דגמי הכבד 3D להשתנות במידה ניכרת בהתאם לנקודת הקצה הביוכימית מסוימת או מסלול תוצאה שלילית להיות ממוקד. לכל דגם יש את היתרונות והמגבלות שלו, החל מווריאציות בין-תאיות במודלים ראשוניים של הפטוציטים אנושיים (PHH) וכלה בפעילות ציטוכרום p450 מופחתת במודלים מבוססי קו תא, אך כולם בעלי ערך בזכות עצמם6,12,18,19. בעת הערכת genotoxicity יש מגבלות בתאימות מודלים עם נקודות קצה שאושרו רגולטורית כגון במבחנה micronucleus assay, כמו התפשטות פעילה נדרשת. זה הכרחי, כמו הערכת genotoxicity דורש כימות של נזק DNA קבוע כדי להיות מוערך לאחר חלוקת התא כאשר יש הזדמנות לתיקון DNA לתקן נגעים חולפים. למרבה הצער, hepatocyte מובחן מאוד (כלומר, HepaRG) מבוסס ספרואידים או microtissues PHH, אשר נחשבים להפגין את המאפיינים הרלוונטיים ביותר מבחינה פיזיולוגית דמויי כבד טופס סטטי (לא שגשוג) מודלים12,19,20. כתוצאה מכך, דגם הכדוריד 3D HepG2 המוצג כאן מספק מודל מתאים ואלטרנטיבי המסוגל לתמוך בבדיקות גנוטוקסיות. Spheroids מבוססי קו התא HepG2 יש מספיק תאים מפרידים באופן פעיל על פני השטח החיצוניים של spheroids תוך שמירה על מאפיינים בסיסיים דמויי כבד, כגון ייצור אלבומין אוריאה וכמה פעילות CYP4505,12,19. בעיקר מודל זה בכבד במבחנה פותחה כדי להשלים את הבדיקה micronucleus, שכן זהו אחד משני מבחני במבחנה מומלץ בסוללה לבדיקת genotoxicity8,10,11,21. עם זאת, המודל יכול להיות מיושם בקלות על ניתוח רצף DNA וטכנולוגיות ביטוי גנים (RNA), בעוד שיש לו פוטנציאל להיות מותאם עוד יותר מנוצל עבור נקודות קצה אחרות נזק DNA, כגון שביט assay. עם זאת, חשוב לקחת בחשבון את התפקיד שהפרעות ENM ממלאות בניתוחים מסוימים של נקודות קצה. לדוגמה, ניתוחים מבוססי cytometry זרימה לא יכול להיות מתאים להערכת genotoxicity ENM במיוחד עקב הפרעה חלקיקים22.
גורם מגביל אחד של מודלים ספרואידיים שעוברים באופן פעיל חלוקת תאים הוא גודלם. אופטימיזציה של צפיפות הזריעה היא קריטית מכיוון שצריכים להיות מספיק תאים המאפשרים למודל להמשיך להתרבות; אבל לא מספר תא גבוה מדי, מה שמוביל לכך שהספרויד הופך לקומפקטי מדי, מה שמוביל לליבה נמקית מוגברת. הגורם לנמק זה הוא האמין להיות מוגבל חמצן ופיזור מים מזינים, כמו הגבול של דיפוזיה זו נחשבת כ 100 – 150 מיקרומטר של רקמה23,24. עם זאת, הדבר תלוי בסוג התא, מספר התא, אינטראקציות הפיגומים ותנאי התרבות25. מאז, הוכח כי כ 700 קוטר מיקרומטר הוא הגבול למניעת התפרצות מוקדמת של נמק במרכז כדורי C3A, זריעת 4000 תאי HepG2 לכל ספרואיד מבטיח את קוטר הדגם בזמן החשיפה הוא ≤500 מיקרומטר26. יתר על כן, Shah et al. קבע כי תאי HepG2 זרעים מעל 5000 תאים לכל ספרואיד הציג ירידה של 25% בכדאיות לאחר 7 ימים בתרבות, אשר יכול לכלול את הקוטר הממוצע של 680 מיקרומטר וזמינות מוגבלת של חומרים מזינים בירידה תלויה 20 μL5. כדי להתגבר על כך, המודל שהומצא בפרוטוקול הנוכחי עובר שלב קריטי שבו הטיפה התלויה מועברת לבארות מצופות אגרוז לאחר היווצרות ראשונית של הספרואיד. זה מבטיח נפח גדול יותר של מדיום תרבות קיים כדי לקיים את המספר ההולך וגדל של תאים בתוך spheroids. כתוצאה מכך, המודל הכדורי HepG2 נשאר מעל 70% קיימא לאחר 10 ימים בתרבות והוא יכול להיות מנוצל להערכת סכנה לטווח ארוך במבחנה.
בעוד המודל הכדורי HepG2 יכול לתמוך הן משטרי חשיפה חריפה וארוכת טווח, מרענן את תרבות התא בינוני במהלך תקופות תרבות מורחבת מוגבל עבור מודל זה כמו החלפה מלאה של המדיום לא מומלץ בשל אובדן פוטנציאלי של spheroids. יש להניח כי עם חשיפות ENM, הנטייה לפיזור ENM הומוגנית כדי agglomerate ומשקעים הוא גבוה. עם זאת, ראוי לציין כי הקצב שבו משקעי ENM יכולים להשתנות בהתאם לפרמטרים החלקיקים (למשל, גודל, צורה וצפיפות) וניתן לקבוע באופן תיאורטי באמצעות משקעים במבחנה, דיפוזיה ודוזימטריה (ISDD), או נגזרות האחרונות שלה, המכונה לעתים קרובות כאשר לגבי ENM (השעיה) חשיפה מתקרב27,28. עם זאת הוא המוח, ההנחה היא כי אם רק 50% של מדיום תרבות התא מוסר בזהירות מפני השטח של תרבות התא, ההפרעה והסרה לאחר מכן של מינון ENM צריך בתיאוריה להיות מינימלי. עם זאת, עם תנועה בראונית במשחק, זה לא יכול להיות המקרה בקפדנות ועבודה נוספת לתוך התצהיר ואת משקעים של כל ENM מסוים להיבדק צריך להתבצע כדי להבטיח את הדוזימטריה הנכונה נשמרת לאורך כל משטר החשיפה לטווח ארוך27. בעיקר זוהי מגבלה פוטנציאלית שיש לקחת בחשבון בעת ביצוע משטרי מנון חוזרים ונשנים שכן זה יכול להיות קריטי לריכוז הסופי, המצטבר. חשיפות מבוססות כימית מצד שני, אמנם לא בלי המגבלות שלהם לשקול, מציעים גישה פשטנית יותר בכך חומרים כימיים נוטים להישאר בתמיסה ובכך החלפה ישירה של הריכוז הכימי המקורי בנוסף לריכוז החדש שנוסף מבטיח כי כל כימיקל שאבד במהלך כיבוד התקשורת מוחלף בהתאם29. יישומים עתידיים יכללו הערכת ההתאמה של המודל למשטרי חשיפה חוזרים ונשנים לאורך תקופות תרבות ארוכות טווח, שכן אסטרטגיות מינון חוזרות ונשנות חשובות ביותר להערכת היכולת של מערכת איברים מסוימת לשפר או להתגבר על ההשפעות השליליות, אם בכלל, הנגרמות על ידי ביואקומולציה של חומר קסנוביוטי.
לסיכום, מודל זה 3D במבחנה הכבד יש את היכולת להיות מנוצל להערכת מגוון של תרחישי חשיפה מציאותיים, ובכך לספק גישה במבחנה בעתיד כדי לתמוך טוב יותר הן ENM והערכת סכנה כימית באופן שגרתי ונגיש בקלות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להכיר בכך שמחקר זה קיבל מימון מתוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי לפרויקט PATROLS, במסגרת הסכם מענק מס' 760813
Materials
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
References
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -. K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. . OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019)
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Erratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 1/26/2021. Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
to:

The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved