Method Article
장기 나노 물질 노출 다음 체외 물질 독성 테스트를 위한 고급 3D 간 모델
Erratum Notice
요약
이 절차는 시험관 내에서 고급 3D 간 배양을 개발하는 데 사용되기 위해 설립되었으며, 급성 또는 장기, 반복 투여 요법 모두에 걸쳐 나노 물질 노출과 관련된 물질 독성 위험의 보다 생리적으로 관련 된 평가를 제공 할 수 있습니다.
초록
다양한 엔지니어링 나노 물질(ENM)의 급속한 개발과 구현으로 인해 ENM에 대한 노출이 불가피하며 견고하고 예측가능한 시험 시스템 개발이 필수적입니다. 간 독성은 ENM 노출을 고려할 때 중요합니다, 간은 신진 대사 항상성 및 해독에 중요한 역할을하고 뿐만 아니라 ENM 축적 포스트 노출의 주요 사이트인. 이를 바탕으로 2D 간세포 모델이 생체내에서 관찰되는 복잡한 다세포 상호 작용 및 대사 활동의 복잡성을 정확하게 모방하지 않는다는 것을 받아들인 이해에 기초하여, 체외에서 ENM 위험 평가 목적으로 맞춤화된 생리학적으로 관련된 3D 간 모델의 개발에 더 중점을 두고 있다. 동물 실험을 대체, 감소 및 정제하는 3R의 원칙에 따라, 3D HepG2 세포주 기반 간 모델이 개발되었으며, 이는 확장 및 반복ENM 노출 정권(≤14일)을 모두 지원할 수 있는 사용자 친화적이고 비용 효율적인 시스템입니다. 이러한 스페로이드 모델(직경 ≥500 μm)은 생체 외에서 게놈 독성을 효과적으로 평가하기 위해 '금본위제' 미세핵 분석과 결합될 수 있도록 증식 능력(즉, 셀 모델을 분할)을 유지합니다. 독성 종말의 범위에 보고하는 그들의 능력 (예를 들어, 간 기능, (pro-) 염증 반응, 세포 독성 및 지독 독성) 급성 (24 h) 및 장기 (120 h) 노출 정권에 걸쳐 여러 ENM을 사용 하 여 특징되었습니다. 이 체외 간 모델은 보다 사실적인 ENM 노출을 평가하는 데 활용할 수 있는 능력을 가지며, 따라서 일상적이고 쉽게 접근 할 수있는 방식으로 ENM 위험 평가를 더 잘 지원하기 위한 미래의 체외 접근 방식을 제공합니다.
서문
다양한 설계 나노 물질(ENM)의 급속한 발전과 구현으로 인해 다양한 인간 기반 응용 분야(예: 식품, 화장품, 의류, 스포츠 장비, 전자, 운송 및 의약품)에 걸쳐 인간이 정기적으로 ENM에 노출될 수밖에 없습니다. 이와 함께, 수많은 응용 프로그램에서 이러한 물질을 유리하게 간주 하는 새로운 크기 특정 생리 화학 특성 인간의 건강과 환경에 악영향을 일으킬 수 있습니다. 현재 많은 국제 활동은 이러한 ENM에 더 생리적으로 관련된 노출을 적극적으로 반영하고 급성, 장기 및 반복된 저용량 노출 시나리오를 통해 이러한 물질의 잠재적 독성을 평가하기 위해 마련되어 있습니다.
간 독성학은 ENM 노출을 고려할 때 핵심이며, 간은 ENM 축적 포스트 노출1,2의주요 부위로 널리 알려져 있기 때문에. 더욱이, 간은 전신 순환을 입력하는 물질의 신진 대사 및 해독을 위한 1차 기관시스템3. 2D 간세포 모델이 복잡한 다세포 상호 작용의 복잡성을 정확하게 모방하지 않거나 생체 내에서 관찰되는 대사 활성을 적절히 나타내지 않는다는 수용된 이해에 기초하여, 생체 내 대체 기술에 대한 시험관 3D 간 모델을 견고하고 생리적으로 관련시키는 개발에 더 중점을 두고4,5. 고급 3D 배양 기술을 활용하여 시험관 내 간 모델의 수명을 향상시켜 장기적인 반복노출 제도를 조사할 수 있습니다. 또한, 이러한 고급 배양 형식은 담즙 카날리큘리, 능동 수송 공정 및 개선된 CYP450 약물 대사 기능과 같은 향상된 생리적, 조직화 기능의 형성을 촉진하여 모델6의예측가능성을 향상시킨다. 모노 배양(간세포만) 또는 공동 배양(비파렌키말 세포를 가진 간세포)으로 구성된 현재 3D 체외 간 모델은 여러 형식으로 존재하며, 초저 유착 판의 미세 조직 또는 스페로이드, 매달려 드롭 스페로이드, 행렬 및 /또는 비계 및 미세 유체 세포 배양 플랫폼에 내장 된 세포에 이르기까지, 모두는 간 독성 평가6,7에대한 효과적인 시험관 내 모델로 간주됩니다. 그러나 이러한 모델 시스템의 대부분은 높은 유지 보수, 특수 장비를 필요로하고 비싸다. 더욱이, 이들 모델은 고정된 DNA 손상을 정량화하는 방법을 활용하는 지적 독성 검사와 같은 위험 종점의 평가에서 사용을 방지하는 정적(즉, 비분할 세포 모델)이다. 유독성은 규제 독성학의 핵심 전제 조건이며, 독성8의위험 평가의 중요한 구성 요소입니다. 외인성 에이전트에 노출된 후 발생할 수 있는 모든 형태의 DNA 손상을 정량화하기 위해 적용될 수 있는 단일 분석이 없습니다. 그러나, 체외 물질 독성 검사 전지의 핵심 성분은 미세핵 분석이며, 이는 총 염색체 손상을 측정하는 신뢰할 수 있고 다각적인 기술이다9. 시험관 내 DNA 손상 및 지독성을 평가하기 위한 OECD 테스트 가이드라인(487)에 의해 기술된 금표준 기술이며, 규제 위험평가(10,11)에대한 테스트 배터리 요구 사항의 일부이다.
인간 간세포 암종 세포주, HepG2는 세포가 쉽게 사용할 수 있고, 상대적으로 저렴하며, 배양에 간단하고 높은 처리량스크리닝(12,13)으로가능하기 때문에 초기 위험 평가 스크리닝에 널리 사용된다. 3D 구형 구조로 배양하면 간 미세 환경을 잘 재구성하고 미세 핵 분석3을지원하기에 충분한 증식 기능을 갖춘 간 모델을 제공하는 것으로 나타났습니다. HepG2 스페로이드 모델의 추가 개발은 장기적이고 반복적인 노출 정권(≤14일)에 걸쳐 물질독성 위험 평가를 지원하기 위해 모델의 장수 및 간과 같은 기능을 개선하기 위해 설립되었습니다. 따라서, 동물 실험을 대체, 감소 및 정제하는 3R의 원칙에 따라, 본 프로토콜은 급성, 장기 및 반복화학 적 및 ENM 루틴에 따라 여러 독성 학적 종점 (예를 들어, 간 기능성, (pro-)염증 성 마커, 세포 독성 및 독독성을 안정적으로 평가 할 수있는 시험관 내 간 모델의 고급 3D를 제공하기 위해 설립되었습니다.
여기서, 급성 또는 장기, 반복된 ENM 노출에 이어, 지독성 위험 평가를 위한 체외 모델 시스템을 기반으로 생리적으로 관련된 3D 간세포 세포주를 확립하는 방법을 제시한다. 프로토콜은 6 개의 주요 단계로 나눌 수 있습니다 : 냉동 보존 HepG2 세포를 배양; HepG2 스페로이드 제제; HepG2 스페로이드 전달 은 아가로즈 서스펜션에 매달려 드롭에서; 헵G2 스페로이드 수확; 미세 핵 분석 및 점수; 데이터 분석.
프로토콜
1.냉동 보존 HepG2 세포를 배양
참고: 미국형 배양컬렉션(ATCC)에서 얻은 HepG2 세포는 4.5g/L D-포도당 및 L-글루타민을 10% 태아 소 혈청(FBS)과 1% 페니실린/성병절제술로 보충한 1x 덜벡코의 수정독수리 매체(DMEM)에서 배양되었다.
- 37°C 수조에서 전온 DMEM 세포 배양 배지(보충제 포함)가 30분 동안.
- 액체 질소에서 HepG2 세포의 유리병 1개를 제거하고 37°C 수조에서 2-3분 동안 해동하고 유리병을 부드럽게 소용돌이면서 세포 현탁액의 균일한 해동을 허용합니다. 오염 가능성을 줄이기 위해 O 링 위의 유리병을 침수하지 않도록 주의하십시오.
- 해동되면 수조에서 바이알을 제거하고 70% 에탄올로 넉넉하게 스프레이하여 바이알의 바깥표면을 오염제거한 후, 클래스 II 라미나르 조직 배양 후드를 배치합니다.
- HepG2 세포의 극저온의 내용을 사전 데밍DMEM 세포 배양 배지의 9mL를 포함하는 원심분리기 튜브로 조심스럽게 피펫(보충제 포함).
- 10mL 스트리펫을 사용하여, 세포 현탁액의 10mL를 25cm2 일회용 세포 배양 플라스크로 이송하고 3일 동안 배양(파종에서) 5% CO2 및 37°C에서 ~80% 인플루엔자에 도달하여 하위 배양을 더 큰 75cm2 일회용 세포 배양 플라스크로 진행한다.
- 일단 80%의 합류에 도달하면, 37°C 수조에서 37°C 수조에서 예열된 트립신/EDTA 용액0.05%를 트립시화하여 멸균 조건하에서 하위 배양 세포가 30분 동안 미리 데워졌다. 어떤 시점에서 세포가 건조 할 수 없습니다.
- 세포가 부착된 단층층을 형성함에 따라 소독제 폐기물 냄비에 기울어 미디어를 제거합니다. 그런 다음 즉시 단층층을 세척하여 실온에서 보관된 멸균 1x PBS 용액 3mL로 플라스크를 두 번 헹구어 기존 미디어의 모든 흔적을 제거합니다. 또한 PBS를 소독제 폐기물 냄비에 버리십시오.
- PBS 세척이 제거되면, 사전 따뜻하게 0.05% 트립신-EDTA 용액의 5mL을 추가하여 세포의 전체 표면을 커버하고 37°C에서 6-8분 동안 세포를 배양하고 5%CO2에서세포를 배양할 수 있도록 한다.
- 플라스크를 부드럽게 탭하여 플라스크 바닥에서 세포를 빼내고 DMEM 세포 배양 배지 5mL(보충제)를 추가하여 트립신 효소를 중화시합니다.
- 셀 서스펜션을 50mL 원심분리관으로 옮기고 세포 현탁액을 완전히 분리되도록 셀 서스펜션을 위아래로 철저히 전달합니다.
- 희석된 셀 현탁액을 5분 동안 230 x g로 원심분리합니다. DMEM 세포 배양 배지의 25mL에서 상체를 소독제로 폐기하고 세포 펠릿을 다시 중단하십시오(보충제).
- 세포 현탁액을 75cm2 일회용 세포 배양 플라스크로 옮기고 37°C및 5%CO2에서 3일 동안 더 구배한 후 스페로이드 제제를 진행한다. HepG2s가 적응하고 다시 한번 ~80%의 합류에 도달하면 스페로이드 파종에 대비하여 세포 농도를 결정합니다.
2. HepG2 스페로이드 제제
- 상술한 서브배양스 단계는 원심분리 후를 제외하고, 37°C 수조에서 미리 따뜻하게 된 DMEM 배양 배지의 1mL에서 셀 펠릿을 다시 중단한다. 파이펫 셀 서스펜션을 위아래로 철저히 유지합니다.
- Trypan Blue 제외 분석(OSHA SOP 3.21 생식 독소, 뮤타겐, 테라토겐 및 배아독신 참조- 안전 취급 및 저장 절차(2019) 및 건강 및 안전 지침을 위한 절차 참조)를 사용하여 세포 생존가능성 점수 매기기 0.4% 사전 필터링된 셀 서스펜션의 1:1 비율로 사용됩니다.
- 세포 계수에 앞서, 1mL 주사기를 사용하여 Trypan 블루 용액 1mL을 복용하고 0.45 μm 필터 유닛을 사용하여 멸균 튜브, 1mL 튜브에 넣습니다.
- 여과된 10 μL의 트리판 블루 용액을 0.2mL 튜브로 옮기고 셀 서스펜션 10μL을 추가합니다. 남은 여과 된 Trypan 블루 용액은 향후 사용을 위해 실온에서 최대 3개월까지 보관할 수 있습니다.
- 70% 에탄올로 혈성계를 철저히 뿌리고 멸균 종이 타월로 닦아 호흡 증기를 사용하여 상단의 커버슬립을 고정하십시오. 숨이 멎을 듯한 표면을 가로질러 커버슬립을 미끄러지면 뉴턴 링을 생성하여 응집력을 유도합니다.
- 혈액 세포계에 10 μL을 추가하기 전에 1000 μL 파이펫 (깎아 지른듯한 스트레스를 줄이기 위해)을 사용하여 Trypan 블루 셀 서스펜션을 위아래로 부드럽게 피펫합니다. 용액이 덮개 슬립 아래에 분산되어 있고 기포없이 전체 그리드를 덮는지 확인합니다.
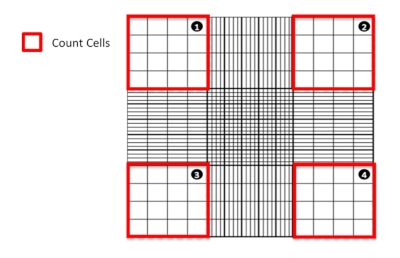
그림 1: 혈액 세포계를 사용하여 셀을 계산합니다. 셀을 계산할 사분면강조되는 혈모세포계의 다이어그램 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 현미경하에서, 4개의 큰 코너사각형(그림 1)에서발견되는 살아있는(염색되지 않은) 및 죽은(스테인드 블루) 세포를 세는다. 카운트에서 큰 모서리 사각형(즉, 선에)의 내부 두 모서리에 겹치거나 앉는 것으로 밝혀진 셀은 제외합니다.
- 다음 계산을 사용하여 샘플에 존재하는 라이브 실행 가능한 셀(스테인드)의 평균 수를 계산합니다.
셀/mL = 라이브 셀 카운트 x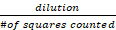 x 10,000의 총 수
x 10,000의 총 수
희석은 Trypan blue(이 경우 2배)에서 주식 용액이 희석된 횟수를 의미하며, #는 계산된 혈모세포계의 4개의 큰 코너 사각형을 말합니다. - 실행 가능한 HepG2 셀 수에 따라 다음 수식을 사용 하 여:
C1V1=C2V2
여기서 C1 = 현재 실행 가능한 세포의 농도,
V1 = 현재 셀 서스펜션의 부피,
C2 = 세포 현탁액의 농도가 원하고,
V2 = 셀 서스펜션의 부피가 원함 - 20 μL 매달려 낙하당당 4000 HepG2 세포를 달성하기 위해 DMEM 세포 배양 배지로 HepG2 세포 현탁액의 10mL 스톡 솔루션을 2.0 x 105 셀/mL 농도로 준비한다. 모든 셀이 미디어 내에서 완전히 중단되도록 1000 μL 파이펫을 사용하여 위아래로 부드럽게 피펫팅하여 셀 서스펜션을 완전히 혼합합니다.
- 96웰 세포 배양 판의 우물에 100 μL의 멸균, 실온 PBS를 추가하여 배양 중에 매달려 방울이 건조되는 것을 방지합니다.
- 표준 평면 바닥 96웰 세포 배양판의 뚜껑을 가지고, 그것을 반전하고 조심스럽게 피펫 20 μL 뚜껑의 각 웰 홈의 중심으로 세포 현탁액의 방울, 도 2에도시된 바와 같이. 멀티 채널 파이펫을 사용하지만 여러 시드가 방울의 정확도와 배치에 영향을 줄 수 있기 때문에 한 번에 2 - 4 방울만 추가하십시오.
- 뚜껑에 놓인 우물의 홈 내의 방울을 중앙으로 배치한다. 그렇지 않으면 접시의 뚜껑을 뒤집어 접시에 떨어질 위험이있을 때 그들은 우물의 중앙에 매달려 있지 않습니다. 96웰 플레이트의 뚜껑을 부드럽게 뒤집기 때문에 방울이 매달려 있고 96웰 플레이트 위에 조심스럽게 놓습니다.
- 전체 96 웰 플레이트에 뚜껑을 37°C, 아가로즈로 옮기기 3일 전에 3일 동안 5%CO2에 부드럽게 뚜껑을 닫습니다.
참고: 배판을 인큐베이터에서/로 운반할 때뿐만 아니라 과도한 움직임이 판이 바뀌거나 스페로이드가 잘못 형성될 수 있으므로 일반적으로 인큐베이터를 열고 닫을 때주의를 기울여야 합니다.

도 2: 시험관 내 3D HepG2 내의 혈청계 모델 제제. (A)20 μL로 시드된 HepG2 세포는 96웰 플레이트의 뚜껑에 떨어뜨립니다. (B)HepG2 세포는 파종 낙하 모델에서 파종 후 스페이로이드 형성을 허용한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. HepG2 스페로이드 전송 매달려 드롭에서 아가로즈 서스펜션에
참고 : 3 일째에 파종 된 방울로 파종, 스페로이드는 이전에 1.5 %의 아가로즈 젤의 미세 층으로 코팅 된 동일한 96 웰 플레이트의 우물로 전송됩니다.
- 플레이트 코팅 일 전에 아가로즈 젤 및 오토 클레이브 (즉, 2 일째 포스트 시드)를 준비하십시오 (즉, 3 일 포스트 시드).
- 1.5% 아가로즈 젤을 준비하려면 0.30 g의 아가로즈를 깨끗한 유리 병에 넣은 다음 페놀 레드 프리 DMEM 배지 20mL를 추가합니다. 멸균을 위해 230°C에서 1시간 동안 아가로즈를 오토클레이브한다. 아가로즈 코팅은 HepG2 스페로이드가 우물 의 바닥에 고착하고 3D 스페로이드 구조를 유지하는 대신 세포 단층을 형성하는 것을 방지합니다.
- 3일째 포스트 시드는 인큐베이터에서 HepG2 매달려 있는 드롭 스퍼로이드를 함유한 96웰 플레이트를 제거하고 뚜껑을 조심스럽게 뒤집어 스페로이드가 더 이상 매달려 있지 않도록 합니다.
- 멀티채널 파이펫을 사용하여 이전에 96웰 플레이트의 베이스에 추가된 PBS의 100 μL을 제거하고 폐기합니다. 코팅을 준비하기 위해 아가로즈를 가열하는 동안 플레이트가 2-3 분 동안 공기 건조되도록하십시오.
주의: 이 절차는 피부에 담그면 화상을 입고 부상을 입을 수 있는 매우 뜨겁고 액체 아가로즈가 발생합니다. 또한 액체 아가로즈가 함유 된 유리 병을 취급 할 때주의해야합니다. - 이전에 준비된 1.5% 아가로즈 젤을 사용하여, 20mL 아가로즈 젤을 함유한 유리병을 최대 와트(즉, 900 W)로 전자레인지에 30s에 가열합니다. 96웰 플레이트 2개를 코팅하려면 미리 준비된 1.5% 아가로즈 젤 1.20mL 병 1병으로 충분합니다.
- 녹으면 유리 병을 회전시켜 거품을 제거한 다음 각 우물의 베이스에 50 μL의 아가로즈를 추가하여 아가로즈를 부드럽게 소용돌이치게 합니다.
참고: 아가로즈를 추가할 때 아가로즈가 빠르게 설정되고 스페로이드 성장을 방해할 수 있는 평평한 레벨 레이어를 형성하지 않기 때문에 플레이트 >45°를 각도로 채점하지 않도록 하십시오. 플레이트가 완전히 코팅되기 전에 아가로즈가 고화되는 것을 방지하기 위해이 단계에서 효율적으로 작업하는 것이 중요합니다. - 플레이트가 실온에서 2분 동안 방치한 후, 각 우물의 고체 아가로즈 층 위에 100 μL의 전온DMEM 세포 배양 배지(보충제)를 첨가합니다.
- 96웰 플레이트의 뚜껑을 뒤집어 96웰 플레이트 위에 다시 놓아 스페로이드가 다시 한 번 매달려 있습니다.
- 96웰 플레이트의 개별 우물로 매달려 있는 물방울에서 스페로이드를 전송하기 위해 200 x g에서 3 분 동안 플레이트를 원심 분리합니다. 이송 후, HepG2 스페로이드는 이제 세포 배양 배지에서 중단되어야 한다. 37°C 및 5% CO2에서인큐베이터에서 24시간 동안 정착하도록 허용한다.
- 이 크기의 HepG2 스페로이드를 4일째 포스트 시드(예: 아가로즈 코팅 플레이트로 옮긴 후 24시간)에 화학 또는 ENM 치료에 노출시키세요.
- 확장된 배양 기간 동안 세포 생존가능성을 유지하기 위해 3일마다 세포 배양 배지를 새로 고칩니다. 이를 위해, 음의 표면으로부터 세포 배양 배지의 50 μL을 부드럽게 흡인시키고 DMEM 세포 배양 배지의 신선한 50 μL로 대체한다. 중간 변경을 수행할 때 스페로이드를 제거하거나 방해하지 않도록 주의하십시오.
4. 나노 물질 / 화학 적 노출
참고: HepG2 간 스페로이드 모델은 ENM 및 화학 기반 노출 정권을 모두 지원할 수 있지만 이 프로토콜의 주요 초점은 ENM 노출입니다. 노출되기 전에 시험 ENM은 적절하게 분산되어야 합니다. 이는 나노게노톡스 분산 프로토콜(보조금 계약 번호 20092101, 2018)15에의해 지시된 대로 수행될 수 있다.
- NanoGenoTox 분산 프로토콜에 따른 분산에 따라, ENM 현탁액을 2.56 mg/mL의 시작 농도에서 사전 데운 DMEM 세포 배양 배지에서 최종 원하는 농도로 희석(보충제 포함). 총 부피 5 mL 1 96 웰 플레이트를 투여 하는 데 필요한.
- HepG2 스페로이드를 화학 물질 또는 ENM에 노출시키기 위해, 200 μL 파이펫을 사용하여 각 우물의 표면으로부터 세포 배양 배지의 50 μL을 흡인(50 μL을 남기고 스페로이드를 방해하지 않도록) 필요한 용량으로 시험 독성물질을 함유하는 50 μL 배지로 대체한다.
- 시험 재료가 적용되면, 37 °C 및 5 % CO2에서원하는 노출 시간에 대한 플레이트를 배양한다.
- 장기(≥24h) 노출 정권이 실시되면, 원하는 노출 기간이 경과한 직후, 아래에 설명된 바와 같이 마이크로핵 엔드포인트 분석을 위한 스페로이드를 수확하여 6.1–6.4단계에서 설명한 바와 같이 한다.
- 그러나 급성 노출 정권(예를 들어, ≤24h)을 사용하면 노출 기간이 끝나면 96웰 플레이트에서 각각의 우물에서 50μl의 수퍼나티를 저장하여 나중에 추가생화학적 분석을 하였다. 세포 배양 배지를 Cytochalasin B의 6 μg/mL을 포함하는 신선한 배지의 50 μL로 대체하고 사이토카네시스 블록 미세핵 분석 수확에 대비하여 1 - 1.5 세포 주기 (즉, 24 - 26 h HepG2용 26 시간)에 대한 배양에 맡깁니다.
참고: 급성(≤24h) 노출 정권의 경우, 사이토샬라신 B를 사용하는 사이토카네시스 블록 미세핵 분석이 적용될 수 있지만 장기(≥24h) 노출 정권의 경우, 분석의 단핵 버전(Cytochalasin B 제외)은 도 4에설명된 바와 같이 활용되어야 한다.
5. HepG2 스페로이드 수확
참고: 화학 적 또는 ENM 노출 치료에 따라, 세포 배양 배지 또는 스페로이드 조직 모두 여러 엔드포인트 분석을 위해 수확 될 수있다. 종점 분석에 따라, 스페로이드는 개별적으로 수확할 수 있습니다 (예를 들어, 이미지 분석을 위해) 또는 함께 풀로 풀 (예를 들어, 사이토 카네시스 블록 미세 핵 분석).
- 인큐베이터에서 96웰 플레이트를 제거합니다.
- 200 μL 파이펫을 사용하여 각 우물에서 스페로이드 조직을 포함하는 세포 배양 배지의 100 μL을 흡인하고 멸균, 15mL 원심분리기 튜브로 수집한다. 아가로즈와의 접촉을 피하기 위해 주의하십시오.
- 수집한 후, 스페로이드 서스펜션을 230 x g에서 5분 동안 원심분리합니다. 상체를 제거하고 -80°C에 저장하여 나중에 추가 종점 분석(예를 들어, 간 기능 검사)을 추가로 검사합니다.
- 멸균, 실온 PBS (1 x)의 1 mL에서 스페로이드의 펠릿을 다시 중단합니다.
- 세척한 후, 3분 동안 230 x g에서 스페로이드 서스펜션을 다시 원심분리합니다. 상체를 버리고, 0.05% 트립신-EDTA 용액의 500 μL에서 다시 중단하고 37°C및 5% CO2에서6-8분 동안 배양한다.
- 배양 후, 트립시화 된 세포를 위아래로 부드럽게 피펫하여 DMEM 세포 배양 배지의 1 mL로 중화하기 전에 HepG2 세포를 완전히 분리하고 다시 중단합니다.
- 희석된 셀 현탁액을 5분 동안 230 x g로 원심분리합니다. 상온 PBS(1x)의 2mL에서 상체를 소독제로 폐기하고 세포 펠릿을 다시 중단한다.
- 5 분 동안 230 x g에서 세포 현탁액을 원심 분리합니다. 상체를 소독제로 폐기한 다음 감기 PBS(1x)의 2mL에서 다시 한 번 세포 펠릿을 다시 중단한다. 현미경 슬라이드에 장착 할 때 시야를 가리는 세포의 덩어리를 방지하기 위해 세포가 잘 분산되어 있는지 확인하십시오.
6. 미세 핵 분석 및 점수
마이크로뉴클레우스 분석의 수동 방법에 대해, 세포원심분리기는 현미경 슬라이드의 중심에서 세포도(정의된, 집중된 세포 영역)를 생성하는 데 요구된다. 이 프로세스는 셀이 널리 퍼질 수 있는 전체 슬라이드를 평가하는 것과 는 달리 득점자가 관심 있는 세포를 쉽게 찾을 수 있기 때문에 슬라이드의 보다 효율적인 점수를 지원합니다.
- 70% 에탄올에 서리가 내린 현미경 슬라이드(용량당 3회)를 찍어 ddH2O로 찍어 5분 동안 공기 건조상태로 둡니다.
- 3A에도시된 바와 같이 준비된 현미경 슬라이드를 큐벳 깔때기로 배치하여 유리 슬라이드(iii)가 필터 카드(ii)와 큐벳 깔때기(i)를 상단에 고정하여 금속 지지대(iv)에 배치한다.
- 깔때기를 향한 사이토센심분리기의 큐벳 깔때기를 정렬하므로 100 μL의 셀 서스펜션을 각 에 직접 첨가할 수 있습니다.
- 세포가 슬라이드 표면에 균등하게 분포되도록 500 x g에서 5 분 동안 사이토 스핀.

도 3: 현미경 슬라이드에 처리 된 세포를 준비하는 사이토스핀 설정. (A)개별 구성 요소를 표시, (i) 큐벳 깔때기, (ii) 필터 카드, (iii) 유리 현미경 슬라이드 및 (iv) 금속 지지는 현미경 슬라이드에 사이토 스핀 HepG2 세포를 필요로한다. (B)최종 큐벳 깔때기 설정. (C)사이토센심분리기 내의 큐벳 깔때기의 올바른 배치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 차가운 얼음에 고정하기 전에 공기 건조에 슬라이드를 두고, 10 분 동안 90 % 메탄올.
- 일단 고정되면, 최대 6 개월 동안 -20 °C에 저장하기 전에 실온에서 밤새 건조 슬라이드를 둡니다.
- 필요한 경우- -20°C 냉동고에서 미리 준비된 현미경 슬라이드를 제거하고 Giemsa 염색을 착수하기 전에 실온으로 따뜻하게 할 수 있습니다.
주의: 규정(EC) 제1272/2008 [CLP]에 따르면, Giemsa 염색 용액은 삼킨 경우 독성이 있고 눈, 피부 또는 흡입시 손상을 일으킬 수 있는 고인화성 액체입니다. 사용하기 전에 이 화학 물질에 대한 자세한 저장, 취급 및 건강 및 안전 조언을 위해 관련 SDS 시트를 참조하십시오. - 슬라이드가 해동되는 동안, 인산파제 버퍼(pH 6.8)에서 희석된 20% Giemsa 염색 용액(염색~30슬라이드에 필요한 25mL)을 준비한다. 깔때기에 놓인 접힌 필터 용지를 사용하여 필터링하기 전에 용액을 부드럽게 소용돌이시켜 철저히 섞습니다.
- 파스퇴르 파이펫을 사용하여 각 슬라이드의 사이토도트에 3 - 5 방울의 여과 된 지름사 용액을 추가하고 8 - 10 분 동안 둡니다.
- 두 개의 연속된 포스파타제 버퍼 세척으로 슬라이드를 세척한 후 차가운 물 에서 잠시 헹구어 남은 여분의 얼룩을 제거합니다. 슬라이드를 공기 건조상태로 둡니다.
- 일단 건조, 연기 후드에, 사이토도의 중심에 장착 매체의 드롭을 추가하기 전에 10 초에 자일렌에 스테인드 슬라이드를 찍어 상단에 유리 커버 슬립을 배치.
- 수동 점수 매기기 전에 건조 하룻밤 연기 후드에 현미경 슬라이드를 두고; 그들은 실온에서 무기한 으로 보관 할 수 있습니다.
7. 데이터 분석
- OECD 시험 지침 487 (2014)11에설명된 바와 같이, ENM 또는 화학 물질에 노출된 결과로 유도된 DNA 손상을 평가하고 정량화하기 위해, 2000개의 단핵또는 1000개의 이중핵세포를 생물학적 복제당 1000개의 이중핵세포를 사용하여 마이크로뉴클레오니의 존재를 위해 점수를 매기는 것으로 나타났다.
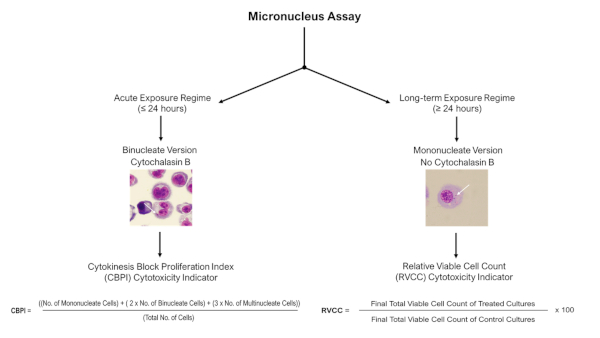
그림 4: 미세 핵 분석 점수 결정 트리. 급성 또는 장기 노출 정권에 따라 3D 모델로 미세 핵 분석술을 사용할 때 다른 채점 및 세포 독성 평가 절차의 필요성을 강조하는 회로도 의사 결정 트리. 급성 (≤24 h) 노출은 세포역학 차단 미세 핵 분석의 사용을 허용, 장기 (≥24 h) 노출은 분석의 단일 핵 버전을 필요로하는 동안; 둘 다 OECD 시험 지침 487에 기술되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 득점된 단핵 또는 이중핵 세포의 수당 존재하는 미세핵의 비율에 기초하여, 유전체 독성 값의 백분율을 계산합니다.
- 관찰된 DNA 손상을 평가하기 위해서는 세포 세포의 높은 비율에 의한 세포 이물질의 결과와 함께 세포 독성을 측정하십시오. 이 경우 Cytochalasin B의 존재에 따라 CPBI 또는 RVCC 계산(그림 4에설명된 대로)을 사용합니다. 유독성은 OECD 테스트 가이드라인 48711에정의된 바와 같이 세포 독성이 55% ± 미만인 샘플에서만 평가되어야 합니다.
결과
장기 배양 및 유노독성 위험 평가를 위한 본 세포주 기반 3D 간 스페로이드 모델의 적합성은 배지 특성화를 수행하여 배양에서 14일 동안 모델의 생존가능성 및 간과 같은 기능을 결정하고 마이크로핵 분석에 대한 적용성을 평가하였다.
3D HepG2 간 스페로이드 모델의 기준특성화
시험관 내 독성 평가에 앞서, 아가로즈 전달 또는 화학/ENM 치료를 수행하기 전에 3D HepG2 스페로이드가 제대로 형성되어 있는지 확인하는 것이 중요하다. 매달려 있는 낙하 방법을 사용하여 생산된 HepG2 스페로이드는 일반적으로 2-3일 후 시드(4000세포/스페로이드)가 평균 직경 495.52 μm W x 482.69 μm H를 형성하는 데 걸린다. 체외 독성 평가에 올바르게 형성되고 허용되는 HepG2 구형구조는 매끄러운 표면과 시각적 프로젝션이 없는 컴팩트하고 구형 모양의 구조를 가져야 합니다. 도 5는 양질의예(도 5D-F)와품질 저하(그림5G-I)스페로이드의 예를 제공한다. 후자는 폐기해야 합니다. 전형적으로, 플레이트당 형성된 스페로이드의 90-95%가 올바르게 형성되고 추가 실험을 위해 실행 가능할 것이다.
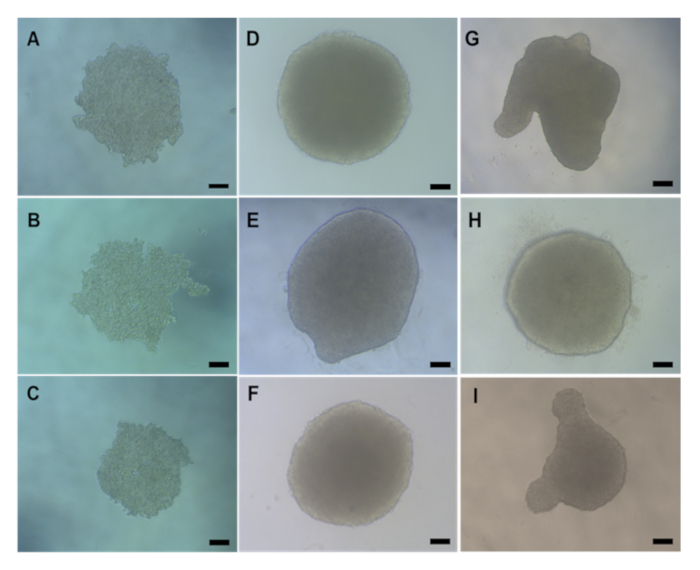
그림 5: 매달려 드롭 방법을 통해 형성 된 HepG2 스페로이드의자연 형태를 나타내는 빛 현미경 이미지. (A-C)쇼 2 일 및(D-I)일 4 HepG2 간 스페로이드 포스트 시드. (D-F)는양질의 HepG2 스페로이드의 예이며(G-I)는 제대로 형성된 스페로이드를 나타낸다. 모든 이미지는 현미경을 사용하여 X20 목표에 촬영되었습니다. 배율 막대는 20 μm을 나타냅니다.
HepG2 스페로이드 생존가능성을 더욱 확인하기 위해 기본 색채 브로모브레솔 그린 알부민(BCG) 분석 또는 우레아 분석이 수행되어 간과 같은 기능을 평가할 수 있다. 간유사 기능은 14일 배양기간 동안 Trypan Blue 배제 분석기를 이용하여 생존가능성에 따라 평가되어 간 스페로이드 모델의 수명을 결정하고 장기 또는 반복된 ENM/화학 물질 기반 위험평가(그림 6)를지원할 수 있는지 를 확립하였다. 알부민 농도는 문화 기간 동안 일관되게 유지되었다. 우레아 생산은 7일째까지 고원에 도달하기 전에 문화에서 1주일 동안 스페로이드당 생산되는 우레아의 농도가 증가하는 것을 표시한다. 3D HepG2 스페로이드에서 생산되는 알부민과 우레아의 수준은 2D 형식으로 배양된 동일한 세포주에서 관찰된 것보다 실질적으로 높다는 점에 유의해야 한다. 실제로, HepG2 세포의 2D 배양, 피크 알부민 및 우레아 수준은 각각 0.001 mg/mL 및 0.010 ng/μL이었습니다. 더욱이, Shah 등에서 거의 동일한 HepG2 스페로이드 시스템을 사용하여 발표한 이전 작품에서, 저자는 2D 배양HepG2 세포5에비해 체외 모델 시스템에서 대사 활성(CYP1A1 및 CYP1A2)의 주목할 만한 개선을 강조한다.
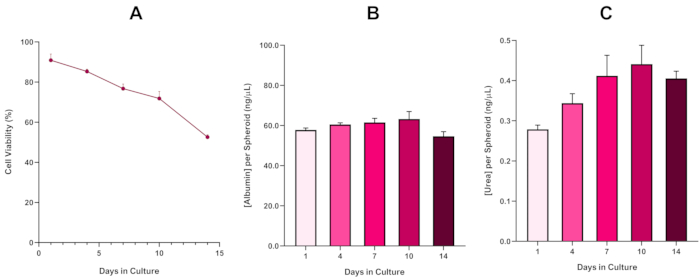
그림 6: HepG2 간 스페로이드에 대한 14 일 기준 특성 데이터. 행딩 드롭에서 의한후(A)는14일 동안 HepG2 스페로이드 모델의 생존가능성을강조하고(B)및(C)는각각 간형 알부민 과 우레아 기능을 강조한다. 평균 데이터 ± SEM 제시, n = 4. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3D 간 스페로이드 배양의 알려진 한계인 괴사 코어의 불가피한 발달로, 이 HepG2 기반 모델의 생존가능성은 미핵 분석5를지원하는 데 필요한 증식 능력을 유지하면서 장기(5-10일) 노출 체제를 유지할 수 있었다는 것을 입증하기 위해 확립되어야 했다. 실제로, 이 3D 간 스페로이드 모델은 문화에서 10 일 동안 >70 % 생존력을 유지하는 것으로 나타났습니다. 이를 바탕으로 ≥14일 배양 기간 동안 관찰된 지속적인 간형 기능과 함께, 이 3D 간 스페로이드 모델은 따라서 최대 10일 길이의 장기 반복ENM 노출 정권(즉, 스페로이드의 생존 가능성이 70% 이하로 떨어지기 전에)을 지원할 수 있다. 참고로, 4000세포/스페로이드에서 시드된 HepG2 스페로이드의 알부민 수준은 ≥20.0 ng/μL이어야 하는 반면, 우레아 생산은 ≥0.25 ng/μL이어야 이 모델을 통해 체외 독성 평가를 실시하는 것이 좋습니다.
엔지니어링 나노 물질의 유전체 독성 평가
유독성 평가를 위해, 미세핵 분석은 급성(24h) 및 장기(120h) ENM 노출 에 따른 미세핵의 존재를 결정하는 데 사용되었다. 아플라톡신 B1은 공지된 간발암물질(16,17)이며 미세핵 분석에 권장되는 양성 대조군이다. 최적화 실험에 따르면 알파톡신 B1의 0.1 μM은 3D HepG2 간 스페로이드에서 유의한 양성(≥2.0배 증가) 게놈독성 반응을 유도하여 이 모델로 실시된 모든 미세핵 분석에서 사용된다. HepG2 스페로이드 모델을 사용하여 미세 핵 분석 결과의 유효성을 보장하기 위해, 이 3D 체외 모델에 사용되는 HepG2 세포에 대한 배경 미세 핵 주파수는 0.6% – 1.2%의 범위 내에 있어야 한다. 그 결과, 알파톡신 B1은 음의 대조군으로 본 것보다 적어도 2배 더 높은 물질독성 반응을 유도해야 한다. 따라서, 알파톡신 B1의 0.1 μM은 1.5% - 3.0% 사이의 미세 핵 주파수를 유도해야 한다. 이러한 제어 매개 변수를 사용하여, 시험관 내ENM 관련 게놈 독성은 그 때 안정적으로 평가될 수 있습니다. OECD 시험 가이드라인(487)에 기초하여, 선택된 농도는 55% 이상 ± 5% 사이토독성(음의 대조군과 관련하여 CPBI 또는 RVCC 값의 감소에 의해 표시됨)이상유도해서는 안 된다는 점에 유의하는 것이 중요하다. 도 7은 아플라톡신 B1 및 2개의 ENM(티타늄 이산화티타늄(TiO2)및 슬라이버(Ag)가 HepG2 스페로이드에서 급성 및 장기 노출에 따라 평가되었을 때 생성된 데이터를 보여 주며, 후속 유전독성 전위는 마이크로핵 분석을 사용하여 분석하였다. 평가된 두 ENM은 급성(24시간) 노출 및 장기(120h) 노출 체제에 비해 5.00 μg/mL의 낮은 용량, 낮은 용량으로 시험하였다. TiO2 및 Ag ENM 모두에 걸쳐 게놈 독성에 대한 유사한 경향을 관찰할 수 있으며, 이로 인해 24시간 노출 이후 발생하는 높은 유독성 반응이 장기간 5일 노출 후에도 명확하지 않았다. 이것은 두 시간 지점에서 Aflatoxin B1 양성 제어에 의해 유도된 지속적인 게놈 독성에도 불구하고 이었습니다.
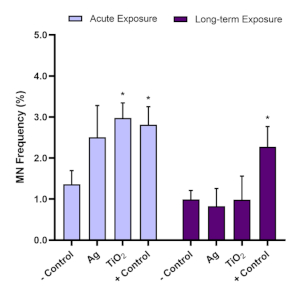
그림 7: HepG2 간 스페로이드에 TiO2 및 Ag ENM 노출 에 따른 독독성 평가. 유전체 독성(micronucleus 주파수) 평가는 미세핵 분석포스트(A)급성(24시간) 및(B)장기(120시간) 노출을 TiO2 및 Ag ENM의 5.00 μg/mL에 노출한다. 음수 제어는 미디어 전용이며, 양수 제어는 Aflatoxin B1의 0.1 μM입니다. 평균 데이터(n=2)는 부정적인 제어와 관련하여 표시된 sD. 의미 ± 제시: * = p≤ 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
3D 간 모형을 위한 응용은 표적으로 되는 특정 생화확적인 끝점 또는 불리한 결과 통로에 따라 상당히 변화합니다. 각 모델은 1차 인간 간세포(PHH) 모델의 인터도어 변이에서 부터 세포선 기반 모델의 감소된 사이토크롬 p450 활성에 이르기까지 그 장점과 한계를 가지고 있지만, 모두 자신의 권리6,12,18,19에서가치가 있다. geno독성을 평가할 때 활성 증식이 요구되기 때문에 체외 마이크로핵 분석과 같은 규제 승인 된 종점과의 모델 호환성에 제한이 있습니다. 이것은 유전자 독성 평가가 DNA 복구가 일시적인 병변을 정정할 기회가 있을 때 세포 분열을 평가하기 위하여 고정된 DNA 손상의 정량화를 요구하기 때문에 필요합니다. 불행하게도, 고도로 분화된 간세포(즉, HepaRG) 기반의 스페로이드 또는 PHH 마이크로티슈는 가장 생리적으로 관련이 있는 간 유사 특성을 나타내는 것으로 간주되며, 이는 정적(비증식)모델(12,19,20)을형성한다. 그 결과, 여기에 제시된 3D HepG2 스페로이드 모델은 genotoxicity 테스트를 지원할 수 있는 적합한 대체 모델을 제공한다. HepG2 세포주 기반 스페로이드는 알부민 및 우레아 생산 및 일부 CYP450 활성5,12,19와같은 기본적인 간 유사 특성을 유지하면서 스페로이드의 외부 표면에 세포를 충분히 적극적으로 분할합니다. 주로 이 체외간 모델은 마이크로핵 분석체를 보완하기 위해 개발되었으며, 이는 지독성 검사를 위해 배터리에 권장되는 두가지 시험관 내 분석제 중 하나이기 때문에8,10,11,21. 그러나, 모델은 DNA 염기서열 분석 및 유전자 발현(RNA) 기술에 용이하게 적용될 수 있으며, 혜성 분석과 같은 다른 DNA 손상 종점에 더 적응되고 활용될 가능성이 있다. 그럼에도 불구하고 일부 종점 분석에서는 ENM 간섭이 수행하는 역할을 고려하는 것이 중요합니다. 예를 들어, 유동 세포측정기반 분석은 특히 입자간섭(22)으로인한 ENM 독독성 평가에 적합하지 않을 수 있다.
적극적으로 세포 분열을 겪는 스페로이드 모델의 한 제한 요소는 그들의 크기입니다. 모델의 확산을 계속할 수 있는 충분한 세포가 필요하기 때문에 시드 밀도의 최적화는 매우 중요합니다. 하지만 너무 높은 세포 수, 스페로이드 지나치게 컴팩트 되 고 결과, 증가 괴사 코어로 이어지는. 이 괴사의 원인은 산소및 영양확산이 제한되는 것으로 추정되며, 이 확산의 한계는 조직23,24의약 100 ~150 μm로 생각된다. 그러나, 이는 세포유형, 세포수, 스캐폴드 상호작용 및배양조건(25)에의존한다. 이후, 약 700 μm 직경이 C3A 스페로이드의 중심에서 괴사의 조기 발병을 피하기 위한 한계이며, 스페로이드 당 4000 HepG2 세포를 시드하면 노출 시 모델의 직경이 ≤500 μm26입니다. 더욱이, Shah et al.은 스페로이드 당 5000세포 이상 시드를 받은 HepG2 세포가 배양 7일 후 생존가능성을 25% 감소시켰으며, 이는 평균 직경 680 μm에 해당하며 20 μL 매달려 낙하5에서영양소의 가용성이 제한적일 수 있음을 확립하였다. 이를 극복하기 위해, 본 프로토콜에서 고안된 모델은 스페로이드의 초기 형성 에 따라 매달려 방울이 아가로즈 코팅 된 우물로 옮겨지는 중요한 단계를 거칩니다. 이것은 스페로이드 내의 세포의 계속 증가하는 수를 유지하기 위하여 배양 매체의 더 큰 양이 존재한다는 것을 보장합니다. 그 결과, HepG2 스페로이드 모델은 문화에서 10일 후에 70% 이상 실행 가능하며 시험관 내 장기 위험 평가를 위해 활용할 수있다.
HepG2 spheroid 모델은 급성 및 장기 노출 정권을 모두 지원할 수 있지만, 확장된 배양 기간 동안 의 상쾌한 세포 배양 배지는 스페로이드의 잠재적 손실로 인해 배지의 완전한 교체가 권장되지 않기 때문에 이 모델에 대해 제한된다. ENM 노출을 통해 동질적인 ENM 분산이 응집및 퇴적물을 증가시키는 경향이 높은 것으로 추정됩니다. 그러나 ENM 퇴적물(예를 들어, 크기, 형상 및 밀도)에 따라 ENM 퇴적물속도가 달라질 수 있으며, 이론적으로 시험관내 침전, 확산 및 도시성(ISDD) 모델 또는 ENM(서스펜션) 노출에 관한 경우 언급되는 최근 유도체를 사용하여 결정될 수 있는 비율이주목할만하다. 이를 염두에 두고, 세포 배양 배지의 50%만이 세포 배양의 표면에서 신중하게 제거된다면, ENM 용량의 중단 및 후속 제거는 이론적으로 최소화되어야 한다고 가정한다. 그러나, 브라우니아의 움직임을 통해, 이것은 엄격하게 경우가 아니며, 시험될 각 특정 ENM의 증착 및 퇴적에 대한 추가 작업이 장기 노출정권(27)에걸쳐 올바른 도시계가 유지되도록 해야 한다. 주로 이것은 최종, 축적 된 농도에 중요 할 수 있기 때문에 반복된 주체 정권을 수행 할 때 고려해야 할 잠재적 인 제한이다. 한편, 화학물질 기반 노출은 자체적인 제한없이는 고려해야 할 것이 아니라, 화학 물질이 용액에 남아 있는 경향이 있으며, 따라서 새로 추가된 농도 이외에 원래화학 농도의 직접적인 교체를 제공하여 미디어 다과 중에 손실된 화학물질이29에따라 대체되도록 한다. 향후 응용 분야에는 반복된 투약 전략이 특정 장기 시스템의 능력을 평가하여 특정 장기 시스템의 능력을 평가하여 xenobiotic 물질의 생체 축적에 의해 유도되는 부작용을 평가하는 데 매우 중요하므로 장기간 배양 기간에 반복적인 노출 정권에 대한 모델의 적합성평가가 포함됩니다.
결론적으로, 이 체외 간 모델은 다양한 사실적인 노출 시나리오를 평가하는 데 활용할 수 있는 능력을 가지며, 따라서 ENM 및 화학 적 위험 평가를 일상적이고 쉽게 접근 할 수있는 방식으로 더 나은 지원을위한 미래의 체외 접근 방식을 제공합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는이 연구가 보조금 계약에 따라, 순찰 프로젝트에 대한 유럽 연합 (EU)의 호라이즌 2020 연구 및 혁신 프로그램에서 자금을 받은 것을 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
참고문헌
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -. K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. . OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019)
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Erratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 1/26/2021. Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
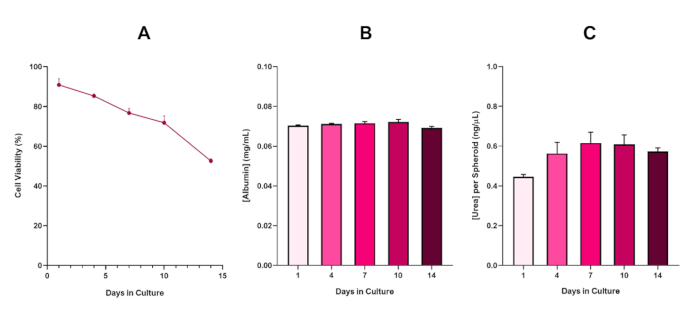
to:

The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유