Method Article
研究TGF-β信号和TGF-β引起的乳腺癌和正常细胞的上皮到中位过渡
Erratum Notice
摘要
我们描述了一个系统的工作流程,通过研究这个信号通路中涉及的蛋白质和基因表达来研究TGF-β信号和TGF-β诱导的EMT。这些方法包括西方污渍、露西费拉塞记者检测、qPCR和免疫荧光染色。
摘要
转变生长因子β(TGF-β)是一种隐秘的多功能因子,在细胞间交流中起着关键作用。TGF-β信号的扰动可导致乳腺癌。TGF-β通过特定细胞表面TGF-β类型I和II型受体(即T+RI和T+RII)引起其对增殖和分化的影响,这些受体包含内在的血清素/三氨基激酶域。在TGF-β诱导的异构体形成时,激活的T+RI通过磷化SMAD2和SMAD3发出细胞内信号。这些激活的SMAD与SMAD4形成异质复合物,以调节特定的目标基因,包括质粒体活化抑制剂1(PAI-1,由SERPINE1基因编码)。上皮到间质过渡(EMT)的诱导允许上皮癌细胞在原位或在遥远地点殖民期间获得侵入性表型并驱动肿瘤进展。TGF-β通过驾驶EMT成为乳腺癌入侵的有力诱因。在这里,我们描述了使用早熟的人类MCF10A-RAS(M2)细胞和小鼠NMuMG上皮细胞来研究TGF-β信号和EMT反应的系统方法。我们描述了通过西方印迹确定TGF-β诱导的SMAD2磷化的方法,SMAD3/SMAD4依赖转录活性使用荧光酶记者活性和SERPINE1目标基因表达通过定量实时聚合酶链反应(qRT-PCR)。此外,还描述了通过测量形态、上皮和间质标记表达、丝状作用素染色和E-cadherin免疫荧光染色的变化来检查TGF-β诱发的EMT的方法。两种选择性小分子TGF-β受体激酶抑制剂GW788388和SB431542用于阻断TGF-β诱导的SMAD2磷酸化、靶向基因和EMT标记表达的变化。此外,我们描述了间质乳房Py2T穆林上皮肿瘤细胞的异化成脂肪细胞。研究乳腺癌中TGF-β诱发信号和EMT的方法可能有助于乳腺癌的新治疗方法。
引言
细胞因子转化生长因子-β(TGF-β)是一大群结构和功能相关的调控多肽的原型,包括TGF-β(即TGF-1、-2和-3)、骨致病蛋白(BMPs)和活性素1、2。这些细胞因子在胚胎发育和维持组织和器官平衡方面都发挥着重要作用。TGF-β的监管不善可导致多种疾病,包括癌症4、5。TGF-β在癌症进展中起着复杂的双重作用:在正常和早熟的上皮细胞中,TGF-β通过抑制增殖和诱导凋亡6、7作为肿瘤抑制剂:然而,在肿瘤进展的后期, 当细胞静态反应被肿瘤基因的激活或肿瘤抑制基因的丧失所阻断时,TGF-β通过促进癌细胞的上皮到间质过渡(EMT)作为肿瘤增强剂,从而使癌细胞入侵和转移,作用于肿瘤微环境中的细胞,刺激血管生成和免疫规避8,9,10。
TGF-β作为含有成熟卡盒端TGF-β和延迟相关肽(LAP)11的非活性前体分子分泌。这种小复合物可以与潜在的TGF-β结合蛋白(LTBP)12共存。成熟的TGF-β的释放可以通过切开LAP的特定蛋白酶的动作或LAP在依赖集成过程13,14的机械拉动来调解。除LTBP外,糖蛋白A重复主要(GARP)在调控T细胞(Tregs)表面高度表达,在调节TGF-β 15、16的激活方面与LTBP发挥类似作用。GARP 通过硫化物关联和非价关联直接与潜在的 TGF-β结合。从GARP/TGF-β复合体中激活TGF-β需要集成17。成熟的TGF-β与TGF-β丝氨酸/三氨基激酶受体结合,即TGF-β型I(T+RI)和TGF-β型II(T+RII)受体18,以启动信号。TGF-β与T+RII的结合促进了T+RI的招募和异质复合体的形成。随后,T+RI由T+RII激酶在血清素和三氨酸残留物的短甘氨酸和血清丰富的(GS)图案,导致其激活19,20。激活后,激活的T+RI招募和磷酸化其基材:两个受体特异性SMAD(R-SMADs),包括SMAD2和SMAD3(图1)。R-SMAD 与两个所谓的疯狂同源域 MH1 和 MH2 共享类似的整体结构,它们由富含蛋白线的链接区域(图 2)分开。SMAD3 MH1域内的DNA结合图案在SMAD2和SMAD3之间没有保存,SMAD2不能直接结合DNA,因为它的MH1域(第3和L1)有两个插入。SMAD2 和 SMAD3 可以通过 SSXS 图案的磷化在其 C -termini (图 2)中激活。磷化SMAD2/3与常见的SMAD介导器SMAD4形成异质复合体,它转移到细胞核中,以调节目标基因的转录(图1)7,21。这种规范的SMAD信号通路被精确调节,并产生特定的细胞和组织反应,如细胞命运和肿瘤细胞转移和入侵22的调节。除了TGF-β-SMAD信号外,非SMAD信号通路也可以由受体直接激活,以调节下游细胞响应23。
在肿瘤进展过程中,需要激活TGF-β诱导的SMAD依赖和SMAD独立通路,用于EMT的诱导。EMT是一个可逆的过程,其中肿瘤细胞从上皮表型,这是与细胞接触的丧失和apical-基质极性下降相关的分化,以增强动能和入侵能力的间质表型24。EMT的特点是中分子标记蛋白的表达增加,包括N-卡德林,维门汀,Zeb2和蜗牛1/2,以及随之而来的上皮标记,如E-卡德林和β-卡他林(图3)25的调节。然而,从上皮状态到间皮状态的过渡往往不完整,细胞获得混合上皮和间质(E/M)特征。国际EMT协会最近的一篇论文建议将接受中间E/M表型状态的细胞的过程描述为上皮-间质可塑性(EMP)26。这种可塑性是指部分 EMT、混合 E/M 状态、可转移的 EMT 状态、EMT 连续体和 EMT 频谱26。在EMT期间,肿瘤细胞获得癌症干细胞(CSC)的特性,并变得更加抗分离诱发的凋亡27。虽然EMT负责在原发性肿瘤细胞中获取一种侵入性表型,并推动癌症的进展,但相比之下,间质上皮过渡(MET)已被证明在遥远的转移位点28、29的传播肿瘤细胞的生长中起着重要作用。最近的一项研究显示,EMT衍生的乳腺癌细胞可以转入脂肪细胞,这可能为抑制转移和克服肿瘤细胞中的治疗阻力和复发的癌症30提供了机会。由于TGF-β信号在激活EMT在乳腺致癌性中的重要作用, 我们提出了详细的西方印迹学方案、荧光酶转录记者检测、定量实时聚合酶链反应(qRT-PCR)和免疫荧光研究TGF-β信号、TGF-β诱导EMT,以及EMT衍生乳腺上皮肿瘤细胞的半分化成乳腺细胞。这些技术是细胞生物学领域最常用的分析工具。qRT-PCR 用于以定量方式检测、描述和量化 mRNA 表达级别。与定量PCR(qPCR)相比,反向转录(RT)-PCR可用于半定量方式31、32确定mRNA表达。西式印迹用于以半定量方式检查给定细胞中具有灵敏度和特异性优势的特定细胞中特定蛋白质水平。因此,我们提出了一个系统的工作流程,以分析从基因表达到蛋白质表达的变化,以帮助研究TGF-β信号,也可以应用于其他信号通路。
研究方案
1. 利用西式印迹分析TGF-β诱导的SMAD2磷酸化
注:前恶性人类乳房MCF10A-Ras细胞被用作调查TGF-β信号响应33的例子。原则上,下面描述的方法也适用于其他TGF-β响应细胞系。
- 培养乳房上皮细胞线MCF10A-Ras在37°C在杜尔贝科的修改鹰的介质(DMEM)/F12含有L-谷氨酰胺与5%的马血清, 20 ng/mL 表皮生长因子 (EGF)、10 毫克/mL 胰岛素、100 ng/mL 霍乱肠毒素、0.5 毫克/mL 氢皮质松和 1:100 青霉素-链霉素(Pen-Strep)。
- 尝试用1mL的0.25%胰蛋白酶-EDTA对MCF10A-Ras细胞进行1分钟的尝试,并使用细胞计数器计算可行的细胞。
- 种子细胞以5×10 5细胞/井的密度放入6 井板中。
- 在夜间生长后,用TGF-β(5 ng/mL)或配体缓冲液(4 mM HCl,0.1%无脂肪酸牛血清白蛋白(BSA)治疗细胞1小时,然后去除培养介质,用1mL的磷酸盐缓冲盐水(PBS)轻轻清洗细胞两次。
- 冰上6井板中的冷却细胞,并添加150μL的预冷无线电免疫降水检测(RIPA)裂解缓冲区(150 mM NaCl, 0.1% 特里顿 X-100, 0.5% 脱氧铬酸钠, 0.1% SDS, 50 mM 特里斯-HCl pH 8.0, 和新鲜添加的迷你蛋白酶抑制剂鸡尾酒).让裂解在冰上进行10分钟。
- 使用塑料电池刮刀将粘附细胞刮掉,然后轻轻地将细胞悬浮物转移到预制的微中心管中。
- 离心细胞在4°C的150离心力(x g)下解压10分钟,并将超分子转移到新鲜的1.5mL微中心管中。
- 使用兼容洗涤剂 (DC) 蛋白质检测套件测量蛋白质浓度。
- 将每个样品中的 30 微克蛋白质加载到 10% 的硫酸钠多丙烯酰胺凝胶电磷化 (SDS-PAGE) 凝胶上,并在 100 V 的电压下运行凝胶 1.5-2 小时。
- 将蛋白质从凝胶转移到 45μm 聚乙烯二氟化物 (PVDF) 膜,电压为 110 V,时间为 1-1.5 小时。
- 将PVDF膜转移到一个合适的容器中,蛋白质侧(面对凝胶的侧面)向上,并在蒸馏水中短暂冲洗膜。
- 丢弃水,加入庞索S溶液,并将膜放在摇动平台上1-2分钟。
- 用蒸馏水去污膜,快速冲洗,然后洗涤1分钟。
- 然后,将PVDF膜放在一个灯箱上,并拍照检查等值的总蛋白质负荷。
- 用 Tween 20(TBST、20 mM 三叶草、pH 7.4、150 mM NaCl 和 0.1% Tween 20)用三叶草缓冲盐水清洗膜,直到没有可见的染色。
- 将膜放入阻塞缓冲区(TBST溶液中的 5% 脱脂牛奶),并在室温下孵育 1 小时。
- 用 TBST 洗膜两次。
- 用主要抗磷-SMAD2(p-SMAD2;1:1000,自制 34),总SMAD2/3 1:1000和甘油醛3-磷酸脱氢酶(GAPDH;1:1000)孵化膜,一夜之间在4°C。
- 用 TBST 洗两次膜,用继发抗体对兔子或小鼠(1:5000) 孵育膜 2 小时。
- 用西 ECL 基板孵化 PVDF 膜 30 秒,并使用成像系统检测信号。
- 重复实验至少三次,以获得生物三倍。
2. 分析TGF-β引起的SMAD3依赖性转录反应
- 执行 SMAD3/SMAD4 依赖 CAGA12-露西费酶转录记者检测。
- 培养和尝试像第 1 步中描述的那样培养和尝试 MCF10A-Ras 细胞。种子细胞在5×10 4细胞/井下进入24 口井板,让细胞在一夜之间粘附。
- 播种后的第二天,用100克的TGF-β/SMAD3-可诱导(CAGA)12卢西费酶转录记者构建35和80克的β-卡拉托西达表达结构使用聚乙烯(PEI)的细胞。β-卡拉托西达酶的转位用于使不同油井之间透射效率的差异正常化。将每个实验组设置为三重组。
- 经过24小时的潜伏,饥饿的细胞与无血清DMEM高葡萄糖,并在6小时后,添加TGF-β(5 ng/mL)或配体缓冲区(4 mM HCl,0.1%BSA)作为车辆控制细胞。
- 再孵育24小时后,用预热PBS清洗电池两次。
- 加入 120 μL/井 1×裂解缓冲区,在 4 °C 下轻轻摇动盘子 20 分钟。
- 将 30 μL 的赖氨酸转移到 96 井白色测定微板的每口井中,使用发光仪测量荧光度活性。
- 将 50μL 的利酸盐转移到 96 井透明板的每口井中,以测量β-卡拉托西达酶活性。
- 将荧光酶活性正常化为β-卡拉托西达酶活性,并重复实验至少三次,以获得生物三倍。
- 使用定量实时聚合酶链反应(qRT-PCR)分析TGF-β靶基因的表达。
- 培养和尝试像第 1 步中描述的那样培养和尝试 MCF10A-Ras 细胞。种子细胞在5×105 细胞/井下进入6井板,让细胞在一夜之间粘附。
- 用TGF-β(5 ng/mL)或配体缓冲液(4 mM HCl,0.1%BSA)治疗细胞6小时,然后用1mL的PBS清洗细胞两次。
- 使用RNA隔离套件隔离总RNA。
- 使用纳米滴确定RNA浓度,并使用第一链 cDNA 合成套件使用 1 μg 的 RNA 进行 cDNA 合成。
- 使用实时 PCR 检测系统,在 10 μL 反应混合物中使用 10 倍稀释的 cDNA 执行定量实时 PCR (qRT-PCR),其中包括GAPDH(用于正常化)、SERPINE1(编码 PAI-1 蛋白质的特定人类前向和反向引物, TGF-β/SMAD目标基因),SMAD7(TGF-β/SMAD目标基因)和qPCR主混合。将每个实验组设置为三重组。
注:用于检测qRT-PCR中目标人类基因的引物序列列在 表1中。 - 使用以下qPCR反应条件:初始化,95°C 3分钟:自然,95°C 10秒;退火,60°C 30秒;和扩展,80°C 10秒;自然、退化和延长重复40次。
- 重复实验至少三次,以获得生物三倍。
3. TGF-β诱发的EMT分析
- 使用西式印迹分析 EMT 标记在蛋白质水平上的表达。
注:TGF-β诱导EMT的分析以小鼠NMuMG上皮细胞为例36,37。- 培养NMuMG细胞在37°C在DMEM高葡萄糖介质补充10%胎儿牛血清和1:100笔链。使用步骤 1 中描述的方法进行蛋白质分离和检测。
注:本实验中使用以下抗体:E-卡德林,1:1000:N-卡德林, 1:1000;蜗牛, 1:1000;斯劳格, 1:1000;图布林,1:1000(图3)。
- 培养NMuMG细胞在37°C在DMEM高葡萄糖介质补充10%胎儿牛血清和1:100笔链。使用步骤 1 中描述的方法进行蛋白质分离和检测。
- 使用步骤 2.2 中描述的定量实时 PCR 分析 mRNA 级别的 EMT 标记的表达。
注:所有用于 qRT-PCR 的鼠标引物,包括CDH1(编码 E-卡德林蛋白)、蜗牛和ZEB2(图 3)都列在表 1 中。 - 使用间接免疫荧光和直接荧光染色分析 EMT 过程。
- E-卡德林的间接免疫荧光染色
- 将无菌的 18 mm 侧方形玻璃盖片放置在 6 井板中(每口井一个盖片)。
- 种子 1×105 NMuMG 细胞与 2 mL 完整的 DMEM 每 6 井板,并允许细胞坚持过夜。
- 用附体细胞轻轻地将盖片移到新的6井板上,并在井中加入2 mL的培养介质。
- 使用TGF-β(5 ng/mL)或配体缓冲液(4 mM HCl,0.1%BSA)治疗细胞2天。
- 取出培养介质,用1mL预热PBS轻轻清洗细胞两次。
- 通过添加1 mL的4%甲醛和在室温下孵育30分钟来修复细胞。然后,用 1 mL 的 PBS 轻轻清洗细胞两次。
- 在室温下用0.1%的Triton X-100将固定细胞渗透10分钟,然后用PBS两次清洗细胞。
- 在室温下用 5% BSA 在 PBS 中阻断细胞 1 小时,然后用 PBS 两次清洗细胞。
- 将针对 E-cadherin 的主要抗体(PBS 中稀释的 1:1000)添加到每个盖夹的顶部,并在室温下孵育 1 小时。
- 取出原发性抗体,用 PBS 洗三次盖夹。
- 将 Alexa Fluor 555 次要抗体(PBS 中稀释 1:500)添加到每个盖片的顶部,并在室温下孵育 1 小时,同时用铝箔覆盖,以防止光线。
- 取出次要抗体,用 PBS 洗三次盖夹。
- 使用装有 4+,6-diamidino-2-苯酚 (DAPI) 的安装介质将盖片(朝下的细胞)安装到玻璃滑梯上,并将安装的滑梯存放在 4 °C 的盒子中,防止光线照射。
- 用SP8心目显微镜观察染色。
- 长丝(F)-作用素的直接荧光染色。
- 按照步骤 3.3.1.1 准备样品。到3.3.1.9。
- 在黑暗中室温下加入亚历克萨氟488法洛丁(1:1000)1小时,使纤维素(F-actin)可视化,从而玷污细胞。
- 用PBS清洗电池三次。
- 使用 DAPI 安装介质将盖片安装到玻璃滑梯上,并使用 SP8 共分显微镜拍摄图像。
- E-卡德林的间接免疫荧光染色
结果
TGF-β信号分析
TGF-β信号的关键步骤是 T+RI 激酶38,39在 SSXS 主题 (图 2)中两个最卡盒端血清残留物的磷化。为了调查TGF-β信号响应,我们进行了磷酸SMAD2的西方印迹。在早熟的人类乳房MCF10A-Ras细胞中,SMAD2的磷酸化在TGF-β刺激下显著增加1小时,而总SMAD2/3的表达不受TGF-β治疗的影响(图4A)。通过使用TGF-β诱导的SMAD3/4驱动CAGA-luc转录记者检测,我们发现TGF-β与未处理的细胞(图4B)相比,在MCF10A-Ras细胞系中明显诱导了荧光酶。此外,我们观察到,TGF-β(包括SMAD7和SERPINE1(编码PAI-1蛋白)的具有良好特征的直接转录基因靶点在TGF-β处理的MCF10A-Ras细胞(图4C)中得到了高度表达。
TGF-β诱发的EMT分析
我们用各种方法评估了TGF-β诱导的EMT,如形态变化、EMT标记物在mRNA和蛋白质水平上的表达以及EMT标记物36的免疫荧光染色。用TGF-β治疗1天和2天的NMuMG上皮细胞从经典的上皮形态学转变为主轴状的元状状形态学,如相位对比显微镜(图5A)所示。根据形态变化,我们观察到TGF-β治疗导致间质标记物的蛋白质表达增加,包括N-卡德林、蜗牛和Slug37(图5B)。相比之下,上皮标记物E-cadherin在经过2天的TGF-β治疗(图5B)后,在NMuMG细胞中受到降低调节。此外,我们还进行了定量实时聚合酶链反应(qRT-PCR),以研究EMT标记物的基因表达。CDH1(编码E-卡德林蛋白)显著减少,而与未经处理的细胞(图5C)相比,TGF-β刺激后,SNAIL和锌指E盒结合的顺势箱2(ZEB2)等间质标记显著增加。TGF-β诱发的NMuMG细胞中的EMT通过E-卡德林的免疫荧光染色进一步得到证实。在TGF-β刺激2天后,NMuMG细胞表达的E-cadherin比未诱导对照组的细胞少,通过结肠显微镜(图5D)分析。此外,TGF-β存在的NMuMG细胞形成了更多的作用素应力纤维,如心包显微镜(图5E)所示。
SB431542 和 GW788388 抑制 TGF-β信号和 TGF-β诱发的 EMT
SB431542 是 T+RI 激酶领域的 ATP 竞争抑制剂,也称为活性素受体样激酶 5 (ALK5),而 GW788388 抑制 T+RI 和 TRII 激酶活性。这两种抑制剂可以抑制TGF-β受体信号40。因此,我们在TGF-β的存在下,用不同浓度的GW788388治疗NMuMG细胞1小时。不出所料,GW788388以剂量依赖的方式抑制TGF-β诱导的SMAD2磷酸化(图6A)。此外,SMAD2的TGF-β介导磷化被SB431542治疗(图6A)阻断。磷酸 SMAD2/3 与 SMAD4 形成异质复合体,并转移到原子核中以调节目标基因的转录。因此,我们通过对SMAD2/3的免疫荧光染色,调查了SMAD2/3细胞在NMuMG细胞中的迁移。数据表明,SB431542和GW788388显著抑制了TGF-β引起的核转移和NMuMG细胞中SMAD2/3的积累(图6B)。此外,在EMT中涉及的重要TGF-β靶基因的mRNA表达水平中也观察到SB431542和GW788388的抑制作用,包括PAI-1、蜗牛、E-卡德林和纤维素(图6C)。这些数据表明,SB431542 和 GW788388 阻止了 TGF-β信号和 TGF-β诱导的 EMT。
中性乳腺癌细胞转位分析
EMT在增强癌症细胞可塑性方面起着至关重要的作用,并导致治疗耐药性的发展。癌细胞可塑性可以通过一种跨分化方法直接针对和抑制,如强迫脂肪生成30。我们使用Py2T穆林乳腺癌细胞,这是从小鼠乳腺肿瘤病毒-多瘤中肿瘤抗原(MMTV-PyMT)转基因小鼠的乳腺衍生,作为EMT诱发的癌细胞可塑性的细胞模型。根据既定的协议41,我们用抗糖尿病药物罗西格利塔酮治疗EMT衍生的Py2T穆林乳腺癌细胞10天,以诱导腺生成。通过使用油红色 O 染色可视化脂质液滴来评估脂肪生成。在经过罗西利酮治疗的Py2T穆林乳腺癌细胞(图7)中很容易发现脂肪细胞,这表明仅用罗利酮治疗就足以促进EMT衍生的乳腺癌细胞转异成脂肪细胞。
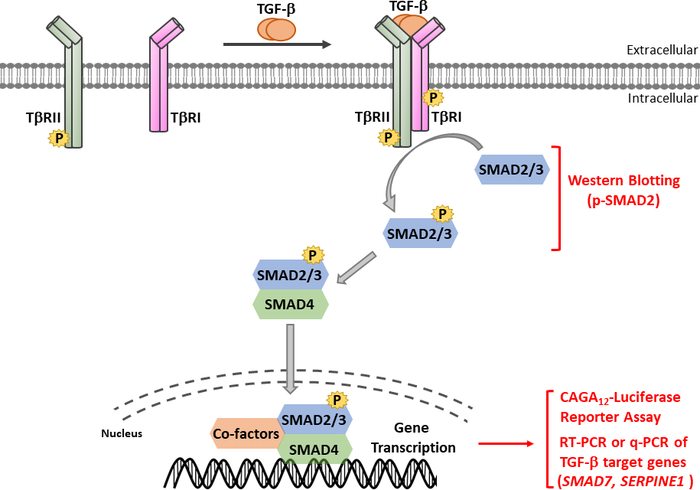
图1:TGF-β/SMAD信号。TGF-β信号启动与TGF-β与TGF-β型II型受体(T+RII)的结合,T+RII,一种构成活性激酶,磷酸酯TGF-β I型受体(T+RI)。然后,激活T+RI激酶磷酸盐SMAD2/3。一种含有SMAD2 SSS图案的肽,带有两个卡盒末端磷酸残留物,用于获得多克隆抗血清识别磷-SMAD2(p-SMAD2)。因此,西方印迹对p-SMAD2表达式的分析可用于确定TGF-β信号通路的激活。磷酸 SMAD2/3 可与 SMAD4 形成异质复合体,然后转移到原子核中以调节转录响应。用于TGF-β靶基因(如SMAD7和SERPINE1(编码PAI-1蛋白)的mRNA表达的CAGA12-luciferase记者检测和定量实时PCR(qRT-PCR),可用于分析TGF-β诱导的SMAD3依赖转录反应。请点击这里查看此数字的较大版本。
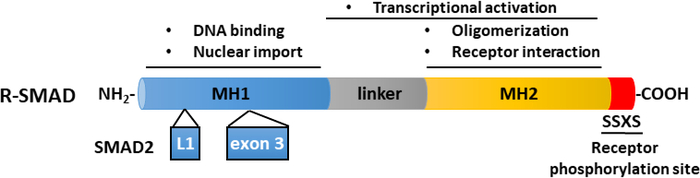
图2:R-SMAD(SMAD2和SMAD3)的示意图结构。MH1(蓝色)和MH2(黄色)域在R-SMAD中保存,但链接区域(灰色)不保存。SMAD3 的 MH1 域具有 DNA 结合的图案,而 SMAD2 不能直接结合 DNA,因为在其 MH1 域中插入(exon 3)。MH2域调解SMAD寡头化、与TGF-β受体的相互作用以及蛋白质结合,并参与转录调节。SMAD2 和 SMAD3 可以通过 SSXS 主题的磷化(红色)在其 C 术语中激活。 请点击这里查看此数字的较大版本。
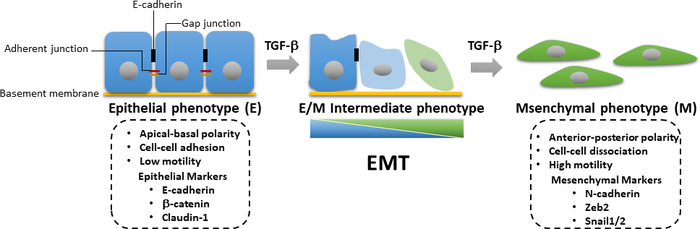
图3:TGF-β诱发的EMT。在TGF-β诱发的上皮-间质过渡(EMT)中,细胞经历上皮损失和获得间质特征,增强细胞运动性和入侵能力。EMT 的诱导导致中微标记(如 N-cadherin、Zeb2 和蜗牛 1/2)的表达,以及上皮标记(包括 E-卡德林、β-卡特宁和克劳丁-1)的下部调节。上皮/间质(E/M)特征的累积损失或增益导致细胞以可逆的方式进入中间状态。 请点击这里查看此数字的较大版本。
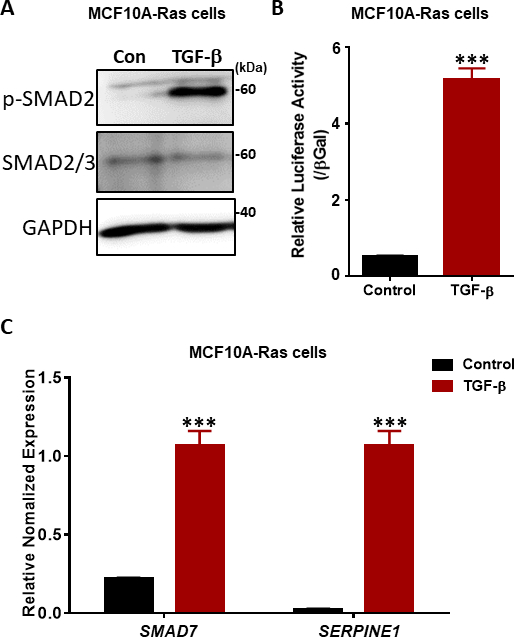
图4:TGF-β MCF10A-Ras细胞中的信号响应。(A) MCF10A-Ras细胞在有或没有TGF-β(2.5 ng/mL)的情况下进行了1小时的治疗,细胞裂解剂用于磷酸 SMAD2 (p-SMAD2)、总 SMAD2/3 和 GAPDH(作为加载控制)。大小标记显示在右侧。康:没有TGF-β治疗的对照组。(B) 使用MF10A-Ras细胞中依赖SMAD3-SMAD4依赖的CAGA 12-露西费酶(LUC)转录记者对TGF-β(5 ng/mL)活性进行分析。这些值已规范化为β-卡拉托西达酶(βGal)活动。数据表示为平均±s.d、n=3。学生t测试,***P≤0.001(C) qRT-PCR分析TGF-β目标基因SMAD7和SERPINE1(编码PAI-1蛋白)在MCF10A-Ras细胞处理TGF-β(2.5 ng/mL)6小时。GAPDH被用作内部控制。数据表示为平均±s.d、n=3。学生考试,***P≤0.001。请点击这里查看此数字的较大版本。
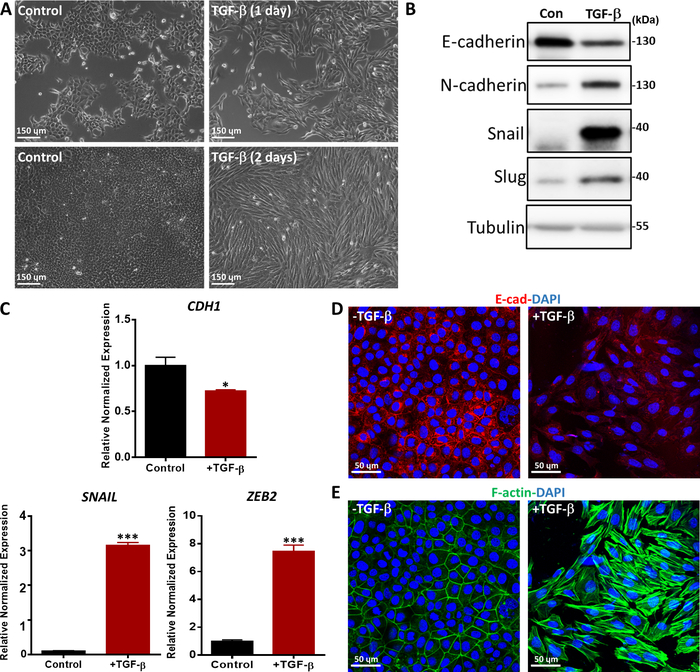
图5:NMuMG细胞中的TGF-β诱导EMT。(A) 用TGF-β(2.5 ng/mL)治疗1天或2天的NMuMG细胞的形态学。在TGF-β的存在下,NMuMG细胞被转移到一个间质表型。比例尺条 = 150μm(B) NMuMG 细胞在 2 天内使用或不使用 TGF-β(5 ng/mL),并通过西方印迹分析 EMT 标记。大小标记如右侧所示。康:没有TGF-β治疗的对照组。(C) 用TGF-β(5 ng/mL)治疗2天的NMuMG细胞中的EMT标记物(CDH1( 编码E-卡德林蛋白)、蜗牛 和 ZEB2) 的基因表达分析。 GAPDH 被用作内部控制。结果表示为平均±s.d.,n=3。学生的 t 测试, *P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001.(D) NMuMG细胞被免疫荧光染色,以检测上皮标记E-卡德林(红色)的表达后,TGF-β(2.5 ng/mL)治疗2天。核与DAPI(蓝色)反污染。图像是用心目显微镜拍摄的。比例尺棒 = 50μm(E) NMuMG 细胞被荧光素-法洛丁(绿色)染色,以可视化 F-actin。核与DAPI(蓝色)反污染。缩放条 = 50μm。 请单击此处查看此数字的较大版本。

图6:SB431542和GW788388抑制了TGF-+信号和TGF-β诱导的EMT。(A) NMuMG细胞在TGF-β(5 ng/mL)存在或缺席的情况下,使用10微米SB431542(SB)或指示浓度GW788388(GW)治疗1小时。细胞裂解剂用于p-SMAD2、SMAD2/3和GAPDH。(B) NMuMG细胞在TGF-β存在或不存在5微克/mL的情况下,接受5微米SB431542(SB)或10微米GW788388(GW)的治疗,为期1小时,并被免疫荧光染色,以检测SMAD2/3(绿色)的核转移。图像是用心目显微镜拍摄的。(C) TGF-β靶基因(包括PAI-1)和编码EMT标记的基因(包括蜗牛、E-卡德林和纤维素)的表达,在SB或GW治疗和TGF-β刺激48小时后,通过NMuMG细胞的反向转录酶聚合酶链反应(RT-PCR)进行分析。GAPDH 充当负载控制。控制表示未经处理的细胞。这个数字已经从彼得森等人修改。34获得出版商的许可。请点击这里查看此数字的较大版本。
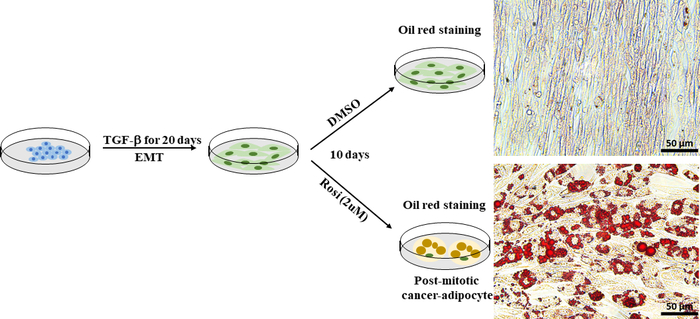
图7:EMT衍生的Py2T穆林乳腺癌细胞可以诱导分化成脂肪细胞。Py2T穆林乳腺癌细胞用2 ng/mL TGF-β刺激20天,以诱导完整的EMT。然后,这些细胞要么用DMSO作为车辆控制,要么用玫瑰花酮(2 μM)治疗10天,以分化间质癌细胞并诱导腺生成。媒体每2天更换一次。经过10天的治疗,细胞被涂上油红色O.Scale bar =50μm。 请点击这里查看此数字的较大版本。
| 物种 | 基因名称 | 向前 (5' 到 3') | 反向 (5' 到 3') | ||
| 人 | 盖普德 | 特加卡卡特格塔格 | 格卡特加格 | ||
| 斯马德7 | 特卡加特格特克 | 格特加特加特克 | |||
| 塞尔皮内1 | 卡卡特卡加格卡特 | 卡茨格特加特克 | |||
| 鼠 | 盖普德 | 特加格特 | 阿加特加特 | ||
| CDH1 | 阿加加格特加格特 | 加加特卡特加特 | |||
| 蜗牛 | 卡格卡特克特 | 格加 | |||
| 泽布2 | 泰特克塔格塔格 | 特克特卡特卡特 | |||
表1:用于qRT-PCR的底漆。
讨论
TGF-β/SMAD信号在乳腺癌进展中起着关键作用,因为它可以通过诱导EMT7促进乳腺癌细胞的侵入性和转移。在这里,我们描述了一个合乎逻辑的工作流程,以调查TGF-β启动的信号,从受体诱导的SMAD激活到SMAD介导的转录和生物反应。我们首先描述了对SMAD2磷酸化的分析,继续用TGF-β诱导的SMAD3依赖性转录反应和基因和蛋白质水平的EMT标记表达来分析TGF-β/SMAD信号响应,最后检查了TGF-β诱导的EMT。我们使用CAGA12-luciferase转录报告器,其中包含来自PAI-1促进器的CAGA信箱,以监测TGF-β/SMAD信号通路35的活动。本报记者构建需要 SMAD3 和 SMAD4 进行激活。先前的研究表明,SMAD4的击倒减弱了TGF-β引起的CAGA12-露西费酶活性37。除了记者的检测,确定内源性SMAD(包括SMAD2和SMAD3)的磷化状态是调查TGF-β信号响应的另一种方式。事实上,TGF-β家族的其他成员,如生长和分化因子(GDF)-8/肌他汀和GDF-9,也通过SMAD2/3蛋白质通过T+RI42、43、44来传递信号。除了CAGA12-露西费拉塞记者,几个类似的记者已经被用来检测TGF-β信号的激活。例如,TGF-β、活性素和BMP45可以有效地诱导具有JunB推广器响应元素的转录 (SBE)4-Lux记者。
西方的印迹和qPCR用于分析TGF-β诱导的EMT,这是研究上皮标记(即E-卡德林)和间质标记(即N-卡德林、蜗牛、斯劳格和Zeb2)表达的经典方法。我们还对E-cadherin进行了间接免疫荧光染色和F-actin的直接荧光染色。这些检测进一步验证了TGF-β治疗后细胞的间质表型。免疫荧光染色的限制是细胞在用抗体和成像物孵化前需要修复,很难研究活细胞EMT标记表达的变化。最近,EMT记者细胞系的设计,如A549肺腺癌-维门汀-RFP,通过红荧光蛋白(RFP)标记的维他汀的表达,能够实时监测上皮细胞向间质细胞的转化。该平台可用于药物筛选和新药开发46。LifeAct染料,一种17-氨基酸肽,可以染色活细胞中的F-actin结构,正在成为一个有价值的工具,可实时可视化活性细胞骨骼,而不会干扰细胞过程47。在这项研究中,我们使用了两种小分子抑制剂,SB431542和GW788388,来验证它们对TGF-β信号和TGF-β诱导EMT的抑制作用。值得注意的是,GW788388 有力地抑制了 T+RI 和 T+RI 活动,而 SB431542 仅对 T+RI(以及 ALK4 和 ALK7)具有抑制作用。先前的研究表明,GW788388在体内比SB43154240更有效。除EMT抑制外,GW788388还减少了纤维化标记物在肾脏中的表达,糖尿病小鼠的GW788388的口服治疗明显减少了25、48。
EMT在促进癌细胞可塑性方面起着至关重要的作用,并导致耐药性和转移性。因此,提出了用特定细胞毒性药物50或通过间质到上皮过渡(MET)51诱导再衍生的EMT衍生细胞作为克服癌细胞转移和治疗耐药性的方法。然而,MET有助于传播癌细胞在遥远的器官52的增殖,这可能会适得其反,当使用EMT的治疗性回归。最近,一项新的研究报告了一种治疗性异化方法,直接针对EMT衍生的乳腺癌细胞分化成脂肪细胞30。伊沙伊-罗宁等人的研究。al.30使用 Py2T 穆林上皮癌细胞,这些癌细胞经过向间质细胞的过渡,以响应 TGF-β的长期治疗。他们证明,玫瑰花酮与MEK抑制剂相结合,增强了上皮分化和脂肪生成。然而,我们发现,仅罗西利酮就足以诱导间质Py2T穆林细胞转异成脂肪细胞。
总之,本研究中使用的方法提供了一个合乎逻辑的工作流程,用于研究TGF-β信号和TGF-β诱发的EMT。这两种抑制剂,SB431542和GW788388,可以阻止TGF-β引起的反应和EMT。此外,我们还证明,单单在某些TGF-β诱发的间质性乳腺癌细胞中,单单就诱导了双丙酮的产生。虽然我们只使用几个乳腺癌细胞系来研究TGF-β反应,但这里描述的方法可以推断为其他(癌症)细胞。在这里,我们使用各种TGF-β浓度来诱导细胞反应。在大多数细胞类型中,TGF-β在0.01-10 ng/mL53 的浓度范围内发挥其生物活性,并以剂量响应模式诱导信号。在原发性内皮细胞(包括牛主动脉内皮细胞)中,TGF-β诱导磷酸 SMAD2 在 0.025 ng/mL 下的实质性表达,达到最大值 0.25 ng/mL,并维持在这一水平,以响应较高的浓度53。在我们的研究中,我们使用高浓度的TGF-β(5 ng/mL)在MCF10A-Ras细胞中进行转录记者检测,以获得强烈的反应。SMAD2磷化和靶向基因表达可以通过低剂量的TGF-β诱导:因此,我们使用2.5 ng/mL TGF-β来治疗细胞。然而,最合适的工作浓度取决于细胞类型和估计效果。为了确定TGF-β的最佳浓度,建议用不同剂量(从低到高)治疗细胞。
披露声明
作者没有什么可透露的。
致谢
我们感谢中国奖学金理事会对J.Z.和荷兰癌症基因组中心(CGC)的支持。Nl) 到 P. t. d.
材料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 18 mm-side square glass coverslips | Menzel Gläser | 631-1331 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-1200 | |
| Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | |
| Alexa Fluor 555 secondary antibody | Thermo Fisher Scientific | A-21422 | |
| Anti-E-cadherin antibody | BD Biosciences | 610181 | |
| anti-glyceraldehyde 3-phosphate dehydrogenase(GAPDH) antibody | Merck Millipore | MAB374 | |
| Anti-N-cadherin antibody | BD Biosciences | 610920 | |
| Anti-Slug antibody | Cell Signaling Technology | 9585 | |
| anti-SMAD2/3 antibody | Becton Dickinson | 610842 | |
| Anti-Snail antibody | Cell Signaling Technology | 3879 | |
| Anti-Tubulin antibody | Cell Signaling Technology | 2148 | |
| Bovine Serum Albumin | Sigma-Aldrich | A2058 | |
| Cholera enterotoxin | Sigma-Aldrich | C8052 | |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| DMEM-high glucose | Thermo Fisher Scientific | 11965092 | |
| DMEM-high glucose medium | Thermo Fisher Scientific | 11965092 | |
| Dulbecco’s modified Eagle’s medium (DMEM)/F12 | Thermo Fisher Scientific | 11039047 | |
| epidermal growth factor (EGF) | Merck Millipore | 01-107 | |
| Fetal bovine serum (FBS) | BioWest | S1860-500 | |
| GoTaq qPCR Master Mix | PROMEGA | A600X | |
| Horse serum | Thermo Fisher Scientific | 26050088 | |
| Hydrocortisone | Sigma-Aldrich | H0135 | |
| Insulin | Sigma-Aldrich | 91077C | |
| Mini Protease Inhibitor Cocktail | Roche | 11836153001 | |
| NucleoSpin RNA II kit | BIOKE´ | 740955 | |
| Penicillin-streptomycin (Pen-Strep) | Thermo Fisher Scientific | 15140148 | |
| Polyethylenimine (PEI) | Polyscience | 23966 | |
| Polyvinylidene difluoride (PVDF) membrane | Merck Millipore | IPVH00010 | |
| Ponceau S solution | Sigma-Aldrich | P7170 | |
| RevertAid First Strand cDNA Synthesis Kit | Thermo Fisher Scientific | K1621 | |
| Rosiglitazone | Sigma-Aldrich | 557366-M | |
| Skimmed milk | Campina: Elk | ||
| Equipment | |||
| ChemiDoc Imaging System | Bio-Rad | 17001402 | |
| CFX Connect Detection System | Bio-Rad | 1855201 | |
| Luminometer | Perkin Elmer | 2030-0050 | |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ND-2000 |
参考文献
- Tzavlaki, K., Moustakas, A. TGF-β Signaling. Biomolecules. 10 (3), (2020).
- Hao, Y., Baker, D., Ten Dijke, P. TGF-β-Mediated Epithelial-Mesenchymal Transition and Cancer Metastasis. International Journal of Molecular Sciences. 20 (11), (2019).
- Morikawa, M., Derynck, R., Miyazono, K. TGF-β and the TGF-β Family: Context-Dependent Roles in Cell and Tissue Physiology. Cold Spring Harbor Perspectives in Biology. 8 (5), (2016).
- Derynck, R., Akhurst, R. J. Differentiation plasticity regulated by TGF-β family proteins in development and disease. Nature Cell Biology. 9 (9), 1000-1004 (2007).
- Massague, J. How cells read TGF-β signals. Nature Reviews Molecular Cell Biology. 1 (3), 169-178 (2000).
- Seoane, J., Gomis, R. R. TGF-β Family Signaling in Tumor Suppression and Cancer Progression. Cold Spring Harbor Perspectives in Biology. 9 (12), (2017).
- Colak, S., Ten Dijke, P. Targeting TGF-β Signaling in Cancer. Trends in Cancer. 3 (1), 56-71 (2017).
- Suriyamurthy, S., Baker, D., ten Dijke, P., Iyengar, P. V. Epigenetic Reprogramming of TGF-β Signaling in Breast Cancer. Cancers (Basel). 11 (5), (2019).
- Drabsch, Y., Ten Dijke, P. TGF-β signalling and its role in cancer progression and metastasis). Cancer and Metastasis Reviews. 31 (3-4), 553-568 (2012).
- Goumans, M. J., Ten Dijke, P. TGF-β Signaling in Control of Cardiovascular Function. Cold Spring Harbor Perspectives in Biology. 10 (2), (2018).
- Robertson, I. B., Rifkin, D. B. Regulation of the Bioavailability of TGF-β and TGF-β-Related Proteins. Cold Spring Harbor Perspectives in Biology. 8 (6), (2016).
- Robertson, I. B., et al. Latent TGF-β-binding proteins. Matrix Biology. 47, 44-53 (2015).
- Khan, Z., Marshall, J. F. The role of integrins in TGF-β activation in the tumour stroma. Cell and Tissue Research. 365 (3), 657-673 (2016).
- Jenkins, G. The role of proteases in transforming growth factor-β activation. The International Journal of Biochemistry & Cell Biology. 40 (6-7), 1068-1078 (2008).
- Tran, D. Q., et al. GARP (LRRC32) is essential for the surface expression of latent TGF-β on platelets and activated FOXP3+ regulatory T cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (32), 13445-13450 (2009).
- Stockis, J., Colau, D., Coulie, P. G., Lucas, S. Membrane protein GARP is a receptor for latent TGF-β on the surface of activated human Treg. European Journal of Immunology. 39 (12), 3315-3322 (2009).
- Wang, R., et al. GARP regulates the bioavailability and activation of TGF-β. Molecular Biology of the Cell. 23 (6), 1129-1139 (2012).
- Vander Ark, A., Cao, J., Li, X. TGF-β receptors: In and beyond TGF-β signaling. Cellular Signalling. 52, 112-120 (2018).
- Heldin, C. H., Miyazono, K., ten Dijke, P. TGF-β signalling from cell membrane to nucleus through SMAD proteins. Nature. 390 (6659), 465-471 (1997).
- ten Dijke, P., Hill, C. S. New insights into TGF-β-Smad signalling. Trends in Biochemical Sciences. 29 (5), 265-273 (2004).
- Miyazono, K. TGF-β signaling by Smad proteins. Cytokine & Growth Factor Reviews. 11 (1-2), 15-22 (2000).
- Yu, Y., Feng, X. H. TGF-β signaling in cell fate control and cancer. Current Opinion in Cell Biology. 61, 56-63 (2019).
- Zhang, Y. E. Non-Smad pathways in TGF-β signaling. Cell Research. 19 (1), 128-139 (2009).
- Katsuno, Y., Lamouille, S., Derynck, R. TGF-β signaling and epithelial-mesenchymal transition in cancer progression. Current Opinion in Oncology. 25 (1), 76-84 (2013).
- Lamouille, S., Xu, J., Derynck, R. Molecular mechanisms of epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. 15 (3), 178-196 (2014).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. 21 (6), 341-352 (2020).
- Zhang, Y., Weinberg, R. A. Epithelial-to-mesenchymal transition in cancer: complexity and opportunities. Frontiers in Medicine. 12 (4), 361-373 (2018).
- Brabletz, T., Kalluri, R., Nieto, M. A., Weinberg, R. A. EMT in cancer. Nature Reviews Cancer. 18 (2), 128-134 (2018).
- Ocana, O. H., et al. Metastatic colonization requires the repression of the epithelial-mesenchymal transition inducer Prrx1. Cancer Cell. 22 (6), 709-724 (2012).
- Ishay-Ronen, D., et al. Gain Fat-Lose Metastasis: Converting Invasive Breast Cancer Cells into Adipocytes Inhibits Cancer Metastasis. Cancer Cell. 35 (1), 17-32 (2019).
- Smith, C. J., Osborn, A. M. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiology Ecology. 67 (1), 6-20 (2009).
- Bustin, S. A., Mueller, R. Real-time reverse transcription PCR (qRT-PCR) and its potential use in clinical diagnosis. Clinical Science. 109 (4), 365-379 (2005).
- Sundqvist, A., et al. JUNB governs a feed-forward network of TGF-β signaling that aggravates breast cancer invasion. Nucleic Acids Research. 46 (3), 1180-1195 (2018).
- Persson, U., et al. The L45 loop in type I receptors for TGF-β family members is a critical determinant in specifying Smad isoform activation. FEBS Letters. 434 (1-2), 83-87 (1998).
- Dennler, S., et al. Direct binding of Smad3 and Smad4 to critical TGF-β-inducible elements in the promoter of human plasminogen activator inhibitor-type 1 gene. The EMBO Journal. 17 (11), 3091-3100 (1998).
- Piek, E., Moustakas, A., Kurisaki, A., Heldin, C. H., ten Dijke, P. TGF-β type I receptor/ALK-5 and Smad proteins mediate epithelial to mesenchymal transdifferentiation in NMuMG breast epithelial cells. Journal of Cell Science. 112, Pt 24 4557-4568 (1999).
- Deckers, M., et al. The tumor suppressor Smad4 is required for transforming growth factor-β-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells. Cancer Research. 66 (4), 2202-2209 (2006).
- Souchelnytskyi, S., et al. Phosphorylation of Ser465 and Ser467 in the C terminus of Smad2 mediates interaction with Smad4 and is required for transforming growth factor-β signaling. Journal of Biological Chemistry. 272 (44), 28107-28115 (1997).
- Abdollah, S., et al. TβRI phosphorylation of Smad2 on Ser465 and Ser467 is required for Smad2-Smad4 complex formation and signaling. Journal of Biological Chemistry. 272 (44), 27678-27685 (1997).
- Petersen, M., et al. Oral administration of GW788388, an inhibitor of TGF-β type I and II receptor kinases, decreases renal fibrosis. Kidney International. 73 (6), 705-715 (2008).
- Gubelmann, C., et al. Identification of the transcription factor ZEB1 as a central component of the adipogenic gene regulatory network. Elife. 3, 03346(2014).
- Nickel, J., Ten Dijke, P., Mueller, T. D. TGF-β family co-receptor function and signaling. Acta Biochimica et Biophysica Sinica. 50 (1), 12-36 (2018).
- Mazerbourg, S., et al. Growth differentiation factor-9 signaling is mediated by the type I receptor, activin receptor-like kinase 5. Molecular Endocrinology. 18 (3), 653-665 (2004).
- Rebbapragada, A., Benchabane, H., Wrana, J. L., Celeste, A. J., Attisano, L. Myostatin signals through a transforming growth factor-β-like signaling pathway to block adipogenesis. Molecular and Cellular Biology. 23 (20), 7230-7242 (2003).
- Jonk, L. J., Itoh, S., Heldin, C. H., ten Dijke, P., Kruijer, W. Identification and functional characterization of a Smad binding element (SBE) in the JunB promoter that acts as a transforming growth factor-β, activin, and bone morphogenetic protein-inducible enhancer. Journal of Biological Chemistry. 273 (33), 21145-21152 (1998).
- Thiery, J. P., Sleeman, J. P. Complex networks orchestrate epithelial-mesenchymal transitions. Nature Reviews Molecular Cell Biology. 7 (2), 131-142 (2006).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5 (7), 605-607 (2008).
- Gellibert, F., et al. Discovery of 4-{4-[3-(pyridin-2-yl)-1H-pyrazol-4-yl]pyridin-2-yl}-N-(tetrahydro-2H- pyran-4-yl)benzamide (GW788388): a potent, selective, and orally active transforming growth factor-β type I receptor inhibitor. Journal of Medicinal Chemistry. 49 (7), 2210-2221 (2006).
- Ishay-Ronen, D., Christofori, G. Targeting Cancer Cell Metastasis by Converting Cancer Cells into Fat. Cancer Research. 79 (21), 5471-5475 (2019).
- Gupta, P. B., et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening. Cell. 138 (4), 645-659 (2009).
- Pattabiraman, D. R., et al. Activation of PKA leads to mesenchymal-to-epithelial transition and loss of tumor-initiating ability. Science. 351 (6277), (2016).
- Gao, D., et al. Myeloid progenitor cells in the premetastatic lung promote metastases by inducing mesenchymal to epithelial transition. Cancer Research. 72 (6), 1384-1394 (2012).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-β type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
Erratum
Formal Correction: Erratum: Studying TGF-β Signaling and TGF-β-induced Epithelial-to-mesenchymal Transition in Breast Cancer and Normal Cells
Posted by JoVE Editors on 12/15/2020. Citeable Link.
An erratum was issued for: Studying TGF-β Signaling and TGF-β-induced Epithelial-to-mesenchymal Transition in Breast Cancer and Normal Cells. NMuMG was mislabeled as cancer cells.
NMuMG cells are non-transformed epithelial breast cells established from a mouse mammary gland. NMuMG cells are frequently used as a model system to investigate TGF-β-induced epithelial to mesenchymal transition (EMT). EMT is induced by TGF-β in premalignant human MCF 10A-RAS (M2) cells and mouse MMTV-PyMT breast cancer cell line. The article has been updated to reflect this.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。