Method Article
乳がんおよび正常細胞におけるTGF-βシグナル伝達とTGF β誘発性上皮間葉間質転移の研究
Erratum Notice
要約
このシグナル経路に関与するタンパク質および遺伝子発現を研究することにより、TGF-βシグナル伝達およびTGF β誘導EMTを調べる系統的ワークフローについて述べる。その方法としては、ウェスタンブロッティング、ルシファーゼレポーターアッセイ、qPCR、免疫蛍光染色法などがあります。
要約
増殖因子β(TGF-β)の転換は、細胞間通信において重要な役割を果たす分泌された多機能因子である。TGF-βシグナル伝達の摂動は、乳癌につながることができます。.TGF-βは、特異なセリン/スレオンニンキナーゼドメインを含む特異的な細胞表面TGF-β型I型およびII型受容体(すなわち、TβRIおよびTβRII)を介した増殖および分化に対するその影響を引き出す。TGF誘導型ヘテロマー複合体形成 β時に、活性化TβRIはSMAD2およびSMAD3をリン酸化することによって細胞内シグナル伝達を惹起する。これらの活性化されたSMAは、SMAD4とヘロメリック複合体を形成し、プラスミノーゲン活性化阻害剤1を含む特定の標的遺伝子を調節する(PAI-1、SERPINE1遺伝子によってコードされる)。上皮間葉転移(EMT)の誘導により、原発部位または遠くの部位での植民地化中に上皮癌細胞が侵襲的表現型を得て腫瘍の進行を促進する。TGF-βは、EMTを駆動することにより、乳癌の浸潤の強力な誘導剤として機能します。ここでは、TGF-βシグナル伝達およびEMT応答を、前悪性ヒトMCF10A-RAS(M2)細胞およびマウスNMuMG上皮細胞を例に用いて調べる系統的方法について述べる。ウエスタンブロッティングによるTGF β誘導SMAD2リン酸化、SMAD3/SMAD4依存性転写活性を定量リアルタイムポリメラーゼ連鎖反応(qRT-PCR)によるルシファーゼレポーター活性およびSERPINE1標的遺伝子発現を用いて決定する方法について説明する。さらに、E-カドヘリン βの形態、上皮および間葉マーカー発現、糸状アクチン染色および免疫蛍光染色の変化を測定することによってTGF誘導EMTを調べる方法が記載されている。2つの選択的小分子TGF-β受容体キナーゼ阻害剤、GW788388およびSB431542は、TGF β誘導SMAD2リン酸化、標的遺伝子およびEMTマーカー発現の変化を阻止するために使用された。また、間葉乳房Py2Tマウス上皮腫瘍細胞の異分化について、葉細胞に説明する。乳がんにおけるTGF β誘導シグナル伝達およびEMTを調べる方法は、乳癌の新しい治療アプローチに寄与する可能性がある。
概要
サイトカイン変換成長因子-β(TGF-β)とは、TGF-βs(すなわち、TGF-β1、-β2および-β3)、骨形態形成タンパク質(BMP)およびアクチビン1、2を含む構造的および機能的に関連する調節ポリペプチドの大規模な群のプロトタイプである。これらのサイトカインはすべて、胚発生および組織および臓器恒常性維持において重要な役割を果たす3.TGF-βの誤調節は、癌4、5を含む多種多様な疾患を引き起こす可能性があります。TGF-βは癌進行において複雑で二重の役割を果たす:正常および前悪性の上皮細胞において、TGF-βは増殖を阻害し、アポトーシス6、7を誘導することによって腫瘍抑制剤として振る舞う。ただし、 腫瘍進行後期において、腫瘍遺伝子の活性化または腫瘍抑制剤遺伝子の喪失によって細胞増殖応答が遮断されると、TGF-βは癌細胞における上皮間葉転移(EMT)を促進することによって腫瘍増強剤として作用し、それによって癌細胞の浸潤および転移を可能にし、腫瘍微小環境における細胞に作用し、血管新生を刺激する。
TGF-βは、成熟したカルボキシ末端TGF-βおよび遅延関連ペプチド(LAP)11を含む不活性前駆体分子として分泌される。この小さな複合体は、潜在的なTGF β結合タンパク質(LTBP)12によって共有結合することができる。成熟したTGF-βの放出は、LAPを切断する特定のプロテアーゼの作用によって、または、インテグリン依存プロセス13、14におけるLAPの機械的引っ張りによって媒介することができる。LTBPに加えて、糖タンパク質A反復性が主に(GARP)は、制御性T細胞(Tregs)の表面上で高発現し、TGF-β 15,16の活性化を調節する上でLTBPと同様の役割を果たしている。GARPは、二硫化結合および非共価関連を介して潜在的なTGF-βに直接結合する。GARP/TGF-β複合体からのTGF-βの活性化には、インテグリン17が必要です。成熟したTGF-βは、TGF-βセリン/スレオンニンキナーゼ受容体、すなわちTGF-β型I(TβRI)およびTGF-β型II(TβRII)受容体18に結合し、シグナル伝達を開始する。TβRIIへのTGF-βの結合は、TβRIの募集およびヘロマー複合体の形成を促進する。続いて、TβRIは、短いグリシンおよびセリンが豊富な(GS)モチーフでセリンおよびスレオニン残基上のTβRIIキナーゼによってリン酸化され、その活性化19、20をもたらす。活性化すると、活性化TβRIは、その基質をリクルートし、リン酸化する:SMAD2およびSMAD3を含む2つの受容体特異的SMA(R-SMAD)(図1)。R-SMAは、プロリンが豊富なリンカー領域によって分離された2つのいわゆるマッドホモロジードメイン、MH1およびMH2と同様の全体的な構造を共有する(図2)。SMAD3のMH1ドメイン内のDNA結合モチーフはSMAD2とSMAD3の間で保存されておらず、SMAD2はMH1ドメイン(エキソン3およびL1)に2回挿入されているためDNAを直接結合することができない。SMAD2およびSMAD3は、それらのC末語におけるSSXSモチーフのリン酸化によって活性化することができる(図2)。リン酸化SMAD2/3は、一般的なSMADメディエーターSMAD4とのヘロマー錯体を形成し、標的遺伝子の転写を調節するために核に転写する(図1)7、21。この正準SMADシグナル伝達経路は、正確に調節され、細胞運命および腫瘍細胞転移および浸潤の調節などの特異的な細胞および組織応答を生成する22。TGF-β-SMADシグナル伝達に加えて、非SMADシグナル伝達経路は、下流細胞応答23を調節する受容体によって直接活性化することもできる。
腫瘍進行時には、EMTの誘導にはTGF-β誘導SMAD依存性およびSMAD非依存性経路の活性化が必要である。EMTは、腫瘍細胞が上皮表現型から脱分化する可逆的なプロセスであり、細胞と細胞の接触の喪失および上端基底極の低下に関連し、運動性および浸潤能を増強した間葉型表現型に対する。EMTは、間葉系マーカータンパク質の発現増加を特徴とするが、N-カドヘリン、ビメンチン、ゼブ2およびSnail1/2、およびEカドヘリンおよびβカテニンなどの上皮マーカーの併用ダウンレギュレーション(図3)25。しかし、上皮から間葉状態への移行は不完全であることが多く、細胞は上皮と間葉(E/M)特性が混在する。国際EMT協会の最近の論文は、E/M中性平体状態を受ける細胞の過程を上皮間葉可塑性(EMP)26として記述することを提案した。この可塑性とは、部分EMT、ハイブリッドE/Mステータス、メタスタブルEMT状態、EMT連続体およびEMTスペクトル26を指す。EMTの間に、腫瘍細胞は癌幹細胞(CSC)特性を得て、剥離誘発アポトーシス27に対してより耐性になる。EMTは原発性腫瘍細胞における侵襲的表現型の獲得を担い、癌の進行を促進するが、対照的に、間葉上皮転移(MET)は、遠方転移部位28,29における分化腫瘍細胞の伸びに重要な役割を果たすることが示されている。最近の研究では、EMT由来の乳癌細胞をアディポサイトにトランス分化することができ、転移を阻害し、腫瘍細胞および再発癌30における治療抵抗性を克服する機会を提供する可能性があることを実証した。乳腺発癌におけるEMTの活性化におけるTGF-βシグナル伝達の重要な役割のために、 ウェスタンブロッティング、ルシパラーゼ転写レポーターアッセイ、定量リアルタイムポリメラーゼ連鎖反応(qRT-PCR)、TGF-βシグナル伝達、TGF β誘導EMT、EMT由来マウス乳房の乳腺細胞の分化を含む免疫蛍光を有する。これらの技術は、細胞生物学分野で最も一般的に使用される分析ツールです。qRT-PCR は、mRNA 発現レベルを定量的に検出、特性評価、定量化するために使用されます。定量PCR(qPCR)と比較して、代替技術である逆転写(RT)-PCRを用いて、半定量的な方法でmRNA発現を決定するために31,32を用いることができる。ウエスタンブロッティングは、特定の細胞ライセートサンプル中の特定のタンパク質レベルを、感度と特異性の利点を半定量的に調べるために使用されます。このように、遺伝子発現からタンパク質発現への変化を解析する体系的なワークフローを提示し、他のシグナル経路にも応用できるTGF-βシグナル伝達を調べるのに役立つ。
プロトコル
1. ウェスタンブロッティングを用いたTGF β誘導SMAD2リン酸化の解析
注:前悪性ヒト乳房MCF10A-Ras細胞は、TGF-βシグナル応答33を調査する例として使用した。原則として、以下に説明する方法は、他のTGF β応答性細胞株にも適用可能である。
- 5%馬血清とL-グルタミンを含むダルベッコの修飾イーグル培地(DMEM)/F12で37°Cで乳房上皮細胞株MCF10A-Rasを培養し、 20 ng/mL 表皮成長因子(EGF)、10 mg/mLインスリン、100 ng/mLコレラエンテオトキシン、0.5 mg/mLヒドロコルチゾン、および1:100ペニシリンストレプトマイシン(Pen-ストレプ)
- 1 mL 0.25% トリプシン-EDTAで MCF10A-Ras細胞を1分間トリプシンし、セルカウンターを使用して生存細胞を数えます。
- 5×105 細胞/ウェルの密度で6ウェルプレートに細胞を播種します。
- 一晩の成長の後、TGF-β(5 ng/mL)またはリガンドバッファー(4 mM HCl、0.1%脂肪酸フリーウシ血清アルブミン(BSA))のいずれかで細胞を1時間治療し、培養液を取り除き、リン酸緩衝生理食塩基(PBS)の1mLで細胞を2回穏やかに洗浄します。
- 氷上の6ウェルプレートに細胞を冷却し、150 μLの予熱された無線免疫沈殿アッセイ(RIPA)リシスバッファー(150 mM NaCl、0.1%トリトンX-100、0.5%デオキシコール酸ナトリウム、0.1%SDS、50 mM Tris-HCl pH 8.0、およびミニ阻害剤プロテアーゼカクテルを追加)を加えます。ライシスを氷の上で10分間進めます。
- プラスチックセルスクレーパーを使用して付着細胞を皿から削り取り、セルサスペンションを予め冷却されたマイクロ遠心チューブにそっと移します。
- 4°Cで150遠心力(x g)で細胞リセートを10分間遠心分離し、上清を新鮮な1.5mLマイクロ遠心チューブに移します。
- 洗浄剤適合性(DC)タンパク質アッセイキットを使用してタンパク質濃度を測定します。
- 各サンプルから30μgのタンパク質を10%のドデシル硫酸ポリアクリルアミドゲル電気泳動(SDS-PAGE)ゲルにロードし、100Vの電圧で1.5〜2時間ゲルを実行します。
- 110 Vの電圧でゲルから45μmポリビニリデンジフルオリド(PVDF)膜に1~1.5時間タンパク質を移します。
- PVDF膜をタンパク質側(ゲルに向いていた側)を上にして適切な容器に移し、蒸留水で膜を短時間リンスします。
- 水を捨て、ポンソーS溶液を加え、1〜2分間揺れるプラットホームに膜を置きます。
- 素早く洗い流し、1分間洗浄して、蒸留水で膜を脱汚します。
- 次に、PVDF膜をライトボックスに置き、同じ総タンパク質負荷をチェックするために写真を撮ります。
- トリスバッファー生理食い物で膜を Tween 20 (TBST, 20 mM Tris-HCl, pH 7.4, 150 mM NaCl, および 0.1% Tween 20) で、目に見える染色がなくなるまで洗浄します。
- 膜をブロッキングバッファー(TBST溶液中の5%スキムミルク)に入れ、室温で1時間インキュベートします。
- 膜をTBSTで2回洗います。
- リンベートをホスホ-SMAD2(p-SMAD2;1:1000、自家製 34)、合計SMAD2/3 1:1000、グリセアルデヒド3リン酸脱水素酵素(GAPDH;1:1000)に対して一次抗体で膜をインキュベートし、4°Cで一晩。
- 膜をTBSTで2回洗浄し、ウサギまたはマウスに対する二次抗体(1:5000)で膜を2時間インキュベートします。
- PVDF膜をウェスタンECL基質と30秒間インキュベートし、撮像システムを用いて信号を検出する。
- 生物学的トリプライズを得るために少なくとも3回実験を繰り返す。
2. TGF β誘導SMAD3依存性転写反応の解析
- SMAD3/SMAD4依存性CAGA12-ルシファーゼ転写レポーターアッセイを行います。
- ステップ1に記載されるMCF10A-Ras細胞を培養し、トリプシン化する。5×104 細胞/ウェルで24ウェルプレートに細胞を播種し、細胞が一晩接着できるようにします。
- 播種の翌日、ポリエチレンアミン(PEI)を用いて、各ウェルの細胞をTGF-β/SMAD3誘導性(CAGA)12ルシファーゼ転写レポーター構築体35および80ngの βポリエチレンシダーゼ発現構築物で各ウェルにコトランスフェクトする。βガラクトシダーゼのトランスフェクションは、異なるウェル間のトランスフェクション効率の違いを正常化するために使用されます。三重にすべての実験グループを設定します。
- 24時間のインキュベーションの後、無血清DMEM高グルコースを有する細胞を飢えさせ、6時間後に、TGF-β(5 ng/mL)またはリガンド緩衝液(4 mM HCl、0.1%BSA)を細胞に対する車両制御として添加した。
- さらに24時間のインキュベーションの後、プリウォームPBSで細胞を2回洗浄する。
- 120 μL/well 1×のリシスバッファーを加え、4°Cでプレートを20分間軽く振ります。
- 96ウェルの白色アッセイマイクロプレートのウェルに30μLのライセートを移し、ルミノメーターを使用してルシファーゼ活性を測定します。
- 96ウェル透明プレートのウェルに50μLのリセートを移し、βガラクトシダーゼ活性を測定します。
- ルシファーゼ活性をガラクトシダーゼ活性βに正規化し、実験を少なくとも3回繰り返して生物学的トリクセートを得る。
- 定量的リアルタイムポリメラーゼ連鎖反応(qRT-PCR)を用いてTGF-β標的遺伝子の発現を解析する。
- ステップ1に記載されるMCF10A-Ras細胞を培養し、トリプシン化する。5×105 細胞/ウェルで6ウェルプレートに細胞を播種し、細胞が一晩接着できるようにします。
- 細胞をTGF-β(5 ng/mL)またはリガンドバッファー(4 mM HCl、0.1%BSA)で6時間処理し、1 mLのPBSで細胞を2回洗浄します。
- RNA分離キットを使用して、トータルRNAを分離します。
- NanoDropでRNA濃度を決定し、最初の鎖cDNA合成キットを使用して1μgのRNAでcDNA合成を行います。
- リアルタイムPCR検出システムを使用して、GAPDH(正規化用)、SERPINE1(PAI-1タンパク質、TGF-β/SMAD標的遺伝子をコードする)、SMAD7(TGF-β/SMAD標的)およびQ.q.の10μL反応混合物で定量的リアルタイムPCR(qRT-PCR)を実行します。三重にすべての実験グループを設定します。
注: qRT-PCR で標的ヒト遺伝子を検出するために使用されるプライマー配列を 表 1に示します。 - 次の qPCR 反応条件を使用してください: 初期化、95 °C 3 分間;変性、10秒間95°C;アニール、30秒間60°C;および延長、10秒間80°C;変性、アニーリングおよび延長は40回繰り返される。
- 生物学的トリプライズを得るために少なくとも3回実験を繰り返す。
3. TGF β誘導EMTの解析
- ウェスタンブロッティングを用いて、タンパク質レベルでのEMTマーカーの発現を解析します。
注: TGF β誘導EMTの分析は、例としてマウスNMuMG上皮細胞を例えば36,37として示しています。- 培養NMuMG細胞は、10%の牛血清と1:100ペンストレップを添加したDMEM高グルコース培地中の37°Cで。タンパク質の分離と検出のためにステップ 1 で説明されている方法を使用します。
注: 以下の抗体は、この実験で使用されます: E-カドヘリン, 1:1000;Nカドヘリン、1:1000;カタツムリ、1:1000;スラッグ、1:1000;チューブリン、1:1000(図3)
- 培養NMuMG細胞は、10%の牛血清と1:100ペンストレップを添加したDMEM高グルコース培地中の37°Cで。タンパク質の分離と検出のためにステップ 1 で説明されている方法を使用します。
- ステップ2.2で説明したように定量的リアルタイムPCRを用いてmRNAレベルでのEMTマーカーの発現を解析する。
注: qRT-PCR に使用されるすべてのマウスプライマーは、CDH1 (E-カドヘリンタンパク質をコード化)、SNAIL、および ZEB2 (図 3)を含む表1に示されています。 - 間接免疫蛍光と直接蛍光染色を用いてEMTプロセスを分析します。
- Eカドヘリンの間接免疫蛍光染色
- 滅菌18 mm側の正方形のガラスカバーリップを6ウェルプレート(ウェルあたり1カバースリップ)に入れます。
- シード1×105 NMuMG細胞は6ウェルプレートあたり2 mLの完全なDMEMを有し、細胞が一晩接着することを可能にする。
- 付着細胞を含むカバーリップを新しい6ウェルプレートにそっと動かし、2mLの培養培地をウェルに加えます。
- TGF-β(5 ng/mL)またはリガンドバッファー(4 mM HCl、0.1%BSA)で細胞を2日間治療します。
- 培養培地を取り出し、1mLのプリウォームPBSで細胞を2回軽く洗います。
- 4%パラホルムアルデヒド1 mLを加え、室温で30分間インキュベートして細胞を固定します。その後、1mLのPBSで細胞を2回軽く洗います。
- 固定細胞を0.1%トリトンX-100で室温で10分間透過し、PBSで2回洗浄します。
- PBSで5%BSAの細胞を室温で1時間ブロックし、PBSで細胞を2回洗浄します。
- E-カドヘリンに対する一次抗体(PBSで希釈した1:1000)を各カバースリップの上部に加え、室温で1時間インキュベートします。
- 一次抗体を取り出し、PBSでカバースリップを3回洗います。
- Alexa Fluor 555二次抗体(PBSでは希釈)を各カバースリップの上部に加え、アルミニウム箔で覆いながら室温で1時間インキュベートして光から保護します。
- 二次抗体を取り出し、PBSでカバースリップを3回洗います。
- 4′,6-ジミジノ-2フェニリンドール(DAPI)の取り付け媒体を使用してカバースリップ(下向きのセル)をガラススライドに取り付け、取り付けたスライドを光から保護された4°Cの箱に保管します。
- SP8共焦点顕微鏡で染色を観察します。
- 糸状(F)-アクチンの直接蛍光染色。
- 手順 3.3.1.1 に従ってサンプルを準備します。3.3.1.9に。
- アレクサフルオール488ファロイジン(1:1000)を暗闇の中で室温で1時間添加して細胞を染色し、糸状アクチン(F-アクチン)を可視化します。
- PBSで細胞を3回洗浄します。
- DAPIを搭載した取り付け媒体を使用してカバースリップをガラススライドに取り付け、SP8共焦点顕微鏡で画像を撮ります。
- Eカドヘリンの間接免疫蛍光染色
結果
TGF-βシグナル伝達の解析
TGF-βシグナル伝達における重要なステップは、TβRIキナーゼ38、39によるSSXSモチーフ(図2)における2つの最もカルボキシ末端セリン残基のリン酸化である。TGF-βシグナル応答を調べるには、リン酸化SMAD2のウェスタンブロッティングを行った。前悪性ヒト乳房MCF10A-Ras細胞では、TGF-β刺激に応答してSMAD2のリン酸化が1時間有意に増加したが、総SMAD2/3の発現はTGF-β治療の影響を受けなかった(図4A)。TGF-β誘導SMAD3/4駆動CAGA-luc転写レポーターアッセイを用いて、TGF-βが非治療細胞と比較してMCF10A-Ras細胞ラインでルシファーゼレポーターを著しく誘導することを発見した(図4B)。また、SMAD7およびSERPINE1(PAI-1タンパク質をコードする)を含むTGF-βの直接転写遺伝子標的を十分に特徴付 βけたことを観察した(図4C)。
tGF-β誘導EMTの解析
形態変化、mRNAレベルおよびタンパク質レベルにおけるEMTマーカーの発現およびEMTマーカー36の免疫蛍光染色などの様々な方法を用いてTGF β誘導EMTを評価した。TGF-βで処理したNMuMG上皮細胞は、古典的な上皮形態から紡錘形の間葉様形態に変化し、位相コントラスト顕微鏡で示された(図5A)。形態学的変化と一致して、TGF-β治療がNカドヘリン、カタツムリ、およびスラッグ37を含む間葉マーカーのタンパク質発現の増加につながったことを観察した(図5B)。これに対し、上皮マーカーであるE-カドヘリンは、TGF-β処理の2日後にNMuMG細胞でダウンレギュレートされた(図5B)。また、EMTマーカーの遺伝子発現を調べるため、定量リアルタイムポリメラーゼ連鎖反応(qRT-PCR)を実施しました。CDH1(Eカドヘリンタンパク質をコードする)は有意に減少したが、未治療細胞と比較してNMuMG細胞におけるTGF-β刺激後、SNAILおよびジンクフィンガーEボックス結合ホメオボックス2(ZEB2)などの間葉マーカーが著しく増加した(図5C)。NMuMG細胞におけるTGF β誘導EMTは、E-カドヘリンの免疫蛍光染色によりさらに確認した。TGF-β刺激が2日間行われた場合、NMuMG細胞は、共焦点顕微鏡法で分析した非誘導対照群の細胞よりもE-カドヘリンが少ない。.また、TGF-βの存在下でNMuMG細胞は、共焦点顕微鏡で示されるように、より多くのアクチンストレス繊維を形成した(図5E)。
SB431542 および GW788388 は TGF-β シグナル伝達および TGF β誘導 EMT を阻害する
SB431542は、TβRIのキナーゼドメインのATP競合阻害剤であり、アクチビン受容体様キナーゼ5(ALK5)とも呼ばれ、一方、GW788388はTβRIおよびTβRIIキナーゼ活性を阻害する。両方の阻害剤は、TGF β受容体シグナル伝達を阻害することができる40.従って、TGF-βの存在下でGW788388の異なる濃度のNMuMG細胞を1時間処理した。予想通り、GW788388は用量依存的な方法でTGF β誘導SMAD2リン酸化を阻害した(図6A)。さらに、SMAD2のTGF β媒介リン酸化をSB431542処理により遮断した(図6A)。リン酸化SMAD2/3は、SMAD4を用いたヘロマー複合体を形成し、核内に転写して標的遺伝子の転写を調節する。そこで、SMAD2/3の免疫蛍光染色法によるNMuMG細胞におけるSMAD2/3の転位を検討した。このデータは、SB431542とGW788388の両方が、TGF βによる核転位およびNMuMG細胞におけるSMAD2/3の蓄積を有意に阻害することを示した(図6B)。さらに、SB431542およびGW788388の阻害作用は、PAI-1、SNAIL、E-カドヘリンおよびフィブロネクチンを含むEMTに関与する重要なTGF-β標的遺伝子のmRNA発現レベルにおいても観察された(図6C)。これらのデータは、SB431542およびGW788388がTGF-βシグナル伝達およびTGF β誘導EMTをブロックすることを示唆した。
間葉系乳癌細胞の異分化の分析
EMTは、癌における細胞の可塑性を高める上で重要な役割を果たし、治療抵抗性の開発に結果を及ぶ。癌細胞可塑性は、強制異分化アプローチ、強制有数化30などのトランス分化アプローチで直接標的化および阻害することができる。マウス乳腺由来のマウス乳がん細胞は、マウス乳腺ウイルス-ポリマ中型腫瘍抗原(MMTV-PyMT)トランスジェニックマウスの細胞モデルとしてEMT誘導癌細胞可塑性の細胞モデルとして用いた。確立されたプロトコル41に基づいて、EMT由来のPy2Tマウス乳癌細胞を抗糖尿病薬ロシグリタゾンで10日間治療し、脂質形成を誘導した。脂肪生成は、油赤O染色を用いて脂質滴を可視化することによって評価した。脂肪細胞は、ロシグリタゾン処理Py2Tマウス乳癌細胞(図7)で容易に検出され、これは、ロシグリタゾン単独での治療がEMT由来乳癌細胞の脂肪細胞への分化を促進するのに十分であることを実証した。
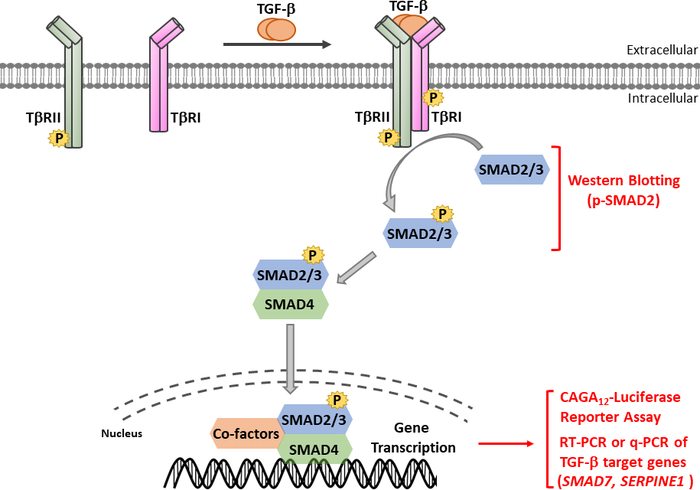
図1:TGF-β/SMAD シグナリングTGF-βシグナル伝達は、TGF-β型II型受容体(TβRII)へのTGF-βの結合と共に開始され、構成的に活性なキナーゼであり、TGF-β型I型受容体(TβRI)をリン酸化する。次いで、活性化TβRIキナーゼがSMAD2/3をリン酸化する。SMAD2のSSXSモチーフを含むペプチドを2つのカルボキシ末端リン酸化セリン残基を用いて、蛍光体-SMAD2(p-SMAD2)を認識するポリクローナル抗血清を得た。従って、ウェスタンブロッティングによるp-SMAD2発現の解析は、TGF-βシグナル経路の活性化を決定するために使用され得る。リン酸化SMAD2/3は、SMAD4を用いてヘロメリック錯体を形成し、核内に転写して転写応答を調節することができる。CaGA12-ルシファーゼレポーターアッセイおよび定量的リアルタイムPCR(qRT-PCR)は、SMAD7およびSERPINE1(PAI-1タンパク質をコードする)などのTGF-β標的遺伝子のmRNA発現に対して、TGF β誘導SMAD3依存性転写応答を分析するために使用することができる。この図の大きなバージョンを表示するには、ここをクリックしてください。
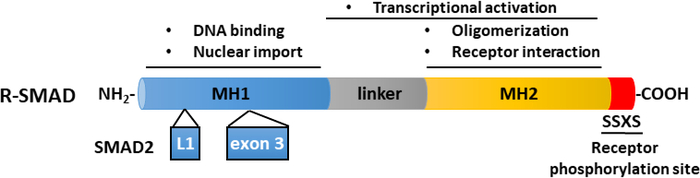
図2:R-SMAD(SMAD2およびSMAD3)の概略構造。MH1(青)およびMH2(黄色)ドメインはR-SMAの間で保存されるが、リンカー領域(灰色)は保存されない。SMAD3のMH1ドメインはDNA結合モチーフを持ち、SMAD2はMH1ドメインに挿入(エキソン3)があるためDNAを直接結合することはできません。MH2ドメインは、SMADオリゴマー化、TGF−β受容体との相互作用、およびタンパク質結合との相互作用を媒介し、転写調節に関与している。SMAD2およびSMAD3は、それらのC末語におけるSSXSモチーフ(赤色)のリン酸化によって活性化することができる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
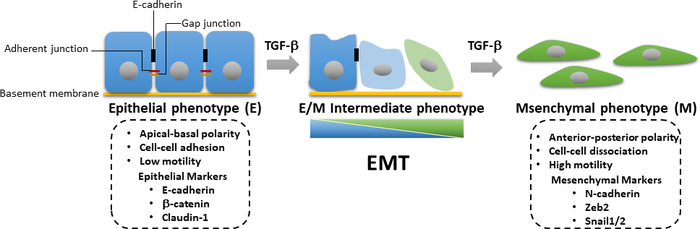
図3:TGF β誘導EMT.TGF-β誘導上皮間葉転移(EMT)の間流中、細胞は上皮の喪失と細胞の運動性および侵略能の増強した間葉特性の獲得を受ける。EMTの誘導は、Nカドヘリン、ゼブ2、スナイム1/2などの間葉間マーカーの発現、ならびにEカドヘリン、βカテニン、クローディン-1を含む上皮マーカーのダウンレギュレーションにつながる。上皮/間葉(E/M)特性の累積損失または利得は、細胞が可逆的に中間状態に入ることを引き起こす。 この図の大きなバージョンを表示するには、ここをクリックしてください。
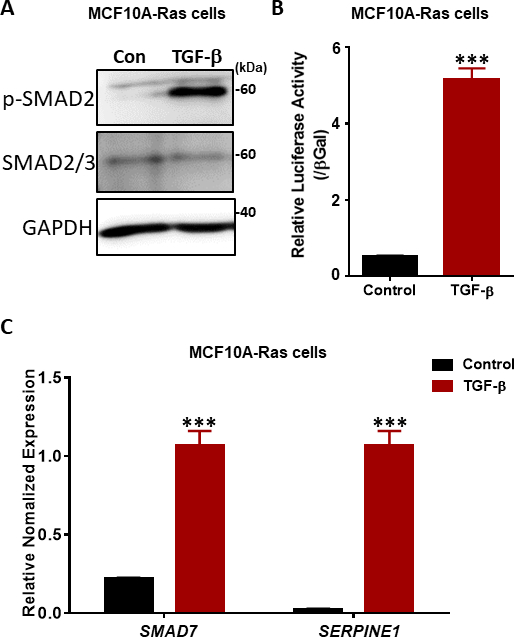
図4:MCF10A-Ras細胞におけるTGF-βシグナル応答(A)MCF10A-Ras細胞をTGF-β(2.5 ng/mL)の有無にかかわらず1時間処理し、細胞ライセートをリン酸化SMAD2(p-SMAD2)、合計SMAD2/3およびGAPDH(ローディングコントロールとして)用に免疫ブロットした。サイズマーカーが右側に表示されます。Con: TGF β治療を受けずコントロール群.(B) MCF10A-Ras細胞におけるSMAD3-SMAD4依存性CAGA12-ルシファーゼ(LUC)転写レポーターを用いたTGF-β(5 ng/mL)活性の解析これらの値は、β-ガラクトシダーゼ(βGal)活性に正規化されます。データは、s.d,n = 3±平均で表されます。学生のtテストは、6時間TGF-β(2.5 ng/mL)で処理されたMCF10A-Ras細胞におけるTGF-β標的遺伝子SMAD7およびSERPINE1(PAI-1タンパク質をコードする)のqRT-PCR分析を≤する。GAPDHは内部制御として使用されました。データは、s.d,n = 3±平均で表されます。学生のテスト、***P≤0.001です。この図の大きなバージョンを表示するには、ここをクリックしてください。
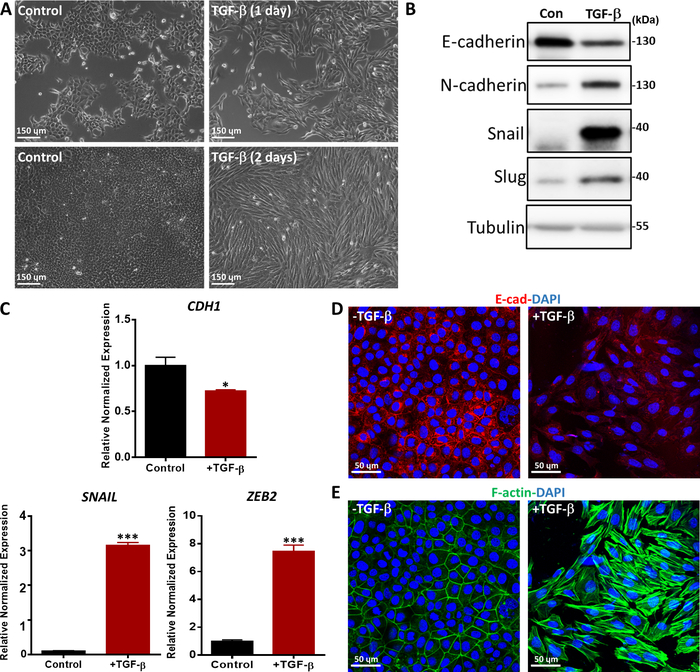
図5:NMuMG細胞におけるTGF-β誘導EMT。(A) TGF-β(2.5 ng/mL)で1日または2日間処理したNMuMG細胞の形態TGF-βの存在下で、NMuMG細胞は間葉型表現型にトランスファノ分化した。スケールバー=150μm(B)NMuMG細胞をTGF-β(5 ng/mL)の有無にかかわらず2日間処理し、EMTマーカーをウェスタンブロッティングで分析した。サイズマーカーは右側に示すとおりです。Con: TGF β治療を受けずコントロール群.(C) TGF-β(5 ng/mL)で2日間処理したNMuMG細胞におけるEMTマーカー(CDH1(E-カドヘリンタンパク質をコードする)、カタツムリおよびZEB2)の遺伝子発現解析。GAPDHは内部制御として使用されました。結果は、s.d.,n = 3 ±平均として表されます。学生のtテスト、*P ≤ 0.05、**P ≤ 0.01、***P ≤ 0.001 です。(D)NMuMG細胞を免疫蛍光により染色し、2日間のTGF-β(2.5 ng/mL)処理後の上皮マーカーEカドヘリン(赤色)の発現を検出した。核はDAPI(青色)で対数化した。画像は共焦点顕微鏡で撮影された。スケールバー=50μm(E)NMuMG細胞をフルオレセイン-ファロイジン(緑色)で染色し、F-アクチンを可視化した。核はDAPI(青色)で対数化した。スケールバー= 50 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:TGF-βシグナル伝達およびTGF-β誘導EMTは、SB431542およびGW788388によって阻害された。(A)NMuMG細胞を、1時間のTGF-β(5 ng/mL)の存在下または不在時にSB431542(SB)またはGW788388(GW)の示された濃度の10μMで1時間処理した。細胞ライセートは、p-SMAD2、SMAD2/3およびGAPDHに対して免疫ブロットを行った。(B)NMuMG細胞は、5 ng/mLのTGF-βの有無に対してSB431542(SB)またはGW788388(GW)の10μMを1時間処理し、免疫蛍光により染色し、SMAD2/3(緑色)の核転位を検出した。画像は共焦点顕微鏡で撮影された。(C)SNAIL、E-カドヘリン、フィブロネクチンを含むPAI-1およびEMTマーカーをコードする遺伝子を含むTGF-β標的遺伝子の発現を、SBまたはGW処理後のNMuMG細胞における逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)およびTGF刺激β 48時間のTGF-βで分析した。GAPDH は、負荷制御として使用されます。コントロールは、未処理でないセルを表します。この図は、ピーターセン・Mらから変更されています。出版社の許可を得た34。この図の大きなバージョンを表示するには、ここをクリックしてください。
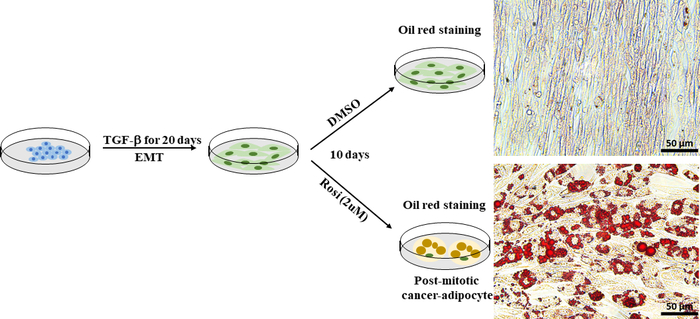
図7:EMT由来のPy2Tマウス乳癌細胞は、アディポサイトに分化誘導することができる。Py2Tマウス乳癌細胞は、完全なEMTを誘導するために20日間2ng /mL TGF-βで刺激された。次いで、細胞をDMSOを車両制御またはロシグリタゾン(2μM)として10日間処理し、間葉癌細胞の分化を可能にし、脂質生成を誘導した。培地は2日ごとに変更した。10日間の処理の後、細胞はオイルレッドOスケールバー=50μmで染色されました 。
| 種 | 遺伝子名 | フォワード (5' から 3') | 逆 (5' から 3') | ||
| 人間 | ギャップド | テクラッカカアクGCGC | グッカトガクトクトカトガグ | ||
| スマッド7 | TCCAGATGCGTGCTCC | グックガートガグクトクトクッチク | |||
| セルピネ1 | カカーアカガクGCGCACT | カツグッヒグトグガアクチ | |||
| 鼠 | ギャップド | TGGCAAGTガガットgtTGtGCC | アガガットガッッググッテツCCCG | ||
| CDH1 | アカガグガククトガクトク | ガガットタクトッグカートッグ | |||
| 蝸牛 | カクトッグコッグククトクトグ | GCGAGGGCCCCGCCA | |||
| ゼブ2 | TTCTGCAGCCTCTタグタグク | TTCTGGCCCCATTATCAT | |||
表1:qRT-PCRに使用するプライマー。
ディスカッション
TGF-β/SMAD シグナル伝達は、EMT7を誘導することによって乳癌細胞浸潤および転移を促進することができるので、乳癌進行において極めて重要な役割を果たす。ここでは、受容体誘導SMAD活性化からSMAD媒介型転写および生物学的応答へのT β GF開始シグナル伝達を調べる論理的ワークフローを説明した。まず、SMAD2リン酸化の分析を説明し、TGF-βに誘導されたSMAD3依存性転写応答とEMTマーカー発現を遺伝子およびタンパク質レベルの両方で継続し、TGF-β/SMADシグナル伝達応答を分析し、最後にTGF β誘導EMTを調べた。PAI-1プロモーターに由来するCAGAボックスを含むCAGA12-ルシパラーゼ転写レポーターを用いて、TGF-β/SMADシグナル伝達経路35の活性をモニタリングした。このレポーター構成では、アクティブ化に SMAD3 と SMAD4 が必要です。これまでの研究では、SMAD4のノックダウンによりTGF-β誘発CAGA12-ルシファーゼ活性37が低下した。レポーターアッセイに加えて、SMAD2およびSMAD3を含む内因性SMASのリン酸化状態を決定することは、TGF-βシグナル応答を調べるもう一つの方法である。実際、TGF-βファミリーの他のメンバーは、成長および分化因子(GDF)-8/ミオスタチンおよびGDF−9のような、TβRI42、43、44を係合させることによってSMAD2/3タンパク質を介してシグナルを伝達する。CAGA12-ルシファーゼレポーターに加えて、いくつかの同様のレポーターがTGF-βシグナル伝達の活性化を検出するために使用されてきた。例えば、JunBプロモーターから誘導された応答要素を有する転写(SBE)4-Luxレポーターは、TGF-β、アクチビンおよびBMP45によって効率的に誘導され得る。
ウェスタンブロッティングおよびqPCRは、上皮マーカー(すなわち、E-カドヘリン)および間葉マーカー(すなわち、Nカドヘリン、カタツムリ、スラグおよびZeb2)の発現を調べる古典的な方法であるTGF-β誘発EMTを分析するために使用された。また、E-カドヘリンの間接免疫蛍光染色、F-アクチンの直接蛍光染色も行いました。これらのアッセイは、TGF β処理後の間葉型表現型をさらに検証した。免疫蛍光染色の限界は、細胞を抗体およびイメージングでインキュベーションする前に固定する必要があり、生細胞におけるEMTマーカー発現の変化を調査することが困難である。近年、A549肺腺癌ビメンチン-RFPなどのEMTレポーター細胞株の設計により、赤蛍光タンパク質(RFP)タグ付きビメンチンの発現を介して、上皮細胞から間葉細胞への変換をリアルタイムで監視することが可能になりました。このプラットフォームは、薬物スクリーニングおよび新薬開発46に利用することができる。LifeAct色素は、17アミノ酸ペプチドであり、生細胞におけるF-アクチン構造を染色できる、細胞プロセス47を妨害することなく、リアルタイムでアクチン細胞骨格を可視化する貴重なツールになりつつある。本研究では、SB431542とGW788388の2つの低分子阻害剤を用いて、TGF-βシグナル伝達およびTGF β誘導EMTに対する阻害効果を検証した。特に、GW788388はTβRIおよびTβRII活性を強力に阻害し、SB431542はTβRI(およびALK4およびALK7)にのみ阻害効果を有する。以前の研究では、GW788388はSB43154240よりもインビボでより強力であることを明らかにしました。EMTの阻害に加えて、GW788388は腎臓における線維症マーカーの発現を低下させ、糖尿病マウスにおけるGW788388の経口投与は顕著に糸球体症25、48を減少させた。
EMTは癌細胞可塑性を促進する上で重要な役割を果たし、薬剤耐性および転移を生じる49.そこで、特定の細胞傷害性薬物50を有するEMT由来細胞を標的とする50または間葉間上皮移行(MET)51を介した再分化を誘導することは、癌細胞転移および治療抵抗性を克服するアプローチとして提案されている。しかしながら、METは遠方器官52における播種癌細胞の増殖に寄与し、EMTの治療復帰を用いた場合に逆効果となる可能性がある。最近、新しい研究は、EMT由来乳癌細胞をアディポサイト30への分化のために直接標的化することによって治療的トランスセ分化アプローチを報告した。イシャイ・ロネンらの研究al.30は、TGF-βによる長期治療に応答して間葉細胞への移行を受けたPy2Tマウス上皮癌細胞を使用した。彼らは、MEK阻害剤と組み合わせたロシグリタゾンが上皮分化および異端形成を増強することを実証した。しかし、ロシグリタゾンだけでは間葉系Py2Tマウス細胞の異分化をアディポサイトに誘導するのに十分であることがわかりました。
要約すると, この研究で使用される方法は、TGF-βシグナル伝達とTGF β誘発EMTを調査するための論理的なワークフローを提供しました.2つの阻害剤は、SB431542およびGW788388、TGF β誘導応答およびEMTを遮断することができる。また、ロシグリタゾン単独で、あるTGF β誘発性間葉系乳癌細胞において、脂質形成を誘導することも実証した。TGF-β応答を調べるのに乳がん細胞株は数個しか使用しませんでしたが、ここで説明する方法は他の(がん)細胞に外挿される可能性があります。ここでは、さまざまなTGF-β濃度を用いて細胞応答を誘導した。ほとんどの細胞タイプにおいて、TGF-βは、0.01-10 ng/mL53 の濃度範囲においてその生物学的活性を発揮し、用量応答パターンでシグナル伝達を誘導する。牛の大動脈内皮細胞を含む一次内皮細胞において、TGF−βは0.025 ng/mLでリン酸化SMAD2の実質的な発現を誘導し、0.25ng/mLで最大に達し、より高濃度53に応答してこのレベルにとどまった。我々の研究では、高濃度のTGF-β(5 ng/mL)をMCF10A-Ras細胞に用い、転写レポーターアッセイを用いて強い反応を得た。SMAD2リン酸化および標的遺伝子発現は、低用量でTGF-βによって誘導され得る。したがって、細胞を治療するために2.5 ng /mL TGF-βを使用しました。しかし、最も適した作業濃度は、細胞の種類と推定効果に依存します。TGF-βの最高濃度を決定するには、異なる用量で細胞を処理することが推奨されます。.
開示事項
著者らは開示するものは何もない。
謝辞
我々は、J.Z.及び癌ゲノミクスセンターオランダ(CGC)に対する中国奨学金評議会(CSC)の支援を認める。NL) から P.t.D.
資料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 18 mm-side square glass coverslips | Menzel Gläser | 631-1331 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-1200 | |
| Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | |
| Alexa Fluor 555 secondary antibody | Thermo Fisher Scientific | A-21422 | |
| Anti-E-cadherin antibody | BD Biosciences | 610181 | |
| anti-glyceraldehyde 3-phosphate dehydrogenase(GAPDH) antibody | Merck Millipore | MAB374 | |
| Anti-N-cadherin antibody | BD Biosciences | 610920 | |
| Anti-Slug antibody | Cell Signaling Technology | 9585 | |
| anti-SMAD2/3 antibody | Becton Dickinson | 610842 | |
| Anti-Snail antibody | Cell Signaling Technology | 3879 | |
| Anti-Tubulin antibody | Cell Signaling Technology | 2148 | |
| Bovine Serum Albumin | Sigma-Aldrich | A2058 | |
| Cholera enterotoxin | Sigma-Aldrich | C8052 | |
| Clarity Western ECL Substrate | Bio-Rad | 1705060 | |
| DC protein assay kit | Bio-Rad | 5000111 | |
| DMEM-high glucose | Thermo Fisher Scientific | 11965092 | |
| DMEM-high glucose medium | Thermo Fisher Scientific | 11965092 | |
| Dulbecco’s modified Eagle’s medium (DMEM)/F12 | Thermo Fisher Scientific | 11039047 | |
| epidermal growth factor (EGF) | Merck Millipore | 01-107 | |
| Fetal bovine serum (FBS) | BioWest | S1860-500 | |
| GoTaq qPCR Master Mix | PROMEGA | A600X | |
| Horse serum | Thermo Fisher Scientific | 26050088 | |
| Hydrocortisone | Sigma-Aldrich | H0135 | |
| Insulin | Sigma-Aldrich | 91077C | |
| Mini Protease Inhibitor Cocktail | Roche | 11836153001 | |
| NucleoSpin RNA II kit | BIOKE´ | 740955 | |
| Penicillin-streptomycin (Pen-Strep) | Thermo Fisher Scientific | 15140148 | |
| Polyethylenimine (PEI) | Polyscience | 23966 | |
| Polyvinylidene difluoride (PVDF) membrane | Merck Millipore | IPVH00010 | |
| Ponceau S solution | Sigma-Aldrich | P7170 | |
| RevertAid First Strand cDNA Synthesis Kit | Thermo Fisher Scientific | K1621 | |
| Rosiglitazone | Sigma-Aldrich | 557366-M | |
| Skimmed milk | Campina: Elk | ||
| Equipment | |||
| ChemiDoc Imaging System | Bio-Rad | 17001402 | |
| CFX Connect Detection System | Bio-Rad | 1855201 | |
| Luminometer | Perkin Elmer | 2030-0050 | |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ND-2000 |
参考文献
- Tzavlaki, K., Moustakas, A. TGF-β Signaling. Biomolecules. 10 (3), (2020).
- Hao, Y., Baker, D., Ten Dijke, P. TGF-β-Mediated Epithelial-Mesenchymal Transition and Cancer Metastasis. International Journal of Molecular Sciences. 20 (11), (2019).
- Morikawa, M., Derynck, R., Miyazono, K. TGF-β and the TGF-β Family: Context-Dependent Roles in Cell and Tissue Physiology. Cold Spring Harbor Perspectives in Biology. 8 (5), (2016).
- Derynck, R., Akhurst, R. J. Differentiation plasticity regulated by TGF-β family proteins in development and disease. Nature Cell Biology. 9 (9), 1000-1004 (2007).
- Massague, J. How cells read TGF-β signals. Nature Reviews Molecular Cell Biology. 1 (3), 169-178 (2000).
- Seoane, J., Gomis, R. R. TGF-β Family Signaling in Tumor Suppression and Cancer Progression. Cold Spring Harbor Perspectives in Biology. 9 (12), (2017).
- Colak, S., Ten Dijke, P. Targeting TGF-β Signaling in Cancer. Trends in Cancer. 3 (1), 56-71 (2017).
- Suriyamurthy, S., Baker, D., ten Dijke, P., Iyengar, P. V. Epigenetic Reprogramming of TGF-β Signaling in Breast Cancer. Cancers (Basel). 11 (5), (2019).
- Drabsch, Y., Ten Dijke, P. TGF-β signalling and its role in cancer progression and metastasis). Cancer and Metastasis Reviews. 31 (3-4), 553-568 (2012).
- Goumans, M. J., Ten Dijke, P. TGF-β Signaling in Control of Cardiovascular Function. Cold Spring Harbor Perspectives in Biology. 10 (2), (2018).
- Robertson, I. B., Rifkin, D. B. Regulation of the Bioavailability of TGF-β and TGF-β-Related Proteins. Cold Spring Harbor Perspectives in Biology. 8 (6), (2016).
- Robertson, I. B., et al. Latent TGF-β-binding proteins. Matrix Biology. 47, 44-53 (2015).
- Khan, Z., Marshall, J. F. The role of integrins in TGF-β activation in the tumour stroma. Cell and Tissue Research. 365 (3), 657-673 (2016).
- Jenkins, G. The role of proteases in transforming growth factor-β activation. The International Journal of Biochemistry & Cell Biology. 40 (6-7), 1068-1078 (2008).
- Tran, D. Q., et al. GARP (LRRC32) is essential for the surface expression of latent TGF-β on platelets and activated FOXP3+ regulatory T cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (32), 13445-13450 (2009).
- Stockis, J., Colau, D., Coulie, P. G., Lucas, S. Membrane protein GARP is a receptor for latent TGF-β on the surface of activated human Treg. European Journal of Immunology. 39 (12), 3315-3322 (2009).
- Wang, R., et al. GARP regulates the bioavailability and activation of TGF-β. Molecular Biology of the Cell. 23 (6), 1129-1139 (2012).
- Vander Ark, A., Cao, J., Li, X. TGF-β receptors: In and beyond TGF-β signaling. Cellular Signalling. 52, 112-120 (2018).
- Heldin, C. H., Miyazono, K., ten Dijke, P. TGF-β signalling from cell membrane to nucleus through SMAD proteins. Nature. 390 (6659), 465-471 (1997).
- ten Dijke, P., Hill, C. S. New insights into TGF-β-Smad signalling. Trends in Biochemical Sciences. 29 (5), 265-273 (2004).
- Miyazono, K. TGF-β signaling by Smad proteins. Cytokine & Growth Factor Reviews. 11 (1-2), 15-22 (2000).
- Yu, Y., Feng, X. H. TGF-β signaling in cell fate control and cancer. Current Opinion in Cell Biology. 61, 56-63 (2019).
- Zhang, Y. E. Non-Smad pathways in TGF-β signaling. Cell Research. 19 (1), 128-139 (2009).
- Katsuno, Y., Lamouille, S., Derynck, R. TGF-β signaling and epithelial-mesenchymal transition in cancer progression. Current Opinion in Oncology. 25 (1), 76-84 (2013).
- Lamouille, S., Xu, J., Derynck, R. Molecular mechanisms of epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. 15 (3), 178-196 (2014).
- Yang, J., et al. Guidelines and definitions for research on epithelial-mesenchymal transition. Nature Reviews Molecular Cell Biology. 21 (6), 341-352 (2020).
- Zhang, Y., Weinberg, R. A. Epithelial-to-mesenchymal transition in cancer: complexity and opportunities. Frontiers in Medicine. 12 (4), 361-373 (2018).
- Brabletz, T., Kalluri, R., Nieto, M. A., Weinberg, R. A. EMT in cancer. Nature Reviews Cancer. 18 (2), 128-134 (2018).
- Ocana, O. H., et al. Metastatic colonization requires the repression of the epithelial-mesenchymal transition inducer Prrx1. Cancer Cell. 22 (6), 709-724 (2012).
- Ishay-Ronen, D., et al. Gain Fat-Lose Metastasis: Converting Invasive Breast Cancer Cells into Adipocytes Inhibits Cancer Metastasis. Cancer Cell. 35 (1), 17-32 (2019).
- Smith, C. J., Osborn, A. M. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiology Ecology. 67 (1), 6-20 (2009).
- Bustin, S. A., Mueller, R. Real-time reverse transcription PCR (qRT-PCR) and its potential use in clinical diagnosis. Clinical Science. 109 (4), 365-379 (2005).
- Sundqvist, A., et al. JUNB governs a feed-forward network of TGF-β signaling that aggravates breast cancer invasion. Nucleic Acids Research. 46 (3), 1180-1195 (2018).
- Persson, U., et al. The L45 loop in type I receptors for TGF-β family members is a critical determinant in specifying Smad isoform activation. FEBS Letters. 434 (1-2), 83-87 (1998).
- Dennler, S., et al. Direct binding of Smad3 and Smad4 to critical TGF-β-inducible elements in the promoter of human plasminogen activator inhibitor-type 1 gene. The EMBO Journal. 17 (11), 3091-3100 (1998).
- Piek, E., Moustakas, A., Kurisaki, A., Heldin, C. H., ten Dijke, P. TGF-β type I receptor/ALK-5 and Smad proteins mediate epithelial to mesenchymal transdifferentiation in NMuMG breast epithelial cells. Journal of Cell Science. 112, 4557-4568 (1999).
- Deckers, M., et al. The tumor suppressor Smad4 is required for transforming growth factor-β-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells. Cancer Research. 66 (4), 2202-2209 (2006).
- Souchelnytskyi, S., et al. Phosphorylation of Ser465 and Ser467 in the C terminus of Smad2 mediates interaction with Smad4 and is required for transforming growth factor-β signaling. Journal of Biological Chemistry. 272 (44), 28107-28115 (1997).
- Abdollah, S., et al. TβRI phosphorylation of Smad2 on Ser465 and Ser467 is required for Smad2-Smad4 complex formation and signaling. Journal of Biological Chemistry. 272 (44), 27678-27685 (1997).
- Petersen, M., et al. Oral administration of GW788388, an inhibitor of TGF-β type I and II receptor kinases, decreases renal fibrosis. Kidney International. 73 (6), 705-715 (2008).
- Gubelmann, C., et al. Identification of the transcription factor ZEB1 as a central component of the adipogenic gene regulatory network. Elife. 3, 03346 (2014).
- Nickel, J., Ten Dijke, P., Mueller, T. D. TGF-β family co-receptor function and signaling. Acta Biochimica et Biophysica Sinica. 50 (1), 12-36 (2018).
- Mazerbourg, S., et al. Growth differentiation factor-9 signaling is mediated by the type I receptor, activin receptor-like kinase 5. Molecular Endocrinology. 18 (3), 653-665 (2004).
- Rebbapragada, A., Benchabane, H., Wrana, J. L., Celeste, A. J., Attisano, L. Myostatin signals through a transforming growth factor-β-like signaling pathway to block adipogenesis. Molecular and Cellular Biology. 23 (20), 7230-7242 (2003).
- Jonk, L. J., Itoh, S., Heldin, C. H., ten Dijke, P., Kruijer, W. Identification and functional characterization of a Smad binding element (SBE) in the JunB promoter that acts as a transforming growth factor-β, activin, and bone morphogenetic protein-inducible enhancer. Journal of Biological Chemistry. 273 (33), 21145-21152 (1998).
- Thiery, J. P., Sleeman, J. P. Complex networks orchestrate epithelial-mesenchymal transitions. Nature Reviews Molecular Cell Biology. 7 (2), 131-142 (2006).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5 (7), 605-607 (2008).
- Gellibert, F., et al. Discovery of 4-{4-[3-(pyridin-2-yl)-1H-pyrazol-4-yl]pyridin-2-yl}-N-(tetrahydro-2H- pyran-4-yl)benzamide (GW788388): a potent, selective, and orally active transforming growth factor-β type I receptor inhibitor. Journal of Medicinal Chemistry. 49 (7), 2210-2221 (2006).
- Ishay-Ronen, D., Christofori, G. Targeting Cancer Cell Metastasis by Converting Cancer Cells into Fat. Cancer Research. 79 (21), 5471-5475 (2019).
- Gupta, P. B., et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening. Cell. 138 (4), 645-659 (2009).
- Pattabiraman, D. R., et al. Activation of PKA leads to mesenchymal-to-epithelial transition and loss of tumor-initiating ability. Science. 351 (6277), (2016).
- Gao, D., et al. Myeloid progenitor cells in the premetastatic lung promote metastases by inducing mesenchymal to epithelial transition. Cancer Research. 72 (6), 1384-1394 (2012).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-β type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
Erratum
Formal Correction: Erratum: Studying TGF-β Signaling and TGF-β-induced Epithelial-to-mesenchymal Transition in Breast Cancer and Normal Cells
Posted by JoVE Editors on 12/15/2020. Citeable Link.
An erratum was issued for: Studying TGF-β Signaling and TGF-β-induced Epithelial-to-mesenchymal Transition in Breast Cancer and Normal Cells. NMuMG was mislabeled as cancer cells.
NMuMG cells are non-transformed epithelial breast cells established from a mouse mammary gland. NMuMG cells are frequently used as a model system to investigate TGF-β-induced epithelial to mesenchymal transition (EMT). EMT is induced by TGF-β in premalignant human MCF 10A-RAS (M2) cells and mouse MMTV-PyMT breast cancer cell line. The article has been updated to reflect this.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved