Method Article
来自肠道密码的穆林原结肠上皮单层的生成
摘要
在此协议中,我们描述了如何直接从肠道密码生成穆林原发性上皮结肠单层。我们提供实验方法,在透气过滤器上生成汇流单层,在划痕伤口愈合和生化研究中产生汇流单层,以及用于免疫荧光分析的稀疏和共生单层。
摘要
肠道上皮由一层细胞组成,作为肠道流明和身体内部之间的屏障。此屏障连续性的中断可能导致炎症性疾病,如炎症性肠病。肠道上皮生物学研究的局限性之一是缺乏初级细胞培养模型,这迫使研究人员使用来自癌细胞的细胞系模型。三维(3D)肠子的出现为上皮生物学家提供了产生原细胞培养的有力工具,然而,这些结构嵌入细胞外基质中,缺乏分化肠道上皮细胞的成熟特性。一些产生肠道上皮单层的技术已经发布,但大多数来自既定的3D肠子,使这个过程费力和昂贵。在这里,我们描述了一个协议,直接从穆林肠道密码生成主要上皮结肠单层。我们还详细介绍了可用于此模型的实验方法,例如在透气过滤器上生成汇流培养物、用于划伤愈合研究的汇流单层以及用于免疫荧光分析的稀疏和共生单层。
引言
肠道上皮细胞(IEC)线肠道形成一个选择性渗透屏障,允许营养和水吸收,同时防止微生物和毒素进入身体 1。肠道粘膜由称为维利(只存在于小肠中)的发光投影和称为密码的入侵组成。Villi 和结肠密码的表面由分化上皮细胞覆盖,而墓穴的基座由干细胞组成,这些干细胞使肠道上皮迅速更新,其周转时间从 3 天到 7 天不等。肠道干细胞(ISC)不仅对维持肠道间质平衡很重要,而且对修复受损的上皮2也很重要。
肠道上皮生物学的研究因缺乏初级细胞培养而受限,转化的细胞系是唯一可用的工具。肠道上皮模型细胞系无法准确复制正常肠道上皮的生理学。来自ISC的3D培养物的发展为肠道粘体生物学家提供了类似于体内肠道粘糖条件的体外模型3。隐体可以很容易地从穆林样品中分离出来,嵌入在地下室膜基质介质(如甲基基)中,生长在含有Wnt3a、R-spondin和Noggin的有条件介质中,产生被称为肠子(小肠)或结肠类(大肠)4的3D结构。肠类和结肠体是极化球形结构,其中阿皮卡尔域面对内部流明,基底区域与细胞外基质直接接触。肠类和结肠类含有所有主要分化的肠道上皮亚类型,如肠细胞/结肠细胞、帕内西特、肠内分泌和哥布莱特细胞,它们出现的比例与肠道中从5中分离的部分相对相同。尽管3D肠和结肠类是肠道发育和生理学研究的重大进展,但这些模型存在某些缺点,例如对上皮细胞(lumen)的阳极表面的有限访问,以及向上或向下扩展培养物以实现对感兴趣分子的高通量筛选的能力。为了克服这些限制,生成了从 3D 肠形/结肠体中获取 IEC 原始 2D 文化的协议。2D肠状体/结肠体像模型细胞系一样生长,是研究肠道伤口修复、宿主-病原体相互作用和再生医学等的理想之选。几篇发表的论文描述了如何从3D结构或直接从肠道密码产生2D单层(见6,7,8,9,10,11),但这些方法往往是劳动密集型的,很难复制。本协议概述了一种快速、简单且可重复的方法,可直接从新分离的鼠标肠道密码中获取单层。
在这里,我们详细解释了密码提取过程与最小的碎片生成,细胞外基质选择和不同的表面和应用为这项技术。这种实验方法对结肠密码进行了优化,但在小肠应用时也获得了类似的结果。
研究方案
下文所述的所有程序均已根据密歇根大学机构动物护理和使用委员会制定的准则获得批准和执行。
1. 为隐秘隔离和文化准备试剂(在组织培养罩中准备)
- 50 m 乙酰胺四乙酸 (EDTA): 添加 50 mL 0.5 M 库存至 450 mL 磷酸盐缓冲盐水,无钙 (Ca2+)和镁 (Mg2+)以准备 500 mL。在此协议中,PBS 将指没有钙和镁的 PBS,除非另有说明。
- 摇动缓冲区:在PBS中溶解7.4克蔗糖(43.3毫米)和5克山醇(54.9毫米),准备500mL。
- L-WRN (L-温特-3A, R-斯庞丁和诺金)媒体:补充高级杜尔贝科的改良鹰中型/哈姆的F-12(DMEM/F12)(780毫升)与20%胎儿牛血清(FBS)(200毫升),1x市售谷氨酰胺补充剂(10毫升),100U/mL青霉素和, 100克/mL链霉素(10mL),并使用0.22微米过滤器对过滤器进行消毒。
- 通过 ATCC 获取 L-WRN 细胞,在 T175 烧瓶中生长,并选择使用遗传素和海霉素。媒体被更改并收集12天。
注:每批媒体都使用 TOPflash Wnt 记者检测测试 Wnt 活动。在这种情况下,遵循密歇根医学转化组织建模实验室协议(https://www.umichttml.org/protocols)。TOPflash HEK 293 细胞系在 T75 烧瓶中生长为并入,尝试去皮化并镀在 96 井板上。第二天,收集的介质的不同稀释被添加到细胞中,并在 5% 的 CO2 孵化器中以 37 °C 的夜间孵化。第二天,细胞被解冻,萤火虫路西法酶检测按照制造商的指示进行。使用重组的 Wnt-3A 使检测正常化。介质分为 25 mL 的 50 mL 圆锥管中的别名,储存在 -80 °C。
- 通过 ATCC 获取 L-WRN 细胞,在 T175 烧瓶中生长,并选择使用遗传素和海霉素。媒体被更改并收集12天。
- 基础媒体: 对于 500 毫升, 补充高级 DMEM/F12 (448 mL) 与 2x 市售谷氨酰胺补充剂 (10 mL), 20 mM HEPES (10 mL), 100 U/mL 青霉素和, 100克/毫升链霉素(10毫升)、2毫米N-乙酰-L-半胱氨酸(2mL)、N2补充剂(10毫升)和B27补充剂(20毫升),过滤器用0.22微米过滤器消毒。将介质分成 25 mL 的二元组,放入 50 mL 圆锥管中,并存储在 -80 °C。
- LWRN 完整介质:将 25 mL LWRN 介质与 25 mL 基础介质相结合,并补充 200 ng/mL 表皮生长因子 (EGF) (20μL) 和 2x 抗生素抗菌溶液 (1 mL)。将完整媒体存储在 4 °C。
- 胶原蛋白和拉米宁:在5mL滤清剂中溶解5毫克粉末,灭菌100m醋酸(将60微升醋酸储存量加入9.94毫升分子级水),产生1毫克/mL的库存浓度。在 4 °C 旋转 4 小时,在 0.2 mL 管中制作 100 个 μL 等离子。冻结在-20°C。 拉米宁以100微克/mL的库存浓度购买。
- 完全无生长因子的媒体 (CMGF-): 补充高级 DMEM/F12 (500 mL) 与 1x 市售谷氨酰胺补充剂 (5 mL), 10 mM HEPES (5 mL), 100 U/mL 青霉素和, 100 g/mL 链霉素 (5 mL).
- 差异化介质:以 9.2 mL 的 CMGF- 介质, 添加 200 μL 的 B27 补充剂、100μL 的 N2 补充剂、20μL 的 N-乙酰-L-半胱氨酸、500 μL 的诺金介质12( 由产生诺金的细胞制成)和 2 μL 的 EGF,使 10 毫升的分化介质。
2. 准备板、室幻灯片和细胞培养膜插入
- 涂层 48 井板和室滑梯电镀 2D 单层:使用涂层溶液,构成层氨酸 (1:40 稀释,见 材料表) 和胶原蛋白 (1:30 稀释) 在冷杜尔贝科的磷酸盐缓冲盐水, 与 Ca2+ 和 Mg2 + (DPBS).在每个井中加入 200μL 的涂层溶液,并在 5% 的 CO2 孵化器中预孵化板/室滑动,在 37 °C 下至少 2 小时。
- 涂层 0.4 μm 细胞培养膜插入:在分子级水中稀释胶原蛋白 1:30,并在每个插入中加入 200 μL。将包含膜插入冰层的板保持在 4 °C 下 30 分钟。孵化30分钟后,将板材保持在5%的CO2 孵化器中,在37°C下保持1.5-2小时。聚酯和聚碳酸酯膜插入产生可比的结果。
注意:任何组织培养板都可以使用此协议进行播种(可进行向上和向下扩展),调整胶原蛋白/层蛋白体积,以获得电镀表面的全覆盖。
3. 隐秘隔离
注意:在开始解剖之前,准备胶原蛋白和/或层蛋白涂层板/膜插入/室滑梯,并将它们留在 5% CO2 孵化器中,在 37 °C。 准备一个清洁的工作台和适合手术的无菌手术器械,以及一个生物安全柜,用于培养2D单层。确认其他 2D 单层培养标准设备(如加湿 CO2 孵化器、台式离心机(保持在 4 °C)、显微镜和移液器(包括血清移液器)已准备就绪。
- 使用C57Bl/6小鼠,8-12周大。使用经批准的安乐死方法对小鼠实施安乐死。
- 用70%乙醇(EtOH)溶液喷洒小鼠尸体,以清洁解剖区域,并使用纸巾去除多余的EtOH。
注意:确保加密隔离试剂(如PBS、50m EDTA、摇动缓冲器)加密保持冷。这些试剂可以提前一天准备,在4°C储存时至少可使用3个月。 此外,请确保 LWRN 完整介质保持在珠子/水浴中,一直保持在 37 °C,直到使用。 - 使用干净的解剖剪刀和钳子,解剖结肠从直肠到粪坑。使用钳子保持结肠末端,用装有 20 G 喂食管(图 1A)的 10 mL 注射器中的冰冷 PBS 轻轻冲洗粪便。确保不要破裂结肠。
- 取出近端冒号。这将是离伊洛塞卡尔交界处最近的结肠部分。
- 用钳子,轻轻地将解剖结肠滑到20 G喂食管上,用4-0丝缝线(图1B)将管末端的结肠绑起来。
- 用手指将结肠从内到外倒置,用 4-0 丝缝线绑住另一端。使用手术剪刀,在喂食管尖下切结肠(图1C,D,E)。
- 使用 1.25 mL 重复注射器的柱塞,轻轻地将倒置结肠的未绑起端打开到 1.25 mL 重复注射器的尖端。将倒置的冒号滑到注射器的末端,用 4-0 丝缝线紧密结合(图 1F,G)。
- 将柱塞插入注射器,使结肠充气形成香肠。膨胀,直到结肠香肠看起来结节,没有明显的皱纹 (图1H).
- 将注射器/结肠放在15mL管中,在冰上放置5mL细胞恢复溶液20分钟,每5分钟充气一次,使结肠放气一次(图1I)。香肠在孵化过程中必须保持充气。
- 使用重复注射器尖端下方的 4-0 丝缝线与结肠充气配合使用。切断重复注射器的香肠,放在15mL管中,内含10mL的50mM(小肠2mM)EDTA 40分钟,在4°C(图1J,K)旋转。
- 关闭 EDTA 解决方案,并更换为 5 mL 的摇动缓冲器。手动在垂直位置(大力)摇动香肠2分钟。
- 将摇动溶液放入新的 15 mL 管中,在摇动缓冲区中重复摇动步骤,共 10 mL 的加密。
- 在培养皿中取 20 μL 的墓穴悬架,并计算显微镜下的墓穴数量。根据浓度计算墓穴/μL中的墓穴浓度,稀释样品,在电镀时获得5个密码/μL(1000个密码/厘米2)。
- 使用桌面离心机在 400 x g 下使用隔离的加密器旋转管子,在 4 °C 下旋转 10 分钟。
- 同时,从孵化器中取出48个井板/插入/室滑梯,并将其放置在生物安全柜中。使用 P200 吸气涂层溶液,将板盖稍稍偏移,直到细胞准备好镀层。
4. 培养 2D 单层
注:关于如何从3D结肠体中生成肠道上皮单层检查协议的详细协议,由埃斯特斯和科夫巴斯纽克实验室(7,11)。
- 使用 10 mL 血清移液器取出摇晃缓冲器。确保颗粒完好无损,并可以使用 P1000 去除剩余的任何液体。用 P1000 将颗粒重新悬浮在 LWRN 的 3 mL 中,并上下悬挂整个介质和移液器。在涂有预涂层的 48 井板/室滑梯的每口井中加入 200μL 的墓穴,并在 37 °C 的 5% CO2 孵化器中孵化。
- 第二天,使用 P200 吸气媒体并添加新鲜媒体。细胞在24-48小时内汇流。
- 对于细胞培养膜插入,在插入器顶部添加 200 μL 密码(5 个密码/μL),在底部添加 600 μL 的完整 L-WRN 介质。第二天,使用P200向媒体发号充气,只在顶室中添加新鲜媒体。在 37 °C 的 5% CO2 孵化器中孵化板。 每天使用上皮伏特/欧米(EVOM)测量跨皮电阻 (TEER)。
注:如果文化具有超过300 Ω.cm2的TEER读数,它们是要汇编的。在3-4天内实现汇流。每2天更换一次媒体。
结果
为了说明主要上皮结肠单层培养物的可靠性,显示了从协议中提取的加密隔离和代表性图像的摘要。用户必须记住,隔离的墓穴是在无菌条件下培养的,因此正确解剖和清洁结肠是一个优先事项。图 1在加密隔离期间具有关键步骤。隔离的墓穴(图2A)现在被计算和浓缩(图2B),以获得5个墓穴/μL的浓度。在集中准备了密码后,细胞将以所需的格式(培养皿、膜插入物或室滑梯)镀金,并根据实验需要用适当的介质孵育。图3显示48井板块中24小时和48小时文化后的文化发展。细胞被孵育,直到达到所需的汇流。为了说明这种方法的可能应用,我们允许48口井板井达到汇流,并着手进行刮伤检测。图4描绘了2D结肠单层中新产生的划痕(图4A),以及24小时后相同的伤口(图4B)。很明显,这种文化仍然是健康和可行的,并且有伤口修复。为了生成差异化单层,媒体从 LWRN 更改为分化介质。差异化通过显示高 TEER 值 (图 5A),减少 ISC 标记((富含乳糖素的重复性 G 蛋白耦合受体 5 (Lgr5) 和 Achaete-scute 如 2 (Ascl2) 和差异化标记的增加来实现 (阿兰尼尔氨基肽酶 (安佩普), 粘液 2 (Muc2), 溶酶 1 (Lyz1), 蔗糖异种马耳他 (姐姐) 和克莫格拉宁 A (Chga)) (图 5B,C)由 PCR .CDX2 和 KRT20 的其他标记也可以包含在此面板中。除了mRNA表达水平外,在分化条件下生长的2D结肠中分化上皮细胞的亚类型外观也通过免疫荧光(Muc2和Chga) 显示:图5D)。
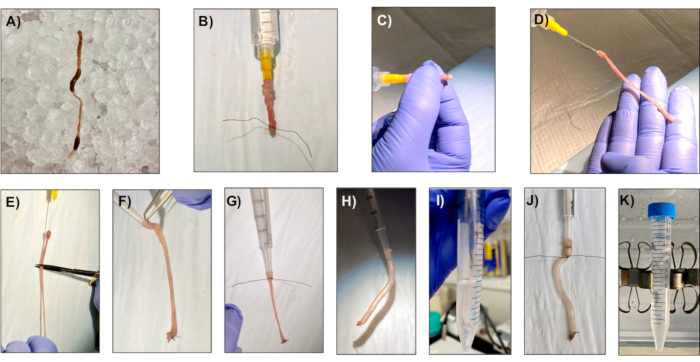
图1:为健康的单层生成准备样品。 样品制备对于生成健康的单层至关重要。此图中描述了隔离过程的关键步骤,以便读者更容易了解。结肠从鼠标中切除,确保没有毛皮剩菜。小心地去除粪便,确保不会穿孔结肠;这是至关重要的,因为结肠需要能够保持空气和膨胀和放气。 请单击此处查看此图的较大版本。
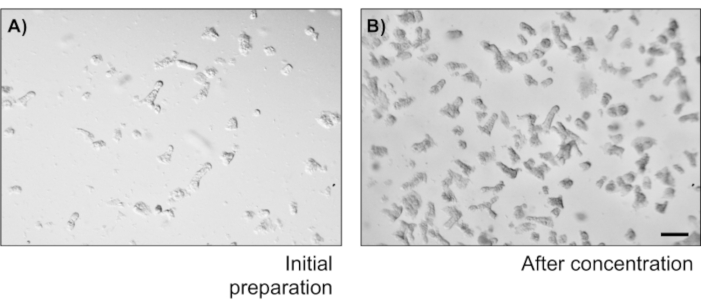
图2:隐性隔离计数和浓度。 (A) 摇动结肠香肠后结肠墓穴。该图像描绘了 20μL 下降的字段。(B) 加密浓度以获得 5 个密码/μL。 比例栏: 1 毫米。 请单击此处查看此图的较大版本。
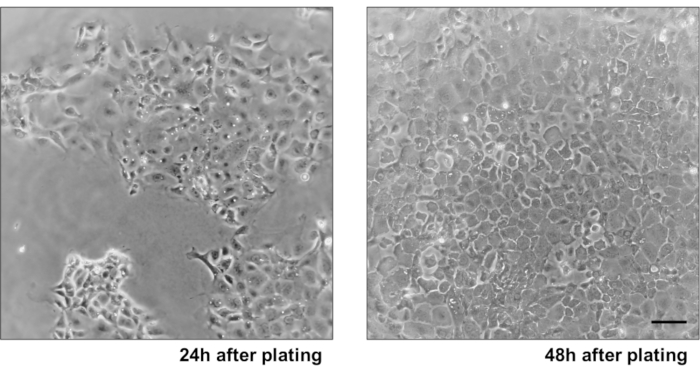
图3:主要IEC单层生长。 (A) 2D IEC 单层后,24小时的电镀和清除细胞碎片。(B) 电镀后 48 小时汇合 2D IEC 单层。比例栏: 10μm. 请单击此处查看此图的更大版本。
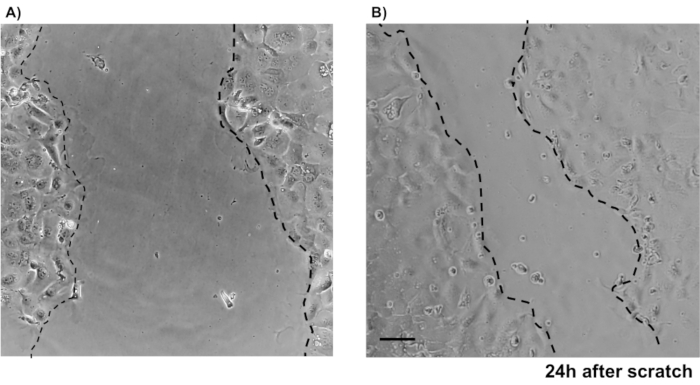
图4:使用穆林原选 IEC 划伤伤口检测。 显示伤口愈合后划伤的图像是在上皮结肠单层。比例栏: 5μm. 请单击此处查看此图的更大版本。
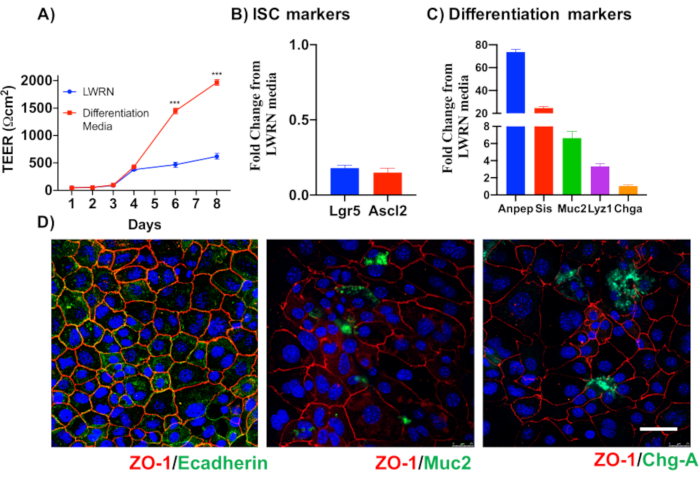
图5:上皮结肠单层的分化。 (A) 分化介质产生紧密的上皮屏障,TEER证明了这一点。分化介质导致(B) 干细胞标记的 mRNA 表达量下降,并导致(C)分化标记的上调节。(D) 通过直接二维结肠的免疫荧光,也可以检测出Muc2和染色格拉宁-A等特殊分化上皮细胞的标记物。比例栏: 5μm. 请单击此处查看此图的更大版本。
讨论
我们的协议提供了一个快速、可重复和可靠的方法来生成直接的主 2D IEC 单层。与之前公布的生成结肠上皮单层的协议相比,我们协议的主要区别之一是,我们不会将结肠切成小块来解放墓穴。相反,我们修改了一个协议,通过化学和机械力的组合,将肠道上皮从mesenchyme13 中分离出来,以极其干净的制备释放墓穴(图2),为研究人员提供理想的材料来产生初级培养物。我们的隔离方法也可用于生成3D肠和结肠。每次进行实验时,都要进行加密计数,使被镀的墓穴数量正常化。变量,如结肠香肠涡轮,隔离速度,用户专业知识可以影响隔离的墓穴数量。协议中提到的电镀加密浓度是一个起点,但每个用户要考虑用户驱动的变量,必须优化它。我们使用这种技术对男性和女性WT小鼠从8到20周不等,我们没有看到细胞生存的重大差异,在理论上,从年轻小鼠分离的墓穴有更好的生存机会。墓穴被镀得过多,因为只有一小部分贴在表面并存活下来。一个平衡,有足够的密码,有一个50%的汇定后一天电镀,但不是太多的加密,其中垂死的密码将有细胞毒性作用是目标。LWRN 介质必须在电镀后 24 小时小心地清除,以消除死墓穴和碎屑,这必须小心避免分离已经作为单层生长的细胞。
在初始去除 LWRN 介质后,用户必须确定实验条件是否需要保持更接近干细胞的原生 IEC 单层,并添加新的 LWRN 介质,或者是否需要单层分化,请替换为分化介质。此协议中最重要的一个因素是在隔离过程中确保结肠的完整性。如果发生破裂,可以缩短香肠以消除受损区域。在将香肠放入 EDTA 之前,请确保结尽可能紧。如果香肠在 EDTA 孵化后放气,则协议可以继续,对整体加密产量影响甚微或根本没有影响。如果重复注射器不可用,常规注射器上附加的普通微皮尖也可以用于通货膨胀和通货紧缩的过程。此外,如果没有细胞恢复解决方案,通货膨胀和通货紧缩的步骤可以在EDTA(200万小肠,50m结肠)完成,但不建议这种替代。如果不需要共存,墓穴可以生长在只涂有胶原蛋白的板中,甚至可以在未涂层的板中生长。只使用未涂层板的情况下,没有其他选择,但细胞不会像在胶原蛋白涂层板健康生长。在文化健康和稳定性方面,镀在塑料中的单层可健康4至5天,而镀在转井中的单层可携带长达8天。
这种方法的主要局限性之一是生长上皮结肠单层所需的细胞介质。LWRN 电池在 ATCC 提供,但 LWRN 条件介质生成是劳动密集型的,需要使用荧光光谱仪来确定 Wnt 活性。分化介质需要在使用前添加一些新鲜的试剂,这使得它成为一个乏味的过程。最后,这些试剂大多是昂贵的,很容易燃烧试剂在快节奏。如果实验室希望建立这种技术,而没有以前的肠道初级细胞培养,强烈建议找到一个有经验的合作者/学院,并培训他们的一个成员。
由于器官培养所需的地下膜基质中等和大量条件介质的成本,3D 培养的维护可能成本高昂,但它具有使用数量减少的小鼠和生成结构可以多次通过的优势。肠类化合物(源自小肠)相对容易分离和维持,而结肠体则更细腻,生长速度较慢,通过能力更有限。3D结肠体的单层生成需要不成比例的3D结构,使得这类实验耗时且成本高昂。相反,直接上皮结肠单层准备是快速的,是获得结果的快速方法。一个结肠准备可以产生一个75厘米2(10至15 mL的有条件介质,更换一次)2至3天后电镀(这个区域将需要144口3D结肠体井,这意味着近6mL的Matrigel和超过250 mL的有条件介质)。介质消耗低、细胞培养维护成本低、功能测试能力强、下游处理快是上皮结肠单层的一大优势。
该协议是研究肠道上皮细胞生物学在细胞粘附、极性和分化等领域的宝贵工具。它的优势是从转基因小鼠(敲击,过度表达,记者)产生原细胞培养。主肠道上皮单层允许轻松访问肛门和基底表面(当镀在透水井上时),从而能够研究不同细胞类型的渗透性、屏障和跨层迁移。最后,该模型可用于不同领域,如宿主-病原体相互作用、上皮损伤、修复和药物发现。
披露声明
作者没有任何利益冲突。
致谢
这项工作得到了克罗恩和结肠炎基金会职业发展奖(544599,MQ)和NIH赠款(DK055679,DK089763,DK059888,给AN)的支持。我们要感谢密歇根医学转化组织建模实验室的不断帮助和访问他们的试剂和协议。
材料
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Antibiotic Antimycotic solution | Corning | 30-004CI | |
| B27 supplement (50X) | Gibco | 12587-010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen from human placenta (type IV) | Sigma-Aldrich | C5533 | |
| D-Sorbitol | Sigma | 85529-250G | |
| D-Sucrose | Fisher Scientific | BP220-1 | |
| Dulbecco’s phosphate buffered saline, with Ca2+ and Mg2+ (DPBS) | Corning | 21-030-CV | |
| Epithelial Volt/Ohm meter | World Precision Instruments | 0-10KΩ with STX2 (EVOM2) | |
| Ethylenediamine tetraacetic acid (EDTA) | Lonza | 51201 | |
| Fetal Bovine Serum (FBS) | Corning | 35-016-CV | |
| Firefly Luciferase assay | Biotium | 30085-2 | |
| Geneticin | Gibco | 10131-035 | |
| GlutaMAX (100X) | Gibco | 35050-061 | |
| HEPES (1M) | Corning | 25060CI | |
| Human recombinant EGF | R&D systems | 236-EG | Stock Concentration: 500µg/mL |
| Human recombinant Wnt-3A | R&D systems | W3a-H-005 | |
| Hygromycin B | Invitrogen | 10687010 | |
| LWRN cells | ATCC | CRL-3276 | |
| Molecular grade water | Corning | 46-000-CV | |
| N2 supplement (100X) | Gibco | 17502-048 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165-5G | Stock Concentration: 500mM |
| Noggin | Conditioned media | - | |
| Nunc Lab-Tek Chamber slide system | Sigma-Aldrich | C7182-1PAK | |
| Pencillin-Streptomycin (10,000U/mL) | Corning | 30002CI | |
| Phospahte buffered saline, Ca2+ and Mg2+ free (PBS) | Corning | 21-040-CV | |
| Plastic 20G feeding tube | Fisher Scientific | 50-810-46 | |
| rh-laminin-521 | Gibco | A29248 | Stock concentration: 100µg/mL |
| Roboz Surgical 4-0 Silk Black Braided 100YD | Fisher Scientific | NC9452680 | |
| TOPflash HEK293 cells | ATCC | CRL-3249 | |
| Transwell Permeable supports (0.4µm) | Corning | 3470 |
参考文献
- Quiros, M., Nusrat, A. Contribution of wound-associated cells and mediators in orchestrating gastrointestinal mucosal wound repair. Annual Reviews in Physiology. 81, 189-209 (2019).
- Blutt, S. E., et al. Use of organoids to study regenerative responses to intestinal damage. American Journal of Physiology-Gastrointestinal and Liver Physiology. 317 (6), 845-852 (2019).
- Zhang, M., Liu, Y., Chen, Y. G. Generation of 3D human gastrointestinal organoids: principle and applications. Cell Regeneration. 9 (1), 6(2020).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Zachos, N. C., et al. Human enteroids/colonoids and intestinal organoids functionally recapitulate normal intestinal physiology and pathophysiology. Journal of Biological Chemistry. 291 (8), 3759-3766 (2016).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- In, J. G., Foulke-Abel, J., Clarke, E., Kovbasnjuk, O. Human colonoid monolayers to study interactions between pathogens, commensals, and host intestinal epithelium. Journal of Visualized Experiments. (146), e59357(2019).
- Cardenas, D., et al. Two- and three-dimensional bioengineered human intestinal tissue models for cryptosporidium. Methods in Molecular Biology. 2052, 373-402 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Zou, W. Y., et al. Human intestinal enteroids: New models to study gastrointestinal virus infections. Methods in Molecular Biology. 1576, 229-247 (2019).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
- Nik, A. M., Carlsson, P. Separation of intact intestinal epithelium from mesenchyme. Biotechniques. 55 (1), 42-44 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。