Method Article
赫尔姆霍尔茨-曾特鲁姆柏林水晶碎片筛选工作流程和工具
摘要
柏林赫尔姆霍尔茨-曾特鲁姆酒店的晶体碎片筛选工作流程采用专用复合库、晶体处理工具、快速数据收集设施和大部分自动化数据分析。所提出的协议旨在最大限度地提高此类实验的产出,为下游基于结构的配体设计提供有希望的起点。
摘要
碎片筛选是一种技术,有助于确定有希望的起点为配体设计。鉴于目标蛋白质的晶体是可用的,并且具有可重复的高分辨率X射线衍射特性,晶体学是选择碎片筛选的最首选方法之一,因为它的灵敏度。此外,它是提供碎片结合模式详细3D信息的唯一方法,对随后的理性复合进化至关重要。该方法的常规使用取决于是否有合适的碎片库、处理大量样品的专用方法、用于快速衍射测量的最先进的同步加速器光束线以及分析结果的大致自动化解决方案。
在这里,介绍了完整的实际工作流程和关于如何在柏林赫尔姆霍尔茨-曾特鲁姆(HZB)进行晶体碎片筛选(CFS)的工具。在此工作流程之前,为可重复的晶体实验优化了晶体浸泡条件和数据收集策略。然后,通常在一到两天的程序中,一个96名成员的CFS焦点库作为干即用板提供,用于浸泡192个晶体,然后单独闪冷。最终的衍射实验可以在一天内在德国柏林-阿德勒肖夫HZB操作的BESSY II电子存储环的机器人安装支持光束线BL14.1和BL14.2上进行。使用专用服务器上的专用软件管道快速、大量自动化地处理晶体图数据、优化蛋白质结构和命中识别,只需很少的用户输入。
使用 HZB 的 CFS 工作流进行常规筛查实验。它增加了成功识别碎片命中作为起点的机会,以开发更有效的粘合剂,可用于药理学或生化应用。
引言
药物开发的第一步是针对感兴趣的目标筛选化合物。传统上,大型复合库在制药行业的高通量生化检测中使用大约 100,000-1,000,000 个条目。该策略辅之以基于碎片的药物设计 (FBDD),这是一种较新的方法,在过去 20 年中急剧上升,并成为主流战略,以产生高质量的领先候选者,由于该方法1的几个固有优势。术语"碎片"是指一个通常含有小于20个非氢原子或重原子(HAs)的小有机分子。因此,片段比传统高通量筛选中探索的药物或铅状分子(通常小于 30 HAs)要小得多。碎片是弱亲和力活页夹。然而,与较大的分子相比,碎片更加多才多艺,因为即使是少量的碎片也能更好地代表相同大小2的分子各自的化学空间。此外,进化的片段筛选击中铅分子比优化已经较大的分子2,3,4,5要有效得多。这意味着,在检测足够敏感之前,可以有效地利用碎片的筛选,并产生高质量的起点,以进一步进行复合进化。几种生物物理方法可用于碎片筛选,其中最受欢迎的是核磁共振、X射线晶体学、表面质子共振和热移检测。这些方法是平行或按顺序使用的,目的是增加对命中的信心,并分别减少误报或假阴性的数量。然而,最近进行的比较研究6表明,由于不同方法之间的重叠性较低,应避免连续筛查级联。
X射线晶体学是原子细节结构测定方法,但最近也已开发成用于筛选目的7、8的工具。由于蛋白质晶体耐受高碎块浓度(例如100mM),晶体片段筛选(CFS)可以与其他生物物理方法竞争,以筛选片段,甚至优于它们作为第一步筛选方法6,9。然而,CFS的一个重要先决条件是目标蛋白质的验证结晶系统,该结晶系统可重复地将具有衍射特性的晶体传送到相当高的分辨率,通常优于2。
与所有其他片段筛选方法相比,CFS 的一个独特好处是提供有关已识别片段绑定模式的详细 3D 信息。这种结构信息对于对高亲和力粘合剂的片段的合理优化绝对至关重要。既定的细化策略正在增长,合并,并链接片段命中5。因此,从一开始就提供了相对较高的配体效率,可以避免引入不必要的或空间上不合适的组,从而降低化学合成成本。总之,CFS作为药物设计的开始策略具有无可匹敌的优势。
鉴于特定的生物目标符合 CFS 对晶体质量的高要求,因此存在一些主要因素,最大限度地提高了此类筛选活动成功的结果的机会。这取决于所使用的碎片库的质量,取决于在衍射实验之前进行实验的有效工作流程,取决于具有足够自动化和数据收集速度的同步加速器光束,以及在很大程度上实现数据处理和分析的方式和手段。在这里,从晶体浸泡实验到命中识别的完整工作流程呈现在BESSY II(图1)的大分子晶体学光束线中。该设施对学术和工业用户开放以供协作使用。此外,德国以外的欧盟国家的学术用户可以通过 iNEXT 发现项目直接申请资金。
能够启动 CFS 运动并执行本工作中概述的协议,有不可或缺的先决条件:目标蛋白质的差异化晶体可以大量重复生长,在环境温度下稳定,并且使用不含高挥发成分的结晶鸡尾酒种植。另一个先决条件是晶体晶格适合实验。在适当的格子中,目标蛋白质的有趣部位必须暴露在溶剂通道上,从而可访问。另一个前一步是可选的,但仍然强烈建议,以确保在CFS运动的工作流程的成功是优化浸泡条件的实验。此处的重要基准统计是晶体的衍射功率和相关数据质量指标,这些指标是在数据缩放过程中确定的。需要优化的典型因素是 DMSO 耐受性、缓冲浓度和低温保护剂。虽然不是下面进一步详细描述的严格先决条件,但DMSO作为一种共同溶剂可以帮助增加碎片溶解。典型测试应包括浸泡 0、3、6 或 10% (v/v) DMSO 过夜。将缓冲浓度提高到 200 或 300 mM 有助于防止由于使用高碎片浓度而偶尔产生的 pH 转移效应导致衍射质量损失。最后,确定是否需要以及需要哪些额外的低温保护剂,以及是否已经将其纳入浸泡状态,是决定性的。然而,在许多情况下,不需要额外的低温保护剂,因为DMSO本身可以充当低温保护剂。如果是这样,这将在最后的实验中节省一个处理步骤。大多数晶体需要更少的低温保护剂,如果在适当大小的循环上闪冷,尽可能减少或避免周围的母酒。然而,在极少数情况下,确实需要一层母酒来防止闪光冷却时对晶体的损坏。
CFS 运动中获得的点击次数不仅取决于目标蛋白质的可药性和晶格的适宜性(见上文),还取决于库的质量。图书馆质量包括两个方面:为图书馆选择化合物和化合物的糖果(即在其中物理形式,它们呈现为实验)。对于化合物选择,可以采用不同的策略。大多数图书馆设计包括最大限度地提高碎片的化学多样性。战略重点可能是将碎片的化学可传性纳入后续设计,例如在钻石-SGC-iNEXT 准备库10中应用。然而,图书馆设计的另一个战略重点可能是通过基于形状和药理磷的聚类最大限度地呈现可商业上的碎片化学空间,HZB11开发的 F2X 库就是例证。更具体地说,1103 人 F2X 通用库和代表 96 复合子集的初始 CFS 活动(称为 F2X 进入屏幕)已经开发,F2X-入口屏幕已成功验证11。F2X 进入屏幕是 HZB CFS 活动的主要选择。随后,您可以使用 F2X 通用图书馆或 HZB 提供的 1056 成员的欧盟 OPENSCREEN 片段库12 开展更大的活动。目前,这些图书馆可根据合作合同免费提供给柏林BESSY II同步加速器的巨分子晶体光束线的用户。这也适用于用户通过 iNEXT 发现建议。此外,根据物质转移协议,所有感兴趣的科学家都可以使用 F2X-入口屏幕。
关于图书馆的物理呈现,通常采用两种方法:碎片要么用作DMSO库存解决方案,要么碎片在现成的板材上干燥和固定。在 HZB,F2X 入口屏幕和 F2X 通用库的非挥发性化合物均作为干性化合物呈现在 3 镜头 96 井 MRC 低姿态结晶板中。在结晶板中固定的碎片的呈现有两个至关重要的优势:第一,它允许将筛选板运送到用户的家庭实验室。因此,此处介绍的工作流程(步骤 1-3)的浸泡和晶体处理步骤可以在任何地方进行。其次,可以采用无DMSO解决方案。因此,DMSO 敏感目标可以很容易地筛选,基本上保留了预期命中率11。但是,DMSO 确实增加了碎片溶解性,因此值得事先检查上面概述的所选晶体系统的 DMSO 耐受性。
下面概述的协议将描述一个典型的实验与96复合屏幕,如F2X-入口屏幕。为此,需要及时准备大约250个晶体才能重新使用。建议为所有 96 种重复化合物准备浸泡剂。建议,但可选的,准备额外的模拟浸泡,稍后将帮助数据分析使用泛数据密度分析(PanDDA)的方法命中识别13。模拟浸泡被定义为使用与碎片浸泡相同的浸泡溶液浸泡蛋白质晶体的浸泡实验,但不存在碎片。如果浸泡溶液等于结晶条件,晶体可直接从结晶板中采集。
根据机器人样品更换器的功能,可能需要使用不同的冰球格式。目前,HZB 操作的光束线 BL14.1 的样品需要以 Unipuck 格式准备,HZB 操作的光束线 BL14.2 的样品需要以 SPINE 冰球格式准备。在此协议中,假设采用未提普格式进行准备。
研究方案
1.浸泡晶体
- 从 -20 °C 冰柜取出筛选板(此处为 F2X-入口屏幕板, 图 2),放在长凳/桌子上约 30 分钟,将其预热至室温,从而避免凝结水分。
- 安排工作地点与两个紧密排列的显微镜和所有所需的工具(图3A)。材料列在 材料表中。
- 选择3-4个大小合适的循环,以便将晶体转移浸泡,并将其放置在显微镜附近。
- 用去离子化或蒸馏水填充玻璃斑板腔。
- 准备5mL的浸泡溶液。
- 切开预热至室温的筛选板袋。
- 从筛选板中取出盖子和铝箔,同时将板放在长凳/桌子上。
- 在试剂储液中浸泡溶液的 5 mL。
- 使用 12 通道移液器为 96 个储液库中的每一个水库加满 40μL 的浸泡溶液。
- 将 EasyAccess 框架放在筛选板的顶部,并通过将夹子滑动到设备的左右两侧来用夹子固定它。
注:易用框架是处理多个晶体的特殊设备,是在HZB14开发的。它通过移动可移动的瓷砖,同时保护其他油井免受蒸发,方便进入每口油井。 - 将筛选板(包括 EasyAccess 框架)放在第一显微镜下,将结晶板(包括要浸泡在第二显微镜下的晶体)放在下。
- 通过移动 EasyAcces 框架的相关丙烯酸玻璃瓦,用手指或提供的笔工具滑开筛选板的 A1。
- 使用新鲜的移液器尖端将 0.4μL 的浸泡溶液从储液池添加到含有油井(左上镜头)的碎片中。通过显微镜检查滴盖干燥的碎片,以便它可以溶解。
注:或者,此步骤可以在 EasyAcces 框架组装之前使用管道机器人执行。这样,所有油井的浸泡滴可以放在一个自动程序中。但是,作者建议在浸泡步骤之前直接添加浸泡溶液,以确保碎片在晶体存在时缓慢溶解。这样可以避免晶体在转移到碎片浓度高的下降时突然受到冲击。 - 在第二个显微镜下,在包含目标晶体的一口井上切开结晶板的密封箔。
- 使用安装在水晶棒上的适当大小的环将两个晶体转移到第一显微镜下筛选板的井 A1 上。
- 在准备好的玻璃斑板中清洗循环,轻轻触摸组织将其干燥。每次转移后都这样做,以避免含有浸泡溶液的碎片交叉污染。
- 使用显微镜检查晶体是否放置正确。
- 继续到下一口井(例如,B1)。
- 重复步骤 1.13-1.18 与筛选板的所有 96 口井,直到每个浸泡滴包含两个晶体。
- 从显微镜下取出筛选板(包括易用帧),并将其放在长凳/桌子上。
- 从筛选板中删除易用帧。
- 用密封箔密封筛选板,并分别放在晶体生长的结晶孵化器或橱柜中。
- 孵化优化的浸泡时间。过夜通常很方便。
- (可选)准备约40个apo晶体(即模拟浸泡)
- 采用 MRC 3 透镜 96 井低调结晶板,使用 12 通道移液器为每口井填充两列 40μL 浸泡溶液。
- 将 EasyAccess 框架放在结晶板的顶部,并通过将夹子滑动到设备的左右两侧来用夹子固定。
- 滑动打开井A1的丙烯酸玻璃瓦。
- 将 0.4 μL 浸泡溶液放在井的两个左镜头中。
- 将2-3个晶体转移到每滴。每次转移后,在准备好的玻璃点板中清洗循环,轻轻触摸组织干燥。
- 移动到下一口井(例如,B1)。
- 重复步骤 1.24.4-1.24.6,直到大约 40 个晶体准备好孵化。
- 将结晶板(包括易用帧)从显微镜下移到长凳/桌子上,并拆下易访问框架。
- 用密封箔密封结晶板,并将其放置在上述结晶孵化器或橱柜中。
- 与筛选板同时孵化。
2.收获晶体
- 分别从孵化器或橱柜中取出孵化板。
- 用一台显微镜和所需的所有工具(图3B)安排工作场所。材料列在材料表中。
- 准备一个带有3个未吸盖(即样品外壳)的未吸泡沫脱壳,并填充液氮(LN2)。
注意:注意使用LN2( 即佩戴安全护目镜和使用适当的防护设备)时应注意适当的安全防范措施。最好在会话期间多次获得新鲜 LN2, 以避免 LN2 存储罐中的水凝结。通过以下整个过程,确保泡沫去战中的 LN2 级别始终达到德瓦的上边缘。还要确保LN2 无冰:经常更换LN2( 例如,每45分钟一次),或最新的,如果冰开始积累。然后,填充第二个泡沫除战,并转移未吸虫到它。清空结冰的泡沫,用吹风机清除残留的冰和水分。 - 从筛选板中取出铝箔,并将易用帧放在顶部。
- 滑开A1。
- 从滴中收获两个晶体,并在 LN2( 一个接一个)中闪冷,通过快速垂直运动跳入 LN2, 然后将样品插入适当的冰球位置。在样本跟踪表上做相关笔记。
- 冷冻保护步骤(如需目标晶体)。在这种情况下,执行此步骤而不是 2.6。
- 将浸泡溶液的 0.4μL(包括冷冻保护剂)放在井的左下透镜上。
- 用安装在左上镜头滴的晶体拉回路,缓慢地穿过左下镜头的溶液,同时将晶体保持在循环中,然后在 LN2中闪冷。以这种方式收获两个晶体。
注意:在步骤 2.6 和 2.7 中,确保晶体在循环中并暴露在空气中的时间保持很短。应尽可能快地执行暴跌(即 LN2填充 dewar 中样品的垂直下降)。这确保了数据中的样品质量和冰环的预防。跟踪样品(即,注意晶体是否有损坏等),以优先确定以下 X 射线测量的重复性,请使用模板进行。即使晶体有裂缝,"头发"或其他缺陷,由于浸泡,他们仍然可以使用,应该总是收获。万一晶体被分成几块,应该收获两块最大/最漂亮的晶体。 图5 显示了这些晶体的外观的一些示例。所有显示的晶体在各自的战役11中都给出了仍然有用的数据集,强调浸泡治疗后收获晶体是值得的,即使发生了巨大的形态变化。
- 转到下一口井,重复步骤 2.5 - 2.6./2.7,直到所有三个冰球都充满。
- 在 LN2预冷却后,在盖子顶部添加未加法基座。
- 将 Unipucks 存放在运输德瓦或存储德瓦的储物架中。
- 重复上述步骤,直到筛选板的所有油井都经过处理。
- (可选)如果准备了模拟浸泡晶体,则以事先描述的类似方式收获。
注:如果筛选板的96个条件中每个条件的两个晶体可以闪光冷却,将有空间为32个模拟浸泡的阿波晶体,以填补14个未加注。 - 将未提问题存储在 LN2 中,直到测量。
3.数据收集
- 将未提问题转移到光束BL14.1。如果在第 2 步中使用了 SPINE 冰球,则将其转移到光束 BL14.2。
- 使用以下特定建议对横梁线进行标准测量。有关该设施和实验控制程序MXCuBE2的细节已经提出之前15,16。图4显示了光束线BL14.1和BL14.2的实验小屋的内部,以及光束线BL14.1的MXCuBE2控制软件的示例屏幕截图。
- 为了最大限度地提高时间效率和吞吐量,跳过测试图像的集合。样品与探测器的距离将固定在适合早期实验中确定的晶体系统高分辨率极限的值上。如果数据收集策略未事先优化,则收集 1800 张 0.2 度图像,每张图像的曝光时间为 0.1 秒。
- 理想情况下,在之前的实验中使用模拟浸泡的阿波晶体测试数据收集策略。对于对称性较高的空间组,1200 张图像甚至 900 张图像(即分别为 240° 或 180°)将提供完整的数据集,具有良好的统计数据,独立于数据收集的起始角度。
注:更高的冗余和更精细的切片可以产生优越的数据质量17。然而,使用这里提出的"足够但并非更多"策略,在质量、数据收集时间以及以后分析的计算要求之间进行了很好的权衡。按照描述的方式,在 24 小时内在光束 BL14.1 和 BL14.2 上非常有可能收集 200 个数据。然而,应优先考虑样品。 - 首先根据步骤 2.6./2.7 中的优先级(即收集更高优先次序重复的数据),为每个片段条件下的一个样本收集衍射数据集。
- 对于数据收集失败、衍射丢失或出现严重冰环的 3.2.3 实验,收集有关碎片状况的第二个重复样本的数据。
- 收集阿波晶体的衍射数据集(如果根据步骤 1.24 和 2.12 进行准备)。
- 收集每个片段条件剩余重复的衍射数据集。
- 在 MXCuBE2 程序中,将 CFS 活动的数据集标识符与以下模式进行匹配:<蛋白><图书馆>[ABCDEFGH] [01] [0123456789 ab] (例如, MyProtein-F2XEntry-B05a,其中"B05"代表井(即屏幕上的片段状态)和以下"a"表示第一个复制品。
4.数据处理
- 有关 CFS 活动的数据分析,请使用 FragMAXapp(基于 Web 的解决方案)控制多路复用分析,用于处理自动优化和 PanDDA 命中 CFS 数据18的评估(Lima 等人的 FragMAXapp,未发布的数据)。在 HZB 部署的 FragMAXapp 版本中,提供以下程序/管道:XDSAPP19、夏2-拨号和夏2-XDS 20、fspipeline7、DIMPLE21、菲尼克斯利格菲特22、潘达13、23。使用目标蛋白的精炼输入模型作为自动精炼的输入:否则,对活动期间收集的一个高分辨率模拟浸泡晶体进行细致的精炼。
注:命中识别的一个关键元素是潘达。详情在有关刊物13、23日解释。简言之,PanDDA 会自动计算 CFS 活动中一组数据集的电子密度图。然后,这些被假定为不绑定的碎片条件,并平均生成所谓的地面状态模型。然后,使用与沃克塞尔相关的 Z 分数来获取每个电子密度图和地面状态图之间的局部差异。然后,对于高 Z 分数区域,通过从各自的地图中微调地态密度减去,创建所谓的 PanDDA 地图。这在很大程度上提高了片段绑定事件的可见性。 - 要最大限度地提高 PanDDA 的结果,请使用两步法。首先,使用标准设置执行泛DDA运行(潘达分析)。即使已经收集了模拟浸泡晶体,它们的身份也不会作为参数(尽管如此是可能的),以便 PanDDA 能够从所有可用数据中公正地生成地面状态模型。之后,用户通过 Coot24中的所谓 PanDDA 检查对输出数据进行评估。在这里,应该注意到相对较高的信心,结束第一步。
- 其次,通过 -exclude_from_characterisation="绑定数据集列表 < ids >"命令行选项重新运行 pandda.分析步骤,将初步命中(在第一步中确定)排除在地面状态模型之外。潘达帮助页面(https://pandda.bitbucket.io/)中描述了更多详细信息。这样,数据集是明确的命中,因此将掩盖地面状态模型,如果包括被忽视。这导致改进了地面状态模型,从而改善了总体结果。最后,进行彻底的 PanDDA 检查以完成命中识别。
注:FragMAXapp 还包括一个输出选项,用于保存建模绑定状态或为 PDB 提交准备数据,以便进一步详细查看 FragMAX 网页(https://fragmax.github.io/)。
结果
作为先前报道的F2X-入口屏幕11验证活动的一部分,在MAX IV的BioMAX光束线进行了三次活动,在HZB的光束线BL14.1进行了一次活动。在后一种运动中,对酵母 Aar2 的蛋白质复合物和酵母 Prp8 (AR) 的 RNaseH 样域进行了筛选,使用不包含 DMSO 的浸泡条件对一组特定的 F2X 进入屏幕条件进行了筛选。选定的一组条件包括 F2X-入口屏幕对 AR 的早期战役中在包含 DMSO11的浸泡状态下发现的命中(即在 HZB 执行的战役中,这些命中在没有 DMSO 的情况下重新筛选)。 图 7 显示了使用 XDSAPP 的 FragMAXapp 组合分析数据后获得的命中情况概述,用于处理,用于自动精炼的气管线以及随后使用 PanDDA 进行命中查找。
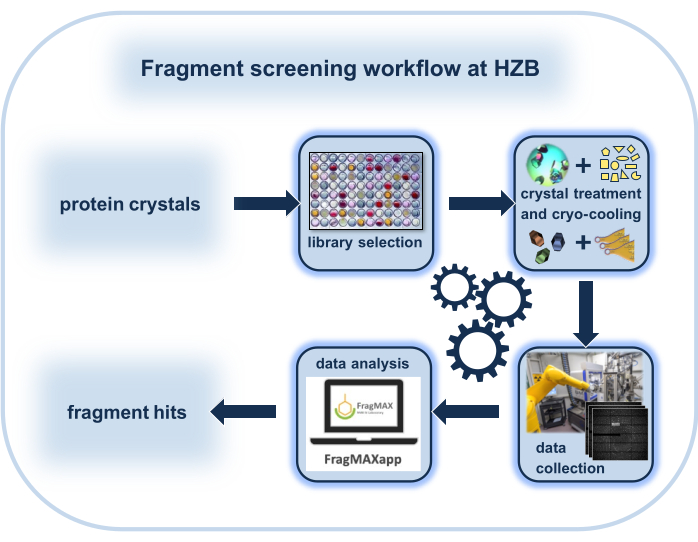
图1:晶体碎片筛选(CFS)实验工作流程的原理图表示,重点是柏林赫尔姆霍尔茨-曾特鲁姆的特殊环境。请点击这里查看此图的更大版本。

图2:F2X-入口屏幕的配方和包装。96 复合屏幕可在 3 透镜 96 井 MRC 低姿态板上使用,密封时带有铝箔和真空包装。屏幕的 96 种化合物从 DMSO 溶液中干燥,每口井的三个透镜中有两个。 请单击此处查看此图的较大版本。

图3:HZB制备实验室CFS工作台的摄影。 显示 为 A)浸泡和 B)晶体采集所需的工具组件。 请单击此处查看此图的较大版本。
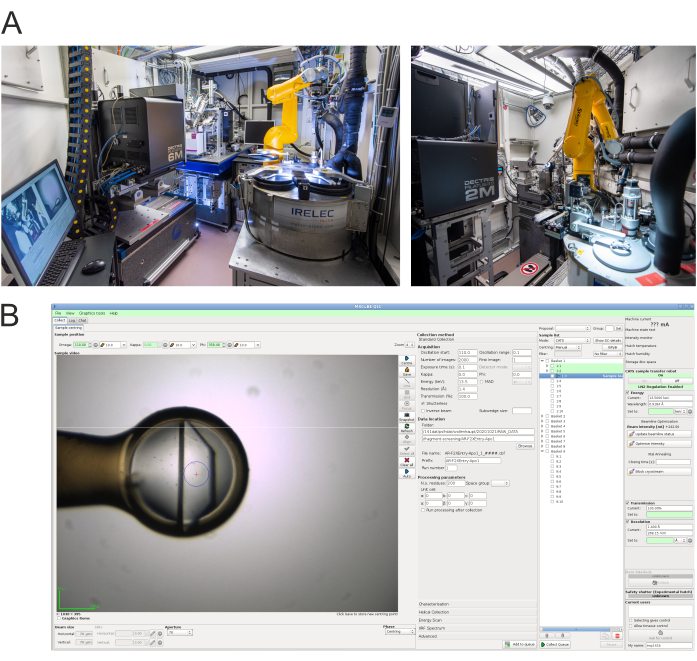
图4:数据收集终端站和控制软件。 A) HZB-MX光束线BL14.1(左)和BL14.2(右)15的实验壳的照片。 B) 用于BL14.1 的MXCuBE2实验控制接口16的屏幕截图,用于衍射数据收集。在 BL14.2 中,使用非常相似的界面。 请单击此处查看此图的较大版本。
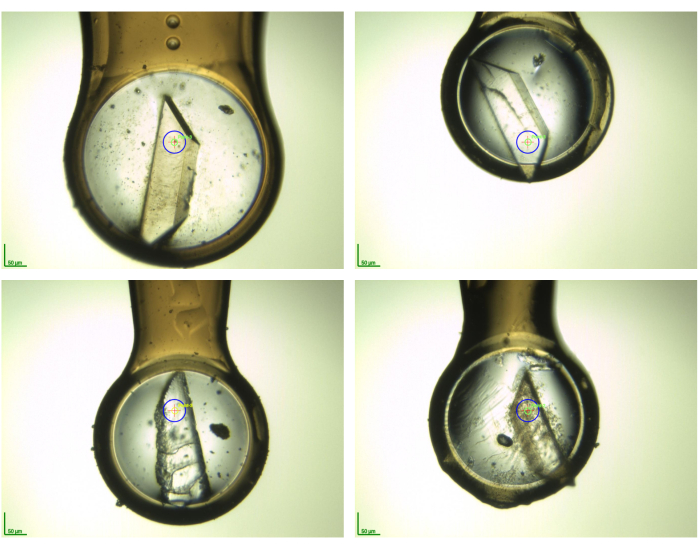
图5:数据收集前低温环境中一些晶体样品的照片快照。 这说明了在进行碎片浸泡和晶体采集后晶体的形态变化。这些照片是在BioMAX光束线(MAX IV同步加速器,瑞典隆德)拍摄的AR样本在那里收集作为F2X-入口屏幕验证11的一部分。 请单击此处查看此图的较大版本。
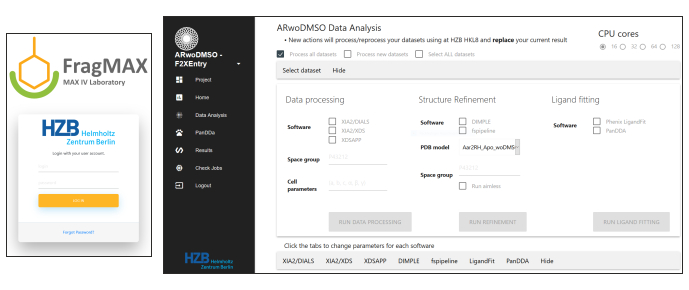
图6:安装在 HZB 的 FragMaxApp18 的屏幕截图,便于数据分析。 利马等人的更多详细信息,弗拉格马萨普,未公布的数据。请单击此处查看此图的较大版本。
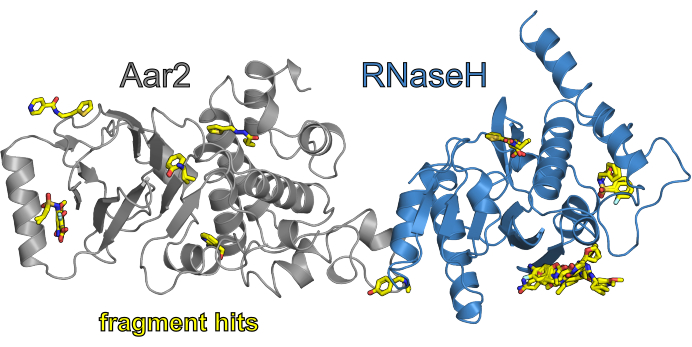
图7:CFS运动F2X-进入与AR(无DMSO)结果概述。 AR 蛋白复合物以卡通视角显示,Aar2 以灰色着色,RNaseH 样区域 Prp8 以蓝色显示。运动的片段命中以元素颜色(C - 黄色,O - 红色,N - 蓝色,S - 橙色,Cl - 浅青色)着色。 请单击此处查看此图的较大版本。
补充资料。 请单击此处下载此文件。
讨论
对于成功的 CFS 活动,必须遵守上述先决条件(参见 简介)。许多高晶体的可重复生长需要可靠的结晶系统,需要完善的结构作为自动精炼的输入 apo 模型。检查蛋白质(活性位点或接口区域)上的目标位点是否可访问晶体晶格中的碎片也很重要。必须事先优化浸泡条件,以确保浸泡不会显著降低晶体质量。忽视这些方面很可能导致一个次优实验,这将有限使用,在最坏的情况下,将需要重复整个实验。
上述协议概述了标准 CFS 活动期间遵循的程序。如果满足所有先决条件,至少 90% 的浸泡晶体应在衍射实验中显示衍射到高分辨率。如果不是这样,浸泡时间可能会缩短到几个小时甚至几分钟。由于大多数碎片的溶解性良好,这应该足以获得体面的占用价值。此外,典型的 CFS 活动将导致大约 10% 或以上的命中率。对于 F2X-入口屏幕验证活动11 和使用同一库的正在进行的用户活动,点击率甚至更高(20% 及以上,未显示数据)。
晶体碎片筛选的一般警告是晶体接触点的存在。这些网站可能不包括 已知的优先 活动站点(在筛选前要检查,见上文),或者这些接触站点通常也提供口袋和热点,碎片可以绑定。这种碎片撞击将是结晶晶格的人工制品,并且可能不会与溶液中的蛋白质结合。这些事件往往发生在浸泡实验中比在联合结晶实验中更频繁(可能是由于浸泡实验中使用的碎片浓度较高)。然而,根据以往的经验,它们通常只占获得的点击量的一小部分。例如,在 F2X-入口屏幕验证活动中,使用内窥镜 (EP) 和 Prp8RNaseH 和 Aar2 (AR) 的拼接体蛋白-蛋白质复合物中,大多数命中发生在有希望的站点11中。对于 EP,在 37 个观察到的绑定事件中,有 27 个位于活动站点(即这种蛋白酶的肽裂口)。10 个远程绑定事件包括 2 个溶剂暴露绑定事件和 8 个晶体接触绑定事件(对应于 5 个独特的命中)。排除这些水晶接触命中仍将反映 EP 活动的整体 24% 独特命中率。同样重要的是要注意,在已知活动站点(水晶接触活页夹除外)远程绑定事件也可能很有趣(例如,揭示蛋白质的新热点或同位素位点)。对于AR运动(在同一出版物中),在23个观察到的结合事件中,7个位于晶体接触处,1个位于两种蛋白质的直接接口处,7个位于已知的蛋白质-蛋白质相互作用点,与其他较大生物背景的结合伙伴(因此拼接体的组装阶段不同),8个结合事件揭示了AR上两个尚未未知的功能热点,一个位于Prp8RnaseH溶剂暴露表面。因此,不包括在晶体接触事件和Prp8RnaseH 单顿,潜在的有用的绑定事件的数量是15(对应14个独特的命中),因此命中率为15.6%。这些命中可以是蛋白质-蛋白质相互作用调节器或工具化合物的设计起点,旨在探索两个发现的Ar2热点。综合起来,也符合已进行的用户活动,通常只有一小部分命中在晶体片段筛选必须忽略为文物。然而,这也将在很大程度上取决于目标。
如果命中率显著降低,这可能表明与目标蛋白相关的以下问题之一。例如,在 CFS 针对病毒半胱氨酸蛋白酶的运动中,只观察到 3% 的命中率(未显示数据)。结果发现,所使用的蛋白质很可能在其活性部位进行化学修饰。在这种情况下,不同的蛋白质制剂可以解决这个问题。如果晶体非常不耐受 DMSO,F2X-入口屏幕也可能在没有 DMSO 的情况下使用,尽管结果可能在一定程度上不同。在 DMSO 面前获得的大部分点击率也将在 DMSO 缺席的情况下出现。在没有DMSO的情况下,也会有一些无法观察到的命中,即使它们可以在DMSO的存在下观察到。最后,将有一些只有在没有DMSO的情况下才会出现。
如果蛋白质在物质结合时发生诱导拟合运动,则发生最严重的困难。最有可能的是,晶格不会容忍蛋白质运动,晶体会解体。在这种情况下,唯一的选择是采用蛋白质和片段的联合结晶。然而,这可能会导致新的晶体形式。因此,整个过程的大部分自动化将不再有效。幸运的是,迄今为止,在 HZB 进行的大多数 CFS 活动中,此类问题尚未遇到。碎片的弱结合可能不足以诱导蛋白质运动,特别是如果结晶的构象通过晶体包装力稳定下来。
作者迄今遇到的另一个严重限制是结晶鸡尾酒(因此浸泡溶液)含有挥发性化合物。然后,它变得几乎不可能以有意义的方式执行所有的晶体处理。
不同的蛋白质可能或多或少地含有可药物的位点。例如,蛋白质-蛋白质相互作用通常由较难瞄准的扩展平面进行调解。因此,片段结合命中率可能取决于蛋白质分子表面的结构。在极端情况下,蛋白质可能不包含任何合适的表面热点,作为碎片结合的目标位点。因此,尽管进行了精心的实验,但筛查不会产生碎片撞击。然而,作者至今没有遇到这样的情况。
原则上,使用上述协议,CFS 运动的晶体浸泡和收获部分可以在任何配备水晶处理的实验室进行。这使 HZB 的方法与其他 CFS 设施不同,在某些情况下可能具有优势。例如,如果晶体不能在另一个站点轻松重新生产,或者实验者的旅行受到限制(例如,在世界范围内大流行的情况下),则 HZB 的用户将获得整个设备(冰球、工具、EasyAccess 框架、样品持有人等)作为便携式设备。
然而,在专门的CFS设施中,对大量样品持有人和低温储存能力的要求仍然更方便地满足。此外,需要收集许多衍射数据集,强烈主张将这些设施本地化,这些设施靠近光束线,以达到高样品吞吐量。例如钻石光源的光束线I04-1和英国8号、25号的相关XChem设施、法国ESRF的MASSIF光束线26号或瑞典MAX IV的BioMAX光束线的FragMAX设施。
将来,可以设想设计CFS实验,而无需完全进行晶体处理。据报道,在这方面取得了第一进展。例如,通过声学液体传输,允许将含晶溶液和碎片溶液直接混合到网状样品支架上。另一种方法用于基于 XFEL 的配体筛查。在原理验证实验中,分批准备了晶体浆料,并在硅固定靶芯片28上进行了浸泡和衍射数据收集。然而,这些方法仍在开发中,远未适用于广泛的蛋白质靶点或可行CFS设施作为例行公事。
通过这项工作中的议定书,已概述了在 HZB(和其他地方)直接成功开展 CFS 运动的详细指示,并提供了一般指导和有用的实践技巧,以提供更高的成功机会准备和进行此类实验。归根结底,CFS筛查的赔率和成功率提高,在很大程度上有助于有效为工具化合物或候选药物的下游开发提供起点。
披露声明
柏林赫尔姆霍尔茨-曾特鲁姆向德国专利商标局提交了有关 EasyAccess 框架的专利申请,注册号为 DE 10 2018 111 478.8。此外,还利用德国专利的优先级,通过PCT途径提出了国际专利申请。
致谢
我们感谢在 HZB 开展 CFS 活动的众多用户群。他们的反馈导致我们的工作流程逐步改善。我们要感谢马尔堡大学的药物设计小组和 MAX IV 的 FragMAX 团队,因为密切合作是改进 CFS 的几次发展飞跃的基础。我们感谢德国联邦教育和科学部 (BMBF) 通过 Frag2Xtal 和 Frag4Lead 项目(数字 05K13M1 和 05K16M1)的支持。我们非常感谢通过 iNEXT-Discovery(项目编号871037)获得的支持,该项目由欧盟委员会的 Horizon 2020 计划资助。
材料
| Name | Company | Catalog Number | Comments |
| 1 µL pipet | Eppendorf | EP3123000012 | |
| 12 channel pipet, 100 µL | Eppendorf | EP4861000791 | |
| Blow dryer | TH-Geyer | 9.106 788 | |
| Crystal containing crystallization plates | Contains crystals to be soaked | ||
| Crystallization incubator | Providing constant temperature for crystallization experiment, at HZB: 20°C | ||
| Dual Thickness MicroLoops (LD) of different aperture sizes | MiTeGen | various, e.g. M5-L18SP-75LD | 250 loops in the appropiate size needed for the protocol, can be provided by HZB |
| EasyAccess Frame | HZB | The EasyAccess Frame is a special device for handling multiple crystals, which was developed at the HZB (Barthel et al., 2021). | |
| F2X-Entry Screen plate | HZB | Developed F2X-Entry Screen (Wollenhaupt et al., 2020) | |
| Glas spot plate | VWR | MARI1406506 | |
| Liquid nitrogen | At least a filled up 5 L can | ||
| Liquid nitrogen storage can | n.a. | n.a. | |
| Magentic crystal wand | MiTeGen | M-R-1013198 | |
| Microscopes | Leica | n.a. | |
| MRC 3-lens 96-well low profile crystallization plate | SwissCI | 3W96TLP-UVP | For mock-soaked crystals (optional) |
| Reagent reservoir | Carl Roth | EKT6.1 | 25 ml volume |
| Sample tracking template | https://www.jove.com/files/ftp_upload/62208/TemplateCFSHZBSampleTracking. xlsx | ||
| Scalpel | B. Braun | BA825SU | |
| Sealing foil for microtiter plates | GreinerBioOne | 676070 | |
| Shelved puck shipping canes (for Unipucks) | MiTeGen | M-CP-111-065 | 2 canes made of aluminum; can be provided by the HZB |
| Soaking solution | At least 5 ml are needed | ||
| Soaking solution including cryo-protectant, 150µL | Only needed if soaking solution is not cryo-protectant already | ||
| Tissues | Roth (Kimberly Clark Professional) | AA64.1 | |
| Transport dewar (Whartington dry shipper) | MiTeGen | TW-CX100 | 2 Travel dewars for storage of the 2 unipuck canes, alternatively a storage dewar of type VHC35 or similar could be used. |
| Unipuck foam dewars with lid | MiTeGen | M-CP-111-022 | two foam dewars especially suited for unipuck handling described in the protocol if SPINE pucks are used, different foam dewars might have to be applied. |
| Unipuck starter set | MiTeGen | M-CP-UPSK001 | Can be provided by the HZB |
| Unipucks | MiTeGen | M-CP-111-021 | 14 unipucks; can be provided by the HZB |
参考文献
- Erlanson, D. A., Fesik, S. W., Hubbard, R. E., Jahnke, W., Jhoti, H. Twenty years on: the impact of fragments on drug discovery. Nature Reviews Drug Discovery. 15 (9), 605-619 (2016).
- Hall, R. J., Mortenson, P. N., Murray, C. W. Efficient exploration of chemical space by fragment-based screening. Progress in Biophysics and Molecular Biology. 116 (2-3), 82-91 (2014).
- Erlanson, D. A. Introduction to fragment-based drug discovery. Topics in Current Chemistry. 317, 1-32 (2012).
- Scott, D. E., Coyne, A. G., Hudson, S. A., Abell, C. Fragment-based approaches in drug discovery and chemical biology. Biochemistry. 51 (25), 4990-5003 (2012).
- Lamoree, B., Hubbard, R. E. Current perspectives in fragment-based lead discovery (FBLD). Essays in Biochemistry. 61 (5), 453-464 (2017).
- Schiebel, J., et al. Six Biophysical Screening Methods Miss a Large Proportion of Crystallographically Discovered Fragment Hits: A Case Study. ACS Chemical Biology. 11 (6), 1693-1701 (2016).
- Schiebel, J., et al. High-Throughput Crystallography: Reliable and Efficient Identification of Fragment Hits. Structure. 24 (8), 1398-1409 (2016).
- Krojer, T., et al. The XChemExplorer graphical workflow tool for routine or large-scale protein-ligand structure determination. Acta Crystallographica Section D: Structural Biology. 73 (3), 267-278 (2017).
- Radeva, N., et al. Active Site Mapping of an Aspartic Protease by Multiple Fragment Crystal Structures: Versatile Warheads to Address a Catalytic Dyad. Journal of Medicinal Chemistry. 59 (21), 9743-9759 (2016).
- Cox, O. B. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7 (3), 2322-2330 (2016).
- Wollenhaupt, J., et al. F2X-Universal and F2X-Entry: Structurally Diverse Compound Libraries for Crystallographic Fragment Screening. Structure. 28 (6), 694-706 (2020).
- . EU OPENSCREEN fragment library Available from: https://www.eu-openscreen.eu/services/compound-collection/fragment-library.html (2020)
- Pearce, N. M., et al. A multi-crystal method for extracting obscured crystallographic states from conventionally uninterpretable electron density. Nature Communications. 8, 15123 (2017).
- Barthel, T., Huschmann, F. U., Wallacher, D., Klebe, G., Weiss, M. S., Wollenhaupt, J. Facilitated crystal handling using a simple device for evaporation reduction in microtiter plates. Journal of Applied Crystallography. 54, (2021).
- Mueller, U., et al. The macromolecular crystallography beamlines at BESSY II of the Helmholtz-Zentrum Berlin: Current status and perspectives. The European Physical Journal Plus. 130 (7), 141 (2015).
- Oscarsson, M., et al. MXCuBE2: The dawn of MXCuBE collaboration. Journal of Synchrotron Radiation. 26 (2), 393-405 (2019).
- Mueller, M., Wang, M., Schulze-Briese, C. Optimal fine φ-slicing for single-photon-counting pixel detectors. Acta Crystallographica Section D: Biological Crystallography. 68 (1), 42-56 (2012).
- Lima, G. M. A., et al. FragMAX: The fragment-screening platform at the MAX IV Laboratory. Acta Crystallographica Section D Structural Biology. 76 (8), 771-777 (2020).
- Sparta, K. M., Krug, M., Heinemann, U., Mueller, U., Weiss, M. S. XDSAPP2.0. Journal of Applied Crystallography. 49 (3), 1085-1092 (2016).
- Winter, G. xia2: an expert system for macromolecular crystallography data reduction. Journal of Applied Crystallography. 43 (1), 186-190 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica Section D: Biological Crystallography. 67 (4), 235-242 (2011).
- Terwilliger, T. C., Klei, H., Adams, P. D., Moriarty, N. W., Cohn, J. D. Automated ligand fitting by core-fragment fitting and extension into density. Acta Crystallographica Section D: Biological Crystallography. 62 (8), 915-922 (2006).
- Pearce, N. M., Krojer, T., Von Delft, F. Proper modelling of ligand binding requires an ensemble of bound and unbound states. Acta Crystallographica Section D Structural Biology. 73 (3), 256-266 (2017).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 486-501 (2010).
- Collins, P. M., et al. Chapter Eleven - Achieving a Good Crystal System for Crystallographic X-Ray Fragment Screening. Methods in Enzymology. 610, 251-264 (2018).
- Bowler, M. W., et al. MASSIF-1: a beamline dedicated to the fully automatic characterization and data collection from crystals of biological macromolecules. Journal of Synchrotron Radiation. 22 (6), 1540-1547 (2015).
- Cuttitta, C. M., et al. Acoustic transfer of protein crystals from agarose pedestals to micromeshes for high-throughput screening. Acta Crystallographica Section D Biological Crystallography. 71 (1), 94-103 (2015).
- Moreno-Chicano, T., et al. High-throughput structures of protein-ligand complexes at room temperature using serial femtosecond crystallography. IUCrJ. 6 (6), 1074-1085 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。