Method Article
헬름홀츠 젠트럼 베를린에서 결정화 조각 검사를 위한 워크플로우 및 도구
요약
헬름홀츠 젠트럼 베를린의 결정적 단편 스크리닝은 전용 복합 라이브러리, 크리스탈 처리 도구, 빠른 데이터 수집 시설 및 대부분 자동화된 데이터 분석이 있는 워크플로우를 사용하여 수행됩니다. 제시된 프로토콜은 다운스트림 구조 기반 리간드 설계에 대한 유망한 출발점을 제공하기 위해 이러한 실험의 출력을 극대화할 계획입니다.
초록
단편 스크리닝은 리간드 설계의 유망한 출발점을 식별하는 데 도움이 되는 기술입니다. 표적 단백질의 결정이 가능하고 재현적으로 고해상도 X선 회절 특성을 표시한다는 점을 감안할 때, 결정예학은 민감성 때문에 단편 스크리닝을 가장 선호하는 방법 중 하나입니다. 또한, 후속 합리적 화합물 진화에 필수적인 단편의 결합 모드에 대한 상세한 3D 정보를 제공하는 유일한 방법이다. 이 방법의 일상적인 사용은 적합한 조각 라이브러리의 가용성, 많은 수의 샘플을 처리하는 전용 수단, 빠른 회절 측정을 위한 최첨단 싱크로트론 빔라인 및 결과 분석을 위한 대부분 자동화된 솔루션에 따라 달라집니다.
여기서, 헬름홀츠 젠트럼 베를린(HZB)에서 결정화 단편 스크리닝(CFS)을 수행하는 방법에 대한 완전한 실용적인 워크플로우와 포함된 도구가 제시됩니다. 이 워크플로우앞에는 수정에 흠뻑 젖은 조건과 데이터 수집 전략이 재현 가능한 결정적 실험에 최적화되어 있습니다. 그런 다음 일반적으로 1~2일 의 절차에서 말린 즉시 사용할 수 있는 플레이트로 제공되는 96개의 CFS 중심 라이브러리가 192개의 결정을 흡수하기 위해 사용되며, 이는 개별적으로 플래시 냉각됩니다. 최종 회절 실험은 베를린-애들러쇼프(독일)의 HZB가 운영하는 BESSY II 전자 저장 링에서 로봇 장착 지원 빔라인 BL14.1 및 BL14.2에서 하루 이내에 수행될 수 있다. 결정적 데이터의 처리, 단백질 구조의 정제 및 적중 식별은 전용 서버의 특수 소프트웨어 파이프라인을 사용하여 빠르고 크게 자동화되어 사용자 입력이 거의 필요하지 않습니다.
HZB에서 CFS 워크플로우를 사용하면 일상적인 스크리닝 실험을 수행할 수 있습니다. 그것은 더 강력한 바인더를 개발하기 위해 출발점으로 조각 안타의 성공적인 식별을위한 기회를 증가, 약리학 또는 생화학 적 응용 프로그램에 유용.
서문
신약 개발의 첫 번째 단계는 관심 대상에 대한 화합물의 검열입니다. 전통적으로, 100,000-1,000,000 항목의 순서로 큰 화합물 라이브러리는 제약 산업에서 높은 처리량 생화학 분석에 사용됩니다. 이러한 전략은 지난 20년 동안 가파른 상승세를 보였던 새로운 방법인 단편계 약물 설계(FBDD)에 의해 보완되었으며, 방법1의몇 가지 내재된 장점으로 인해 고품질 의 잠재 후보를 생성하는 주류 전략이 되었다. 용어 "단편"은 전형적으로 20개 미만의 비수소 또는 무거운 원자(HA)를 포함하는 작은 유기 분자를 지칭한다. 따라서, 단편은 기존의 고처리량 스크리닝에서 탐구된 약물 또는 납과 같은 분자(보통 30H 미만)보다 훨씬 작다. 조각은 약한 친화성 바인더입니다. 그러나, 더 큰 분자에 비해, 단편은 더 다재다능, 그들 중 작은 수집도 더 나은 동일한 크기의 분자의 각각의 화학 공간을 나타낼 수 있기 때문에2. 또한, 진화하는 단편 스크리닝은 이미 더 큰분자2,3,4,5를최적화하는 것보다 훨씬 더 효과적입니다. 즉, 검출의 충분한 감도가 보류되고, 조각의 스크리닝은 효율적으로 사용될 수 있으며, 추가 화합물 진화를 위해 고품질의 출발점을 산출할 수 있다. 몇몇 생물물리학적 방법은 단편 스크리닝, 가장 인기있는 핵 자기 공명, X선 결정학, 표면 플라스몬 공명 및 열 시프트 에세이인 에 적용될 수 있다. 이러한 방법은 병렬 또는 순차적 방법으로 사용되며, 안타에 대한 신뢰를 높이고 각각 거짓 긍정 또는 거짓 네거티브의 수를 줄이는 것을 목표로합니다. 그러나, 최근 실시된 비교 연구6은 상이한 방법 간의 낮은 중첩으로 인해 순차적 스크리닝 캐스케이드를 피할 수 있어야 한다고 제안했다.
X선 결정학은 원자상 세부체에서 구조 측정을 위한 잘 확립된 방법이지만 최근에는 스크리닝 목적7,8을위한 도구로 개발되었다. 단백질 결정이 고단편 농도(예를 들어, 100mMMM)를 용인함에 따라 결정성 단편 스크리닝(CFS)은 단편을 선별하기 위한 다른 생물물리학적 방법과 경쟁할 수 있거나 심지어 1단계 스크리닝 방법6,9로능가할 수 있다. 그러나, CFS에 대한 중요한 전제 조건은 타깃 단백질의 검증된 결정화 시스템이 회절 특성을 가진 결정을 상당히 높은 해상도로 재현가능하게 전달하며, 전형적으로 2Å보다 더 낫다.
다른 모든 단편 스크리닝 방법론에 비해 CFS의 독점적 인 이점은 식별 된 조각의 바인딩 모드에 대한 상세한 3D 정보를 제공하는 것입니다. 이 구조 정보는 더 높은 친화성 바인더에 대한 조각 히트의 합리적 최적화에 절대적으로 중요합니다. 확립된 정교화 전략이 성장, 병합 및 링크 조각 히트5. 이에 따라 비교적 높은 리간드 효율이 처음부터 제공되고, 불필요하거나 공간적으로 적합하지 않은 그룹의 도입을 피할 수 있어 화학합성 비용을 절감할 수 있다. 모두 모두, CFS는 약물 설계를위한 시작 전략으로 타의 추종을 불허하는 장점을 가지고있다.
특정 생물학적 목표가 결정 품질에 관한 CFS의 높은 요구 사항을 충족한다는 점을 감안할 때, 그러한 선별 캠페인의 성공적인 결과에 대한 가능성을 극대화하는 몇 가지 주요 요인이 있습니다. 그것은 사용되는 조각 라이브러리의 품질에 따라 달라집니다, 회절 실험 전에 실험을 수행하기 위해 효율적인 워크 플로우에, 충분한 자동화 및 데이터 수집 속도와 싱크로트론 빔 라인에, 뿐만 아니라, 주로 자동화 된 데이터 처리 및 분석을위한 방법과 수단에. 여기서, 결정담 실험에서 히트 식별에 이르는 완전한 워크플로우가 제시되고, BESSYII(그림 1)에서거대 분자 결정학 빔라인에서 성공적으로 확립되는 방식이다. 이 시설은 협업을 위해 학술 및 산업 사용자에게 열려 있습니다. 또한 독일 이외의 EU 국가의 학술 사용자는 iNEXT 디스커버리 프로젝트를 통해 자금을 직접 신청할 수 있습니다.
CFS 캠페인을 시작하고 이 작업에 설명된 프로토콜을 수행할 수 있는 필수 전제 조건이 있습니다: 표적 단백질의 잘 확산되는 결정은 많은 수에서 재현적으로 성장할 수 있고, 주변 온도에서 안정적이며, 휘발성이 높은 성분없이 결정화 칵테일을 사용하여 성장했습니다. 또 다른 전제 조건은 실험에 대한 결정 격자의 적합성입니다. 적절한 격자에서, 표적 단백질의 흥미로운 사이트는 용매 채널을 향해 노출되어야하므로 접근 할 수 있어야합니다. 선택 사항이지만 CFS 캠페인의 워크플로우에서 성공을 보장하는 것이 좋습니다 또 다른 이전 단계는 실험에 대한 담그어 상태의 최적화입니다. 여기서 중요한 벤치마크 통계는 결정의 회절 능력과 데이터 크기 조정 절차 중에 결정되는 관련 데이터 품질 지표입니다. 최적화해야 할 일반적인 요인은 DMSO 허용 오차, 완충성 농도 및 저온 보호제입니다. 아래 자세히 설명된 엄격한 전제 조건은 아니지만 공동 용매로서의 DMSO는 단편 용해화를 증가시키는 데 도움이 될 수 있습니다. 일반적인 테스트에는 하룻밤 사이에 0, 3, 6 또는 10 % (v /v) DMSO를 담가 두어야합니다. 완충 농도가 200 mM로 증가하면 사용되는 고단편 농도에서 발생하는 간헐적인 pH 이동 효과로 인해 회절 품질의 손실을 방지하는 데 도움이 된다. 마지막으로, 추가 냉동 보호제가 필요한지 여부와 이미 흡수 상태에 포함 될 수 있는지 여부를 확인하는 것이 결정적입니다. 그러나 많은 경우 DMSO 자체가 극저온 보호제로 작용할 수 있기 때문에 추가 극저온 보호제가 필요하지 않습니다. 그렇다면 최종 실험에서 하나의 처리 단계를 저장합니다. 대부분의 크리스탈은 적절한 크기의 루프에서 플래시 냉각, 최소화 하거나 가능한 한 주변 어머니 주류를 피하기 하는 경우 덜 저온 보호제 필요. 그러나 드문 경우지만, 플래시 냉각 시 결정의 손상을 방지하기 위해 어머니 주류의 층이 실제로 필요합니다.
CFS 캠페인에서 얻은 안타의 수는 대상 단백질의 약물 성 및 결정 격자의 적합성에 의존할 뿐만 아니라 라이브러리의 품질에도 의존합니다. 라이브러리 품질은 두 가지 측면을 포함한다: 라이브러리에 대한 화합물의 선택 및 화합물의 과자, (즉, 물리적 형태는 실험을 위해 제시되는). 복합 선택의 경우 다른 전략을 사용할 수 있습니다. 대부분의 라이브러리 설계에는 단편의 화학적 다양성 극대화가 포함됩니다. 전략적 초점은 다이아몬드-SGC-iNEXT 태세 라이브러리10에적용된 후속 설계를 위한 조각의 화학적 요도를 포함시키는 것입니다. 그러나 도서관 설계를 위한 또 다른 전략적 초점은 HZB11에서개발된 F2X 라이브러리에 의해 예시된 바와 같이 형상 및 약리 기반 클러스터링에 의해 조각의 상업적으로 이용 가능한 화학 공간의 표현을 극대화하는 것입니다. 보다 구체적으로, 1103명으로 구성된 F2X-유니버설 라이브러리와 F2X-엔트리 스크린이라고 불리는 초기 CFS 캠페인을 위한 대표 96복합 서브세트가 개발되었으며 F2X-엔트리 스크린이 성공적으로검증되었다 11. F2X-엔트리 화면은 HZB에서 CFS 캠페인의 주요 선택입니다. 그런 다음 더 큰 캠페인은 F2X-유니버설 라이브러리 또는 HZB에서 제공되는 1056개의 EU-OPENSCREEN 조각 라이브러리12를 사용하여 수행할 수 있습니다. 현재, 이러한 라이브러리는 공동 작업 계약에 기초하여 베를린에서 BESSY II 싱크로트론의 거대 분자 결정학 빔 라인의 사용자가 사용할 수 있습니다. 이는 iNEXT 디스커버리 제안을 통해 사용자에게도 적용됩니다. 또한, F2X-엔트리 스크린은 재료 이전 계약을 기반으로 모든 관심 있는 과학자들에게 제공됩니다.
라이브러리의 물리적 프레젠테이션과 관련하여 두 가지 방법이 일반적으로 채택됩니다: 조각은 DMSO 스톡 솔루션으로 사용되거나 조각이 즉시 사용 가능한 플레이트에 건조되고 고정됩니다. HZB에서는 F2X-엔트리 스크린과 F2X-유니버설 라이브러리의 비휘발성 화합물을 모두 3렌즈 96웰 MRC 로우 프로파일 결정화 플레이트에 건조화합물로 제시한다. 결정화 플레이트에 고정된 조각의 프리젠 테이션은 두 가지 중요한 장점이 있습니다 : 첫째로, 사용자의 홈 랩으로 스크리닝 플레이트를 전송할 수 있습니다. 따라서 여기에 제시된 워크플로우의 담그고 결정 처리 단계(1-3단계)는 어디에서나 수행될 수 있다. 둘째, DMSO 가없는 솔루션을 사용할 수 있습니다. 따라서 DMSO 에 민감한 대상은 쉽게 선별할 수 있으므로 예상적중률(11)을크게 유지할 수 있습니다. 그러나 DMSO는 단편 용해도를 증가시키기 때문에 위에서 설명한 대로 미리 선택한 결정 시스템의 DMSO 허용 오차를 확인하는 것이 좋습니다.
아래에 설명된 프로토콜은 F2X-엔트리 스크린과 같은 96복합 스크린을 가진 일반적인 실험을 설명합니다. 이를 위해 약 250개의 크리스탈을 제 시간에 준비하여 신선하게 사용해야 합니다. 그것은 매우 중복모든 96 화합물에 대 한 담근을 준비 하는 것이 좋습니다. 나중에 적중식별(13)에대한 범데이터 밀도 분석(PanDDA) 접근 방식을 사용하여 데이터 분석에 도움이 되는 추가 모의 흡수를 준비하는 것이 좋습니다. 모의 흡수는 조각이 동일한 잠복 시간 동안 흡수되는 것과 동일한 담그고 용액을 사용하여 단백질 결정에 대한 흡수 실험으로 정의되지만 조각은 존재하지 않습니다. 침전용이 결정화 조건과 같으면 결정화 플레이트로부터 직접 수확될 수 있다.
로봇 샘플 체인저의 기능에 따라 다양한 퍽 형식을 사용해야 할 수 있습니다. 현재 HZB 작동 빔라인 BL14.1용 샘플은 유니퍽 형식으로 준비해야 하며, HZB 작동 빔라인 BL14.2용 샘플은 SPINE 퍽 형식으로 준비해야 합니다. 이 프로토콜에서는 Unipuck 형식으로 준비하는 것이 가정됩니다.
프로토콜
1.크리스탈을 담그다
- -20°C 냉동고에서 스크리닝 플레이트(여기, F2X-엔트리 스크린 플레이트, 도 2)를벤치/테이블에 약 30분 동안 놓고 실온으로 미리 데워져 응축 수분을 피하십시오.
- 밀접하게 배열된 두 개의 현미경과 필요한 모든도구(그림 3A)로작업 장소를 정렬합니다. 재료는 재료표에나열됩니다.
- 적폐물의 전달을 위해 적절한 크기의 3-4 루프를 선택하고 현미경에 가까이 두십시오.
- 유리 반점 판 구멍을 탈이온 또는 증류수로 채웁니다.
- 5mL의 담그용 액수를 준비합니다.
- 실온으로 미리 데워진 스크리닝 플레이트의 가방을 잘라냅니다.
- 접시를 벤치/테이블에 놓으면서 스크리닝 플레이트에서 뚜껑과 호일을 제거합니다.
- 시약 저장소에 담그용 5mL를 데산한다.
- 12채널 파이펫을 사용하여 40μL의 침을 흡수용 으로 96개의 저수지를 채웁니다.
- EasyAccess 프레임을 스크리닝 플레이트 위에 놓고 장치의 왼쪽과 오른쪽으로 슬라이딩하여 포함된 클램프로 고정합니다.
참고: EasyAccess 프레임은 HZB14에서개발된 여러 결정을 처리하기 위한 특수 장치입니다. 다른 우물을 증발으로부터 보호하면서 이동식 타일을 이동하여 각 우물에 쉽게 접근할 수 있습니다. - 제1 현미경 및 제2 현미경아래에 담글 결정을 포함하는 결정화 플레이트 아래에 스크리닝 플레이트(EasyAccess 프레임 포함)를 배치합니다.
- 손가락또는 제공된 펜 도구를 사용하여 EasyAccess 프레임의 각 아크릴 유리 타일을 이동하여 스크리닝 플레이트의 A1을 잘 엽니다.
- 저수지에서 신선한 파이펫 팁을 사용하여 잘 함유된 조각(왼쪽 상단 렌즈)에 0.4 μL의 담그용 용액을 추가합니다. 낙하가 건조 된 조각을 덮는 현미경을 통해 확인, 그래서 그것은 용해 할 수 있습니다.
참고: 또는 이 단계는 EasyAccess 프레임의 조립 전에 파이펫팅 로봇을 사용하여 수행할 수 있습니다. 이렇게하면 모든 우물의 담그방울을 하나의 자동 절차에 배치 할 수 있습니다. 그러나 저자는 조각이 천천히 크리스탈의 존재가 되도록 설명된 대로 담그기 단계 앞에 직접 담글 수 있는 용액을 추가하는 것이 좋습니다. 이것은 결정이 높은 단편 농도로 드롭으로 전송시 갑작스런 충격을 경험하는 것을 피합니다. - 두 번째 현미경하에서, 표적 결정이 포함된 우물 중 하나에서 결정화 판의 밀봉 호일을 열어 놓는다.
- 결정 지팡이에 장착된 적절한 크기의 루프를 사용하여 제1 현미경하에서 스크리닝 플레이트의 우물 A1로 두 개의 결정을 전달한다.
- 준비된 유리 반점 플레이트에서 루프를 씻고 조직을 부드럽게 만져 서 말리십시오. 모든 전송 후 이 작업을 수행하여 담그고 있는 솔루션을 포함하는 파편으로 교차 오염을 방지합니다.
- 현미경을 사용하여 결정이 제대로 배치되었는지 확인합니다.
- 다음 우물(예: B1)으로 이동합니다.
- 각 담그 방울이 두 개의 결정을 포함 할 때까지 스크리닝 플레이트의 모든 96 우물과 함께 1.13-1.18 단계를 반복합니다.
- 현미경 아래에서 스크리닝 플레이트(EasyAccess 프레임 포함)를 제거하고 벤치/테이블에 놓습니다.
- 스크리닝 플레이트에서 EasyAccess 프레임을 제거합니다.
- 스크리닝 플레이트를 밀봉 호일로 밀봉하여 결정성 배양기 또는 찬장에 각각 배치하여 결정이 재배된 곳에 놓습니다.
- 최적화된 담그기 시간을 위해 인큐베이션을 사용할 수 있습니다. 하룻밤은 일반적으로 편리합니다.
- (선택 사항) 약 40개의 아포 결정 준비(예: 모의 담그기)
- MRC 3 렌즈 96-l-프로파일 결정화 플레이트를 가지고 12 채널 파이펫을 사용하여 우물 당 40 μL의 담그용 용액으로 두 개의 열을 채웁니다.
- EasyAccess 프레임을 결정화 플레이트 위에 놓고 장치의 왼쪽과 오른쪽으로 슬라이딩하여 포함된 클램프로 고정합니다.
- 슬라이드는 잘 A1의 아크릴 유리 타일을 엽니 다.
- 우물의 두 개의 왼쪽 렌즈 각각에 담그용 용액의 0.4 μL을 놓습니다.
- 각 드롭에 2-3 개의 결정을 옮김합니다. 각 전달 후, 준비 된 유리 반점 접시에 루프를 세척하고 부드럽게 조직을 터치하여 건조.
- 다음 우물(예: B1)으로 이동합니다.
- 약 40개의 결정이 배양할 때까지 1.24.4-1.24.6 단계를 반복합니다.
- 현미경 아래에서 벤치/테이블로 결정화 플레이트(EasyAccess 프레임 포함)를 제거하고 EasyAccess 프레임을 제거합니다.
- 결정화 플레이트를 밀봉 호일로 밀봉하여 전술한 결정화 인큐베이터 또는 찬장에 놓습니다.
- 스크리닝 플레이트와 동시에 인큐베이션합니다.
2.크리스탈 수확
- 인큐베이터 또는 찬장에서 인큐베이팅 플레이트를 각각 꺼내십시오.
- 하나의 현미경과 필요한 모든 도구(그림 3B)로작업 장소를 정렬합니다. 재료는 재료 표에 나열됩니다.
- 유니퍽 폼 데워3 개의 유니퍽 뚜껑(즉, 샘플 인클로저)로 준비하여 액체 질소(LN2)로채웁니다.
참고: LN 2(예: 안전 고글을 착용하고 적절한 보호 장비를 사용)로 작업할 때 적절한 안전 예방 조치를 준수하십시오. LN2 스토리지 캔의 물 응축을 피하기 위해 세션 중에 신선한 LN2를 여러 번 얻는 것이 가장 좋습니다. 전체 다음 절차를 통해 폼 데워의 LN2 레벨이 항상 데워의 상부 가장자리에 도달하고 있는지 확인하십시오. 또한 LN2가 얼음이 없는지 확인하십시오. LN2(예: 45분마다 한 번) 또는 얼음이 축적되기 시작하는 최신 을 자주 교체합니다. 그런 다음 두 번째 폼 드와르를 채우고 유니퍽을 이체로 옮습니다. 얼음 거품 dewar를 비우고 블로우 드라이어로 잔류 얼음과 습기를 제거합니다. - 스크리닝 플레이트에서 호일을 제거하고 EasyAccess 프레임을 위에 놓습니다.
- 슬라이드는 잘 열립니다 A1.
- LN 2(하나씩)에서 드롭에서 두 개의 크리스탈을 수확한 다음 적절한 퍽 위치에 샘플을 삽입합니다. 샘플 추적 시트에 관련 메모를 합니다.
- 극저온 보호 단계 (대상 결정에 필요한 경우). 이 경우 2.6 대신 이 단계를 수행합니다.
- 웰의 왼쪽 아래 렌즈에 저온 보호제를 포함한 담그용 용액0.4 μL을 놓습니다.
- 왼쪽 상단 렌즈의 낙하로부터 장착된 크리스탈로 루프를 천천히 당기고 LN2에서크리스탈을 유지합니다. 이런 식으로 두 개의 결정을 수확하십시오.
참고: 2.6 및 2.7 단계에서 결정이 루프에 있고 공기에 노출된 시간이 매우 짧게 유지되는지 확인합니다. 급락(즉, LN2-채워진드와드에서 샘플의 수직 낙하)은 가능한 한 빨리 수행되어야 한다. 이를 통해 높은 샘플 품질과 데이터 내 얼음 고리를 방지할 수 있습니다. 다음 X선 측정에 대한 중복 우선 순위를 지정하기 위해 샘플(예: 결정이 손상이 있는 경우 참고)을 추적하여 템플릿을 사용합니다. 크리스탈에 균열, "머리카락" 또는 담그기 때문에 다른 결함이 있더라도 여전히 사용할 수 있으며 항상 수확해야합니다. 크리스탈이 여러 조각으로 부서진 경우 가장 크고 가장 잘 생긴 조각 두 개를 수확해야 합니다. 그림 5는 그러한 결정이 어떻게 보일 수 있는지에 대한 몇 가지 예를 보여줍니다. 표시된 모든 결정은 각 캠페인11에서여전히 유용한 데이터 세트를 제공했으며, 상당한 형태학적 변화가 발생하더라도 치료를 흡수 한 후 결정을 수확 할 가치가 있음을 강조했습니다.
- 다음 우물로 이동하여 세 개의 퍽이 모두 채워지때까지 2.5 - 2.6./2.7 단계를 반복하십시오.
- LN2에서미리 냉각한 후 뚜껑 위에 Unipuck 베이스를 추가합니다.
- 유니퍽을 저장 선반에 보관하여 운송 디워드 또는 스토리지 드와르에 보관하십시오.
- 스크리닝 플레이트의 모든 우물이 처리될 때까지 앞단계를 반복합니다.
- (선택 사항) 모의에 흠뻑 젖은 결정이 준비되었다면, 미리 설명한 것과 비슷한 방식으로 수확하십시오.
참고: 스크리닝 플레이트의 96개 조건에 대해 각각 2개의 결정이 플래시 냉각될 수 있다면, 14개의 유니퍽을 채우기 위해 32개의 모의 에젖은 아포 크리스탈을 위한 공간이 있을 것입니다. - 측정될 때까지 LN2에 유니퍽을 저장합니다.
3. 데이터 수집
- 유니퍽을 빔라인 BL14.1로 옮길 수 있습니다. 2단계에서 SPINE 퍽을 사용한 경우 빔라인 BL14.2로 전송합니다.
- 아래와 같은 특정 권장 사항을 사용하여 빔라인에서 표준 측정을 수행합니다. 시설 및 실험 제어 프로그램 MXCuBE2에 대한 자세한 내용은 이전에15,16을제시했다. 도 4는 빔라인 BL14.1 및 BL14.2의 실험 허치의 내부뿐만 아니라 빔라인 BL14.1에서 MXCuBE2 제어 소프트웨어의 예 스크린샷을 나타낸다.
- 시간 효율성과 처리량을 최대화하려면 테스트 이미지 컬렉션을 건너뜁니다. 샘플 대 검출기 거리는 이전 실험에서 결정된 결정 시스템의 상한 해상도 한계에 적합한 값으로 고정됩니다. 데이터 수집 전략이 사전에 최적화되지 않은 경우 이미지당 0.1s의 노출 시간으로 각각 0.2도의 1800개의 이미지를 수집합니다.
- 이상적으로는 모의 에젖은 아포 결정을 사용하여 이전 실험에서 데이터 수집 전략을 테스트하는 것이 좋습니다. 대칭 공간 그룹의 경우 1200개의 이미지 또는 900개의 이미지(즉, 240°또는 180°)는 데이터 수집의 시작 각도와는 별개로 이미 좋은 통계가 있는 완전한 데이터 집합을 제공합니다.
참고: 중복성이 높고 세분화하면 우수한 데이터품질(17)을얻을 수 있습니다. 그러나 여기에서 제안된 이 "충분하지만 더 이상"전략을 사용하는 것은 품질, 데이터 수집 시간 및 나중에 분석을 위한 계산 요구 사항 간의 훌륭한 절충안입니다. 설명된 방식으로 빔라인 BL14.1 및 BL14.2에서는 24시간 동안 200개의 데이터 수집이 가능합니다. 그럼에도 불구하고 샘플의 우선 순위를 지정해야 합니다. - 먼저 2.6./2.7 단계의 우선 순위 지정에 따라 조각 조건당 하나의 샘플에 대한 회절 데이터 집합을 수집합니다(즉, 우선 순위가 높은 중복에 대한 데이터를 수집).
- 데이터 수집이 실패한 3.2.3의 실험의 경우 회절이 손실되거나 심한 얼음 고리가 발생하여 각 조각 조건의 두 번째 중복 샘플에 대한 데이터를 수집합니다.
- apo 결정의 회절 데이터 집합을 수집합니다(1.24 단계 및 2.12 단계에 따라 준비된 경우).
- 각 조각 조건의 나머지 중복 항목의 회절 데이터 집합을 수집합니다.
- MXCuBE2 프로그램에서는 CFS 캠페인의 데이터 집합 식별자를 다음과 같은 패턴에 일치시합니다: <단백질>-<라이브러리>-[ABCDEFGH][01][0123456789][ab] (예를 들어, "B05"가 화면의 우물(즉, 화면의 단편 상태)을 의미하는 MyProtein-F2XEntry-B05a
4. 데이터 처리
- CFS 캠페인의 데이터 분석을 위해 웹 기반 솔루션인 FragMAXapp을 사용하여 CFS 데이터18(Lima et al. FragMAXapp, 미공개 데이터)의 자동 개선 및 PanDDA 적중 평가를 처리하기 위한 멀티플렉스 분석을 제어합니다. HZB에 배포 된 FragMAXapp 버전에서 다음 프로그램 / 파이프 라인을 사용할 수 있습니다 : XDSAPP19,샤2 다이얼및 샤2-XDS20,fspipeline7,DIMPLE21,페닉스 LigFit22,PanDDA13,23. 자동 정제를 위한 입력으로서 표적 단백질의 잘 정제된 입력 모델을 사용; 그렇지 않으면 캠페인 기간 동안 수집 된 하나의 고해상도 모의 젖은 크리스탈의 세심한 세련미를 수행합니다.
참고: 적중 식별의 핵심 요소는 PanDDA입니다. 자세한 내용은 각간행물(13,23)에설명되어 있습니다. 간단히 말해서 PanDDA는 CFS 캠페인에서 데이터 집합 집합의 전자 밀도 맵을 자동으로 계산합니다. 그런 다음 바인딩되지 않은 조각 조건으로 가정하고 소위 접지 상태 모델을 생성하기 위해 평균화됩니다. 그런 다음 접지 상태 모델은 복셀 관련 Z 점수를 사용하여 각 전자 밀도 맵과 지면 상태 맵 간의 로컬 불일치를 도출하는 데 사용됩니다. 그런 다음, 높은 Z 점수의 영역에 대해 소위 PanDDA 맵은 각 맵에서 지면 상태 밀도의 미세 조정 된 뺄셈에 의해 생성됩니다. 이렇게 하면 조각 바인딩 이벤트의 가시성이 크게 향상됩니다. - PanDDA의 결과를 최대화하려면 2단계 접근 방식을 사용합니다. 첫째, 표준 설정으로 PanDDA 실행(pandda.analyse)을 수행합니다. 모의에 젖은 결정이 수집되더라도, 해당 ID는 사용 가능한 모든 데이터에서 PanDDA에 의한 지면 상태 모델의 편향되지 않은 생성을 가능하게 하기 위해 매개 변수(그럼에도 불구하고 가능)로 포함되지 않습니다. 그 후, 출력 데이터는 Coot24에서소위 PanDDA 검사를 통해 사용자에 의해 평가된다. 여기서, 상대적으로 높은 자신감을 가진 안타는 첫 번째 단계를 마무리, 주목해야한다.
- 둘째, -exclude_from_characterisation="<바인딩 데이터 세트-ids>" 명령줄 옵션을 통해 지상 상태 모델에서 예비 적중(첫 번째 단계에서 결정)을 제외한 pandda.analyse 단계를 다시 실행합니다. 자세한 내용은 PanDDA 도움말 페이지(https://pandda.bitbucket.io/)에 설명되어 있습니다. 이렇게 하면 명확한 조회이므로 포함된 경우 접지 상태 모델이 모호해지면 해당 되는 데이터 집합이 무시됩니다. 이것은 향상된 접지 상태 모델로 이끌어 내고 따라서 전반적인 향상된 결과로 이끌어 냅니다. 마지막으로, 히트 식별을 완료하기 위해 철저한 PanDDA 검사가 수행됩니다.
참고: FragMAXapp에는 모델링된 바운드 상태를 저장하거나 PDB 제출을 위한 데이터를 준비하는 출력 옵션도 포함되어 있으며, 자세한 내용은 FragMAX 웹페이지(https://fragmax.github.io/)를 참조하십시오.
결과
이전에 보고된 F2X-엔트리 스크린11의검증 캠페인의 일환으로 MAX IV의 BioMAX 빔라인에서 3개의 캠페인이 진행되었으며, 1개의 캠페인은 HZB의 빔라인 BL14.1에서 진행되었습니다. 후자의 캠페인에서, DMSO를 포함하지 않은 흡수 상태를 이용한 특정 F2X-엔트리 스크린 조건세트는 효모 Aar2의 단백질-단백질 복합체와 효모 Prp8(AR)의 RNaseH와 같은 도메인에 대해 선별되었다. 선택된 조건세트는 DMSO11을포함하는 흡수 조건에서 AR에 대한 F2X-엔트리 스크린의 이전 캠페인에서 발견된 히트곡(즉, HZB에서 수행된 캠페인에서 DMSO부재 시 다시 상영됨)으로 구성됩니다. 도 7은 처리를 위한 XDSAPP의 FragMAXapp 조합, PanDDA를 이용한 자동 개선을 위한 fspipeline 및 후속 히트 발견을 통해 얻은 적중의 개요를 나타낸다.
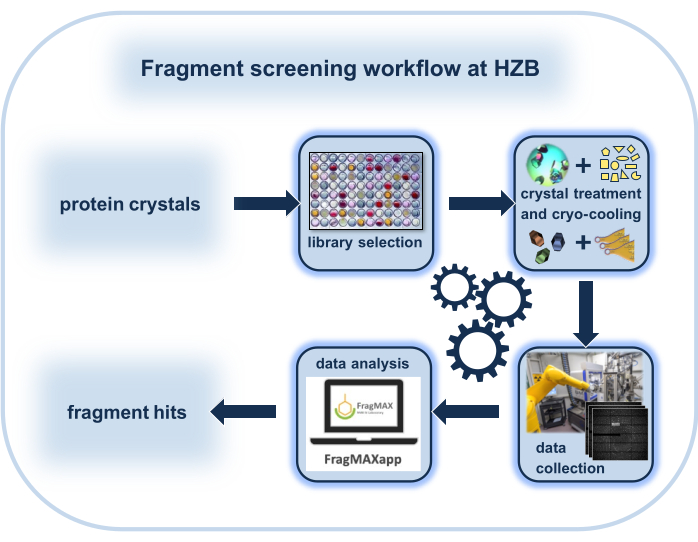
그림 1: 결정적 단편 스크리닝(CFS) 실험의 워크플로우를 회로도 표현하여 헬름홀츠 젠트럼 베를린의 특수 환경에 초점을 맞춘 실험.

그림 2: F2X 입력 화면의 제형 및 포장. 96복합 스크린은 호일과 진공 포장으로 밀봉된 3렌즈 96웰 MRC 로우 프로파일 플레이트에서 사용할 수 있습니다. 화면의 96 화합물은 각각 의 세 가지 렌즈 중 두 개로 DMSO 솔루션에서 건조됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: HZB 준비 실험실에서 CFS 워크 벤치의 사진. A)침을 구하고 B)크리스탈 수확에 필요한 도구의 어셈블리가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
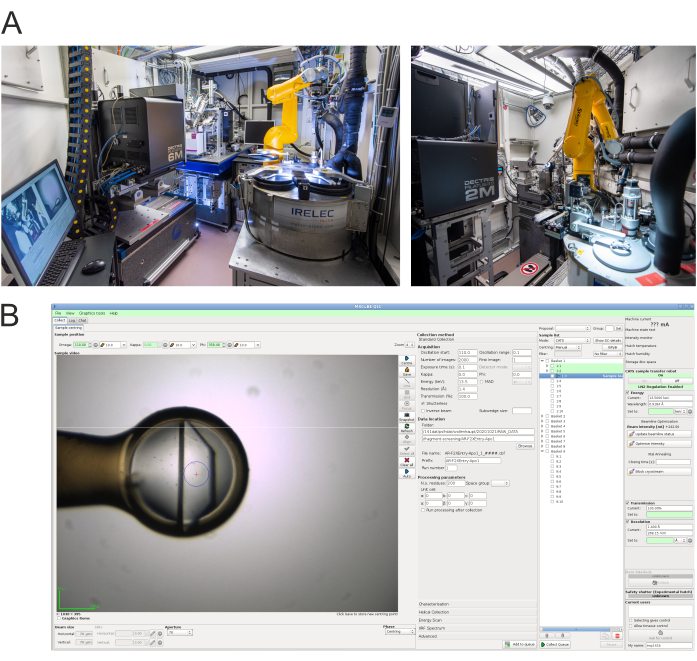
그림 4: 데이터 수집 엔드 스테이션 및 제어 소프트웨어. A)HZB-MX 빔라인 BL14.1(왼쪽)과 BL14.2(오른쪽)15의실험오두막 사진. B)회절 데이터 수집을 위해 BL14.1에서 사용되는 MXCuBE2 실험 제어인터페이스(16)의 스크린샷. BL14.2에서 매우 유사한 인터페이스가 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
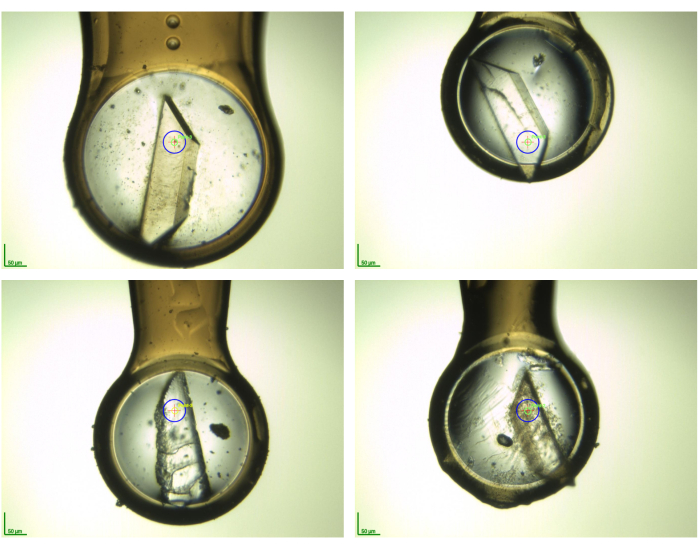
그림 5: 데이터 수집 전에 극저온 환경에서 일부 결정성 샘플의 사진 스냅샷. 이것은 파편 담그고 결정 수확을 수행 한 후 결정의 형태학의 가변성을 보여줍니다. 사진은 F2X-엔트리 스크린 유효성 검사11의일환으로 수집된 AR 샘플용 BioMAX 빔라인(MAX IV 싱크로트론, 룬드, 스웨덴)에서 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
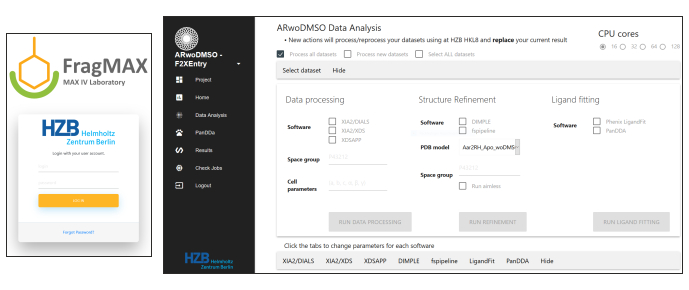
그림 6: 편리한 데이터 분석을 위해 HZB에 설치된 FragMaxApp18의 스크린 샷. 리마 외, FragMAXapp, 게시되지 않은 데이터에 대한 자세한 내용. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
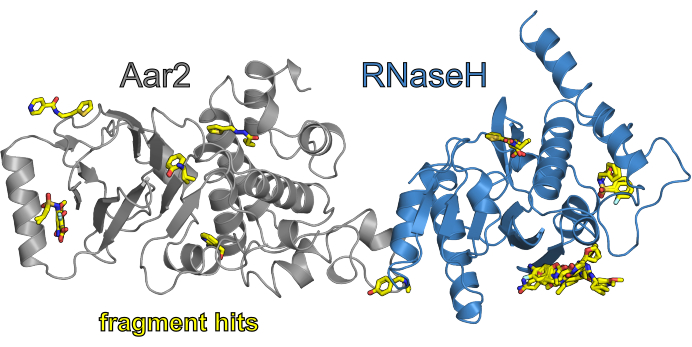
그림 7: CFS 캠페인 F2X-엔트리 대 AR(DMSO 제외)의 결과 개요입니다. AR 단백질 복합체는 만화 뷰에 표시되며, Aar2는 회색으로, Prp8과 같은 도메인은 파란색으로 색칠되어 있습니다. 캠페인의 조각 히트는 요소 색상 (C - 노란색, O - 빨간색, N - 파란색, S - 오렌지, Cl - 가벼운 시안)으로 채색됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 정보. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
성공적인 CFS 캠페인의 경우 설명된 전제 조건을 준수하는 것이 중요합니다(소개참조). 많은 잘 확산 결정의 재현 가능한 성장을 위해 신뢰할 수있는 결정화 시스템이 필요하며 자동화 된 정제를위한 입력 아포 모델로서 잘 정제 된 구조가 필요합니다. 단백질(활성 부위 또는 인터페이스 영역)의 표적 부위가 결정 격자의 단편에 접근할 수 있는지 확인하는 것도 중요합니다. 침을 흡수하는 것이 결정 품질을 크게 저하시키지 않도록 미리 담그고 조건을 최적화하는 것이 중요합니다. 이러한 측면을 무시하면 최적이 아닌 실험으로 이어질 가능성이 매우 높으며, 이는 제한된 사용이 될 것이며 최악의 경우 전체 실험의 반복이 필요합니다.
위에서 설명한 프로토콜은 표준 CFS 캠페인 중에 따르는 절차를 간략하게 설명합니다. 모든 전제 조건이 충족되면 모든 담근 결정의 90% 이상이 회절 실험에서 고해상도로 회절을 표시해야 합니다. 그렇지 않은 경우 몸을 담그는 시간이 몇 시간 또는 몇 분으로 단축 될 수 있습니다. 대부분의 조각의 좋은 용해도때문에, 이것은 괜찮은 점유 값을 얻기에 충분해야한다. 또한 일반적인 CFS 캠페인은 약 10% 이상의 적중률을 초래합니다. F2X-엔트리 스크린 유효성 검사캠페인(11)과 동일한 라이브러리를 통한 지속적인 사용자 캠페인의 경우 히트율이 훨씬 더 높은 경우(20% 이상, 데이터는 표시되지 않음).
결정화 단편 스크리닝의 일반적인 주의 사항은 결정적 접촉 부위의 존재입니다. 이러한 사이트는 사전 알려진 활성 사이트를 폐색할 수 있습니다 (심사 전에 검사할, 위 참조), 또는 이러한 연락처 사이트는 종종 파편이 바인딩할 수 있는 주머니와 핫스팟을 제공합니다. 이러한 단편 안타는 결정화 격자의 유물이 될 것이며 용액의 단백질에 결합하지 않을 것입니다. 이러한 이벤트는 공동 결정화 실험보다 실험을 담글 때 더 자주 발생하는 경향이 있습니다 (아마도 흡수 실험에 사용되는 더 높은 단편 농도로 인해). 그러나, 이전 경험에 따르면, 그들은 일반적으로 얻은 안타의 단지 사소한 부분을 구성. 예를 들어, 내도피아펩신(EP)과 Prp8RNaseH 및 Aar2(AR)의 화려한 단백질 단백질 복합체를 이용한 F2X-엔트리 스크린 유효성 검사 캠페인에서 대부분의 안타는 유망한사이트(11)에서일어났다. EP의 경우, 37개의 관찰된 결합 이벤트 중 27개가 활성 부위(즉, 이 프로테아제의 펩타이드 갈라진)에 위치하였다. 10개의 원격 바인딩 이벤트는 2개의 용매 노출 결합 이벤트와 8개의 크리스탈 접점 바인딩 이벤트(5개의 고유 히트에 해당)로 구성됩니다. 이러한 크리스탈 접촉 안타를 제외하면 EP 캠페인의 24%의 고유 조회수가 여전히 반영됩니다. 또한 알려진 활성 부위(크리스탈 접촉 바인더 제외)의 바인딩 이벤트가 잠재적으로 흥미로울 수 있다는 것을 알아차릴 수 있습니다(예: 단백질의 새로운 핫스팟 또는 알로스터스 부위를 드러내는 경우). AR 캠페인(동일한 간행물)의 경우, 23개의 관찰된 결합 이벤트 중 7개는 결정 접점에 위치하였고, 하나는 2개의 단백질의 직접 인터페이스에 위치하였고, 7개는 더 큰 생물학적 맥락의 다른 결합 파트너와 알려진 단백질 단백질 상호 작용 부위에 위치하였고(따라서 스pliceosome의 다른 조립 단계), 8개의 결합 이벤트는 AR에 아직 알려지지 않은 기능과 1개의 알 수 없는 기능을드러냈습니다. 따라서, 결정 접접촉 및 Prp8RnaseH 싱글톤의 이벤트를 제외하면 잠재적으로 유용한 결합 이벤트의 수는 15(14개의 고유 안타에 해당)이므로 15.6%의 적중률이다. 이러한 안타는 단백질-단백질 상호 작용 변조기 설계또는 발견된 두 개의 Aar2 핫스팟을 탐구하는 공구 화합물의 시작점이 될 수 있습니다. 또한 진행된 사용자 캠페인에 맞춰 결정화 조각 검사에서 적중한 부분만 아티팩트로 무시해야 합니다. 그러나 이것은 또한 주로 대상 종속적입니다.
적중률이 현저히 낮은 경우, 이는 표적 단백질과 관련된 다음 문제 중 하나를 나타낼 수 있다. 예를 들어, 바이러스 성 시스테인 프로테아제에 대한 CFS 캠페인에서 3 %의 적중률이 관찰되었습니다 (데이터는 표시되지 않음). 사용된 단백질이 활성 부위에서 화학적으로 변형되었을 가능성이 있는 것으로 나타났습니다. 이 경우, 다른 단백질 제제는 문제를 해결할 수 있다. 결정이 매우 DMSO 내성이있는 경우, F2X -엔트리 스크린은 DMSO없이 사용될 수 있습니다, 결과는 어느 정도 다를 수 있지만. DMSO의 존재에서 얻은 히트 곡의 대부분은 부재에 나타납니다. DMSO가 없는 경우 관찰할 수 없는 경우, 그 존재속에서 관찰할 수 있더라도 관찰할 수 없는 히트곡도 있을 것입니다. 그리고 마지막으로, DMSO의 부재에 만 표시 일부가있을 것입니다.
가장 심각한 어려움은 단백질이 물질 결합시 유도된 맞춤 운동을 겪는 경우에 생깁니다. 대부분의 경우, 결정 격자는 단백질 운동을 용납하지 않으며 결정은 붕괴됩니다. 이러한 경우, 유일한 선택은 단백질과 단편의 조정에 의존하는 것입니다. 그러나 이것은 새로운 결정 형태로 이어질 수 있습니다. 따라서 전체 프로세스의 자동화의 대부분은 더 이상 효율적으로 작동하지 않습니다. 다행히 지금까지 HZB에서 진행된 대부분의 CFS 캠페인에서이러한 종류의 문제가 발생하지 않았습니다. 단편의 약한 결합이 단백질 운동을 유도하기에 충분한 에너지를 제공하지 못하고, 특히 결정화된 형태가 결정포장력에 의해 안정화될 수 있다.
저자가 지금까지 만난 방법의 또 다른 심각한 제한은 결정화 칵테일 (따라서 담그용)이 휘발성 화합물을 포함 할 때입니다. 그런 다음 의미있는 방법으로 모든 크리스탈 핸들링을 수행하는 것이 불가능해집니다.
상이한 단백질은 더 크거나 적은 정도로 약물 이 가능한 부위를 포함할 수 있다. 예를 들면, 단백질 단백질 상호 작용은 일반적으로 표적으로 하기 더 어려운 확장된 평평한 표면에 의해 중재됩니다. 따라서 단편 결합 적중률은 단백질의 분자 표면의 구조에 따라 달라질 수 있습니다. 극단적인 경우, 단백질은 단편 결합을 위한 표적 사이트역할을 하는 적합한 표면 핫스팟을 포함하지 않을 수 있습니다. 따라서, 꼼꼼하게 수행 된 실험에도 불구하고, 어떤 조각 안타는 스크리닝에서 발생하지 않습니다. 그러나, 저자는 지금까지 이러한 상황을 발생하지 않았습니다.
원칙적으로 위에 설명된 프로토콜을 사용하여 CFS 캠페인의 크리스탈 담그고 수확하는 부분은 크리스탈 처리를 위해 장착된 모든 실험실에서 수행될 수 있습니다. 이는 HZB의 방법론과 다른 CFS 시설을 구별하며 경우에 따라 이점이 될 수 있습니다. 예를 들어, 결정이 다른 사이트에서 쉽게 재생산할 수 없거나 실험자의 여행이 제한된 경우(예: 전 세계 적인 전염병 상황에서), HZB의 사용자는 따라서 전체 장비(퍽, 도구, EasyAccess 프레임, 샘플 홀더 등)를 휴대용 세트로 제공합니다.
그러나 많은 수의 샘플 홀더와 극저온 저장 용량에 대한 요구 사항은 여전히 전용 CFS 시설에서 더 편리하게 충족됩니다. 또한, 많은 회절 데이터 세트의 수집의 필요성은 높은 샘플 처리량을 향해 기어드 빔 라인 에 가까운 이러한 시설을 지역화 강력하게 옹호한다. 이에 대한 예는 다이아몬드 광원및영국의관련 XChem 시설에서 빔라인 I04-1, 프랑스 ESRF의 MASSIF 빔라인26 또는 스웨덴의 MAX IV의 BioMAX 빔라인의 FragMAX시설(18)이다.
앞으로는 크리스탈 처리없이 CFS 실험을 설계할 수 있습니다. 이 방향의 첫 번째 발전이 보고되었습니다. 예를 들어, 음향 액체 전달에 의해 결정 함유 솔루션과 메쉬 형 샘플홀더(27)에직접 단편 용액을 혼합할 수 있다. 또 다른 접근 법은 XFEL 기지를 둔 리간드 검열을 위해 이용되었습니다. 원리 증명 실험에서, 결정 슬러리가 일괄 처리되어 제조되었고, 실리콘 고정 대상칩(28)에서담그고 회절된 데이터 수집을 수행하였다. 그러나, 이 접근은 아직도 개발되고 멀리 단백질 표적의 넓은 범위에 적용되거나 일상적인 CFS 시설에 유효하지 않습니다.
이 작업의 프로토콜을 통해 HZB(및 기타)에서 CFS 캠페인을 직접 수행하기 위한 자세한 지침이 설명되어 있으며, 성공 가능성이 높은 이러한 실험을 준비하고 수행하는 데 유용한 지침과 유용한 실습 팁이 제공되었습니다. 궁극적으로, CFS 심사에서 더 나은 확률과 성공률은 공구 화합물 또는 약물 후보자의 다운스트림 개발을 위한 출발점을 효율적으로 제공하는 데 크게 기여합니다.
공개
EasyAccess 프레임에 관한 특허 출원은 헬름홀츠 젠트럼 베를린에 의해 독일 특허 상표 사무소에 등록 번호 DE 10 2018 111 478.8로 출원되었습니다. 또한 독일 특허의 우선 순위를 사용하여 PCT 경로를 통한 국제 특허 출원이 출원되었습니다.
감사의 말
HZB에서 CFS 캠페인을 수행한 수많은 사용자 그룹에 감사드립니다. 그들의 피드백은 워크플로우의 점진적 개선으로 이어졌습니다. 우리는 마부르크 대학과 MAX IV의 FragMAX 그룹의 약물 디자인 그룹에 감사드리고 싶습니다. 우리는 프로젝트 Frag2Xtal 및 Frag4Lead (번호 05K13M1 및 05K16M1)를 통해 독일 연방 교육 과학 부 (BMBF)의 지원에 감사드립니다. 우리는 또한 iNEXT-Discovery를 통해 지원에 감사, 프로젝트 번호 871037, 유럽 위원회의 호라이즌 2020 프로그램에 의해 투자.
자료
| Name | Company | Catalog Number | Comments |
| 1 µL pipet | Eppendorf | EP3123000012 | |
| 12 channel pipet, 100 µL | Eppendorf | EP4861000791 | |
| Blow dryer | TH-Geyer | 9.106 788 | |
| Crystal containing crystallization plates | Contains crystals to be soaked | ||
| Crystallization incubator | Providing constant temperature for crystallization experiment, at HZB: 20°C | ||
| Dual Thickness MicroLoops (LD) of different aperture sizes | MiTeGen | various, e.g. M5-L18SP-75LD | 250 loops in the appropiate size needed for the protocol, can be provided by HZB |
| EasyAccess Frame | HZB | The EasyAccess Frame is a special device for handling multiple crystals, which was developed at the HZB (Barthel et al., 2021). | |
| F2X-Entry Screen plate | HZB | Developed F2X-Entry Screen (Wollenhaupt et al., 2020) | |
| Glas spot plate | VWR | MARI1406506 | |
| Liquid nitrogen | At least a filled up 5 L can | ||
| Liquid nitrogen storage can | n.a. | n.a. | |
| Magentic crystal wand | MiTeGen | M-R-1013198 | |
| Microscopes | Leica | n.a. | |
| MRC 3-lens 96-well low profile crystallization plate | SwissCI | 3W96TLP-UVP | For mock-soaked crystals (optional) |
| Reagent reservoir | Carl Roth | EKT6.1 | 25 ml volume |
| Sample tracking template | https://www.jove.com/files/ftp_upload/62208/TemplateCFSHZBSampleTracking. xlsx | ||
| Scalpel | B. Braun | BA825SU | |
| Sealing foil for microtiter plates | GreinerBioOne | 676070 | |
| Shelved puck shipping canes (for Unipucks) | MiTeGen | M-CP-111-065 | 2 canes made of aluminum; can be provided by the HZB |
| Soaking solution | At least 5 ml are needed | ||
| Soaking solution including cryo-protectant, 150µL | Only needed if soaking solution is not cryo-protectant already | ||
| Tissues | Roth (Kimberly Clark Professional) | AA64.1 | |
| Transport dewar (Whartington dry shipper) | MiTeGen | TW-CX100 | 2 Travel dewars for storage of the 2 unipuck canes, alternatively a storage dewar of type VHC35 or similar could be used. |
| Unipuck foam dewars with lid | MiTeGen | M-CP-111-022 | two foam dewars especially suited for unipuck handling described in the protocol if SPINE pucks are used, different foam dewars might have to be applied. |
| Unipuck starter set | MiTeGen | M-CP-UPSK001 | Can be provided by the HZB |
| Unipucks | MiTeGen | M-CP-111-021 | 14 unipucks; can be provided by the HZB |
참고문헌
- Erlanson, D. A., Fesik, S. W., Hubbard, R. E., Jahnke, W., Jhoti, H. Twenty years on: the impact of fragments on drug discovery. Nature Reviews Drug Discovery. 15 (9), 605-619 (2016).
- Hall, R. J., Mortenson, P. N., Murray, C. W. Efficient exploration of chemical space by fragment-based screening. Progress in Biophysics and Molecular Biology. 116 (2-3), 82-91 (2014).
- Erlanson, D. A. Introduction to fragment-based drug discovery. Topics in Current Chemistry. 317, 1-32 (2012).
- Scott, D. E., Coyne, A. G., Hudson, S. A., Abell, C. Fragment-based approaches in drug discovery and chemical biology. Biochemistry. 51 (25), 4990-5003 (2012).
- Lamoree, B., Hubbard, R. E. Current perspectives in fragment-based lead discovery (FBLD). Essays in Biochemistry. 61 (5), 453-464 (2017).
- Schiebel, J., et al. Six Biophysical Screening Methods Miss a Large Proportion of Crystallographically Discovered Fragment Hits: A Case Study. ACS Chemical Biology. 11 (6), 1693-1701 (2016).
- Schiebel, J., et al. High-Throughput Crystallography: Reliable and Efficient Identification of Fragment Hits. Structure. 24 (8), 1398-1409 (2016).
- Krojer, T., et al. The XChemExplorer graphical workflow tool for routine or large-scale protein-ligand structure determination. Acta Crystallographica Section D: Structural Biology. 73 (3), 267-278 (2017).
- Radeva, N., et al. Active Site Mapping of an Aspartic Protease by Multiple Fragment Crystal Structures: Versatile Warheads to Address a Catalytic Dyad. Journal of Medicinal Chemistry. 59 (21), 9743-9759 (2016).
- Cox, O. B. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7 (3), 2322-2330 (2016).
- Wollenhaupt, J., et al. F2X-Universal and F2X-Entry: Structurally Diverse Compound Libraries for Crystallographic Fragment Screening. Structure. 28 (6), 694-706 (2020).
- . EU OPENSCREEN fragment library Available from: https://www.eu-openscreen.eu/services/compound-collection/fragment-library.html (2020)
- Pearce, N. M., et al. A multi-crystal method for extracting obscured crystallographic states from conventionally uninterpretable electron density. Nature Communications. 8, 15123 (2017).
- Barthel, T., Huschmann, F. U., Wallacher, D., Klebe, G., Weiss, M. S., Wollenhaupt, J. Facilitated crystal handling using a simple device for evaporation reduction in microtiter plates. Journal of Applied Crystallography. 54, (2021).
- Mueller, U., et al. The macromolecular crystallography beamlines at BESSY II of the Helmholtz-Zentrum Berlin: Current status and perspectives. The European Physical Journal Plus. 130 (7), 141 (2015).
- Oscarsson, M., et al. MXCuBE2: The dawn of MXCuBE collaboration. Journal of Synchrotron Radiation. 26 (2), 393-405 (2019).
- Mueller, M., Wang, M., Schulze-Briese, C. Optimal fine φ-slicing for single-photon-counting pixel detectors. Acta Crystallographica Section D: Biological Crystallography. 68 (1), 42-56 (2012).
- Lima, G. M. A., et al. FragMAX: The fragment-screening platform at the MAX IV Laboratory. Acta Crystallographica Section D Structural Biology. 76 (8), 771-777 (2020).
- Sparta, K. M., Krug, M., Heinemann, U., Mueller, U., Weiss, M. S. XDSAPP2.0. Journal of Applied Crystallography. 49 (3), 1085-1092 (2016).
- Winter, G. xia2: an expert system for macromolecular crystallography data reduction. Journal of Applied Crystallography. 43 (1), 186-190 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica Section D: Biological Crystallography. 67 (4), 235-242 (2011).
- Terwilliger, T. C., Klei, H., Adams, P. D., Moriarty, N. W., Cohn, J. D. Automated ligand fitting by core-fragment fitting and extension into density. Acta Crystallographica Section D: Biological Crystallography. 62 (8), 915-922 (2006).
- Pearce, N. M., Krojer, T., Von Delft, F. Proper modelling of ligand binding requires an ensemble of bound and unbound states. Acta Crystallographica Section D Structural Biology. 73 (3), 256-266 (2017).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 486-501 (2010).
- Collins, P. M., et al. Chapter Eleven - Achieving a Good Crystal System for Crystallographic X-Ray Fragment Screening. Methods in Enzymology. 610, 251-264 (2018).
- Bowler, M. W., et al. MASSIF-1: a beamline dedicated to the fully automatic characterization and data collection from crystals of biological macromolecules. Journal of Synchrotron Radiation. 22 (6), 1540-1547 (2015).
- Cuttitta, C. M., et al. Acoustic transfer of protein crystals from agarose pedestals to micromeshes for high-throughput screening. Acta Crystallographica Section D Biological Crystallography. 71 (1), 94-103 (2015).
- Moreno-Chicano, T., et al. High-throughput structures of protein-ligand complexes at room temperature using serial femtosecond crystallography. IUCrJ. 6 (6), 1074-1085 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유