Method Article
单一肌纤维培养测定法用于评估体外成人肌肉干细胞功能
摘要
在该协议中,描述了肌肉干细胞的体外培养和功能分析方法,该方法保留了它们与其内源性生态位的大部分相互作用。
摘要
成人骨骼肌组织拥有干细胞群,这对于其再生能力是必不可少的。肌肉损伤后,肌肉干细胞离开其静止状态并激活肌源程序,最终导致受损组织的修复,同时补充肌肉干细胞池。影响肌肉干细胞活性的各种因素,其中包括内在刺激,但也包括来自直接肌肉干细胞环境,干细胞生态位的信号。单个肌纤维及其相关肌肉干细胞的分离和培养保留了干细胞与其生态位的大部分相互作用,因此是研究肌肉干细胞功能离体的最接近的可能性。在这里,提供了从小鼠EDL(长指伸肌)肌肉中分离,培养,siRNA转染和免疫染色的方案。这里概述的实验条件允许在体外研究和操纵肌肉干细胞,包括研究肌原活性,而无需体内动物实验。
引言
成人骨骼肌是有丝分裂后组织,主要由多核肌纤维组成,肌纤维是自主运动的效应细胞。它具有显着的再生能力,这一过程类似于胚胎肌原,并经历年龄和疾病的损害1。骨骼肌的这种惊人的再生能力取决于肌肉干细胞(MuSC),由于它们位于肌层和肌纤维的基底层之间,因此也称为卫星细胞2,3。在静止条件下,MuSC是静止的,其特征在于转录因子Pax7和静音标记物如Sprouty1 4,5,6,7,8的表达。在激活时,例如,在损伤后,MuSC离开静止状态并上调肌源性调节因子MyoD9。Pax7 / MyoD双阳性MuSC增殖和分化,从而产生肌原前体细胞,这些细胞通常也被称为成肌细胞。然后,这些成肌细胞进一步分化成细长的肌细胞,这一过程与分子和形态变化相吻合,例如,Pax7的丧失和肌原蛋白表达10的上调。然后,肌细胞最终相互融合或融合到现有的肌纤维,从而修复受损组织。重要的是,一小部分肌肉干细胞恢复MyoD上调,并能够自我更新11。通过研究Pax7,MyoD和Myogenin10等肌源标志物可以很容易地观察到MuSC分化和肌原进展的状态。
单一肌峰凝剂与其相邻的MuSCs的培养是在离体环境中研究MuSC功能的极好方法,因为MuSC保留在其内源性生态位12,13中。MuSC的行为由内在信号以及由生态位提供的外在信号调节,生态位是一个特殊的解剖学位置,包括MuSC周围的细胞外基质(ECM)的成分和肌纤维本身。例如,MuSC静止的外在调节器之一是Notch信号传导。在这里,MuSC从肌纤维和ECM14,15,16接收信号线索。此外,MuSC生态位对于控制MuSC的分裂轴非常重要,从而调节MuSC子细胞17,18的细胞命运。合理地,不对称的MuSC分裂,肌源进展和自我更新等参数可以在这种实验设置中进行唯一的评估。例如,在培养期72小时后,一个MuSC可以形成多细胞簇,可以研究不同肌源性群体的发生和百分比,例如自我更新,增殖和进一步分化的MuSCs 8,19,20,21。MuSC的分化状态可以通过研究Pax7,MyoD和Myogenin的表达/共表达来确定。培养72小时后,可以通过以下参数区分簇中的细胞:Pax7只有细胞是自我更新的MuSC,而Pax7 / MyoD双阳性细胞是增殖/活化的MuSC,进一步分化的肌原细胞是Myogenin阳性22。此外,除了肌原进展之外,还可以研究MuSC数量或重新进入细胞周期/活化,例如,通过基于上述参数的基于免疫荧光的分析。
在这里,描述了肌纤维分离和培养方案的独特特征,例如,保存MuSC与其龛位的相互作用。小鼠整个EDL(长指伸肌)肌肉被仔细解剖,被胶原酶消化,并物理研磨以获得单个肌纤维及其相关的MuSC进行进一步培养。此外,该协议还描述了用siRNA转染MuSC的步骤,用于候选基因的功能分析和基于免疫荧光的连续分析,而无需转基因动物。
研究方案
动物的牺牲必须按照国家动物实验规定进行。这里描述的协议是根据莱布尼茨衰老研究所 - 弗里茨·李普曼研究所的指导方针和欧盟(EU)指令2010/63 / EU(器官摘取许可证编号:O_JvM_18-20)执行的。 图1总结了该协议的基本步骤。
1. 培养板、培养基和巴斯德移液器的制备
注意:分离和培养单个肌峰布所需的所有材料和设备都需要尽可能无菌。因此,建议在半无菌解剖罩下分离单个肌纤维。
- 使用无菌HS(马血清)涂覆组织培养板。涂层可防止单个肌纤维附着在塑料表面。对于每只小鼠,需要4孔12孔板用于分离,24孔板的专用孔用于培养。将1 mL的12孔板的孔和具有0.5mL HS的24孔板的孔在室温(室温)下孵育5分钟,然后取出HS并让板再干燥5分钟。
注意:如果保持无菌,HS可以多次收集并重复用于涂层目的。 - 通过补充DMEM(Dulbecco的改性Eagle培养基,含有4.5g / L葡萄糖和丙酮酸钠)和20%FBS(胎儿牛血清)来制备肌纤维分离培养基,通过0.22μm过滤器过滤。在分离前约30分钟将培养基加入预包被的隔离板(12孔板,每孔2-4mL分离培养基),并在加湿的37°C培养箱中平衡,其中CO2为5%。
- 通过补充DMEM(Dulbecco的改性Eagle培养基,含有4.5g / L葡萄糖和丙酮酸钠)和20%FBS(胎儿牛血清)和1%鸡胚提取物来制备肌纤维培养基,通过0.22μm过滤器过滤。在分离前约30分钟向预包衣培养板(24孔板)的每个孔中加入0.5mL培养基,并在加湿的37°C培养箱中平衡,其中CO为5%。
- 通过将0.2%(w / v)胶原酶1型(来自组织 溶解梭状芽胞杆菌)溶解在DMEM(Dulbecco的改性Eagle培养基,含有4.5g / L葡萄糖和丙酮酸钠)中来制备胶原酶消化溶液,通过0.22μm过滤器过滤。对于两个EDL(长指伸肌)肌肉,在无菌的15 mL反应管中使用2.5 mL胶原酶溶液。此外,在开始隔离之前,在37°C的循环水浴中预热溶液约10分钟。
- 准备无菌巴斯德移液器,用于胶原酶消化的肌肉的研磨。使用钻石笔切割巴斯德移液器。
- 对于每只小鼠,使用一个大孔径移液器,开口约0.3厘米,长度约10-12厘米,第二个玻璃移液器,小开口约0.1厘米,长度约22厘米(图2F)。
- 通过用本生燃烧器的火焰进行热抛光,使两个移液器的边缘变得光滑。轻轻移动,将移液器吸头放入火焰中5-10秒,以允许均匀的热量分布,直到锋利的玻璃边缘变得平滑。
- 使用前立即用无菌HS涂覆两种类型的玻璃移液器,在整个移液器中加入〜2mL HS5分钟,然后,弹出HS并让移液器在室温下干燥5分钟。
2. EDL肌肉分离和胶原酶消化
- 用70%乙醇喷洒所有设备,以避免污染。
- 按照国家动物实验规定牺牲小鼠。
- 用70%乙醇喷洒小鼠的后肢。使用硬化的细弯曲剪刀(24毫米切削刃)和细镊子(Dumont 7,弯曲或直)去除皮肤并暴露下面的肌肉。避免下层肌肉与皮毛接触(增加污染的风险)。
- 用细小弯曲的镊子去除周围的筋膜,而不会损坏下面的肌肉(图2A)。合上镊子以避免弯曲。
- 使用弯曲的镊子暴露TA(胫骨前)和EDL肌肉的远端肌腱。要去除TA,请用镊子抓住远端TA肌腱,并用精细的Vannas弹簧剪刀(5毫米切削刃,0.35毫米尖端直径)切割。当将TA保持在肌腱处时,将其拉向膝盖并切开靠近膝盖的肌肉(图2B),EDL肌肉现在暴露在外。
注意:请确保在此步骤中仅抓住TA肌腱,否则下面的EDL可能会损坏。当切断TA肌肉时,请确保膝盖处的肌腱在之后可以很容易地看到。 - 用细弯曲的镊子抬起远端EDL肌腱,并用细Vannas弹簧剪刀切割(图2C)。通过小心地将EDL拉向膝盖来暴露近端EDL肌腱。用细的Vannas弹簧剪刀剪开近端肌腱。将EDL肌肉转移到步骤1.4的15mL反应管中预热的37°C的2.5mL胶原酶消化溶液中。(图2D)。
注意:在外膝关节结缔组织做一个小切口,以完全暴露EDL肌腱近端。确保只抓住肌腱,不要过度拉伸EDL。 - 重复步骤 2.3。到 2.6.与第二个EDL。将两块EDL肌肉加入装有2.5 mL胶原酶消化溶液的同一15 mL反应管中。
- 将EDL肌肉在循环水浴中在37°C的反应管中孵育。
注意:孵育时间取决于几个因素,例如胶原酶活性,小鼠年龄和纤维化组织的数量。成年小鼠(2-6个月大)的EDL肌肉的典型孵育时间为1-1.5小时,老年小鼠(18个月大)的典型孵育时间为1.5-2小时。 - 为避免肌肉过度消化,请在消化时间检查肌肉。当肌肉松弛并且可以看到单个肌纤维时停止消化(图2E)。用大口径移液管小心地将肌肉转移到含有肌纤维分离培养基的预热12孔板的第一孔(图2G)。
3. 肌纤维解离与培养
- 对于以下步骤,请使用立体双目显微镜,最好配备加热板(37°C)。使用大口径移液器用温隔离培养基冲洗肌肉,直到释放单个肌排纤维。用大口径移液器解离肌肉,直到所需数量的肌纤维在溶液中自由漂浮。
注意:避免过度研磨,以降低肌纤维受损的风险。强烈建议使用加热板进行肌纤维解离,因为在分离过程中温度会下降,这将导致肌纤维死亡。 - 将带有HS涂层的小口径玻璃移液器的非收缩肌峰(图2H)转移到充满隔离介质的第二孔中,以洗去碎片和收缩(损坏的)肌峰(图2I)。
注意:为避免孤立的肌纤维过度移动,可以将它们转移到第二个孔中,然后可以继续研磨过程。 - 将未收缩的肌纤维转移到下一个(第3个)充满隔离培养基的孔中再次洗涤。
- 使用涂有HS的小口径玻璃移液器将约50-100个非收缩肌力移植到含有肌纤维培养基的24孔板中。
- 在37°C,5%CO2 下孵育肌纤维,用于专用时间(建议最长96小时)。
注意:μSCs在培养42小时后分裂一次平面或顶端基底。此外,在培养72小时后,MuSCs形成由自我更新,增殖或承诺(分化)MuSC组成的多细胞簇。
4. 硅核酸转染
- 肌纤维分离后4小时,用脂质转染试剂转染肌纤维相关MuSCs(在充满500μL培养基的24孔板的一个孔中转染50-100个非收缩肌奥夫体),例如根据制造商的方案,终浓度为5 pmol siRNA。因此,将25μLOpti-MEM和相应体积的siRNA加入到含有1.5μL转染试剂的25μL Opti-MEM中。孵育反应混合物5分钟,然后加入到500μL培养基中。
注意:对于较长的培养期,例如超过48小时,建议在24小时或48小时后进行第二次转染。转染后无需更换培养基。
5. 固定和中频染色
- 对于免疫染色,请使用立体双目显微镜。以下步骤中的所有体积都调整到24孔板的一个孔中。使用HS涂层的小口径移液器执行所有以下步骤。
- 小心地丢弃肌纤维培养基,同时在孔中留下一些溶液(每24孔约100μL)。对于所有进一步的步骤,请执行此操作,除非另有说明以允许肌纤维漂浮。加入500μL2%PFA以将肌纤维与相邻的MuSC固定,在室温(RT)下孵育5分钟。
- 小心地除去上清液,并用PBS洗涤肌峰三次(pH 7.4,500μL,每次室温5分钟)。
- 加入500μL透化溶液(0.1%Triton X-100,PBS中0.1M甘氨酸,pH 7.4),在室温下孵育10分钟。
- 除去透化溶液,加入500μL封闭溶液(PBS中的5%HS,pH 7.4)在室温下1小时。
注意:检查推荐的一抗封闭溶液,以避免非特异性结合。 - 除去封闭溶液,每孔加入300μL一抗稀释液(例如,抗Pax7(PAX7,DSHB,未稀释),抗MyoD(克隆G-1,Santa Cruz,1:200))。在4°C孵育过夜。
- 用每孔500μLPBS洗涤三次(室温5分钟)。
- 除去PBS,每孔加入300μL二抗稀释液(例如,抗小鼠IgG1-546和抗小鼠IgG2b-488 1:1000)。在避光室下孵育1小时。对于以下步骤,建议使用轻度减少条件。
- 用每孔500μLPBS洗涤两次(室温5分钟)。
- 通过在每孔使用500μL溶液(最终DAPI浓度10μg/ mL)在室温下进行5分钟进行DAPI染色。
- 用每孔500μLPBS洗涤两次(室温5分钟)。
- 使用疏水笔在微观载玻片上画一个圆圈,以形成防水屏障,防止含有肌纤维的液体溢出。将尽可能小体积的肌峰移送到显微载玻片上,并将它们分散在载玻片上。
注意:避免在微观载玻片上物理拉动肌,因为这可能会导致摩擦,导致簇与肌纤维分离。 - 用小口径巴斯德移液器或200μL移液器除去残留液体。
- 使用两滴水性安装介质,并用盖玻片覆盖肌纤维。让载玻片在制造商建议的时间内干燥。将载玻片储存在4°C的黑暗中。
结果
该协议为单肌峰管与来自小鼠EDL肌肉的相关MuSCs的成功衍生和培养提供了说明。 图1总结了该协议的基本步骤。小心地对EDL肌肉进行肌腱到肌腱的夹层(图2A-C)对于高产的活肌纤维至关重要。肌肉解离首先通过胶原酶消化(图2D)实现,然后通过物理研磨(图2G)实现。培养完整的肌纤维(图2H),而超包合和死亡的肌峰纤维(图2I)应排除在培养和分析之外。
MuSC在分离过程中保持肌纤维相关。转录因子Pax7的免疫荧光染色鉴定并区分了7-9个MuSC细胞核与每个肌纤维的大量肌核,当在分离过程完成后直接固定时(图3A)。图3B显示了图3A中具有额外明场通道的放大区域,该通道暴露了肌管的亚细胞肌原纤维结构,并在粘液素核中显示了Pax7免疫荧光信号。
肌纤维相关MuSC的激活和肌原进展可以通过肌原标志物表达进行分析。与新鲜分离的肌纤维(0小时)相关,可以发现大多数静止的MuSC,其特征在于Pax7表达和缺乏MyoD表达,因此类似于体内稳态状态(图4,0小时)。由于解剖/解离程序和肌纤维培养基组成,MuSC迅速激活和上调转录因子MyoD以促进增殖,正如在42小时观察到的那样,当MuSC经历第一次分裂时(图4,42小时)。培养72小时后,MuSC形成具有不同肌原命运的后代簇,与不同肌原标记的表达模式平行(图4,72小时)。只有Pax7 +细胞抵抗分化并成为自我更新的干细胞。Pax7 +和MyoD +双阳性细胞是增殖的,而只有MyoD +的细胞沿着肌原谱系进一步发展并会分化。
肌纤维培养系统允许通过各种干预措施有效地干扰MuSC活性,其中之一是siRNA转染,如本方案中详细描述的那样。为了监测肌纤维相关MuSC的转染效率,转染了荧光标记的非靶向siRNA。Pax7阳性MuSC以颗粒状方式积累细胞质siRNA,表明有效摄取(图5A)。在肌纤维的细胞质中没有观察到荧光颗粒,表明在分离后4小时肌纤维中存在天然的摄取屏障,并且siRNA转染特异性靶向MuSCs。对每个肌纤维的阳性转染Pax7 +细胞的定量显示,超过一半的MuSC在24小时完成第一轮分裂之前吸收了可见量的荧光标记siRNA。转染的Pax7 +细胞的数量在30小时后进一步增加至74%(图5B)。此外,在两个时间点,转染或未转染条件的每个肌纤维的Pax7 +细胞数量没有差异,表明转染程序对干细胞数量没有不利影响(图5C)。
总之,该协议提供了EDL单肌力补板及其相邻肌肉干细胞的分离和培养的详细描述。它能够研究肌纤维相关的肌肉干细胞活体活性,例如,通过基于免疫荧光的分析。通过siRNA转染操作肌肉干细胞是有效的,并为功能分析提供了方法学基础。
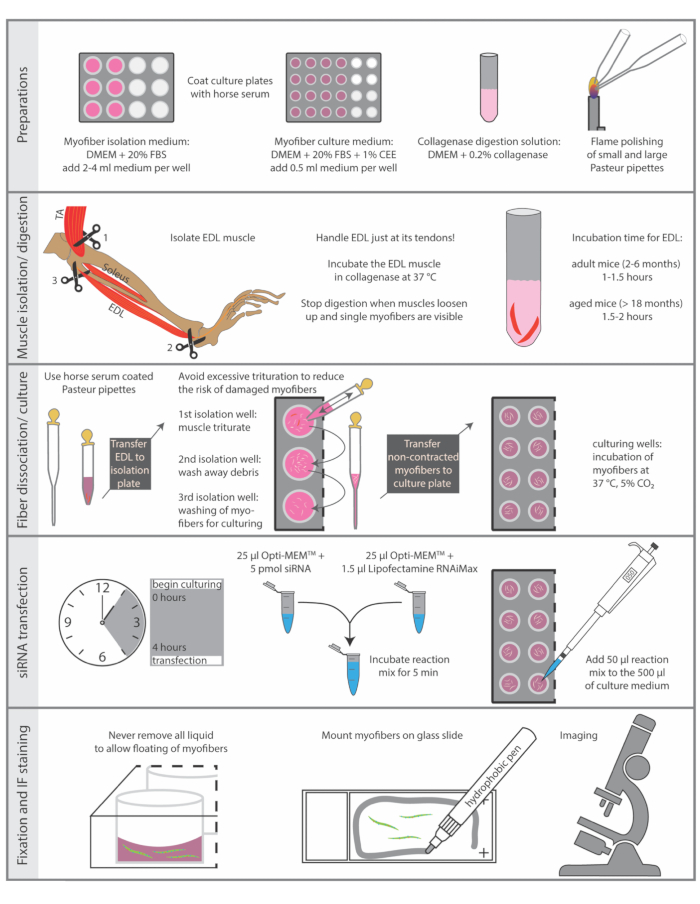
图1:基本步骤的示意图摘要。 本图总结了分离和免疫染色程序的基本步骤。缩写:DMEM,Dulbecco的Modified Eagle's Medium;FBS,胎牛血清;CEE,鸡胚提取物;TA, 胫骨前部;EDL, extensor digitorum longus 请单击此处查看此图的放大版本。
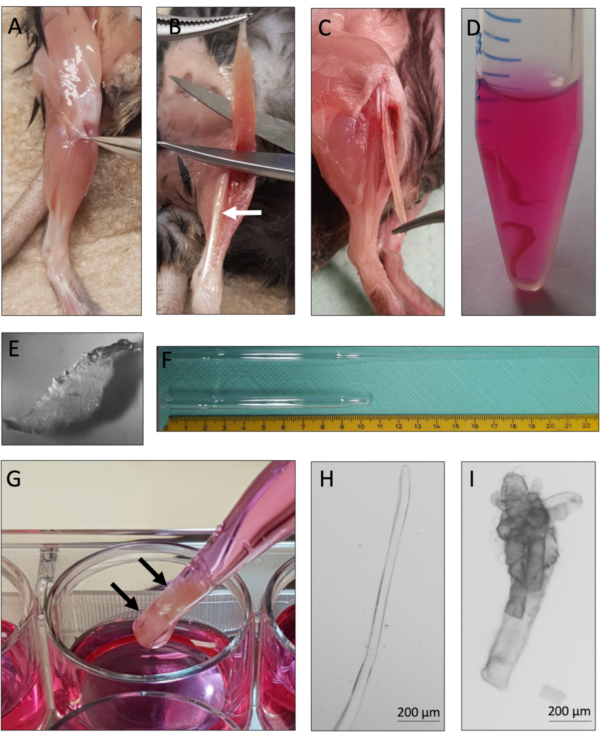
图2:小鼠EDL解剖和单肌纤维分离(A)移除小鼠后肢的皮肤,拉开筋膜周围的肌肉,露出TA(胫骨前)肌。(B)去除TA肌以暴露EDL(长指伸肌)肌肉,以白色箭头标记。(C)EDL肌肉通过切割其肌腱进行解剖。(D) 两块EDL肌肉被胶原酶消化。(E)胶原酶消化肌肉的外观,可见单个肌纤维从组织核心松动。(F) 大口径和小口径巴斯德移液器与鳞片。(G) EDL肌肉(用黑色箭头标记)使用大口径巴斯德移液器进行物理研磨。(H)单个完整的肌纤维化物薄而有光泽,可以单独收集用于培养和分析。(I) 超包和死亡的肌纤维不适合培养和分析。使用N-Achroplan 5x物镜用显微镜捕获2H和2I的显微图像。比例尺为200μm,请点击此处查看此图的放大版本。
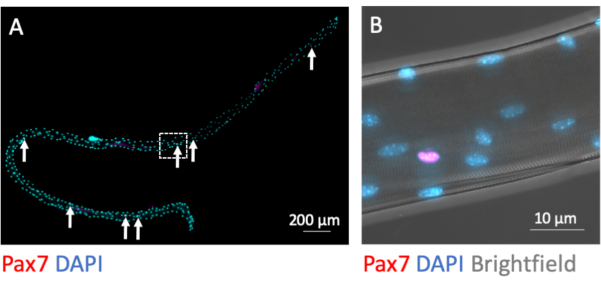
图3:整个单个肌纤维及其相关MuSC的显微图像。制备来自年轻C57BL / 6小鼠EDL的单个肌峰布,并在分离(0 h)后固定PFA。(A) Pax7 和 DAPI 免疫荧光染色可识别肌纤维相关肌肉干细胞(MuSC,用箭头标记)。使用配备Plan-Apochromat 40x油物镜的显微镜的瓷砖和z-stack功能捕获显微图像。比例尺为200μm.(B)放大倍率(A),显示明场中肌核,一个Pax7阳性核和来自肌原纤维结构的明暗图案。比例尺为10μm,请点击此处查看此图的放大版本。
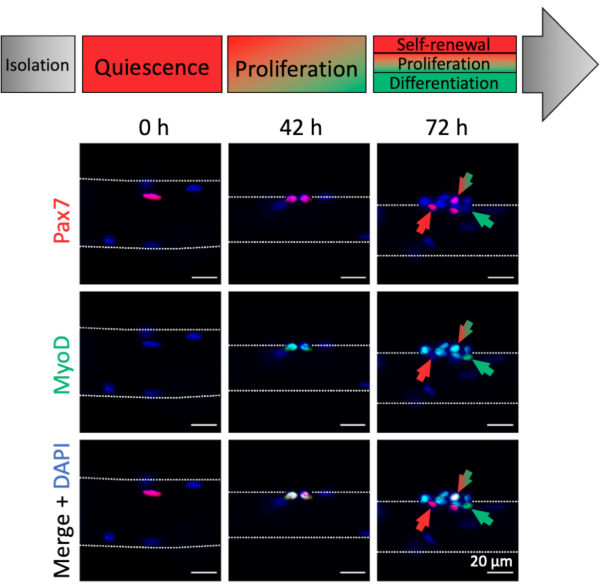
图4:单次肌纤维培养过程中MuSC激活和肌原进展的免疫荧光图像。 新鲜分离的肌纤维(0小时)的肌肉干细胞(MuSC)代表接近体内静止的稳态状态,其特征在于Pax7的表达和缺乏MyoD表达。在单次肌纤维培养期间,大多数MuSC上调MyoD并重新进入细胞周期以分裂和增殖(42小时)。培养72小时后,可以根据肌源标记物表达来区分MuSC的命运。仅具有Pax7表达的细胞将自我更新(红色箭头),而Pax7和MyoD双阳性细胞(红色/绿色箭头)继续增殖。MyoD只有阳性细胞(绿色箭头)致力于肌源分化。使用具有Plan-Apochromat 20x物镜(0小时,42小时)或LD Plan-Neofluar 40x物镜(72小时)的显微镜捕获显微镜图像。比例尺为20μm, 请点击此处查看此图的放大版本。
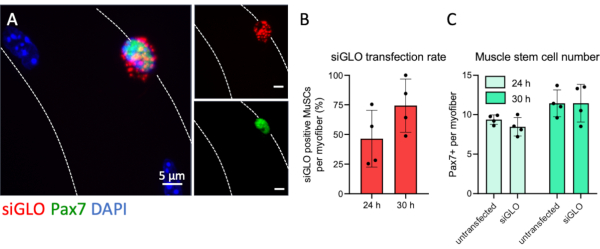
图5:MuSC的荧光siRNA转染和摄取分析。按照该方案提供的步骤制备EDL单肌奥非布,并用荧光标记的siRNA(siGLO)转染。(A)在培养30小时时,siGLO颗粒的细胞质特异性地积聚在单个肌纤维上的Pax7阳性肌肉干细胞(MuSC)中。使用具有Plan-Apochromat 100x油物镜的显微镜的z-stack和apotome功能捕获显微图像。比例尺为5μm(B)在培养24或30小时时Pax7阳性肌肉干细胞对siRNA的摄取进行定量。(C) 每根肌纤维的Pax7阳性细胞数,比较培养24或30小时时未转染和转染的情况。数据显示为平均值,标准偏差为n = 4只小鼠。请点击此处查看此图的放大版本。
讨论
在这里,提出了一种使用体外方法在功能上研究特定基因在MuSC中的作用的方法。重要的是,在这里描述的系统中,MuSC在条件下培养,这些条件尽可能类似于体内情况,从而保留了MuSC与其生态位的大部分相互作用。这是通过在浮动条件下培养分离的肌峰布及其相邻的MuSC和连续siRNA转染来实现的。描述了肌纤维分离,siRNA转染和通过免疫荧光分析在培养72小时内研究MuSC群体的程序。此外,还证明,在培养30小时后,大约74%的MuSC被荧光标记的对照siRNA转染。
应特别注意仔细解剖EDL肌肉,因为广泛的拉伸,捏合或挤压将导致肌纤维收缩和连续死亡。此外,重要的是要研究每个条件每个重复的至少20个不同肌纤维的MuSC簇。这是必要的,因为MuSC的数量和性质由于MuSC亚群的存在而变化。当使用浮动肌纤维培养方法研究特定siRNA对MuSCs的影响时,应在同一小鼠和肌肉内将条件与靶向siRNA与非靶向对照进行比较。建议这样做是为了避免可能覆盖或放大siRNA效应的小鼠特异性差异。敲低效率可以通过免疫荧光分析来确定,使用单个肌力缓冲器及其相邻的MuSC对靶基因进行抗体。如果这不是一种选择,可以测试原代成肌细胞中的siRNA敲低效率,然后进行定量RT-PCR或免疫印迹分析。在分析siRNA对MuSC对单个肌峰出纤维的影响之前,应确定siRNA的效率。使用由4种不同的siRNA组成的智能池与单个siRNA相比,可以提高敲低效率,但也会增加非特异性靶向的风险。应使用非靶向siRNA作为对照。为了直接监测转染效率,可以使用荧光标记的非靶向siRNA,就像这里所做的那样。用siRNA转染的时间点在分离后约4小时,这是MuSC周围的基底层已经可以渗透siRNA的时间点。如果需要研究特定siRNA在72或96小时后对MuSC的影响,建议在24小时或48小时后进行第二次siRNA转染,以保持高敲低效率。
与使用常规细胞培养方法研究MuSC相比,肌纤维培养测定显示出不同的优势。MuSC在整个分离过程中保持附着在肌峰纤维上,从而保留了MuSC与其龛位19,23,24,25的关键相互作用。MuSC与肌纤维的保留相互作用是研究对MuSC功能的利基依赖性效应的先决条件,这在常规的2D肌母细胞培养物中无法概括。例如,在衰老过程中,MuSC显示出受损的肌原能力,导致损伤后肌肉组织的再生效率降低20,26。这种损伤至少部分归因于MuSC生态位的变化,特别是ECM组成27,28的变化。肌纤维培养方案允许研究和干扰这些异常的生态位变化。
与这里描述的方法相反,通过免疫标记和分选技术(如FACS(荧光激活细胞分选)或MACS(磁性细胞分选)纯化MuSC涉及从其生态位中去除MuSC。有趣的是,来自衰老肌肉的分离MuSC的2D培养物会失去其外在线索,并且行为类似于从年轻肌肉中分离的MuSC,因此无法适当地概括体内情况29。此外,肌肉组织的完全解离和用表面标记物标记MuSC导致转录组学变化和细胞活化30,31,32。肌纤维培养系统的另一个优点是可以在不同水平上干扰MuSC功能。通过siRNA介导的基因敲低,可以有效地实现培养的肌纤维上MuSCs的操作,如本文所述。同样,施用化合物或递送重组蛋白非常有效地干扰干细胞通路20、28。此外,逆转录或慢病毒表达载体允许引入外源性基因,即构成活性突变体33。此外,外源因素对粘液表面活性的影响可以在这里描述的系统中探索,例如,培养条件可以用来自不同生理或病理来源的上清液补充,以模拟不同的状态,如癌症恶病质34,35。
这里描述的方法的一个局限性是,单个肌纤维培养系统不能完全概括所有全身因子或其他细胞类型对MuSC的影响。此外,肌纤维在培养物中保持活力的时间有限,因此对MuSC相关过程的研究侧重于早期事件,如激活和肌原承诺。此外,研究MuSC与其他生态位细胞(如免疫细胞或纤维脂肪生成祖细胞)的相互作用是不可能的。为了研究对MuSC功能的全身影响,可以进行肌肉损伤实验,然后分析体内肌肉再生或进行移植实验36,37。
综上所述,肌纤维分离和培养方案为成年MuSC的遗传或机制研究提供了很好的机会,而不需要转基因小鼠模型,并且可以潜在地减少动物实验。
披露声明
作者声明没有竞争的经济利益。
致谢
我们感谢Christine Poser和Christina Picker对手稿的出色技术援助和批判性阅读。这项工作得到了Deutsche Forschungsgemeinschaft对JvM(MA-3975/ 2-1),卡尔蔡司基金会和Deutsche Krebshilfe(DKH-JvM-861005)的资助。
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 goat anti-rabbit IgG 2b | ThermoScientific | A-21141 | use 1:1000 for IF |
| Alexa Fluor 546 goat anti-mouse IgG1 | ThermoScientific | A-21123 | use 1:1000 for IF |
| chicken embryo extract | Seralab | CE-650-J | chicken embryo extract containing growth factors etc. |
| collagenase type 1 | Sigma | C0130 | |
| DMEM (Dulbecco’s modified Eagle’s medium with 4.5 g/l glucose and sodium pyruvate) | GibCo | 41966029 | cell culture medium |
| fetal bovine serum | Gibco | 10270-106 | fetal bovine serum |
| horse serum | Gibco | 26050-088 | |
| Lipofectamine RNAiMax | ThermoScientific | 13778150 | transfection reagent |
| MyoD antibody clone G-1 | Santa Cruz | sc-377460 | dilute 1:200 for IF |
| Pax7 antibody | DSHB | PAX7 | use undiluted |
| siGLO Red Transfection Indicator | horizon discovery | D-001630-02-05 | non targeting siRNA |
参考文献
- Henze, H., Jung, M. J., Ahrens, H. E., Steiner, S., von Maltzahn, J. Skeletal muscle aging - Stem cells in the spotlight. Mechanisms of Ageing and Development. 189, 111283 (2020).
- Chang, N. C., Rudnicki, M. A. Satellite cells: the architects of skeletal muscle. Current Topics in Developmental Biology. 107, 161-181 (2014).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysics and Biochemical Cytolology. 9, 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. 76 (13), 2559-2570 (2019).
- Motohashi, N., Asakura, A. Muscle satellite cell heterogeneity and self-renewal. Frontiers in Cell and Developmental Biology. 2, 1 (2014).
- Huttner, S. S., et al. Isolation and culture of individual myofibers and their adjacent muscle stem cells from aged and adult skeletal muscle. Methods in Molecular Biology. 2045, 25-36 (2019).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- Mourikis, P., et al. A critical requirement for notch signaling in maintenance of the quiescent skeletal muscle stem cell state. Stem Cells. 30 (2), 243-252 (2012).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. Journal of Cell Biology. 190 (3), 427-441 (2010).
- Kuang, S., Kuroda, K., Le Grand, F., Rudnicki, M. A. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell. 129 (5), 999-1010 (2007).
- Troy, A., et al. Coordination of satellite cell activation and self-renewal by Par-complex-dependent asymmetric activation of p38alpha/beta MAPK. Cell Stem Cell. 11 (4), 541-553 (2012).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490 (7420), 355-360 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in skeletal muscle of aged mice. Nature Medicine. 20 (3), 265-271 (2014).
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127, 4543-4548 (2014).
- Bentzinger, C. F., Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Cellular dynamics in the muscle satellite cell niche. EMBO Reports. 14 (12), 1062-1072 (2013).
- Eliazer, S., et al. Wnt4 from the Niche Controls the Mechano-Properties and Quiescent State of Muscle Stem Cells. Cell Stem Cell. 25 (5), 654-665 (2019).
- Goel, A. J., Rieder, M. K., Arnold, H. H., Radice, G. L., Krauss, R. S. Niche cadherins control the quiescence-to-activation transition in muscle stem cells. Cell Reports. 21 (8), 2236-2250 (2017).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular wisp1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. Aging Cell. 12 (3), 333-344 (2013).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- van Velthoven, C. T. J., Rando, T. A. Stem cell quiescence: Dynamism, restraint, and cellular idling. Cell Stem Cell. 24 (2), 213-225 (2019).
- Judson, R. N., et al. The Hippo pathway member Yap plays a key role in influencing fate decisions in muscle satellite cells. Journal of Cell Science. 125, 6009-6019 (2012).
- He, W. A., et al. NF-kappaB-mediated Pax7 dysregulation in the muscle microenvironment promotes cancer cachexia. Journal of Clinical Investigation. 123 (11), 4821-4835 (2013).
- Schmidt, M., Poser, C., von Maltzahn, J. Wnt7a counteracts cancer cachexia. Molecular Therapy Oncolytics. 16, 134-146 (2020).
- Feige, P., Rudnicki, M. A. Isolation of satellite cells and transplantation into mice for lineage tracing in muscle. Nature Protocols. 15 (3), 1082-1097 (2020).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin induced injury and skeletal muscle regeneration. Methods in Molecular Biology. 1460, 61-71 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。