Method Article
一种人外周血淋巴细胞γ-H2AX病灶测定的自动显微镜评分方法
摘要
该协议介绍了外周血淋巴细胞上γ-H2AX病灶测定的载玻片制备和自动评分。为了说明测定的方法和灵敏度,在 体外照射分离的淋巴细胞。这种自动化的DNA DSB检测方法对于快速和高通量的生物剂量测定应用非常有用。
摘要
电离辐射是DNA损伤的有效诱导剂,也是一种有据可查的致癌物质。生物剂量测定法包括检测暴露于电离辐射引起的生物效应,以进行个体剂量评估。这在辐射紧急情况的框架内是相关的,因为在辐射紧急情况下,对暴露受害者的健康评估和临床治疗规划至关重要。由于DNA双链断裂(DSB)被认为是辐射诱导的DNA损伤的最致命形式,因此该协议提出了一种检测血液样本中DNA DSB的方法。该方法基于检测荧光标记的磷酸化DNA修复蛋白,即γ-H2AX。使用自动显微镜平台对每个细胞的γ-H2AX病灶数量进行评分,可以进行标准化分析,并显着缩短周转时间。因此,γ-H2AX测定有可能成为生物剂量测定中最快和最灵敏的测定之一。在该协议中,来自健康成年志愿者的全血样本将在 体外 进行处理和照射,以说明自动和灵敏的γ-H2AX病灶测定在生物剂量测定应用中的使用。使用带有集成荧光显微镜的自动玻片扫描系统和分析平台,可以快速,自动地对DNA DSB进行评分,并降低偏倚程度。
引言
自发现以来,电离辐射(IR)已成为当前医疗和工业实践以及农业和军事应用中不可或缺的工具。然而,IR的广泛使用也增加了专业辐射工作者和公众成员过度暴露于辐射的风险。IR是一种众所周知的物理致癌物,可以直接或间接地诱导DNA损伤,导致重大的健康风险1,2。因此,进行剂量评估很重要,因为暴露程度是辐射事故管理的重要初始步骤1。
在发生大规模核或辐射紧急情况时,根据事故的规模,需要进行的剂量评估数量可以从几人到几千人不等3。在这些情况下,当涉及公众成员时,物理剂量测定也可能含糊不清(例如,如果剂量计佩戴不当)或不可用。虽然临床症状可用于分诊,但它们不一定是辐射特异性的,并且可能导致错误诊断。因此,建议将生物剂量测定法与物理剂量测定法和临床评估结合使用。该方法允许在细胞水平上分析辐射诱导的变化,并能够明确识别需要药物治疗的暴露个体4。然后,医生可以使用这种生物剂量评估来补充物理剂量重建和其他临床诊断,以便开出适当的医疗护理5。当暴露情况不为人所知且受害者是公众时,对生物剂量测定法的需求对于伤员的分诊和医疗管理将特别高。分诊的主要目的是有效地区分"担心良好"的人,他们可能有前驱症状,但没有接受高剂量,与需要立即医疗帮助和专业护理的暴露者。可导致辐射病的辐射剂量阈值水平约为0.75 - 1.00 Gy。然后,那些接受>2 Gy暴露的人患急性辐射综合征的风险更高,应立即接受治疗6,7。对陷入此类灾害交火的受害者进行及时和准确的生物剂量估计至关重要。此外,它还可以安慰和安抚暴露程度最小的受害者8。
辐射防护机构使用各种生物剂量学标记,这些标记主要基于检测培养的人类淋巴细胞中的细胞遗传学损伤,例如双中心染色体或微核9。细胞遗传学损伤的检测也可以通过荧光原位杂交(FISH)易位测定法10进行。然而,常规细胞遗传学方法的主要缺点是在紧急情况下获得结果的周转时间长8。
DNA DSB识别过程中最早的步骤之一是组蛋白变体H2AX的磷酸化,导致γ-H2AX的形成,以及随后修复因子的募集。在过去的十年中,使用免疫荧光显微镜检测外周血淋巴细胞中辐射诱导的γ-H2AX病灶作为可靠的生物剂量学工具11,12,13,14,15受到越来越多的关注。根据辐射质量和细胞类型,在照射后0.5 - 1小时内检测到γ-H2AX病灶的最大产量16,17。预计DNA DSB和γ-H2AX病灶的数量之间以及病灶消失与DSB修复之间存在密切相关性。使用脉冲激光微束的激光剪刀实验表明,γ-H2AX病灶定位于DNA DSB18的位点。虽然它仍然是一个活跃的争论话题,但最早的研究之一是125,我建议每个细胞计算的崩解数(可表示辐射诱导的DNA DSB的数量)与得分为19,20的γ-H2AX病灶的数量之间存在一对一的相关性。
在过去十年中,欧盟资助了MULTIBIODOSE(多学科生物测量工具,用于管理大规模放射性伤亡)和RENEB(实现欧洲生物剂量学网络)项目,以创建一个可持续的生物和回顾性剂量学网络。21,22.该项目包括整个欧洲的各个实验室,以评估发生辐射紧急情况时的应急能力14,21,22.γ-H2AX病灶测定具有许多相当大的优点,例如快速处理时间,批处理的潜力允许高通量,以及如果在暴露后几个小时内使用,则具有高灵敏度13,23,24.低剂量范围内测定的高灵敏度导致许多研究,其中γ-H2AX病灶测定被用作医学辐射暴露效果的指标,无论是在放射治疗还是在诊断成像应用中25,26,27,28,29,30.这些特性使γ-H2AX病灶测定成为大型核事故早期分诊方法的高度竞争性替代方案,以将严重暴露的个体与低风险个体分开。一些优化实验表明,用少量血液进行γ-H2AX病灶测定是可行的,例如Moquet等人的研究,他们报告说,仅用一滴血(手指点刺)进行γ-H2AX病灶测定是可行的。31.在开发全自动高通量RABIT(快速自动生物剂量测定工具)系统时使用了类似的方法,该系统经过优化,可以测量指尖衍生血液样品的γ-H2AX产量。32,33.总体而言,MULTIBIODOSE和RENEB互比研究的结果表明,γ-H2AX病灶测定可能是最近(长达24小时)急性辐射暴露后非常有用的分类工具。12,13,14.在低剂量范围互比研究中,可将低至10 mGy的剂量与假照射对照样品区分开来,突出了低剂量范围内测定的敏感性。34.重要的是要注意,该测定的高灵敏度对于淋巴细胞尤其如此,这使它们成为评估低剂量暴露的最合适的细胞类型之一。淋巴细胞主要是非循环细胞,代表同步群体。后者避免了与DNA复制相关的γ-H2AX的表达,这显着降低了测定在细胞周期的G2和S期检测辐射诱导的DSB的灵敏度。35.除了对低剂量淋巴细胞的敏感性外,γ-H2AX病灶测定的周转时间明显快于细胞遗传学技术,如双中心和微核测定,因为它不需要刺激淋巴细胞。因此,与细胞遗传学技术相比,可以在几个小时内获得结果。该测定的一个主要缺点是γ-H2AX病灶信号的快速消失,其通常在辐射暴露后几天内根据DNA修复动力学降低到基线水平。36.因此,该测定在生物剂量测定环境中最合适的应用是用于初始分类目的,并优先考虑对某些受害者进行更耗时的细胞遗传学生物剂量测定随访。然而,为了精确的回顾性生物剂量测定和长期效果,人们必须依靠细胞遗传学技术,如三色FISH分析来检测稳定的染色体畸变,以防暴露发生在几年前。10.
作为几项生物剂量测定计划的一部分,在γ-H2AX病灶测定旁边,已经对多种测定进行了分类评估,以在大规模放射学紧急情况下对人们进行分类;如二心化测定、细胞运动阻断微核测定、电子顺磁共振(EPR)、血清蛋白测定(SPA)、皮肤斑点测定(SSA)、光学刺激发光(OSL)以及基因表达分析37、38。 γ-H2AX病灶测定可定量用于评估DNA DSB的形成和修复39。然而,该测定是时间依赖性的,因为由于DNA DSB修复动力学,γ-H2AX病灶的水平随照射后的时间而变化40。一项比较研究表明,具有z级容量的微观评分在1 Gy照射后提供最准确的结果,而流式细胞术仅在较高剂量的IR41下提供可靠的结果。有许多关于开发用于自动评分的图像分析解决方案的报告 42,43,44,45,46。在该协议中,使用自动化的高通量荧光显微镜平台分析外周血淋巴细胞中的γ-H2AX病灶。使用自动评分系统避免了实验室间和观察者之间的评分偏差,同时它仍然允许足够的灵敏度来检测低于1 Gy47的剂量 。与用于焦点评分的免费开源软件相比,该系统的主要优点是,从扫描幻灯片到捕获和评分的完整过程是自动化的。用户可定义和可存储分类器的概念保证了可重复性,从而为结果增加了无偏的质量。因此,这项工作说明了如何使用自动显微镜扫描和评分方法获得γ-H2AX病灶结果,当放射生物学实验室接收来自潜在过度暴露个体的血液样本用于生物剂量测定目的时,可以使用该方法。
研究方案
本研究已获得西开普大学伦理委员会生物医学研究伦理委员会的批准 - 准则BM18 / 6 / 12。
1. 溶液的制备48
- 细胞固定溶液(PBS中3%PFA)
- 穿戴适当的个人防护装备(PPE)并在通风橱中工作,将20克多聚甲醛加入200毫升蒸馏H2O中,将混合物加热至60°C以帮助溶解。
- PFA溶解后,在30分钟内小心地加入40滴5 N NaOH,并冷却至室温。使用1 M HCl调节pH 7,并用蒸馏的H 2 O组成高达250mL的最终体积(等分试样可在-20°C下储存1年)。将 25 mL 来自该溶液的容量添加到 41.7 mL PBS 中,以提供 3% PFA 溶液。
- 1%牛血清白蛋白(BSA)溶液:将10克BSA加入1000毫升PBS中,混合直至溶解。储存在4°C直至使用(最多72小时)。
- 浓度为1:500的Triton-X溶液:加入1μLTriton-X至500μLPBS,储存在4°C直至使用(最长24小时)。
- 抗体解决方案
- 一抗 - 抗γ-H2AX,浓度为1:500:将1μL抗γ-H2AX加入500μL1%BSA溶液中,储存在4°C直至使用(最长24小时)。
- 二抗 - DAM-TRITC,浓度为1:1000:将1μLDAM-TRITC加入1000μL1%BSA溶液中,储存在4°C直至使用(最长24小时)。
- 完整的罗斯威尔公园纪念研究所(cRPMI)媒体
- 将过滤的胎牛血清(FBS)和青霉素 - 链霉素加入无菌瓶中的RPMI 1640培养基中,得到10%FBS和1%青霉素 - 链霉素的终浓度。
2. 样品制备
注意:对于该协议,外周全血样本通过静脉穿刺从健康的成年志愿者的锂肝素收集管中收集(经知情同意 - BM18/6/12西开普大学伦理委员会生物医学研究伦理委员会)。在开始之前,确保血液和密度培养基1.077 g / mL适应室温。
- 在准备好的生物安全柜中,用PBS以1:1的体积稀释外周全血,并将稀释后的血液轻轻地分层在等体积至密度为1.077g / mL的两体积培养基上。重要的是通过将管子倾斜45°逐渐分层到密度培养基上,确保血液和密度培养基不会混合。
- 小心地将悬浮液转移到离心机中,并以900×g旋转20分钟。此后,仅将"浑浊"层移液到新的无菌锥形管中,并用PBS填充管子,并以1000×g离心10分钟。此后,用移液管吸出上清液,小心不要干扰沉淀,将PBMC沉淀小心地重悬于1mL PBS中,并用PBS填充管中。
- 重复上述洗涤步骤两次,共洗涤三次。
- 使用血细胞计数器计算PBMCs的数量,知道来自成人供体的每毫升外周血将导致1 - 1.5 x 106 PBMC49的粗略平均值。计数后,将PBMC沉淀稀释至1mLcRPMI中的8×105 淋巴细胞浓度。然后将约2 x 106 个PBMC或2.5 mL从分离的PBMC溶液中加入无菌锥形管中进行照射。
3. 样品照射
注意:根据辐射防护指南处理辐射装置,并始终佩戴物理剂量计。确保所使用的辐照系统经过校准和设置,以达到正确的预期剂量。
- 使用 60Co 源在室温下照射 PBMC。使用 Farmer 117 腔室校准(TRS-398 协议),其中腔室校准因子从南非国家计量研究所 (NMISA)50获得。
- 对于该测定,将锥形管放置在5 mm丙烯酸板(用于光束进入积聚)和50 mm反向散射材料之间,当前 60Co源剂量率为0.57 Gy / min,在750 mm源到表面距离下为300 mm×300 mm均匀场尺寸。
- 以0.125、0.500、1.000、1.500和2.000 Gy的分级剂量照射PBMCs,并在控制室中保持假照射的对照样品,仅接受环境辐射暴露。
- 将辐照样品在37°C下在加湿的5%CO2 培养箱中孵育1小时,以达到最大数量的γ-H2AX病灶。
注:孵育时间可根据实验设计进行修改。
4. 玻片制备
注:有关幻灯片设置,请参见图 1。
- 使用涂有带正电荷表面的载玻片准备3张载玻片(技术重复),以提高每个辐照条件(或每个锥形管)的附着力。将幻灯片放入夹持器中,在其上添加过滤器卡,最后是漏斗。固定玻片夹并放入细胞离心机中。
- 将250μL细胞悬浮液加入漏斗(200,000个细胞/载玻片),并使用细胞离心机旋转30×g 5分钟。
- 细胞离心后,从夹子支架上取下载玻片,并使用疏水笔,在细胞周围画一个圆圈,以便在染色过程中将免疫荧光染色保留在结合的细胞上。
5. 固定和免疫荧光γ-H2AX染色
注意:所有溶液都小心翼翼地直接添加到以疏水圆标记的细胞区域。染色溶液分配在载玻片上方,不允许移液器尖端破坏细胞。解决方案不会添加到整个幻灯片中。
- 将载玻片固定在新鲜制备的3%PFA中20分钟。
注意:在进行免疫染色之前,载玻片可以在4°C下储存在含有0.5%PFA的PBS中最多2天。此后,在带有PBS的Coplin罐中洗涤载玻片5分钟,然后用100μL冷Triton-X溶液覆盖细胞10分钟以允许通透。 - 将Triton-X溶液倒在薄纸上,并在1%BSA溶液中洗涤载玻片三次10分钟。这样做是为了通过阻断非特异性抗体结合来防止不需要的背景。
- 在室温下用100μL的1:500稀释的初级抗γ-H2AX抗体在加湿室中孵育载玻片1小时,通过在矩形载玻片存储盒的底部添加湿纸巾即可轻松完成。
- 将抗体溶液倒在薄纸上,在Coplin罐中用1%BSA溶液洗涤三次,持续10分钟,以除去未结合的一抗并防止二抗的非特异性结合。
- 用100μL1:1000稀释的二级DAM-TRITC抗体溶液在加湿室中孵育载玻片1小时。将抗体溶液倒在薄纸上,用PBS洗涤载玻片10分钟三次。
- 最后,用柔软、无尘的薄纸将载玻片干燥在疏水圈外,加入1-2滴在水性安装介质中分辨的DAPI,并用24 x 50 mm的盖玻片轻轻盖住载玻片,确保没有滞留的气泡,并在4°C的冰箱中放置过夜。玻片在扫描前可在4°C下储存最多2周。
6. 自动扫描和评分幻灯片
注:扫描系统需要有一个荧光显微镜、一个连接到图像采集卡的高分辨率CCD(带电耦合器件)相机,用于视频图像的实时数字化,一个扫描台,用于手动移动的轨迹球,3D鼠标,快速PC和显示器,以及用于存档的硬盘驱动器(图2)。
- 分类器设置
注意:分类器是一组参数,用于定义系统如何检测单元格。它是基于预分类图像字段的训练的结果。分类器专门用于显微镜放大倍率、细胞类型和实验室。因此,分类器可能需要修改以下参数,以使其适应当前条件。建议在评估之前使用参考幻灯片测试设置。- 图像采集:使用40倍干式物镜进行成像。要在所有单元中实现可比较的图像质量,请将相机集成时间设置为自动模式。将两个颜色通道的最长积分时间设置为至少 1 秒(相机增益 4.0)。信号通道通过10个聚焦平面和14/40 μm的平面之间获取。
- 电极选择:在20.00 μm2 和76.00 μm2 范围内检测到PBMC。将最大凹深设置为 0.05,将最大纵横比设置为 1.4。将相对灰度级别阈值设置为 20%。
- 单元处理:使用直方图最大值算法处理 DAPI 复色通道以减少背景。信号通道使用TopHat滤波器(强度7,平滑因子0)进行处理,以减少背景并增强信号。
- 信号计数:使用设备的"对象计数"功能对焦点进行计数。为避免对剩余背景信号进行假阳性评估,仅对与细胞中最亮的物体相比显示至少30%强度的信号进行计数。
- 用70%乙醇轻轻清洁后,将载玻片插入/放置到自动扫描平台或载玻片台上,以除去任何灰尘。
- 幻灯片设置 - 打开幻灯片设置对话框菜单(图3)
- 选择正确的 "数据路径",这将指定从搜索生成的幻灯片文件的存储位置。
- 为幻灯片命名,必须为每张幻灯片指定一个唯一的名称。如果以枚举列表的形式输入一系列幻灯片,则可以将"?"用作幻灯片编号的通配符。
- 选择适当的分类器,如第1.1 - 1.4节(图4)中所述。
- 选择 "搜索窗口", 如果存在与细胞离心机细胞圈匹配的搜索窗口定义,则选择" 预定义 ",在"大小"列中选择相应的定义,或者如果没有可用的预定义搜索窗口定义,则选择"手动"。在这种情况下,不必设置"大小"列。
- 选择 最大细胞计数 ,然后添加需要扫描的最大细胞数。即使所选搜索窗口尚未在达到最大细胞计数后立即完全扫描,搜索也会终止。对于生物剂量测定应用,考虑到每个血液样品准备了3张载玻片,每张载玻片1000个细胞的自动评分就足够了。单击 "确定" 以确认设置。
- 玻片扫描设置
- 点按侧边栏上的" 搜索 "按钮。如果在幻灯片设置中选择了"手动搜索窗口"设置,将打开一个对话框,允许确定扫描区域(图5)。通过使用 10 倍物镜,通过左键单击鼠标来固定搜索字段的两个角,以交互方式选择幻灯片上的矩形搜索区域。这可以通过 "确定" 按钮进行确认。如果搜索窗口引用预定义的搜索窗口,则将省略此步骤。
- 系统将提示用户调整对焦开始位置。然后将自动选择一个参考对象,软件将提示用户为每张幻灯片聚焦和居中参考细胞核(使用40倍物镜),并使用OK确认设置。系统将自动按顺序移动到所有幻灯片。如有必要,请调整此步骤的实时映像设置 - 积分时间(图5)。
- 检查所有显微镜设置,并使用 OK确认系统提示。系统将启动自动对焦和扫描过程。扫描完成后,数据将保存到计算机进行分析。扫描完成后,扫描系统会自动关闭。
注:确保显微镜管的拉杆处于将所有光线转移到相机的位置。 - 搜索结束,如果已扫描整个搜索、已达到最大单元格计数或搜索已取消,则搜索将终止。
- 玻片分析
注:完成的扫描如图 6所示。- 扫描完成后,单击侧边栏上的" 图库 "按钮。查看库,其中包含检测到的细胞的小图像。在此窗口中(图7),指定是否通过从下拉菜单中选择的标准存储在库中的单元格。单元格通常按检测到它们的顺序显示。
- 单击 质量直方图/特征值图 (图8),给出检测到的细胞的质量测量分布,以及平均值和焦点评分的标准偏差。
结果
对于该协议,从四名健康成年志愿者的全血中分离出人外周血单核细胞(PMBCs),并暴露于0.125,0.250,0.500,1.000和2.000 Gy的辐射剂量。此后,将样品在37°C下在加湿的5%CO2 培养箱中孵育1小时。固定和免疫荧光染色后,自动扫描载玻片并评分。 图 6、7和图 8 表示软件向用户输出的内容。扫描完成后,将出现一个分析窗口,提供评分焦点的概述。该库使用可以删除异常值的交互式菜单给出了所有评分的焦点,最后给出了带有详细数据摘要的直方图。
暴露于γ射线后γ-H2AX焦点产量如图 9所示。随着剂量的增加,γ-H2AX病灶的数量逐渐增加。该图不仅说明了测定的剂量依赖性和敏感性,而且当从暴露于未知剂量的个体接收样品时,拟合也可用于进行剂量估计。重要的是要注意,一个人不会有假照射控制或这个人的背景病灶水平。因此, 图9 包括假辐照对照样品的0 Gy值,本研究中四个成年供体为0.57±0.23 Gy。

图1:用于细胞离心的载玻片的制备。将幻灯片放入夹持器中,在其上添加过滤器卡,最后是漏斗。固定玻片夹并放入细胞离心机中。细胞离心后,从夹子支架上取下载玻片,并使用疏水笔在细胞周围画一个圆圈。请点击此处查看此图的放大版本。

图 2:此协议中使用的自动扫描平台,包含连接到荧光显微镜的自动扫描仪。请单击此处查看此图的大图。
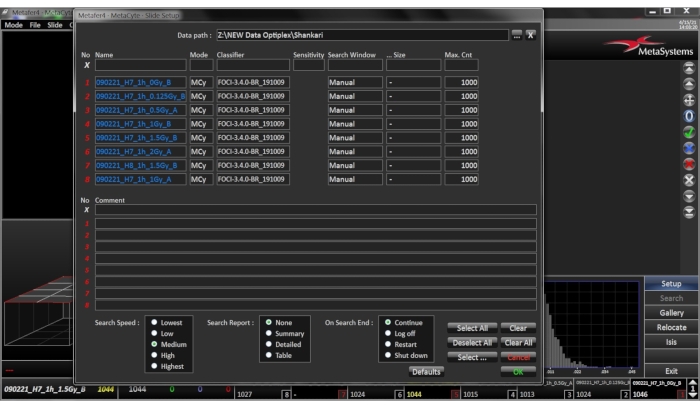
图3:幻灯片设置菜单。 通过点按边栏中的"设置"按钮打开对话框。选择或输入结果文件的目标目录 请单击此处查看此图的大图。
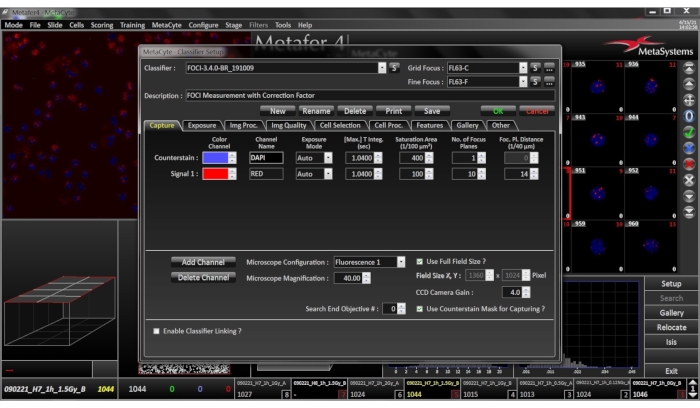
图4:分类器设置菜单。 确保所选的分类器设置与样品的当前细胞类型、制备条件和染色模式相匹配。 请点击此处查看此图的放大版本。

图5:手动搜索窗口的设置菜单。 在幻灯片设置中选择了窗口;将打开一个对话框,以便确定扫描区域。通过使用 10 倍物镜,通过左键单击鼠标来固定搜索字段的两个角,以交互方式选择幻灯片上的矩形搜索区域。 请点击此处查看此图的放大版本。
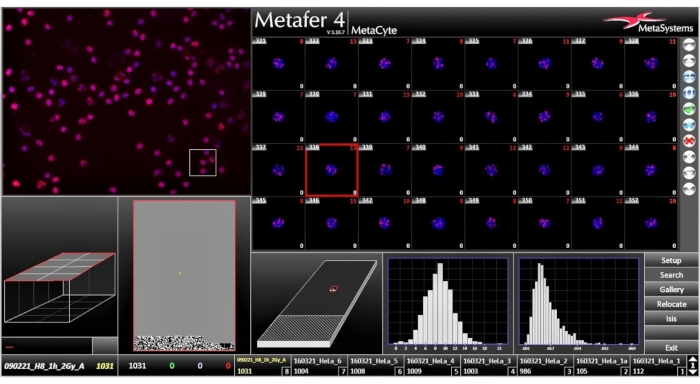
图 6:分析窗口,扫描完成后,分析窗口将显示扫描结果。请单击此处查看此图的大图。
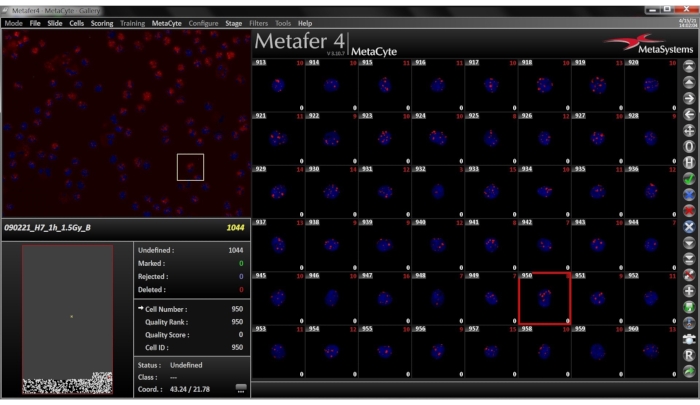
图 7:所选幻灯片的图库视图。 "图库"选项卡位于侧边栏上。图像库由检测到的细胞的小图像组成,显示为组合的DAPI-TRITC图像。在每个图像的左下角和右下角显示直接病灶计数和校正后的病灶计数。 请点击此处查看此图的放大版本。
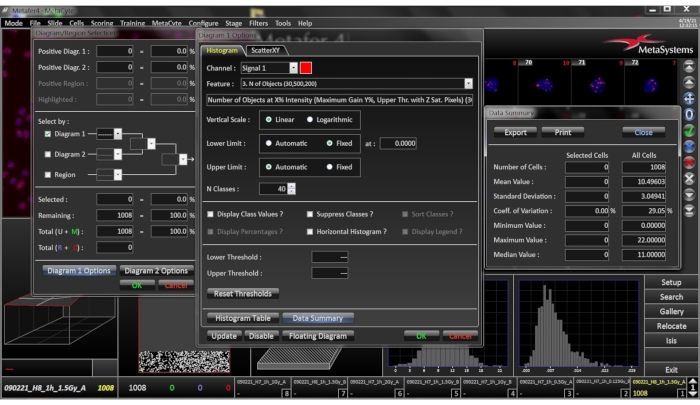
图8:所选幻灯片的直方图图像。 此窗口通过右键单击直方图打开。通过单击直方图,直方图选项卡工作表提供数据摘要,其中列出了所分析单元格的平均值,标准偏差,变异系数,最小值,最大值和中位数。 请点击此处查看此图的放大版本。
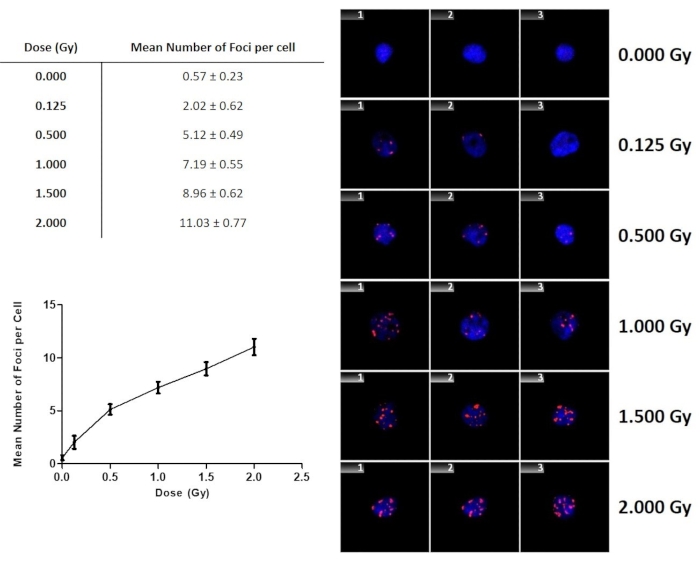
图9:暴露于 60Co γ射线的淋巴细胞的γ-H2AX病灶的数量与剂量的函数关系。 误差线是代表供体之间个体间差异的标准偏差。数据表示四名健康志愿者的平均γ-H2AX病灶±标准偏差。 请点击此处查看此图的放大版本。
讨论
该协议描述了基于γ-H2AX病灶测定的基于自动荧光显微镜评分的逐步程序。它说明了病灶测定作为分析外周血淋巴细胞中辐射诱导的DNA DSB数量的时间有效方法的实用性,以便在个体可能暴露于未知水平的IR的辐射事故情况下进行生物剂量评估。
在这种特定的方案中,PBMC 在体外 照射以模拟 体内 辐射暴露。一旦照射和一小时的孵育时间完成,使用细胞离心机制作载玻片以在载玻片上产生细胞的浓缩点。使用细胞离心机对于实现自动评分的标准化条件至关重要。完成后,疏水笔用于在细胞周围形成一个圆圈,通过允许用户定位染色试剂来减少试剂的浪费。这种类型的笔可用于各种免疫染色技术,例如石蜡切片,冷冻切片和细胞学制剂。此外,选择与酶和荧光检测系统兼容的疏水笔也很重要。在载玻片制备之后,发生了固定和免疫荧光γ-H2AX染色。在该协议中,在PBS溶液中使用3%PFA固定细胞20分钟。为了使免疫染色成功,必须保留细胞的形态,并且所使用的检测试剂可以访问抗原位点。PFA是一种相对温和的固定剂,在保持蛋白质结构的同时稳定细胞51。具有较高PFA浓度和更长固定时间的优化实验对载玻片质量产生了负面影响,但是在0.5%PFA中进一步储存(过夜)长达24小时产生了良好的结果。
该方案中使用的原发性2F3单克隆抗体在DNA DSB诱导后在丝氨酸139磷酸化时对组蛋白变体H2AX发生反应。抗体能够与磷酸化残基结合,与其他磷酸化组蛋白52无交叉反应。由于这是一种一级小鼠单克隆抗体,因此在替代宿主(即驴抗小鼠(DAM)-TRITC)中培养时,针对一抗的宿主物种选择二抗。虽然免疫荧光染色基于特异性抗体-表位结合,但几种分子间力也可能导致非特异性背景染色。为了减少非特异性结合,重要的是在免疫荧光染色方案53中使用封闭试剂;我们使用了 BSA 解决方案。此外,应为该封闭步骤分配足够的时间,方法是在一抗和二抗染色之前将载玻片留在溶液中至少20分钟。此外,BSA溶液还应用作一抗和二抗的稀释剂。根据用于染色的抗γ-H2AX和二抗,应考虑测试不同的抗体稀释度,以确定最佳浓度。为了获得更精确的评分,可以通过添加额外的DNA DSB修复蛋白抗体进行双重染色。
这种类型的分析的一个主要缺点是需要在暴露后尽快获取血液样本,因为已知最大病灶数量在照射后48小时内会降低到正常水平。因此,当已知辐射事故和随后的血液采样时间时,使用在体外照射后的不同时间点(例如,4,8,12和24小时)建立的不同校准曲线可能是有用的。然而,正如手稿的引言部分已经提到的,γ-H2AX病灶测定的优势在于初始,快速的分类目的,它应该用于优先考虑更耗时的细胞遗传学生物剂量测定。并行使用多个生物剂量学生物标志物的组合方案将产生最可靠的剂量估计,并且世界各地的各种生物剂量学实验室已联手建立全国性网络,这些网络可以激活并用于允许具有不同专业知识的实验室进行多个并行的生物剂量学评估37,54,55.此外,正在开发超快速分析,例如事故现场56上或附近的移动实验室。新的,有前途的生物剂量测定方法正在不断发展,这有望在未来57年带来更快,更可靠的通量。
对于自动图像分析系统,将载玻片插入或放置在自动扫描平台或载玻片台上。此后,命名幻灯片详细信息并将其保存在所连接计算机上的相应文件夹中。对于该实验,自动核和病灶检测基于各自的分类器设置。在创建分类器时,请确保所选分类器设置与样品的当前细胞类型、制备条件和免疫荧光染色相匹配。在分类器中设置与一抗和二抗激发光谱匹配的适当荧光通道。如果需要,分类器允许设置额外的评分参数(例如,细胞核大小,荧光强度,如第6.1节所述)。如果在实验中结合两个或多个DNA修复蛋白(例如,γ-H2AX和53BP1),则系统还能够检测信号的共定位。首先,系统获取DAPI图像,应用图像处理,并使用分类器中设置的形态学标准识别原子核。TRITC信号使用10个z-stack获取,焦平面之间的步长为0.35 mm47。分类器使用直接病灶计数,其中对细胞核内不同TRITC信号的数量进行评分。在这里,重要的是要考虑到随着辐射剂量的增加,焦点信号往往会合并成更大的物体,如果直接计算物体,则会导致实际病灶数的低估。此处描述的分析不需要它,但可以使用校正病灶计数实现额外的步骤来解决此问题。后者允许系统获得检测到的信号的大小并相应地对其进行称重。使用这两种计数方法可以更真实地估计较高剂量下的实际病灶数量。
要开始自动扫描,通过使用显微镜的10倍物镜确定扫描区域,通过左键单击鼠标(图 5),然后聚焦起始位置。自动选择参考对象,软件提示用户为每张载玻片聚焦和居中参考原子核(使用40倍物镜)。搜索开始后,系统将移动到第一张选定幻灯片的搜索窗口的中心,并请求将参考对象居中和聚焦。此对象稍后将用作位置参考,以更正单元格位置的任何偏移。参考场的第二个目的是自动调节光线,在透射光模式下,光线被调节,直到达到最佳光照水平。在荧光模式下,光照水平是固定的,但CCD相机的积分时间可以增加,直到测量到所需的信号。为了能够进行正确的光线调整,参考应包含具有典型染色的物体。重要的是不要使用具有非常高染色强度的伪影的场。光线调整后,系统在最靠近参考场的网格位置启动网格自动对焦。它继续将字段聚焦在常规网格上,向搜索窗口的正面和背面蜿蜒移动。网格自动对焦完成后开始扫描。舞台在蜿蜒的图案字段中移动,以捕获数据。当检测到细胞时,其位置和图库图像将被存储并显示在屏幕上,并且细胞计数被更新。如果发生显微镜、载物台或进纸器错误,搜索将自动取消。操作员手动干预的唯一步骤是在玻片扫描设置期间。这也是进行快速质量控制检查(气泡,低细胞数,荧光信号染色伪影褪色)以及可以决定中止扫描质量较差的载玻片的地方。如果已扫描整张玻片、已达到最大细胞计数或已取消搜索,则搜索将终止。扫描完成后,将显示数据,如 图 6.要查看扫描的单元格,将打开"图库"窗口,并且可以查看每个单元格 (图 7).这是操作员可以通过检查图库图像的焦点和已评分的单元格总数来执行质量控制的另一个点。如果太多的细胞失焦或系统检测到的细胞太少而无法进行真实的剂量估计(例如,100个细胞而不是预期的1000个细胞),则应决定从最终评估中排除载玻片和自动评分。所有数据都汇总在直方图(图 8),以及有关每个单元格的分布、均值和焦点评分标准差的信息。直方图还可用于根据自动发现选择和显示原子核的亚群以供审查。在手动记录每个像元的分布、平均值和每个像元的病灶数的标准差后,对结果执行统计分析。该图可用作校准曲线,用于对生物剂量测定样品进行剂量估计。这可以使用趋势线的方程来完成,以近似估计所接受的剂量。此外 图 9 说明自动扫描足够灵敏,可以检测低剂量下诱发的病灶。此外,结果显示每个细胞的病灶数量随剂量的明显线性增加。需要注意的是,结果仅代表所使用的分类器,对于不同的分类器参数,结果会有所不同。因此,在生物剂量测定分析的情况下,重要的是,生物剂量测定样品使用的分类器和载玻片制备方法与用于建立用于执行剂量估计的校准曲线的分类器和载玻片制备相同。虽然它超出了本研究的范围,但重要的是要注意,γ-H2AX病灶测定也可用于确定部分身体照射。大多数意外辐射暴露是不均匀或部分的身体暴露,其中只有身体的局部区域受到高剂量暴露。几项研究表明,可以使用γ-H2AX病灶测定法来估计被照射的身体比例和对照射分数的剂量42.当发生全身照射时,所有细胞中都会随机诱导DNA DSB,并且可以期望找到泊松分布。与细胞遗传学方法类似,其中染色体畸变的诱导往往过度分散在外周血淋巴细胞中,其中具有多种畸变的细胞和具有正常变相的细胞,使用受污染的泊松方法对分散的病灶分布进行γ-H2AX病灶的分散分析建议58.后者也在 in vivo 小猪和恒河猴的实验59.
披露声明
C. Schunck 是 MetaSystems Hard & Software GmbH( Altlussheim, Germany) 的员工。
致谢
作者要感谢研究参与者的献血,以及护士V. Prince的血液样本收集。特此感谢南非国家研究基金会(NRF)对这项研究的财政援助。所表达的意见和得出的结论是作者的观点和结论,不一定归因于NRF。这项工作得到了国际原子能机构(原子能机构)的财政支持,通过一个技术合作项目(编号:URU6042)来支持W. Martínez-López,以及协调研究项目E35010(合同编号:22248)。
材料
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin - BSA | Merck | A3059 | |
| Coplin Jar | Sigma | S6016 | |
| Cover Slips (Size 24 x 50 mm) | Lasec | Glass2C29M2450Rec | |
| Cryogenic Vials (1.2 mL) | WhiteSci | 607101 | |
| Cytospin | Healthcare Technologies | JC370-12-L | |
| Cytospin Clips | Healthcare Technologies | JC302 | |
| Cytospin filter cards | Healthcare Technologies | JC307 | |
| Cytospin Funnels | Healthcare Technologies | JC372 | |
| DAM-TRITC | Invitrogen | A16022 | |
| DAPI-Fluroshield | Sigma/Merck | F6057 | |
| Ethanol | Kimix | ETD901 | |
| Filter tips | WhiteSci | 200ul (312012) and 1000ul (313012) | |
| Hydrochloric acid- HCl | Merck | ||
| Histopaque | Sigma/Merck | 10771 | |
| lithium–heparin collection tubes | The Scientific Group | 367526 | |
| MetaSystems - Metafer | Metasystems | Azio Imager Z2: 195-041848 | |
| NaOH | Merck | 221465 | |
| NovoPen | Leica Biosystems | NCL-PEN | |
| Paraformaldehyde | Sigma/Merck | 158127 | |
| Phosphate-buffered saline Tablets | Separations | SH30028,02 | |
| Pipettes | WhiteSci | P11037 and P1033 | X-tra Clipped Corner Slides are clipped at 45° angles to help reduce glass breakage. |
| Purified anti-H2A.X Phospho (Ser139) Antibody | Biolegend | 613402 / 100 μg | |
| RPMI medium | WhiteSci | BE12-702F | |
| Triton X-100 (Octoxinol 9) | Sigma/Merck | T-9284 | |
| Tubes (15ml) | WhiteSci | 601002 | |
| X-Tra adhesive slides – corner clipped | SMM Technologies | 3800200E |
参考文献
- Barnes, J. L., et al. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Little, J. B. Radiation carcinogenesis. Carcinogenesis. 21 (3), 397-404 (2000).
- Barquinero, J. F., et al. Lessons from past radiation accidents: Critical review of methods addressed to individual dose assessment of potentially exposed people and integration with medical assessment. Environment International. 146, 106175(2021).
- International Atomic Energy Agency. Radiotherapy in Cancer Care: Facing The Global Challenge. International Atomic Energy Agency. , IAEA. Vienna. (2017).
- Achel, D. G., et al. Towards establishing capacity for biological dosimetry at Ghana Atomic Energy commission. Genome Integrity. 7 (1), 1-5 (2016).
- Sullivan, J. M., et al. Assessment of biodosimetry methods for a mass-casualty radiological incident: Medical response and management considerations. Health Physics. 105 (6), 540-554 (2013).
- Rea, M. E., et al. Proposed triage categories for large-scale radiation incidents using high-accuracy biodosimetry methods. Health Physics. 98 (2), 136-144 (2010).
- Swartz, H. M., et al. A critical assessment of biodosimetry methods for large-scale incidents. Health Physics. 98 (2), 95-108 (2010).
- International Atomic Energy Agency. Cytogenetic Dosimetry: Applications in Preparedness for and Response to Radiation Emergencies. International Atomic Energy Agency. , IAEA. Vienna. (2011).
- Grégoire, E., et al. Twenty years of FISH-based translocation analysis for retrospective ionizing radiation biodosimetry. International Journal of Radiation Biology. 94 (3), 248-258 (2018).
- Moroni, M., et al. Evaluation of the gamma-H2AX assay for radiation biodosimetry in a swine model. International Journal of Molecular Sciences. 14 (7), 14119-14135 (2013).
- Rothkamm, K., et al. Laboratory Intercomparison on the γ-H2AX Foci Assay. Radiation Research. 180 (2), 149(2013).
- Barnard, S., et al. The first gamma-H2AX biodosimetry intercomparison exercise of the developing european biodosimetry network RENEB. Radiation Protection Dosimetry. 164 (3), 265-270 (2015).
- Moquet, J., et al. The second gamma-H2AX assay inter-comparison exercise carried out in the framework of the European biodosimetry network (RENEB). International Journal of Radiation Biology. 93 (1), 58-64 (2017).
- Vinnikov, V., et al. Clinical Applications of Biomarkers of Radiation Exposure: Limitations and Possible Solutions Through Coordinated Research. Radiation Protection Dosimetry. 186 (1), 3-8 (2019).
- Mariotti, L. G., et al. Use of the γ-H2AX assay to investigate DNA repair dynamics following multiple radiation exposures. PLoS ONE. 8 (11), 1-12 (2013).
- Ivashkevich, A. N., et al. γH2AX foci as a measure of DNA damage: A computational approach to automatic analysis. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 711 (1-2), 49-60 (2011).
- Rogakou, E. P., et al. Megabase chromatin domains involved in DNA double-strand breaks in vivo. Journal of Cell Biology. 146 (5), 905-915 (1999).
- Sedelnikova, O. A., et al. Quantitative Detection of 125 IdU-Induced DNA Double-Strand Breaks with γ-H2AX Antibody. Radiation Research. 158 (4), 486-492 (2002).
- Han, J., et al. Quantitative analysis reveals asynchronous and more than DSB-associated histone H2AX phosphorylation after exposure to ionizing radiation. Radiation Research. 165 (3), 283-292 (2006).
- Jaworska, A., et al. Operational guidance for radiation emergency response organisations in Europe for using biodosimetric tools developed in EU multibiodose project. Radiation Protection Dosimetry. 164 (1-2), 165-169 (2015).
- Kulka, U., et al. Realising the european network of biodosimetry RENEB - status quo. Radiation protection dosimetry. 164 (1), 42-45 (2015).
- Sánchez-Flores, M., et al. γH2AX assay as DNA damage biomarker for human population studies: Defining experimental conditions. Toxicological Sciences. 144 (2), 406-413 (2015).
- Raavi, V., et al. Potential application of γ-H2AX as a biodosimetry tool for radiation triage. Mutation Research/Reviews in Mutation Research. 787, 108350(2020).
- Lassmann, M., et al. In vivo formation of γ-H2AX and 53BP1 DNA repair foci in blood cells after radioiodine therapy of differentiated thyroid cancer. Journal of Nuclear Medicine. 51 (8), 1318-1325 (2010).
- Vandevoorde, C., et al. γ-H2AX foci as in vivo effect biomarker in children emphasize the importance to minimize x-ray doses in paediatric CT imaging. European Radiology. 25 (3), 800-811 (2015).
- Beels, L., et al. γ-H2AX foci as a biomarker for patient X-ray exposure in pediatric cardiac catheterization: Are we underestimating radiation risks. Circulation. 120 (19), 1903-1909 (2009).
- Bogdanova, N. V., et al. Persistent DNA double-strand breaks after repeated diagnostic CT scans in breast epithelial cells and lymphocytes. Frontiers in Oncology. 11, 1-14 (2021).
- Schumann, S., et al. DNA damage in blood leukocytes of prostate cancer patients undergoing PET/CT examinations with [68Ga]Ga-psma. Cancers. 12 (2), 1-14 (2020).
- Ivashkevich, A., et al. Use of the γ-H2AX assay to monitor DNA damage and repair in translational cancer research. Cancer Letters. 327 (1-2), 123-133 (2012).
- Moquet, J., et al. Gamma-H2AX biodosimetry for use in large scale radiation incidents: Comparison of a rapid "96 well lyse/fix" protocol with a routine method. PeerJ. 2014 (1), 1-11 (2014).
- Turner, H. C., et al. Adapting the γ-H2AX Assay for Automated Processing in Human Lymphocytes. Radiation Research. 175 (3), 282-290 (2008).
- Sharma, P. M., et al. High Throughput Measurement of γ H2AX DSB Repair Kinetics in a Healthy Human Population. PLoS ONE. 10 (3), 0121083(2015).
- Vandevoorde, C., et al. EPI-CT: In vitro assessment of the applicability of the γ-H2AX-foci assay as cellular biomarker for exposure in a multicentre study of children in diagnostic radiology. International Journal of Radiation Biology. 91 (8), 653-663 (2015).
- MacPhail, S. H., et al. Cell cycle-dependent expression of phosphorylated histone H2AX: Reduced expression in unirradiated but not X-irradiated G1-phase cells. Radiation Research. 159 (6), 759-767 (2003).
- Barnard, S., et al. The shape of the radiation dose response for DNA double-strand break induction and repair. Genome Integrity. 4 (1), 1(2013).
- Kulka, U., et al. Biodosimetry and biodosimetry networks for managing radiation emergency. Radiation Protection Dosimetry. 182 (1), 128-138 (2018).
- Macaeva, E., et al. Gene expression-based biodosimetry for radiological incidents: assessment of dose and time after radiation exposure. International Journal of Radiation Biology. 95 (1), 64-75 (2018).
- Khanna, K. K., et al. DNA double-strand breaks: Signaling, repair and the cancer connection. Nature Genetics. 27 (3), 247-254 (2001).
- Rothkamm, K., et al. γ-H2AX as protein biomarker for radiation exposure. Annali dell'Istituto Superiore di Sanita. 45 (3), 265-271 (2009).
- Borràs, M., et al. Comparison of methods to quantify histone H2AX phosphorylation and its usefulness for prediction of radiosensitivity. International Journal of Radiation Biology. 91 (12), 915-924 (2015).
- Horn, S., et al. Gamma-H2AX-based dose estimation for whole and partial body radiation exposure. PLoS ONE. 6 (9), 1-8 (2011).
- Costes, S. V., et al. Imaging Features that Discriminate between Foci Induced by High- and Low-LET Radiation in Human Fibroblasts. Radiation Research. 165 (5), 505-515 (2006).
- Leatherbarrow, E. L., et al. Induction and quantification of γ-H2AX foci following low and high LET-irradiation. International Journal of Radiation Biology. 82 (2), 111-118 (2006).
- Mistrik, M., et al. Low-dose DNA damage and replication stress responses quantified by optimized automated single-cell image analysis. Cell Cycle. 8 (16), 2592-2599 (2009).
- Oeck, S., et al. The Focinator - a new open-source tool for high-throughput foci evaluation of DNA damage. Radiation Oncology. 10 (1), 1-11 (2015).
- Vandersickel, V., et al. Early increase of radiation-induced γH2AX foci in a humanku70/80 knockdown cell line characterized by an enhanced radiosensitivity. Journal of Radiation Research. 51 (6), 633-641 (2010).
- Sambrook, J., et al. Molecular cloning : a laboratory manual. , Cold Spring Harbor Laboratory. Cold Spring Harbor, N.Y. (2001).
- Rifai, A., et al. B and T lumphocytes. Recent Advances in IgA Nephropathy. (6), 193-210 (2009).
- Andreo, P., et al. Absorbed dose determination in external beam radiotherapy: An international code of practice for dosimetry based on absorbed dose to water. International Atomic Energy Agency. , Technical Report Series No. 398 (2001).
- Jamur, M. C., et al. Cell fixatives for immunostaining. Methods in Molecular Biology. 588, 55-61 (2010).
- Rogakou, E. P., et al. DNA Double-stranded Breaks Induce DNA Double-stranded Breaks Induce Histone H2AX Phosphorylation on Serine 139. Journal of Biological Chemistry. 273 (10), 1-12 (1998).
- Kyuseok, I. An introduction to Performing Immunofluorescence Staining. Methods in Molecular Biology. 1897, 299-311 (2019).
- Ainsbury, E. A., et al. Multibiodose radiation emergency triage categorization software. Health Physics. 107 (1), 83-89 (2014).
- Ainsbury, E. A., et al. Dose estimation software for radiation biodosimetry. Health Physics. 98 (2), 290-295 (2010).
- Turner, H. C., et al. The RABiT: High-throughput technology for assessing global DSB repair. Radiation and Environmental Biophysics. 53 (2), 265-272 (2014).
- Wang, Q., et al. Development of the FAST-DOSE assay system for high-throughput biodosimetry and radiation triage. Scientific Reports. 10 (1), 1-11 (2020).
- Rothkamm, K., et al. Leukocyte DNA damage after multi-detector row CT: A quantitative biomarker of low-level radiation exposure. Radiology. 242 (1), 244-251 (2007).
- Redon, C. E., et al. an analysis method for partial-body radiation exposure using γ-H2AX in nonhuman primate lymphocytes. Radiation Measurements. 46 (9), 877-881 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。