Method Article
İnsan Periferik Kan Lenfositlerinde γ-H2AX Odak Analizi için Otomatik Mikroskobik Puanlama Yöntemi
Bu Makalede
Özet
Bu protokol, periferik kan lenfositleri üzerinde γ-H2AX odak analizinin slayt hazırlanmasını ve otomatik puanlamasını sunar. Tahlil yöntemini ve hassasiyetini göstermek için, izole lenfositler in vitroışınlandı. Dna DSB algılamanın bu otomatik yöntemi, hızlı ve yüksek verimli biyolojik dozimetri uygulamaları için yararlıdır.
Özet
İyonlaştırıcı radyasyon, DNA hasarının güçlü bir indükleyicisi ve iyi belgelenmiş bir kanserojendir. Biyolojik dozimetri, bireysel bir doz değerlendirmesi yapmak için iyonlaştırıcı radyasyona maruz kalmanın neden olduğu biyolojik etkilerin tespitini içerir. Bu, maruz kalan kurbanlar için sağlık değerlendirmelerinin ve klinik tedavinin planlanması kritik öneme sahip radyasyon acil durumları çerçevesinde ilgilidir. DNA çift iplikçik kırılmaları (DSB) radyasyon kaynaklı DNA hasarının en ölümcül formu olarak kabul edildiğinden, bu protokol kan örneklerinde DNA DSB'yi tespit etmek için bir yöntem sunar. Metodoloji, fosforillenmiş DNA onarım proteini yani γ-H2AX olarak etiketlenmiş bir floresan tespitine dayanmaktadır. Hücre başına γ-H2AX odak sayısını puanlamak için otomatik bir mikroskopi platformunun kullanılması, dönüş süresinde önemli bir azalma ile standartlaştırılmış bir analiz sağlar. Bu nedenle, γ-H2AX tahlil, biyolojik dozimetri için en hızlı ve hassas tahlillerden biri olma potansiyeline sahiptir. Bu protokolde, biyodozimetri uygulamaları için otomatik ve hassas γ-H2AX odak tahlilinin kullanımını göstermek amacıyla sağlıklı yetişkin gönüllülerden alınan tam kan örnekleri işlenecek ve tüp bebek olarak ışınlanacaktır. Dna DSB'nin daha az önyargı derecesiyle hızlı ve otomatik puanlamasını sağlayan entegre floresan mikroskobuna sahip otomatik bir slayt tarama sistemi ve analiz platformu kullanılır.
Giriş
Keşfinden bu yana, iyonlaştırıcı radyasyon (IR), mevcut tıbbi ve endüstriyel uygulamaların yanı sıra tarımsal ve askeri uygulamalarda vazgeçilmez bir araç haline gelmiştir. Bununla birlikte, IR'nin geniş kullanımı, hem profesyonel radyasyon çalışanları hem de halk üyeleri için radyasyonun aşırı maruzlanma riskini de artırmaktadır. IR, DNA hasarına doğrudan veya dolaylı bir şekilde neden olabilecek ve önemli sağlık risklerine yol açabilen iyi bilinen bir fiziksel kanserojendir 1,2. Bu nedenle, bir doz değerlendirmesi yapmak önemlidir, çünkü maruz kalma derecesi radyasyon kazasının yönetiminde önemli bir ilk adım oluşturur 1.
Büyük ölçekli nükleer veya radyolojik acil durumlarda, yapılması gereken doz değerlendirmelerinin sayısı, kazanın boyutuna bağlı olarak birkaç ila binlerce kişi arasında değişebilir3. Bu senaryolarda, fiziksel dozimetri de belirsiz olabilir (örneğin, dozimetre düzgün giyilmemişse) veya kamu üyeleri söz konusu olduğunda kullanılamaz. Klinik semptomlar triyaj için kullanılabilirken, mutlaka radyasyona özgü değildir ve yanlış tanı ile sonuçlanabilir. Bu nedenle, fiziksel dozimetri ve klinik değerlendirmelerin yanı sıra biyolojik dozimetrinin kullanılması tavsiye edilir. Bu yöntem, radyasyon kaynaklı değişikliklerin hücresel düzeyde analizini sağlar ve tıbbi tedavi gerektiren maruz kalan bireylerin kesin olarak tanımlanmasını sağlar4. Doktor daha sonra uygun tıbbi bakımı reçete etmek için fiziksel doz rekonstrüksiyonlarını ve diğer klinik teşhisleri tamamlamak için bu biyolojik doz değerlendirmesini kullanabilir5. Maruz kalma senaryosu iyi bilinmediğinde ve kurbanlar halkın bir üyesi olduğunda, biyolojik dozimetri ihtiyacı özellikle kayıpların triyajı ve tıbbi yönetimi için yüksek olacaktır. Triyajın temel amacı, prodromal semptomlara sahip olabilecek ancak yüksek doz almayan "endişeli" kişileri, acil tıbbi yardıma ve özel bakıma ihtiyaç duyan maruz kalan kişilerden etkili bir şekilde ayırt etmektir. Radyasyon hastalığına neden olabilecek radyasyon dozunun eşik seviyesi yaklaşık 0.75 - 1.00 Gy'dir. Daha sonra, > 2 Gy maruziyet alan bireyler akut radyasyon sendromu için daha yüksek risk altındadır ve hızlı tıbbi tedavi almalıdır6,7. Bu tür felaketlerin çapraz ateşinde yakalanan kurbanlar için zamanında ve doğru biyolojik doz tahminleri kritik öneme sahiptir. Ayrıca, minimal maruz kalan kurbanları rahatlatabilir ve güven verebilir8.
Radyasyondan korunma yetkilileri, kültürlü insan lenfositlerinde disantrik kromozomlar veya mikronüklei gibi sitogenetik hasarın tespitine dayanan çeşitli biyodozimetri belirteçlerikullanırlar 9. Sitogenetik hasarın tespiti, floresan in situ hibridizasyon (FISH) translokasyon tahlil10ile de yapılabilir. Bununla birlikte, geleneksel sitogenetik yöntemlerin en büyük dezavantajı, acil bir durumda sonuçları elde etmek için uzun geri dönüş süresidir8.
DNA DSB tanıma sürecindeki en erken adımlardan biri, histone varyantı H2AX'ın fosforilasyonudur ve γ-H2AX oluşumuna ve daha sonra onarım faktörlerinin işe alınmasına yol açmaktadır. Son on yılda, immünofonoresans mikroskopisi kullanılarak periferik kan lenfositlerinde radyasyona bağlı γ-H2AX odaklarının tespiti güvenilir bir biyolojik dozimetri aracı11 , 12,13,14,15olarak giderek artan bir ilgi gördü. Radyasyon kalitesine ve hücre tipine bağlı olarak, γ-H2AX odaklarının maksimum verimi ışınlama 16,17'den sonraki0,5-1saat içinde tespit edilir. DNA DSB ve γ-H2AX odaklarının sayısı ile odakların kaybolması ve DSB onarımı arasında yakın bir korelasyon olması bekmektedir. Darbeli lazer mikrobura ile lazer makas deneyleri, γ-H2AX odaklarının DNA DSB18bölgelerine lokalize olduğunu göstermiştir. Aktif bir tartışma konusu olmaya devam ederken, 125ile yapılan ilk çalışmalardan biri, hücre başına hesaplanan parçalanma sayısı (radyasyon kaynaklı DNA DSB sayısı için temsil edilebilir) ile19,20puanlanan γ-H2AX odaklarının sayısı arasında bire bir korelasyon önerdim.
Son on yılda, Avrupa Birliği biyolojik ve geriye dönük dozimetride sürdürülebilir bir ağ oluşturmak için MULTIBIODOSE (Yüksek ölçekli radyolojik kayıpları yönetmek için çok disiplinli biyodozimetri araçları) ve RENEB (Avrupa Biyodozimetri Ağının Gerçekleştirilmesi) projelerini finanse etti.21,22. Bu proje, radyolojik bir acil durum durumunda acil müdahale yeteneklerini değerlendirmek için Avrupa çapında çeşitli laboratuvarları içeriyordu.14,21,22. γ-H2AX odak analizi, hızlı işlem süresi, yüksek verim sağlayan toplu işleme potansiyeli ve pozlamadan sonraki birkaç saat içinde kullanıldığında yüksek hassasiyeti gibi bir dizi önemli avantaja sahiptir.13,23,24. Testin düşük doz aralığındaki yüksek duyarlılığı, γ-H2AX odak testinin hem radyoterapide hem de tanısal görüntüleme uygulamalarında tıbbi radyasyona maruz kalmanın etkisinin bir göstergesi olarak kullanıldığı bir dizi çalışmayla sonuçlandı.25,26,27,28,29,30. Bu özellikler, γ-H2AX odak tahlilini, kritik derecede maruz kalanları düşük riskli bireylerden ayırmak için büyük nükleer kazalarda erken triyaj için diğer yöntemlere son derece rekabetçi bir alternatif haline getirmektedir. Birkaç optimizasyon deneyi, γ-H2AX odak tahlilinin küçük hacimlerde kanla gerçekleştirilebilir olduğunu göstermiş, örneğin γ moquet ve ark.31. Benzer bir yaklaşım, parmak çubuğundan elde edilen kan örneklerinden elde edilen γ-H2AX verimini ölçmek için optimize edilmiş tam otomatik yüksek verimli RABIT (Hızlı Otomatik Biyodozimetri Aracı) sisteminin geliştirilmesinde de kullanılmıştır.32,33. Genel olarak, MULTIBIODOSE ve RENEB karşılaştırma çalışmalarının sonuçları, γ-H2AX odak tahlilinin yakın zamanda (24 saate kadar) akut radyasyona maruz kaldıkça çok yararlı bir triyaj aracı olabileceğini göstermektedir.12,13,14. Düşük doz aralığı karşılaştırmalı bir çalışmada, 10 mGy kadar düşük bir doz, düşük doz aralığındaki testlerin hassasiyetini vurgulayarak, sham ışınlanmış kontrol örneklerinden ayırt edilebilir.34. Tahlilin yüksek hassasiyetinin özellikle lenfositler için geçerli olduğunu ve bu da onları düşük doz maruziyetlerin değerlendirilmesi için en uygun hücre türlerinden biri haline getirdiğini belirtmek önemlidir. Lenfositler esas olarak bisiklete binmeyen hücrelerdir ve senkron bir popülasyonu temsil eder. İkincisi, γ-H2AX'ın, hücre döngüsünün G2 ve S fazı sırasında radyasyon kaynaklı DSB'yi tespit etme hassasiyetini önemli ölçüde azaltan DNA replikasyon ile ilişkili olduğunu ifade etmekten kaçınır.35. Lenfositler için düşük dozlara duyarlılığına ek olarak, γ-H2AX odak tahlilinin geri dönüş süresi, lenfositlerin uyarılmasını gerektirmediğinden, disantrik ve mikronükleus tahlil gibi sitogenetik tekniklerden önemli ölçüde daha hızlıdır. Bu nedenle, sitogenetik teknikler için birkaç güne kıyasla birkaç saat içinde sonuç alınabilir. Testin en büyük dezavantajı, DNA onarım kinetiğine bağlı olarak radyasyona maruz kaldıktan sonraki birkaç gün içinde normalde temel seviyelere düşürülecek olan γ-H2AX odak sinyalinin hızlı bir şekilde kaybolmasıdır.36. Bu nedenle, tahlilin biyodozimetri bağlamında en uygun uygulaması ilk triyaj amaçlıdır ve belirli kurbanlar için daha fazla zaman alan sitogenetik biyolojik dozimetri takibine öncelik vermektir. Bununla birlikte, kesin retrospektif biyodozimmetri ve uzun vadeli etkiler için, maruz kalmanın birkaç yıl önce gerçekleşmesi durumunda kararlı kromozomal sapmaların tespiti için üç renkli FISH analizleri gibi sitogenetik tekniklere güvenmek gerekir.10.
Çeşitli biyodozimetri girişimlerinin bir parçası olarak, büyük ölçekli radyolojik acil durumlarda insanları triyaj etmek için γ-H2AX odaklarının tahlilinin yanında triyaj amaçlı birden fazla tahlil değerlendirilmiştir; dicentrics tahlil, sitokin blok mikronükleus tahlil, elektron paramanyetik rezonans (EPR), serum protein tahlili (SPA), cilt benekli test (SSA), optik uyarılmış lüminesans (OSL) ve gen ekspresyon analizi 37,38gibi. γ-H2AX odak testi DNA DSB oluşumunun değerlendirilmesi ve onarımı için nicel olarak kullanılabilir39. Bununla birlikte, γ-H2AX odaklarının seviyesi DNA DSB onarım kinetiği nedeniyle ışınlamadan sonraki zamana göre değiştiğinden test zamana bağlıdır40. Karşılaştırmalı bir çalışma, z-stage kapasiteli mikroskobik skorun 1 Gy ışınlamadan sonra en doğru sonuçları sunduğunu, akış sitometrisinin ise sadece daha yüksek dozlarda güvenilir sonuçlar verdiğini göstermektedir IR41. Otomatik puanlamada kullanılmak üzere görüntü analizi çözümlerinin geliştirilmesine dair birçok rapor vardır42,43,44,45,46. Bu protokolde periferik kan lenfositlerinde γ-H2AX odaklarını analiz etmek için otomatik, yüksek verimli floresan mikroskopi platformu kullanılmaktadır. Otomatik puanlama sisteminin kullanımı hem laboratuvarlar arası hem de gözlemciler arası puanlama önyargısını önlerken, yine de 1 Gy47'ninaltındaki dozları tespit etmek için yeterli hassasiyet sağlar. Bu sistemin odak puanlaması için ücretsiz açık kaynaklı yazılımlara kıyasla birincil avantajı, slaytların taranmasından yakalama ve puanlamaya kadar tüm sürecin otomatik olmasıdır. Kullanıcı tanımlanabilir ve torable sınıflandırıcılar kavramı, sonuçlara tarafsız bir kalite derecesi ekleyen tekrarlanabilirliği garanti eder. Bu nedenle, bu çalışma, biyolojik dozimetri amacıyla radyobiyoloji laboratuvarları tarafından aşırı maruz kalan bireylerden kan örnekleri alındığında kullanılabilecek otomatik bir mikroskobik tarama ve puanlama yöntemi kullanılarak γ-H2AX odak sonuçlarının nasıl elde edilebileceğini göstermektedir.
Protokol
Bu çalışma Western Cape Üniversitesi Biyomedikal Araştırma Etik Kurulu tarafından onaylanmıştır - Kod BM18/6/12.
1. Çözümlerin Hazırlanması48
- Hücre fiksasyon çözümü (PBS'de %3 PFA)
- Uygun kişisel koruyucu ekipmanı (KKD) giyin ve bir duman davlumbazında çalışarak, 200 mL damıtılmış H 2 O'ya20g paraformaldehit ekleyin.
- PFA çözüldükten sonra, 30 dakika boyunca dikkatlice 40 damla 5 N NaOH ekleyin ve oda sıcaklığına soğuması için. 1 M HCl kullanarak pH 7'ye ayarlayın ve damıtılmış H 2 O ile250mL'lik son hacme kadar yapın (aliquots 1 yıl boyunca -20 °C'de saklanabilir). %3 PFA çözümü sağlamak için bu çözümden 41,7 mL PBS'ye 25 mL ekleyin.
- %1 Sığır Serum Albümini (BSA) çözeltisi: 1000 mL PBS'ye 10 g BSA ekleyin ve çözünene kadar karıştırın. Kullanıma kadar 4 °C'de saklayın (maksimum 72 saat).
- Triton-X Çözeltisi 1:500 konsantrasyonda: 500 μL PBS'ye 1 μL Triton-X ekleyin, kullanıma kadar 4 °C'de saklayın (maksimum 24 saat).
- Antikor Çözümleri
- Birincil antikor - Anti-γ-H2AX 1:500 konsantrasyonda: %1 BSA çözeltisinin 500 μL'sine 1 μL anti-γ-H2AX ekleyin, kullanıma kadar 4 °C'de saklayın (maksimum 24 saat).
- İkincil antikor - 1:1000 konsantrasyonda DAM-TRITC: %1 BSA çözeltisinin 1000 μL'sine 1 μL DAM-TRITC ekleyin, kullanıma kadar 4 °C'de saklayın (maksimum 24 saat).
- Roswell Park Memorial Institute (cRPMI) Medyayı Tamamlayın
- Filtrelenmiş Fetal Sığır Serumu (FBS) ve Penisilin-Streptomisisini steril bir şişede RPMI 1640 ortamına ekleyerek %10 FBS ve %1 Penisilin-Streptomisiin konsantrasyonu verin.
2. Örneklerin Hazırlanması
NOT: Bu protokol için periferik tam kan örnekleri sağlıklı yetişkin gönüllülerden lityum-heparin toplama tüplerinde venipuntür ile toplanır (bilgilendirilmiş onay ile - BM18/6/12 Batı Cape Üniversitesi Etik Kurulu Biyomedikal Araştırma Etik Kurulu). Başlamadan önce, kanın ve 1.077 g/mL yoğunluk ortamının oda sıcaklığına alıştığından emin olun.
- Hazırlanan bir biyogüvenlik kabininde, periferik bütün kanı PBS ile 1:1 hacimde seyreltin ve seyreltilmiş kanı 1.077 g/mL yoğunlukta iki hacimli ortama eşit hacimde hafifçe katlayın. Tüpü 45° eğimli tutarak kanın yoğunluk ortamına kademeli olarak katlanmasını sağlamak, kan ve yoğunluk ortamının karışmamasını sağlamak önemlidir.
- Süspansiyonu dikkatlice bir santrifüje aktarın ve 20 dakika boyunca 900 x g'da döndürün. Bundan sonra, 'bulutlu' tabakayı sadece yeni bir steril konik tüpe pipetleyin ve tüpü 1000 x g'da 10 dakika boyunca PBS ve santrifüj ile doldurun. Bundan sonra, peleti rahatsız etmemek için dikkatli davranarak, süpernatantı bir pipetle epire edin, PBMC peletini 1 mL PBS'de dikkatlice yeniden oluşturun ve tüpü PBS ile doldurun.
- Toplam üç yıkamaya ulaşmak için yukarıdaki yıkama adımını iki kez daha tekrarlayın.
- Yetişkin bir donörden gelen her bir çevresel kan mL'nin kabaca ortalama 1 - 1,5 x 106 PBMC49ile sonuçlanacağının farkında olarak, hemositometre kullanan PBMC sayısını sayın. Sayma yaptıktan sonra, PBMC peletini 1 mL cRPMI'de 8 x10 5 lenfosit konsantrasyonuna seyreltin. Ardından, izole PBMC çözeltisinden ışınlamalar için steril, konik bir tüpe yaklaşık 2 x 106 PBMC veya 2,5 mL ekleyin.
3. Örnek ışınlamalar
DİkKAT: Radyasyon ünitesini Radyasyondan Korunma yönergelerine göre kullanın ve her zaman fiziksel bir dozimetre takın. Kullanılan ışınlama sisteminin kalibre edildiğine ve beklenen doğru dozlara ulaşılması için ayarlanabileceğine emin olun.
- PBMC'leri 60Co kaynağı kullanarak oda sıcaklığında ışınlayın. Güney Afrika Ulusal Metroloji Enstitüsü'nden (NMISA) elde edilen bir oda kalibrasyon faktörü olan bir Farmer 117 odası ile kalibre edin (TRS-398 protokolü)50.
- Bu test için konik tüpleri 5 mm akrilik levha (ışın girişi birikmesi için kullanılır) ile 50 mm geri teli malzemesi arasına yerleştirin ve 750 mm Kaynak-Yüzey Mesafesinde 300 mm × 300 mm homojen alan boyutu için mevcut 60Co kaynak doz oranı 0,57 Gy/dk olan geri saçılma malzemesi.
- PBMC'leri dereceli dozlarda 0.125, 0.500, 1.000, 1.500 ve 2.000 Gy ile ışınlayın ve sadece ortam radyasyonuna maruz kalarak kontrol odasında sahte ışınlanmış kontrol örneklerini koruyun.
- Işınlanmış numuneleri, maksimum γ-H2AX odak sayısına ulaşmak için nemlendirilmiş% 5 CO 2 inkübatöründe 37 ° C'de1 saat boyunca kuluçkaya yatırın.
NOT: Kuluçka süresi deneysel tasarıma göre değiştirilebilir.
4. Slayt hazırlama
NOT: Slayt kurulumu için Şekil 1'e bakın.
- Işınlama durumuna (veya konik tüp başına) yapışıklığı iyileştirmek için pozitif yüklü bir yüzeyle kaplanmış slaytlar kullanarak 3 slayt (teknik tekrar) hazırlayın. Slaydı klips tutucusuna yerleştirin, üzerine filtre kartını ve son olarak huniyi ekleyin. Slayt klipslerini sabitleyin ve sitosantrifüle yerleştirin.
- Hunine 250 μL hücre süspansiyonu ekleyin (200.000 hücre/slayt) ve bir sitosantrifüj kullanarak 5 dakika boyunca 30 x g döndürün.
- Sitosantrifüjasyondan sonra, slaytı klips tutucudan çıkarın ve hidrofobik bir kalem kullanarak, boyama işlemi sırasında bağlı hücrelerdeki immünofluoresan lekeyi korumak için hücrelerle noktanın etrafına bir daire çizin.
5. Fiksasyon ve immünofonoresans γ-H2AX boyama
NOT: Tüm çözeltiler, hidrofobik bir daire ile işaretlenmiş hücre bölgesine dikkatlice eklenir. Boyama çözeltileri, pipet ucunun hücreleri bozmasına izin vermeden slaydın biraz üzerine dağıtılır. Çözümler tüm slayda EKLENMEZ.
- Slaytları 20 dakika boyunca taze hazırlanmış %3 PFA'da sabitleyin.
NOT: Slaytlar, immünostainleme yapılmadan önce en fazla 2 gün boyunca 4 °C'de %0,5 PFA içeren PBS'de saklanabilir. Daha sonra, slaytları PBS'li bir Coplin kavanozunda 5 dakika yıkayın, ardından permeabilizasyona izin vermek için hücreleri 100 μL soğuk Triton-X çözeltisi ile 10 dakika örtün. - Triton-X çözeltisini kağıt mendile dökin ve slaytları% 1 BSA çözeltisinde 10 dakika boyunca üç kez yıkayın. Bu, spesifik olmayan antikor bağlamayı engelleyerek istenmeyen arka planı önlemek için yapılır.
- Oda sıcaklığında, 1:500 seyreltilmiş birincil anti-γ-H2AX antikorunun 100 μL'si ile nemlendirici bir odada 1 saat boyunca, dikdörtgen bir slayt saklama kutusunun tabanına ıslak kağıt ekleyerek kolayca gerçekleştirilir.
- Antikor çözeltisini kağıt mendile yerleştirin ve ilişkisiz birincil antikoru çıkarmak ve ikincil antikorun spesifik olmayan bağlanmasını önlemek için Coplin kavanozunda 10 dakika boyunca% 1 BSA çözeltisi ile üç yıkama yapın.
- Nemlendirici haznede 1 saat boyunca 1:1000 seyreltilmiş ikincil DAM-TRITC antikor çözeltisinin 100 μL'si ile slaytları kuluçkaya yatırın. Antikor çözeltisini kağıt mendile dökin ve slaytları PBS'de üç kez 10 dakika yıkayın.
- Son olarak hidrofobik dairenin dışındaki slaytları yumuşak, tozsuz kağıtla kurulayın ve sulu bir montaj ortamında çözülen 1-2 damla DAPI ekleyin ve kaydırağı 24 x 50 mm'lik bir kapak kayması ile hafifçe örtün, sıkışmış hava kabarcıkları olmadığından ve buzdolabına bir gecede 4 °C'de yer olmadığından emin olun. Slaytlar taramadan önce en fazla 2 hafta boyunca 4 °C'de saklanabilir.
6. Slaytların Otomatik Taranması ve Puanlatması
NOT: Tarama sisteminin floresan mikroskobu, video görüntülerinin gerçek zamanlı dijitalleştirilmesi için bir kare tutucuya bağlı yüksek çözünürlüklü bir CCD (şarjlı bağlantılı cihaz) kamera, tarama aşaması, manuel hareketler için izleme topu, 3D fare, hızlı PC ve monitör ve arşivleme için sabit sürücüye sahip olması gerekir (Şekil 2).
- Sınıflandırıcı kurulumu
NOT: Sınıflandırıcı, sistemin hücreleri nasıl algıladığını tanımlayan bir parametre kümesidir. Önceden sınıflandırılmış görüntü alanlarına dayalı eğitimden kaynaklanır. Sınıflandırıcı mikroskop büyütme, hücre tipi ve laboratuvar için özeldir. Bu nedenle, sınıflandırıcılar geçerli koşullara uyarlamak için aşağıdaki parametrelerde değişiklikler gerektirebilir. Değerlendirmeden önce ayarların bir başvuru slaydı ile sınanmasınız önerilir.- Görüntü alma: Görüntüleme için 40x kuru bir hedef kullanın. Tüm hücrelerde karşılaştırılabilir görüntü kalitesi elde etmek için kamera tümleştirme süresini otomatik moda ayarlayın. Her iki renk kanalı için de maksimum entegrasyon süresini en az 1 saniye olarak ayarlayın (kamera kazancı 4,0). Sinyal kanalı 10 odak düzlemi ve uçaklar arasında 14/40 μm ile elde edilir.
- Hücre seçimi: 20.00 μm 2 ve 76.00 μm 2 aralığında PBMC'ler tespit edilir. Maksimum sarsıntı derinliğini 0,05'e ve maksimum en boy oranını 1,4'e ayarlayın. Göreli gri düzey eşiğini %20 olarak ayarlayın.
- Hücre işleme: Arka planı azaltmak için DAPI sayaç kanalını histogram maksimum algoritmasıyla işleyin. Sinyal kanalı, arka planı azaltmak ve sinyalleri geliştirmek için bir TopHat filtresi (güç 7, yumuşatma faktörü 0) ile işlenir.
- Sinyal sayımı: Cihazın Nesne Sayısı özelliğini kullanarak odakları sayın. Kalan arka plan sinyallerinin yanlış-pozitif değerlendirilmesini önlemek için, hücredeki en parlak nesneyle karşılaştırıldığında yalnızca yoğunluğun en az% 30'unu gösteren sinyaller sayılır.
- Tozları temizlemek için %70 etanol ile hafifçe temizlendikten sonra otomatik tarama platformuna veya slayt aşamasına slaytlar yerleştirin/yerleştirin.
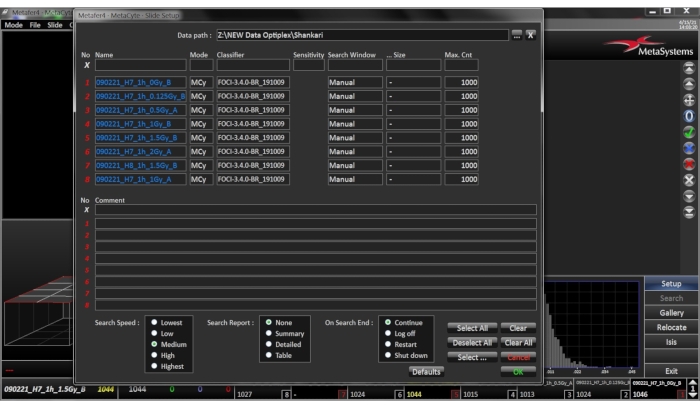
- Slayt Kurulumu - Slayt Kurulumu İletişim Menüsünü Aç (Şekil 3)
- Doğru Veri Yolu 'nuseçin, bu, aramadan kaynaklanan slayt dosyalarının depolandığı yeri belirtir.
- Slayda bir ad verin, her slayda benzersiz bir ad verilmelidir. Numaralandırılmış liste biçiminde bir dizi slayt girilirse, '?' slayt numarası için joker karakter olarak kullanılabilir.
- Bölüm 1.1 - 1.4'te(Şekil4) açıklandığı gibi uygun sınıflandırıcıyı seçin.
- Arama Penceresi'ni seçin ve cytocentrifuge hücre dairesiyle eşleşen bir arama penceresi tanımı varsa Önceden Tanımlanmış'ı seçin, Boyut sütununda ilgili tanımı seçin veya önceden tanımlanmış bir arama penceresi tanımı yoksa El ile'yi seçin. Bu durumda, Boyut sütununun ayarlanacak olması gerekmez.
- En Fazla Hücre Sayısı'nı seçin ve taranmak için gereken en fazla hücre sayısını ekleyin. Seçilen arama penceresi henüz Tam Olarak Taranmamış olsa bile, En Fazla Hücre Sayısına ulaşılır ulaşılmaz arama sonlandırılır. Biyodozimetri uygulamaları için, kan örneği başına 3 slayt hazırlandığı düşünüldüğünde, slayt başına 1000 hücrenin otomatik olarak puanlat edilmesi yeterlidir. Ayarları onaylamak için Tamam'ı tıklatın.
- Slayt Tarama Kurulumu
- Yan çubukta Ara düğmesini tıklatın. Slayt kurulumunda El ile Arama Penceresi ayarı seçilmişse, tarama alanının belirlenmesine izin verecek bir diyalog açılır (Şekil 5). 10x hedefini kullanarak, fareyi sol tıklatarak arama alanının iki köşesini sabitleyerek slayttaki dikdörtgen arama alanını etkileşimli olarak seçin. Bu, Tamam düğmesiyle onaylanabilir. Arama penceresi önceden tanımlanmış bir arama penceresine atıfta bulunuyorduysa, bu adım atlanır.
- Kullanıcıdan odak başlangıç konumunu ayarlaması istenir. Daha sonra otomatik olarak bir referans nesnesi seçilecektir, yazılım kullanıcıdan her slayt için bir referans çekirdeğini (40x hedefini kullanarak) odaklayıp ortalamasını ve ayarları Tamamile onaylamasını ister. Sistem otomatik olarak tüm slaytlara sırayla taşınır. Gerekirse, bu adım için Canlı Görüntü Kurulumu - Tümleştirme Süresi'ni ayarlayın ( Şekil5).
- Tüm mikroskop ayarlarını kontrol edin ve sistem istemini Tamam ile onaylayın. Sistem otomatik odaklama ve tarama prosedürünü başlatacaktır. Tarama tamamlandıktan sonra veriler analizler için bilgisayara kaydedilir. Tarama tamamlandıktan sonra tarama sistemi otomatik olarak kapanır.
NOT: Mikroskop tüpünün kolunun tüm ışığı kameraya yönlendiren bir konumda olduğundan emin olun. - Arama Sonu, aramanın tamamı taranmışsa, en fazla hücre sayısına ulaşılmışsa veya arama iptal edilmişse arama sonlandırılır.
- Slayt Analizi
NOT: Tamamlanan tarama Şekil 6'da temsil edilir.- Tarama tamamlandığında, yan çubukta Galeri düğmesini tıklatın. Algılanan hücrelerin küçük görüntülerinden oluşan galeriyi gözden geçirin. Bu pencerede (Şekil 7), galeride bir üst menüden seçilecek bir ölçütle depolanan hücrelerin olup olmadığını belirtin. Hücreler genellikle algılandıkları sırada görüntülenir.
- Tespit edilen hücrelerin kalite ölçüsünün dağılımının yanı sıra araçlar ve puanlanan odakların standart sapmasını vermek için Kalite Histogram/Özellik Değer Diyagramı 'na (Şekil 8) tıklayın.
Sonuçlar
Bu protokol için, insan periferik kan mononükleer hücreleri (PMBC' ler) dört sağlıklı yetişkin gönüllünün tam kanından izole edildi ve 0.125, 0.250, 0.500, 1.000 ve 2.000 Gy radyasyon dozlarına maruz kaldı. Daha sonra, numuneler nemlendirilmiş% 5 CO 2 inkübatörde 37 ° C'de1 saat boyunca inkübe edildi. Fiksasyon ve immünoresans boyamanın ardından slaytlar otomatik olarak taranır ve puanlanır. Şekil 6, 7 ve 8, yazılımın kullanıcıya ne verdiğinin bir gösterimini verir. Tarama tamamlandığında, puanlanan odaklara genel bir bakış sağlayan bir analiz penceresi görüntülenir. Galeri, aykırılıkları silebilen interaktif bir menü ile puanlanan tüm odaklara ve son olarak ayrıntılı bir veri özeti içeren bir histogram verir.
γ ışınlarına maruz kaldıktan sonra γ-H2AX odak verimi Şekil 9'dasunulmuştur. Artan doz ile γ-H2AX odaklarının sayısında kademeli bir artış oldu. Bu grafik sadece tahlil doz bağımlılığını ve hassasiyetini göstermekle kalmaz, aynı zamanda bilinmeyen bir doza maruz kalan bir bireyden bir örnek alındığında bir doz tahmini yapmak için de kullanılabilir. Bu birey için sahte ışınlanmış kontrol veya arka plan odak seviyelerine sahip olmayacağını not etmek önemlidir. Bu nedenle Şekil 9, bu çalışmadaki dört yetişkin donör için 0,57 ± 0,23 Gy olan sham ışınlanmış kontrol örneklerinin 0 Gy değerini içerir.

Şekil 1: Sitosantrifüjleme için slaytların hazırlanması. Slaydı klips tutucusuna yerleştirin, üzerine filtre kartını ve son olarak huniyi ekleyin. Slayt klipslerini sabitleyin ve sitosantrifüle yerleştirin. Sitosantrifüjlemeden sonra, slaydı klips tutucudan çıkarın ve hidrofobik bir kalem kullanarak hücrelerle noktanın etrafına bir daire çizin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Bu protokolde kullanılan, floresan mikroskopa bağlı otomatik bir tarayıcı içeren otomatik tarama platformu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: Slayt kurulumu menüsü. Kenar çubuğundaki KUR düğmesini tıklatarak diyaloğu açın. Sonuç dosyaları için hedef dizini seçin veya girin Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen burayı tıklatın.
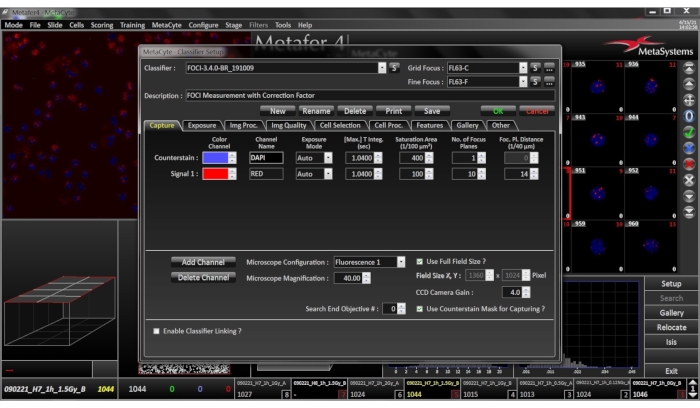
Şekil 4: Sınıflandırıcı Kurulum Menüsü. Seçili sınıflandırıcı ayarlarının numunenin geçerli hücre türü, hazırlama koşulları ve boyama desenleriyle eşleştiğından emin olun. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: El ile Arama Penceresi için Kurulum menüsü. Slayt kurulumunda pencere seçildi; tarama alanının belirlenmesine izin verecek bir diyalog açılacaktır. 10x hedefini kullanarak, slayttaki dikdörtgen arama alanı, farenin sol tıklamasıyla arama alanının iki köşesi sabitlenerek etkileşimli olarak seçilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
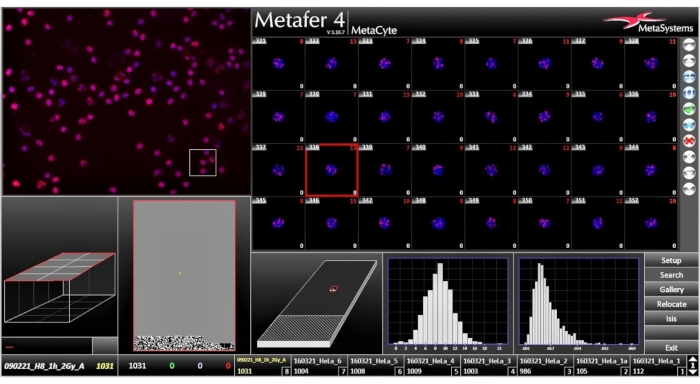
Şekil 6: Analiz Penceresi, tarama tamamlandıktan sonra, analiz penceresi tarama sonuçlarını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
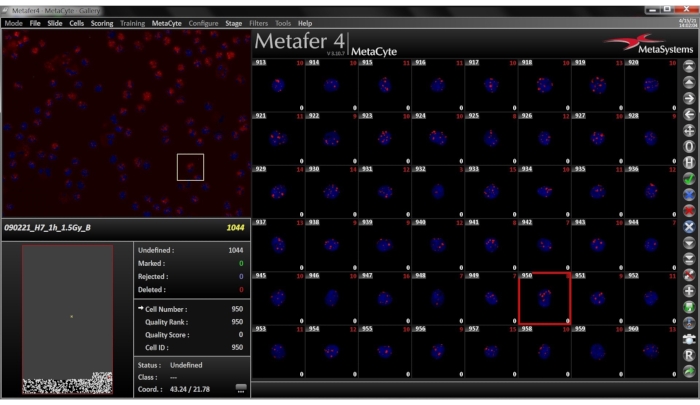
Şekil 7: Seçili slayt için Galeri Görünümü. Galeri sekmesi yan çubukta bulunur. Görüntü galerisi, algılanan hücrelerin küçük görüntülerinden oluşur ve birleşik bir DAPI-TRITC görüntüsü olarak görüntülenir. Her görüntünün sol alt ve sağ köşesinde doğrudan odak sayısı ve düzeltilen odak sayıları görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 8: Seçili slayt için histogram görüntüleri. Bu pencere histogram sağ tıklatarak açılır. Histograma tıklayarak, histogram sekme sayfası analiz edilen hücrelerin ortalama, standart sapma, değişim katsayısı, minimum, maksimum ve ortanca değerlerini listeleyen bir veri özeti sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
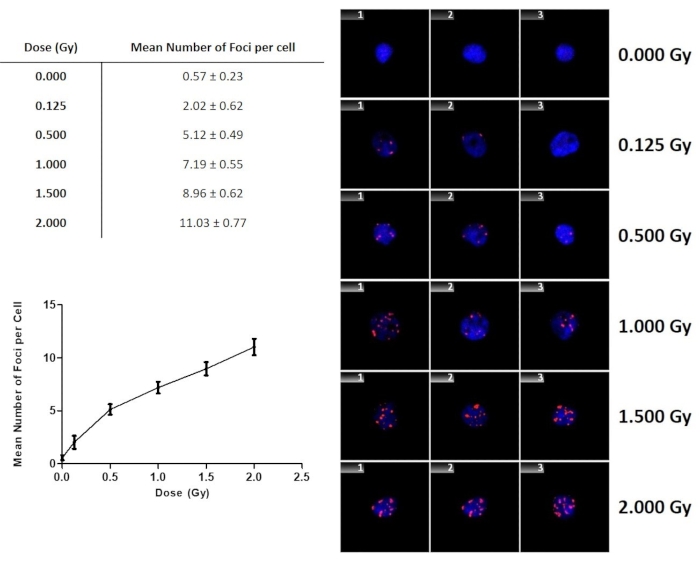
Şekil 9: 60Co γ ışınlarına maruz kalan lenfositler için doz fonksiyonu olarak γ-H2AX odaklarının sayısı. Hata çubukları, bağışçılar arasındaki interindividual varyasyonu temsil eden standart sapmalardır. Veriler, dört sağlıklı gönüllünün ortalama γ-H2AX odak ± standart sapma sayısını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, γ-H2AX odak analizinin otomatik floresan mikroskopi tabanlı puanlaması için adım adım bir yordamı açıklar. Odak testinin yararını, bireylerin bilinmeyen IR seviyelerine maruz kalabileceği bir radyasyon kazası senaryosunda biyolojik doz değerlendirmesi yapmak için periferik kan lenfositlerindeki radyasyon kaynaklı DNA DSB sayısını analiz etmek için zaman etkili bir yöntem olarak göstermektedir.
Bu özel protokolde PBMC'ler in vivo radyasyona maruz kalmayı taklit etmek için in vitro olarak ışınlandı. Işınlama ve bir saatlik kuluçka süresi tamamlandıktan sonra, slaytta bir hücre konsantrasyon noktası oluşturmak için bir sitosantrifüj kullanılarak slaytlar yapılır. Bir sitosantrifüj kullanımı, otomatik puanlama için standart koşullar elde etmek için hayati önem taşır. Tamamlandığında, hücrelerin etrafında bir daire yapmak, kullanıcının boyama reaktiflerini yerelleştirmesine izin vererek reaktiflerin wastage'ını azaltmak için hidrofobik bir kalem kullanılır. Bu kalem türü parafin bölümleri, dondurulmuş bölümler ve sitoloji preparatları gibi çeşitli immünostainleme tekniklerinde kullanılabilir. Ayrıca, enzim ve floresan bazlı algılama sistemleri ile uyumlu bir hidrofobik kalem seçmek önemlidir. Slayt hazırlığından sonra fiksasyon ve immünofonoresans γ-H2AX lekelenme meydana geldi. Bu protokolde, hücreler 20 dakika boyunca bir PBS çözeltisinde% 3 PFA kullanılarak sabitlenir. İmmün yetiminin başarılı olması için, hücrelerin morfolojisinin korunması ve antijenik bölgelerin kullanılan algılama reaktifleri için erişilebilir olması esastır. PFA, fiksasyon için nispeten nazik bir ajandır ve protein yapılarını korurken hücreleri stabilize eder51. Daha yüksek PFA konsantrasyonlarına ve daha uzun sabitleme sürelerine sahip optimizasyon deneyleri slayt kalitesi üzerinde olumsuz bir etkiye neden oldu, ancak 24 saate kadar% 0,5 PFA'da daha fazla depolama (bir gecede) iyi sonuçlar verdi.
Bu protokolde kullanılan primer, 2F3 monoklonal antikor, DNA DSB indüksiyonu sonrası Serine 139'da fosforilize edildiğinde histon varyantı H2AX'a tepki verir. Antikor fosforillenmiş kalıntıya diğer fosforillenmiş histonlarla çapraz reaktivite olmadan bağlanabilir52. Bu birincil fare monoklonal antikoru olduğundan, alternatif bir konakta, yani eşek-anti-fare (DAM)-TRITC'de yetiştirilirken birincil antikorun konak türlerine karşı ikincil bir antikor seçildi. İmmünofluoresan lekeleme spesifik antikor-epitop bağlamaya dayanırken, birkaç intermoleküler kuvvet de spesifik olmayan arka plan lekeleme ile sonuçlanabilir. Spesifik olmayan bağlamayı azaltmak için, immünofluoresan boyama protokollerinde bir bloke reaktifi kullanmakönemlidir 53; BSA çözümü kullandık. Ayrıca, birincil ve ikincil antikor lekelemeden önce slaytları çözeltide en az 20 dakika bırakarak bu engelleme adımına yeterli zaman ayrılmalıdır. Ek olarak, BSA çözeltisi birincil ve ikincil antikorlar için seyreltici olarak da kullanılmalıdır. Lekelenme için kullanılan anti-γ-H2AX ve ikincil antikora bağlı olarak, optimum konsantrasyonu belirlemek için farklı antikor seyreltmelerini test etmeyi düşünmelidir. Daha kesin puanlama için, ek DNA DSB onarım protein antikorları eklenerek çift boyama yapılabilir.
Bu tür analizlerin en büyük dezavantajı, maruziyetten sonra mümkün olan en kısa sürede kan örnekleri alma ihtiyacıdır, çünkü maksimum odak sayısının ışınlamadan sonraki 48 saat içinde normal seviyelere geri döndüğü bilinmektedir. Bu nedenle, radyasyon kazası ve sonraki kan örnekleme zamanı bilindiğinde, in vitro ışınlamadan sonra farklı zaman noktalarında (örneğin, 4, 8, 12 ve 24 saat) kurulan farklı kalibrasyon eğrileriyle çalışmak yararlı olabilir. Bununla birlikte, makalenin giriş bölümünde daha önce de belirtildiği gibi, γ-H2AX odak tahlilinin gücü başlangıç, hızlı triyaj amaçlarında yatmaktadır ve daha fazla zaman alan sitogenetik biyolojik dozimetriye öncelik vermek için kullanılmalıdır. Birden fazla biyodozimetri biyobelirteçlerinin paralel olarak kullanıldığı, en güvenilir doz tahminini oluşturacağı ve dünya çapında çeşitli biyodozimetri laboratuvarlarının, farklı uzmanlıklara sahip laboratuvarlar tarafından birden fazla paralel biyodozimetri değerlendirmesine izin vermek için etkinleştirilebilen ve kullanılabilecek ülke çapında ağlar kurmak için güçlerini birleştirdiği birleşik bir senaryo37,54,55 . Ayrıca kaza yerinde veya yakınında mobil laboratuvar gibi süper hızlı analizler için gelişmeler devam etmektedir56. Yeni, umut verici biyodozitri yöntemleri sürekli geliştirilmektedir, bu da gelecekte daha hızlı ve daha güvenilir verimle sonuçlanacaktır57.
Otomatik görüntü analiz sistemi için slaytlar otomatik tarama platformuna veya slayt aşamasına eklenir veya yerleştirilir. Bundan sonra, slayt ayrıntılarını adlandırın ve ekli bilgisayardaki uygun klasöre kaydedin. Bu deneme için otomatik çekirdek ve odak algılama, ilgili sınıflandırıcı ayarlarını temel alıp verdir. Sınıflandırıcı oluştururken, seçilen sınıflandırıcı ayarlarının numunenin geçerli hücre tipi, hazırlık koşulları ve immünofluoresan boyama ile eşleştiğından emin olun. Birincil ve ikincil antikorların ekscitasyon spektrumu ile eşleşen uygun floresan kanallar sınıflandırıcıda ayarlanır. Sınıflandırıcı, gerekirse ek puanlama parametreleri ayarlamaya izin verir (örneğin, bölüm 6.1'de açıklandığı gibi çekirdek boyutu, floresan yoğunluğu). İki veya daha fazla DNA onarım proteini (örneğin, γ-H2AX ve 53BP1) bir deneyde birleştirilirse, sistem sinyallerin birlikte lokalizasyonlarını da tespit edebilir. İlk olarak, sistem DAPI görüntülerini alır, görüntü işleme uygular ve sınıflandırıcıda belirlenen morfolojik ölçütleri kullanarak çekirdekleri tanımlar. TRITC sinyalleri, odak düzlemleri arasında 0,35 mm adım boyutuna sahip 10 z-stack kullanılarak elde edilir47. Sınıflandırıcı, çekirdek içindeki farklı TRITC sinyallerinin sayısının puanlandığı Doğrudan Odak Sayısı'nı kullandı. Burada, artan radyasyon dozu ile odak sinyallerinin daha büyük nesnelerle birleşme eğiliminde olduğunu ve nesneler doğrudan sayılırsa gerçek odak sayısının hafife alınmasına neden olduğunu göz önünde bulundurmak önemlidir. Burada açıklanan analiz için gerekli değildi, ancak bu sorunu çözmek için Düzeltilmiş Odak Sayısı ile ek bir adım uygulanabilir. İkincisi, sistemin algılanan sinyallerin boyutlarını elde etmesine izin verir ve bunları buna göre tartar. Her iki sayma yönteminin kullanılması, daha yüksek dozlarda gerçek odak sayısının daha gerçekçi bir tahminini sağlayabilir.
Otomatik taramaya başlamak için, tarama alanı, farenin sol tıklaması ile arama alanının iki köşesini sabitleyerek dikdörtgen bir arama alanı yapmak için mikroskobun 10x hedefi kullanılarak belirlenir (Şekil 5), ardından başlangıç pozisyonuna odaklanır. Başvuru nesnesi otomatik olarak seçilir ve yazılım, kullanıcıdan her slayt için bir referans çekirdeğini (40x hedefini kullanarak) odaklayıp ortalamasını ister. Arama başladıktan sonra, sistem seçilen ilk slaydın arama penceresinin ortasına taşınır ve referans nesneyi ortalamayı ve odaklamayı talep eder. Bu nesne daha sonra hücrenin konumlarındaki herhangi bir kaymayı düzeltmek için bir konum başvurusu olarak kullanılacaktır. Referans alanının ikinci amacı otomatik ışık ayarıdır, iletilen ışık modunda ışık optimum ışık seviyesine ulaşılana kadar ayarlanır. Floresan modunda ışık seviyesi sabittir, ancak CCD kameranın entegrasyon süresi gerekli sinyal ölçülene kadar artırılabilir. Doğru bir ışık ayarını etkinleştirmek için, başvuru tipik boyamaya sahip nesneler içermelidir. Leke yoğunluğu çok yüksek eserlere sahip bir alan kullanılmaması önemlidir. Işık ayarlamasını takiben, sistem kılavuz otomatik netlemeyi referans alanına en yakın ızgara konumunda başlatır. Alanları normal bir ızgaraya odaklamaya devam eder ve arama penceresinin önüne ve arkasına doğru bir menderes halinde hareket eder. Tarama, kılavuz otomatik netlem tamamlandığında başlar. Aşama, verileri yakalamak için alandan sonra bir menderes deseni alanında taşınır. Bir hücre algılandığında, konumu ve galeri görüntüsü ekranda depolanır ve görüntülenir ve hücre sayısı güncelleştirilir. Mikroskop, aşama veya besleyici hatası oluşursa, arama otomatik olarak iptal edilir. Operatörden manuel müdahalenin olduğu tek adım, slayt tarama kurulumu sırasındadır. Bu aynı zamanda hızlı bir kalite kontrol kontrolünün gerçekleştiği noktadır (hava kabarcıkları, düşük hücre numaraları, floresan sinyal boyama eserlerinin solması) ve düşük kalitede bir slaytın taranmasının durdurulmasına karar verilebilir. Tüm slayt taranmışsa, en fazla hücre sayısına ulaşılmışsa veya arama iptal edilmişse arama sonlandırılır. Tarama tamamlandıktan sonra, veriler Şekil 6. Taranan hücreleri görüntülemek için Galeri penceresi açılır ve her hücre görüntülenebilir (Şekil 7). Bu, operatörün galeri görüntülerinin odağını ve puanlanan toplam hücre sayısını denetleyerek kalite kontrolü yapabileceği başka bir noktadır. Çok fazla hücre odak dışındaysa veya sistem tarafından gerçekçi bir doz tahmini yapmak için çok az hücre tespit edildiyse (örneğin, hedeflenen 1000 hücre yerine 100 hücre), slaytı ve otomatik puanı nihai değerlendirmenin dışında tutmaya karar verilmelidir. Tüm veriler histogramlarda özetlenmiştir (Şekil 8), her hücre için puanlanan odakların dağılımı, araçları ve standart sapması hakkında bilgilerle birlikte. Histogramlar, incelenmek üzere otomatik bulgulara dayanarak çekirdeklerin alt popülasyonlarını seçmek ve görüntülemek için de kullanılabilir. Sonuçlar üzerinde istatistiksel analizler, dağılım, ortalama ve hücre başına sayı odaklarının standart sapması manuel olarak kaydedildikten sonra gerçekleştirilir. Grafik, biyodozimetri örneğinin doz tahminini yapmak için kalibrasyon eğrisi olarak kullanılabilir. Bu, alınan dozun yaklaşık bir tahminini yapmak için eğilim çizgisinin denklemi kullanılarak yapılabilir. Dahası Şekil 9 otomatik taramanın düşük dozlarda indüklenen odakları tespit edecek kadar hassas olduğunu gösterir. Ayrıca, sonuçlar doz ile hücre başına odak sayısının net bir doğrusal artışını göstermektedir. Sonuçların yalnızca kullanılan sınıflandırıcı için temsili olduğu, sonuçların farklı sınıflandırıcı parametreleri için farklı olacağı belirtilmelidir. Bu nedenle, biyodozimetri analizi durumunda, biyodozimetri örnekleri için doz tahminini gerçekleştirmek için kullanılan kalibrasyon eğrisini oluşturmak için kullanılanlarla aynı sınıflandırıcı ve slayt hazırlığının kullanılması önemlidir. Bu çalışmanın kapsamı dışında olmakla birlikte, γ-H2AX odak analizinin kısmi vücut ışınlamalarını belirlemek için de kullanılabileceğini belirtmek önemlidir. Kazara radyasyona maruz kalmaların çoğu, vücudun sadece lokalize bir bölgesinin yüksek dozda maruz kaldığı inhomogeneous veya kısmi vücut maruziyetleridir. Çeşitli çalışmalar, ışınlanan vücudun fraksiyonunu ve radyasyona maruz kalınan fraksiyonun dozunu tahmin etmek için γ-H2AX odak tahlilini kullanmanın mümkün olduğunu göstermektedir.42. Tüm vücut ışınlama gerçekleştiğinde, tüm hücrelerde DNA DSB'nin rastgele indüksiyonu olacaktır ve bir Poisson dağılımı bulmayı bekleyebilirsiniz. Kromozomal sapmaların indüksiyonunun, birden fazla sapmaya sahip hücrelerin ve normal metafazlara sahip hücrelerin yüksek bolluğunun olduğu periferik kan lenfositlerinde aşırı dağılma eğiliminde olduğu sitogentik yöntemlere benzer şekilde, dağınık odak dağılımları üzerinde önerilen kontamine bir Poisson yöntemi kullanılarak γ-H2AX odaklarının dağılım analizi58. İkincisi de teyit edildi in vivo minipigs ve rhesus makak ile deneyler59.
Açıklamalar
C. Schunck, MetaSystems Hard & Software GmbH, Altlussheim, Almanya'nın bir çalışanıdır.
Teşekkürler
Yazarlar, kan bağışı için çalışma katılımcılarına ve kan örneği toplama için Hemşire V. Prince'e teşekkür eder. Güney Afrika Ulusal Araştırma Vakfı'nın (NRF) bu araştırmaya yönelik mali yardımı bu vesileyle kabul edilmektedir. İfade edilen görüşler ve varılan sonuçlar, yazarların görüşleridir ve mutlaka NRF'ye atfedilmesi gerekmez. Bu çalışma, W. Martínez-López'i ve Eşgüdümlü Araştırma Projesi E35010'u (sözleşme numarası: 22248) desteklemek için Bir Teknik İşbirliği Projesi (sayı: URU6042) aracılığıyla Uluslararası Atom Enerjisi Ajansı (IAEA) tarafından finansal olarak desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin - BSA | Merck | A3059 | |
| Coplin Jar | Sigma | S6016 | |
| Cover Slips (Size 24 x 50 mm) | Lasec | Glass2C29M2450Rec | |
| Cryogenic Vials (1.2 mL) | WhiteSci | 607101 | |
| Cytospin | Healthcare Technologies | JC370-12-L | |
| Cytospin Clips | Healthcare Technologies | JC302 | |
| Cytospin filter cards | Healthcare Technologies | JC307 | |
| Cytospin Funnels | Healthcare Technologies | JC372 | |
| DAM-TRITC | Invitrogen | A16022 | |
| DAPI-Fluroshield | Sigma/Merck | F6057 | |
| Ethanol | Kimix | ETD901 | |
| Filter tips | WhiteSci | 200ul (312012) and 1000ul (313012) | |
| Hydrochloric acid- HCl | Merck | ||
| Histopaque | Sigma/Merck | 10771 | |
| lithium–heparin collection tubes | The Scientific Group | 367526 | |
| MetaSystems - Metafer | Metasystems | Azio Imager Z2: 195-041848 | |
| NaOH | Merck | 221465 | |
| NovoPen | Leica Biosystems | NCL-PEN | |
| Paraformaldehyde | Sigma/Merck | 158127 | |
| Phosphate-buffered saline Tablets | Separations | SH30028,02 | |
| Pipettes | WhiteSci | P11037 and P1033 | X-tra Clipped Corner Slides are clipped at 45° angles to help reduce glass breakage. |
| Purified anti-H2A.X Phospho (Ser139) Antibody | Biolegend | 613402 / 100 μg | |
| RPMI medium | WhiteSci | BE12-702F | |
| Triton X-100 (Octoxinol 9) | Sigma/Merck | T-9284 | |
| Tubes (15ml) | WhiteSci | 601002 | |
| X-Tra adhesive slides – corner clipped | SMM Technologies | 3800200E |
Referanslar
- Barnes, J. L., et al. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Little, J. B. Radiation carcinogenesis. Carcinogenesis. 21 (3), 397-404 (2000).
- Barquinero, J. F., et al. Lessons from past radiation accidents: Critical review of methods addressed to individual dose assessment of potentially exposed people and integration with medical assessment. Environment International. 146, 106175 (2021).
- International Atomic Energy Agency. Radiotherapy in Cancer Care: Facing The Global Challenge. International Atomic Energy Agency. , (2017).
- Achel, D. G., et al. Towards establishing capacity for biological dosimetry at Ghana Atomic Energy commission. Genome Integrity. 7 (1), 1-5 (2016).
- Sullivan, J. M., et al. Assessment of biodosimetry methods for a mass-casualty radiological incident: Medical response and management considerations. Health Physics. 105 (6), 540-554 (2013).
- Rea, M. E., et al. Proposed triage categories for large-scale radiation incidents using high-accuracy biodosimetry methods. Health Physics. 98 (2), 136-144 (2010).
- Swartz, H. M., et al. A critical assessment of biodosimetry methods for large-scale incidents. Health Physics. 98 (2), 95-108 (2010).
- International Atomic Energy Agency. Cytogenetic Dosimetry: Applications in Preparedness for and Response to Radiation Emergencies. International Atomic Energy Agency. , (2011).
- Grégoire, E., et al. Twenty years of FISH-based translocation analysis for retrospective ionizing radiation biodosimetry. International Journal of Radiation Biology. 94 (3), 248-258 (2018).
- Moroni, M., et al. Evaluation of the gamma-H2AX assay for radiation biodosimetry in a swine model. International Journal of Molecular Sciences. 14 (7), 14119-14135 (2013).
- Rothkamm, K., et al. Laboratory Intercomparison on the γ-H2AX Foci Assay. Radiation Research. 180 (2), 149 (2013).
- Barnard, S., et al. The first gamma-H2AX biodosimetry intercomparison exercise of the developing european biodosimetry network RENEB. Radiation Protection Dosimetry. 164 (3), 265-270 (2015).
- Moquet, J., et al. The second gamma-H2AX assay inter-comparison exercise carried out in the framework of the European biodosimetry network (RENEB). International Journal of Radiation Biology. 93 (1), 58-64 (2017).
- Vinnikov, V., et al. Clinical Applications of Biomarkers of Radiation Exposure: Limitations and Possible Solutions Through Coordinated Research. Radiation Protection Dosimetry. 186 (1), 3-8 (2019).
- Mariotti, L. G., et al. Use of the γ-H2AX assay to investigate DNA repair dynamics following multiple radiation exposures. PLoS ONE. 8 (11), 1-12 (2013).
- Ivashkevich, A. N., et al. γH2AX foci as a measure of DNA damage: A computational approach to automatic analysis. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 711 (1-2), 49-60 (2011).
- Rogakou, E. P., et al. Megabase chromatin domains involved in DNA double-strand breaks in vivo. Journal of Cell Biology. 146 (5), 905-915 (1999).
- Sedelnikova, O. A., et al. Quantitative Detection of 125 IdU-Induced DNA Double-Strand Breaks with γ-H2AX Antibody. Radiation Research. 158 (4), 486-492 (2002).
- Han, J., et al. Quantitative analysis reveals asynchronous and more than DSB-associated histone H2AX phosphorylation after exposure to ionizing radiation. Radiation Research. 165 (3), 283-292 (2006).
- Jaworska, A., et al. Operational guidance for radiation emergency response organisations in Europe for using biodosimetric tools developed in EU multibiodose project. Radiation Protection Dosimetry. 164 (1-2), 165-169 (2015).
- Kulka, U., et al. Realising the european network of biodosimetry RENEB - status quo. Radiation protection dosimetry. 164 (1), 42-45 (2015).
- Sánchez-Flores, M., et al. γH2AX assay as DNA damage biomarker for human population studies: Defining experimental conditions. Toxicological Sciences. 144 (2), 406-413 (2015).
- Raavi, V., et al. Potential application of γ-H2AX as a biodosimetry tool for radiation triage. Mutation Research/Reviews in Mutation Research. 787, 108350 (2020).
- Lassmann, M., et al. In vivo formation of γ-H2AX and 53BP1 DNA repair foci in blood cells after radioiodine therapy of differentiated thyroid cancer. Journal of Nuclear Medicine. 51 (8), 1318-1325 (2010).
- Vandevoorde, C., et al. γ-H2AX foci as in vivo effect biomarker in children emphasize the importance to minimize x-ray doses in paediatric CT imaging. European Radiology. 25 (3), 800-811 (2015).
- Beels, L., et al. γ-H2AX foci as a biomarker for patient X-ray exposure in pediatric cardiac catheterization: Are we underestimating radiation risks. Circulation. 120 (19), 1903-1909 (2009).
- Bogdanova, N. V., et al. Persistent DNA double-strand breaks after repeated diagnostic CT scans in breast epithelial cells and lymphocytes. Frontiers in Oncology. 11, 1-14 (2021).
- Schumann, S., et al. DNA damage in blood leukocytes of prostate cancer patients undergoing PET/CT examinations with [68Ga]Ga-psma. Cancers. 12 (2), 1-14 (2020).
- Ivashkevich, A., et al. Use of the γ-H2AX assay to monitor DNA damage and repair in translational cancer research. Cancer Letters. 327 (1-2), 123-133 (2012).
- Moquet, J., et al. Gamma-H2AX biodosimetry for use in large scale radiation incidents: Comparison of a rapid "96 well lyse/fix" protocol with a routine method. PeerJ. 2014 (1), 1-11 (2014).
- Turner, H. C., et al. Adapting the γ-H2AX Assay for Automated Processing in Human Lymphocytes. Radiation Research. 175 (3), 282-290 (2008).
- Sharma, P. M., et al. High Throughput Measurement of γ H2AX DSB Repair Kinetics in a Healthy Human Population. PLoS ONE. 10 (3), 0121083 (2015).
- Vandevoorde, C., et al. EPI-CT: In vitro assessment of the applicability of the γ-H2AX-foci assay as cellular biomarker for exposure in a multicentre study of children in diagnostic radiology. International Journal of Radiation Biology. 91 (8), 653-663 (2015).
- MacPhail, S. H., et al. Cell cycle-dependent expression of phosphorylated histone H2AX: Reduced expression in unirradiated but not X-irradiated G1-phase cells. Radiation Research. 159 (6), 759-767 (2003).
- Barnard, S., et al. The shape of the radiation dose response for DNA double-strand break induction and repair. Genome Integrity. 4 (1), 1 (2013).
- Kulka, U., et al. Biodosimetry and biodosimetry networks for managing radiation emergency. Radiation Protection Dosimetry. 182 (1), 128-138 (2018).
- Macaeva, E., et al. Gene expression-based biodosimetry for radiological incidents: assessment of dose and time after radiation exposure. International Journal of Radiation Biology. 95 (1), 64-75 (2018).
- Khanna, K. K., et al. DNA double-strand breaks: Signaling, repair and the cancer connection. Nature Genetics. 27 (3), 247-254 (2001).
- Rothkamm, K., et al. γ-H2AX as protein biomarker for radiation exposure. Annali dell'Istituto Superiore di Sanita. 45 (3), 265-271 (2009).
- Borràs, M., et al. Comparison of methods to quantify histone H2AX phosphorylation and its usefulness for prediction of radiosensitivity. International Journal of Radiation Biology. 91 (12), 915-924 (2015).
- Horn, S., et al. Gamma-H2AX-based dose estimation for whole and partial body radiation exposure. PLoS ONE. 6 (9), 1-8 (2011).
- Costes, S. V., et al. Imaging Features that Discriminate between Foci Induced by High- and Low-LET Radiation in Human Fibroblasts. Radiation Research. 165 (5), 505-515 (2006).
- Leatherbarrow, E. L., et al. Induction and quantification of γ-H2AX foci following low and high LET-irradiation. International Journal of Radiation Biology. 82 (2), 111-118 (2006).
- Mistrik, M., et al. Low-dose DNA damage and replication stress responses quantified by optimized automated single-cell image analysis. Cell Cycle. 8 (16), 2592-2599 (2009).
- Oeck, S., et al. The Focinator - a new open-source tool for high-throughput foci evaluation of DNA damage. Radiation Oncology. 10 (1), 1-11 (2015).
- Vandersickel, V., et al. Early increase of radiation-induced γH2AX foci in a humanku70/80 knockdown cell line characterized by an enhanced radiosensitivity. Journal of Radiation Research. 51 (6), 633-641 (2010).
- Sambrook, J., et al. . Molecular cloning : a laboratory manual. , (2001).
- Rifai, A., et al. B and T lumphocytes. Recent Advances in IgA Nephropathy. (6), 193-210 (2009).
- Andreo, P., et al. Absorbed dose determination in external beam radiotherapy: An international code of practice for dosimetry based on absorbed dose to water. International Atomic Energy Agency. , (2001).
- Jamur, M. C., et al. Cell fixatives for immunostaining. Methods in Molecular Biology. 588, 55-61 (2010).
- Rogakou, E. P., et al. DNA Double-stranded Breaks Induce DNA Double-stranded Breaks Induce Histone H2AX Phosphorylation on Serine 139. Journal of Biological Chemistry. 273 (10), 1-12 (1998).
- Kyuseok, I. An introduction to Performing Immunofluorescence Staining. Methods in Molecular Biology. 1897, 299-311 (2019).
- Ainsbury, E. A., et al. Multibiodose radiation emergency triage categorization software. Health Physics. 107 (1), 83-89 (2014).
- Ainsbury, E. A., et al. Dose estimation software for radiation biodosimetry. Health Physics. 98 (2), 290-295 (2010).
- Turner, H. C., et al. The RABiT: High-throughput technology for assessing global DSB repair. Radiation and Environmental Biophysics. 53 (2), 265-272 (2014).
- Wang, Q., et al. Development of the FAST-DOSE assay system for high-throughput biodosimetry and radiation triage. Scientific Reports. 10 (1), 1-11 (2020).
- Rothkamm, K., et al. Leukocyte DNA damage after multi-detector row CT: A quantitative biomarker of low-level radiation exposure. Radiology. 242 (1), 244-251 (2007).
- Redon, C. E., et al. an analysis method for partial-body radiation exposure using γ-H2AX in nonhuman primate lymphocytes. Radiation Measurements. 46 (9), 877-881 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır