Method Article
Автоматизированный микроскопический метод подсчета баллов для анализа γ-H2AX в лимфоцитах периферической крови человека
В этой статье
Резюме
В этом протоколе представлена подготовка слайдов и автоматизированное оценивание γ-H2AX на лимфоцитах периферической крови. Чтобы проиллюстрировать метод и чувствительность анализа, изолированные лимфоциты облучали in vitro. Этот автоматизированный метод обнаружения ДНК DSB полезен для быстрых и высокопроизводительных биологических дозиметрических приложений.
Аннотация
Ионизирующее излучение является мощным индуктором повреждения ДНК и хорошо документированным канцерогеном. Биологическая дозиметрия включает в себя обнаружение биологических эффектов, вызванных воздействием ионизирующего излучения, для проведения индивидуальной оценки дозы. Это актуально в рамках чрезвычайных ситуаций, связанных с радиацией, где критически важное значение имеют оценки состояния здоровья и планирование клинического лечения пострадавших, подвергшихся воздействию. Поскольку двухцепочечные разрывы ДНК (DSB) считаются наиболее смертельной формой радиационно-индуцированного повреждения ДНК, этот протокол представляет собой метод обнаружения ДНК DSB в образцах крови. Методология основана на обнаружении флуоресцентного меченого фосфорилированного белка репарации ДНК, а именно γ-H2AX. Использование автоматизированной платформы микроскопии для оценки количества γ-H2AX очагов на ячейку позволяет проводить стандартизированный анализ со значительным уменьшением времени обработки. Таким образом, анализ γ-H2AX может стать одним из самых быстрых и чувствительных анализов для биологической дозиметрии. В этом протоколе образцы цельной крови здоровых взрослых добровольцев будут обработаны и облучены in vitro, чтобы проиллюстрировать использование автоматизированного и чувствительного анализа очагов γ-H2AX для применения в биодозиметрии. Используется автоматизированная система сканирования слайдов и платформа анализа со встроенным флуоресцентным микроскопом, что позволяет быстро и автоматически оценивать ДНК DSB с уменьшенной степенью смещения.
Введение
С момента своего открытия ионизирующее излучение (ИК) стало незаменимым инструментом в современных медицинских и промышленных практиках, а также в сельскохозяйственных и военных применениях. Тем не менее, широкое использование ИК также увеличивает риск чрезмерного воздействия радиации как для профессиональных работников радиации, так и для представителей общественности. ИК является хорошо известным физическим канцерогеном, который может вызывать повреждение ДНК прямым или косвенным образом, что приводит к значительным рискам для здоровья 1,2. Поэтому важно выполнить оценку дозы, так как степень облучения формирует важный начальный этап в управлении радиационной аварией 1.
В случае крупномасштабных ядерных или радиологических аварийных ситуаций количество оценок дозы, которые необходимо выполнить, может варьироваться от нескольких до тысяч человек в зависимости от размера аварии3. В этих сценариях физическая дозиметрия также может быть неоднозначной (например, если дозиметр не носится должным образом) или недоступной, когда участвуют представители общественности. Хотя клинические симптомы могут быть использованы для сортировки, они не обязательно являются радиационно-специфическими и могут привести к ложному диагнозу. Поэтому целесообразно использовать биологическую дозиметрию наряду с физической дозиметрией и клиническими оценками. Этот метод позволяет анализировать радиационно-индуцированные изменения на клеточном уровне и позволяет однозначно идентифицировать облученных лиц, нуждающихся в медицинском лечении4. Затем врач может использовать эту биологическую оценку дозы для дополнения реконструкций физической дозы и других клинических диагнозов, чтобы назначить соответствующую медицинскую помощь5. Потребность в биологической дозиметрии будет особенно высока для сортировки и медицинского управления жертвами, когда сценарий воздействия не очень хорошо известен и когда жертвы являются представителями общественности. Основная цель сортировки состоит в том, чтобы эффективно отличить «обеспокоенных» лиц, которые могли иметь продромальные симптомы, но которые не получили высокую дозу, от лиц, подвергшихся воздействию, нуждающихся в немедленной медицинской помощи и специализированной помощи. Пороговый уровень дозы облучения, который может вызвать лучевую болезнь, составляет примерно 0,75 - 1,00 Гр. Тогда те лица, которые получают > 2 Гр облучения, подвергаются более высокому риску острого лучевого синдрома и должны получить оперативное медицинское лечение6,7. Важнейшее значение имеют своевременные и точные оценки биологических доз для жертв, оказавшихся под перекрестным огнем таких бедствий. Кроме того, он также может успокоить и успокоить минимально подверженных воздействию жертв8.
Органы радиационной защиты используют различные биодозиметрические маркеры, которые в основном основаны на обнаружении цитогенетических повреждений, таких как дицентрические хромосомы или микроядра, в культивируемых лимфоцитах человека9. Обнаружение цитогенетических повреждений также может быть выполнено с помощью флуоресцентной гибридизации in situ (FISH) транслокационного анализа10. Однако основным недостатком обычных цитогенетических методов является длительное время обработки для получения результатов в аварийной ситуации8.
Одним из самых ранних этапов в процессе распознавания ДНК DSB является фосфорилирование гистонового варианта H2AX, приводящее к образованию γ-H2AX и последующему набору факторов репарации. За последнее десятилетие обнаружение радиационно-индуцированных γ-H2AX очагов в лимфоцитах периферической крови с помощью иммунофлуоресцентной микроскопии получило все большее внимание как надежный биологический дозиметрический инструмент11,12,13,14,15. В зависимости от качества излучения и типа ячейки максимальный выход очагов γ-H2AX выявляется в течение 0,5 - 1 ч после облучения16,17. Предполагается, что существует тесная корреляция между количеством ДНК DSB и γ-H2AX очагов, а также между исчезновением очагов и репарацией DSB. Эксперименты с лазерными ножницами с импульсным лазерным микролучом продемонстрировали, что очаги γ-H2AX локализуются на участках ДНК DSB18. Хотя это остается темой активных дебатов, в одном из самых ранних исследований со 125я предложил корреляцию один к одному между рассчитанным числом распадов на клетку (репрезентативным для числа радиационно-индуцированных ДНК DSB) и количеством γ-H2AX очагов, которое было оценено19,20.
За последнее десятилетие Европейский союз финансировал проекты MULTIBIODOSE (Многопрофильные биодосиметрические инструменты для управления крупномасштабными радиологическими авариями) и RENEB (Реализация Европейской сети биодозиметрии) для создания устойчивой сети в биологической и ретроспективной дозиметрии21,22. Этот проект включал в себя различные лаборатории по всей Европе для оценки возможностей реагирования на чрезвычайные ситуации в случае радиационной аварийной ситуации.14,21,22. Анализ γ-H2AX имеет ряд значительных преимуществ, таких как быстрое время обработки, потенциал для пакетной обработки, обеспечивающий высокую пропускную способность, а также его высокая чувствительность при использовании в течение нескольких часов после воздействия13,23,24. Высокая чувствительность анализа в диапазоне низких доз привела к ряду исследований, в которых анализ очагов γ-H2AX использовался в качестве индикатора влияния медицинского радиационного облучения, как в лучевой терапии, так и в диагностических приложениях визуализации.25,26,27,28,29,30. Эти характеристики делают анализ очагов γ-H2AX высококонкурентной альтернативой другим методам ранней сортировки при крупных ядерных авариях для отделения критически уязвимых лиц от лиц с низким риском. Несколько экспериментов по оптимизации показали, что можно выполнить анализ очагов γ-H2AX с небольшими объемами крови, например, исследование Moquet et al., которые сообщили, что можно выполнить анализ очагов γ-H2AX только каплей крови (укол пальца).31. Аналогичный подход был использован при разработке полностью автоматизированной высокопроизводительной системы RABIT (Rapid Automated Biodosimetry Tool), которая была оптимизирована для измерения выходов γ-H2AX из образцов крови, полученных с помощью пальцев.32,33. В целом, результаты сравнительных исследований MULTIBIODOSE и RENEB показывают, что анализ очагов γ-H2AX может быть очень полезным инструментом сортировки после недавнего (до 24 часов) острого радиационного облучения.12,13,14. В сравнительном исследовании с диапазоном низких доз доза может быть отличима от контрольных образцов с фиктарным облучением, что подчеркивает чувствительность анализа в диапазоне низких доз.34. Важно отметить, что высокая чувствительность анализа особенно актуальна для лимфоцитов, что делает их одним из наиболее подходящих типов клеток для оценки воздействия низких доз. Лимфоциты в основном являются нециклическими клетками и представляют собой синхронную популяцию. Последний позволяет избежать экспрессии γ-H2AX связан с репликацией ДНК, что значительно снижает чувствительность анализа к обнаружению радиационно-индуцированного DSB во время G2 и S-фазы клеточного цикла.35. Помимо своей чувствительности к низким дозам для лимфоцитов, время обработки γ-H2AX фокусного анализа значительно быстрее, чем цитогенетических методов, таких как дицентрический и микроядерный анализ, поскольку он не требует стимуляции лимфоцитов. Поэтому результаты можно получить в течение нескольких часов по сравнению с парой дней для цитогенетических методик. Основным недостатком анализа является быстрое исчезновение сигнала очагов γ-H2AX, который обычно снижается до исходных уровней в течение нескольких дней после радиационного облучения в зависимости от кинетики репарации ДНК.36. Поэтому наиболее подходящим применением анализа в контексте биодозиметрии является первоначальная сортировка и приоритизация более трудоемкого наблюдения за цитогенетической биологической дозиметрией для определенных жертв. Однако для точной ретроспективной биодозиметрии и долгосрочных эффектов приходится полагаться на цитогенетические методы, такие как трехцветные анализы FISH для обнаружения стабильных хромосомных аберраций в случае, если воздействие имело место несколько лет назад.10.
В рамках нескольких инициатив в области биодозиметрии были проведены многочисленные анализы для целей сортировки рядом с анализом очагов γ-H2AX для сортировки людей в крупномасштабных радиологических чрезвычайных ситуациях; такие как анализ дицентриков, анализ блока цитокинеза микроядер, электронный парамагнитный резонанс (ЭПР), анализ сывороточного белка (SPA), анализ кожных пятен (SSA), оптически стимулированная люминесценция (OSL), а также анализ экспрессии генов 37,38. Анализ очагов γ-H2AX может быть использован количественно для оценки формирования и репарации ДНК DSB39. Однако анализ зависит от времени, так как уровень фокусов γ-H2AX изменяется со временем после облучения из-за кинетики репарации ДНК DSB40. Сравнительное исследование показало, что микроскопическая оценка с z-ступенчатой емкостью дает наиболее точные результаты после 1 Гр облучения, в то время как проточная цитометрия дает надежные результаты только при более высоких дозах IR41. Существует множество сообщений о разработке решений для анализа изображений для использования в автоматизированном подсчетебаллов 42,43,44,45,46. В этом протоколе автоматизированная высокопроизводительная платформа флуоресцентной микроскопии используется для анализа очагов γ-H2AX в лимфоцитах периферической крови. Использование автоматической системы подсчета баллов позволяет избежать как межлабораторного, так и межнаблюдательного смещения, в то время как она по-прежнему обеспечивает достаточную чувствительность для обнаружения доз ниже 1 Гр47. Основным преимуществом этой системы по сравнению с бесплатным программным обеспечением с открытым исходным кодом для оценки фокусов является тот факт, что весь процесс от сканирования слайдов до захвата и оценки автоматизирован. Концепция определяемых пользователем и хранимых классификаторов гарантирует воспроизводимость, которая добавляет объективную степень качества к результатам. Таким образом, эта работа иллюстрирует, как результаты фокусов γ-H2AX могут быть получены с использованием автоматизированного метода микроскопического сканирования и оценки, который может быть использован, когда образцы крови от потенциально чрезмерно подвергшихся воздействию лиц получают радиобиологические лаборатории для целей биологической дозиметрии.
протокол
Это исследование было одобрено Комитетом по этике биомедицинских исследований Комитета по этике Университета Западной Капской провинции - Кодекс BM18/6/12.
1. Приготовлениерастворов 48
- Раствор для фиксации клеток (3% PFA в PBS)
- Носите соответствующие средства индивидуальной защиты (СИЗ) и, работая в вытяжке, добавьте 20 г параформальдегида в 200 мл дистиллированногоH2O.Нагрейте смесь до 60 °C, чтобы способствовать растворению.
- Как только PFA растворится, добавьте 40 капель 5 N NaOH осторожно в течение 30 минут и охладите до комнатной температуры. Приспособить к рН 7 с использованием 1 M HCl и составить до конечного объема 250 мл с дистиллированнымH2O(аликвоты могут храниться при -20 °C в течение 1 года). Добавьте 25 мл из этого раствора в 41,7 мл PBS, чтобы получить 3% раствор PFA.
- 1% раствор бычьего сывороточного альбумина (BSA): Добавьте 10 г BSA к 1000 мл PBS и перемешайте до растворения. Хранить при температуре 4 °C до использования (максимум 72 часа).
- Раствор Тритон-Х в концентрации 1:500: Добавьте 1 мкл Тритона-Х до 500 мкл PBS, храните при 4 °C до использования (максимум 24 часа).
- Растворы антител
- Первичное антитело - Анти-γ-H2AX в концентрации 1:500: Добавляют 1 мкл анти-γ-H2AX к 500 мкл 1% раствора BSA, хранят при 4 °C до использования (максимум 24 часа).
- Вторичное антитело - DAM-TRITC в концентрации 1:1000: Добавляют 1 мкл DAM-TRITC к 1000 мкл 1% раствора BSA, хранят при 4 °C до применения (максимум 24 часа).
- Полный Мемориальный институт Розуэлл Парк (cRPMI) Медиа
- Добавьте фильтрованную фетальную бычью сыворотку (FBS) и пенициллин-стрептомицин в среду RPMI 1640 в стерильной бутылке, чтобы получить конечную концентрацию 10% FBS и 1% пенициллина-стрептомицина.
2. Подготовка образцов
ПРИМЕЧАНИЕ: Для этого протокола образцы периферической цельной крови собираются путем венипункции в литий-гепариновых сборных пробирках у здоровых взрослых добровольцев (с информированного согласия - BM18/6/12 Комитет по этике биомедицинских исследований Комитета по этике Университета Западной Капской провинции). Перед началом убедитесь, что кровь и плотность среды 1,077 г/мл акклиматизированы к комнатной температуре.
- В подготовленном шкафу биобезопасности разводят периферическую цельную кровь в объеме 1:1 с PBS и аккуратно наслаивают разбавленную кровь на равный объем до двухтомной среды плотностью 1,077 г/мл. Важно постепенно наслаивать кровь на среду плотности, удерживая трубку наклоненной под углом 45°, следя за тем, чтобы кровь и плотность среды не смешивались.
- Осторожно перенесите суспензию в центрифугу и вращайте при 900 х г в течение 20 минут. После этого пипеткой «мутный» слой только до новой стерильной конической трубки и заполняют трубку PBS и центрифугой в течение 10 минут при 1000 х г. После этого аспирируйте супернатант пипеткой, соблюдая осторожность, чтобы не потревожить гранулу, осторожно повторно суспендируйте гранулу PBMC в 1 мл PBS и заполните трубку PBS.
- Повторите описанный выше шаг стирки еще два раза, чтобы получить в общей сложности три стирки.
- Подсчитайте количество PBMCs с помощью гемоцитометра, зная, что каждый мл периферической крови от взрослого донора приведет к приблизительному среднему значению 1 - 1,5 х 106 PBMCs49. После подсчета разводят гранулу ПБМК до концентрации 8 х 105 лимфоцитов в 1 мл цРБМИ. Затем добавляют приблизительно 2 х 106 PBMCs или 2,5 мл из изолированного раствора PBMC в стерильную коническую трубку для облучения.
3. Облучение образцов
ВНИМАНИЕ: Обращайтесь с радиационной установкой в соответствии с руководящими принципами радиационной защиты и всегда носите физический дозиметр. Убедитесь, что используемая система облучения откалибрована и настроена таким образом, чтобы были достигнуты правильные ожидаемые дозы.
- Облучайте НБМК при комнатной температуре с помощью источника 60Co. Калибровка (протокол TRS-398) с камерой Farmer 117, для которой калибровочный коэффициент камеры получен от Национального института метрологии Южной Африки (NMISA)50.
- Для этого анализа поместите конические трубки между акриловым листом диаметром 5 мм (используемым для наращивания входа в балку) и материалом обратного рассеяния 50 мм с текущей мощностью исходной дозы 60Co 0,57 Гр / мин для однородного размера поля 300 мм × 300 мм при расстоянии от источника до поверхности 750 мм.
- Облучайте НБМК градуированными дозами 0,125, 0,500, 1,000, 1,500 и 2,000 Гр и храните фиктивные облученные контрольные образцы в диспетчерской, получая только облучение окружающей среды.
- Инкубировать облученные образцы в течение 1 часа при 37 °C в увлажненном 5% CO2 инкубаторе для достижения максимального количества очагов γ-H2AX.
ПРИМЕЧАНИЕ: Время инкубации может быть изменено в соответствии с экспериментальным дизайном.
4. Подготовка слайдов
ПРИМЕЧАНИЕ: См. рисунок 1 для настройки слайдов.
- Подготовьте 3 слайда (технические повторы) с помощью слайдов, покрытых положительно заряженной поверхностью, чтобы улучшить адгезию к состоянию облучения (или к конической трубке). Поместите слайд в держатель зажима, добавьте поверх него карту фильтра и, наконец, воронку. Закрепите зажимы для слайдов и поместите в цитоцентрифугу.
- Добавьте 250 мкл клеточной суспензии в воронку (200 000 клеток на слайд) и вращайте в течение 30 х г в течение 5 минут с помощью цитоцентрифуги.
- После цитоцентрифугирования извлеките слайд из держателя зажима и с помощью гидрофобной ручки проведите круг вокруг пятна с клетками, чтобы сохранить иммунофлуоресцентное пятно на связанных клетках во время процесса окрашивания.
5. Фиксация и иммунофлуоресценция окрашивания γ-H2AX
ПРИМЕЧАНИЕ: Все растворы осторожно добавляются непосредственно на область ячейки, которая отмечена гидрофобным кругом. Окрашивающие растворы дозируются немного выше слайда, не позволяя кончику пипетки разрушить клетки. Решения НЕ добавляются ко всему слайду.
- Зафиксируйте слайды в свежеприготовленном 3% PFA в течение 20 минут.
ПРИМЕЧАНИЕ: Слайды могут храниться в PBS, содержащем 0,5% PFA при 4 °C, в течение максимум 2 дней до проведения иммуноокрашивания. После этого промыть слайды в банке Коплина с PBS в течение 5 минут, затем покрыть клетки 100 мкл холодного раствора Тритона-Х в течение 10 минут, чтобы обеспечить пермеабилизацию. - Опрокиньте раствор Triton-X на папиросной бумаге и трижды вымойте слайды в 1% растворе BSA в течение 10 минут. Это делается для предотвращения нежелательного фона путем блокирования связывания неспецифических антител.
- Инкубировать слайды при комнатной температуре со 100 мкл разбавленного 1:500 первичного антитела против γ-H2AX в течение 1 часа в увлажняющей камере, что легко достигается путем добавления влажной папиросной бумаги к основанию прямоугольного ящика для хранения слайдов.
- Отложите раствор антител на папиросной бумаге и выполните три промывки 1% раствором BSA в течение 10 минут в банке Коплина, чтобы удалить несвязанное первичное антитело и предотвратить неспецифическое связывание вторичного антитела.
- Инкубировать слайды со 100 мкл разбавленного 1:1000 раствора вторичных антител DAM-TRITC в течение 1 часа в увлажняющей камере. Отложите раствор антител на папиросной бумаге и трижды вымойте слайды в PBS в течение 10 минут.
- Наконец, высушите горки за пределами гидрофобного круга мягкой, свободной от пыли папиросной бумагой и добавьте 1-2 капли DAPI, разрешенные в водной монтажной среде, и аккуратно накройте горку крышкой 24 x 50 мм, гарантируя, что нет захваченных пузырьков воздуха, и поместите в холодильник при температуре 4 °C на ночь. Слайды можно хранить при температуре 4 °C в течение максимум 2 недель перед сканированием.
6. Автоматическое сканирование и озвучивание слайдов
ПРИМЕЧАНИЕ: Система сканирования должна иметь флуоресцентный микроскоп, ПЗС-камеру высокого разрешения (заряженное связанное устройство), подключенную к захватчику кадров для оцифровки видеоизображений в режиме реального времени, сцену сканирования, трекбол для ручных движений, 3D-мышь, быстрый ПК и монитор, а также жесткий диск для архивирования(рисунок 2).
- Настройка классификатора
ПРИМЕЧАНИЕ: Классификатор представляет собой набор параметров, определяющих, как система обнаруживает ячейки. Это результат обучения на основе предварительно классифицированных полей изображения. Классификатор специфичен для увеличения микроскопа, типа клетки и лаборатории. Поэтому классификаторы могут потребовать изменения следующих параметров для их адаптации к текущим условиям. Рекомендуется протестировать настройки с помощью эталонного слайда перед оценкой.- Получение изображения: используйте 40-кратный сухой объектив для визуализации. Для достижения сопоставимого качества изображения во всех ячейках установите время интеграции камеры в автоматический режим. Установите максимальное время интеграции не менее 1 секунды для обоих цветовых каналов (коэффициент усиления камеры 4,0). Сигнальный канал приобретается с 10 плоскостями фокусировки и 14/40 мкм между плоскостями.
- Выбор клеток: обнаруживаются PBMCs в диапазоне 20,00мкм2 и 76,00мкм2. Установите максимальную глубину вогнутости равным 0,05, а максимальное соотношение сторон — 1,4. Установите пороговое значение относительного уровня серого равным 20%.
- Обработка ячеек: обработка канала счетчика DAPI с максимальным алгоритмом гистограммы для уменьшения фона. Сигнальный канал обрабатывается фильтром TopHat (сила 7, коэффициент сглаживания 0) для уменьшения фона и усиления сигналов.
- Подсчет сигналов: подсчет фокусов с помощью функции «Количество объектов» устройства. Чтобы избежать ложноположительной оценки оставшихся фоновых сигналов, учитываются только те сигналы, которые показывают не менее 30% интенсивности по сравнению с самым ярким объектом в клетке.
- Вставьте/поместите слайды на автоматизированную сканирующую платформу или слайд-сцену после тщательной очистки 70% этанолом, чтобы удалить пыль.
- Настройка слайдов - Открыть диалоговое меню настройки слайда (Рисунок 3)
- Выберите правильный путь к данным,который указывает, где хранятся файлы слайдов, полученные в результате поиска.
- Присвойте слайду имя, каждому слайду должно быть присвоено уникальное имя. Если серия слайдов введена в виде перечисленного списка, '?' можно использовать в качестве подстановочного знака для номера слайда.
- Выберите соответствующий классификатор, как описано в разделах 1.1 - 1.4(рисунок 4).
- Выберите Окно поиска и выберите Предопределено, если существует определение окна поиска, соответствующее кругу ячеек цитоцентрифуги, выберите соответствующее определение в столбце Размер или выберите Вручную, если нет предопределенного определения окна поиска. В этом случае столбец Размер не нужно задавать.
- Выберите Максимальное количество ячеек и добавьте максимальное количество ячеек, необходимое для сканирования. Поиск завершается, даже если выбранное окно поиска еще не было полностью отсканировано, как только достигнуто максимальное количество ячеек. Для применения в биодозиметрии достаточно автоматического подсчета 1000 клеток на слайд, учитывая, что подготовлено 3 слайда на образец крови. Нажмите кнопку ОК, чтобы подтвердить настройки.
- Настройка сканирования слайдов
- Нажмите кнопку Поиск на боковой панели. Если при настройке слайда была выбрана настройка Manual Search Window, откроется диалоговое окно, позволяющее определить область сканирования(рисунок 5). С помощью цели 10x выберите прямоугольную область поиска на слайде в интерактивном режиме, зафиксировав два угла поля поиска щелчком мыши левой кнопкой мыши. Это можно подтвердить с помощью кнопки OK. Если окно поиска ссылается на предопределенное окно поиска, этот шаг будет опущен.
- Пользователю будет предложено настроить начальное положение фокуса. Затем эталонный объект будет выбран автоматически, программное обеспечение предложит пользователю сфокусировать и центрировать опорное ядро (используя цель 40x) для каждого слайда и подтвердить настройки с помощью OK. Система автоматически перейдет ко всем слайдам последовательно. При необходимости отрегулируйте Live Image Setup - Integration Time для этого шага(рисунок 5).
- Проверьте все настройки микроскопа и подтвердите системный запрос с помощью OK. Система запустит автоматизированную процедуру фокусировки и сканирования. После завершения сканирования данные сохраняются на компьютере для анализа. Система сканирования автоматически отключается после завершения сканирования.
ПРИМЕЧАНИЕ: Убедитесь, что рычаг трубки микроскопа находится в положении, которое отводит весь свет на камеру. - Search End, поиск прекращается, если весь поиск был отсканирован, если достигнуто максимальное количество ячеек или если поиск был отменен.
- Анализ слайдов
ПРИМЕЧАНИЕ: Завершенное сканирование представлено на рисунке 6.- После завершения сканирования нажмите кнопку Галерея на боковой панели. Просмотрите галерею, которая состоит из небольших изображений обнаруженных клеток. В этом окне(рисунок 7)укажите, будут ли ячейки, хранящиеся в галерее, по критерию выбираться из выпадающего меню. Клетки обычно отображаются в том порядке, в котором они были обнаружены.
- Нажмите на Диаграмму гистограммы качества / значения признаков (рисунок 8),чтобы дать распределение измерения качества для обнаруженных клеток, а также средние значения и стандартное отклонение оцениваемых очагов.
Результаты
Для этого протокола мононуклеарные клетки периферической крови человека (PMBC) были выделены из цельной крови четырех здоровых взрослых добровольцев и подвергались воздействию доз радиации 0,125, 0,250, 0,500, 1000 и 2000 Гр. После этого образцы инкубировали в течение 1 часа при 37 °C в увлажненном 5% CO2 инкубаторе. После фиксации и иммунофлуоресцентного окрашивания слайды автоматически сканируются и оцениваются. Рисунки 6,7 и 8 дают представление о том, что программное обеспечение выводит пользователю. После завершения сканирования появляется окно анализа, дающее обзор оцененных очагов. Галерея дает все фокусы, оцененные с помощью интерактивного меню, которое может удалять выбросы и, наконец, дается гистограмма с подробной сводкой данных.
Выход γ-H2AX после воздействия γ-лучей представлен на фиг.9. Наблюдалось постепенное увеличение количества очагов γ-H2AX с увеличением дозы. Этот график не только иллюстрирует дозовую зависимость и чувствительность анализа, но и может быть использован для оценки дозы, когда образец получен от человека, который подвергся воздействию неизвестной дозы. Важно отметить, что у этого человека не будет фиктивного облученного контроля или фоновых очагов. Таким образом, рисунок 9 включает значение 0 Гр контрольных образцов с фиктарным облучением, которое составило 0,57 ± 0,23 Гр для четырех взрослых доноров в этом исследовании.

Рисунок 1: Подготовка слайдов для цитоцентрифугирования. Поместите слайд в держатель зажима, добавьте поверх него карту фильтра и, наконец, воронку. Закрепите зажимы для слайдов и поместите в цитоцентрифугу. После цитоцентрифугирования снимите слайд с держателя зажима и нарисуйте круг вокруг пятна с помощью клеток с помощью гидрофобной ручки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Автоматизированная сканирующая платформа, которая использовалась в этом протоколе, содержащая автоматический сканер, прикрепленный к флуоресцентному микроскопу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
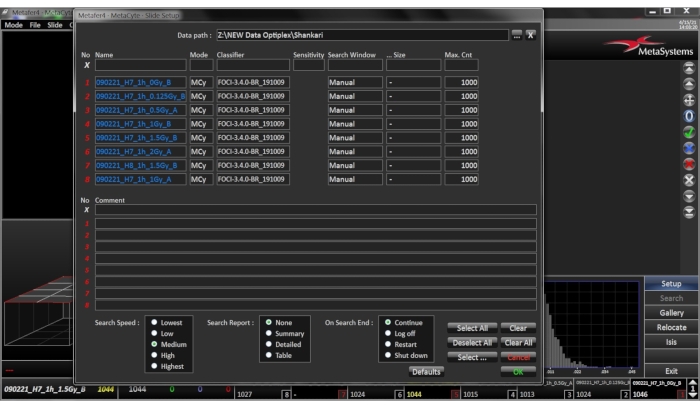
Рисунок 3:Меню для настройки слайдов. Откройте диалоговое окно, нажав кнопку SETUP на боковой панели. Выберите или введите целевой каталог для результирующих файлов Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
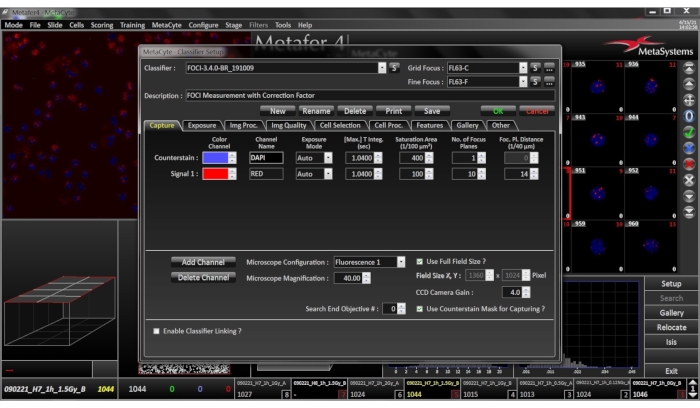
Рисунок 4:Меню настройки классификатора. Убедитесь, что выбранные параметры классификатора соответствуют текущему типу ячейки, условиям подготовки и шаблонам окрашивания образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Меню настройки для окна ручного поиска. Окно было выбрано при настройке слайда; откроется диалог, позволяющий определить область сканирования. С помощью цели 10x прямоугольная область поиска на слайде выбирается в интерактивном режиме путем фиксации двух углов поля поиска щелчком мыши левой кнопкой мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
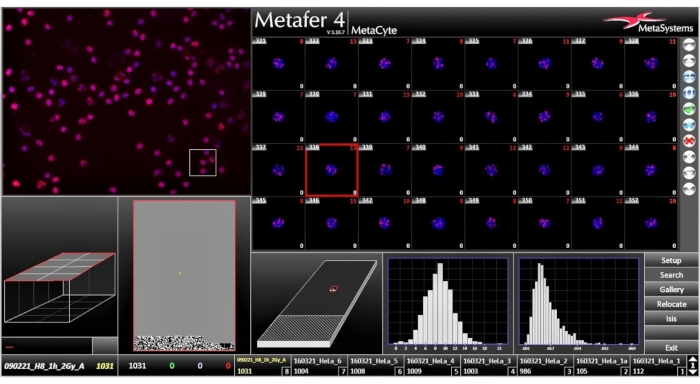
Рисунок 6:Окно анализа, после завершения сканирования в окне анализа отображаются результаты сканирования. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
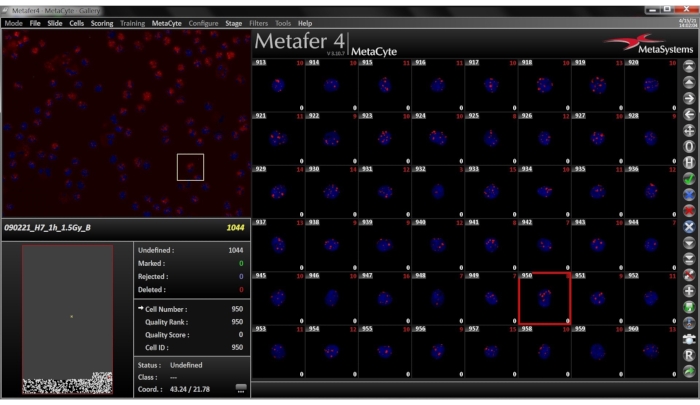
Рисунок 7:Вид галереи для выбранного слайда. Вкладка Галерея находится на боковой панели. Галерея изображений состоит из небольших изображений обнаруженных ячеек, отображаемых в виде комбинированного изображения DAPI-TRITC. В левом и правом нижнем углу каждого изображения отображается прямое количество фокусов и скорректированное количество фокусов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 8:Изображения гистограммы для выбранного слайда. Это окно открывается щелчком правой кнопкой мыши по гистограмме. Нажимая на гистограмму, лист вкладки гистограммы предоставляет сводку данных, в которой перечислены среднее, стандартное отклонение, коэффициент вариации, минимальные, максимальные и медианные значения анализируемых ячеек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
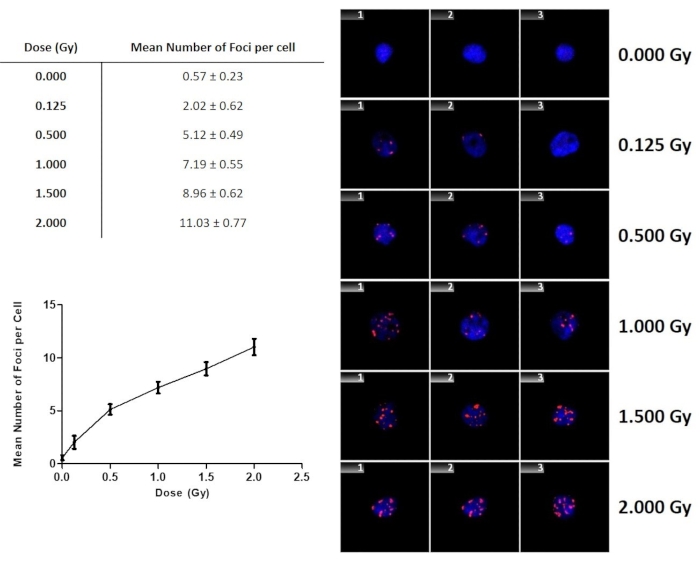
Рисунок 9:Количество очагов γ-H2AX в зависимости от дозы для лимфоцитов, подвергшихся воздействию 60Co γ-лучей. Полосы ошибок представляют собой стандартные отклонения, представляющие межиндивидуальные различия среди доноров. Данные представляют собой среднее число очагов γ-H2AX ± стандартным отклонением четырех здоровых добровольцев. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол описывает пошаговую процедуру автоматизированного анализа фокусов γ-H2AX на основе флуоресцентной микроскопии. Он иллюстрирует полезность анализа фокусов в качестве эффективного по времени метода анализа количества радиационно-индуцированной ДНК DSB в лимфоцитах периферической крови для выполнения оценки биологической дозы в сценарии радиационной аварии, где люди могут подвергаться воздействию неизвестных уровней ИК.
В этом конкретном протоколе НБМК облучались in vitro, чтобы имитировать радиационное воздействие in vivo. После того, как облучение и время инкубации в один час завершено, слайды делаются с использованием цитоцентрифуги для создания точки концентрации клеток на слайде. Использование цитоцентрифуги имеет жизненно важное значение для достижения стандартизированных условий для автоматизированного подсчета баллов. После завершения гидрофобная ручка используется для создания круга вокруг клеток, чтобы уменьшить потери реагентов, позволяя пользователю локализовать окрашивающие реагенты. Этот тип ручки может быть использован в различных методах иммуноокрашивания, таких как парафиновые срезы, замороженные срезы и цитологические препараты. Кроме того, важно выбрать гидрофобную ручку, которая совместима с ферментными и флуоресцентными системами обнаружения. После подготовки слайдов произошло окрашивание фиксации и иммунофлуоресценции γ-H2AX. В этом протоколе клетки фиксируются с помощью 3% PFA в растворе PBS в течение 20 минут. Для успешного иммуноокрашивания важно, чтобы морфология клеток сохранялась и чтобы антигенные участки были доступны для используемых реагентов обнаружения. PFA является относительно мягким агентом для фиксации и стабилизации клеток при сохранении белковых структур51. Оптимизационные эксперименты с более высокими концентрациями PFA и более длительным временем фиксации привели к негативному влиянию на качество слайда, но дальнейшее хранение (в течение ночи) в 0,5% PFA до 24 часов дало хорошие результаты.
Первичное моноклональное антитело 2F3, используемое в этом протоколе, реагирует с гистоновым вариантом H2AX при фосфорилировании в серине 139 после индукции ДНК DSB. Антитело способно связываться с фосфорилированным остатком без перекрестной реактивности с другими фосфорилированными гистонами52. Поскольку это первичное моноклональное антитело мыши, вторичное антитело было выбрано против вида хозяина первичного антитела при выращивании в альтернативном хозяине, а именно ослик-анти-мышь (DAM)-TRITC. В то время как иммунофлуоресцентное окрашивание основано на специфическом связывании антитела с эпитопом, несколько межмолекулярных сил также могут привести к неспецифическому фоновому окрашиванию. Для того чтобы уменьшить неспецифическое связывание, важно использовать блокирующий реагент в протоколах иммунофлуоресцентного окрашивания53; мы использовали решение BSA. Кроме того, достаточное время должно быть выделено для этой стадии блокировки, оставляя слайды в растворе по крайней мере за 20 минут до первичного и вторичного окрашивания антител. Кроме того, раствор BSA также следует использовать в качестве разбавителя для первичных и вторичных антител. В зависимости от анти-γ-H2AX и вторичного антитела, которое используется для окрашивания, следует рассмотреть возможность тестирования различных разведений антител, чтобы определить оптимальную концентрацию. Для более точного подсчета баллов может быть проведено двойное окрашивание, путем добавления дополнительных антител к белкам репарации ДНК DSB.
Основным недостатком этого типа анализа является необходимость получения образцов крови как можно скорее после воздействия, так как максимальное количество очагов, как известно, уменьшается до нормального уровня в течение 48 часов после облучения. Поэтому, когда известно время радиационной аварии и последующего забора крови, может быть полезно работать с различными калибровочными кривыми, которые были установлены в разные моменты времени после облучения in vitro (например, 4, 8, 12 и 24 часа). Однако, как уже упоминалось во введении к рукописи, сила анализа очагов γ-H2AX заключается в начальных, быстрых целях сортировки, и его следует использовать для приоритизации более трудоемкой цитогенетической биологической дозиметрии. Комбинированный сценарий, в котором несколько биодозиметрических биомаркеров используются параллельно, позволит получить наиболее надежную оценку дозы, и различные биодозиметрические лаборатории во всем мире объединили усилия для создания общенациональных сетей, которые могут быть активированы и использованы для обеспечения множественных параллельных оценок биодозиметрии лабораториями с различным опытом37,54,55 . Кроме того, продолжаются разработки по сверхбыстрому анализу, такие как мобильная лаборатория на месте аварии56или рядом с ним. Постоянно разрабатываются новые, перспективные методы биодозиметрии, которые, как мы надеемся, приведут к еще более быстрой и надежной пропускной способности в будущем57.
Для автоматизированной системы анализа изображений слайды вставляются или размещаются на автоматизированной сканирующей платформе или слайд-сцене. После этого присвойте имя и сохраните сведения о слайде в соответствующей папке на подключенном компьютере. Для этого эксперимента автоматическое обнаружение ядер и очагов основано на соответствующих настройках классификатора. При создании классификатора убедитесь, что выбранные настройки классификатора соответствуют текущему типу клетки, условиям приготовления и иммунофлуоресцентному окрашиванию образца. В классификаторе установлены соответствующие флуоресцентные каналы, соответствующие спектру возбуждения первичных и вторичных антител. Классификатор позволяет при необходимости задавать дополнительные параметры оценки (например, размер ядра, интенсивность флуоресценции, как описано в разделе 6.1). Если два или более белка репарации ДНК (например, γ-H2AX и 53BP1) объединены в эксперименте, система также способна обнаруживать колокализации сигналов. Во-первых, система получает изображения DAPI, применяет обработку изображений и идентифицирует ядра, используя морфологические критерии, заданные в классификаторе. Сигналы TRITC принимаются с помощью 10 z-стеков с размером шага 0,35 мм между фокальными плоскостями47. Классификатор использовал Direct Foci Count, где оценивается количество различных сигналов TRITC в ядре. Здесь важно учитывать, что с увеличением дозы излучения сигналы фокусов имеют тенденцию сливаться в более крупные объекты, что приводит к недооценке фактического числа очагов, если объекты подсчитываются напрямую. Это не требовалось для анализа, описанного здесь, но для решения этой проблемы может быть реализован дополнительный шаг с Corrected Foci Count. Последнее позволяет системе получать размеры обнаруженных сигналов и взвешивать их соответствующим образом. Использование обоих методов подсчета может обеспечить более реалистичную оценку фактического количества очагов при более высоких дозах.
Чтобы начать автоматическое сканирование, область сканирования определяется с помощью 10-кратного объектива микроскопа, чтобы сделать прямоугольную область поиска путем фиксации двух углов поля поиска левым щелчком мыши (Рисунок 5), с последующей фокусировкой стартовой позиции. Ссылочный объект выбирается автоматически, и программное обеспечение предлагает пользователю сфокусировать и центрировать опорное ядро (используя цель 40x) для каждого слайда. После начала поиска система переместится в центр окна поиска первого выбранного слайда и запросит центрирование и фокусировку эталонного объекта. Этот объект позже будет использоваться в качестве ссылки на положение для исправления любого сдвига в положениях ячейки. Вторым назначением опорного поля является автоматическая регулировка освещения, в режиме пропускаемого света свет регулируется до достижения оптимального уровня освещенности. В режиме флуоресценции уровень освещенности фиксирован, но время интеграции ПЗС-камеры может быть увеличено до тех пор, пока не будет измерен требуемый сигнал. Чтобы обеспечить правильную регулировку освещения, ссылка должна содержать объекты с типичным окрашиванием. Важно не использовать поле, в котором есть артефакты с очень высокой интенсивностью окрашивания. После регулировки освещенности система запускает автофокус сетки в позиции сетки, ближайшей к опорному полю. Он продолжает фокусировать поля на обычной сетке, двигаясь в меандре к передней и задней части окна поиска. Сканирование начинается после завершения автофокусировки сетки. Этап перемещается в поле за полем шаблона меандра для сбора данных. При обнаружении ячейки ее положение и изображение галереи сохраняются и отображаются на экране, а количество ячеек обновляется. При возникновении ошибки микроскопа, ступени или фидера поиск автоматически отменяется. Единственный шаг, на котором происходит ручное вмешательство со стороны оператора, - это настройка сканирования слайдов. Это также точка, где происходит быстрая проверка качества (пузырьки воздуха, низкие номера ячеек, выцветание артефактов окрашивания флуоресцентного сигнала) и где может быть решено прервать сканирование слайда низкого качества. Поиск прекращается, если весь слайд был отсканирован, если достигнуто максимальное количество ячеек или если поиск был отменен. После завершения сканирования данные представляются так, как показано в Рисунок 6. Для просмотра отсканированных ячеек открывается окно Галерея и можно просмотреть каждую ячейку (Рисунок 7). Это еще одна точка, где оператор может выполнять контроль качества, проверяя фокус изображений галереи и общее количество ячеек, которые были оценены. Если слишком много клеток находится вне фокуса или система обнаружила слишком мало клеток, чтобы сделать реалистичную оценку дозы (например, 100 клеток вместо предполагаемых 1000 клеток), то должно быть принято решение исключить слайд и автоматическую оценку из окончательной оценки. Все данные обобщаются в гистограммах (Рисунок 8), вместе с информацией о распределении, средствах и стандартном отклонении очагов, набранных для каждой ячейки. Гистограммы также могут быть использованы для выбора и отображения субпопуляций ядер на основе автоматизированных результатов для обзора. Статистический анализ результатов проводится после того, как распределение, среднее и стандартное отклонение числа очагов на клетку были записаны вручную. График может быть использован в качестве калибровочной кривой для оценки дозы биодозиметрического образца. Это можно сделать, используя уравнение линии тренда, чтобы сделать приблизительную оценку полученной дозы. Сверх того Рисунок 9 иллюстрирует, что автоматизированное сканирование достаточно чувствительно для обнаружения очагов, индуцированных при низких дозах. Кроме того, результаты показывают четкое линейное увеличение количества очагов на клетку с дозой. Следует отметить, что результаты являются репрезентативными только для используемого классификатора, результаты будут отличаться для разных параметров классификатора. Поэтому в случае биодозиметрического анализа важно, чтобы для биодозиметрических образцов использовался тот же классификатор и подготовка слайдов, что и те, которые использовались для установления калибровочной кривой, которая используется для выполнения оценки дозы. Хотя это вышло за рамки данного исследования, важно отметить, что анализ очагов γ-H2AX также может быть использован для определения частичного облучения тела. Большинство случайных радиационных воздействий являются неоднородными или частичными воздействиями на организм, когда только локализованная область тела получила воздействие высокой дозы. Несколько исследований показали, что можно использовать анализ очагов γ-H2AX для оценки фракции тела, которая была облучена, и дозы облученной фракции.42. Когда происходит облучение всего тела, происходит случайная индукция ДНК DSB во всех клетках, и можно ожидать найти распределение Пуассона. Аналогично цитогентическим методам, где индукция хромосомных аберраций имеет тенденцию быть чрезмерно диспергированной в лимфоцитах периферической крови, где наблюдается высокое обилие клеток с множественными аберрациями и клеток с нормальными метафазами, дисперсионный анализ очагов γ-H2AX с использованием загрязненного метода Пуассона, предложенный над диспергированными распределениями очагов58. Последнее было также подтверждено в in vivo эксперименты с минипигами и макакой-резусом59.
Раскрытие информации
С. Шунк является сотрудником компании MetaSystems Hard & Software GmbH, Альтлуссхайм, Германия.
Благодарности
Авторы хотели бы поблагодарить участников исследования за сдачу крови, а также медсестру В. Принс за сбор образцов крови. Настоящим признается финансовая помощь Южноафриканского национального исследовательского фонда (NRF) в проведении этого исследования. Высказанные мнения и сделанные выводы являются мнениями авторов и не обязательно должны приписываться СРН. Эта работа была финансово поддержана Международным агентством по атомной энергии (МАГАТЭ) в рамках проекта технического сотрудничества (номер: URU6042) для поддержки В. Мартинеса-Лопеса, а также скоординированного исследовательского проекта E35010 (номер контракта: 22248).
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin - BSA | Merck | A3059 | |
| Coplin Jar | Sigma | S6016 | |
| Cover Slips (Size 24 x 50 mm) | Lasec | Glass2C29M2450Rec | |
| Cryogenic Vials (1.2 mL) | WhiteSci | 607101 | |
| Cytospin | Healthcare Technologies | JC370-12-L | |
| Cytospin Clips | Healthcare Technologies | JC302 | |
| Cytospin filter cards | Healthcare Technologies | JC307 | |
| Cytospin Funnels | Healthcare Technologies | JC372 | |
| DAM-TRITC | Invitrogen | A16022 | |
| DAPI-Fluroshield | Sigma/Merck | F6057 | |
| Ethanol | Kimix | ETD901 | |
| Filter tips | WhiteSci | 200ul (312012) and 1000ul (313012) | |
| Hydrochloric acid- HCl | Merck | ||
| Histopaque | Sigma/Merck | 10771 | |
| lithium–heparin collection tubes | The Scientific Group | 367526 | |
| MetaSystems - Metafer | Metasystems | Azio Imager Z2: 195-041848 | |
| NaOH | Merck | 221465 | |
| NovoPen | Leica Biosystems | NCL-PEN | |
| Paraformaldehyde | Sigma/Merck | 158127 | |
| Phosphate-buffered saline Tablets | Separations | SH30028,02 | |
| Pipettes | WhiteSci | P11037 and P1033 | X-tra Clipped Corner Slides are clipped at 45° angles to help reduce glass breakage. |
| Purified anti-H2A.X Phospho (Ser139) Antibody | Biolegend | 613402 / 100 μg | |
| RPMI medium | WhiteSci | BE12-702F | |
| Triton X-100 (Octoxinol 9) | Sigma/Merck | T-9284 | |
| Tubes (15ml) | WhiteSci | 601002 | |
| X-Tra adhesive slides – corner clipped | SMM Technologies | 3800200E |
Ссылки
- Barnes, J. L., et al. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Little, J. B. Radiation carcinogenesis. Carcinogenesis. 21 (3), 397-404 (2000).
- Barquinero, J. F., et al. Lessons from past radiation accidents: Critical review of methods addressed to individual dose assessment of potentially exposed people and integration with medical assessment. Environment International. 146, 106175 (2021).
- International Atomic Energy Agency. Radiotherapy in Cancer Care: Facing The Global Challenge. International Atomic Energy Agency. , (2017).
- Achel, D. G., et al. Towards establishing capacity for biological dosimetry at Ghana Atomic Energy commission. Genome Integrity. 7 (1), 1-5 (2016).
- Sullivan, J. M., et al. Assessment of biodosimetry methods for a mass-casualty radiological incident: Medical response and management considerations. Health Physics. 105 (6), 540-554 (2013).
- Rea, M. E., et al. Proposed triage categories for large-scale radiation incidents using high-accuracy biodosimetry methods. Health Physics. 98 (2), 136-144 (2010).
- Swartz, H. M., et al. A critical assessment of biodosimetry methods for large-scale incidents. Health Physics. 98 (2), 95-108 (2010).
- International Atomic Energy Agency. Cytogenetic Dosimetry: Applications in Preparedness for and Response to Radiation Emergencies. International Atomic Energy Agency. , (2011).
- Grégoire, E., et al. Twenty years of FISH-based translocation analysis for retrospective ionizing radiation biodosimetry. International Journal of Radiation Biology. 94 (3), 248-258 (2018).
- Moroni, M., et al. Evaluation of the gamma-H2AX assay for radiation biodosimetry in a swine model. International Journal of Molecular Sciences. 14 (7), 14119-14135 (2013).
- Rothkamm, K., et al. Laboratory Intercomparison on the γ-H2AX Foci Assay. Radiation Research. 180 (2), 149 (2013).
- Barnard, S., et al. The first gamma-H2AX biodosimetry intercomparison exercise of the developing european biodosimetry network RENEB. Radiation Protection Dosimetry. 164 (3), 265-270 (2015).
- Moquet, J., et al. The second gamma-H2AX assay inter-comparison exercise carried out in the framework of the European biodosimetry network (RENEB). International Journal of Radiation Biology. 93 (1), 58-64 (2017).
- Vinnikov, V., et al. Clinical Applications of Biomarkers of Radiation Exposure: Limitations and Possible Solutions Through Coordinated Research. Radiation Protection Dosimetry. 186 (1), 3-8 (2019).
- Mariotti, L. G., et al. Use of the γ-H2AX assay to investigate DNA repair dynamics following multiple radiation exposures. PLoS ONE. 8 (11), 1-12 (2013).
- Ivashkevich, A. N., et al. γH2AX foci as a measure of DNA damage: A computational approach to automatic analysis. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 711 (1-2), 49-60 (2011).
- Rogakou, E. P., et al. Megabase chromatin domains involved in DNA double-strand breaks in vivo. Journal of Cell Biology. 146 (5), 905-915 (1999).
- Sedelnikova, O. A., et al. Quantitative Detection of 125 IdU-Induced DNA Double-Strand Breaks with γ-H2AX Antibody. Radiation Research. 158 (4), 486-492 (2002).
- Han, J., et al. Quantitative analysis reveals asynchronous and more than DSB-associated histone H2AX phosphorylation after exposure to ionizing radiation. Radiation Research. 165 (3), 283-292 (2006).
- Jaworska, A., et al. Operational guidance for radiation emergency response organisations in Europe for using biodosimetric tools developed in EU multibiodose project. Radiation Protection Dosimetry. 164 (1-2), 165-169 (2015).
- Kulka, U., et al. Realising the european network of biodosimetry RENEB - status quo. Radiation protection dosimetry. 164 (1), 42-45 (2015).
- Sánchez-Flores, M., et al. γH2AX assay as DNA damage biomarker for human population studies: Defining experimental conditions. Toxicological Sciences. 144 (2), 406-413 (2015).
- Raavi, V., et al. Potential application of γ-H2AX as a biodosimetry tool for radiation triage. Mutation Research/Reviews in Mutation Research. 787, 108350 (2020).
- Lassmann, M., et al. In vivo formation of γ-H2AX and 53BP1 DNA repair foci in blood cells after radioiodine therapy of differentiated thyroid cancer. Journal of Nuclear Medicine. 51 (8), 1318-1325 (2010).
- Vandevoorde, C., et al. γ-H2AX foci as in vivo effect biomarker in children emphasize the importance to minimize x-ray doses in paediatric CT imaging. European Radiology. 25 (3), 800-811 (2015).
- Beels, L., et al. γ-H2AX foci as a biomarker for patient X-ray exposure in pediatric cardiac catheterization: Are we underestimating radiation risks. Circulation. 120 (19), 1903-1909 (2009).
- Bogdanova, N. V., et al. Persistent DNA double-strand breaks after repeated diagnostic CT scans in breast epithelial cells and lymphocytes. Frontiers in Oncology. 11, 1-14 (2021).
- Schumann, S., et al. DNA damage in blood leukocytes of prostate cancer patients undergoing PET/CT examinations with [68Ga]Ga-psma. Cancers. 12 (2), 1-14 (2020).
- Ivashkevich, A., et al. Use of the γ-H2AX assay to monitor DNA damage and repair in translational cancer research. Cancer Letters. 327 (1-2), 123-133 (2012).
- Moquet, J., et al. Gamma-H2AX biodosimetry for use in large scale radiation incidents: Comparison of a rapid "96 well lyse/fix" protocol with a routine method. PeerJ. 2014 (1), 1-11 (2014).
- Turner, H. C., et al. Adapting the γ-H2AX Assay for Automated Processing in Human Lymphocytes. Radiation Research. 175 (3), 282-290 (2008).
- Sharma, P. M., et al. High Throughput Measurement of γ H2AX DSB Repair Kinetics in a Healthy Human Population. PLoS ONE. 10 (3), 0121083 (2015).
- Vandevoorde, C., et al. EPI-CT: In vitro assessment of the applicability of the γ-H2AX-foci assay as cellular biomarker for exposure in a multicentre study of children in diagnostic radiology. International Journal of Radiation Biology. 91 (8), 653-663 (2015).
- MacPhail, S. H., et al. Cell cycle-dependent expression of phosphorylated histone H2AX: Reduced expression in unirradiated but not X-irradiated G1-phase cells. Radiation Research. 159 (6), 759-767 (2003).
- Barnard, S., et al. The shape of the radiation dose response for DNA double-strand break induction and repair. Genome Integrity. 4 (1), 1 (2013).
- Kulka, U., et al. Biodosimetry and biodosimetry networks for managing radiation emergency. Radiation Protection Dosimetry. 182 (1), 128-138 (2018).
- Macaeva, E., et al. Gene expression-based biodosimetry for radiological incidents: assessment of dose and time after radiation exposure. International Journal of Radiation Biology. 95 (1), 64-75 (2018).
- Khanna, K. K., et al. DNA double-strand breaks: Signaling, repair and the cancer connection. Nature Genetics. 27 (3), 247-254 (2001).
- Rothkamm, K., et al. γ-H2AX as protein biomarker for radiation exposure. Annali dell'Istituto Superiore di Sanita. 45 (3), 265-271 (2009).
- Borràs, M., et al. Comparison of methods to quantify histone H2AX phosphorylation and its usefulness for prediction of radiosensitivity. International Journal of Radiation Biology. 91 (12), 915-924 (2015).
- Horn, S., et al. Gamma-H2AX-based dose estimation for whole and partial body radiation exposure. PLoS ONE. 6 (9), 1-8 (2011).
- Costes, S. V., et al. Imaging Features that Discriminate between Foci Induced by High- and Low-LET Radiation in Human Fibroblasts. Radiation Research. 165 (5), 505-515 (2006).
- Leatherbarrow, E. L., et al. Induction and quantification of γ-H2AX foci following low and high LET-irradiation. International Journal of Radiation Biology. 82 (2), 111-118 (2006).
- Mistrik, M., et al. Low-dose DNA damage and replication stress responses quantified by optimized automated single-cell image analysis. Cell Cycle. 8 (16), 2592-2599 (2009).
- Oeck, S., et al. The Focinator - a new open-source tool for high-throughput foci evaluation of DNA damage. Radiation Oncology. 10 (1), 1-11 (2015).
- Vandersickel, V., et al. Early increase of radiation-induced γH2AX foci in a humanku70/80 knockdown cell line characterized by an enhanced radiosensitivity. Journal of Radiation Research. 51 (6), 633-641 (2010).
- Sambrook, J., et al. . Molecular cloning : a laboratory manual. , (2001).
- Rifai, A., et al. B and T lumphocytes. Recent Advances in IgA Nephropathy. (6), 193-210 (2009).
- Andreo, P., et al. Absorbed dose determination in external beam radiotherapy: An international code of practice for dosimetry based on absorbed dose to water. International Atomic Energy Agency. , (2001).
- Jamur, M. C., et al. Cell fixatives for immunostaining. Methods in Molecular Biology. 588, 55-61 (2010).
- Rogakou, E. P., et al. DNA Double-stranded Breaks Induce DNA Double-stranded Breaks Induce Histone H2AX Phosphorylation on Serine 139. Journal of Biological Chemistry. 273 (10), 1-12 (1998).
- Kyuseok, I. An introduction to Performing Immunofluorescence Staining. Methods in Molecular Biology. 1897, 299-311 (2019).
- Ainsbury, E. A., et al. Multibiodose radiation emergency triage categorization software. Health Physics. 107 (1), 83-89 (2014).
- Ainsbury, E. A., et al. Dose estimation software for radiation biodosimetry. Health Physics. 98 (2), 290-295 (2010).
- Turner, H. C., et al. The RABiT: High-throughput technology for assessing global DSB repair. Radiation and Environmental Biophysics. 53 (2), 265-272 (2014).
- Wang, Q., et al. Development of the FAST-DOSE assay system for high-throughput biodosimetry and radiation triage. Scientific Reports. 10 (1), 1-11 (2020).
- Rothkamm, K., et al. Leukocyte DNA damage after multi-detector row CT: A quantitative biomarker of low-level radiation exposure. Radiology. 242 (1), 244-251 (2007).
- Redon, C. E., et al. an analysis method for partial-body radiation exposure using γ-H2AX in nonhuman primate lymphocytes. Radiation Measurements. 46 (9), 877-881 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены