Method Article
非人灵长类动物模型中视网膜色素上皮移植治疗退行性视网膜疾病
* 这些作者具有相同的贡献
Erratum Notice
摘要
由于解剖学和遗传相似性,非人灵长类动物(NHP)是研究人类视网膜细胞疗法的理想模型。本手稿描述了在NHP眼中进行视网膜色素上皮细胞的黄斑下移植方法以及预防与黄斑操作相关的术中并发症的策略。
摘要
视网膜色素上皮(RPE)移植对于治疗遗传性和获得性视网膜退行性疾病具有很大的前景。这些疾病包括色素性视网膜炎 (RP) 和晚期年龄相关性黄斑变性 (AMD),如地理萎缩 (GA)。这些疾病共同代表了目前全球无法治愈的失明的很大一部分。这些未满足的医疗需求引起了学术界对开发RPE替代方法的兴趣。在通常用于治疗药物临床前测试的动物模型中,非人灵长类动物(NHP)是唯一具有黄斑的动物模型。由于NHP眼与人眼具有这种解剖学上的相似性,因此它是开发RPE细胞疗法等先进治疗药物(ATMPs)的重要且合适的临床前动物模型。
本手稿描述了一种在聚对苯二甲酸乙二醇酯(PET)细胞载体上培养的RPE单层黄斑下移植到免疫抑制的NHP中手术产生的RPE伤口的方法。中央凹 - 黄斑的中央缺血部分 - 是移植过程中最大的机械无力部位。如果初始视网膜下输液对视网膜产生过大的力,则会发生中央凹创伤。因此,建议在全氟碳液体 (PFCL) 玻璃体填塞下缓慢注射,在低眼压 (IOP) 设置下使用双孔视网膜下注射插管,以形成视网膜血疱。
还建议使用玻璃体内纤溶酶原注射液进行预处理,以释放中央凹旁 RPE 光感受器粘连。与传统技术相比,这些组合策略可以降低中央凹撕裂的可能性。NHP是RPE细胞治疗发展临床前阶段的关键动物模型。该协议解决了与在NHP眼中提供RPE细胞治疗相关的技术挑战。
引言
RPE移植在治疗遗传性和获得性视网膜退行性疾病方面具有很大的前景。这些疾病包括色素性视网膜炎(RP、视杆细胞营养不良)和晚期AMD(如GA)。总的来说,这些疾病占目前全球无法治愈的失明的很大一部分1,2。AMD的晚期阶段分为新生血管性AMD(nAMD)和GA。虽然nAMD有有效的治疗选择,例如抗血管内皮生长因子(anti-VEGF)注射,但GA患者的治疗选择有限。RP 是一组高度异质性的遗传性视网膜疾病,其特征是进行性视网膜光感受器变性。在一些患者中,致病性遗传缺陷位于RPE内而不是光感受器内;因此,如果基因治疗不可行,RPE替代疗法可能是一种替代策略。
对开发针对这些疾病的有效治疗方法非常感兴趣。特别是,RPE移植作为一种潜在的治疗方法已经获得了牵引力3,4,5,6,7,8。自 20 世纪 80 年代首次出现 RPE 移植报告以来9,该领域已扩展到包括各种 RPE 细胞来源、递送策略以及疾病和移植的实验模型10、11、12、13、14。在各种动物模型中,只有NHP具有带有"中央凹"的"黄斑黄斑",这是与人类共享的视网膜后极的解剖学专业化。中央凹包含非常高密度的视锥光感受器,可实现高分辨率的中央视觉15。与人类相比,NHP还具有相似的基因组和蛋白质组学组成16 。这些相似性使其成为研究影响人类视网膜的眼部疾病的重要和适当的动物模型17,18。
本手稿描述了一种在免疫抑制的 NHP 中对 RPE 异种移植物进行黄斑移植的方法,该移植由 PET 细胞载体支持。一种用于兔子视网膜下RPE移植的经玻璃体技术已在之前的手稿中有所描述19。然而,在非人眼保健品中,在术中操作期间需要特别注意中央凹的存在20。特别是,如果视网膜下输液方法对视网膜产生过大的力,则中央凹撕裂的风险很高20。因此,本手稿的重点是降低NHP中意外中央凹创伤风险的策略。
其中包括术前玻璃体内纤溶酶原注射液释放中央凹旁粘连,以及术中使用手术显微镜集成光学相干断层扫描(miOCT)实时可视化中央凹解剖结构。建议在低眼压设置下定制的 25/41 G 双孔视网下视网下导管,并伴有眼内 PFCL 填塞,以便更好地控制中央凹脱离过程。此外,建议在植入前手术切除天然RPE,以允许移植的RPE细胞和宿主光感受器之间更好地整合。最后,描述了用于NHP模型的围手术期和术后全身免疫抑制方案,以提高移植后RPE异种移植物的存活率11,21。
研究方案
注意:所有动物实验均根据视觉和眼科研究协会(ARVO)进行,用于眼科和视觉研究动物。伦理学批准来自新加坡新加坡兴业医疗机构动物护理和使用委员会。动物被安置在经实验动物护理评估和认证协会(AAALAC)批准的SingHealth实验医学中心。该批准强调,所有动物实验均符合新加坡农业食品和兽医局制定的国家实验动物研究咨询委员会指南的标准。以下实验方案是根据在6只 猕猴 (4只男性和2只雌性,4至6岁,2.8至4.0公斤)的6只眼睛中进行的实验建立的 。
1. 在NHP模型中实现免疫抑制
- 手术前 7 天开始免疫抑制,并在整个随访期间继续免疫抑制。
- 在给予全身免疫抑制之前称量NHP,以确保准确的药物剂量。在基线时对动物进行称重,此后每周称重一次。
- 口服西罗莫司、多西环素和米诺环素实现全身免疫抑制。
- 给予2mg口服西罗莫司的负荷剂量,然后每日维持剂量为1mg。在给药前获得基线血西罗莫司水平,并在整个随访期间进行监测。确保浓度至少为5μg/L,以获得充分的免疫抑制。
注意:西罗莫司剂量不适应体重。 - 每天口服多西环素7.5mg / kg的剂量,每天两次。
- 每天口服米诺环素7.5mg / kg的剂量,每天两次。
- 给予2mg口服西罗莫司的负荷剂量,然后每日维持剂量为1mg。在给药前获得基线血西罗莫司水平,并在整个随访期间进行监测。确保浓度至少为5μg/L,以获得充分的免疫抑制。
- 在免疫抑制期间,监测所有非传染性疾病药物的不良全身效应。寻找显着的体重减轻(>10%),食欲和饮水量下降,脱发以及异常行为,如攻击性和嗜睡。评估将在第3天,第14天和第1个月进行,然后是每月评估。
2. 器械灭菌
- 使用蒸馏水冲洗手术器械。
- 将仪器放入装有 500 mL 蒸馏水和 2 mL 器械消毒剂的超声波浴中。使用超声波浴的扫描功能清洁仪器15分钟。
- 从超声波浴中取出仪器。用蒸馏水彻底冲洗两次,每次冲洗5分钟。冲洗后风干仪器。
- 将仪器放入仪器盒中。使用通用程序设置对盒子进行高压灭菌(在134°C下对器械灭菌50分钟:高压灭菌30分钟,干燥20分钟)。
3. 制备不含防腐剂的曲安奈德(40毫克/毫升)
- 使用1 mL注射器,取出1mL曲安奈德溶液(10mg / mL)。将其转移到15 mL锥形管中,并与4 mL无菌平衡盐溶液(BSS)混合。
- 将溶液以120× g 离心5分钟。确保所有曲安奈德颗粒都在锥形管的底部。从锥形管中丢弃上清液(BSS)。
- 将曲安奈德颗粒与5mL无菌BSS重新悬浮在锥形管中。将溶液以120× g 离心5分钟。再次丢弃上清液。
- 重复步骤3.3,用BSS(3x)完成曲安奈德颗粒的洗涤。
- 用0.25mL无菌BSS重新悬浮曲安奈德颗粒以达到40mg / mL的浓度。
- 用新的1 mL注射器吸出重新悬浮的曲安奈德(40mg / mL)。连接25 G钝头凹槽针头,并保持注射器与曲安奈德溶液准备术中使用。
4. 使用玻璃体内纤溶酶原(0.25μg/μL)预处理NHP眼睛
- 手术前一周,给予玻璃体内注射(20μL)猴纤溶酶原(0.25μg/ μL)。
- 手术前,肌内注射氯胺酮(10-20 mg / kg BW)和皮下注射阿托品(0.05 mg / kg BW)镇静NHP。给予丁卡因滴眼液进行局部麻醉。
- 在玻璃体内注射前,用10%聚维酮碘消毒眶周区域。通过对NHP的结膜补品施用5%聚维酮碘来消毒眼睛。确保溶液在补品中停留至少1分钟,然后用无菌BSS彻底冲洗。
- 使用250μL注射器从小瓶中吸出预稀释的猴子纤溶酶原(0.25μg/ μL)。将30G针头连接到注射器上,并保持猴子纤溶酶原准备好玻璃体内给药。
- 使用一对卡尺识别眼睛上的注射部位。在距离边缘3mm的地方进行玻璃体内注射。
- 继续注射,针头朝向地球中心。从球体上取出针头后,使用棉膏棒填塞注射部位并防止眼内内容物反流。
- 施用润滑凝胶或软膏,以减少术后立即对眼表的刺激。
5. 手术台和设备设置
- 建立无菌领域。在无菌区时,请始终佩戴外科磨砂膏、面罩和护发器。
- 准备不含防腐剂的曲安奈德(40 mg / mL)用于术中玻璃体的可视化(见第3节)。在10 mL注射器中准备无菌BSS,在5 mL注射器中准备润滑剂。将它们放在垂坠物上。
- 将其他仪器放在悬垂物上,包括 3-0 丝、7-0 针线、棉胶棒、缠绕闭合条和枝形吊灯内发光纤维线。
- 使用无菌技术将玻璃体切除术套件(包括高速玻璃体切除器、文丘里盒和 25 G 枝形吊灯内腔发光器)连接到玻璃体切除术机。
- 打开一个 500 mL 眼科级 BSS 瓶,并根据制造商的说明将其连接到文丘里盒。继续启动系统。
- 打开 miOCT/手术显微镜。选择手术显微镜的预设配置,用于后段手术和照明。输入程序的详细信息,包括 ID、性别、动物眼睛的侧向性和程序的名称。
- 安装非接触式广角 128 度眼底透镜。
- 将无菌的一次性手柄盖连接到手术显微镜/ miOCT上。调整显微镜位置并使用脚踏板对焦。继续进行手术。
6.动物麻醉和定位的准备(最好由兽医团队进行)
- 确保在诱导麻醉之前禁食NHP至少8小时,以防止反流和呕吐。在诱导麻醉之前镇静NHP(参见步骤4.2了解镇静说明)。
- 使用1%托吡卡胺和2.5%去氧肾上腺素滴眼液至少3次,间隔5分钟,以实现瞳孔扩张。
- 在手术前30分钟肌内注射丁丙诺啡(0.005-0.03mg / kg BW)以达到镇痛。
- 用气管插管插管照管NHP,通常大小为3-5毫米。尝试插管时,请确保有几种尺寸可用。使用可以穿过喉部而不会造成创伤的最大尺寸。测量末端潮气 CO2,以确保气管插管的适当放置。
- 通过气管插管输送2%异氟烷气体以诱导全身麻醉。通过评估NHP对周围刺激(包括声音和触摸)的反应来确认全身麻醉的状态(对触摸缺乏反应)。使用0.5-2%异氟烷气体维持全身麻醉状态。
- 在整个手术过程中持续监测NHP心电图,呼吸频率,血压和血氧饱和度。
- 将NHP放置在手术台上,使眼睛垂直于手术显微镜。将润滑凝胶或软膏敷在眼睛上,不要对其进行手术以减少麻醉期间的眼表刺激。
- 用剪刀剪掉睫毛,以减少感染的机会。
- 用10%聚维酮碘消毒眶周区域。通过对NHP的结膜补品施用5%聚维酮碘来消毒眼睛。确保溶液在补品中停留至少1分钟,然后用无菌BSS彻底冲洗。
- 放置无菌悬垂物,使预切开口居中于眼睛进行手术。用粘性手术切口悬垂物覆盖眼睛。
- 对眼睛进行侧切开术以进行手术。
- 插入利伯曼窥器,以确保眼睑充分打开,以显示眼睛。
7. 玻璃体切除术
注意:为了进入视网膜下腔进行PET支架RPE移植物的输送,本方案建议使用标准玻璃体视网膜手术装置和非接触式广角128°眼底镜进行4端口(瓣膜)25 G玻璃体切除术。该协议还建议使用配备miOCT的手术显微镜来指导几个关键的手术步骤,包括中央凹脱离的诱导,RPE移植物的植入和视网膜下液体引流。
- 使用一把vannas剪刀切开边缘附近的结膜,进行360°结膜围膜检查。通过钝性解剖扩大腹膜。
- 使用25 G微玻璃视网膜刀片,在8点钟对右眼或4点钟对左眼进行硬质疏松术。从眼睛的边缘进行3毫米的硬化切开术。
- 使用7-0 vicryl缝合线插入并缝合25 G定制侧端口输液套管。确认玻璃体内位置后,启动BSS输注并将系统设置为保持20 mmHg的IOP。
- 使用25 G平头镜,在2点钟对右眼或10点钟对左眼进行绝育,如步骤7.2。
- 将 25 G 枝形吊灯插入平头灯槽,并用胶带固定。将光源调节到约60%。
- 在右眼10点钟或左眼2点钟进行另一次类似于步骤7.2的绝育器切开术。在硬质切开术周围放置U形的维克里7-0缝合线,而不打结。将玻璃体切除术切刀尖端插入该硬质切开术。
- 在入口处周围开始玻璃体切除术,然后进行短核玻璃体切除术,设置如下:每分钟最多切口5000次,最大吸气量为400 mmHg。
- 注射20-50μL曲安奈德(40mg / mL)以获得更好的玻璃体可视化。
- 通过将玻璃体与视网膜分离来诱导后玻璃体脱离(PVD)。
- 将玻璃体滴管放置在视盘上方,以允许轻柔地诱导PVD。玻璃体仅在抽吸时保持在最大400 mmHg的设置下,不涉及任何切割。
- 如果需要,使用25 G眼内镊子操纵椎间盘边缘的玻璃体,在玻璃体皮层中形成撕裂,以促进脱离。
注:如果曲安奈德晶体在视网膜表面上不受阻碍地滑动,则PVD被认为是成功的。
- 用切刀打开后舌膜,取出脱落的玻璃体裙,直到玻璃体基底(视网膜赤道处)。抽吸视网膜表面任何剩余的曲安奈德。
8. miOCT引导式中央凹脱离
- 注射 1-2 mL PFCL,覆盖后极直至前外周视网膜。
- 用视网膜下注射套管进入眼睛。在玻璃体切除机上将IOP设置为0-4 mmHg(确保完美的水密系统;如果需要,在端口周围系上缝合线)。
- 使用25/41 G定制的双孔视网膜下注射套管或连接到250μL注射器的25/38 G视网膜下注射套管,轻轻地进行视网膜下注射BSS以诱导局部视网膜脱离。一旦水疱刚好穿过中央凹,停止注射。从单独的方向创建第二个气泡。合并两个凸块以完全分离中央凹。
- 启用 miOCT 功能以可视化水疱形成。确保线和立方体扫描处于高清模式,并设置(512 x 128像素,扫描宽度4 mm)以在中央凹处获取图像。观察miOCT图像,使神经视网膜与中央凹处的RPE层完全分离。
- 用一把垂直的25 G玻璃体视网膜剪刀将视网膜切开术扩大至1.5mm,以允许进入视网膜下空间进行移植。
9. 去除天然 RPE
- 在玻璃体切除机上将IOP设置为50 mmHg。
- 使用拉丝硅胶吸头套管通过活性挤出去除PFCL。
- 用1.4毫米切口刀延长硬膜切开术,以允许20 G器械进入。
- 使用定制的20 G可扩展环路仪器,刮擦黄斑下宿主RPE以进行移除。刮擦至少 2 x 3 mm 的区域。
10. 装载用于递送RPE细胞单层移植的射手
- 有关在PET细胞载体上加载从RPE培养物中切割的子弹形移植物的一般说明,请参阅先前的出版物22。
11. miOCT引导下移植物植入和位置调整
- 将射手装置的尖端以20 mmHg的IOP通过硬质疏松术插入。通过视网膜表面形成的视网膜切开术边缘将植入物注射到视网膜下间隙。
- 注射植入物时,细胞载体侧面向Bruch膜,RPE异种移植物侧面向光感受器。
- 启用miOCT功能,可视化种植体位置。确保植入物平放在视网膜下空间的Bruch膜上,并且视网膜上覆完整。确保它距离创建的视网膜切开术有合理的距离,并且不会撞击视网膜切开术部位。
- 使用视网膜下注射插管或25 G弯曲的眼内剪刀调整植入物位置,以确保其在黄斑下位置良好。
12. miOCT引导下输注视网膜下腔积液
- 使用拉丝硅胶尖端插管,进行液-空气交换和仔细的视网膜下液体引流。尝试从睑板视网膜脱离和视网膜切开术边缘进行轻柔的视网膜下液体抽吸。
- 启用 miOCT 功能,实时可视化视网膜下液体的充分引流,直到视网膜重新附着在植入物上。
13. 结束操作
- 使用预先放置的7-0 vicryl缝合线关闭工作端口巩膜切开术。取下 25 G 枝形吊灯和 25 G 输液插管。用7-0个维克里缝合线关闭这些硬化切片。
- 在缝合前8点进行玻璃体内注射防腐剂游离曲安奈德(40mg / ml)中的2mg。
- 触诊眼睛以确保眼压在可接受的范围内。如果需要,通过30 G针注入过滤空气(或BSS)。
- 用7-0个玻璃酰缝合线缝合结膜,用5-0个丙烯缝合结膜(10-14天后取出)。
14. 术后动物护理
- 手术后将 NHP 正面朝下放置 1 小时。在恢复意识之前,不要让动物无人看管。确保兽医和动物护理技术人员在术后过程中可以进行观察和支持。
- 术后每日两次,局部应用抗生素(妥布霉素)、类固醇(地塞米松)软膏和高马托品滴眼液,持续 5 天。
- 术后6小时另施用另一种皮下注射丁丙诺啡(0.005-0.03mg / kg BW)以充分控制疼痛。
- 只有当NHP完全恢复意识时,才将NHP归还给其他动物的陪伴。
- 在手术后的第3天,第14天和第1个月进行多模式成像随访,然后每月进行检查。手术后每月执行 ERG。在第14天移除5-0个用于切口术的prolene缝合线,同时使用用于多模态成像的镇静期。其余的缝合线是可吸收的,7-0个玻璃缝合线,不需要移除。
15. 多模态成像的术后监测方法
- 在一夜之间禁食NHP。在影像学检查前镇静NHP(见步骤4.2了解药物和镇静剂浓度)。如果镇静不足以阻止眼球运动,请考虑使用全身麻醉。
- 在影像学检查前,使用1%托吡卡胺和2.5%去氧肾上腺素滴眼液以实现瞳孔扩张(见步骤6.2)。
- 使用具有 55° 视场透镜和 30° 视场透镜的高分辨率 OCT 机进行自发荧光 (AF)、眼底荧光素血管造影 (FFA) 和光学相干断层扫描 (OCT)。
- 静脉注射 10% 荧光素(0.1 mL/kg BW)治疗 FFA。要获得早期阶段的图像,请在注射后30秒内捕获图像。对于后期图像,在注射后5-10分钟捕获图像。
- 在FFA的早期和晚期阶段之间使用眼底相机进行眼底摄影。
16. 全场视网膜电图(ERG)研究的术后监测方法
- 在一夜之间禁食国家人类健康计划。在ERG研究之前镇静NHP(见步骤4.2的药物和镇静浓度)。在整个ERG记录中,在适当的时候重新施用镇静剂。
- 将多模态成像和ERG记录分开,间隔至少为2-3天。
- 镇静后,确保NHP在ERG记录前30分钟处于黑暗适应状态。
- 将不锈钢皮下针电极放置在左右侧坎(参比电极)和NHP主体(接地电极)的背面。使用活性凝胶将ERG隐形眼镜电极放在NHP角膜上,以帮助接触和粘附。
- 所有ERG测试均基于国际视觉临床电生理学会(ISCEV)推荐的人体方案14。在暗视觉条件下开始ERG记录,并从调光器闪光开始。遵循 ISCEV 建议的推荐刺激间隔。
- 在光像测试之前,确保NHP经过10分钟的光适应,再次使用标准ISCEV建议的背景强度。
17. 新药的安乐死
- 为了安乐死NHP进行去核,按照美国兽医协会安乐死小组的建议,静脉注射戊巴比妥钠(75mg / kg)。
结果
多模态成像方式(眼底照相、眼底自发荧光成像(FAF)、眼底荧光素血管造影(FFA)-早期和晚期以及光学相干断层扫描(OCT))突出了成功进行大面积下RPE移植的特征(图1)。眼底摄影显示了RPE移植在中央凹的位置,没有随时间迁移。FAF 成像显示与 RPE 移植物重叠的过度自发荧光(表现为白色、高强度区域)的微小变化。早期和晚期FFA在RPE移植物周围没有显示任何明显的渗漏(表现为随时间扩大的白色高强度区域)。第3天的初始图像显示由于移植物植入前去除天然RPE而导致的窗口缺陷。黄斑OCT图像显示随着时间的推移,RPE移植物上视网膜外层(特别是光感受器层)的保存。苏木精和曙红染色显示视网膜层完整,无微撕裂的证据。移植物外围上方的外核层的保存表明RPE细胞正在执行其维持光感受器健康的生理功能。
25/41 G双孔套管的眼内和外视图突出了在视网膜下注射期间控制眼压的机制(图2)。BSS在视网膜下输液期间通过中央长套管进入视网膜下腔。眼内压的显着增加导致玻璃体腔内的BSS通过套管的较大金属孔离开眼睛。然后,BSS沿着套管行进,最终从套管轮毂附近的出口口弹出。要评估套管是否按预期工作,请确保流体从套管轮毂附近的出口口流出。
miOCT允许在中央凹脱离期间在术中可视化水疱尺寸和潜在的中央凹撕裂(图3)。图3A1-A3突出显示了一例伴有中央凹撕裂的疱疹。在图3A1中,虽然下部水疱在手术显微镜下可见,但很难看到撕裂。图3A2显示了没有任何撕裂的气泡的纵向部分。图3A3显示了评估水疱垂直部分时中央凹撕裂。图3B1-B3显示了一个成功创建的气泡,没有任何眼泪的存在。
ERG波形中没有显着恶化表明,视网膜下RPE异种移植物可维持杆和视锥光感受器的全局功能(图4)。ERG波形显示了视网膜的整体功能。特别是,应注意A波以确定光感受器功能的任何损失。

图1:术后多模态成像 体内 分析。 (A)在各种成像方式(从左到右的柱:眼底摄影,眼底造影-早期期,眼底荧光素血管造影-早期期,眼底荧光素血管造影-晚期,光学相干断层扫描)上的左眼黄斑下RPE移植(眼底摄影为黄色) 的体内 成像,时间点长达3个月(从上到下行:第3天,第14天;第1、3个月)。眼底照片上的星号表示视网膜切开术的部位;白色虚线箭头指示线扫描的方向。眼底自发荧光成像上的黄色绘图形状突出显示了移植的位置。OCT图像上的白色三角形表示移植物的相应侧边缘(根据彩色眼底图像上的线扫描)。(B)在萎缩性中央凹下(由于术中撕裂)下移植的苏木精和曙红染色,并标记层。比例尺 = A 中的 1 mm(自发荧光和 FA 图像), A (OCT 图像)中的 200 μm 和 B 中的 100 μm。缩写: FA = 眼底血管造影;OCT = 光学相干断层扫描;RGC = 视网膜神经节细胞层;INL = 内核层;ONL = 外核层;RPE = 视网膜色素上皮。 请点击此处查看此图的放大版本。
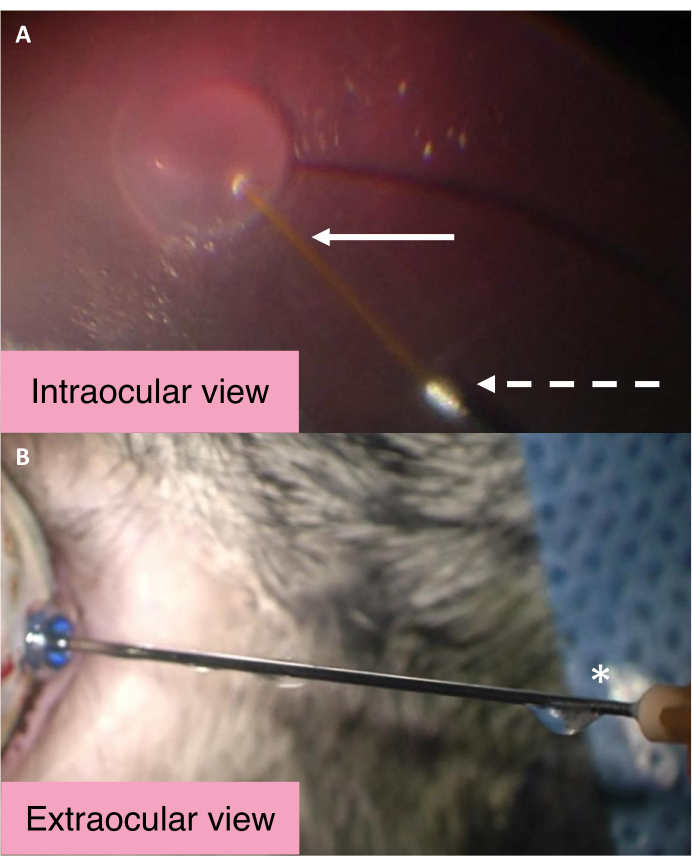
图 2:25/41 G 双孔导管的眼内和外 视图。(A) 25/41 G 双孔导管在视网膜下形成期间的眼内视图。白色箭头指向用于视网膜下注射的较长中央套管。虚线箭头指向出口套管的开口,BSS通过该开口离开眼睛。(B) 25/41 G双孔套管的外部视图。星号标记眼内BSS引流管轮毂附近的出口端口。缩写:BSS = 平衡盐溶液。 请点击此处查看此图的放大版本。
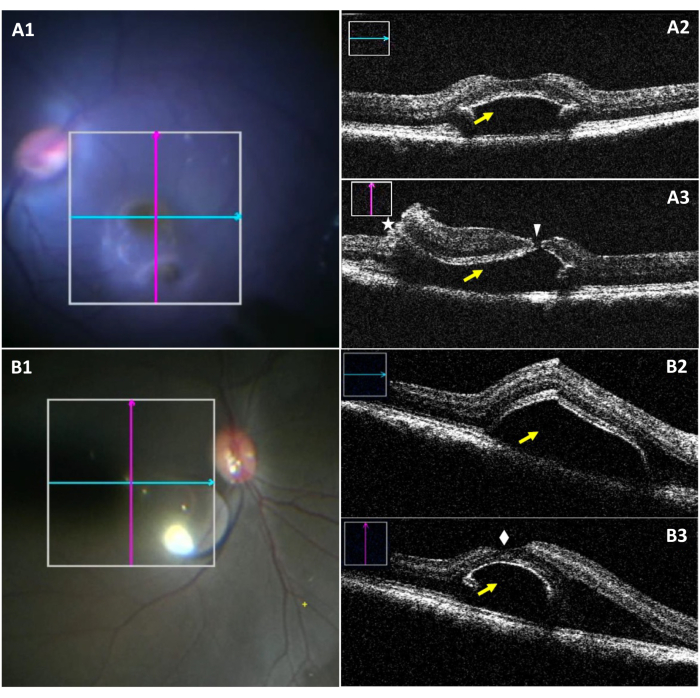
图 3:视网膜下水疱并发中央凹撕裂的术中显微镜图像和 miOCT 图像。 (A1) 术中显微镜图像显示中央凹撕裂水疱中纵向(蓝色)和横向(红色)扫描的位置。(答2)纵向 miOCT 扫描显示中央凹区域的视网膜下血疱(黄色箭头)。(答3)横向 miOCT 扫描捕获中央凹撕裂(白色箭头)以及视网膜切开术(星号和视网膜下血疱(黄色箭头)。(B1)术中显微图像,显示成功形成的血疱中纵向(蓝色)和横向(红色)扫描的位置。(B2)纵向 miOCT 扫描显示中央凹区域的视网膜下血疱(黄色箭头)。(B3)横向 miOCT 扫描显示成功形成的视网膜下睑缘,中央凹完整(白色钻石)。缩写:miOCT = 显微镜集成光学相干断层扫描。 请点击此处查看此图的放大版本。
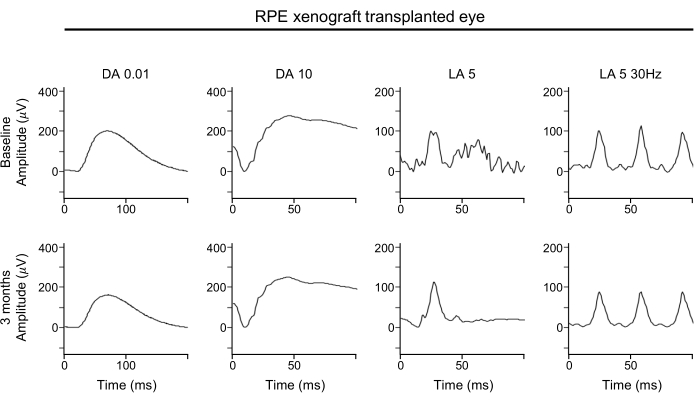
图4:RPE异种移植物移植眼的ERG。 对于视网膜的功能评估,在基线(顶排)和移植后3个月(下排)对RPE异种移植眼进行的全场ERG评估显示,在黑暗适应或光适应条件下,RPE异种移植对任何反应幅度,时间或波形没有显着影响。缩写: RPE = 视网膜色素上皮;ERG = 视网膜电图;DA = 黑暗适应;LA = 光适应。 请点击此处查看此图的放大版本。
讨论
对于黄斑下 RPE 移植,有两种主要方法正在评估 - 注射 RPE 悬浮液和移植单层 RPE 移植物。这两种方法之间的详细比较超出了本文的范围。然而,单层RPE移植物的移植可能是有利的,因为RPE细胞在单层中比在悬浮液中组织得更好。移植物中的RPE细胞组织在汇合的单层中,其类似于生理RPE细胞层的组织,并使移植的RPE细胞能够执行其生理功能。与细胞悬浮液相比,这可以实现更精确的剂量参数,这与监管工作和工业放大高度相关。
将RPE贴片移植物输送到视网膜下腔需要仔细操作黄斑并在视网膜下间隙准确插入移植物。显微外科的技术进步,如miOCT,以及对术中视网膜组织动力学的更好理解,减少了该手术的学习曲线。在本次讨论中,将解释以下方面的基本原理:i)术前纤溶酶原注射;ii)术中miOCT的使用;iii)使用定制的41 G双孔套管,低IOP设置和PFCL进行视网膜下血疱形成;iv)移植前刮除天然RPE细胞层;v)使用西罗莫司,曲安奈德,多西环素和米诺环素来减少免疫原性移植物排斥反应。
术前纤溶酶原注射液释放中央凹旁视网膜粘连
在最初的实验中,用单个流体波分离中央凹是具有挑战性的。在使用miOCT进行评估时,图像显示存在中央凹外视网膜粘连到天然RPE以及视网膜内创伤的证据20。这些粘连可能导致水疱垂直扩张,而不是视网膜下液波在视网膜轮廓上扩散,从而导致中央凹创伤。纤溶酶原是纤溶酶的非活性前体,纤溶酶是一种靶向纤连蛋白和层粘连蛋白的蛋白酶。Ocriplasmin是人类纤溶酶的生物工程变体,经美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)批准用于治疗伴或不伴有黄斑孔的症状玻璃体瘤性牵引。然而,唾液蛋白注射后囊样黄斑水肿发展的批准后报告表明,该酶对视网膜有更广泛的影响23。
虽然确切的机制尚未确定,但有人认为纤溶酶可以通过降解负责光感受器-RPE粘附的异光感受器基质元素来削弱视网膜粘附24。在该协议中,NHP眼睛在手术前1周用玻璃体内纤溶酶原治疗,以释放中央窝外视网膜粘连。在光感受器 - RPE 粘附减弱的假设下,需要较低的力来分离神经感觉视网膜,包括远端中央凹旁环,其通常抵抗视网膜体波 20 。因此,在视网膜水疱脱离期间施加的力导致水疱在视网膜轮廓上的扩张,而不是切向拉伸视网膜。这降低了中央凹撕裂的风险。然而,应该注意的是,该方案没有研究纤溶酶原对长期移植物存活的影响。未来的研究应尝试确定这种效果。
miOCT 提供解剖学反馈,以指导视网膜下血疱形成、移植物植入和视网膜下积液引流
术中非创伤性黄斑操作是实现良好移植结果的关键。然而,与操作显微镜相关的黄斑的微观结构变化可能并不总是很明显。在这样的程序中,miOCT是一种重要的工具,可提供黄斑结构的实时,三维,术中反馈。miOCT 在中央凹脱离、移植植入和使用液-空气交换引流视网膜下腔的步骤中特别有用。在中央凹脱离期间,miOCT可以确定水疱的垂直和水平尺寸。中央凹微撕裂,可能无法在手术显微镜上清晰地观察,可以通过miOCT确认(图3)。在移植物植入过程中,miOCT图像通过显示移植物的位置或与中央凹的接近程度,通过通常不太透明,分离的视网膜来引导。miOCT还可以突出在困难的移植过程中视网膜粘附的可能区域25。最后,在视网膜下积液引流过程中,miOCT可以可靠地引导视网膜下积液引流,直到实现完全的视网膜-RPE移植接触。
双孔套管、低眼压设置和 PFCL 玻璃体填塞相结合,可协同减少视网膜下血疱形成过程中的黄斑创伤
在视网膜下 BSS 注射期间,视网膜切向拉伸和液体湍流可能发生,导致中央凹脱离,从而导致不必要的中央凹撕裂。为了抵消这些现象,诸如开始注射的中央凹中心的相对位置和距离,注射量和速度,玻璃体填塞,视网膜下器械的选择以及IOP等因素都被证明是相关的20,26,27。用于中央凹脱离的视网膜下水疱应位于距中央凹足够远的位置,因为视网膜拉伸可能在水疱起始部位最高27。在视网膜下血疱的整个创建过程中,IOP 也应保持在较低水平。当眼睛的眼压高时,观察到水疱大小的垂直增加较高,而不是沿着视网膜轮廓的扩张,而在较低的压力下,水疱较浅20。此外,尽管玻璃体内注射50μL可有效使人类眼压增加一倍28,但鉴于非传染性疾病患者眼长较短,视网膜下注射期间眼压升高可能比人类更高、更快。虽然大多数玻璃体切除术机器会根据眼压波动进行调整,但调整不是同时进行的,而是视网膜下注射过程中发生的反应过程。因此,眼压越高,视网膜过度拉伸和导致中央凹创伤的风险就越高。因此,在视网膜下注射期间保持稳定的低IOP至关重要。
建议使用商用 20/41 G (DORC) 或定制的 25/41 G 双孔视网膜下插管进行视网膜下注射。插管允许液体流出玻璃体腔,以换取BSS注入视网膜下腔。这确保了在视网膜下注射期间"同时"调节IOP。双孔套管的示意图如图 2所示。最后,PFCL用于降低中央凹撕裂的风险20,26,27。由于PFCL(如八边形)具有更高的比重,因此它们在中央凹脱离期间对视网膜施加向下的力29。这进一步稳定了中央凹脱离水疱的产生过程,并增强了水疱沿视网膜轮廓的扩张。该技术已成功用于视网膜下注射rtPA,以治疗由于nAMD30引起的大量黄斑下出血。
原生RPE的植入前去除允许恢复RPE-光感受器复合物
移植物移植前应切除宿主 RPE。这是因为需要恢复RPE-光感受器复合物才能使RPE移植执行其支持光感受器的生理功能21。如果不移除,主体RPE可能会构成机械屏障,从而阻止该复合物的恢复。它可以通过施用RPE有毒化学品或使用物理去除手段来去除。化学去除方法包括全身或视网膜下给予碘酸钠31,32。由于碘酸钠在给药时会导致光感受器、RPE细胞和绒毛细血管广泛变性,其视网膜和全身毒性使其无法用于人体试验32,33。因此,首选术中物理技术。各种物理方法已被概念化。当使用物理方法时,Bruch的膜保持未损坏至关重要。许多 体外 研究表明,RPE移植物存活依赖于完整的Bruch膜34,35,36。
水力清创尝试与 Bruch 膜断裂、视网膜前膜发育速度增加和增殖性玻璃体视网膜病变相关,导致牵引性视网膜脱离37。建议用于RPE清创的钻石粉尘刮刀也导致Bruch膜断裂,导致细胞从脉络膜增殖到视网膜下空间38。有趣的是,定制的可伸缩环路仪器可以去除覆盖的RPE,同时保存兔子和猪眼中的Bruch膜11,39。去除基础RPE也有助于建立具有RPE和外视网膜萎缩的动物模型,类似于AMD的高级萎缩形式。当RPE的局灶区域从黄斑中移除时,RPE伤口通过剩余RPE细胞的肥大闭合。然而,这种伤口愈合反应与外核层的萎缩有关40。虽然动物模型的创建超出了本手稿的范围,但类似的程序可以创建高级萎缩性AMD表型的动物模型,用于测试RPE衍生的细胞疗法。
使用西罗莫司、曲安奈德、多西环素和米诺环素来减少免疫原性移植物排斥反应
视网膜下腔被认为是免疫特权位点,由完整的血液 - 视网膜屏障和其他因素维持41。在许多涉及具有完整血液 - 视网膜屏障的干细胞衍生物的视网膜下移植的研究中,免疫抑制药物在移植物存活中的作用可以忽略不计42。外层血液 - 视网膜屏障被认为是由天然RPE层和RPE细胞之间的紧密连接形成的。虽然天然RPE去除允许移植的RPE和宿主光感受器更好地整合,但血液 - 视网膜屏障在此过程中被破坏,增加了免疫排斥的可能性。传统上,T细胞是肾脏和肝脏等其他器官移植排斥反应过程的核心43。因此,视网膜组织移植的初始免疫抑制方案旨在减少这些适应性免疫反应。
西罗莫司(雷帕霉素抑制剂的机械靶标)和他克莫司(钙调磷酸酶抑制剂)是靶向适应性免疫反应的免疫抑制药物的例子。然而,尽管T细胞受到充分的抑制,移植物存活率仍然很低。此外,已知RPE细胞通过释放抑制因子来抑制T细胞活化并促进调节性T细胞的产生44。因此,越来越明显的是,适应性免疫可能不是移植物排斥的唯一因素42。视网膜下移植细胞产物可导致小胶质细胞的积累和活化45。
小胶质细胞是视网膜的巨噬细胞。它们由两个主要群体组成:1)视网膜内脉管系统的血管周围小胶质细胞和2)视网膜组织实质内的小胶质细胞。由于小胶质细胞是先天免疫应答的一部分,玻璃体内注射糖皮质激素(如曲安奈酮)可抑制细胞因子介导的增殖46。多西环素和米诺环素也可以抑制小胶质细胞活化,应考虑47,48。最后,RPE同种异体移植物与异种移植物的免疫排斥反应的差异尚不完全清楚49。例如,在 体内 免疫排斥模型的血清中已经报道了针对诱导多能干细胞衍生RPE细胞的同种抗体。然而,这些抗体的作用以及抗体介导的排斥反应在移植物存活中的重要性仍不得而知50。因此,提出了一种多药方案,利用西罗莫司抑制适应性免疫,联合曲安奈德、多西环素和米诺环素抑制先天免疫。该方案已成功用于具有良好移植物生存结局和最小全身效应的兔子11。
这种手术技术的局限性
本文描述了一种可能的手术方法,将RPE移植物片送入NHP的视网膜下空间;但是,这并不意味着这是唯一优化的方法。不同的玻璃体视网膜外科医生可能对器械和技术有其他偏好。例如,这种植入装置设计只能提供由更硬的细胞载体支撑的扁平植入物,因此可能不适合相对柔韧(或滚动)的植入物。RPE悬浮液移植可以省略大部分这种技术。因此,手术细节将需要根据每种分娩策略进行修改。
随着对用于治疗退行性视网膜疾病的细胞疗法的兴趣不断增长,NHP动物模型对于研究影响RPE移植物存活的因素的临床前研究至关重要。在本文中,提出了使NHP眼中黄斑下单层RPE移植物更顺畅地递送的策略。还推荐用于更好地可视化术中并发症的方法。预计随着细胞疗法的使用扩大,这些方法将继续改进。未来的方法论文还应考虑提出一份全面的调查清单,以评估移植物的各种结构和功能方面。
披露声明
Boris Stanzel拥有本研究中使用的仪器(RPE刮刀)的美国专利9980851。C. Zeiss Meditec和Geuder到Boris Stanzel的演讲者酬金。其他作者没有利益冲突要声明。
致谢
本研究得到了IAF-PP(HMBS Domain)(OrBID)的支持:OculaR BIomaterials and Device,A * STAR,新加坡(H17/01/a0/013),NUS启动补助金NUHSRO/2016/100/SU/01,NUHS临床科学家计划(NCSP)资助和国家研究基金会竞争性研究计划,新加坡(NRF-CRP21-2018-0008)给X.S.,Hong Leong向G.E.H.和B.V.S.捐赠教授资金。我们要感谢转化临床前模型平台(新加坡眼科研究所,新加坡)的兽医团队为NHP手术准备和动物随访提供支持。我们要感谢Jill Teo和蔡司Meditec Singapore的同事为OPMI-Lumera 700提供集成的术中OCT设备的技术支持。
材料
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
参考文献
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217 (2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719 (2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603 (2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077 (2020).
- The Architecture Of The Human Fovea. Webvision. Moran Eye Center Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021)
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927 (2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10 (2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -. H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514 (2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11 (2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161 (2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209 (2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。