Method Article
Trasplante de epitelio pigmentario retiniano en un modelo de primate no humano para enfermedades degenerativas de la retina
* Estos autores han contribuido por igual
En este artículo
Erratum Notice
Resumen
El primate no humano (NHP) es un modelo ideal para estudiar la terapéutica celular de la retina humana debido a las similitudes anatómicas y genéticas. Este manuscrito describe un método para el trasplante submacular de células epiteliales pigmentarias de la retina en el ojo NHP y estrategias para prevenir las complicaciones intraoperatorias asociadas con la manipulación macular.
Resumen
El trasplante epitelial pigmentario de la retina (EPR) es muy prometedor para el tratamiento de enfermedades degenerativas de la retina hereditarias y adquiridas. Estas afecciones incluyen retinitis pigmentosa (RP) y formas avanzadas de degeneración macular relacionada con la edad (DMAE), como la atrofia geográfica (AG). Juntos, estos trastornos representan una proporción significativa de la ceguera actualmente intratable a nivel mundial. Estas necesidades médicas insatisfechas han generado un mayor interés académico en el desarrollo de métodos de reemplazo de EPR. Entre los modelos animales comúnmente utilizados para las pruebas preclínicas de terapias, el primate no humano (NHP) es el único modelo animal que tiene una mácula. Como comparte esta similitud anatómica con el ojo humano, el ojo NHP es un modelo animal preclínico importante y apropiado para el desarrollo de medicamentos de terapia avanzada (ATMP) como la terapia celular RPE.
Este manuscrito describe un método para el trasplante submacular de una monocapa de EPR, cultivada en un portador de células de tereftalato de polietileno (PET), debajo de la mácula en una herida de EPR creada quirúrgicamente en NHP inmunodeprimidos. La fóvea, la porción avascular central de la mácula, es el sitio de la mayor debilidad mecánica durante el trasplante. El traumatismo foveal ocurrirá si la inyección inicial de líquido subretiniano genera una fuerza excesiva sobre la retina. Por lo tanto, se recomienda la inyección lenta bajo el taponamiento vítreo líquido de perfluorocarbono (PFCL) con una cánula de inyección subretiniana de doble orificio en configuraciones de presión intraocular (PIO) baja para crear una ampolla retiniana.
También se recomienda el pretratamiento con una inyección intravítrea de plasminógeno para liberar adherencias parafoveales RPE-fotorreceptores. Estas estrategias combinadas pueden reducir la probabilidad de desgarros foveales en comparación con las técnicas convencionales. El NHP es un modelo animal clave en la fase preclínica del desarrollo de la terapia celular RPE. Este protocolo aborda los desafíos técnicos asociados con la administración de la terapia celular RPE en el ojo NHP.
Introducción
El trasplante de EPR es muy prometedor para el tratamiento de enfermedades degenerativas de la retina hereditarias y adquiridas. Estas condiciones incluyen retinosis pigmentaria (RP, distrofia de cono de bastón) y formas avanzadas de DMAE como la AG. En conjunto, estos trastornos representan una proporción significativa de la ceguera actualmente intratable a nivel mundial1,2. Las etapas avanzadas de la DMAE se clasifican en DMAE neovascular (nAMD) y AG. Si bien existen opciones de tratamiento efectivas para la nAMD, como las inyecciones de factor de crecimiento endotelial antivascular (anti-VEGF), los pacientes con AG tienen opciones de tratamiento limitadas. La RP es un grupo muy heterogéneo de trastornos retinianos hereditarios caracterizados por degeneración progresiva de los fotorreceptores retinianos. En algunos pacientes, el defecto genético causal se encuentra dentro del EPR en lugar de los fotorreceptores; por lo tanto, la terapia de reemplazo de EPR puede ser una estrategia alternativa si la terapia génica no es factible.
Existe un interés significativo en el desarrollo de tratamientos efectivos para estas afecciones. En particular, el trasplante de EPR ha ido ganando terreno como un potencial abordaje terapéutico3,4,5,6,7,8. Desde que aparecieron los primeros informes sobre el trasplante de EPR en la década de 19809, el campo se ha ampliado para incluir varias fuentes de células de EPR, estrategias de administración y modelos experimentales de enfermedad y trasplante10,11,12,13,14. Entre los diversos modelos animales, solo el NHP tiene una 'mácula lútea' con una 'fóvea central', una especialización anatómica en el polo posterior de la retina compartida con los humanos. La fóvea contiene una densidad muy alta de fotorreceptores de cono que permiten una visión central de alta resolución15. El NHP también tiene una composición genómica y proteómica similar16 en comparación con los humanos. Estas similitudes lo convierten en un modelo animal importante y apropiado para el estudio de las enfermedades oculares que afectan a la retina humana17,18.
Este manuscrito describe un método para el trasplante submacular de un xenoinjerto de EPR, apoyado por un portador de células PET, en NHP inmunodeprimidos. En un manuscrito anterior se ha descrito una técnica transvítrea para el trasplante subretiniano de EPR en conejos19. Sin embargo, en los PNH, la presencia de la fóvea requiere un cuidado especial durante la manipulación intraoperatoria20. En particular, existe un alto riesgo de desgarro foveal si los métodos de inyección de líquido subretiniano generan una fuerza excesiva en la retina20. El enfoque de este manuscrito es, por lo tanto, en las estrategias para reducir el riesgo de trauma foveal inadvertido en nhP.
Estos incluyen el uso de la inyección preoperatoria de plasminógeno intravítreo para la liberación de adherencias parafoveales y la tomografía de coherencia óptica integrada con microscopio quirúrgico (miOCT) intraoperatoria para la visualización en tiempo real de la anatomía foveal. Se propone una cánula subretiniana de doble orificio de 25/41 G hecha a medida con taponamiento intraocular PFCL en configuraciones de PIO baja para permitir un proceso más controlado de desprendimiento foveal. Además, se recomienda la extirpación quirúrgica del EPR nativo antes de la implantación para permitir una mejor integración entre las células EPR trasplantadas y los fotorreceptores del huésped. Finalmente, se describe un protocolo de inmunosupresión sistémica peri y postoperatoria para modelos nhP para mejorar la supervivencia del xenoinjerto de EPR post-trasplante11,21.
Protocolo
NOTA: Todos los experimentos con animales se llevaron a cabo de acuerdo con la Asociación de Investigación en Visión y Oftalmología (ARVO) para el Uso de Animales en la Investigación Oftálmica y de la Visión. La aprobación ética se obtuvo del Comité Institucional de Cuidado y Uso de Animales, SingHealth, Singapur. Los animales fueron alojados en el Centro de Medicina Experimental SingHealth aprobado por la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio (AAALAC). Esta aprobación destaca que todos los experimentos con animales cumplen con los estándares del Comité Asesor Nacional para la Investigación de Animales de Laboratorio directrices establecidas por la Autoridad Agroalimentaria y Veterinaria de Singapur. Se estableció el siguiente protocolo experimental basado en experimentos realizados en 6 ojos de 6 Macaca fascicularis (4 machos y 2 hembras, de 4 a 6 años, de 2,8 a 4,0 kg ).
1. Lograr la inmunosupresión en el modelo NHP
- Comience la inmunosupresión 7 días antes de la cirugía y continúe la inmunosupresión durante todo el período de seguimiento.
- Pesar el NHP antes de la administración de inmunosupresión sistémica para garantizar una dosis precisa del medicamento. El animal se pesa al inicio y semanalmente a partir de entonces.
- Use sirolimus oral, doxiciclina y minociclina para lograr la inmunosupresión sistémica.
- Administrar una dosis de carga de 2 mg de sirolimus oral seguido de una dosis diaria de mantenimiento de 1 mg. Obtener el nivel basal de sirolimus en sangre antes de la administración y controlarlo durante todo el período de seguimiento. Asegurar una concentración de al menos 5 μg/L para una inmunosupresión adecuada.
NOTA: La dosis de Sirolimus no está adaptada al peso. - Administrar una dosis de 7,5 mg/kg de doxiciclina oral al día, dos veces al día.
- Administrar una dosis de 7,5 mg/kg de minociclina oral al día, dos veces al día.
- Administrar una dosis de carga de 2 mg de sirolimus oral seguido de una dosis diaria de mantenimiento de 1 mg. Obtener el nivel basal de sirolimus en sangre antes de la administración y controlarlo durante todo el período de seguimiento. Asegurar una concentración de al menos 5 μg/L para una inmunosupresión adecuada.
- Durante la inmunosupresión, controle todos los NHP para detectar efectos sistémicos adversos. Busque una pérdida significativa de peso corporal (>10%), disminución del apetito y el consumo de agua, pérdida de cabello sin espacio y comportamiento anormal como agresión y letargo. Las evaluaciones se realizarán los días 3, 14 y 1 mes, seguidas de evaluaciones mensuales.
2. Esterilización del instrumento
- Enjuague los instrumentos quirúrgicos con agua destilada.
- Coloque los instrumentos en un baño ultrasónico lleno de 500 ml de agua destilada y 2 ml de desinfectante para instrumentos. Limpie los instrumentos utilizando la función de barrido del baño ultrasónico durante 15 minutos.
- Retire los instrumentos del baño ultrasónico. Enjuague dos veces, a fondo, con agua destilada durante 5 minutos cada enjuague. Seque al aire los instrumentos después del enjuague.
- Coloque los instrumentos en una caja de instrumentos. Autoclave la caja utilizando la configuración del programa universal (esterilización de instrumentos a 134 °C durante 50 min: 30 min para autoclave, 20 min para secado).
3. Preparación de triamcinolona sin conservantes (40 mg/ml)
- Usando una jeringa de 1 ml, retire 1 ml de solución de triamcinolona (10 mg/ml). Transfiéralo a un tubo cónico de 15 ml y mézclelo con 4 ml de solución salina equilibrada estéril (BSS).
- Centrifugar la solución a 120 × g durante 5 min. Asegúrese de que todas las partículas de triamcinolona estén en la parte inferior del tubo cónico. Deseche el sobrenadante (BSS) del tubo cónico.
- Vuelva a suspender las partículas de triamcinolona con 5 ml de BSS estéril en el tubo cónico. Centrifugar la solución a 120 × g durante 5 min. Descarta de nuevo el sobrenadante.
- Repita el paso 3.3 para completar el lavado de las partículas de triamcinolona con BSS (3x).
- Vuelva a suspender las partículas de triamcinolona con 0,25 ml de BSS estéril para alcanzar una concentración de 40 mg/ml.
- Aspire la triamcinolona resuspendida (40 mg/ml) con una jeringa nueva de 1 ml. Coloque una aguja de flauta de punta roma de 25 G y mantenga la jeringa con la solución de triamcinolona lista para uso intraoperatorio.
4. Pretratamiento de los ojos NHP con plasminógeno intravítreo (0,25 μg/μL)
- Una semana antes de la cirugía, administrar una inyección intravítrea (20 μL) de plasminógeno de mono (0,25 μg/μL).
- Sedar el NHP antes del procedimiento con una inyección intramuscular de ketamina (10-20 mg/kg de peso corporal) y una inyección subcutánea de atropina (0,05 mg/kg de peso corporal). Administrar gotas oftálmicas de tetracaína para la anestesia local.
- Antes de la inyección intravítrea, desinfecte la región periorbitaria con povidona yodada al 10%. Desinfectar el ojo administrando povidona yodo al 5% a los fornices conjuntivales del NHP. Asegúrese de que la solución permanezca en los fornices durante al menos 1 minuto antes de enjuagar bien con BSS estéril.
- Utilice una jeringa de 250 μL para aspirar el plasminógeno de mono prediluido (0,25 μg/μL) del vial. Conecte una aguja de 30 G a la jeringa y mantenga el plasminógeno de mono listo para la administración intravítrea.
- Use un par de pinzas para identificar el sitio de inyección en el ojo. Administrar la inyección intravítrea a 3 mm de distancia del limbo.
- Proceda con la inyección con la aguja dirigida hacia el centro del globo. Al retirar la aguja del globo, use un aplicador de algodón para taponar el sitio de inyección y prevenir el reflujo del contenido intraocular.
- Administre un gel lubricante o ungüento para reducir la irritación inmediata de la superficie ocular postoperatoria.
5. Mesa quirúrgica y configuración del equipo
- Establecer un campo estéril. Cuando esté en el campo estéril, use exfoliantes quirúrgicos, máscara y cubierta para el cabello en todo momento.
- Preparar la triamcinolona sin conservantes (40 mg/ml) para la visualización intraoperatoria del vítreo (ver sección 3). Prepare el BSS estéril en una jeringa de 10 ml y el lubricante en una jeringa de 5 ml. Colócalos sobre una cortina.
- Mantenga otros instrumentos listos en una cortina, incluyendo seda 3-0, suturas vicryl 7-0, palos aplicadores de algodón, tiras de cierre de heridas y alambre de fibra de endoiluminación de araña.
- Conecte el conjunto de vitrectomía, incluido el vitrector de alta velocidad, el cassette Venturi y el endoiluminizador de araña de 25 G a la máquina de vitrectomía mediante técnica estéril.
- Abra una botella BSS de grado oftálmico de 500 ml y conéctela al cassette Venturi de acuerdo con las instrucciones del fabricante. Proceda a cebar el sistema.
- Encienda el microscopio miOCT/quirúrgico. Seleccione las configuraciones preestablecidas del microscopio quirúrgico para la cirugía del segmento posterior y la iluminación. Ingrese los detalles del procedimiento, incluida la identificación, el sexo, la lateralidad del ojo del animal y el nombre del procedimiento.
- Monte una lente de fondo de ojo de 128 grados, sin contacto, gran angular.
- Coloque cubiertas estériles desechables para piezas de mano en el microscopio quirúrgico / miOCT. Ajuste la posición y el enfoque del microscopio con el pedal. Proceda con la cirugía.
6. Preparación de la anestesia y posicionamiento del animal (preferiblemente realizado por un equipo veterinario)
- Asegúrese de que el NHP esté en ayunas durante al menos 8 horas antes de la inducción de la anestesia para prevenir la regurgitación y los vómitos. Sedar el NHP antes de la inducción de la anestesia (ver paso 4.2 para las instrucciones de sedación).
- Aplique gotas oftálmicas de tropicamida al 1% y fenilefrina al 2,5% al menos 3 veces con intervalos de 5 minutos para lograr la dilatación de la pupila.
- Administrar una inyección intramuscular de buprenorfina (0,005-0,03 mg/kg de peso corporal) 30 min antes de la cirugía para lograr la analgesia.
- Intubar el NHP con un tubo endotraqueal, generalmente de 3-5 mm de tamaño. Cuando intente la intubación, asegúrese de que haya varios tamaños disponibles. Use el tamaño más grande que se pueda pasar a través de la laringe sin causar trauma. Mida el CO2 de marea final para garantizar la colocación adecuada del tubo endotraqueal.
- Administrar gas isofluorano al 2% a través del tubo endotraqueal para inducir la anestesia general. Confirme el estado de la anestesia general (falta de respuesta al tacto) evaluando la respuesta del NHP a los estímulos circundantes, incluidos los sonidos y el tacto. Use gas isofluorano al 0.5-2% para mantener el estado de anestesia general.
- Controle continuamente el electrocardiograma NHP, la frecuencia respiratoria, la presión arterial y la saturación de oxígeno durante toda la cirugía.
- Coloque el NHP en la mesa quirúrgica de tal manera que el ojo sea perpendicular al microscopio quirúrgico. Administre un gel o ungüento lubricante al ojo, que no está siendo operado para reducir la irritación de la superficie ocular durante la anestesia.
- Corte las pestañas con tijeras para reducir la posibilidad de infecciones.
- Desinfectar la región periorbitaria con 10% de povidona-yodo. Desinfectar el ojo administrando povidona yodo al 5% a los fornices conjuntivales del NHP. Asegúrese de que la solución permanezca en los fornices durante al menos 1 minuto antes de enjuagar bien con BSS estéril.
- Coloque una cortina estéril de tal manera que la abertura previa al corte se centre sobre el ojo para someterse a una cirugía. Cubra el ojo con una cortina de incisión quirúrgica adhesiva.
- Realizar una cantotomía lateral en el ojo para someterse a cirugía.
- Inserte el espéculo de Lieberman para asegurar una apertura adecuada de los párpados para la visualización del ojo.
7. Vitrectomía
NOTA: Para acceder al espacio subretiniano para la administración del injerto RPE de andamio PET, este protocolo recomienda una vitrectomía de 25 G de 4 puertos (con válvula) que se realizará utilizando una configuración quirúrgica vitreorretiniana estándar y una lente de fondo de ojo gran angular y sin contacto de 128 °. El protocolo también recomienda el uso de un microscopio quirúrgico equipado con miOCT para guiar varios pasos quirúrgicos críticos, incluida la inducción del desprendimiento de foveal, la implantación del injerto de EPR y el drenaje de líquido subretiniano.
- Realice una peritomía conjuntival de 360° incizando la conjuntiva cerca del limbo usando un par de tijeras vannas. Agrandar la peritomía realizando una disección contundente.
- Usando una cuchilla microvitreorretiniana de 25 G, realice una esclerotomía a las 8 en punto para el ojo derecho o a las 4 en punto para el ojo izquierdo. Realizar la esclerotomía a 3 mm del limbo del ojo.
- Inserte y suture una cánula de infusión de puerto lateral personalizada de 25 G con sutura vicryl 7-0. Después de confirmar la ubicación intravítrea, inicie la infusión de BSS y configure el sistema para mantener una PIO de 20 mmHg.
- Usando un trochar de cabeza plana de 25 G, realice una esclerotomía a las 2 en punto para el ojo derecho o a las 10 en punto para el ojo izquierdo, como en el paso 7.2.
- Inserte la luz de la araña de 25 G en el trochar de cabeza plana y asegúrelo con cinta adhesiva. Ajuste la fuente de luz a aproximadamente el 60%.
- Realice otra esclerotomía, similar al paso 7.2, a las 10 en punto para el ojo derecho o a las 2 en punto para el ojo izquierdo. Coloque suturas vicryl 7-0 en forma de U alrededor de la esclerotomía sin atar los nudos. Inserte la punta del cortador de vitrectomía a través de esta esclerotomía.
- Comience la vitrectomía alrededor de los puertos de entrada, seguida de una vitrectomía de núcleo corto con los siguientes ajustes: máximo 5000 cortes por minuto, aspiración máxima a 400 mmHg.
- Inyecte 20-50 μL de triamcinolona (40 mg/ml) para una mejor visualización vítrea.
- Inducir un desprendimiento de vítreo posterior (PVD) separando el cuerpo vítreo de la retina.
- Coloque el vitrector sobre el disco óptico para permitir una inducción suave del PVD. Mantenga el vitrector solo en aspiración al ajuste máximo de 400 mmHg sin ningún corte involucrado.
- Si es necesario, use fórceps intraoculares de 25 G para manipular el vítreo en el margen del disco para crear un desgarro en la corteza vítrea para facilitar el desprendimiento.
NOTA: La PVD se considera exitosa si los cristales de triamcinolona se deslizan sin obstáculos sobre la superficie de la retina.
- Abra la membrana hialoide posterior con el cortador y retire la falda vítrea desprendida hasta la base vítrea (en el ecuador retiniano). Aspire cualquier triamcinolona restante en la superficie de la retina.
8. Desprendimiento foveal guiado por miOCT
- Inyecte 1-2 ml de PFCL para cubrir el polo posterior hasta la retina anterior y periférica media.
- Ingrese al ojo con una cánula de inyección subretiniana. Ajuste la PIO a 0-4 mmHg en la máquina de vitrectomía (asegúrese de un sistema perfectamente estanco; si es necesario, ate las suturas alrededor de los puertos).
- Usando la cánula de inyección subretiniana de doble orificio personalizada de 25/41 G o la cánula de inyección subretiniana de 25/38 G conectada a una jeringa de 250 μL, realice suavemente una inyección subretiniana de BSS para inducir un desprendimiento de retina localizado. Una vez que la ampolla acaba de cruzar la fóvea, detenga la inyección. Cree una segunda ampolla desde una dirección separada. Fusiona ambas ampollas para separar completamente la fóvea.
- Habilite la función miOCT para visualizar la formación de ampollas. Asegúrese de que los escaneos de línea y cubo estén en modo HD con la configuración (512 x 128 píxeles, ancho de escaneo de 4 mm) para adquirir una imagen en la fóvea. Observe la imagen miOCT para un desprendimiento completo de la retina neural de la capa de EPR en la fóvea.
- Ampliar la retinotomía a 1,5 mm con un par de tijeras vitreorretinianas verticales de 25 G para permitir el acceso al espacio subretiniano para el trasplante.
9. Eliminación de RPE nativo
- Ajuste la PIO a 50 mmHg en la máquina de vitrectomía.
- Retire el PFCL mediante extrusión activa utilizando una cánula de punta de silicona cepillada.
- Extienda la esclerotomía con un cuchillo de incisión de 1,4 mm para permitir la entrada de un instrumento de 20 G.
- Usando un instrumento de bucle extensible personalizado de 20 G, raspe el RPE del host submacular para su eliminación. Raspe un área que mida al menos 2 x 3 mm.
10. Carga del tirador para la entrega de trasplante monocapa de células RPE
- Para obtener instrucciones generales sobre la carga de un injerto en forma de bala cortado a partir de cultivos RPE en portadores de células PET, consulte una publicación anterior22.
11. Implantación de injerto guiada por miOCT y ajuste de posición
- Inserte la punta del dispositivo tirador a través de la esclerotomía a una PIO de 20 mmHg. Inyecte el implante hacia el espacio subretiniano a través del borde de la retinotomía creado a partir de la superficie de la retina.
- Inyecte el implante con el lado portador de células frente a la membrana de Bruch y el lado del xenoinjerto RPE frente a los fotorreceptores.
- Habilite la función miOCT para visualizar la ubicación del implante. Asegúrese de que el implante descanse sobre la membrana de Bruch en el espacio subretiniano, con una retina recubierta intacta. Asegúrese de que se encuentre a una distancia razonable de la retinotomía creada y que no afecte el sitio de la retinotomía.
- Ajuste la posición del implante con la cánula de inyección subretiniana o una tijera intraocular curvada de 25 G para asegurarse de que esté bien posicionada debajo de la mácula.
12. drenaje guiado por miOCT del líquido subretiniano
- Usando una cánula de punta de silicona cepillada, realice un intercambio fluido-aire y un cuidadoso drenaje de líquido subretiniano. Intente una aspiración suave del líquido subretiniano desde el desprendimiento de retina de la ampolla y la aposición del borde de la retinotomía.
- Habilite la función miOCT para la visualización en tiempo real del drenaje adecuado del líquido subretiniano hasta que la retina se vuelva a unir sobre el implante.
13. Finalización de la operación
- Cierre la esclerotomía del puerto de trabajo con la sutura vicryl 7-0 precolocada. Retire la lámpara de araña de 25 G y la cánula de infusión de 25 G. Cierre estas esclerotomías con 7-0 suturas vicryl.
- Administrar 2 mg en 0,05 ml de triamcinolona libre de conservante intravítreo (40 mg/ml) a las 8 en punto de la esclerotomía antes de la sutura.
- Palpe el ojo para asegurarse de que la PIO está dentro del rango aceptable. Inyecte aire filtrado (o BSS) a través de una aguja de 30 G si es necesario.
- Suturar la conjuntiva con 7-0 suturas vicryl y cantotomía con 5-0 proleno (retirar después de 10-14 días).
14. Cuidado postoperatorio de animales
- Coloque el NHP boca abajo durante 1 h después de la cirugía. No deje al animal desatendido hasta que se haya recuperado la conciencia. Asegúrese de que un veterinario y un técnico de cuidado de animales estén disponibles para la observación y el apoyo durante el proceso postoperatorio.
- Aplique antibiótico tópico (tobramicina), ungüento con esteroides (dexametasona) y gotas oftálmicas de homatropina dos veces al día durante 5 días después de la operación.
- Administrar otra inyección subcutánea de buprenorfina (0,005-0,03 mg/kg de peso corporal) 6 h después de la cirugía para un control adecuado del dolor.
- Devolver el NHP a la compañía de otros animales sólo cuando haya recuperado completamente la conciencia.
- Realice seguimientos de imágenes multimodales los días 3, 14 y 1 después del procedimiento, seguidos de chequeos mensuales. Realice ERG cada mes después del procedimiento. Retire las suturas de proleno 5-0 para la cantotomía en el día 14 simultáneamente con el período de sedación utilizado para las imágenes multimodales. Las suturas restantes son reabsorbibles, 7-0 suturas vicryl, que no requieren eliminación.
15. Métodos de monitorización postoperatoria para imágenes multimodales
- Rápido el NHP durante la noche. Sedar el NHP justo antes de la toma de imágenes (ver paso 4.2 para el fármaco y la concentración para la sedación). Si la sedación es insuficiente para detener el movimiento ocular, considere el uso de anestesia general.
- Aplique gotas oftálmicas de tropicamida al 1% y fenilefrina al 2,5% para lograr la dilatación de la pupila antes de la obtención de imágenes (ver paso 6.2).
- Realice la autofluorescencia (FA), la angiografía con fluoresceína del fondo de ojo (FFA) y la tomografía de coherencia óptica (OCT) utilizando una máquina oct de alta resolución con una lente de campo de 55 ° y una lente de campo de 30 °.
- Administrar fluoresceína intravenosa al 10% (0,1 ml/kg de peso corporal) para la FFA. Para obtener una imagen de fase temprana, capture una imagen dentro de los 30 s posteriores a la inyección. Para una imagen de fase tardía, capture una imagen 5-10 minutos después de la inyección.
- Realice fotografías de fondo de ojo utilizando una cámara de fondo de ojo entre las fases temprana y tardía de FFA.
16. Métodos de monitorización postoperatoria para estudios de electrorretinograma de campo completo (ERG)
- Ayuna los NHP durante la noche. Sedar el NHP antes de los estudios de ERG (ver paso 4.2 para el fármaco y la concentración para la sedación). A lo largo de las grabaciones de ERG, vuelva a administrar la sedación cuando sea apropiado.
- Imágenes multimodales separadas y grabaciones ERG con un intervalo de al menos 2-3 días.
- Una vez sedado, asegúrese de que el NHP esté adaptado a la oscuridad durante 30 minutos antes de la grabación ERG.
- Coloque los electrodos de aguja subdérmica de acero inoxidable en el canthi lateral izquierdo y derecho (electrodos de referencia) y en la parte posterior del cuerpo NHP (electrodo de tierra). Coloque los electrodos de lentes de contacto ERG en la córnea NHP usando gel vidisic para ayudar al contacto y la adhesión.
- Basar todas las pruebas de ERG en los protocolos humanos recomendados por la Sociedad Internacional de Electrofisiología Clínica de la Visión (ISCEV)14. Comience la grabación ERG en condiciones escotópicas y comience con los destellos de atenuación. Siga las recomendaciones de ISCEV para los intervalos interestímulos recomendados.
- Asegúrese de que el NHP esté adaptado a la luz durante 10 minutos antes de las pruebas fotográficas, nuevamente utilizando las recomendaciones estándar de ISCEV para la intensidad del fondo.
17. Eutanasia de NHP
- Para sacrificar el NHP para la enucleación, administre pentobarbital de sodio intravenoso (75 mg / kg), según lo recomendado por el Panel de Eutanasia de la Asociación Americana de Medicina Veterinaria.
Resultados
Las modalidades de imagen multimodal (fotografía de fondo de ojo, imágenes de autofluorescencia de fondo de ojo (FAF), angiografía de fluoresceína de fondo de ojo (FFA)-fase temprana y fase tardía, y tomografía de coherencia óptica (OCT)) destacan las características de un trasplante de injerto de EPR submacular exitoso (Figura 1). La fotografía del fondo de ojo muestra el posicionamiento del trasplante de injerto RPE en la fóvea sin migración a lo largo del tiempo. Las imágenes de FAF muestran cambios mínimos en la hiperautofluorescencia (demostrada por áreas blancas de alta intensidad) que se superponen al injerto de EPR. La FFA de fase temprana y tardía no muestra ninguna fuga obvia (demostrada por áreas blancas de alta intensidad que se agrandan con el tiempo) que rodean el injerto de EPR. Las imágenes iniciales en el día 3 muestran un defecto en la ventana debido a la eliminación de RPE nativo antes de la implantación del injerto. Las imágenes de OCT macular muestran la preservación de las capas externas de la retina (en particular, la capa fotorreceptora) sobre el injerto de EPR a medida que avanza el tiempo. La tinción de hematoxilina y eosina muestra capas retinianas intactas sin evidencia de microdesgarros. La preservación de la capa nuclear externa por encima de las periferias del injerto sugiere que las células RPE están realizando sus funciones fisiológicas de mantener la salud de los fotorreceptores.
Las vistas intraocular y externa de la cánula de doble orificio de 25/41 G resaltan el mecanismo por el cual se controla la PIO durante la inyección subretiniana (Figura 2). BSS entra en el espacio subretiniano durante la inyección de líquido subretiniano a través de la cánula central más larga. Los aumentos significativos en la presión intraocular hacen que el BSS dentro de la cavidad vítrea salga del ojo a través del orificio metálico más grande de la cánula. BSS luego viaja a lo largo de la cánula y finalmente es expulsado del puerto de salida cerca del centro de la cánula. Para evaluar si la cánula está funcionando como se esperaba, asegúrese de que el fluido fluya desde el puerto de salida cerca del centro de la cánula.
El miOCT permite la visualización de las dimensiones de la ampolla y un potencial desgarro foveal intraoperatoriamente durante el desprendimiento foveal (Figura 3). Figura 3A1-A3 resalta un caso de ampolla con un desgarro foveal. En la Figura 3A1, mientras que la ampolla inferior es visible bajo el microscopio quirúrgico, la visualización del desgarro es difícil. La Figura 3A2 muestra la sección longitudinal de una ampolla sin desgarros. La Figura 3A3 muestra un desgarro foveal al evaluar la sección vertical de la ampolla. La figura 3B1-B3 muestra una mancha creada con éxito sin la presencia de lágrimas.
La ausencia de deterioro significativo en las formas de onda ERG sugiere que la función global de los fotorreceptores de bastones y conos se mantiene con xenoinjertos subretinianos de EPR (Figura 4). Las formas de onda ERG muestran la función general de la retina. En particular, se debe prestar atención a las ondas A para determinar cualquier pérdida de la función fotorreceptora.

Figura 1: Análisis postoperatorio in vivo con imagen multimodal. (A) Imágenes in vivo del trasplante de injerto de EPR submacular del ojo izquierdo (amarillo en la fotografía del fondo de ojo) en varias modalidades de imagen (columnas de izquierda a derecha: fotografía del fondo de ojo, autofluorescencia, angiografía con fondo de ojo con fluoresceína-fase temprana, angiografía con fondo de ojo fluoresceína-fase tardía, tomografía de coherencia óptica) para puntos de tiempo de hasta 3 meses (filas superiores a inferiores: días 3, 14; Meses 1, 3). El asterisco en la fotografía del fondo de ojo indica el sitio de la retinotomía; la flecha discontinua blanca indica la dirección del escaneo de línea. La forma amarilla dibujada en las imágenes de autofluorescencia del fondo de ojo resalta la ubicación del trasplante. Los triángulos blancos en las imágenes octanuales indican los bordes laterales respectivos del injerto (según el escaneo de línea en la imagen del fondo de ojo en color). (B) Tinción de hematoxilina y eosina del trasplante bajo fóvea atrófica (debido a desgarro intraoperatorio) con capas marcadas. Barras de escala = 1 mm en A (imágenes de autofluorescencia y FA), 200 μm en A (imágenes oct) y 100 μm en B. Abreviaturas: FA = angiografía de fondo de ojo; OCT = tomografía de coherencia óptica; RGC = capa de células ganglionares de la retina; INL = capa nuclear interna; ONL = capa nuclear exterior; EPR = epitelio pigmentario de la retina. Haga clic aquí para ver una versión más grande de esta figura.
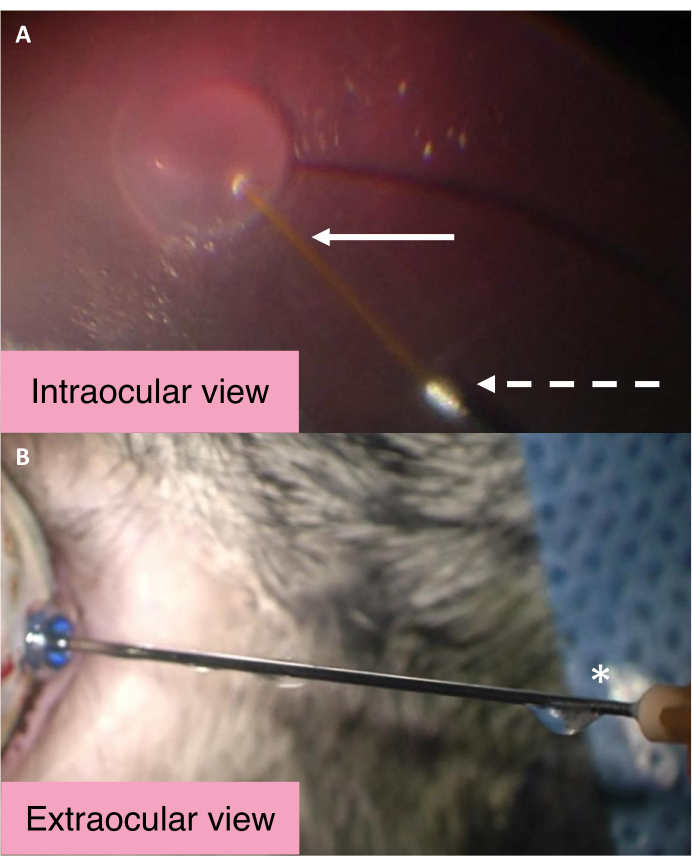
Figura 2: Vistas intraoculares y externas de la cánula de doble orificio de 25/41 G. (A) Vista intraocular de la cánula de doble orificio de 25/41 G durante la creación de la ampolla subretiniana. La flecha blanca apunta a la cánula central más larga para la inyección subretiniana. La flecha discontinua apunta a la abertura de la cánula de salida a través de la cual pasa el BSS para salir del ojo. (B) Vista externa de la cánula de doble diámetro de 25/41 G. El asterisco marca el puerto de salida cerca del cubo de la cánula desde el que se drena el BSS intraocular. Abreviatura: BSS = solución salina equilibrada. Haga clic aquí para ver una versión más grande de esta figura.
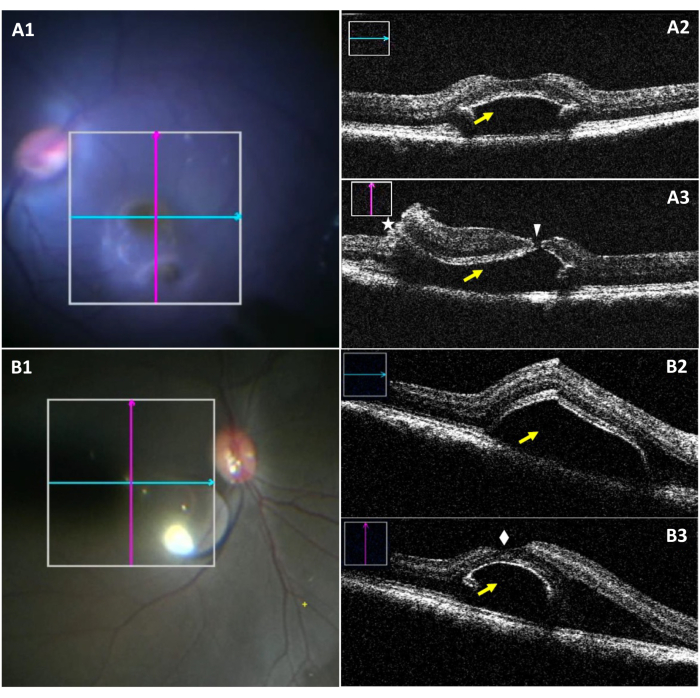
Figura 3: Imágenes de microscopio intraoperatorio e imágenes miOCT de ampolla subretiniana complicada por un desgarro foveal. (A1) Imagen de microscopio intraoperatorio que muestra la posición de las exploraciones longitudinales (azules) y transversales (rojas) en una ampolla con un desgarro foveal. (A2) Gammagrafía miOCT longitudinal que muestra una hemorragia subretiniana en la región foveal (flecha amarilla). (A3) Gammagrafía miOCT transversal que captura un desgarro foveal (punta de flecha blanca), junto con una retinotomía (asterisco y una ampolla subretiniana (flecha amarilla). (B1) Una imagen microscópica intraoperatoria que muestra la posición de las exploraciones longitudinales (azules) y transversales (rojas) en una ampolla formada con éxito. (B2) Gammagrafía miOCT longitudinal que muestra una hemorragia subretiniana en la región foveal (flecha amarilla). (B3) La exploración miOCT transversal muestra una ampolla subretiniana creada con éxito con una fóvea intacta superiormente (diamante blanco). Abreviatura: miOCT = tomografía de coherencia óptica integrada con microscopio. Haga clic aquí para ver una versión más grande de esta figura.
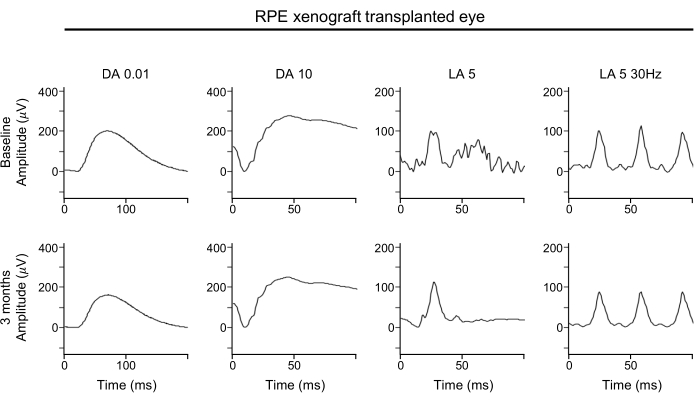
Figura 4: ERG del ojo trasplantado con xenoinjerto RPE. Para la evaluación funcional de la retina, las evaluaciones de ERG de campo completo del ojo xenoinjertado con EPR realizadas al inicio (fila superior) y 3 meses después del trasplante (fila inferior) no muestran ningún efecto significativo del trasplante de xenoinjerto de EPR en ninguna amplitud de respuesta, tiempo o forma de onda en condiciones adaptadas a la oscuridad o a la luz. Abreviaturas: RPE = epitelio pigmentario de la retina; ERG = electrorretinograma; DA = adaptado a la oscuridad; LA = adaptado a la luz. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay dos enfoques principales que se están evaluando para el trasplante de EPR submacular: la inyección de una suspensión de EPR y el trasplante de un injerto de EPR monocapa. Una comparación detallada entre los dos métodos está más allá del alcance de este manuscrito. Sin embargo, el trasplante de un injerto de EPR monocapa puede ser ventajoso ya que las células de EPR están más organizadas en una monocapa que en una suspensión. Las células RPE en el injerto están organizadas en una monocapa confluente, que se asemeja a la organización de la capa celular fisiológica de RPE y permite que las células RPE trasplantadas realicen sus funciones fisiológicas. Esto permite parámetros de dosificación más precisos en comparación con las suspensiones celulares, lo que es muy relevante para el trabajo regulatorio y la ampliación industrial.
La entrega del injerto de parche RPE en el espacio subretiniano requiere una manipulación cuidadosa de la mácula y una inserción precisa del injerto en el espacio subretiniano. Los avances tecnológicos en microcirugía, como miOCT, y una mejor comprensión de la dinámica del tejido retiniano intraoperatorio han reducido la curva de aprendizaje de este procedimiento. En esta discusión, se explicarán los fundamentos de los siguientes aspectos: i) inyección preoperatoria de plasminógeno; ii) el uso de miOCT intraoperatorio; iii) el uso de una cánula personalizada de doble orificio de 41 G, ajustes de PIO baja y PFCL para la creación de ampollas subretinianas; iv) raspado de la capa celular nativa de EPR antes del trasplante; v) el uso de sirolimus, triamcinolona, doxiciclina y minociclina para reducir el rechazo del injerto inmunogénico.
Las inyecciones preoperatorias de plasminógeno liberan adherencias retinianas parafoveales
En los experimentos iniciales, fue difícil separar la fóvea con una sola onda fluida. En la evaluación con miOCT, las imágenes revelaron la presencia de adherencias retinianas externas parafoveales al EPR nativo junto con evidencia de trauma intrarretiniano20. Estas adherencias pueden haber llevado a una expansión vertical de la ampolla en lugar de la onda de líquido subretiniano que se extiende a través del contorno de la retina, lo que resulta en un traumatismo foveal. El plasminógeno es el precursor inactivo de la plasmina, una proteasa dirigida a la fibronectina y la laminina. La ocriplasmina es una variante de bioingeniería de la plasmina humana, aprobada por la Administración de Alimentos y Medicamentos (FDA) y la Agencia Europea de Medicamentos (EMA) para el tratamiento de la tracción vitreomacular sintomática con o sin un agujero macular concomitante. Sin embargo, los informes posteriores a la aprobación del desarrollo de edema de mácula cistoide después de la inyección de ocriplasmina han sugerido un efecto más extenso de la enzima sobre la retina23.
Aunque no se han identificado los mecanismos exactos, se sugirió que la plasmina podría debilitar la adhesión retiniana a través de la degradación de los elementos de la matriz interfotorreceptora responsables de la adhesión fotorreceptor-EPR24. En este protocolo, los ojos NHP fueron tratados con plasminógeno intravítreo 1 semana antes de la cirugía para liberar las adherencias externas parafoveales de la retina. Bajo el supuesto de que la adhesión fotorreceptor-EPR está debilitada, se requiere una fuerza menor para separar la retina neurosensorial, incluido el anillo parafoveal distal, que típicamente resiste la onda del líquido subretiniano20. Por lo tanto, la fuerza administrada durante el desprendimiento de la ampolla retiniana da como resultado la expansión de la ampolla a través del contorno de la retina en lugar de estirar la retina tangencialmente. Esto reduce el riesgo de desgarros foveales. Sin embargo, cabe señalar que el efecto del plasminógeno sobre la supervivencia del injerto a largo plazo no se estudió en este protocolo. Los estudios futuros deben intentar determinar este efecto.
miOCT proporciona retroalimentación anatómica para guiar la creación de ampollas subretinianas, la implantación de injertos y el drenaje de líquido subretiniano
La manipulación intraoperatoria y atraumática de la mácula es clave para lograr buenos resultados de trasplante. Sin embargo, los cambios microestructurales de la mácula relacionados con la manipulación pueden no ser siempre evidentes en el microscopio operativo. En tales procedimientos, el miOCT es una herramienta importante que proporciona retroalimentación intraoperatoria tridimensional en tiempo real de la estructura macular. miOCT es especialmente útil durante los pasos de desprendimiento de foveal, implantación de injertos y drenaje del líquido subretiniano mediante un intercambio fluido-aire. Durante el desprendimiento foveal, miOCT puede determinar las dimensiones verticales y horizontales de la ampolla. Los microdesgarros foveales, que pueden no visualizarse claramente en el microscopio quirúrgico, pueden confirmarse mediante miOCT (Figura 3). Durante la implantación del injerto, las imágenes miOCT guían mostrando la ubicación o proximidad del injerto a la fóvea, a través de la retina desprendida, a menudo menos transparente. miOCT también puede resaltar posibles áreas de adhesión retiniana durante un difícil proceso de trasplante25. Finalmente, en el proceso de drenaje de líquido subretiniano, miOCT puede guiar de manera confiable el drenaje de líquido subretiniano hasta que se logre un contacto completo entre el injerto retinal-RPE.
La combinación de una cánula de doble orificio, ajustes de PIO baja y taponamiento vítreo PFCL reduce sinérgicamente el trauma macular durante la creación de ampollas subretinianas
El estiramiento tangencial de la retina y la turbulencia de líquidos pueden ocurrir durante la inyección subretiniana de BSS para el desprendimiento de foveal que conduce a desgarros foveales no deseados. Para contrarrestar estos fenómenos, factores como la posición relativa y la distancia desde el centro foveal donde se inicia la inyección, el volumen y la velocidad de la inyección, el taponamiento vítreo, la elección de la instrumentación subretiniana y la PIO han demostrado ser relevantes20,26,27. La ampolla subretiniana para el desprendimiento de foveal debe situarse en un lugar adecuadamente distante de la fóvea, ya que el estiramiento de la retina puede ser mayor en el sitio de inicio de la ampolla27. La PIO también debe mantenerse baja durante toda la creación de la ampolla subretiniana. Cuando la PIO del ojo es alta, se observa un mayor aumento vertical en el tamaño de la ampolla en lugar de expansión a lo largo del contorno de la retina, mientras que las ampollas son menos profundas a presiones más bajas20. Además, aunque una inyección intravítrea de 50 μL duplicará efectivamente la PIO en humanos28, dada la longitud ocular más corta en los NHP, el aumento de la PIO durante la inyección subretiniana probablemente será mayor y más rápido que en humanos. Si bien la mayoría de las máquinas de vitrectomía se ajustan a la fluctuación de la PIO, el ajuste no es simultáneo, sino más bien un proceso reactivo que ocurre a medida que avanza la inyección subretiniana. Por lo tanto, cuanto mayor sea la PIO, mayor será el riesgo de estiramiento excesivo de la retina y el trauma foveal resultante. Por lo tanto, es esencial mantener una PIO baja estable durante la inyección subretiniana.
Se recomienda una cánula subretiniana comercial de 20/41 G (DORC) o una cánula subretiniana de doble orificio de 25/41 G hecha a medida para la inyección subretiniana. La cánula permite que el líquido salga de la cavidad vítrea a cambio de BSS inyectado en el espacio subretiniano. Esto asegura la regulación "simultánea" de la PIO durante la inyección subretiniana. Un esquema de la cánula de doble orificio se ve en la Figura 2. Finalmente, pfCL se utiliza para reducir el riesgo de desgarros foveales20,26,27. Como los PFCL, como la octalina, tienen una mayor gravedad específica, ejercen una fuerza descendente sobre la retina durante el desprendimiento de foveal29. Esto estabiliza aún más el proceso de creación de ampollas por desprendimiento foveal y mejora la expansión de la ampolla a lo largo del contorno de la retina. Esta técnica se ha utilizado con éxito para la inyección subretiniana de rtPA en el contexto de hemorragia submacular masiva debido a nAMD30.
La eliminación previa al trasplante de EPR nativo permite la restauración del complejo RPE-fotorreceptor
El EPR del huésped debe extraerse antes del trasplante de injerto. Esto se debe a que se requiere la restauración del complejo RPE-fotorreceptor para permitir que el trasplante de RPE realice sus funciones fisiológicas de soporte de los fotorreceptores21. El RPE huésped, si no se elimina, puede presentarse como una barrera mecánica, lo que impide la restauración de este complejo. Se puede eliminar mediante la administración de productos químicos tóxicos para RPE o mediante el uso de medios físicos de eliminación. Los métodos de eliminación química incluyen la administración sistémica o subretiniana de yodato de sodio31,32. Como el yodato de sodio causa una degeneración generalizada de fotorreceptores, células RPE y Coriocapillaris cuando se administra, su toxicidad retiniana y sistémica impide su uso en ensayos en humanos32,33. Por lo tanto, se prefieren las técnicas físicas intraoperatorias. Se han conceptualizado varios métodos físicos. Cuando se utilizan métodos físicos, es crucial que la membrana de Bruch permanezca intacta. Muchos estudios in vitro han demostrado la dependencia de la supervivencia del injerto de EPR en una membrana de Bruch intacta34,35,36.
Los intentos de desbridamiento hidráulico se asociaron con roturas en la membrana de Bruch, un aumento de la tasa de desarrollo de la membrana epirretiniana y vitreorretinopatía proliferativa, lo que resultó en desprendimiento de retina por tracción37. Una espátula espolvoreada de diamante propuesta para el desbridamiento de RPE también provocó roturas en la membrana de Bruch, lo que resultó en la proliferación celular de la coroides al espacio subretiniano38. Curiosamente, un instrumento de bucle extensible hecho a medida podría eliminar el RPE suprayacente con la preservación de la membrana de Bruch a los ojos de conejos y cerdos11,39. La eliminación del EPR subyacente también es útil para establecer modelos animales con EPR y atrofia externa de la retina, similar a la forma atrófica avanzada de la DMAE. Cuando se elimina un área focal de RPE de la mácula, la herida de RPE se cierra a través de la hipertrofia de las células de RPE restantes. Sin embargo, esta respuesta de cicatrización de heridas se asocia con la atrofia de la capa nuclear externa40. Si bien la creación de un modelo animal está más allá del alcance de este manuscrito, un procedimiento similar puede crear un modelo animal de un fenotipo avanzado de DMAE atrófica para la prueba de terapias celulares derivadas de RPE.
El uso de sirolimus, triamcinolona, doxiciclina y minociclina para reducir el rechazo del injerto inmunogénico
Se cree que el espacio subretiniano es un sitio inmuno-privilegiado, mantenido por una barrera sangre-retina intacta y otros factores41. En muchos estudios relacionados con el trasplante subretiniano de derivados de células madre con una barrera hematoencefaliana intacta, los fármacos inmunosupresores desempeñan un papel insignificante en la supervivencia del injerto42. Se cree que la barrera externa sangre-retina está formada por la capa nativa de EPR y las uniones estrechas entre las células de EPR. Mientras que la eliminación nativa de RPE permite una mejor integración del RPE trasplantado y los fotorreceptores del huésped, la barrera sangre-retina se interrumpe en el proceso, lo que aumenta la probabilidad de un rechazo inmunológico. Clásicamente, las células T son fundamentales para el proceso de rechazo del trasplante de otros órganos como el riñón y el hígado43. Por lo tanto, los regímenes inmunosupresores iniciales para el trasplante de tejido retiniano se dirigieron a reducir estas respuestas inmunes adaptativas.
Sirolimus, un objetivo mecanicista del inhibidor de la rapamicina, y tacrolimus, un inhibidor de la calcineurina, son ejemplos de fármacos inmunosupresores dirigidos a las respuestas inmunitarias adaptativas. Sin embargo, a pesar de la supresión adecuada de las células T, las tasas de supervivencia del injerto siguen siendo bajas. Además, se sabe que las células RPE suprimen la activación de las células T a través de la liberación de factores inhibitorios y promueven la generación de células T reguladoras44. Por lo tanto, se ha vuelto cada vez más evidente que la inmunidad adaptativa puede no ser el único contribuyente al rechazo del injerto42. El trasplante subretiniano de productos celulares puede dar lugar a la acumulación y activación de microglia45.
La microglía son los macrófagos de la retina. Consisten en dos poblaciones principales: 1) la microglía perivascular de la vasculatura interna de la retina y 2) la microglía dentro del parénquima del tejido retiniano. Como la microglía forma parte de la respuesta inmune innata, los glucocorticoides intravítreos, como la triamcinolona, pueden suprimir la proliferación mediada por citoquinas46. La doxiciclina y la minociclina también pueden suprimir la activación microglial y deben considerarse47,48. Por último, las diferencias en el rechazo inmune de los aloinjertos de EPR frente a los xenoinjertos no se comprenden íntegramente49. Por ejemplo, se han notificado aloanticuerpos contra células RPE derivadas de células madre pluripotentes inducidas en el suero de modelos de rechazo inmunitario in vivo. Sin embargo, sigue siendo desconocido el papel de estos anticuerpos y la importancia del rechazo mediado por anticuerpos en la supervivencia del injerto50. Por lo tanto, se propone un régimen multifarmacológico que utiliza sirolimus para la supresión de la inmunidad adaptativa y una combinación de triamcinolona, doxiciclina y minociclina para la supresión de la inmunidad innata. Este régimen se ha utilizado con éxito en conejos con buenos resultados de supervivencia del injerto y efectos sistémicos mínimos11.
Limitaciones de esta técnica quirúrgica
Este artículo describe un posible método quirúrgico para administrar una hoja de injerto de EPR en el espacio subretiniano de nhp; sin embargo, esto no significa que esta sea la única forma optimizada. Diferentes cirujanos vítreo-retinianos pueden tener otras preferencias por la instrumentación y la técnica. Por ejemplo, este diseño de dispositivo de implantación solo puede entregar implantes planos soportados con un portador de células más rígido y, por lo tanto, puede no ser adecuado para implantes relativamente flexibles (o enrollados). Los trasplantes en suspensión de EPR pueden omitir gran parte de esta técnica. En consecuencia, los detalles quirúrgicos requerirán modificaciones en función de cada estrategia de entrega.
A medida que el interés en la terapéutica celular para el tratamiento de enfermedades degenerativas de la retina continúa creciendo, el modelo animal NHP será esencial en estudios preclínicos para estudiar los factores que afectan la supervivencia del injerto de EPR. En este manuscrito, se proponen estrategias para permitir la entrega más suave de un injerto de EPR monocapa submacular en el ojo NHP. También se recomiendan métodos para una mejor visualización de las complicaciones intraoperatorias. Se anticipa que estos métodos continuarán mejorando a medida que se expanda el uso de la terapéutica celular. Los futuros documentos de métodos también deben considerar la propuesta de una lista completa de investigaciones para evaluar varios aspectos estructurales y funcionales del injerto.
Divulgaciones
Boris Stanzel tiene una patente estadounidense 9980851 sobre un instrumento (raspador de RPE) utilizado en este estudio. Conferencista honorarios de C. Zeiss Meditec y Geuder a Boris Stanzel. Los otros autores no tienen ningún conflicto de intereses que declarar.
Agradecimientos
Este estudio fue apoyado por IAF-PP (HMBS Domain) (OrBID): OculaR BIomaterials and Device, A*STAR, Singapur (H17/01/a0/013), la subvención NUS Start-up NUHSRO/2016/100/SU/01, la subvención del Programa de Científicos Clínicos de NUHS (NCSP) y el Programa de Investigación Competitiva de la Fundación Nacional de Investigación, Singapur (NRF-CRP21-2018-0008) a X.S., Hong Leong Fondos de Cátedra Dotada a G.E.H. y B.V.S. Nos gustaría agradecer al equipo veterinario de la Plataforma de Modelos Preclínicos Traslacionales (Instituto de Investigación Ocular de Singapur, Singapur) por brindar apoyo en la preparación de la cirugía NHP y el seguimiento de animales. Nos gustaría extender nuestro agradecimiento a Jill Teo y sus colegas de C. Zeiss Meditec Singapur por el soporte técnico para el OPMI-Lumera 700 con dispositivo OCT intraoperatorio integrado.
Materiales
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
Referencias
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217 (2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719 (2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603 (2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077 (2020).
- The Architecture Of The Human Fovea. Webvision. Moran Eye Center Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021)
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927 (2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10 (2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -. H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514 (2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11 (2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161 (2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209 (2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados