Method Article
Transplante de Epitélio de Pigmento De Retina em um modelo de primata não humano para doenças degenerativas da retina
* Estes autores contribuíram igualmente
Neste Artigo
Erratum Notice
Resumo
O primata não humano (NHP) é um modelo ideal para estudar a terapêutica celular da retina humana devido às semelhanças anatômicas e genéticas. Este manuscrito descreve um método de transplante submacular de células epiteliais de pigmento retiniano no olho nHP e estratégias para prevenir complicações intraoperatórias associadas à manipulação macular.
Resumo
O transplante epitelial de pigmento retiniano (RPE) é uma grande promessa para o tratamento de doenças degenerativas da retina herdadas e adquiridas. Essas condições incluem retinite pigmentosa (RP) e formas avançadas de degeneração macular relacionada à idade (AMD), como atrofia geográfica (GA). Juntos, esses transtornos representam uma proporção significativa da cegueira atualmente intratável globalmente. Essas necessidades médicas não atendidas têm gerado maior interesse acadêmico no desenvolvimento de métodos de substituição de RPE. Entre os modelos animais comumente utilizados para testes pré-clínicos de terapêutica, o primata não humano (NHP) é o único modelo animal que possui uma mácula. Como compartilha essa semelhança anatômica com o olho humano, o olho NHP é um importante e apropriado modelo animal pré-clínico para o desenvolvimento de medicamentos de terapia avançada (ATMPs) como a terapia celular RPE.
Este manuscrito descreve um método para o transplante submacular de uma monocamada RPE, cultivada em um portador de células de tereftalato de polietileno (PET), sob a mácula em uma ferida RPE cirurgicamente criada em NHPs imunossupressores. A parte avascular central da mácula é o local da maior fraqueza mecânica durante o transplante. O trauma foveal ocorrerá se a injeção inicial de fluido subretinal gerar uma força excessiva na retina. Assim, a injeção lenta sob o tampão vítreo de líquido perfluorocarbono (PFCL) é recomendada com uma cânula de injeção subretinal de duplo furo em configurações de baixa pressão intraocular (IOP) para criar uma bleb de retina.
O pré-tratamento com uma injeção de plasminogênio intravitreal para liberar aderências parafoveais de fotorreceptor RPE também é aconselhado. Essas estratégias combinadas podem reduzir a probabilidade de lágrimas de potro quando comparadas às técnicas convencionais. O NHP é um modelo animal chave na fase pré-plínica do desenvolvimento da terapia celular RPE. Este protocolo aborda os desafios técnicos associados à entrega da terapia celular RPE no olho NHP.
Introdução
O transplante de RPE é uma grande promessa para o tratamento de doenças degenerativas da retina herdadas e adquiridas. Essas condições incluem retinite pigmentosa (RP, distrofia de rod-cone) e formas avançadas de DPA, como GA. Coletivamente, esses distúrbios representam uma proporção significativa da cegueira atualmente intratável globalmente1,2. Os estágios avançados da AMD são categorizados em AMD neovascular (nAMD) e GA. Embora existam opções eficazes de tratamento para nAMD, como injeções de fator de crescimento endotelial anti-vascular (anti-VEGF), pacientes com GA têm opções limitadas de tratamento. RP é um grupo altamente heterogêneo de distúrbios herdados da retina caracterizado pela degeneração progressiva do fotorreceptor da retina. Em alguns pacientes, o defeito genético causador está localizado dentro do RPE e não nos fotorreceptores; portanto, a terapia de substituição de RPE pode ser uma estratégia alternativa se a terapia genética não for viável.
Há um interesse significativo em desenvolver tratamentos eficazes para essas condições. Em particular, o transplante de RPE vem ganhando força como uma abordagem terapêutica potencial3,4,5,6,7,8. Desde que os primeiros relatos sobre transplante de RPE surgiram na década de 1980, o campo expandiu-se para incluir várias fontes celulares RPE, estratégias de parto e modelos experimentais de doenças e transplantes10,11,12,13,14. Entre os vários modelos animais, apenas o NHP possui uma 'mula lutea' com um 'fovea centralis', uma especialização anatômica no polo posterior da retina compartilhada com os humanos. O fovea contém uma densidade muito alta de fotorreceptores de cone que permitem visão central de alta resolução15. O NHP também tem uma maquiagem genômica e proteômica semelhante16 quando comparada com os humanos. Essas semelhanças fazem dele um importante e adequado modelo animal para o estudo de doenças oculares que afetam a retina humana17,18.
Este manuscrito descreve um método para o transplante submacular de um xenoenxerto RPE, apoiado por um portador de células PET, em NHPs imunossupressores. Uma técnica transvitreal para transplante de RPE subretinal em coelhos foi descrita em um manuscrito anterior19. No entanto, nas NHPs, a presença da fovea requer cuidados particulares durante a manipulação intraoperatória20. Em particular, há um alto risco de uma ruptura de potro se métodos de injeção de fluidos subretinar geram uma força excessiva na retina20. O foco deste manuscrito está, portanto, em estratégias para reduzir o risco de trauma foveal inadvertido no PSN.
Estes incluem o uso de injeção de plasminogen intraconoperatório pré-operatório para a liberação de aderências parafoveais e tomografia de coerência óptica integrada por microscópio cirúrgico (miOCT) intraoperatória para visualização em tempo real da anatomia foveal. Uma cânula subretinal de duplo furo 25/41 G com tamponade PFCL intraocular em configurações de IOP baixas é proposta para permitir um processo mais controlado de descolamento foveal. Além disso, recomenda-se a remoção cirúrgica de RPE nativo antes da implantação para permitir uma melhor integração entre as células RPE transplantadas e os fotorreceptores do hospedeiro. Finalmente, um protocolo de imunossupressão sistêmica peri e pós-operatória para modelos de NHP é descrito para melhorar a sobrevivência do xenerto RPE pós-transplante11,21.
Protocolo
NOTA: Todos os experimentos em animais foram realizados de acordo com a Associação de Pesquisa em Visão e Oftalmologia (ARVO) para o Uso de Animais em Pesquisa Oftalmológica e De Visão. A aprovação ética foi obtida no Comitê Institucional de Cuidados e Uso de Animais, SingHealth, Cingapura. Os animais foram alojados no Centro de Medicina Experimental SingHealth aprovado pela Associação de Avaliação e Acreditação de Cuidados Com Animais Laboratoriais (AAALAC). Esta aprovação destaca que todos os experimentos com animais cumprem as normas do Comitê Consultivo Nacional para as Diretrizes de Pesquisa Animal laboratorial estabelecidas pela Autoridade Agroalimentar e Veterinária de Cingapura. O protocolo experimental a seguir foi estabelecido com base em experimentos realizados em 6 olhos de 6 macaca fascicularis (4 homens e 2 mulheres, 4 a 6 anos, 2,8 a 4,0 kg) .
1. Alcançar a imunossupressão no modelo NHP
- Inicie a imunossupressão 7 dias antes da cirurgia e continue a imunossupressão durante todo o período de seguimento.
- Pesar o NHP antes da administração da imunossupressão sistêmica para garantir a dosagem precisa da medicação. O animal é pesado na linha de base e semanalmente depois disso.
- Use sirolimus oral, doxiciclina e minocícica para alcançar a imunossupressão sistêmica.
- Administrar uma dose de carga de 2 mg de sirolimus oral seguido de uma dosagem diária de manutenção de 1 mg. Obtenha o nível de sirolimus de sangue da linha de base antes da administração e monitore isso durante todo o período de seguimento. Certifique-se de uma concentração de pelo menos 5 μg/L para uma imunossupressão adequada.
NOTA: A dose de sirolimus não é adaptada ao peso. - Administre uma dose de 7,5 mg/kg de doxiciclina oral por dia, duas vezes por dia.
- Administrar uma dose de 7,5 mg/kg de minocilina oral por dia, duas vezes por dia.
- Administrar uma dose de carga de 2 mg de sirolimus oral seguido de uma dosagem diária de manutenção de 1 mg. Obtenha o nível de sirolimus de sangue da linha de base antes da administração e monitore isso durante todo o período de seguimento. Certifique-se de uma concentração de pelo menos 5 μg/L para uma imunossupressão adequada.
- Durante a imunossupressão, monitore todas as NHPs para efeitos sistêmicos adversos. Procure uma perda significativa de peso corporal (>10%), diminuição do apetite e consumo de água, queda de cabelo sem espaço e comportamento anormal, como agressão e letargia. As avaliações serão feitas nos dias 3, 14 e 1 mês, seguidas de avaliações mensais.
2. Esterilização de instrumentos
- Enxágüe os instrumentos cirúrgicos usando água destilada.
- Coloque os instrumentos em um banho ultrassônico recheado com 500 mL de água destilada e 2 mL de desinfetante de instrumentos. Limpe os instrumentos usando a função de varredura do banho ultrassônico por 15 minutos.
- Remova os instrumentos do banho ultrassônico. Enxágüe duas vezes completamente com água destilada por 5 minutos cada enxágue. Seque o ar dos instrumentos após a lavagem.
- Coloque os instrumentos em uma caixa de instrumentos. Autoclave a caixa usando a configuração universal do programa (esterilização de instrumentos a 134 °C para 50 min: 30 min para autoclaving, 20 min para secagem).
3. Preparação de triamcinolone sem conservantes (40 mg/mL)
- Utilizando uma seringa de 1 mL, retire 1 mL de solução triamcinolone (10 mg/mL). Transfira para um tubo cônico de 15 mL e misture-o com 4 mL de solução de sal estéril (BSS).
- Centrifugar a solução a 120 × g por 5 min. Certifique-se de que todas as partículas de triamcinolone estão na parte inferior do tubo cônico. Descarte o supernatante (BSS) do tubo cônico.
- Suspenda-as as partículas de triamcinolone com 5 mL de BSS estéreis no tubo cônico. Centrifugar a solução a 120 × g por 5 min. Descarte o supernatante novamente.
- Repita o passo 3.3 para completar a lavagem das partículas de triamcinolone com BSS (3x).
- Suspenda-as as partículas triamcinolone com 0,25 mL de BSS estérei para alcançar uma concentração de 40 mg/mL.
- Aspire a triamcinolone re-suspensa (40 mg/mL) com uma nova seringa de 1 mL. Conecte uma agulha de flauta de ponta bruta de 25 G e mantenha a seringa com a solução de triamcinolone pronta para uso intraoperatório.
4. Pré-tratamento de olhos NHP com plasminogen intravitreal (0,25 μg/μL)
- Uma semana antes da cirurgia, administre uma injeção intravitreal (20 μL) de plasminênio de macaco (0,25 μg/μL).
- Sedar o NHP antes do procedimento com uma injeção intramuscular de cetamina (10-20 mg/kg BW) e uma injeção subcutânea de atropina (0,05 mg/kg BW). Administre colírios tetracainas para anestesia local.
- Antes da injeção intravitreal, desinfete a região periorbital com 10% de povidona-iodo. Desinfete o olho administrando 5% de povidona-iodo ao conjuntivo fornices do PNS. Certifique-se de que a solução permaneça nas fornices por pelo menos 1 min antes de enxaguar completamente com BSS estéril.
- Use uma seringa de 250 μL para aspirar o plasminênio de macaco pré-lol (0,25 μg/μL) do frasco. Coloque uma agulha de 30 G na seringa, e mantenha o plasminênio macaco pronto para administração intravital.
- Use um par de pinças para identificar o local da injeção no olho. Administre a injeção intravitreal a 3 mm do limbus.
- Continue com a injeção com a agulha direcionada para o centro do globo. Após a remoção da agulha do globo, use uma vara aplicadora de algodão para tamponar o local da injeção e evitar o refluxo do conteúdo intraocular.
- Administre um gel lubrificante ou pomada para reduzir a irritação imediata da superfície ocular pós-operatória.
5. Configuração de mesa e equipamentos cirúrgicos
- Estabeleça um campo estéril. Quando estiver no campo estéril, use esfregões cirúrgicos, máscara e tampa de cabelo o tempo todo.
- Prepare o triamcinolone livre de conservantes (40 mg/mL) para visualização intraoperatória de vítreo (ver seção 3). Prepare o BSS estéril em uma seringa de 10 mL e lubrificante em uma seringa de 5 mL. Coloque-os em uma cortina.
- Mantenha outros instrumentos prontos em uma cortina, incluindo seda 3-0, suturas vicryl 7-0, palitos aplicadores de algodão, tiras de fechamento de feridas e fio de fibra de endoilluminação do lustre.
- Conecte o conjunto de vitrectomia, incluindo o vitrector de alta velocidade, o Venturi e o endoilluminador de lustre de 25 G à máquina de vitrectomia usando técnica estéril.
- Abra uma garrafa BSS de grau oftálmico de 500 mL e conecte-a ao Venturi de acordo com as instruções do fabricante. Continue com a preparação do sistema.
- Ligue o microscópio miOCT/cirúrgico. Selecione as configurações predefinidas do microscópio cirúrgico para cirurgia e iluminação do segmento posterior. Insira os detalhes do procedimento, incluindo IDENTIDADE, sexo, lateralidade do olho animal e o nome do procedimento.
- Monte uma lente de fundus de 128 graus sem contato.
- Conecte capas de peças de mão descartáveis estéreis no microscópio cirúrgico/miOCT. Ajuste a posição do microscópio e foque usando o pedal do pé. Prossiga com a cirurgia.
6. Preparação da anestesia e posicionamento do animal (preferencialmente realizado pela equipe veterinária)
- Certifique-se de que o NHP esteja em jejum por pelo menos 8 h antes da indução da anestesia para evitar regurgitação e vômitos. Sedar o NHP antes da indução da anestesia (ver passo 4.2 para instruções de sedação).
- Aplique 1% de tropicamida e 2,5% colírios de fenilefrina pelo menos 3x com intervalos de 5 minutos para alcançar a dilatação da pupila.
- Administre uma injeção intramuscular de buprenorfina (0,005-0,03 mg/kg BW) 30 min antes da cirurgia para alcançar a analgesia.
- Entubar o NHP com um tubo endotraqueal, geralmente de 3-5 mm de tamanho. Ao tentar entubação, certifique-se de que vários tamanhos estejam disponíveis. Use o maior tamanho que pode ser passado através da laringe sem causar trauma. Meça o CO2 final da maré para garantir a colocação adequada do tubo endotraqueal.
- Entregue 2% de gás isofluorano através do tubo endotraqueal para induzir anestesia geral. Confirme o estado da anestesia geral (falta de resposta ao toque) avaliando a resposta do PNS aos estímulos circundantes, incluindo sons e toque. Use gás isofluorano de 0,5-2% para manter o estado de anestesia geral.
- Monitore continuamente o eletrocardiograma de NHP, taxa respiratória, pressão arterial e saturação de oxigênio durante toda a cirurgia.
- Posicione o PNC na mesa cirúrgica de modo que o olho seja perpendicular ao microscópio cirúrgico. Administre um gel lubrificante ou pomada ao olho, que não está sendo operado para reduzir a irritação da superfície ocular durante a anestesia.
- Corte os cílios usando uma tesoura para reduzir a chance de infecções.
- Desinfete a região periorbital com 10% de povidone-Iodo. Desinfete o olho administrando 5% de povidona-iodo ao conjuntivo fornices do PNS. Certifique-se de que a solução permaneça nas fornices por pelo menos 1 min antes de enxaguar completamente com BSS estéril.
- Posicione uma cortina estéril de tal forma que a abertura pré-cortada seja centrada sobre o olho para ser submetida a cirurgia. Cubra o olho com uma cortina de incisão cirúrgica adesiva.
- Faça uma cantotomia lateral no olho para ser submetido a uma cirurgia.
- Insira o espéculo lieberman para garantir a abertura adequada das pálpebras para a visualização do olho.
7. Vitrectomia
NOTA: Para acessar o espaço subretral para a entrega do enxerto PET-andaffold RPE, este protocolo recomenda que uma vitrectomia de 4 portas (válvula) 25 G seja realizada utilizando uma configuração cirúrgica vitreoretinal padrão e uma lente de fundus de 128° de ângulo largo. O protocolo também recomenda o uso de um microscópio cirúrgico equipado com miOCT para orientar várias etapas cirúrgicas críticas, incluindo a indução do descolamento foveal, implantação do enxerto RPE e drenagem de fluidos subretinar.
- Realize uma peritomia conjuntiva de 360° incisivando a conjuntiva perto do limbus usando uma tesoura de vannas. Amplie a peritomia realizando uma dissecção contundente.
- Usando uma lâmina microvitreoretinal de 25 G, realize uma esclerotomia às 8 horas para o olho direito ou 4 horas para o olho esquerdo. Realize a esclerotomia 3 mm do limbus do olho.
- Insira e suture uma cânula de infusão de porta lateral personalizada de 25 G usando sutura vicryl 7-0. Após confirmar a localização intravitreal, inicie a infusão de BSS e defina o sistema para manter um IOP de 20 mmHg.
- Usando um trochar de cabeça plana de 25 G, realize uma esclerotomia às 2 horas para o olho direito ou 10 horas para o olho esquerdo, como no passo 7.2.
- Insira a luz do lustre de 25 G no trochar de cabeça plana e fixe-a com fita adesiva. Ajuste a fonte de luz para aproximadamente 60%.
- Faça outra esclerotomia, semelhante ao passo 7.2, às 10 horas para o olho direito ou 2 horas para o olho esquerdo. Coloque as suturas vicryl 7-0 em forma de U ao redor da esclerotomia sem amarrar os nós. Insira a ponta do cortador de vitrectomia através desta esclerotomia.
- Inicie a vitrectomia ao redor das portas de entrada, seguido de uma vitrectomia de núcleo curto com as seguintes configurações: máximo de 5000 cortes por minuto, aspiração máxima de 400 mmHg.
- Injete 20-50 μL de triamcinolone (40 mg/mL) para melhor visualização vítrea.
- Induzir um descolamento vítreo posterior (PVD) separando o corpo vítreo da retina.
- Posicione o vitrector acima do disco óptico para permitir a indução suave do PVD. Mantenha o vitrector apenas na aspiração na configuração máxima de 400 mmHg sem qualquer corte envolvido.
- Se necessário, use fórceps intraoculares de 25 G para manipular o vítreo na margem do disco para criar uma ruptura no córtex vítreo para facilitar o desprendimento.
NOTA: O PVD é considerado bem sucedido se os cristais triamcinolone deslizarem sem impedimentos sobre a superfície da retina.
- Abra a membrana hialoide posterior com o cortador, e remova a saia vítrea destacada até a base vítrea (no equador da retina). Aspire qualquer triamcinolone restante na superfície da retina.
8. descolamento foveal guiado por miOCT
- Injete 1-2 mL de PFCL para cobrir o polo posterior até a retina periférica anterior.
- Entre no olho com uma cânula de injeção subretinal. Defina o IOP para 0-4 mmHg na máquina de vitrectomia (certifique-se de sistema perfeitamente impermeável; se necessário, amarre suturas ao redor das portas).
- Usando a cânula de injeção subretinal personalizada de 25/41 G ou a cânula de injeção subretinal de 25/38 G conectada a uma seringa de 250 μL, realize suavemente uma injeção subretinal de BSS para induzir um descolamento de retina localizado. Uma vez que o bleb cruze a fovea, pare a injeção. Crie uma segunda bleb de uma direção separada. Mescle ambos os blebs para desprender totalmente a fovea.
- Habilite a função miOCT visualize a formação bleb. Certifique-se de que as varreduras de linha e cubos estão no modo HD com as configurações (512 x 128 pixels, largura de varredura de 4 mm) para adquirir uma imagem no fovea. Observe a imagem miOCT para um descolamento completo da retina neural da camada RPE na fovea.
- Amplie a retinotomia para 1,5 mm com um par de tesouras vitreoretinais verticais de 25 G para permitir o acesso ao espaço subretinal para transplante.
9. Remoção de RPE nativo
- Coloque o IOP em 50 mmHg na máquina de vitrectomia.
- Remova o PFCL através de extrusão ativa usando uma cânula de ponta de silicone escovada.
- Estenda a esclerotomia com uma faca de incisão de 1,4 mm para permitir a entrada de um instrumento de 20 G.
- Usando um instrumento de loop extensível personalizado de 20 G, raspe o RPE do host submacular para remoção. Raspe uma área que mede pelo menos 2 x 3 mm.
10. Carregamento do atirador para entrega de transplante de monocamada celular RPE
- Para obter instruções gerais sobre o carregamento de um enxerto em forma de bala cortado das culturas RPE em portadores de células PET, consulte uma publicação anterior22.
11. implantação de enxerto guiado por miOCT e ajuste de posição
- Insira a ponta do dispositivo de tiro através da esclerotomia em um IOP de 20 mmHg. Injete o implante em direção ao espaço subretinal através da borda de retinotomia criada a partir da superfície da retina.
- Injete o implante com o lado portador da célula voltado para a membrana do Bruch e o lado do xenoenxerto RPE voltado para os fotorreceptores.
- Habilite a função miOCT para visualizar o local do implante. Certifique-se de que o implante está descansando plano na membrana do Bruch no espaço subretinal, com uma retina intacta sobrelada. Certifique-se de que está localizado a uma distância razoável da retinotomia criada e não impingido no local da retinotomia.
- Ajuste a posição do implante com a cânula de injeção subretinal ou uma tesoura intraocular curva de 25 G para garantir que esteja bem posicionada sob a mácula.
12. drenagem guiada por miOCT do fluido subretinal
- Usando uma cânula de ponta de silicone escovada, realize uma troca de fluido-ar e uma cuidadosa drenagem de fluidos subretinar. Tente aspiração suave de fluido subretinal a partir do descolamento da retina bleb e da apposição da borda da retinotomia.
- Habilite a função miOCT para visualização em tempo real da drenagem adequada de fluidos subretinar até que a retina seja recolocada sobre o implante.
13. Encerrar a operação
- Feche a esclerotomia da porta de trabalho usando a sutura vicryl 7-0 pré-colocada. Remova o lustre de 25 G e a cânula de infusão de 25 G. Feche essas esclerotomias com suturas vicryl 7-0.
- Administrar 2 mg em 0,05 ml de triamcinolone livre de conservantes intravitreal (40 mg/ml) na esclerotomia das 8 horas antes da sutura.
- Palpa o olho para garantir que o IOP esteja dentro do alcance aceitável. Injete ar filtrado (ou BSS) através de uma agulha de 30 G, se necessário.
- Sutura a conjuntiva com suturas vicríl 7-0 e cantomia com prolene 5-0 (remova após 10-14 dias).
14. Cuidados com animais pós-operatórios
- Posicione o NHP de frente para baixo para 1h após a cirurgia. Não deixe o animal sozinho até que a consciência seja recuperada. Certifique-se de que um veterinário e técnico de cuidados com animais estejam disponíveis para observação e suporte durante o processo pós-operatório.
- Aplique antibiótico tópico (tobramicina), pomada esteroide (dexametasona) e colírios de homatropina duas vezes por dia durante 5 dias pós-operatórios.
- Administre outra injeção de buprenorfina subcutânea (0,005-0,03 mg/kg BW) 6 h após a cirurgia para controle adequado da dor.
- Devolva o PNH à companhia de outros animais somente quando tiver plena consciência.
- Realizar acompanhamentos de imagens multimodais nos dias 3, 14 e 1º mês após o procedimento, seguido de check-ups mensais. Realize ERGs todos os meses após o procedimento. Remova as suturas de prolene 5-0 para a cantotomia no dia 14 simultaneamente com o período de sedação usado para imagens multimodais. As suturas restantes são resorbáveis, 7-0 suturas vicryl, que não requerem remoção.
15. Métodos de monitoramento pós-operatório para imagens multimodais
- Acelere o NHP durante a noite. Sedar o NHP pouco antes da imagem (ver passo 4.2 para droga e concentração para sedação). Se a sedação for insuficiente para parar o movimento ocular, considere o uso de anestesia geral.
- Aplique 1% de tropicamida e 2,5% colírios de fenilefrina para alcançar a dilatação da pupila antes da imagem (ver passo 6.2).
- Realize a autofluorescência (AF), a angiografia fundus fluoresceína (FFA) e a tomografia óptica de coerência (OCT) utilizando uma máquina DE ALTA Resolução OCT com lente de campo de 55° e lente de campo de 30°.
- Administrar fluoresceína intravenosa 10% fluoresceína (0,1 mL/kg BW) para FFA. Para obter uma imagem de fase inicial, capture uma imagem dentro de 30 s de injeção. Para uma imagem em fase final, capture uma imagem de 5 a 10 minutos após a injeção.
- Realize a fotografia fundus usando uma câmera de fundus entre as fases inicial e tardia da FFA.
16. Métodos de monitoramento pós-operatório para estudos de eletroretinograma de campo integral (ERG)
- Acelere os NHPs durante a noite. Sedar o NHP antes dos estudos do ERG (ver passo 4.2 para a droga e concentração para sedação). Ao longo das gravações do ERG, reassistir a sedação quando apropriado.
- Separe imagens multimodais e gravações de ERG com um intervalo de pelo menos 2-3 dias.
- Uma vez sedado, certifique-se de que o NHP esteja adaptado ao escuro por 30 minutos antes da gravação do ERG.
- Posicione os eletrodos subdérmicos de agulha de aço inoxidável no canthi lateral esquerdo e direito (eletrodos de referência) e na parte de trás do corpo NHP (eletrodo moído). Coloque os eletrodos da lente de contato ERG na córnea NHP usando gel vidísico para auxiliar o contato e a adesão.
- Basear todos os testes de ERG nos protocolos humanos recomendados pela Sociedade Internacional de Eletrofisiologia Clínica da Visão (ISCEV)14. Inicie a gravação do ERG em condições scotopic e comece com os flashes de dimmer. Siga as recomendações do ISCEV para intervalos interestimulos recomendados.
- Certifique-se de que o NHP esteja adaptado à luz por 10 minutos antes do teste fotopico, novamente usando recomendações padrão do ISCEV para a força de fundo.
17. Eutanásia da NHP
- Para eutanásia do NHP para enucleação, administre pentobarbital de sódio intravenoso (75 mg/kg), conforme recomendado pelo Painel de Eutanásia da Associação Médica Veterinária Americana.
Resultados
As modalidades de imagem multimodal (fotografia fundus, fundus autofluorescence imaging (FAF), angiografia de fluoresceína fundus (FFA)-fase inicial e tardia, e tomografia de coerência óptica (OCT)) destacam as características de um transplante de enxerto de RPE submacular bem sucedido (Figura 1). A fotografia da Fundus mostra o posicionamento do transplante de enxerto RPE no fovea sem migração ao longo do tempo. A imagem faf mostra mudanças mínimas na hiperfluorescência (demonstrada por áreas brancas e de alta intensidade) sobrepondo o enxerto RPE. A FFA de fase inicial e tardia não mostra nenhum vazamento óbvio (demonstrado por áreas brancas e de alta intensidade que aumentam com o tempo) em torno do enxerto RPE. As imagens iniciais do dia 3 mostram defeito na janela devido à remoção do RPE nativo antes da implantação do enxerto. As imagens de OCT macular mostram a preservação das camadas externas da retina (em particular, a camada fotorreceptora) sobre o enxerto RPE à medida que o tempo avança. A hematoxilina e a coloração de eosina mostram camadas intactas da retina sem evidência de microtears. A preservação da camada nuclear externa acima das periferias do enxerto sugere que as células RPE estão realizando suas funções fisiológicas de manter a saúde do fotorreceptor.
As visões intraoculares e externas da cânula de 25/41 G de duplo furo destacam o mecanismo pelo qual o IOP é controlado durante a injeção subretinal (Figura 2). A BSS entra no espaço subretinal durante a injeção de fluido subretinal através da cânula central mais longa. Aumentos significativos na pressão intraocular fazem com que o BSS dentro da cavidade vítrea saia do olho através do maior furo metálico da cânula. A BSS então viaja ao longo da cânula e eventualmente é ejetada do porto de saída perto do hub de cânula. Para avaliar se a cânula está funcionando como esperado, certifique-se de que o fluido flua do porto de egresso perto do centro de cânula.
O miOCT permite a visualização das dimensões bleb e uma ruptura foveal potencial intraoperatória durante o descolamento foveal (Figura 3). Figura 3A1-A3 destaca um caso de bleb com uma lágrima de potro. Na Figura 3A1, enquanto o bleb inferior é visível sob o microscópio cirúrgico, a visualização da lágrima é difícil. A Figura 3A2 mostra a seção longitudinal de um bleb sem lágrimas. A figura 3A3 mostra uma ruptura de potro ao avaliar a seção vertical do bleb. Figura 3B1-B3 mostram um bleb criado com sucesso sem a presença de quaisquer lágrimas.
A ausência de deterioração significativa nas formas de onda ERG sugere que a função global dos fotorreceptores de vara e cone é mantida com xenoenxertos RPE subretinar (Figura 4). As formas de onda ERG mostram a função geral da retina. Em particular, deve-se prestar atenção às ondas A para determinar qualquer perda da função fotorreceptora.

Figura 1: Análise in vivo pós-operatória com imagem multimodal. (A) Imagem in vivo do transplante de enxerto RPE submacular do olho esquerdo (amarelo na fotografia fundus) em várias modalidades de imagem (colunas da esquerda para a direita: fotografia fundus, autofluorescência, fundus fluoresceína-fase inicial, fase de angiografia-tardia fundus fluoresceína, tomografia de coerência óptica) para pontos de tempo até 3 meses (linhas superiores a inferior: Dias 3, 14; Meses 1, 3). O asterisco na fotografia do fundus indica o local da retinotomia; a seta branca tracejada indica a direção da varredura da linha. A forma amarela desenhada na imagem de autofluorescência do Fundus destaca a localização do transplante. Os triângulos brancos nas imagens oct indicam as respectivas bordas laterais do enxerto (de acordo com a varredura de linha na imagem fundus de cor). (B) Mancha de hematoxilina e eosina do transplante sob fovea atrófica (devido à ruptura intraoperatória) com camadas rotuladas. Barras de escala = 1 mm em A (autofluorescência e imagens FA), 200 μm em A (imagens OCT) e 100 μm em B. Abreviaturas: FA = angiografia fundus; OCT = tomografia de coerência óptica; RGC = camada celular gânglio da retina; INL = camada nuclear interna; ONL = camada nuclear externa; RPE = pigmento de retina epitélio. Clique aqui para ver uma versão maior desta figura.
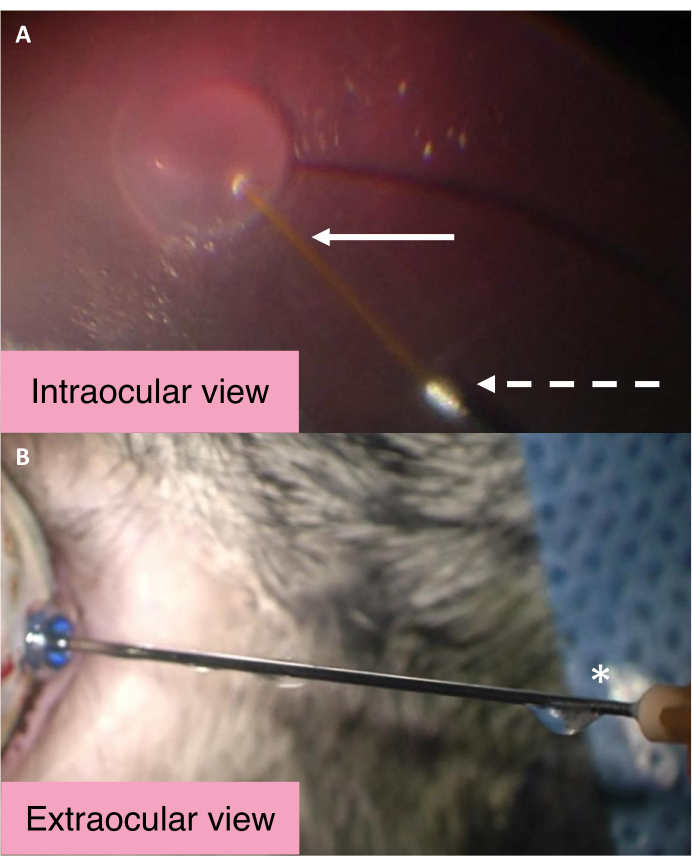
Figura 2: Visões intraoculares e externas da cânula de 25/41 G de duplo furo. (A) Visão intraocular da cânula de 25/41 G de duplo furo durante a criação de bleb subretinar. A seta branca aponta para a cânula central mais longa para injeção subretinal. A seta tracejada aponta para a abertura da cânula de saída através da qual o BSS passa para sair do olho. (B) Visão externa da cânula de 25/41 G de duplo furo. O asterisco marca a porta de saída perto do cubo de cânula de onde o BSS intraocular é drenado. Abreviação: BSS = solução de sal balanceada. Clique aqui para ver uma versão maior desta figura.
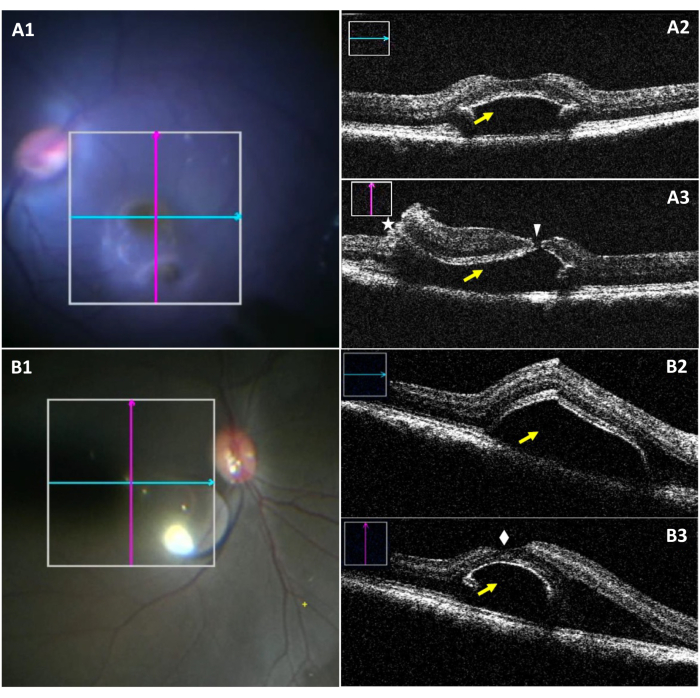
Figura 3: Imagens de microscópio intraoperatório e imagens de miOCT de bleb subretinal complicadas por uma ruptura foveal. (A1) Uma imagem de microscópio intraoperatório mostrando a posição de varreduras longitudinais (azul) e transversais (vermelhas) em um bleb com uma ruptura de potro. (A2) Varredura longitudinal miOCT mostrando um bleb subretinal na região do potro (seta amarela). (A3) Escaneamento miOCT transversal capturando uma lágrima de potro (ponta de flecha branca), juntamente com uma retinotomia (asterisco e um bleb subretinal (seta amarela). (B1) Uma imagem microscópica intraoperatória mostrando a posição de varreduras longitudinais (azul) e transversais (vermelhas) em um bleb formado com sucesso. (B2) Varredura longitudinal miOCT mostrando um bleb subretinal na região do potro (seta amarela). (B3) Varredura miOCT transversal mostrando um bleb subretinal criado com sucesso com uma fovea intacta superiormente (diamante branco). Abreviação: miOCT = tomografia de coerência óptica integrada ao microscópio. Clique aqui para ver uma versão maior desta figura.
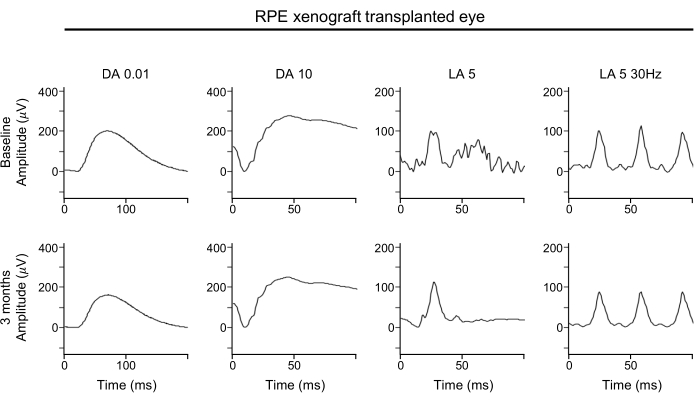
Figura 4: ERG do olho transplantado de xenoenxerto RPE. Para a avaliação funcional da retina, as avaliações de ERG em campo integral do olho RPE-xenoenerted realizadas na linha de base (linha superior) e 3 meses após o transplante (linha inferior) não mostram nenhum efeito significativo do transplante de xenoenxerto RPE em qualquer amplitude de resposta, tempo ou forma de onda em condições adaptadas à escuridão ou adaptadas à luz. Abreviaturas: RPE = epitélio pigmento da retina; ERG = eletroretinograma; DA = adaptado à escuridão; LA = adaptado à luz. Clique aqui para ver uma versão maior desta figura.
Discussão
Existem duas abordagens principais sendo avaliadas para transplante de RPE submacular - a injeção de uma suspensão de RPE e o transplante de um enxerto RPE monocamada. Uma comparação detalhada entre os dois métodos está além do escopo deste manuscrito. No entanto, o transplante de um enxerto RPE de monocamada pode ser vantajoso, pois as células RPE são mais organizadas em uma monocamada do que em uma suspensão. As células RPE no enxerto são organizadas em uma monocamada confluente, que se assemelha à organização da camada fisiológica da célula RPE e permite que as células RPE transplantadas realizem suas funções fisiológicas. Isso permite parâmetros de dosagem mais precisos em comparação com as suspensões celulares, o que é altamente relevante para o trabalho regulatório e a escala industrial.
A entrega do enxerto de remendo RPE no espaço subretinal requer uma manipulação cuidadosa da mácula e a inserção precisa do enxerto no espaço subretinal. Os avanços tecnológicos na microcirurgia, como o miOCT, e uma melhor compreensão da dinâmica intraoperatória do tecido retiniano reduziram a curva de aprendizado desse procedimento. Nesta discussão, as razões dos seguintes aspectos serão explicadas: i) injeção pré-operatória de plasmininogen; ii) o uso de miOCT intraoperatória; iii) o uso de uma cânula personalizada de 41 G de duplo furo, configurações de IOP baixas e PFCL para criação de bleb subretinar; iv) raspagem da camada celular RPE nativa antes do transplante; v) o uso de sirolimus, triamcinolone, doxiciclina e minocíciclina para reduzir a rejeição do enxerto imunogênico.
Injeções de plasminogênio pré-operatórias liberam aderências parafoveais de retina
Nos experimentos iniciais, foi desafiador separar a fovea com uma única onda fluida. Na avaliação com o MIOCT, as imagens revelaram a presença de aderências parafoveais externas da retina ao RPE nativo, juntamente com evidências de trauma intraretinal20. Essas aderências podem ter levado a uma expansão vertical do bleb em vez da onda de fluido subretinal que se espalha pelo contorno da retina, resultando em trauma foveal. Plasminogênio é o precursor inativo de plasmin, um protease voltado para fibronectina e laminina. Ocriplasmin é uma variante bioengenheira de plasmin humana, aprovada pela Food and Drug Administration (FDA) e pela European Medicines Agency (EMA) para o tratamento de tração vitreomacular sintomática com ou sem um orifício macular concomitante. No entanto, relatos pós-aprovação do desenvolvimento de edema de mácula cistoide após a injeção de ocriplasmina sugeriram um efeito mais extenso da enzima na retina23.
Embora os mecanismos exatos não tenham sido identificados, foi sugerido que plasmin poderia enfraquecer a adesão da retina através da degradação dos elementos da matriz interfotorreceptora responsável pela adesão fotoreceptor-RPE24. Neste protocolo, os olhos de PNS foram tratados com plasminênio intravitreal 1 semana antes da cirurgia para liberar as aderências parafoveais externas da retina. Sob a suposição de que a adesão fotoreceptor-RPE está enfraquecida, uma força inferior é necessária para desprender a retina neurossensorial, incluindo o anel parafoveal distal, que normalmente resiste à onda de fluido subretinal20. Assim, a força administrada durante o descolamento bleb da retina resulta na expansão do bleb através do contorno da retina em vez de esticar a retina tangencialmente. Isso reduz o risco de lágrimas de potro. No entanto, deve-se notar que o efeito do plasminênio na sobrevivência do enxerto a longo prazo não foi estudado neste protocolo. Estudos futuros devem tentar determinar esse efeito.
miOCT fornece feedback anatômico para orientar a criação de bleb subretinar, implantação de enxerto e drenagem de fluidos subretinar
A manipulação intraoperatória e atraumática da mácula é a chave para alcançar bons resultados de transplante. No entanto, alterações microestruturais da mácula relacionadas à manipulação podem nem sempre ser evidentes no microscópio operacional. Nesses procedimentos, o miOCT é uma ferramenta importante que fornece feedback intraoperatório em tempo real, tridimensional e intraoperatório da estrutura macular. miOCT é especialmente útil durante as etapas do descolamento foveal, implantação de enxerto e drenagem do fluido subretinal usando uma troca de fluido-ar. Durante o descolamento foveal, o miOCT pode determinar as dimensões verticais e horizontais do bleb. Os micrários foveal, que podem não ser visualizados claramente no microscópio cirúrgico, podem ser confirmados por miOCT (Figura 3). Durante a implantação do enxerto, as imagens miOCT guiam mostrando a localização ou proximidade do enxerto com a fovea, através da retina, muitas vezes menos transparente e descolada. o miOCT também pode destacar possíveis áreas de adesão da retina durante um difícil processo de transplante25. Finalmente, no processo de drenagem de fluidos subretinar, o miOCT pode orientar de forma confiável a drenagem de fluidos subretinar até que o contato completo do enxerto retina-RPE seja alcançado.
A combinação de uma cânula de duplo furo, configurações de IOP baixas e tamponade vitreous PFCL reduz sinergicamente o trauma macular durante a criação de bleb subretinar
O alongamento da retina tangencial e a turbulência do fluido podem ocorrer durante a injeção de BSS subretinal para descolamento foveal que leva a lágrimas foveais indesejadas. Para neutralizar esses fenômenos, fatores como a posição relativa e a distância do centro foveal onde a injeção é iniciada, volume de injeção e velocidade, tampão vítreo, escolha de instrumentação subretinal e IOP têm se mostrado relevantes20,26,27. O bleb subretinal para descolamento foveal deve estar situado em um local adequadamente distante da fovea, pois o alongamento da retina pode ser mais alto no local de iniciação bleb27. O IOP também deve ser mantido baixo durante toda a criação do bleb subretinal. Quando o IOP do olho é alto, um aumento vertical maior no tamanho do bleb em vez de expansão ao longo do contorno da retina é observado, enquanto as manchas são mais rasas em pressões mais baixas20. Além disso, embora uma injeção intravitreal de 50 μL efetivamente dobre o IOP em humanos28, dado o menor comprimento dos olhos em NHPs, o aumento do IOP durante a injeção subretinal provavelmente será maior e mais rápido do que em humanos. Enquanto a maioria das máquinas de vitrectomia ajustam-se para a flutuação IOP, o ajuste não é um processo simultâneo, mas sim um processo reativo que ocorre à medida que a injeção subretinal prossegue. Assim, quanto maior o IOP, maior o risco de alongamento excessivo da retina e trauma foveal resultante. Assim, é essencial manter um IOP baixo estável durante a injeção subretinal.
Recomenda-se um comercial 20/41 G (DORC) ou uma cânula subretinal de 25/41 G de furo duplo sob medida para injeção subretinal. A cânula permite que o fluido saia da cavidade vítrea em troca de BSS injetado no espaço subretinal. Isso garante a regulação "simultânea" do IOP durante a injeção subretinal. Um esquema da cânula de duplo furo é visto na Figura 2. Por fim, o PFCL é utilizado para reduzir o risco de lágrimas de potro20,26,27. Como os PFCLs, como a octalina, têm maior gravidade específica, eles exercem uma força descendente na retina durante o descolamento foveal29. Isso estabiliza ainda mais o processo de criação de descolamento foveal bleb e aumenta a expansão do bleb ao longo do contorno da retina. Esta técnica tem sido usada com sucesso para a injeção subretinal de rtPA na configuração de hemorragia submacular maciça devido ao nAMD30.
Remoção de pré-transplante de RPE nativo permite a restauração do complexo RPE-fotoreceptor
O RPE do hospedeiro deve ser removido antes do transplante de enxerto. Isso porque a restauração do complexo fotorreceptor RPE é necessária para permitir que o transplante RPE realize suas funções fisiológicas de suporte aos fotorreceptores21. O RPE hospedeiro, se não for removido, pode representar uma barreira mecânica, o que impede a restauração deste complexo. Pode ser removido através da administração de produtos químicos tóxicos RPE ou usando meios físicos de remoção. Os métodos de remoção química incluem a administração sistêmica ou subretinal de iodate de sódio31,32. Como o iodato de sódio causa degeneração generalizada de fotorreceptores, células RPE e Choriocapillaris quando administrado, sua toxicidade retinal e sistêmica impede seu uso para testes em humanos32,33. Por isso, são preferidas técnicas físicas intraoperatórias. Vários métodos físicos foram conceituados. Quando os métodos físicos são utilizados, é crucial que a membrana do Bruch permaneça intacta. Muitos estudos in vitro demonstraram a dependência da sobrevivência do enxerto de RPE na membrana de Bruch intacta34,35,36.
Tentativas de desbridamento hidráulico foram associadas a quebras na membrana de Bruch, aumento da taxa de desenvolvimento de membrana epiretinal e vitreoretinopatia proliferativa, resultando em descolamento da retina tração37. Uma espátula empoeirada de diamante proposta para o debridamento RPE também levou a quebras na membrana de Bruch, resultando em proliferação celular do coroide para o espaço subretinal38. Curiosamente, um instrumento de loop extensível feito sob medida poderia remover o RPE sobrelada com a preservação da membrana de Bruch nos olhos de coelhos e porcos11,39. A remoção do RPE subjacente também é útil para estabelecer modelos animais com RPE e atrofia de retina externa, semelhante à forma atrofífica avançada da AMD. Quando uma área focal de RPE é removida da mácula, a ferida RPE fecha através da hipertrofia das células RPE restantes. No entanto, esta resposta de cura da ferida está associada à atrofia da camada nuclear externa40. Embora a criação de um modelo animal esteja além do escopo deste manuscrito, um procedimento semelhante pode criar um modelo animal de um fenótipo atroférico avançado de AMD para o teste de terapêutica celular derivada de RPE.
O uso de sirolimus, triamcinolone, doxiciclina e minocíciclina para reduzir a rejeição do enxerto imunogênico
Acredita-se que o espaço subretral seja um local imuno-privilegiado, mantido por uma barreira sangue-retina intacta e outros fatores41. Em muitos estudos envolvendo o transplante subretinal de derivados de células-tronco com uma barreira sangue-retina intacta, as drogas imunossupressores desempenham um papel insignificante na sobrevivência do enxerto42. Acredita-se que a barreira sanguínea-retina externa seja formada pela camada RPE nativa e pelas junções apertadas entre as células RPE. Enquanto a remoção nativa de RPE permite uma melhor integração do RPE transplantado e fotorreceptores de host, a barreira hemorrânea é interrompida no processo, aumentando a probabilidade de uma rejeição imunológica. Classicamente, as células T são centrais para o processo de rejeição do transplante de outros órgãos, como o rim e o fígado43. Assim, os regimes imunossupressores iniciais para transplante de tecido retiniano foram direcionados para reduzir essas respostas imunes adaptativas.
Sirolimus, um alvo mecanicista do inibidor da rapamicina, e tacrolimus, um inibidor de calcineurina, são exemplos de drogas imunossupressoras que visam respostas imunes adaptativas. No entanto, apesar da supressão adequada das células T, as taxas de sobrevivência dos enxertos permanecem baixas. Além disso, as células RPE são conhecidas por suprimir a ativação de células T através da liberação de fatores inibitórios e promover a geração de células T regulatórias44. Assim, tornou-se cada vez mais evidente que a imunidade adaptativa pode não ser o único contribuinte para a rejeição do enxerto42. O transplante subretinal de produtos celulares pode resultar no acúmulo e ativação da microglia45.
Microglia são os macrófagos da retina. Eles consistem em duas populações principais: 1) a microglia perivascular da vasculatura da retina interna e 2) a microglia dentro do parênquim do tecido retiniano. Como a microglia faz parte da resposta imune inata, glicocorticoides intravitreal, como a triamcinolone, podem suprimir a proliferação mediada por citocinas46. Doxiciclina e minocíciclina também podem suprimir a ativação microglial e devem ser consideradas47,48. Por fim, as diferenças na rejeição imunológica das alusões RPE versus xenoenxertos são incompletamente compreendidas49. Por exemplo, alusões contra células RPE derivadas de células-tronco pluripotentes induzidas foram relatadas no soro de modelos de rejeição imunológica in vivo. No entanto, o papel desses anticorpos e a importância da rejeição mediada por anticorpos na sobrevivência do enxerto permanece desconhecido50. Assim, propõe-se um regime multidrogas utilizando sirolimus para a supressão da imunidade adaptativa e uma combinação de triamcinolone, doxiciclina e minocíclina para supressão de imunidade inata. Este regime tem sido usado com sucesso em coelhos com bons resultados de sobrevivência de enxerto e efeitos sistêmicos mínimos11.
Limitações desta técnica cirúrgica
Este artigo descreve um possível método cirúrgico para entregar uma folha de enxerto RPE no espaço subretinal de NHP; no entanto, isso não significa que esta seja a única maneira otimizada. Diferentes cirurgiões vitreo-retinais podem ter outras preferências de instrumentação e técnica. Por exemplo, este design de dispositivo de implantação só pode fornecer implantes planos suportados com um portador de células mais rígido e, portanto, pode não ser adequado para implantes relativamente flexíveis (ou enrolados). Transplantes de suspensão RPE podem omitir grande parte dessa técnica. Assim, os detalhes cirúrgicos exigirão modificações com base em cada estratégia de entrega.
À medida que o interesse pela terapêutica celular para o tratamento de doenças degenerativas da retina continua a crescer, o modelo animal NHP será essencial em estudos pré-clínicos para estudar os fatores que afetam a sobrevivência do enxerto de RPE. Neste manuscrito, são propostas estratégias para permitir a entrega mais suave de um enxerto monocamada submacular RPE no olho NHP. Métodos para melhor visualização de complicações intraoperatórias também são recomendados. Espera-se que esses métodos continuem a melhorar à medida que o uso da terapêutica celular se expande. Os trabalhos futuros também devem considerar a proposta de uma lista abrangente de investigações para avaliar vários aspectos estruturais e funcionais do enxerto.
Divulgações
Boris Stanzel possui um 9980851 de Patentes dos EUA sobre um instrumento (raspador RPE) usado neste estudo. Palestrante honoraria de C. Zeiss Meditec e Geuder para Boris Stanzel. Os outros autores não têm conflito de interesses para declarar.
Agradecimentos
Este estudo foi apoiado pelo IAF-PP (Domínio HMBS) (OrBID): OculaR BIomaterials and Device, A*STAR, Cingapura (H17/01/a0/013), a concessão nus start-up NUHSRO/2016/100/SU/01, Nuhs Clinical Scientist Program (NCSP) grant and National Research Foundation Competitive Research Program, Cingapura (NRF-CRP21-2018-0008) para X.S., Hong Leong dotado fundos de professor para G.E.H. e B.V.S. Gostaríamos de reconhecer a equipe veterinária da Plataforma de Modelo Pré-Clínico Translacional (Singapore Eye Research Institute, Cingapura) por fornecer suporte na preparação da cirurgia nhp e acompanhamento animal. Gostaríamos de estender nossa apreciação a Jill Teo e colegas da C. Zeiss Meditec Singapura por suporte técnico para o OPMI-Lumera 700 com dispositivo DEV intraoperatório integrado.
Materiais
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
Referências
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217(2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719(2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603(2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077(2020).
- Kolb, H., Nelson, R., Ahnelt, P., Ortuño-Lizarán, I., Cuenca, N. The Architecture Of The Human Fovea. Webvision. Moran Eye Center. , Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021).
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927(2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10(2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514(2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11(2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161(2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209(2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados