Method Article
Трансплантация пигментного эпителия сетчатки в модели нечеловеческих приматов для дегенеративных заболеваний сетчатки
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Нечеловеческий примат (NHP) является идеальной моделью для изучения клеточной терапии сетчатки человека из-за анатомического и генетического сходства. В данной рукописи описан метод субмакулярной трансплантации пигментных эпителиальных клеток сетчатки в глазу NHP и стратегии предотвращения интраоперационных осложнений, связанных с макулярными манипуляциями.
Аннотация
Трансплантация пигментного эпителия сетчатки (RPE) имеет большие перспективы для лечения наследственных и приобретенных дегенеративных заболеваний сетчатки. Эти состояния включают пигментный ретинит (RP) и запущенные формы возрастной макулярной дегенерации (AMD), такие как географическая атрофия (GA). Вместе эти расстройства составляют значительную долю неизлечимой в настоящее время слепоты во всем мире. Эти неудовлетворенные медицинские потребности вызвали повышенный академический интерес к разработке методов замены RPE. Среди животных моделей, обычно используемых для доклинических испытаний терапевтических средств, нечеловеческий примат (NHP) является единственной животной моделью, которая имеет макулу. Поскольку он разделяет это анатомическое сходство с человеческим глазом, глаз NHP является важной и подходящей доклинической животной моделью для разработки лекарственных средств передовой терапии (ATMP), таких как клеточная терапия RPE.
В этой рукописи описывается способ субмакулярной трансплантации монослоя RPE, культивируемого на носителе клеток полиэтилентерефталата (ПЭТ), под макулой на хирургически созданную рану RPE в иммуносупрессированных NHP. Ямка — центральная аваскулярная часть макулы — является местом наибольшей механической слабости во время трансплантации. Травма фовеальной артерии произойдет, если начальная инъекция субретинальной жидкости генерирует чрезмерную силу на сетчатку. Следовательно, медленная инъекция под перфторуглеродной жидкостью (PFCL) стекловидного тампонады рекомендуется с двухканальной субретинальной инъекционной канюлей при низком внутриглазном давлении (ВГД) для создания сетчатки.
Также рекомендуется предварительная обработка интравитреальной инъекцией плазминогена для высвобождения парафовеальных RPE-фоторецепторных спаек. Эти комбинированные стратегии могут снизить вероятность разрывов фовеального нерва по сравнению с обычными методами. NHP является ключевой животной моделью в доклинической фазе развития клеточной терапии RPE. Этот протокол решает технические проблемы, связанные с доставкой клеточной терапии RPE в глаз NHP.
Введение
Трансплантация РПЭ имеет большие перспективы для лечения наследственных и приобретенных дегенеративных заболеваний сетчатки. Эти состояния включают пигментный ретинит (RP, палочкоконусная дистрофия) и продвинутые формы ВМД, такие как GA. В совокупности эти расстройства представляют собой значительную долю неизлечимой в настоящее время слепоты во всем мире1,2. Продвинутые стадии ВМД подразделяются на неоваскулярные ВМД (nAMD) и GA. Хотя существуют эффективные варианты лечения nAMD, такие как инъекции антисосудистого эндотелиального фактора роста (anti-VEGF), пациенты с ГА имеют ограниченные варианты лечения. РП представляет собой высоко гетерогенную группу наследственных нарушений сетчатки, характеризующихся прогрессирующей дегенерацией фоторецепторов сетчатки. У некоторых пациентов причинный генетический дефект расположен внутри RPE, а не фоторецепторов; следовательно, заместительная терапия RPE может быть альтернативной стратегией, если генная терапия неосуществима.
Существует значительный интерес к разработке эффективных методов лечения этих состояний. В частности, трансплантация RPE набирает обороты в качестве потенциального терапевтического подхода3,4,5,6,7,8. С тех пор, как в 1980-х годах появились первые сообщения о трансплантации RPE, область расширилась, включив в себя различные источники клеток RPE, стратегии доставки и экспериментальные модели заболеваний и трансплантации10,11,12,13,14. Среди различных животных моделей только NHP имеет «macula lutea» с «fovea centralis», анатомическую специализацию на заднем полюсе сетчатки, общую с людьми. Ямка содержит очень высокую плотность конусных фоторецепторов, обеспечивающих центральное зрение высокого разрешения15. NHP также имеет аналогичный геномный и протеомный состав16 по сравнению с людьми. Эти сходства делают его важной и подходящей животной моделью для изучения глазных заболеваний, которые влияют на сетчатку человека17,18.
В этой рукописи описывается метод субмакулярной трансплантации ксенотрансплантата RPE, поддерживаемого носителем ПЭТ-клеток, в иммуносупрессированных NHP. Трансвитреальный метод субретинальной трансплантации RPE у кроликов был описан в предыдущей рукописи19. Однако при НХП наличие ямки требует особой осторожности при интраоперационных манипуляциях20. В частности, существует высокий риск разрыва фовеальной артерии, если методы инъекции субретинальной жидкости генерируют чрезмерную силу на сетчатку20. Таким образом, основное внимание в этой рукописи уделяется стратегиям снижения риска непреднамеренной травмы фовеального нерва при NHP.
К ним относятся использование предоперационной интравитреальной инъекции плазминогена для высвобождения парафовеальных спаек и хирургической микроскоп-интегрированной оптической когерентной томографии (miOCT) интраоперационно для визуализации анатомии фовеала в режиме реального времени. Предлагается изготовленная на заказ субретинальная канюля 25/41 G с двойным отверстием с внутриглазной тампонадой PFCL при низких настройках ВГД, чтобы обеспечить более контролируемый процесс отслоения фовеала. Кроме того, перед имплантацией рекомендуется хирургическое удаление нативного RPE, чтобы обеспечить лучшую интеграцию между трансплантированными клетками RPE и фоторецепторами хозяина. Наконец, описан пери- и послеоперационный протокол системной иммуносупрессии для моделей NHP для улучшения выживаемости ксенотрансплантата RPE после трансплантации11,21.
протокол
ПРИМЕЧАНИЕ: Все эксперименты на животных проводились в соответствии с Ассоциацией исследований в области зрения и офтальмологии (ARVO) для использования животных в офтальмологических и зрительных исследованиях. Одобрение этики было получено от Институционального комитета по уходу за животными и их использованию, SingHealth, Сингапур. Животные были размещены в Центре экспериментальной медицины SingHealth, одобренном Ассоциацией по оценке и аккредитации ухода за лабораторными животными (AAALAC). Это утверждение подчеркивает, что все эксперименты на животных соответствуют стандартам Национального консультативного комитета по лабораторным исследованиям на животных, установленным Агропродовольственным и ветеринарным управлением Сингапура. Следующий экспериментальный протокол был установлен на основе экспериментов, проведенных в 6 глазах 6 Макаки фасцикулярных (4 самца и 2 женщины, от 4 до 6 лет, от 2,8 до 4,0 кг ).
1. Достижение иммуносупрессии в модели NHP
- Начните иммуносупрессию за 7 дней до операции и продолжайте иммуносупрессию в течение всего периода наблюдения.
- Взвесьте NHP перед введением системной иммуносупрессии, чтобы обеспечить точную дозировку лекарства. Животное взвешивается на исходном уровне и еженедельно после этого.
- Используйте пероральный сиролимус, доксициклин и миноциклин для достижения системной иммуносупрессии.
- Вводят нагрузочную дозу 2 мг перорального сиролимуса с последующим ежедневным поддерживающим дозированием 1 мг. Получить исходный уровень сиролимуса в крови перед введением и контролировать его в течение всего периода наблюдения. Обеспечить концентрацию не менее 5 мкг/л для адекватной иммуносупрессии.
ПРИМЕЧАНИЕ: Доза сиролимуса не адаптирована к весу. - Вводят дозу 7,5 мг/кг перорального доксициклина в день, два раза в день.
- Вводят дозу 7,5 мг/кг перорального миноциклина в сутки, два раза в день.
- Вводят нагрузочную дозу 2 мг перорального сиролимуса с последующим ежедневным поддерживающим дозированием 1 мг. Получить исходный уровень сиролимуса в крови перед введением и контролировать его в течение всего периода наблюдения. Обеспечить концентрацию не менее 5 мкг/л для адекватной иммуносупрессии.
- Во время иммуносупрессии контролировать все NHP на наличие неблагоприятных системных эффектов. Ищите значительную потерю массы тела (>10%), снижение аппетита и потребления воды, неухоженное выпадение волос и ненормальное поведение, такое как агрессия и вялость. Оценки будут проводиться в день 3, 14 и 1 месяц, за которыми следуют ежемесячные оценки.
2. Стерилизация инструментов
- Промыть хирургические инструменты дистиллированной водой.
- Поместите инструменты в ультразвуковую ванну, заполненную 500 мл дистиллированной воды и 2 мл дезинфицирующего средства. Очистите инструменты с помощью функции развертки ультразвуковой ванны в течение 15 минут.
- Извлеките инструменты из ультразвуковой ванны. Промывайте дважды- тщательно - дистиллированной водой в течение 5 мин каждый смыв. Высушите инструменты на воздухе после промывки.
- Поместите инструменты в ящик для инструментов. Автоклав коробки с помощью универсальной программной настройки (стерилизация инструментов при 134 °C в течение 50 мин: 30 мин для автоклавирования, 20 мин для сушки).
3. Приготовление триамцинолона без консервантов (40 мг/мл)
- Используя шприц объемом 1 мл, изъять 1 мл раствора триамцинолона (10 мг/мл). Переложите его в коническую трубку объемом 15 мл и смешайте с 4 мл стерильного сбалансированного раствора соли (BSS).
- Центрифугировать раствор при 120 × г в течение 5 мин. Убедитесь, что все частицы триамцинолона находятся в нижней части конической трубки. Выбросьте супернатант (BSS) из конической трубки.
- Повторно суспендировать частицы триамцинолона с 5 мл стерильного BSS в конической пробирке. Центрифугировать раствор при 120 × г в течение 5 мин. Снова выбросьте супернатант.
- Повторите шаг 3.3, чтобы завершить промывку частиц триамцинолона BSS (3x).
- Повторно суспендировать частицы триамцинолона с 0,25 мл стерильной BSS для достижения концентрации 40 мг/мл.
- Аспирировать повторно суспендированный триамцинолон (40 мг/мл) с новым шприцем 1 мл. Прикрепите иглу флейты с тупым наконечником весом 25 г и держите шприц с раствором триамцинолона готовым к интраоперационному использованию.
4. Предварительная обработка глаз NHP интравитреальным плазминогеном (0,25 мкг/мкл)
- За неделю до операции введите интравитреальную инъекцию (20 мкл) обезьяньего плазминогена (0,25 мкг/мкл).
- Седативный NHP перед процедурой путем внутримышечной инъекции кетамина (10-20 мг/кг BW) и подкожной инъекции атропина (0,05 мг/кг BW). Вводят тетракаиновые глазные капли для местной анестезии.
- Перед интравитреальной инъекцией дезинфицируйте периорбитальную область 10% повидон-йодом. Дезинфицировать глаза путем введения 5% повидона-йода в конъюнктивальный форник NHP. Убедитесь, что раствор остается в форнисе не менее 1 мин, прежде чем тщательно промыть стерильным BSS.
- Используйте шприц объемом 250 мкл для аспирации предварительно разбавленного обезьяньего плазминогена (0,25 мкг/мкл) из флакона. Прикрепите иглу 30 г к шприцу и держите плазминоген обезьяны готовым к интравитреальному введению.
- Используйте пару суппортов, чтобы определить место инъекции на глазу. Ввести интравитреальную инъекцию на расстоянии 3 мм от лимбуса.
- Продолжайте инъекцию иглой, направленной к центру земного шара. После извлечения иглы из земного шара используйте ватную аппликаторную палочку, чтобы тампонадировать место инъекции и предотвратить рефлюкс внутриглазного содержимого.
- Введите смазочный гель или мазь, чтобы уменьшить немедленное послеоперационное раздражение глазной поверхности.
5. Установка хирургического стола и оборудования
- Установите стерильное поле. Находясь в стерильном поле, всегда носите хирургические скрабы, маску и волосяной покров.
- Подготовьте триамцинолон без консервантов (40 мг/мл) для интраоперационной визуализации стекловидного тела (см. раздел 3). Приготовьте стерильный BSS в шприце 10 мл и смазку в шприце 5 мл. Поместите их на драпировку.
- Держите другие инструменты наготове на драпировке, в том числе 3-0 шелковых, 7-0 викрильных швов, хлопчатобумажных аппликаторных палочек, полосок для закрытия ран и волоконной проволоки для эндоиллюминации люстры.
- Подключите набор витрэктомии, включая высокоскоростной витректор, кассету Вентури и эндоиллюминатор люстры 25 G, к аппарату для витрэктомии с использованием стерильной техники.
- Откройте офтальмологическую бутылку BSS емкостью 500 мл и подключите ее к кассете Вентури в соответствии с инструкциями производителя. Приступайте к грунтовке системы.
- Включите miOCT/хирургический микроскоп. Выберите предустановленные конфигурации хирургического микроскопа для хирургии заднего сегмента и освещения. Введите детали процедуры, включая удостоверение личности, пол, боковой размер глаза животного и название процедуры.
- Установите бесконтактную широкоугольную линзу с 128-градусным глазным дном.
- Прикрепите стерильные одноразовые наручники к хирургическому микроскопу/miOCT. Отрегулируйте положение микроскопа и фокусировку с помощью ножной педали. Приступайте к операции.
6. Подготовка анестезии и позиционирование животного (предпочтительно выполняется ветеринарной бригадой)
- Убедитесь, что NHP голодает в течение не менее 8 ч до введения анестезии, чтобы предотвратить регургитацию и рвоту. Успокойте NHP перед введением анестезии (см. шаг 4.2 для инструкций по седации).
- Применяют 1% тропикамид и 2,5% фенилэфриновые глазные капли не менее 3x с интервалом 5 мин для достижения расширения зрачка.
- Вводят внутримышечную инъекцию бупренорфина (0,005-0,03 мг/кг BW) за 30 мин до операции для достижения анальгезии.
- Интубируют NHP эндотрахеальной трубкой, обычно размером 3-5 мм. При попытке интубации убедитесь, что доступно несколько размеров. Используйте наибольший размер, который можно пропустить через гортань, не вызывая травмы. Измерение конечного приливного CO2 для обеспечения надлежащего размещения эндотрахеальной трубки.
- Доставьте 2% изофторанового газа через эндотрахеальную трубку, чтобы вызвать общую анестезию. Подтвердите состояние общей анестезии (отсутствие реакции на прикосновение), оценив реакцию NHP на окружающие раздражители, включая звуки и прикосновения. Используйте 0,5-2% газообразного изофторана для поддержания состояния общей анестезии.
- Непрерывно контролировать электрокардиограмму NHP, частоту дыхания, кровяное давление и насыщение кислородом в течение всей операции.
- Расположите NHP на хирургическом столе так, чтобы глаз был перпендикулярен хирургическому микроскопу. Введите в глаз смазочный гель или мазь, которая не оперируется, чтобы уменьшить раздражение глазной поверхности во время анестезии.
- Режьте ресницы ножницами, чтобы уменьшить вероятность инфекций.
- Дезинфицировать периорбитальную область 10% повидоном-йодом. Дезинфицировать глаза путем введения 5% повидона-йода в конъюнктивальный форник NHP. Убедитесь, что раствор остается в форнисе не менее 1 мин, прежде чем тщательно промыть стерильным BSS.
- Расположите стерильную драпировку таким образом, чтобы предварительно вырезанное отверстие было центрировано над глазом для проведения операции. Накройте глаз клейкой хирургической разрезной драпировкой.
- Выполните боковую кантотомию на глазу, чтобы пройти операцию.
- Вставьте зеркало Либермана, чтобы обеспечить адекватное открытие век для визуализации глаза.
7. Витрэктомия
ПРИМЕЧАНИЕ: Для доступа к субретинальному пространству для доставки трансплантата RPE ПЭТ-каркаса этот протокол рекомендует выполнять 4-портовую (клапанную) витрэктомию 25 G с использованием стандартной витреоретинальной хирургической установки и бесконтактной, широкоугольной линзы глазного дна 128°. Протокол также рекомендует использовать хирургический микроскоп, оснащенный miOCT, для руководства несколькими критическими хирургическими шагами, включая индукцию отслоения фовея, имплантацию трансплантата RPE и дренаж субретинальной жидкости.
- Выполните перитомию конъюнктивы на 360°, разрезав конъюнктиву возле лимбуса с помощью ножниц ваннаса. Увеличьте перитомию, выполнив тупое рассечение.
- Используя 25 Г микровитреоретинального лезвия, выполните склеротомию в положении «8 часов» для правого глаза или в 4 часа для левого глаза. Выполняют склеротомию на расстоянии 3 мм от конечности глаза.
- Вставьте и зашить 25-граммовую боковую инфузионную канюлю с использованием 7-0 викрильного шва. После подтверждения интравитреального расположения запустите инфузию BSS и настройте систему на поддержание ВГД 20 мм рт.ст.
- Используя трохар с плоской головкой 25 G, выполните склеротомию в положении «2 часа» для правого глаза или в 10 часов для левого глаза, как на шаге 7.2.
- Вставьте светильник люстры 25 G в плоский трочар и закрепите его липкой лентой. Отрегулируйте источник света примерно до 60%.
- Выполните еще одну склеротомию, аналогичную шагу 7.2, в положении «10 часов» для правого глаза или 2 часа для левого глаза. Наложите U-образный викрильный шов 7-0 вокруг склеротомии, не завязывая узлы. Вставьте наконечник резака витрэктомии через эту склеротомию.
- Начните витрэктомию вокруг входных отверстий, а затем короткую витрэктомию ядра со следующими настройками: максимум 5000 разрезов в минуту, максимальная аспирация при 400 мм рт.ст.
- Вводят 20-50 мкл триамцинолона (40 мг/мл) для лучшей визуализации стекловидного тела.
- Индуцировать заднюю отслойку стекловидного тела (PVD) путем отделения стекловидного тела от сетчатки.
- Расположите стекловидный двигатель над оптическим диском, чтобы обеспечить мягкую индукцию PVD. Держите стекловидный столб только на аспирации при максимальной установке 400 мм рт.ст. без каких-либо разрезов.
- При необходимости используйте внутриглазные щипцы 25 Г для манипулирования стекловидным телом на краю диска, чтобы создать разрыв в коре стекловидного тела для облегчения отслоения.
ПРИМЕЧАНИЕ: PVD считается успешным, если кристаллы триамцинолона беспрепятственно скользят по поверхности сетчатки.
- Откройте заднюю подъязычную оболочку резаком и снимите отделившуюся стекловидную юбку до стекловидного тела (на экваторе сетчатки). Аспирируйте любой оставшийся триамцинолон на поверхности сетчатки.
8. Отслойка фовеа под управлением miOCT
- Вводят 1-2 мл PFCL, чтобы покрыть задний полюс до передней, средней периферической сетчатки.
- Вводят в глаз с помощью субретинальной инъекции канюли. Установите ВГД на 0-4 мм рт.ст. на аппарате для витрэктомии (убедитесь в идеально водонепроницаемой системе; при необходимости завяжите швы вокруг портов).
- Используя индивидуальную субретинальную инъекционную канюлю с двойным отверстием 25/41 Г или канюлю для субретинальной инъекции 25/38 Г, подключенную к шприцу объемом 250 мкл, осторожно выполните субретинальную инъекцию BSS, чтобы вызвать локализованную отслойку сетчатки. Как только блеб просто пересечет ямку, прекратите инъекцию. Создайте второй блеб с другого направления. Объедините оба блеба, чтобы полностью отсоединить яму.
- Включите функцию miOCT для визуализации образования bleb. Убедитесь, что сканирование линий и кубов находится в режиме HD с настройками (512 x 128 пикселей, ширина сканирования 4 мм), чтобы получить изображение на ямке. Наблюдайте за изображением miOCT для полного отслоения нервной сетчатки от слоя RPE на ямке.
- Увеличьте ретинотомию до 1,5 мм с помощью пары вертикальных витреоретинальных ножниц весом 25 Г, чтобы обеспечить доступ к субретинальному пространству для трансплантации.
9. Удаление нативного RPE
- Установите ВГД на 50 мм рт.ст. на аппарате для витрэктомии.
- Удалите PFCL с помощью активной экструзии с помощью канюли с матовым силиконовым наконечником.
- Вытяните склеротомию с помощью разреза 1,4 мм, чтобы обеспечить вход инструмента 20 G.
- Используя пользовательский инструмент с расширяемой петлей 20 Г, соскоблите субмакулярный хост RPE для удаления. Соскоблите область размером не менее 2 х 3 мм.
10. Загрузка стрелка для доставки RPE клеточной однослойной трансплантации
- Общие инструкции по загрузке пулеобразного трансплантата, вырезанного из культур RPE на носителях ПЭТ-клеток, см. в предыдущей публикации22.
11. Имплантация трансплантата под управлением miOCT и регулировка положения
- Вставьте наконечник стрелкового устройства через склеротомию при ВГД 20 мм рт.ст. Введите имплантат в подретинальное пространство через ретинотомический край, созданный из поверхности сетчатки.
- Введите имплантат со стороны клеточного носителя, обращенной к мембране Бруха, и стороной ксенотрансплантата RPE, обращенной к фоторецепторам.
- Включите функцию miOCT для визуализации местоположения имплантата. Убедитесь, что имплантат опирается на мембрану Бруха в подретинальном пространстве с неповрежденной вышележащей сетчаткой. Убедитесь, что он расположен на разумном расстоянии от созданной ретинотомии и не влияет на сайт ретинотомии.
- Отрегулируйте положение имплантата с помощью субретинальной инъекционной канюли или изогнутого внутриглазного ножницы весом 25 г, чтобы убедиться, что он хорошо расположен под макулой.
12. дренаж субретинальной жидкости под контролем miOCT
- Используя матовую силиконовую канюлю, выполните обмен жидкостью и воздухом и тщательный дренаж субретинальной жидкости. Попробуйте мягкую аспирацию субретинальной жидкости из отслоения сетчатки и аппозиции края ретинотомии.
- Включите функцию miOCT для визуализации в режиме реального времени адекватного дренажа субретинальной жидкости до тех пор, пока сетчатка не будет вновь прикреплена к имплантату.
13. Завершение операции
- Закройте рабочий порт склеротомии с помощью предварительно установленного викрильного шва 7-0. Снимите люстру весом 25 г и канюлю с инфузией 25 г. Закройте эти склеротомии 7-0 викрильными швами.
- Вводят 2 мг в 0,05 мл интравитреального консерванта без триамцинолона (40 мг/мл) в 8 часов склеротомии перед наложением швов.
- Пальпируйте глаз, чтобы убедиться, что ВГД находится в допустимом диапазоне. При необходимости впрыскивайте отфильтрованный воздух (или BSS) через иглу весом 30 г.
- Зашить конъюнктиву 7-0 викрильными швами и кантотомию с 5-0 проленом (снять через 10-14 дней).
14. Послеоперационный уход за животными
- Расположите NHP лицом вниз в течение 1 часа после операции. Не оставляйте животное без присмотра до тех пор, пока сознание не будет восстановлено. Убедитесь, что ветеринар и техник по уходу за животными доступны для наблюдения и поддержки во время послеоперационного процесса.
- Применяют местный антибиотик (тобрамицин), стероидную (дексаметазон) мазь и глазные капли хоматропина два раза в день в течение 5 дней после операции.
- Введите еще одну подкожную инъекцию бупренорфина (0,005-0,03 мг/кг BW) через 6 ч после операции для адекватного контроля боли.
- Возвращать NHP в компанию других животных только тогда, когда она полностью придет в сознание.
- Проводите мультимодальные наблюдения за визуализацией в день 3, 14 и месяц 1 после процедуры, а затем ежемесячные осмотры. Выполняйте ЭРГ каждый месяц после процедуры. Снимите 5-0 проленовых швов для кантотомии на 14-й день одновременно с периодом седации, используемым для мультимодальной визуализации. Остальные швы рассасываются, 7-0 викрильных швов, которые не требуют снятия.
15. Методы послеоперационного мониторинга мультимодальной визуализации
- Ускорьте NHP в течение ночи. Седация NHP непосредственно перед визуализацией (см. шаг 4.2 для лекарственного средства и концентрации для седации). Если седация недостаточна для остановки движения глаз, рассмотрите возможность использования общей анестезии.
- Применяют 1% тропикамида и 2,5% фенилэфрина для достижения расширения зрачка перед визуализацией (см. шаг 6.2).
- Выполните автофлуоресценцию (AF), флуоресцеиновую ангиографию глазного дна (FFA) и оптическую когерентную томографию (OCT) с использованием машины OCT высокого разрешения с полевой линзой 55 ° и полевой линзой 30 °.
- Вводят внутривенно 10% флуоресцеин (0,1 мл/кг BW) для FFA. Чтобы получить изображение ранней фазы, захватите изображение в течение 30 с после инъекции. Для получения изображения поздней фазы сделайте снимок через 5-10 минут после инъекции.
- Выполняйте фотосъемку глазного дна с помощью камеры глазного дна между ранней и поздней фазами FFA.
16. Методы послеоперационного мониторинга полнопольных электроретинограммных исследований (ЭРГ)
- Ускорьте nhP в одночасье. Седативный препарат NHP перед исследованиями ERG (см. шаг 4.2 для лекарственного средства и концентрацию для седации). На протяжении всех записей ERG повторно вводите седацию, когда это необходимо.
- Раздельные мультимодальные изображения и записи ERG с интервалом не менее 2-3 дней.
- После седации убедитесь, что NHP адаптирован к темноте в течение 30 минут до записи ERG.
- Расположите подкожные игольчатые электроды из нержавеющей стали на левом и правом боковых канти (опорные электроды) и задней части корпуса NHP (заземляющий электрод). Поместите электроды контактных линз ERG на роговицу NHP с помощью видизического геля для облегчения контакта и адгезии.
- Основывайте все испытания ERG на человеческих протоколах, рекомендованных Международным обществом клинической электрофизиологии зрения (ISCEV)14. Начните запись ERG в условиях скотопика и начните с диммерных вспышек. Следуйте рекомендациям ISCEV для рекомендуемых интервалов между стимулами.
- Убедитесь, что NHP адаптирован к свету в течение 10 минут перед фотопик-тестированием, снова используя стандартные рекомендации ISCEV по прочности фона.
17. Эвтаназия NHP
- Для эвтаназии NHP для энуклеации вводят внутривенно пентобарбитал натрия (75 мг/кг), как это рекомендовано Группой по эвтаназии Американской ветеринарной медицинской ассоциации.
Результаты
Мультимодальные методы визуализации (фотосъемка глазного дна, автофлуоресцентная визуализация глазного дна (FAF), флуоресцеиновая ангиография глазного дна (FFA) - ранняя фаза и поздняя фаза, а также оптическая когерентная томография (OCT)) подчеркивают особенности успешной субмакулярной трансплантации трансплантата RPE (рисунок 1). Фотография глазного дна показывает позиционирование трансплантата RPE в ямке без миграции с течением времени. Визуализация FAF показывает минимальные изменения гиперавтофлуоресценции (продемонстрированные белыми областями высокой интенсивности), перекрывающими трансплантат RPE. Ранняя и поздняя фазы FFA не показывают какой-либо очевидной утечки (о чем свидетельствуют белые, высокоинтенсивные области, которые увеличиваются со временем), окружающие трансплантат RPE. Первоначальные изображения на 3-й день показывают дефект окна из-за удаления нативного RPE перед имплантацией трансплантата. Макулярные изображения OCT показывают сохранение внешних слоев сетчатки (в частности, слоя фоторецепторов) над трансплантатом RPE с течением времени. Окрашивание гематоксилином и эозином показывает неповрежденные слои сетчатки без признаков микросоединений. Сохранение внешнего ядерного слоя над периферией трансплантата говорит о том, что клетки RPE выполняют свои физиологические функции поддержания здоровья фоторецепторов.
Внутриглазный и внешний вид двухствольной канюли 25/41 G подчеркивает механизм, с помощью которого ВГД контролируется во время субретинальной инъекции (рисунок 2). BSS попадает в субретинальное пространство во время инъекции субретинальной жидкости через центральную более длинную канюлю. Значительное увеличение внутриглазного давления приводит к тому, что BSS в стекловидной полости выходит из глаза через более крупное металлическое отверстие канюли. Затем BSS перемещается вдоль канюли и в конечном итоге выбрасывается из выходного порта рядом с ступицей канюли. Чтобы оценить, работает ли канюля так, как ожидалось, убедитесь, что жидкость течет из выходного порта вблизи ступицы канюли.
MiOCT позволяет визуализировать размеры bleb и потенциальный интраоперационный разрыв ямки во время отслоения ямки (рисунок 3). На рисунке 3А1-А3 выделен корпус блеба с разрывом ямки. На рисунке 3A1, в то время как нижняя блеб видна под хирургическим микроскопом, визуализация разрыва затруднена. На рисунке 3А2 показано продольное сечение блеба без каких-либо разрывов. На рисунке 3A3 показан разрыв фовеального отверстия при оценке вертикального сечения блеба. На рисунке 3В1-В3 показан успешно созданный блеб без присутствия каких-либо разрывов.
Отсутствие значительного ухудшения осциллограмм ERG говорит о том, что глобальная функция как палочковых, так и конусных фоторецепторов поддерживается субретинальными ксенотрансплантатами RPE (рисунок 4). Формы сигналов ERG показывают общую функцию сетчатки. В частности, следует обратить внимание на А-волны для определения любой потери функции фоторецептора.

Рисунок 1: Послеоперационный анализ in vivo с мультимодальной визуализацией. (A) Визуализация in vivo субмакулярного трансплантата RPE левого глаза (желтый на фотографии глазного дна) на различных методах визуализации (слева направо колонки: фотосъемка глазного дна, автофлуоресценция, флуоресцеиновая ангиография глазного дна - ранняя фаза, флуоресцеиновая ангиография глазного дна - поздняя фаза, оптическая когерентная томография) для временных точек до 3 месяцев (верхние и нижние ряды: дни 3, 14; Месяцы 1, 3). Звездочка на фотографии глазного дна указывает на место ретинотомии; белая пунктирная стрелка указывает направление сканирования линии. Желтая нарисованная форма на автофлуоресцентной визуализации глазного дна подчеркивает местоположение трансплантата. Белые треугольники на изображениях OCT указывают на соответствующие боковые края трансплантата (в соответствии со сканированием линии на цветном изображении глазного дна). (B) Окрашивание трансплантата гематоксилином и эозином под атрофической ямкой (из-за интраоперационного разрыва) с мечеными слоями. Шкала стержней = 1 мм в A (автофлуоресценция и изображения FA), 200 мкм в A (изображения OCT) и 100 мкм в B. Сокращения: FA = ангиография глазного дна; ОКТ = оптическая когерентная томография; RGC = ганглиозный клеточный слой сетчатки; INL = внутренний ядерный слой; ONL = внешний ядерный слой; RPE = пигментный эпителий сетчатки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
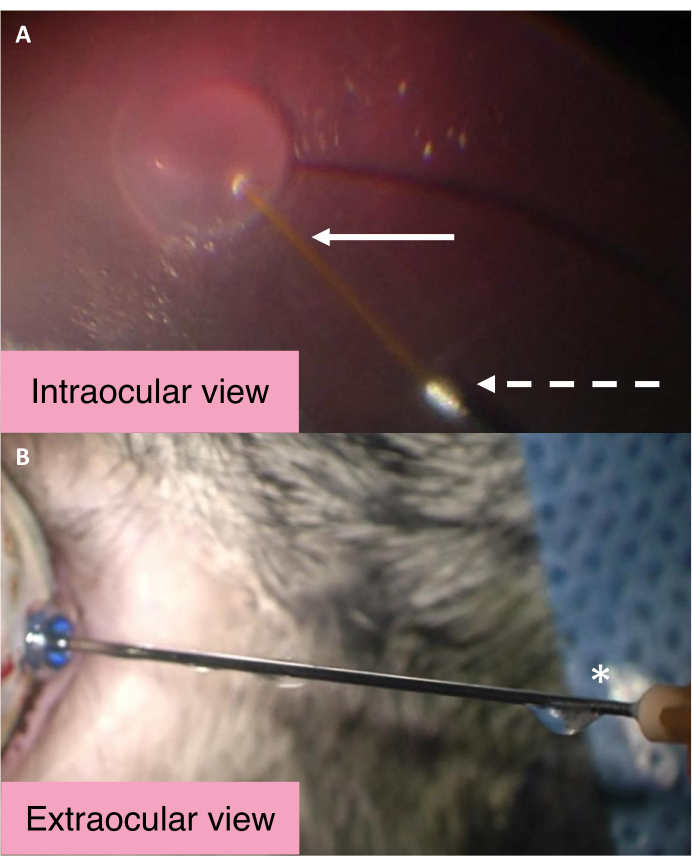
Рисунок 2: Внутриглазный и внешний вид двухствольной канюли 25/41 G. (A) Внутриглазный вид канюли с двойным отверстием 25/41 G во время создания субретинального блеба. Белая стрелка указывает на более длинную центральную канюлю для субретинальной инъекции. Пунктирная стрелка указывает на отверстие выходной канюли, через которое проходит BSS, чтобы выйти из глаза. B) Внешний вид двухствольной канюли 25/41 G. Звездочкой обозначен выходной порт рядом с концентратором канюли, из которого дренируется внутриглазная BSS. Аббревиатура: BSS = сбалансированный раствор соли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
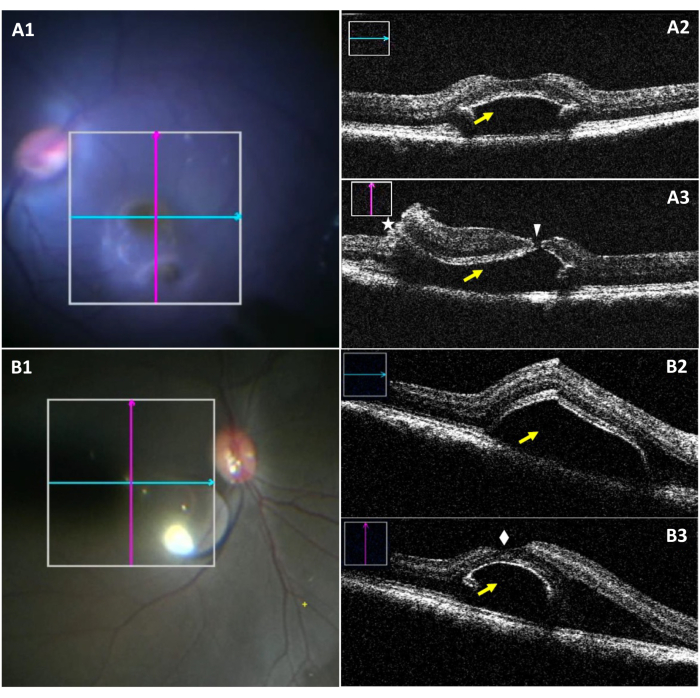
Рисунок 3: Изображения интраоперационного микроскопа и miOCT субретинального блеба, осложненного разрывом фовеала. (A1) Изображение интраоперационного микроскопа, показывающее положение продольного (синего) и поперечного (красный) сканирований в блебе с разрывом фовеала. (А2) Продольное сканирование miOCT, показывающее субретинальный блеб в области ямки (желтая стрелка). (А3) Поперечное сканирование miOCT захватывает разрыв фовеальной кости (белый наконечник стрелы), а также ретинотомию (звездочка и субретинальный блеб (желтая стрелка). (В1) Интраоперационное микроскопическое изображение, показывающее положение продольного (синего) и поперечного (красный) сканирований в успешно сформированном блебе. (В2) Продольное сканирование miOCT, показывающее субретинальный блеб в области ямки (желтая стрелка). (В3) Поперечное сканирование miOCT, показывающее успешно созданный субретинальный блеб с неповрежденной ямкой (белый алмаз). Аббревиатура: miOCT = микроскоп-интегрированная оптическая когерентная томография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
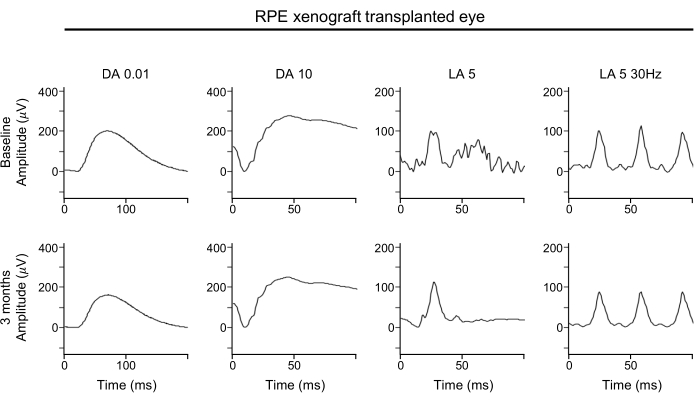
Рисунок 4: ЭРГ РПЭ ксенотрансплантатно-трансплантированного глаза. Для функциональной оценки сетчатки полнопольные оценки ERG RPE-ксенотрансплантированного глаза, выполненные на исходном уровне (верхний ряд) и через 3 месяца после трансплантации (нижний ряд), не показывают значительного влияния трансплантации ксенотрансплантата RPE на любые амплитуды ответа, время или форму волны в условиях, адаптированных к темноте или свету. Сокращения: RPE = пигментный эпителий сетчатки; ERG = электроретинограмма; DA = адаптированный к темноте; LA = адаптированный к свету. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Существует два основных подхода, оцениваемых для субмакулярной трансплантации RPE - инъекция суспензии RPE и трансплантация монослойного трансплантата RPE. Подробное сравнение между этими двумя методами выходит за рамки данной рукописи. Однако трансплантация монослойного RPE-трансплантата может быть выгодной, поскольку клетки RPE более организованы в монослое, чем в суспензии. Клетки RPE в трансплантате организованы в сливающийся монослой, который напоминает организацию физиологического клеточного слоя RPE и позволяет трансплантированным клеткам RPE выполнять свои физиологические функции. Это обеспечивает более точные параметры дозирования по сравнению с клеточными суспензиями, что очень актуально для нормативной работы и промышленного масштабирования.
Доставка пластырного трансплантата RPE в субретинальное пространство требует тщательных манипуляций с макулой и точного введения трансплантата в субретинальное пространство. Технологические достижения в области микрохирургии, такие как miOCT, и лучшее понимание динамики интраоперационной ткани сетчатки уменьшили кривую обучения этой процедуре. В ходе этого обсуждения будут объяснены обоснования следующих аспектов: i) предоперационная инъекция плазминогена; ii) применение интраоперационного miOCT; iii) использование кастомной канюли 41 G с двойным отверстием, низкими настройками ВГД и PFCL для создания субретинального блеба; iv) выскабливание нативного клеточного слоя РПЭ перед трансплантацией; v) применение сиролимуса, триамцинолона, доксициклина и миноциклина для снижения отторжения иммуногенного трансплантата.
Предоперационные инъекции плазминогена высвобождают парафовеальные спайки сетчатки
В первоначальных экспериментах было сложно отделить яму одной волной жидкости. При оценке с помощью miOCT изображения выявили наличие парафовеальных наружных спаек сетчатки к нативному RPE наряду с доказательствами интраретинальной травмы20. Эти спайки, возможно, привели к вертикальному расширению блеба, а не к волне субретинальной жидкости, распространяющейся по контуру сетчатки, что приводит к травме фовеальной кости. Плазминоген является неактивным предшественником плазмина, протеазы, нацеленной на фибронектин и ламинин. Окриплазмин является биоинженерным вариантом плазмина человека, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Европейским агентством по лекарственным средствам (EMA) для лечения симптоматического витреомакулярного вытяжения с сопутствующим макулярным отверстием или без него. Однако постодобрационные сообщения о развитии отека цистовидной макулы после инъекции окриплазмина предполагают более обширное влияние фермента на сетчатку23.
Хотя точные механизмы не были идентифицированы, было высказано предположение, что плазмин может ослаблять адгезию сетчатки за счет деградации элементов матрицы интерфоторецептора, ответственных за адгезию фоторецептора-RPE24. В этом протоколе глаза NHP лечили интравитреальным плазминогеном за 1 неделю до операции для высвобождения парафовеальных наружных спаек сетчатки. При предположении, что адгезия фоторецептора-RPE ослаблена, требуется более низкая сила для отделения нейросенсорной сетчатки, включая дистальное парафовеальное кольцо, которое обычно сопротивляется волне субретинальной жидкости20. Таким образом, сила, вводимая во время отслоения сетчатки, приводит к расширению блеба по всему контуру сетчатки, а не к растяжению сетчатки по касательной. Это снижает риск разрывов фовеальных пороков. Однако следует отметить, что влияние плазминогена на долгосрочную выживаемость трансплантата в этом протоколе не изучалось. Будущие исследования должны попытаться определить этот эффект.
miOCT обеспечивает анатомическую обратную связь для управления созданием субретинального блеба, имплантацией трансплантата и дренажем субретинальной жидкости
Интраоперационное, атравматическое манипулирование макулой является ключом к достижению хороших результатов трансплантации. Однако микроструктурные изменения макулы, связанные с манипуляцией, не всегда могут быть очевидны на операционном микроскопе. В таких процедурах miOCT является важным инструментом, который обеспечивает трехмерную, интраоперационную обратную связь макулярной структуры в режиме реального времени. miOCT особенно полезен на этапах отслоения фовеальной кости, имплантации трансплантата и дренажа субретинальной жидкости с использованием жидкостно-воздушного обмена. Во время отслоения фовеала miOCT может определять вертикальные и горизонтальные размеры блеба. Фовеальные микросоединения, которые не могут быть четко визуализированы на хирургическом микроскопе, могут быть подтверждены miOCT (рисунок 3). Во время имплантации трансплантата изображения miOCT направляются, показывая местоположение трансплантата или близость к ямке через часто менее прозрачную, отслоившуюся сетчатку. miOCT также может выделять возможные области адгезии сетчатки во время сложного процесса трансплантации25. Наконец, в процессе дренажа субретинальной жидкости miOCT может надежно направлять дренаж субретинальной жидкости до тех пор, пока не будет достигнут полный контакт между трансплантатом сетчатки и RPE.
Сочетание двухствольной канюли, низких установок ВГД и тампонады стекловидного тела PFCL синергетически уменьшает макулярную травму во время создания субретинального блеба
Тангенциальное растяжение сетчатки и турбулентность жидкости могут возникать во время субретинальной инъекции BSS для отслоения фовеальной кости, приводящей к нежелательным разрывам фовеала. Чтобы противодействовать этим явлениям, было показано, что такие факторы, как относительное положение и расстояние от ямочного центра, где инициируется инъекция, объем и скорость инъекции, тампонада стекловидного тела, выбор субретинальных инструментов и ВГД20,26,27. Субретинальный блеб для отслоения фовеи должен быть расположен в месте, достаточно удаленном от ямки, так как растяжение сетчатки может быть самым высоким в месте инициации блеба27. ВГД также следует поддерживать на низком уровне на протяжении всего создания субретинального блеба. Когда ВГД глаза высока, наблюдается более высокое вертикальное увеличение размера блеба, а не расширение по контуру сетчатки, тогда как блебы более мелкие при более низких давлениях20. Кроме того, хотя интравитреальная инъекция 50 мкл эффективно удвоит ВГД у людей28, учитывая более короткую длину глаз в NHP, повышение ВГД во время субретинальной инъекции, вероятно, будет выше и быстрее, чем у людей. В то время как большинство аппаратов для витрэктомии приспосабливаются к колебаниям ВГД, корректировка не является одновременным, а скорее реактивным процессом, который происходит по мере продолжения субретинальной инъекции. Следовательно, чем выше ВГД, тем выше риск перерастяжения сетчатки и последующей травмы плода. Таким образом, важно поддерживать стабильно низкий УГОД во время субретинальной инъекции.
Для субретинальной инъекции рекомендуется коммерческая субретинальная канюля 20/41 G (DORC) или изготовленная на заказ субретинальная канюля 25/41 G. Канюля позволяет жидкости выходить из полости стекловидного тела в обмен на BSS, вводимую в субретинальное пространство. Это обеспечивает «одновременную» регуляцию ВГД во время субретинальной инъекции. Схема канюли с двойным отверстием показана на рисунке 2. Наконец, PFCL используется для снижения риска разрывов фовеаля20,26,27. Поскольку PFCL, такие как окталин, имеют более высокий удельный вес, они оказывают нисходящую силу на сетчатку во время отслоения фовея29. Это дополнительно стабилизирует процесс создания отслоения фовеального отслоения и усиливает расширение блеба по контуру сетчатки. Этот метод был успешно использован для субретинальной инъекции rtPA в условиях массивного субмакулярного кровоизлияния из-за nAMD30.
Предтрансплантационное удаление нативного RPE позволяет восстановить RPE-фоторецепторный комплекс
Хозяин RPE должен быть удален перед трансплантацией трансплантата. Это связано с тем, что восстановление RPE-фоторецепторного комплекса необходимо для того, чтобы трансплантат RPE выполнял свои физиологические функции поддержки фоторецепторов21. Хозяин RPE, если его не удалить, может выступать в качестве механического барьера, который препятствует восстановлению этого комплекса. Он может быть удален либо путем введения RPE-токсичных химических веществ, либо с помощью физических средств удаления. Методы химического удаления включают системное или субретинальное введение йодата натрия31,32. Поскольку йодат натрия вызывает широко распространенную дегенерацию фоторецепторов, клеток RPE и Choriocapillaris при введении, его сетчаточная и системная токсичность исключает его использование для испытаний на людях32,33. Следовательно, физические интраоперационные методы являются предпочтительными. Различные физические методы были концептуализированы. Когда используются физические методы, крайне важно, чтобы мембрана Бруха оставалась неповрежденной. Многие исследования in vitro продемонстрировали зависимость выживаемости трансплантата RPE от интактной мембраны Бруха34,35,36.
Попытки гидравлической санации были связаны с разрывами мембраны Бруха, повышенной скоростью развития эпиретинальной мембраны и пролиферативной витреоретинопатией, что привело к тракционной отслойке сетчатки37. Алмазно-пылевидный шпатель, предложенный для санации RPE, также привел к разрывам мембраны Бруха, что привело к клеточной пролиферации из сосудистой оболочки в субретинальное пространство38. Интересно, что изготовленный на заказ выдвижной петлевой инструмент мог удалить вышележащую RPE с сохранением мембраны Бруха в глазах кроликов и свиней11,39. Удаление лежащего в основе RPE также полезно для установления животных моделей с RPE и наружной атрофией сетчатки, аналогичной прогрессирующей атрофической форме AMD. Когда фокальная область RPE удаляется из макулы, рана RPE закрывается через гипертрофию оставшихся клеток RPE. Однако эта реакция заживления ран связана с атрофией внешнего ядерного слоя40. Хотя создание животной модели выходит за рамки этой рукописи, аналогичная процедура может создать животную модель продвинутого атрофического фенотипа ВМД для тестирования клеточной терапии, полученной из RPE.
Применение сиролимуса, триамцинолона, доксициклина и миноциклина для снижения отторжения иммуногенного трансплантата
Считается, что субретинальное пространство является иммунопривилегированным участком, поддерживаемым неповрежденным гемато-ретинальным барьером и другими факторами41. Во многих исследованиях, связанных с субретинальной трансплантацией производных стволовых клеток с интактным гемато-ретинальным барьером, иммунодепрессанты играют незначительную роль в выживании трансплантата42. Считается, что внешний гемато-ретинальный барьер образован нативным слоем RPE и плотными соединениями между клетками RPE. В то время как нативное удаление RPE позволяет лучше интегрировать трансплантированные RPE и фоторецепторы хозяина, гемато-ретинальный барьер нарушается в процессе, увеличивая вероятность иммунного отторжения. Классически, Т-клетки занимают центральное место в процессе отторжения трансплантата других органов, таких как почки и печень43. Следовательно, первоначальные иммуносупрессивные схемы трансплантации ткани сетчатки были направлены на снижение этих адаптивных иммунных реакций.
Сиролимус, механистическая мишень ингибитора рапамицина, и такролимус, ингибитор кальциневрина, являются примерами иммуносупрессивных препаратов, нацеленных на адаптивные иммунные реакции. Однако, несмотря на адекватное подавление Т-клеток, показатели выживаемости трансплантата остаются низкими. Кроме того, известно, что клетки RPE подавляют активацию Т-клеток за счет высвобождения ингибирующих факторов и способствуют генерации регуляторных Т-клеток44. Следовательно, становится все более очевидным, что адаптивный иммунитет может быть не единственным фактором, способствующим отторжению трансплантата42. Субретинальная трансплантация клеточных продуктов может привести к накоплению и активации микроглии45.
Микроглии являются макрофагами сетчатки. Они состоят из двух основных популяций: 1) периваскулярной микроглии внутренней сосудистой системы сетчатки и 2) микроглии в паренхиме ткани сетчатки. Поскольку микроглия является частью врожденного иммунного ответа, интравитреальные глюкокортикоиды, такие как триамцинолон, могут подавлять цитокин-опосредованную пролиферацию46. Доксициклин и миноциклин также могут подавлять активацию микроглии и должны рассматриваться47,48. Наконец, различия в иммунном отторжении аллотрансплантатов RPE по сравнению с ксенотрансплантатами не полностью изучены49. Например, аллоантитела против индуцированных плюрипотентных клеток RPE, полученных из стволовых клеток, были зарегистрированы в сыворотке моделей иммунного отторжения in vivo. Однако роль этих антител и важность опосредованного антителами отторжения в выживаемости трансплантата остаются неизвестными50. Следовательно, предложен мультилекарственный режим с использованием сиролимуса для подавления адаптивного иммунитета и комбинации триамцинолона, доксициклина и миноциклина для подавления врожденного иммунитета. Этот режим успешно используется у кроликов с хорошими результатами выживания трансплантата и минимальными системными эффектами11.
Ограничения этой хирургической техники
В данной работе описывается возможный хирургический метод доставки листа трансплантата RPE в субретинальное пространство NHP; однако это не означает, что это единственный оптимизированный способ. Различные витрео-ретинальные хирурги могут иметь другие предпочтения в отношении инструментов и техники. Например, эта конструкция имплантационного устройства может доставлять только плоские имплантаты, поддерживаемые более жестким клеточным носителем, и, следовательно, может не подходить для относительно гибких (или свернутых) имплантатов. Трансплантация суспензии RPE может опустить большую часть этой техники. Соответственно, хирургические детали потребуют модификации на основе каждой стратегии доставки.
Поскольку интерес к клеточной терапии для лечения дегенеративных заболеваний сетчатки продолжает расти, животная модель NHP будет иметь важное значение в доклинических исследованиях для изучения факторов, влияющих на выживаемость трансплантата RPE. В этой рукописи предлагаются стратегии, позволяющие обеспечить более плавную доставку субмакулярного монослойного трансплантата RPE в глаз NHP. Также рекомендуются методы лучшей визуализации интраоперационных осложнений. Ожидается, что эти методы будут продолжать совершенствоваться по мере расширения использования клеточной терапии. В будущих методологических документах следует также рассмотреть вопрос о предложении всеобъемлющего перечня исследований для оценки различных структурных и функциональных аспектов трансплантата.
Раскрытие информации
Борис Станцель имеет патент США 9980851 на инструмент (скребок RPE), используемый в этом исследовании. Гонорар спикера от C. Zeiss Meditec и Geuder Борису Станцелю. У других авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Это исследование было поддержано IAF-PP (HMBS Domain) (OrBID): OculaR BIomaterials and Device, A*STAR, Сингапур (H17/01/a0/013), грантом NUS Start-up NUHSRO/2016/100/SU/01, грантом NUHS Clinical Scientist Program (NCSP) и Программой конкурентных исследований Национального исследовательского фонда, Сингапур (NRF-CRP21-2018-0008) для X.S., Hong Leong Endowed Professorship funds to G.E.H. и B.V.S. Мы хотели бы поблагодарить ветеринарную команду Трансляционной доклинической модельной платформы (Сингапурский научно-исследовательский институт глаз, Сингапур) за оказание поддержки в подготовке к хирургии NHP и наблюдении за животными. Мы хотели бы выразить нашу признательность Джилл Тео и коллегам из C. Zeiss Meditec Singapore за техническую поддержку OPMI-Lumera 700 со встроенным интраоперационным устройством OCT.
Материалы
| Name | Company | Catalog Number | Comments |
| 1% Mydriacyl (Tropicamide 1.0%) Sterile Ophthalmic preparation | Alcon | SIN 4715P | Surgical procedure |
| 10% Neutral buffered formalin | Leica | 3800598 | Histology procedure |
| 2.5% Mydfrin (Phenylephrine hydrochloride) Ophthalmic solution | Alcon | No. 01785 | Surgical procedure |
| 25 G AWH Vivid Chandelier | Synergetics | 56.54.25P | Surgical procedure |
| 25 Ga Bi-Blade Vitreous Cutter Combined Wide-Field Stellaris Elite Pack | Bausch & Lomb | SE5525WVB | Surgical procedure |
| AMO ENDOSOL Balanced Salt Solution for ophthalmic irrigation | Abbott Medical Optics | 15020 | Surgical procedure |
| Apo-minocycline | Apotex Inc | 2084104 | Immunosuppression |
| AUROVISC - Hypromellose Ophthalmic Solution USP 2% w/v | Aurolab | TN 00002387 | Surgical procedure |
| Autoclave MELAG, Vacuklav | MELAG | 1131-B2300 | Surgical procedure |
| Autostainer XL (ST5010) | Leica | 2433 | Histology procedure |
| Balanced Saline Solution | Beaver Visitec | 581732 | Surgical procedure |
| Cotton Bud | WINNER MEDICAL | 1NA6-100 | Surgical procedure |
| Diagnosys Espion E3 Console | Diagnosys | 272 | Ophthamic imaging |
| Doxycycline | Yung Shin | MAL 19950403AEZ | Immunosuppression |
| Eosin Y | Merck Millipore | 1.15935.0100 | Histology procedure |
| ERG-Jet contact lens electrodes | Fabrinal | F-06 | Ophthamic imaging |
| Extendable PolyTip Cannula 25 G/38 G | MedOne | 3247 | Surgical procedure |
| FlexTip Brush (25 g) 1.5 mm | MedOne | 3222 | Surgical procedure |
| Fluoresceine 10% Faure | Curatis AG | 5030376 | Ophthamic imaging |
| Gauze Swab | WINNER MEDICAL | 1NP3275 | Surgical procedure |
| Hamilton gas tight syringe 250 µL | Hamilton | 81101 | Surgical procedure |
| Heidelberg Spectralis HRA + OCT Computer System | Heidelberg Engineering | N.A. | Ophthamic imaging |
| Hematoxylin Gill II | Merck Millipore | 3801520 | Histology procedure |
| Inverted microscope eclipse Ti-E main body (100-240V) | Nikon | 33131 | Histology procedure |
| Ketamin injection | Ceva | 37711/58317 | Surgical procedure |
| Lithium carbonate | Merck Millipore | 1.05680.0250 | Histology procedure |
| Monkey plasminogen | Molecular Innovations | SKU-CYPLG | Surgical procedure |
| Non-contact wide angled 128 degree fundus lens | C. Zeiss Medtech | Resight 700 | Surgical procedure |
| Non-woven Ophthalmic Drape | Alcon | 8065103120 | Surgical procedure |
| Ophthalmic Corneal/Scleral V-Lance Knife 20 G | Alcon | 8065912001 | Surgical procedure |
| Paraffin Embedding Station | Leica | EG1150 H | Histology procedure |
| Paraplast High Melt Paraffin | Leica | 39601095 | Histology procedure |
| Phloxin B | Merck Millipore | 1.15935.0025 | Histology procedure |
| Prepowdered Surgical Gloves | MAXITEX | 85-173-2/85-173-3/85-173-4 | Surgical procedure |
| PRODINE Povidone-Iodine Solution BP | ICM PHARMA | PMLBLP20-01 | Surgical procedure |
| Righton Slit Lamp Model MW50D (RAA133CB) | Righton-Oph | 5200162 | Ophthamic imaging |
| Rotary microtome | Leica | RM2255 | Histology procedure |
| Safil Polyglycolic acid, braided, coated, absorbable surgical suture 7/0 | B.Braun | G1048711 | Surgical procedure |
| SHINCORT I.M. INJ. Triamcinolone Acetonide 40 mg/mL | Yung Shin | SHI40 SGP-2610015-001 | Surgical procedure |
| Single-Use Hypodermic Needle 21 G | B.Braun | 4657527 | Surgical procedure |
| Single-Use Hypodermic Needle 23 G | B.Braun | 4657667 | Surgical procedure |
| Sirolimus | Pfizer | SIN12034P | Immunosuppression |
| Stainless steel subdermal needle electrode | OcuScience | F-E2 | Ophthamic imaging |
| Stellaris Elite vision enhancement system | Bausch & Lomb | BL15455 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 27 G 12 mm | B.Braun | 4665406 | Surgical procedure |
| Sterican Single Use Insulin Needles Long Bevel 30 G 12 mm | B.Braun | 4656300 | Surgical procedure |
| Surgical gown + 2 Hand Towels | STERIL | APP10 00 01 | Surgical procedure |
| Tegaderm Film | 3M | 1626W | Surgical procedure |
| TERUMO Syringe 1 cc/mL Luer SlipTip with needle 26 G | Teruma | SS-01S | Surgical procedure |
| TERUMO Syringe 3 cc/mL Luer LockTip | Teruma | SS-03L | Surgical procedure |
| TERUMO Syringe 5 cc/mL Luer LockTip | Teruma | SS-05L | Surgical procedure |
| TobraDex (Tobramycin, Dexamethasone) Sterile Ophthalmic Ointment | Alcon | No. 01577 | Surgical procedure |
| Topcon Retinal Camera TRC-50DX | Topcon | 948605 | Ophthamic imaging |
| Vidisic Gel | Bausch & Lomb | GB41789155517 | Surgical procedure |
| Xylazil-20 | Ilium | 38653/50276 | Surgical procedure |
| Zeiss Opmi Rescan 700 | Carl Zeiss Meditec AG | 7210 | Surgical procedure |
Ссылки
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet. Global Health. 2 (2), 106-116 (2014).
- Verbakel, S. K., et al. Non-syndromic retinitis pigmentosa. Progress in Retinal and Eye Research. 66, 157-186 (2018).
- Schwartz, S. D., et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 385 (9967), 509-516 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Mehat, M. S., et al. Transplantation of human embryonic stem cell-derived retinal pigment epithelial cells in macular degeneration. Ophthalmology. 125 (11), 1765-1775 (2018).
- Mandai, M., et al. Autologous induced stem-cell-derived retinal cells for macular degeneration. New England Journal of Medicine. 376 (11), 1038-1046 (2017).
- Sugita, S., et al. HLA-matched allogeneic iPS cells-derived RPE transplantation for macular degeneration. Journal of Clinical Medicine. 9 (7), 2217 (2020).
- Gouras, P., Flood, M. T., Kjeldbye, H. Transplantation of cultured human retinal cells to monkey retina. Anais da Academia Brasileira de Ciências. 56 (4), 431-443 (1984).
- Koster, C., et al. A systematic review on transplantation studies of the retinal pigment epithelium in animal models. International Journal of Molecular Sciences. 21 (8), 2719 (2020).
- Stanzel, B., et al. Surgical approaches for cell therapeutics delivery to the retinal pigment epithelium and retina. Advances in Experimental Medicine and Biology. 1186, 141-170 (2019).
- Kamao, H., et al. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Stem Cell Reports. 2 (2), 205-218 (2014).
- Ben M'Barek, K., et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents. Biomaterials. 230, 119603 (2020).
- Fujii, S., et al. A strategy for personalized treatment of iPS-retinal immune rejections assessed in cynomolgus monkey models. International Journal of Molecular Sciences. 21 (9), 3077 (2020).
- The Architecture Of The Human Fovea. Webvision. Moran Eye Center Available from: https://webvision.med.utah.edu/book/part-ii-anatomy-and-physiology-of-the-retina/the-architecture-of-the-human-fovea/ (2021)
- Francis, P. J., et al. Rhesus monkeys and humans share common susceptibility genes for age-related macular disease. Human Molecular Genetics. 17 (17), 2673-2680 (2008).
- Picaud, S., et al. The primate model for understanding and restoring vision. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26280-26287 (2019).
- Pennesi, M. E., Neuringer, M., Courtney, R. J. Animal models of age related macular degeneration. Molecular Aspects of Medicine. 33 (4), 487-509 (2012).
- Al-Nawaiseh, S., et al. A step by step protocol for subretinal surgery in rabbits. Journal of Visualized Experiments: JoVE. (115), e53927 (2016).
- Tan, G. S. W., et al. Hints for gentle submacular injection in non-human primates based on intraoperative OCT guidance. Translational Vision Science & Technology. 10 (1), 10 (2021).
- Liu, Z., et al. Surgical transplantation of human RPE stem cell-derived RPE monolayers into non-human primates with immunosuppression. Stem Cell Reports. 16 (2), 237-251 (2021).
- Stanzel, B. V., et al. Human RPE stem cells grown into polarized RPE monolayers on a polyester matrix are maintained after grafting into rabbit subretinal space. Stem Cell Reports. 2 (1), 64-77 (2014).
- Shaikh, M., Miller, J. B., Papakostas, T. D., Husain, D. The efficacy and safety profile of ocriplasmin in vitreomacular interface disorders. Seminars in Ophthalmology. 32 (1), 52-55 (2017).
- Johnson, M. W., Fahim, A. T., Rao, R. C. Acute ocriplasmin retinopathy. Retina. 35 (6), 1055-1058 (2015).
- Kashani, A. H., et al. Surgical method for implantation of a biosynthetic retinal pigment epithelium monolayer for geographic atrophy: experience from a phase 1/2a study. Ophthalmology. Retina. 4 (3), 264-273 (2020).
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. New England Journal of Medicine. 358 (21), 2240-2248 (2008).
- Xue, K., Groppe, M., Salvetti, A. P., MacLaren, R. E. Technique of retinal gene therapy: delivery of viral vector into the subretinal space. Eye. 31 (9), 1308-1316 (2017).
- Grzybowski, A., et al. Update on intravitreal injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 239 (4), 181-193 (2018).
- Wong, D., Williams, R., Stappler, T., Groenewald, C. What pressure is exerted on the retina by heavy tamponade agents. Graefe's Archive for Clinical and Experimental Ophthalmology. 243 (5), 474-477 (2005).
- Steel, G. B., Kearns, V., Stanzel, B. V., Wong, D. Subretinal injection under perfluorocarbon liquids to avoid foveal dehiscence. Retina. , (2021).
- Petrus-Reurer, S., et al. Integration of subretinal suspension transplants of human embryonic stem cell-derived retinal pigment epithelial cells in a large-eyed model of geographic atrophy. Investigative Ophthalmology & Visual Science. 58 (2), 1314-1322 (2017).
- Koh, A. E. -. H. Retinal degeneration rat model: A study on the structural and functional changes in the retina following injection of sodium iodate. Journal of Photochemistry and Photobiology B: Biology. 196, 111514 (2019).
- Bürgi, H., Schaffner, T. H., Seiler, J. P. The toxicology of iodate: a review of the literature. Thyroid. 11 (5), 449-456 (2001).
- Tezel, T. H., Kaplan, H. J., Del Priore, L. V. Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch's membrane. Investigative Ophthalmology & Visual Science. 40 (2), 467-476 (1999).
- Tezel, T. H., Del Priore, L. V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium. Graefe's Archive for Clinical and Experimental Ophthalmology. 235 (1), 41-47 (1997).
- Castellarin, A. A., et al. In vitro transplantation of fetal human retinal pigment epithelial cells onto human cadaver Bruch's membrane. Experimental Eye Research. 66 (1), 49-67 (1998).
- Lopez, P. F., et al. Retinal pigment epithelial wound healing in vivo. Archives of Ophthalmology. 113 (11), 1437-1446 (1995).
- Lopez, R., Gouras, P., Brittis, M., Kjeldbye, H. Transplantation of cultured rabbit retinal epithelium to rabbit retina using a closed-eye method. Investigative Ophthalmology & Visual Science. 28 (7), 1131-1137 (1987).
- Thieltges, F., et al. Localized RPE removal with a novel instrument aided by viscoelastics in rabbits. Translational Vision Science & Technology. 5 (3), 11 (2016).
- Phillips, S. J., et al. Autologous transplantation of retinal pigment epithelium after mechanical debridement of Bruch's membrane. Current Eye Research. 26 (2), 81-88 (2003).
- Sugita, S., Mandai, M., Kamao, H., Takahashi, M. Immunological aspects of RPE cell transplantation. Progress in Retinal & Eye Research. , (2021).
- Xian, B., Huang, B. The immune response of stem cells in subretinal transplantation. Stem Cell Research & Therapy. 6, 161 (2015).
- Issa, F., Schiopu, A., Wood, K. J. Role of T cells in graft rejection and transplantation tolerance. Expert Review of Clinical Immunology. 6 (1), 155-169 (2010).
- Yan, F., et al. Transforming growth factor-β2 increases the capacity of retinal pigment epithelial cells to induce the generation of regulatory T cells. Molecular Medicine Reports. 13 (2), 1367-1372 (2016).
- Singhal, S., et al. Chondroitin sulfate proteoglycans and microglia prevent migration and integration of grafted Müller stem cells into degenerating retina. Stem Cells. 26 (4), 1074-1082 (2008).
- Singhal, S., Lawrence, J. M., Salt, T. E., Khaw, P. T., Limb, G. A. Triamcinolone attenuates macrophage/microglia accumulation associated with NMDA-induced RGC death and facilitates survival of Müller stem cell grafts. Experimental Eye Research. 90 (2), 308-315 (2010).
- Santa-Cecília, F. V., et al. Doxycycline suppresses microglial activation by inhibiting the p38 MAPK and NF-kB signaling pathways. Neurotoxicity Research. 29 (4), 447-459 (2016).
- Scholz, R., et al. Minocycline counter-regulates pro-inflammatory microglia responses in the retina and protects from degeneration. Journal of Neuroinflammation. 12, 209 (2015).
- Sugita, S., Makabe, K., Iwasaki, Y., Fujii, S., Takahashi, M. Natural killer cell inhibition by HLA-E molecules on induced pluripotent stem cell-derived retinal pigment epithelial cells. Investigative Ophthalmology & Visual Science. 59 (5), 1719-1731 (2018).
- Sugita, S., et al. Detection of retinal pigment epithelium-specific antibody in iPSC-derived retinal pigment epithelium transplantation models. Stem Cell Reports. 9 (5), 1501-1515 (2017).
Erratum
Formal Correction: Erratum: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases
Posted by JoVE Editors on 12/29/2021. Citeable Link.
An erratum was issued for: Retinal Pigment Epithelium Transplantation in a Non-human Primate Model for Degenerative Retinal Diseases. The Authors section was updated.
The Authors section was updated from:
Ivan Seah*1, Zengping Liu*2,3,4, Daniel Soo Lin Wong3, Wendy Wong1, Graham E. Holder1,3,5, Veluchamy Amutha Barathi3,4,6, Gopal Lingam1,3,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, National University Hospital, Singapore,
2Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR),
3Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore,
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
to:
Ivan Seah*1,2, Zengping Liu*1,3,4, Daniel Soo Lin Wong1, Wendy Wong2, Graham E. Holder1,2,5, Veluchamy Amutha Barathi1,4,6, Gopal Lingam1,2,4, Xinyi Su1,2,3,4, Boris V. Stanzel1,7,8
1Department of Ophthalmology, Yong Loo Lin School of Medicine, National University of Singapore
2Department of Ophthalmology, National University Hospital, Singapore,
3Institute of Molecular and Cell Biology (IMCB), Agency for Science, Technology and Research (A*STAR)
4Singapore Eye Research Institute (SERI),
5UCL Institute of Ophthalmology,
6Academic Clinical Program in Ophthalmology, Duke-NUS Medical School,
7Macula Center Saar, Eye Clinic Sulzbach, Knappschaft Hospital Saar,
8Department of Ophthalmology, University of Bonn
* These authors contributed equally
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены