Method Article
人性化调解员发布分析作为过敏原效力的读出
摘要
在这里,我们介绍介质释放分析,使用与人类IgE受体相互感染的鼠血友病白血病细胞系,模拟在1型过敏反应中通常观察到的效应细胞的去粒。该方法以高度敏感、可重复和可定制的方式研究过敏原的生物活性。
摘要
介导器释放分析 体外 免疫球蛋白E (IgE) 介导的除草和分泌的介导器通过效应细胞,如乳腺细胞和基础嗜好者,刺激与假定过敏原的串行稀释。因此,这些检测是一种基本工具,模仿 体内 脱粒过程,这发生在过敏性患者或皮肤刺测试中的过敏原暴露。此外,这些检测通常用于调查蛋白质的过敏潜力和患者塞拉反应的反应。在这里,我们描述了一个简单的2天协议使用不朽的鼠巴索菲尔白血病细胞系通过人类高亲和力IgE血浆膜受体(FcéRI)传播和人性化。介导器释放检测的这种变种是一个坚固、敏感和可重复的 体外 细胞系统,无需将抗原固定到固体母体中。该协议包括以下步骤:(1) 补充人体血红素的灭活,(2) 细胞的采集、播种和被动敏感:(3) 用抗原刺激引起调解人释放:(4) 测量β-六氧沙胺酶活性,作为释放的炎症调解人的代孕者,如组胺。检测是评估过敏原-IgE交叉链接触发细胞脱粒能力的有用工具,可以实施标准化过敏原提取物, 比较患者对小过敏原或主要过敏原的反应,以及过敏提取物(花粉、猫皮屑等),以调查过敏原同源体、同形体和折叠变异(如低过敏原性)的效力,以及配体对过敏活动的影响。最近的应用包括使用检测来监测过敏原免疫治疗过程中的治疗效果。
引言
I型超敏反应,其特征是免疫球蛋白E(IgE)的产生,特定于各自的抗原,影响世界近三分之一的人口。这些反应与一些过敏表现有关,如哮喘和鼻膜炎,甚至可能导致系统性危及生命的反应1。与体内测试不同,免疫化学方法,如酶相关免疫吸附剂检测(ELISA),完全适合研究抗体的目标结合,但不涉及可能导致立即过敏反应的蛋白质的功能方面。在固体支架(如ELISA板)上固定过敏原可能导致其结构完整性的变化和过敏相关表位2的破坏。即使是皮肤刺测试 (SPT), 最常见的工具,以确认对某些过敏原的敏感性, 有其限制的检测症状IgE介导食物过敏或过敏原可用性3,4.为了找到一种合乎道德、高度具体、敏感和具有成本效益的方法来测试过敏原的生物效力,从而引起I型过敏反应,建立了所谓的介导释放检测方法。
这些测定原理依赖于敏感阶段之后的事件,以及IgE与效应细胞表面表达的高亲和力受体(如乳腺细胞和嗜血杆菌)的α链结合的能力。IgE主要由粘膜相关淋巴组织中的血浆细胞产生。虽然它是血液中免疫球蛋白最少的(非特异性个体约0.05%),但它拥有极高的生物活性是过敏症状的主要原因。IgE 的半衰岁时间可以从 2-3 天增加到数周甚至数月,当与效应器细胞上的受体结合时。抗原随后与两个受体结合的IgE分子的可变区域结合,导致它们相互连接,随后在效应细胞中引入下游信号级联,导致脱粒,并释放出几个引起血管吸血的亲炎症介导器,如组胺、血清蛋白酶(如丁二烯蛋白酶)和前列腺素5、6、7。细胞因子的分泌,如白细胞素4(IL-4)和IL-13负责维持炎症T帮手2(Th2)反应和B细胞的类切换到IgE生产的等离子细胞5,8,9。另一方面,释放血栓烷导致支气管收缩,白细胞炎刺激平滑的肌肉收缩以及血管泄漏,并在导致哮喘或过敏性鼻炎的气道炎症中起着至关重要的作用。
分析上述大多数调解人的研究工具已经建立,尽管有一些主要缺点。Tryptase 检测是通过乳腺细胞活化测量全身过敏的合适临床方法,但与 SPT 等黄金标准方法相比,它们在过敏诊断中的敏感性和特异性太不准确了。另一方面,西胱氨酸白细胞素检测不能诊断过敏β乳腺素或非类固醇抗炎药物12。1960年代已经制定了测量组胺作为过敏反应释放的主要调解人的议定书。一旦释放在外周血液中,组胺立即被组胺甲基转移酶降解,导致血浆半衰仅几分钟,使其分析相当具有挑战性。除了其不稳定性外,对组胺的监测还表明,对药物过敏以及商业食品蛋白和黄蜂毒剂的特异性和敏感性较低。
已引入具有效应细胞系的体外模型,作为从过敏患者中分离和培养嗜血杆菌以进行释放检测的劳动密集型程序的替代方案。因此,使用RBL-2H3细胞系的鼠血友病白血病(RBL-)基测定已经建立了3。由于这种细胞系不能结合人类IgE,它首先被人类IgE等离子膜受体(FcéRI)的α、β和γ链所感染。已经生成了几个克隆,并测试了人类α链的表达水平和均质,其中克隆RBL-30/25成为体外测试最有希望的候选者。通过钙动员检测测试了转染克隆受体激活后诱导的信号级联。作为组胺释放的脱粒和代孕指标,测得溶酶β-六氧酶,具有较高的稳定性14的显著优势。使用 RBL-30/25 细胞的介导器释放达到 100%,因此用于测试来自过敏患者的血色素。在用商业过敏原提取物挑战敏感细胞后,对介质释放进行了检测。这导致发现,从不同的制造商提取的过敏原提取物的成分(总蛋白质含量高达60倍)存在巨大差异,用于诊断(如SPT)或治疗方法3,15,16。
在此,我们提供了RBL协议的详细描述,以执行调解人释放检测使用来自过敏捐赠者的血清。在被动敏化过程中,血清中的IgE被基底细胞表面表达的高亲和力FcéR1受体捕获。抗原刺激后,针对抗原的绑定IgEs是相互关联的,触发细胞脱粒和释放介导器β-六氧酶。随后使用合适的基板测量β-六氧三恶症的活性。对于检测,使用 huRBL-2H3 细胞,并在以下协议中称为 huRBL。该协议描述了一个标准的抗原稀释系列,8个步骤稀释1:10范围从1微克/mL到0.1 pg/mL过敏原。
研究方案
使用来自白杨花粉过敏患者的塞拉的道德批准来自荷兰伦理委员会(批准编号:NL65758.018.18)。
1. 安全程序
- 在实验的第一天使用生物安全2级工作台在无菌条件下工作(生物安全2级)。遵循机构使用人类血清的安全准则。
2. 补充人类塞拉的灭活
- 从细胞培养瓶中收获P3X63Ag8.653细胞(称为Ag8细胞)的密集培养物,并将其转移到离心管中。
- 使用以下培养基为这些细胞:修改鹰的最低基本介质与减少血清浓度, 1% 青霉素-链霉素 (100 单位 Pen., 0.1 毫克/mL 链球菌),5% 热灭活胎儿小腿/牛血清 (FCSI).。
- 离心机Ag8细胞在室温下250 x g 下5分钟。
- 将细胞颗粒重新悬浮到 huRBL 介质中约 1 x10 6 细胞/mL 的最终浓度(带阿尔法修饰的最低基本中型鹰、4 mM L-Glutamine、5% FCSi、1% G418(100% 库存:10 克/125 mL dH2O)。
注:通过传递来维护Ag8细胞,供将来使用。 - 在Ag8细胞悬浮中稀释人血色素1:10。测定中的最后血清稀释为 1:20。
注:对于低特异性IgE的塞拉,可以使用1:5(1:10最终稀释)。 - 在 37 °C 和 5%-7% CO2下孵育 1 小时。
3. 胡尔布尔细胞的收获和播种
- 小心地从 T-75 细胞培养瓶中吸气介质,而不接触 huRBL 细胞(HURBL 细胞是粘附的)。确保细胞的汇流在 50%-90% 左右。
注:根据细胞汇合,密集的T-75细胞培养瓶的细胞含量通常足以容纳一到两个96井板。 - 通过加入10兆加仑的杜尔贝科磷酸盐缓冲盐水(DPBS),清洗细胞两次。将DPBS添加到烧瓶的另一侧,而不是直接添加到细胞上。
- 吸气DPBS,并添加5 mL预热1x试金石EDTA(0.05%/0.02%EDTA稀释在DPBS)的细胞分离。
- 在 37 °C 下孵化烧瓶 5 分钟。
- 通过小心地敲击烧瓶来分离细胞。
- 将电池悬架转移到 15 mL 离心管中,并填充 huRBL 介质或 DPBS 以稀释试药素-EDTA。
- 在室温下,在 250 x g 下离心 5 分钟。
- 吸气超高分子,并在5 mL的huRBL介质中重新吸气颗粒进行细胞计数。
- 计算细胞并在 huRBL 介质中稀释它们,以获得 2 x 106 细胞/mL 的最终浓度。
- 使用无菌的 96 井板,每口井添加 50 μL 的 huRBL 电池悬浮,相当于 1 x 105 个电池/井。
4. huRBL细胞的被动敏感性
- 以250 x g离心预孵化Ag8/血清悬架5分钟。
- 将离心Ag8/血清悬架的50微升转移到每个含有huRBL细胞的井中,而不会干扰Ag8细胞颗粒。
- 包括无抗原控制,这是敏感的,但未刺激的细胞(不添加抗原),作为底部信号高原/背景的迹象。背景和最大裂解控制井不需要用血清敏感。添加 50 μL 的 huRBL 介质来控制油井。
- 盖上盖子,在37°C和5%-7%CO2下孵育过夜。
5. 抗原刺激的去粒和调解释放
- 提前在1x Tyrode的缓冲液(9.5克/升泰罗德盐,0.1%牛血清白蛋白(BSA),0.5克/升碳酸钠(NaHCO3)中提前准备抗原稀释。每口井需要 100 μL 的最终金额。
注:并不是每个过敏原,无论是从天然来源纯化或重组生产,可能稳定在1xTyrode的缓冲。因此,在检测程序之前,在 1x Tyrode 的缓冲器中执行稳定性测试。或者,稀释氧化铀 (D2O) 中的 1x Tyrode 缓冲器,以增加检测的信号与噪声比。 - 在反应管中对1:10稀释系列感兴趣的抗原进行8次稀释,从10或1微克/mL蛋白质开始。
注意:请务必事先测试稀释系列。或者,调整 1:10 稀释系列(例如,1:5、1:20 或 1:30),以覆盖完整释放曲线。此外,开始浓度可能因实验设置而异。 - 要洗涤镀在 96 井板上的 huRBL 细胞,请首先通过小心地吸气、倒置和敲击吸水纸上的板来去除含有血红素的细胞介质。
- 每口井用 200 微升 1 倍泰洛德斯的缓冲器清洗细胞。对所有油井都进行类似对待。
注意:将洗涤溶液缓慢添加到细胞中,以免干扰它们。 - 离开约30s,并重复洗涤步骤共三次。
- 最后一次添加洗涤溶液后,将溶液留在井中,直到准备好继续添加抗原稀释。
注意:避免将细胞暴露在空气中太久。 - 将 100 μL 的抗原溶液转移到每个含有预敏化 huRBL 细胞的井中。
注:如果分析几个不同的参数,将稀释系列的单个样品转移到额外的不绑定 96 井板(使用与 huRBL 板相同的布局),然后直接在 HURBL 细胞板上使用多通道移液器进行转移。这样,可以避免将细胞暴露在空气中太久,这可能导致检测性能差(低/无信号)。 - 用 100 微升 1x Tyrode 缓冲液盖住控制井(最大裂解和非敏感背景细胞)。不要用抗原刺激这些控制井。
- 此外,在稀释系列的敏感无抗原井中加入 100 μL 的 1x Tyrode 缓冲器,这需要在数据分析过程中考虑敏感细胞的抗原独立自发释放。
- 在 37 °C 和 5%-7% CO2下孵育 1 小时的 huRBL 细胞。
6. β-六氧三角酶活性荧光测量
- 以每口井 10% Triton X-100 的 10 μL 处理最大裂解控制的井,并正确混合,以彻底裂解细胞,获得 100% 释放的β-六氧沙米尼达酶。
- 将 50 μL 的基板溶液添加到新的不绑定 96 井板中。一个96井板的基板解决方案:5mL 0.1 M柠檬检测缓冲器,pH4.5:和 80 μL 的 10 mM 4 甲基苯丙胺 N - 乙酰 - β - D - 葡萄糖酰胺。
- 将所有油井的 50 μL 细胞超高剂转移到包含基板溶液的新板中。
注意: 派佩特超纳特小心地从 hurbl 板上脱落, 以免破坏 hurbl 细胞。 - 在 37 °C 下用基板溶液和细胞超高纳坦孵化板 1 小时,以便转换荧光基板。
注意:保留 huRBL 板,以便进行细胞生存性检测。 - 每口油井加入 100 微升停止溶液(15 克/升甘氨酸,11.7 克/升 NaCl 溶解在 dH2O 中,pH 10.7)。
- 使用板读器测量 360 nm 激发和 465 nm 发射的荧光。
7. 数据分析
- 对于百分比释放的基本计算,请使用任何电子表格软件。
- 对于背景减法/基线去除,从所有其他油井中减去背景井的平均值。
- 计算最大裂解井的均值,并按百分比表达稀释系列的数据。这样可以表达数据作为细胞释放的百分比正常化到细胞裂解造成的最大酶释放。
- 完整的剂量反应介导器释放曲线最能表示为 XY 图形,X 轴上的日志上具有抗原浓度,Y 轴上的介导器释放百分比。
- 将无抗原控制值添加为虚线,以指示背景或底部高原。
注:使用此规范化策略可以比较几个经过类似处理的塞拉。为了直接比较,我们进一步建议计算半最大释放,即每条曲线最大值和最小值的平均值所必需的抗原浓度(以ng/mL为限)。刺激半最大释放的抗原浓度是通过将半最大释放值插值到对数回归线来计算的。
结果
调解人释放分析,基于huRBL细胞(图1A 和B),导致钟形剂量反应曲线(图1C)。对于简化的数据表示,可以使用线性回归(图 1D)计算半最大介导器释放所需的抗原浓度。进行细胞生存性检测,以排除从敏感血清或用于刺激的抗原中产生的细胞毒性效应(图1E)。检测可用于测试不同塞拉对某种抗原的反应。在我们的例子中,5个塞拉中,有4个来自白木花粉过敏患者,对Bet v 1刺激做出了反应。血清 #1 显示最高的调解人释放 (图 2)。血清 #5 没有响应 Bet v 1 刺激, 因此, 可能会对其他白木花粉过敏原 (例如, 投注 v 2, 普罗菲林) 做出反应。这些数据表明,Bet v 1 是一种有效的过敏原,负责 IgE 介质过敏症状。通过使用 huRBL 检测,可以评估 IgE 对同源过敏原的交叉反应(图 3)。在这里,两个白木花粉过敏患者对Bet v 1反应良好,而只有患者#2也回应了Cor a 1,Bet v 1同源食物过敏原发现粽子。根据这些数据,患者 #2 很可能具有比患者 #1 高 1 交叉反应 IgE 水平的 Cor,导致粽子消耗时的口腔过敏症状。甚至对过敏原突变变异(效力降低)的低过敏性性质的评估,也可以分析并与其野生型对应物进行比较(图4)。在所提供的示例中,折叠变异的释放曲线与野生型过敏原相比转向更高的抗原浓度,导致引起半最大释放所需的抗原浓度显著提高(图 4B)。这些数据意味着生成的突变/折叠变异与野生型蛋白质相比过敏性较低。这种降低的效力触发IgE介导的去粒突出折叠变种的低过敏性。基于此检测,折叠变种是过敏原特异性免疫治疗的有趣候选,因为它可能会在治疗过程中导致减少 IgE 相关副作用。
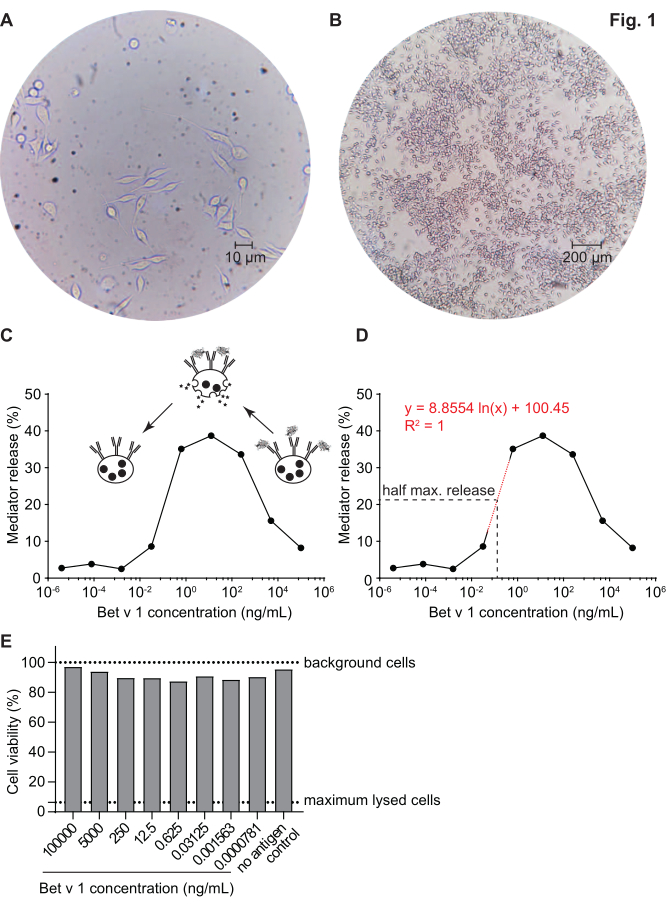
图1:人性化的RBL细胞和IgE-过敏原交叉连接诱导β-六氧沙米尼酶释放的具有代表性的钟形曲线。RBL细胞是粘附在培养瓶,这给了他们一个棒状的形状,因为他们试图连接自己(A)。细胞收获的理想汇合水平不超过90%(B)。细胞的放大倍数分别为40倍和10倍。与白木花粉过敏个体的人类血清敏感的细胞在挑战时与重组剂 Bet v 1 (rBet v 1) 发生反应, 主要的白木花粉过敏原(C)。作为调解人释放的代理,β-六氧沙米尼酶活性在细胞超分子中测量。钟形曲线是由于过敏原的过量而对IgE上的抗原表位进行单价占用的结果,这在竞争中抑制了高抗原浓度下的过敏原-IgE交叉连接。高过敏原浓度低释放的另一个解释是,在存在过量抗原的情况下抑制细胞内通路。为了确定获得半最大释放所需的过敏原浓度,使用了基于代表介质释放曲线斜度线性部分的实验值的对数回归线(D)。红色虚线表示用于计算的对数回归线。回归线的公式以红色显示。半最大释放定义为:半最大释放 = (最低释放值 = 最大释放值)/2。在示例中,计算的半最大释放值为 20.6%。本实验中使用的代表性人类血清被稀释1:20,用于用huRBL细胞孵育,用于刺激的抗原浓度从100微克/mL到Bet v 1的0.004 pg/mL不等。细胞生存能力测定,在这种情况下是MTT检测,在抗原刺激后与剩余细胞一起进行,以评估敏感血清以及抗原稀释对细胞生存能力和细胞计数的影响(E)。未经处理的背景细胞和裂解细胞(最大裂解)显示为虚线。请单击此处查看此图的较大版本。
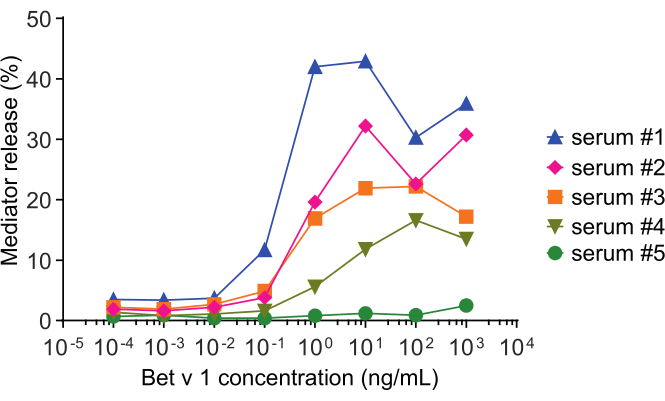
图2:代表曲线的β-六氧三恶三叶草百分比释放五个不同的人类塞拉。 rBet v 1 的相同抗原浓度范围与不同白木花粉敏感个体的塞拉一起培养。不同患者之间释放的百分比明显不同,这与症状的严重程度相对应。请注意,患者 #5 对主要的白杨花粉过敏原 Bet v 1 没有反应。所有五个用于获得这些介质释放曲线的人类血色素均被稀释1:20,用于与huRBL细胞的孵育。 请单击此处查看此图的较大版本。
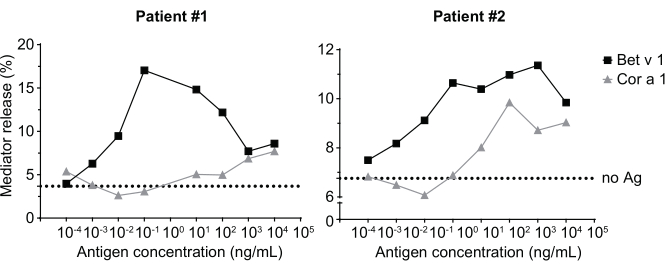
图3:来自白木花粉敏感患者的IgE的交叉反应与Bet v 1同源粽子过敏原Cor a 1。 两个有代表性的患者对白木花粉敏感, 对 Bet v 1 的强烈反应, 以及对同源过敏原 Cor a 1 的较小程度的反应。患者 2 显示对 Cor a 1 的显著反应,因此在粽子消耗时可能会表现出口腔过敏症状,而患者 1 的调解释放几乎可以忽略不小。虚线表示无抗原控制,这种控制是细胞对人体血清敏感,但不会受到过敏原的刺激,因此,作为底部信号高原/背景的指示。 请单击此处查看此图的较大版本。
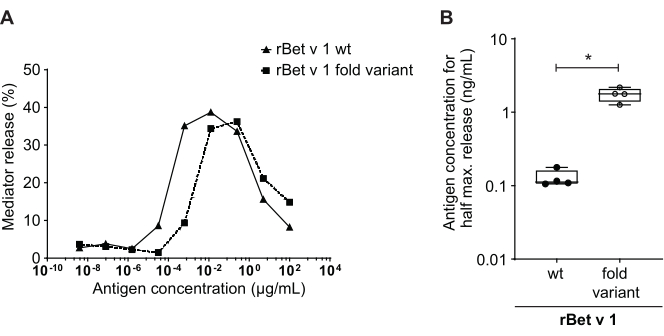
图4:rBet v 1野生类型与低过敏性折叠变种之间百分比释放的比较。 同一种白木花粉敏感个体的血清与rBet v 1野生类型(wt)和主要白木花粉过敏原(A)的低过敏性折叠变异一起孵育。尽管介导器释放在两种抗原中都可以看到,但在将折叠变异与野生类型 rBet v 1 进行相同百分比释放时,反原浓度明显转向较高。比较不同抗原百分比释放百分比差异的标准方法是计算达到半最大释放(B)所需的抗原浓度。这通常在生物复制中执行(测试不同人类血色中的每个过敏原的相同抗原范围)。通常,为了得出任何重要的结论,调解人释放是与塞拉从至少8至10个不同的患者进行。在这里,四个不同的塞拉的结果被绘制为一个例子。用于统计分析的配对 t测试。*p ≤ 0.05;**p ≤ 0.01;p ≤ 0.001:p ≤ 0.0001。 请单击此处查看此图的较大版本。
| 潜在问题和故障排除 | 溶液 |
| 由于细胞响应性改变,检测到检测的变异性 | 确保单元格通过周期数不超过 20 到 30 通道。在早期通道上制作冷冻库存,以便将来进行实验。 |
| 而不是依靠生物复制(使用不同的塞拉)而不是技术复制。 | |
| 塞拉含有低水平的特定IgE | 可使用较低的最终血清稀释(即 1:10)而不是 1:20。相反,含有高浓度特定IgE的塞拉可以进一步稀释(1:30或1:40)。 |
| 没有足够的细胞进行检测 | 确保 T-75 烧瓶中的汇流在 50-90% 左右。通过更多的烧瓶。 |
| 塞拉的细胞毒性作用,即由于不完全的补充灭活 | 除了调解人释放分析之外,还执行细胞生存能力分析。增加 Ag8 浓度,以避免不完全的补充灭活。 |
| 低信号 | 通过稀释氧化二氮 (D2O) 中的 1 倍 Tyrode 缓冲,而不是 dH2O,或使用具有较高特定 IgE 水平的血红素来稀释特定 IgE 的检测信号与噪声比,从而改善检测结果。 |
| 泰罗德缓冲区(例如降水)中的过敏原不稳定 | 在检测程序之前,在 1x Tyrode 的缓冲器中进行稳定性测试。不建议替换泰罗德的缓冲器。 |
| 找到各自过敏原正确启动浓度的问题 | 稀释系列的适应,以覆盖完整的释放曲线(更多的稀释步骤,1:20稀释,而不是1:10)。 |
| 低/无信号表示的检测性能差 | 避免细胞毒性作用,无论是塞拉或抗原刺激(例如酶过敏原)。小心地清洗和浸泡细胞。避免长时间暴露在空气中,防止细胞干燥。 |
| 如何知道是否达到底部信号高原? | 在盘子中添加"无抗原"控件。这些是敏感细胞,只有1倍泰罗德的缓冲刺激,但没有过敏原。 |
| 除了最大的裂解井之外, 我还需要积极的控制吗? | 作为额外的阳性控制,可以使用血清和抗原组合,已知会导致脱粒或抗 FcéR1 抗体。 |
| 我需要多少口井? | 这取决于你的点子系列,你想分析的抗原和塞拉的数量。 根据要测试的塞拉/抗原量,规划 96 井板的布局。不要忘记添加"无抗原控制",背景细胞(无敏感,非刺激)以及最大的裂解井。 |
| 我应该测试多少塞拉?我需要复制吗? | 虽然检测相当稳健,但由于细胞响应性改变,检测到检测的变异性也有所变化。因此,建议它宁愿依靠生物复制(使用不同的塞拉),而不是依靠技术复制。至少八种不同的塞拉足以分析过敏原。但是,如图 4B 所示,已经可以使用更少的塞拉获得显著结果。 |
表1:故障排除。
讨论
此处描述的 huRBL 基于细胞的介质释放检测是一种强大的方法,可在任何实验室中轻松执行和实现。唯一的要求是在无菌条件下培养细胞。该检测用于评估过敏原或过敏源引起患者IgE交叉链接和嗜血杆菌脱粒17的可能性。只要患者的血清具有高水平的特定IgE,识别感兴趣的过敏原,检测就可以轻松适应任何过敏原或过敏源。建议除调解人释放检测外,进行细胞生存性检测,以解释可能导致检测性能不佳的任何潜在细胞毒性影响。这可能是由于血清或其他血清衍生的细胞毒性作用的不完全补充灭活。例如,即使是抗原本身,由于蛋白解/酶活性,也会损害huRBL细胞。我们通常使用 MTT(3-(4,5-二甲基硫醇-2-yl)-2,5-迪普尼特拉佐利姆溴化物的细胞生存能力检测来评估潜在的细胞毒性效应。检测可以很容易地执行与细胞超纳特被收集和转移后留下的 huRBL 细胞(参见协议的第 6.3 步)。与其他免疫化学方法(如 ELISA 和西式印迹)相比,用于确定基于过敏原-IgE 结合的单个过敏原或复杂提取物的过敏潜力,此检测不仅可以检测 IgE 与过敏原的结合,还可以测量人类 IgE 和过敏原的功能,从而引发以 IgE 介质的巴索菲尔脱粒18。因此,它可以帮助研究过敏症状的严重程度前体内使用患者的塞拉。据报道,检测比传统的被动皮肤过敏测试更一致和有效,因为检测使用RBL-2H3细胞,这是相对容易处理和产生较少的变异性的结果相比,原发性细胞,如桅杆细胞或人类嗜血杆菌19,20。除此之外,检测还很好地表现了过敏原的生物活性,并能准确估计给定复杂样本3中的总过敏原含量。有关协议中的某些步骤的故障排除,请参阅表 1。
关于这种版本的调解人释放分析的适用性,它主要用于研究目的,但也用于基于其生物活性的过敏提取物的标准化。这包括分析不同批次的SPT溶液、挑衅测试溶液以及用于过敏原特异性免疫治疗的提取物:如花粉,猫皮屑,家尘虫,花生提取物,以及蜜蜂毒液3,17,21。该技术可以特别应用于诊断食物过敏,因为它可以检测到甚至最少量的过敏成分在复杂的食品,如花生,牛奶,小麦和鸡蛋22。在这方面,也已报告作为评估动物食物过敏原体,如肌霉素的过敏性的宝贵工具,并可以帮助区分强效过敏原和非过敏原23。作为一种研究工具,该检测用于研究食品加工的影响,以及评估配体结合对过敏原的影响及其对过敏性的影响24,25。例如,Bet v 1 与配体的结合表明不会影响过敏原-IgE 的交叉连接,尽管它导致其热和蛋白解稳定性增加 25。检测可用于比较患者的反应与轻微和主要过敏原,以及调查过敏原同源和同形体的交叉反应,如我们使用Bet v 1和同源食物过敏原Cor a 1(图3)的例子所示。关于过敏原同源体,介导器释放检测用于确定主要过敏原安布1.01作为最有力的IgE反应同位素在抹布花粉(安布罗西亚青苔花粉)。相比之下,另外两种被鉴定的同质体在抹布花粉提取物中,Amb a 1.02和Amb a1.03,显示对患者的IgE26反应减少。
近年来,该检测已应用于研究潜在的抗过敏化合物和新型过敏原低过敏变异,有助于确定适合过敏原特异性免疫治疗的候选者27,28。另一种新方法是使用检测来监测过敏原特异性免疫治疗过程中的治疗效果。在这方面,我们的研究小组开发了一个huRBL检测抑制系统,它与患者在过敏原特异性免疫治疗29期间症状评分的降低密切相关。研究还建议进行检测,以研究TGF+1对过敏原诱发的IgE介导脱粒30的免疫抑制作用。
检测的局限性是,即使 huRBL 细胞具有桅杆细胞或嗜血杆菌的某些特征,它们也不会完全模仿这些效应细胞的自然功能。例如,桅杆细胞广泛表达模式识别受体收费样受体4(TLR4),这是病原体识别所必需的,而RBL-2H3细胞31则完全不足。由于功能上的差异,检测没有完全模拟现实情况,在解释数据时需要牢记这一点。此外,由于huRBL细胞是癌性嗜血细胞,培养条件的变化和长期培养可能导致表型差异导致不同实验室的结果改变20。另一个方面是过敏原浓度的选择,在适应这种方法时必须考虑,因为高过敏原浓度可能导致非IgE介质去粒,由于存在大量的蛋白酶或内毒素18。其他限制是依赖具有相对较高的特定IgE水平(RAST类5-6)的人体血色素,以及细胞培养系统的需要,这仍然是一个需要克服的障碍,以便在日常临床常规中实施该技术。
除了这些限制外,huRBL检测是诊断和治疗过敏性疾病的宝贵研究工具,可用于广泛的应用。
披露声明
作者没有什么可透露的。
致谢
作者要感谢德国兰根分子过敏学系的斯特凡·维斯博士提供人性化/FcéRI转染的RBL细胞,并同意撰写本研究方法论文。我们要感谢法蒂玛·费雷拉教授提供出色的反馈。我们还要感谢罗纳德·范里教授和阿姆斯特丹大学医学中心实验免疫学系的贾普·阿克达斯博士, 荷兰阿姆斯特丹,因为同意公布本方法文件中提供的代表性数据,这些数据是在 BM4SIT 项目过程中生成的 - 过敏创新(www.BM4SIT.eu 作者的工作得到了奥地利科学基金(P32189项目)、萨尔茨堡大学优先项目过敏-癌症-比奥纳诺研究中心、奥地利科学基金资助的癌症免疫和过敏-ICA博士项目以及欧洲联盟第七框架方案FP7的BM4SIT项目(赠款编号601763)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4-Methylumbelliferyl N-acetyl-β-D-glucosaminide | Sigma | M2133 | |
| 96-well plate for huRBL cells (Nunc MicroWell 96-Well, Nunclon Delta-treated, flat-bottom microplate) | ThermoFisher Scientific | 167008 | |
| 96-well plate for substrate solution and cell supernatant (Greiner Bio-One non-treated 96-well microplates) | Fisher Scientific | 655101 | |
| Bovine serum albumin (BSA) | Sigma | 10735078001 | |
| Citric acid | Applichem | 131018 | |
| Dulbecco's phosphate-buffered saline (DPBS without calcium and magnesium) | Sigma | D8537 | |
| G418 | Sigma | A1720 | |
| Glycine | Applichem | A3707 | |
| Heat-inactivated fetal calf/bovine serum (FCSi) | Sigma | F0804 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Minimum Essential Medium Eagle with Alpha Modification, with ribonucleosides, deoxyribonucleosides and sodium bicarbonate, without L-glutamine, liquid, sterile-filtered, suitable for cell culture | Sigma | M8042 | |
| Opti-MEM reduced serum medium, GlutaMAX supplement | Gibco/ThermoFisher Scientific | 51985034 | |
| Penicillin-Streptomycin (10K units Pen. 10 mg/mL Strep.) | Sigma | P4333 | |
| Sodium chloride (NaCl) | Applichem | A2942 | |
| Sodium hydrogen carbonate (NaHCO3) | Applichem | 131638 | |
| Triton X-100 | Sigma | X100 | |
| Trypsin-EDTA | Sigma | 59418C | |
| Tyrode’s salt | Sigma | T2145 |
参考文献
- Curin, M., et al. Next-generation of allergen-specific immunotherapies: molecular approaches. Current Allergy and Asthma Reports. 18 (7), 39(2018).
- Okamoto-Uchida, Y., et al. Different results of IgE binding- and crosslinking-Based allergy tests caused by allergen immobilization. Biological and Pharmaceutical Bulletin. 39 (10), 1662-1666 (2016).
- Vogel, L., Lüttkopf, D., Hatahet, L., Haustein, D., Vieths, S. Development of a functional in vitro assay as a novel tool for the standardization of allergen extracts in the human system. Allergy. 60 (8), 1021-1028 (2005).
- Ocmant, A., et al. Basophil activation tests for the diagnosis of food allergy in children. Clinical and Experimental Allergy. 39 (8), 1234-1245 (2009).
- Platts-Mills, T. A. The role of immunoglobulin E in allergy and asthma. American Journal of Respiratory and Critical Care Medicine. 164 (8), Pt 2 1-5 (2001).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693-704 (2012).
- Lawrence, M. G., et al. Half-life of IgE in serum and skin: Consequences for anti-IgE therapy in patients with allergic disease. The Journal of Allergy and Clinical Immunology. 139 (2), 422-428 (2017).
- Draber, P., Halova, I., Polakovicova, I., Kawakami, T. Signal transduction and chemotaxis in mast cells. European Journal of Pharmacology. 778, 11-23 (2016).
- Peebles, R. S. Prostaglandins in asthma and allergic diseases. Pharmacology & Therapeutics. 193, 1-19 (2019).
- Cyphert, J. M., et al. Allergic inflammation induces a persistent mechanistic switch in thromboxane-mediated airway constriction in the mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (1), 140-151 (2012).
- Méndez-Enríquez, E., Hallgren, J. Mast cells and their progenitors in allergic asthma. Frontiers Immunology. 10, 821(2019).
- Demoly, P., Lebel, B., Arnoux, B. Allergen-induced mediator release tests. Allergy. 58 (7), 553-558 (2003).
- Yamaga, S., et al. Decreased intracellular histamine concentration and basophil activation in anaphylaxis. Allergology International. 69 (1), 78-83 (2020).
- Huang, L., et al. A rapid and sensitive assay based on particle analysis for cell degranulation detection in basophils and mast cells. Pharmacological Research. 111, 374-383 (2016).
- González-Pérez, R., Poza-Guedes, P., Barrios Del Pino, Y., Matheu, V., Sánchez-Machín, I. Evaluation of major mite allergens from European standardized commercial extracts for in vivo diagnosis: addressing the need for precision medicine. Clinical and Translational Allergy. 9, 14(2019).
- Focke, M., Marth, K., Valenta, R. Molecular composition and biological activity of commercial birch pollen allergen extracts. European Journal of Clinical Investigation. 39 (5), 429-436 (2009).
- Hoffmann, A., Vieths, S., Haustein, D. Biologic allergen assay for in vivo test allergens with an in vitro model of the murine type I reaction. The Journal of Allergy and Clinical Immunology. 99 (2), 227-232 (1997).
- Sun, N., Zhou, C., Zhou, X., Sun, L., Che, H. Use of a rat basophil leukemia (RBL) cell-based immunological assay for allergen identification, clinical diagnosis of allergy, and identification of anti-allergy agents for use in immunotherapy. Journal of Immunotoxicology. 12 (2), 199-205 (2015).
- Kaul, S., Hoffmann, A. Mediator release assay of rat basophil leukemia cells as alternative for passive cutaneous anaphylaxis testing (PCA) in laboratory animals. Altex. 18 (1), 55-58 (2001).
- Passante, E., Frankish, N. The RBL-2H3 cell line: its provenance and suitability as a model for the mast cell. Inflammation Research. 58 (11), 737-745 (2009).
- Kaul, S., et al. Mediator release assays based on human or murine immunoglobulin E in allergen standardization. Clinical and Experimental Allergy. 37 (1), 141-150 (2007).
- Huang, J., et al. Application of in vitro and in vivo models in the study of food allergy. Food Science and Human Wellness. 7 (4), 235-243 (2018).
- Klueber, J., et al. Homologous tropomyosins from vertebrate and invertebrate: Recombinant calibrator proteins in functional biological assays for tropomyosin allergenicity assessment of novel animal foods. Clinical and Experimental Allergy. 50 (1), 105-116 (2020).
- Zhang, T., et al. Different thermal processing effects on peanut allergenicity. Journal of the Science of Food and Agriculture. 99 (5), 2321-2328 (2019).
- Soh, W. T., et al. Multiple roles of Bet v 1 ligands in allergen stabilization and modulation of endosomal protease activity. Allergy. 74 (12), 2382-2393 (2019).
- Wolf, M., et al. Amb a 1 isoforms: Unequal siblings with distinct immunological features. Allergy. 72 (12), 1874-1882 (2017).
- Eichhorn, S., et al. Rational design, structure-activity relationship, and immunogenicity of hypoallergenic Pru p 3 variants. Molecular Nutrition & Food Research. 63 (18), 1900336(2019).
- Abd Rani, N. Z., et al. Mechanistic studies of the antiallergic activity of phyllanthus amarus Schum. and Thonn. and its compounds. Molecules. 26 (3), (2021).
- Huber, S., et al. Does clinical outcome of birch pollen immunotherapy relate to induction of blocking antibodies preventing IgE from allergen binding? A pilot study monitoring responses during first year of AIT. Clinical and Translational Allergy. 8 (1), 39(2018).
- Araujo, G. R., et al. TGFβ1 mimetic peptide modulates immune response to grass pollen allergens in mice. Allergy. 75 (4), 882-891 (2020).
- Passante, E., Frankish, N. Deficiencies in elements involved in TLR4-receptor signalling in RBL-2H3 cells. Inflammation Research. 59, Suppl 2 185-186 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。