Method Article
Humanized Mediator Release Assay als Ausleser für Allergenpotenz
In diesem Artikel
Zusammenfassung
Hier stellen wir den Mediator-Release-Assay vor, bei dem eine basophile Leukämiezelllinie der Ratte verwendet wird, die mit dem menschlichen IgE-Rezeptor transfiziert ist, um die Degranulation von Effektorzellen zu simulieren, die typischerweise bei allergischen Reaktionen vom Typ 1 beobachtet wird. Diese Methode untersucht die biologische Aktivität von Allergenen hochempfindlich, reproduzierbar und passgenannt.
Zusammenfassung
Mediator-Release-Assays analysieren die in vitro Immunglobulin E (IgE)-vermittelte Degranulation und Sekretion von Mediatoren durch Effektorzellen wie Mastzellen und Basophile nach Stimulation mit seriellen Verdünnungen von mutmaßlichen Allergenen. Daher stellen diese Assays ein wesentliches Werkzeug dar, das den In-vivo-Degranulationsprozess nachahmt, der bei Allergenexposition bei sensibilisierten Patienten oder bei Hautpricktests auftritt. Darüber hinaus werden diese Assays in der Regel verwendet, um das allergene Potenzial von Proteinen und die Reaktivität der Serenreaktivität der Patienten zu untersuchen. Hierin beschreiben wir ein einfaches 2-Tage-Protokoll unter Verwendung einer immortalisierten basophilen Leukämie-Zelllinie der Ratte, die mit dem humanen hochaffinen IgE-Plasmamembranrezeptor (FcεRI) transfiziert und humanisiert wurde. Diese Variante des Mediatorfreisetzungsassays ist ein robustes, empfindliches und reproduzierbares zellbasiertes In-vitro-System, ohne dass das Antigen zu festen Matrizen immobilisiert werden muss. Das Protokoll besteht aus den folgenden Schritten: (1) Komplementinaktivierung menschlicher Seren, (2) Ernte, Aussaat und passive Sensibilisierung der Zellen, (3) Stimulation mit Antigen, um eine Mediatorfreisetzung zu verursachen, und (4) Messung der β-Hexosaminidase-Aktivität als Ersatz für die freigesetzten Entzündungsmediatoren wie Histamin. Der Assay stellt ein nützliches Werkzeug dar, um die Fähigkeit der Allergen-IgE-Vernetzung zur Auslösung der Zelldegranulation zu bewerten und kann implementiert werden, um Allergenextrakte zu standardisieren, die Reaktivität der Patienten mit kleineren oder großen Allergenen und mit allergenen Extrakten (Pollen, Katzenhaare usw.) zu vergleichen, die Wirksamkeit von Allergenhomologen, Isoformen und Faltenvarianten (z. B. Hypoallergenität) sowie die Auswirkungen von Liganden auf die allergene Aktivität zu untersuchen. Eine neuere Anwendung umfasst die Verwendung des Assays zur Überwachung der Behandlungswirksamkeit im Verlauf der Allergenimmuntherapie.
Einleitung
Typ-I-Überempfindlichkeitsreaktionen, gekennzeichnet durch die produktion von Immunglobulin E (IgE), die für ein entsprechendes Antigen spezifisch sind, betreffen fast ein Drittel der Weltbevölkerung. Diese Reaktionen sind mit mehreren allergischen Manifestationen wie Asthma und Rhinokonjunktivitis verbunden und können sogar zu systemischen lebensbedrohlichen Reaktionen führen1. Im Gegensatz zu In-vivo-Tests eignen sich immunchemische Ansätze wie der Enzyme-Linked Immunosorbent Assay (ELISA) ausschließlich zur Untersuchung der Zielbindung von Antikörpern, adressieren jedoch nicht den funktionellen Aspekt von Proteinen, die sofortige Überempfindlichkeitsreaktionen hervorrufen können. Die Immobilisierung der Allergene auf festen Trägern (z.B. ELISA-Platten) könnte zu Veränderungen ihrer strukturellen Integrität und zur Zerstörung allergierelevanter Epitope führen2. Auch Hautpricktests (SPT), das gebräuchlichste Instrument zur Bestätigung der Sensibilisierung gegen bestimmte Allergene, haben ihre Grenzen hinsichtlich des Nachweises symptomatischer IgE-vermittelter Nahrungsmittelallergien oder Allergenverfügbarkeit3,4. Um eine ethische, hochspezifische, empfindliche und kostengünstige Methode zur Prüfung der biologischen Potenz von Allergenen zu finden, um eine Typ-I-Überempfindlichkeitsreaktion auszulösen, wurden die sogenannten Mediator-Freisetzungsassays etabliert.
Das Prinzip dieser Assays beruht auf Ereignissen nach der Sensibilisierungsphase und der damit einhergehenden Fähigkeit von IgE, an die α Kette der hochaffinen Rezeptoren zu binden, die auf der Oberfläche von Effektorzellen wie Mastzellen und Basophilen exprimiert werden. IgE wird hauptsächlich von Plasmazellen im schleimhaut-assoziierten lymphatischen Gewebe produziert. Obwohl es das am wenigsten vorkommende Immunglobulin (etwa 0,05% bei nicht-atopischen Personen) im Blut ist, besitzt es eine außergewöhnlich hohe biologische Aktivität, die die Hauptursache für allergische Symptome ist. Die Halbwertszeit von IgE kann von 2-3 Tagen auf mehrere Wochen und sogar Monate ansteigen, wenn es an seine Rezeptoren auf Effektorzellen gebunden ist. Die anschließende Bindung eines Antigens an die variable Region zweier rezeptorgebundener IgE-Moleküle führt zu deren Vernetzung, gefolgt von der Induktion einer nachgeschalteten Signalkaskade in der Effektorzelle, die zur Degranulation und Freisetzung mehrerer entzündungsfördernder Mediatoren führt, die eine Vasodilatation verursachen, wie Histamin, Serinproteasen (z. B. Tryptase) und Prostaglandine5,6,7. Die Sekretion von Zytokinen wie Interleukin 4 (IL-4) und IL-13 sind verantwortlich für die Aufrechterhaltung der entzündlichen T-Helfer-2 (Th2)-Reaktion und den Klassenwechsel von B-Zellen zu IgE-produzierenden Plasmazellen5,8,9. Auf der anderen Seite verursacht freigesetztes Thromboxan Bronchokonstriktion, und Leukotriene stimulieren die Kontraktion der glatten Muskulatur sowie Gefäßleckagen und spielen eine entscheidende Rolle bei Atemwegsentzündungen, die zu Asthma oder allergischer Rhinitis führen10,11.
Forschungswerkzeuge zur Analyse der meisten der oben genannten Mediatoren wurden etabliert, wenn auch mit einigen großen Nachteilen. Tryptase-Assays sind geeignete klinische Ansätze zur Messung der systemischen Anaphylaxie durch Mastzellaktivierung, aber ihre Sensitivität und Spezifität bei Allergiediagnosen ist im Vergleich zu Goldstandardmethoden wie SPT zu ungenau. Auf der anderen Seite sind Cysteinylleukotrien-Assays nicht in der Lage, Allergien gegen β-Lactame oder nichtsteroidale entzündungshemmende Medikamente zu diagnostizieren12. Protokolle zur Messung von Histamin als Hauptmediator bei allergischen Reaktionen wurden bereits in den 1960er Jahren etabliert. Einmal im peripheren Blut freigesetzt, wird Histamin sofort durch Histaminmethyltransferasen abgebaut, was zu einer Plasmahalbwertszeit von nur wenigen Minuten führt, was seine Analyse ziemlich schwierig macht13. Abgesehen von seiner Instabilität zeigte sich, dass die Überwachung von Histamin eine geringe Spezifität und Empfindlichkeit für Arzneimittelallergien sowie kommerzielle Lebensmittelproteine und Waspengifteaufweist 12.
In-vitro-Modelle mit Effektorzelllinien wurden als Alternative zu den arbeitsintensiven Verfahren der Isolierung und Kultivierung von Basophilen von Allergischen eingeführt, um Freisetzungstests durchzuführen. Daher wurde der auf Basukämie (RBL) basierende Test der Ratte unter Verwendung der RBL-2H3-Zelllinie etabliert3. Da diese Zelllinie nicht in der Lage ist, menschliches IgE zu binden, wurde sie zunächst mit der α-, β- und γ-Kette des humanen IgE-Plasmamembranrezeptors (FcεRI) transfiziert. Mehrere Klone wurden generiert und auf Expressionsniveaus und Homogenität der menschlichen α-Kette getestet, von denen sich der Klon RBL-30/25 als vielversprechendster Kandidat für In-vitro-Tests herausstellte. Die Signalkaskade, die bei der Rezeptoraktivierung des transfizierten Klons induziert wurde, wurde mittels Calciummobilisierungsassays getestet. Als Indikator für Degranulation und Surrogat für die Histaminfreisetzung wurde das lysosomale Enzym β-Hexosaminidase gemessen, das den signifikanten Vorteil einer höheren Stabilität hat14. Die Mediatorfreisetzung unter Verwendung von RBL-30/25-Zellen erreicht bis zu 100% und wird daher verwendet, um Seren von allergischen Patienten zu testen. Der Assay wurde auf die Mediatorfreisetzung getestet, nachdem sensibilisierte Zellen mit kommerziellen Allergenextrakten herausgefordert wurden. Dies führte zu der Feststellung, dass es eine enorme Variation in der Zusammensetzung (bis zu 60-fach hinsichtlich des Gesamtproteingehalts) von Allergenextrakten gibt, die von verschiedenen Herstellern stammen und für diagnostische (z. B. SPT) oder therapeutische Ansätze verwendet werden3,15,16.
Hier finden Sie eine detaillierte Beschreibung des RBL-Protokolls zur Durchführung des Mediator-Release-Assays mit Serum von allergischen Spendern. Während der passiven Sensibilisierung wird IgE im Serum durch den fcεR1-Rezeptor mit hoher Affinität eingefangen, der auf der Oberfläche der basophilen Zellen exprimiert wird. Bei der Antigenstimulation werden gebundene IgEs, die für das Antigen spezifisch sind, vernetzt, was die Zelldegranulation und die Freisetzung des Mediators β-Hexosaminidase auslöst. Die Aktivität der β-Hexosaminidase wird anschließend mit einem geeigneten Substrat gemessen. Für den Assay wurden huRBL-2H3-Zellen verwendet, die im folgenden Protokoll als huRBL bezeichnet wurden. Das Protokoll beschreibt eine Standard-Antigenverdünnungsreihe mit 8 Schritten, die 1:10 verdünnt werden und von 1 μg/ ml bis 0,1 pg/ml Allergen reichen.
Protokoll
Die ethische Zulassung zur Verwendung von Seren, die von Birkenpollenargikern abgeleitet wurden, wurde von der niederländischen Ethikkommission erhalten (Zulassungsnummer: NL65758.018.18).
1. Sicherheitsverfahren
- Arbeiten unter sterilen Bedingungen mit einer Werkbank der biologischen Sicherheitsklasse 2 am ersten Tag des Experiments (Biosafety Level 2). Befolgen Sie die Sicherheitsrichtlinien der Einrichtung für die Verwendung von humanem Serum.
2. Komplementinaktivierung menschlicher Seren
- Aus dem Zellkulturkolben wird eine dichte Kultur von P3X63Ag8.653-Zellen (fortan Ag8-Zellen genannt) entnommen und in ein Zentrifugationsröhrchen überführen.
- Verwenden Sie für diese Zellen das folgende Kulturmedium: Modified Eagles's Minimum Essential Medium mit reduzierter Serumkonzentration, 1% Penicillin-Streptomycin (100 Einheiten Pen., 0,1 mg/ml Streptokokken), 5% hitzeinaktiviertes fetales Kalbs-/Rinderserum (FCSi).
- Zentrifuge Ag8 Zellen für 5 min bei 250 x g bei Raumtemperatur.
- Suspendieren Sie das Zellpellet wieder auf eine Endkonzentration von ca. 1 x 106 Zellen/ml in huRBL Medium (Minimum Essential Medium Eagle mit Alpha Modifikation, 4 mM L-Glutamin, 5% FCSi, 1% G418 (100% Vorrat: 10 g/125 ml dH2O).
HINWEIS: Pflegen Sie Ag8-Zellen, indem Sie auch für die zukünftige Verwendung passagieren. - Humane Seren 1:10 in Ag8-Zellsuspension verdünnen. Die endgültige Serumverdünnung im Assay wird 1:20 sein.
HINWEIS: Für Seren mit niedrigem spezifischem IgE kann eine 1:5 (1:10 Endverdünnung) verwendet werden. - 1 h bei 37 °C und 5%-7%CO2 inkubieren.
3. Ernte und Aussaat von huRBL-Zellen
- Das Medium aus einem T-75-Zellkulturkolben vorsichtig absaugen, ohne die huRBL-Zellen zu berühren (huRBL-Zellen sind adhärent). Stellen Sie sicher, dass die Zellen zu etwa 50% bis 90% konfluent sind.
HINWEIS: Je nach Zellkonfluenz reicht der Zellgehalt eines dichten T-75-Zellkulturkolbens in der Regel für ein bis zwei 96-Well-Platten aus. - Waschen Sie die Zellen zweimal, indem Sie 10 ml Dulbeccos phosphatgepufferte Kochsalzlösung (DPBS) hinzufügen. Fügen Sie DPBS auf der gegenüberliegenden Seite des Kolbens und nicht direkt auf die Zellen hinzu.
- Saugen Sie DPBS an und fügen Sie 5 ml vorgewärmtes 1x Trypsin-EDTA (0,05% / 0,02% EDTA in DPBS verdünnt) zur Zellablösung hinzu.
- Den Kolben 5 min bei 37 °C inkubieren.
- Entfernen Sie die Zellen, indem Sie vorsichtig auf den Kolben tippen.
- Die Zellsuspension wird in ein 15-ml-Zentrifugationsröhrchen gegeben und mit huRBL-Medium oder DPBS aufgefüllt, um das Trypsin-EDTA zu verdünnen.
- Zentrifugieren Sie die Zellen bei 250 x g für 5 min bei Raumtemperatur.
- Saugen Sie den Überstand an und resuspendieren Sie das Pellet in 5 ml huRBL-Medium für die Zellzählung.
- Zählen Sie die Zellen und verdünnen Sie sie in huRBL-Medium, um eine Endkonzentration von 2 x 106 Zellen / ml zu erhalten.
- Verwenden Sie eine sterile 96-Well-Platte und fügen Sie 50 μL huRBL-Zellsuspension pro Vertiefung hinzu, was 1 x 105 Zellen / Well entspricht.
4. Passive Sensibilisierung von huRBL-Zellen
- Zentrifugieren Sie die vorinkubierte Ag8/Serum-Suspension für 5 min bei 250 x g.
- 50 μL der zentrifugierten Ag8/Serum-Suspension werden in jede Vertiefung, die huRBL-Zellen enthält, übertragen, ohne das Ag8-Zellpellet zu stören.
- Schließen Sie die No-Antigen-Kontrolle ein, die sensibilisiert sind, aber nicht restimulierte Zellen (fügen Sie kein Antigen hinzu), die als Hinweis für das untere Signalplateau / -hintergrund dienen. Hintergrund- und maximale Lysekontrollbrunnen müssen nicht mit Serum sensibilisiert werden. Fügen Sie stattdessen 50 μL huRBL-Medium hinzu, um die Bohrstücke zu kontrollieren.
- Die Platte mit dem Deckel abdecken und über Nacht bei 37 °C und 5%-7%CO2inkubieren.
5. Antigenstimulierte Degranulation und Mediatorfreisetzung
- Bereiten Sie die Antigenverdünnung in 1x Tyrode-Puffer (9,5 g/L Tyrode-Salze, 0,1% Rinderserumalbumin (BSA), 0,5 g/L Natriumhydrogencarbonat(NaHCO3)in dH2O) im Voraus vor. Eine Endmenge von 100 μL pro Vertiefung wird benötigt.
HINWEIS: Nicht jedes Allergen, das entweder aus natürlichen Quellen gereinigt oder rekombinant produziert wird, kann im Puffer von 1x Tyrode stabil sein. Führen Sie daher vor dem Assay-Verfahren Stabilitätstests in 1x Tyrodes Puffer durch. Alternativ können Sie den 1-fachen Tyrode-Puffer in Deuteriumoxid(D2O) verdünnen, um das Signal-Rausch-Verhältnis des Assays zu erhöhen. - Machen Sie 8 Verdünnungen des interessierenden Antigens einer 1:10-Verdünnungsreihe in Reaktionsröhrchen, beginnend mit entweder 10 oder 1 μg / ml Protein.
HINWEIS: Testen Sie die Verdünnungsreihe immer vorher. Alternativ können Sie die Verdünnungsreihe 1:10 (z. B. 1:5, 1:20 oder 1:30) anpassen, um die vollständige Freisetzungskurve abzudecken. Zudem kann die Ausgangskonzentration je nach Versuchsaufbau variieren. - Um huRBL-Zellen, die auf der 96-Well-Platte plattiert sind, zu waschen, entfernen Sie zuerst das serenhaltige Zellmedium, indem Sie die Platte vorsichtig absaugen, invertieren und auf saugfähigem Papier klopfen.
- Waschzellen mit 200 μL 1x Tyrodes Puffer pro Vertiefung. Behandeln Sie alle Brunnen ähnlich.
HINWEIS: Geben Sie die Waschlösung langsam in die Zellen, um sie nicht zu stören. - Lassen Sie es ca. 30 s ein und wiederholen Sie den Waschschritt insgesamt dreimal.
- Nachdem Sie die Waschlösung zum letzten Mal hinzugefügt haben, lassen Sie die Lösung in den Vertiefungen, bis Sie mit der Zugabe der Antigenverdünnung fortfahren können.
HINWEIS: Vermeiden Sie es, Zellen zu lange der Luft auszusetzen. - 100 μL Antigenlösung werden in jede Vertiefung, die die vorsensibilisierten huRBL-Zellen enthält, übertragen.
HINWEIS: Wenn Sie mehrere verschiedene Parameter analysieren, übertragen Sie die einzelnen Proben der Verdünnungsserie in eine zusätzliche unverbindliche 96-Well-Platte (verwenden Sie das gleiche Layout wie auf der huRBL-Platte) und übertragen Sie sie anschließend mit einer Mehrkanalpipette direkt auf die huRBL-Zellplatte. Auf diese Weise kann vermieden werden, dass die Zellen zu lange der Luft ausgesetzt werden, was zu einer schlechten Assay-Leistung führen kann (niedrigeres/kein Signal). - Decken Sie Kontrollbrunnen (maximale Lyse und nicht sensibilisierte Hintergrundzellen) mit 100 μL 1x Tyrode-Puffer ab. Stimulieren Sie diese Kontrollbrunnen nicht mit dem Antigen.
- Zusätzlich werden 100 μL 1x Tyrode-Puffer zu den sensibilisierten No-Antigen-Wells der Verdünnungsreihe hinzugefügt, was benötigt wird, um die antigenunabhängige spontane Freisetzung sensibilisierter Zellen bei der Datenanalyse zu berücksichtigen.
- Inkubieren Sie huRBL-Zellen für 1 h bei 37 °C und 5%-7% CO2.
6. Fluoreszenzmessung der β-Hexosaminidase-Aktivität
- Behandeln Sie die Vertiefungen der maximalen Lysekontrolle mit 10 μL 10% Triton X-100 pro Vertiefung und mischen Sie richtig, um die Zellen vollständig zu lysieren und die 100% ige Freisetzung von β-Hexosaminidase zu erhalten.
- Fügen Sie 50 μL Substratlösung in eine neue unverbindliche 96-Well-Platte ein. Substratlösung für eine 96-Well-Platte: 5 ml 0,1 M Zitronen-Assay-Puffer, pH 4,5; und 80 μL 10 mM 4-Methylumbelliferyl N-Acetyl-β-D-Glucosaminid.
- 50 μL Zellüberstand aller Vertiefungen auf die neue Platte, die die Substratlösung enthält, übertragen.
HINWEIS: Pipetten Sie den Überstand vorsichtig von der huRBL-Platte, um die huRBL-Zellen nicht zu stören. - Inkubieren Sie die Platte mit Substratlösung und Zellüberstand für 1 h bei 37 °C, um die Umwandlung des fluorogenen Substrats zu ermöglichen.
HINWEIS: Bewahren Sie die huRBL-Platte für den Zelllebensfähigkeitstest auf. - 100 μL Stopplösung (15 g/L Glycin, 11,7 g/L NaCl gelöst in dH2O, pH 10,7) pro Vertiefung hinzufügen.
- Messen Sie die Fluoreszenz bei 360 nm Anregung und 465 nm Emission mit einem Plattenleser.
7. Datenanalyse
- Für grundlegende Berechnungen der prozentualen Freigabe verwenden Sie eine beliebige Tabellenkalkulationssoftware.
- Für die Hintergrundsubtraktion/Baseline-Entfernung subtrahieren Sie den Durchschnitt der Hintergrundbohrungen von allen anderen Vertiefungen.
- Berechnen Sie den Mittelwert der maximalen Lysebohrungen und drücken Sie die Daten der Verdünnungsreihe in Prozent aus. Auf diese Weise kann man Daten als Prozentsatz der Zellfreisetzung normalisiert auf die maximale Enzymfreisetzung durch Zelllyse ausdrücken.
- Vollständige Dosis-Wirkungs-Mediator-Freisetzungskurven werden am besten als XY-Graphen mit der Antigenkonzentration auf einem Log auf der X-Achse und dem Prozentsatz der Mediatorfreisetzung auf der Y-Achse dargestellt.
- Fügen Sie die Werte der No-Antigen-Kontrolle als gestrichelte Linie hinzu, um den Hintergrund oder das untere Plateau anzugeben.
HINWEIS: Mehrere ähnlich behandelte Seren können mit dieser Normalisierungsstrategie verglichen werden. Für den direkten Vergleich wird weiterhin empfohlen, die halbmaximale Freisetzung zu berechnen, d. h. die Antigenkonzentration (in ng / ml), die für die halbe maximale Freisetzung erforderlich ist, definiert als Durchschnitt der maximalen und minimalen Werte pro Kurve. Die Antigenkonzentration zur Stimulierung der halbmaximalen Freisetzung wird durch Interpolation des halbmaximalen Freisetzungswertes in eine logarithmische Regressionslinie berechnet.
Ergebnisse
Der Mediatorfreisetzungstest, basierend auf huRBL-Zellen (Abbildung 1A und B), ergibt eine glockenförmige Dosis-Wirkungs-Kurve ( Abbildung1C). Zur vereinfachten Datendarstellung kann die für die halbmaximale Mediatorfreisetzung notwendige Antigenkonzentration mittels linearer Regression berechnet werden (Abbildung 1D). Ein Zelllebensfähigkeitstest wird durchgeführt, um zytotoxische Wirkungen auszuschließen, die entweder aus dem sensibilisierenden Serum oder dem zur Stimulation verwendeten Antigen stammen (Abbildung 1E). Der Assay kann verwendet werden, um die Reaktivität verschiedener Seren auf ein bestimmtes Antigen zu testen. In unserem Fall sprachen 4 von 5 Seren, die von Birkenpollenargikern stammen, auf die Bet v 1-Stimulation an. Serum #1 zeigte die höchste Mediatorfreisetzung (Abbildung 2). Serum #5 reagierte nicht auf die Bet v 1 Stimulation und könnte daher auf andere Birkenpollenallergene reagieren (z.B. Bet v 2, Profilin). Diese Daten deuten darauf hin, dass Bet v 1 ein starkes Allergen ist, das für IgE-vermittelte allergische Symptome verantwortlich ist. Mit dem huRBL-Assay kann die Kreuzreaktivität von IgE gegenüber homologen Allergenen beurteilt werden (Abbildung 3). Hier sprachen beide Birkenpollenargiker gut auf Bet v 1 an, während nur Patient #2 auch auf Cor a 1, das Bet v 1-homologe Nahrungsmittelallergen in Haselnüssen, anspricht. Basierend auf diesen Daten hat Patient Nr. 2 höchstwahrscheinlich höhere Cor a 1-Kreuz-reaktive IgE-Spiegel als Patient Nr. 1, was zu oralen Allergiesymptomen beim Haselnusskonsum führt. Auch die Beurteilung der hypoallergenen Natur mutierter Varianten von Allergenen (verminderte Potenz) kann analysiert und mit ihrem Wildtyp-Gegenstück verglichen werden (Abbildung 4). Im angegebenen Beispiel verschob sich die Freisetzungskurve der Faltenvariante in Richtung einer höheren Antigenkonzentration im Vergleich zum Wildtypallergen, was zu einer signifikant höheren Antigenkonzentration führte, die notwendig war, um eine halbe maximale Freisetzung zu provozieren (Abbildung 4B). Diese Daten deuten darauf hin, dass die erzeugte Mutanten-/Faltenvariante im Vergleich zum Wildtypprotein weniger allergen ist. Diese reduzierte Potenz zur Auslösung einer IgE-vermittelten Degranulation unterstreicht den hypoallergenen Charakter der Faltenvariante. Basierend auf diesem Assay ist die Faltungsvariante ein interessanter Kandidat für eine allergenspezifische Immuntherapie, da sie während der Behandlung reduzierte IgE-assoziierte Nebenwirkungen verursachen kann.
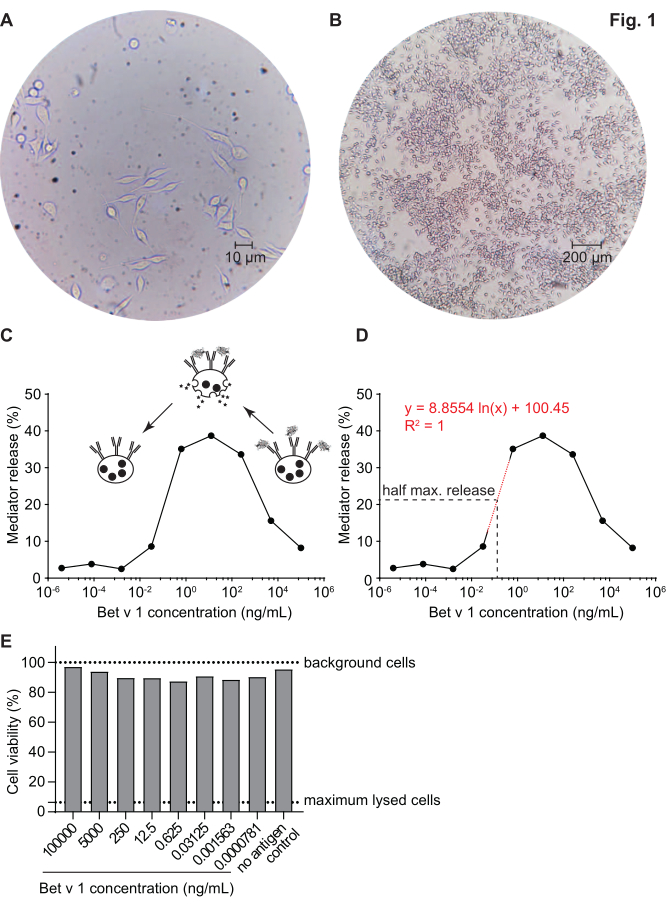
Abbildung 1: Humanisierte RBL-Zellen und eine repräsentative glockenförmige Kurve der IgE-Allergen-Vernetzungs-induzierten β-Hexosaminidase-Freisetzung. RBL-Zellen haften an den Kulturkolben, was ihnen eine stabartige Form verleiht, wenn sie versuchen, sich selbst zu befestigen (A). Ein idealer Konfluenzgrad für die zu ernteenden Zellen beträgt nicht mehr als 90% (B). Zellen werden unter einer Vergrößerung von 40x bzw. 10x angezeigt. Zellen, die mit humanem Serum eines Birkenpollenargikers sensibilisiert wurden, reagierten auf Herausforderung mit rekombinantem Bet v 1 (rBet v 1), dem wichtigsten Birkenpollenallergen (C). Als Ersatz für die Mediatorfreisetzung wird die β-Hexosaminidase-Aktivität in Zellüberständen gemessen. Die glockenförmige Kurve resultiert aus einer monovalenten Besetzung von Antigenepitopen auf IgE aufgrund des Allergenüberschusses, der die Allergen-IgE-Vernetzung bei hohen Antigenkonzentrationen kompetitiv hemmt. Eine weitere Erklärung für die geringe Freisetzung bei hohen Allergenkonzentrationen ist die Hemmung intrazellulärer Signalwege in Gegenwart von überschüssigem Antigen. Zur Bestimmung der Allergenkonzentration, die notwendig ist, um eine halbe maximale Freisetzung zu erhalten, wurde eine logarithmische Regressionslinie basierend auf den experimentellen Werten verwendet, die den linearen Teil der Steigung der Mediatorfreisetzungskurve darstellen (D). Die rot gepunktete Linie stellt die logarithmische Regressionslinie dar, die für die Berechnung verwendet wird. Die Formel der Regressionslinie ist rot dargestellt. Die halbe maximale Freigabe ist definiert als: halbe maximale Freigabe = (minimaler Freigabewert + maximaler Freigabewert)/2. Im Beispiel betrug die berechnete halbe maximale Freisetzung 20,6%. Das repräsentative menschliche Serum, das in diesem Experiment verwendet wurde, wurde 1:20 für die Inkubation mit huRBL-Zellen verdünnt, und die für die Stimulation verwendete Antigenkonzentration reichte von 100 μg / ml bis 0,004 pg / ml von Bet v 1. Mit den verbleibenden Zellen wurde nach Antigenstimulation ein Zelllebensfähigkeitstest, in diesem Fall ein MTT-Assay durchgeführt, um den Einfluss des sensibilisierenden Serums sowie der Antigenverdünnung auf die Zelllebensfähigkeit und Zellzahl zu beurteilen (E). Unbehandelte Hintergrundzellen und lysierte Zellen (Maximallyse) werden als gepunktete Linie dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
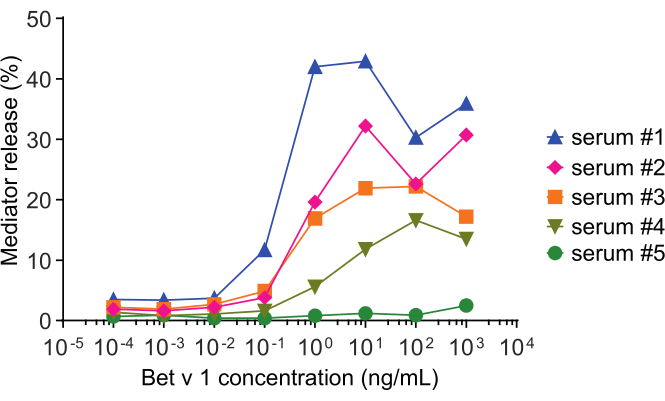
Abbildung 2: Repräsentative Kurven der β-Hexosaminidase-prozentualen Freisetzung von fünf verschiedenen menschlichen Seren. Der gleiche Antigenkonzentrationsbereich von rBet v 1 wurde mit huRBL-Zellen inkubiert, die mit Seren verschiedener Birkenpollen sensibilisierter Personen sensibilisiert wurden. Es gibt einen deutlichen Unterschied der prozentualen Freisetzung zwischen den verschiedenen Patienten, der der Schwere ihrer Symptome entspricht. Beachten Sie, dass Patient #5 nicht auf das Hauptpollenallergen Bet v 1 reaktiv ist. Alle fünf menschlichen Seren, die zur Gewinnung dieser Mediatorfreisetzungskurven verwendet wurden, wurden für die Inkubation mit huRBL-Zellen gleichmäßig 1:20 verdünnt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
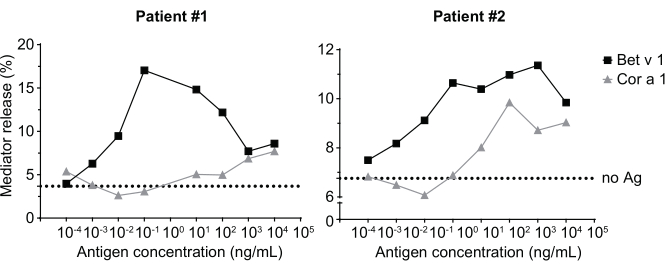
Abbildung 3: Kreuzreaktivität von IgE aus Seren von Birkenpollen sensibilisierten Patienten mit dem homologen Haselnussallergen Bet v 1 Cor a 1. Zwei repräsentative Seren von Patienten, die auf Birkenpollen sensibilisiert sind, reagieren stark auf Bet v 1 sowie in geringerem Maße auf das homologe Allergen Cor a 1. Patient 2 zeigt eine signifikante Reaktion auf Cor a 1 und wird daher wahrscheinlich orale Allergiesymptome beim Haselnusskonsum zeigen, verglichen mit Patient 1, bei dem die Mediatorfreisetzung fast vernachlässigbar ist. Die gepunktete Linie stellt die No-Antigen-Kontrolle dar, das sind Zellen, die mit den menschlichen Seren sensibilisiert, aber nicht mit einem Allergen stimuliert werden, und dient somit als Hinweis auf das untere Signalplateau/-hintergrund. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
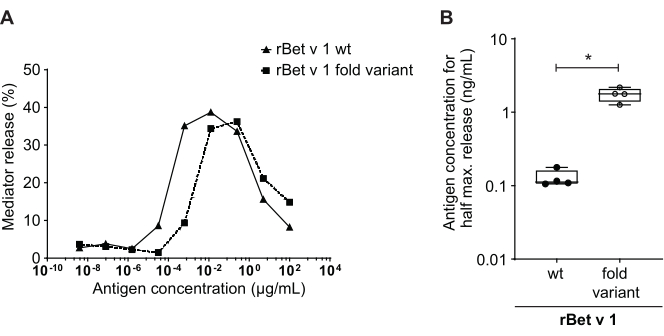
Abbildung 4: Vergleich der prozentualen Freisetzung zwischen rBet v 1 Wildtyp und einer hypoallergenen Faltvariante. Das gleiche Serum eines Birkenpollen-sensibilisierten Individuums wurde mit rBet v 1 Wildtyp (wt) und einer hypoallergenen Faltvariante des Hauptpollenallergens birken (A) inkubiert. Obwohl die Mediatorfreisetzung in beiden Antigenen beobachtet wird, gibt es eine deutliche Verschiebung in Richtung höherer Antigenkonzentrationen, wenn man die Faltvariante mit dem Wildtyp rBet v 1 für die gleiche prozentuale Freisetzung vergleicht. Eine Standardmethode zum Vergleich der Differenz in der prozentualen Freisetzung verschiedener Antigene ist die Berechnung der Antigenkonzentration, die erforderlich ist, um die halbe maximale Freisetzung zu erreichen (B). Dies wird normalerweise in biologischen Replikaten durchgeführt (Test des gleichen Antigenbereichs für jedes Allergen in verschiedenen menschlichen Seren). Um signifikante Schlussfolgerungen zu ziehen, wird die Mediatorfreisetzung in der Regel mit Seren von mindestens 8 bis 10 verschiedenen Patienten durchgeführt. Hier werden die Ergebnisse von vier verschiedenen Seren als Beispiel dargestellt. Für die statistische Analyse wurde ein gepaarter t-Testverwendet. *p ≤ 0,05; **p ≤ 0,01; p ≤ 0,001; s ≤ 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Mögliche Fragen und Fehlerbehebung | Lösung |
| Assay-zu-Assay-Variabilität aufgrund veränderter Zellreaktionsfähigkeit | Stellen Sie sicher, dass die Anzahl der Zelldurchgänge 20 bis 30 Passagen nicht überschreitet. Machen Sie gefrorene Bestände an frühen Passagen für zukünftige Experimente. |
| Setzen Sie eher auf biologische Replikate (Verwendung verschiedener Seren) als auf technische. | |
| Sera enthält geringe Konzentrationen an spezifischem IgE | Anstelle von 1:20 kann eine niedrigere abschließende Serumverdünnung (d. h. 1:10) verwendet werden. Umgekehrt können Seren, die einen hohen Gehalt an spezifischem IgE enthalten, weiter verdünnt werden (1:30 oder 1:40). |
| Nicht genügend Zellen, um den Assay durchzuführen | Stellen Sie sicher, dass die Konfluenz in einem T-75-Kolben etwa 50-90% beträgt. Durchgang mehr Flaschen. |
| Zytotoxische Wirkungen von Seren, z. B. durch unvollständige Komplementinaktivierung | Führen Sie zusätzlich zum Mediatorfreisetzungstest einen Zelllebensfähigkeitstest durch. Erhöhen Sie die Ag8-Konzentration, um eine unvollständige Komplementinaktivierung zu vermeiden. |
| Niedriges Signal | Verbessern Sie das Signal-Rausch-Verhältnis des Assays, indem Sie den 1x Tyrode-Puffer in Deuteriumoxid(D2O) anstelle vondH2O verdünnen oder eine Ser mit höheren Konzentrationen an spezifischem IgE für das interessierende Allergen verwenden. |
| Allergen ist im Tyrode-Puffer nicht stabil (z. B. Niederschlag) | Führen Sie vor dem Assay-Verfahren Stabilitätstests im 1x Tyrode-Puffer durch. Die Substitution des Tyrode-Puffers wird nicht empfohlen. |
| Probleme beim Finden der richtigen Ausgangskonzentration für das jeweilige Allergen | Anpassung der Verdünnungsreihe zur Abdeckung der vollständigen Freisetzungskurve (mehr Verdünnungsschritte, 1:20 Verdünnung statt 1:10). |
| Schlechte Assay-Leistung durch niedriges/kein Signal angezeigt | Vermeiden Sie zytotoxische Wirkungen durch Seren- oder Antigenstimulation (z. B. enzymatische Allergene). Waschen und tränken Sie die Zellen sorgfältig. Vermeiden Sie eine zu lange Exposition gegenüber Luft und verhindern Sie, dass Zellen austrocknen. |
| Woher weiß ich, ob das untere Signalplateau erreicht ist? | Fügen Sie Ihrem Teller "kein Antigen" -Steuerelemente hinzu. Dabei handelt es sich um sensibilisierte Zellen, die nur mit 1x Tyrodes Puffer, aber ohne Allergen stimuliert wurden. |
| Benötige ich zusätzlich zu den maximalen Lysebrunnen eine Positivkontrolle? | Als zusätzliche Positivkontrolle kann eine Serum- und Antigenkombination verwendet werden, von der bekannt ist, dass sie eine Degranulation verursacht, oder ein Anti-FcεR1-Antikörper. |
| Wie viele Brunnen brauche ich? | Das hängt von Ihrer Titrationsreihe, der Anzahl der Antigene und Seren ab, die Sie analysieren möchten. Planen Sie das Layout für die 96-Well-Platten entsprechend der Zahl der Seren/ Antigene, die Sie testen möchten. Vergessen Sie nicht, die "No Antigen Controls", die Hintergrundzellen (nicht sensibilisiert, nicht stimuliert) sowie die maximalen Lysebrunnen hinzuzufügen. |
| Wie viele Seren sollte ich testen? Und brauche ich Replikate? | Obwohl der Assay recht robust ist, gibt es aufgrund der veränderten Zellreaktionsfähigkeit eine gewisse Assay-zu-Assay-Variabilität. Daher empfiehlt es sich, sich eher auf biologische Replikate (mit unterschiedlichen Seren) als auf technische Replikate zu verlassen. Mindestens acht verschiedene Seren reichen aus, um Allergene zu analysieren. Wie in Abb. 4B gezeigt, können jedoch bereits mit weniger Seren signifikante Ergebnisse erzielt werden. |
Tabelle 1: Problembehandlung.
Diskussion
Der hier beschriebene huRBL zellbasierte Mediatorfreisetzungsassay ist eine robuste Methode, die in jedem Labor leicht durchgeführt und implementiert werden kann. Die einzige Voraussetzung ist, dass Zellen unter sterilen Bedingungen kultiviert werden müssen. Der Assay wird verwendet, um die Wahrscheinlichkeit zu bewerten, dass ein Allergen oder eine allergene Quelle die IgE-Vernetzung und basophile Degranulation der Patienten hervorruft17. Der Assay kann leicht an jedes Allergen oder jede allergene Quelle angepasst werden, solange das Serum des Patienten mit einem hohen Gehalt an spezifischem IgE, das das interessierende Allergen erkennt, verfügbar ist. Es wird empfohlen, zusätzlich zum Mediatorfreisetzungstest einen Zelllebensfähigkeitstest durchzuführen, um mögliche zytotoxische Wirkungen zu berücksichtigen, die zu einer schlechten Assay-Leistung führen könnten. Dies könnte auf eine unvollständige Komplementinaktivierung der Seren oder andere zytotoxische Wirkungen aus dem Serum zurückzuführen sein. Sogar das Antigen selbst kann beispielsweise aufgrund proteolytischer/enzymatischer Aktivität die huRBL-Zellen schädigen. Wir verwenden normalerweise einen Zelllebensfähigkeitstest mit MTT (3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazoliumbromid), um mögliche zytotoxische Wirkungen zu bewerten. Der Assay kann leicht mit den huRBL-Zellen durchgeführt werden, die nach der Entnahme und Übertragung des Zellüberstands übrig geblieben sind (siehe Schritt 6.3. des Protokolls). Im Vergleich zu anderen immunchemischen Methoden wie ELISAs und Western Blotting zur Bestimmung des allergenen Potenzials einzelner Allergene oder komplexer Extrakte auf der Grundlage der Allergen-IgE-Bindung kann dieser Assay nicht nur die Bindung von IgE an ein Allergen nachweisen, sondern auch die Funktionalität sowohl des menschlichen IgE als auch des Allergens messen, um eine IgE-vermittelte basophile Degranulation zu provozieren18. So kann es helfen, die Schwere allergischer Symptome ex vivo mit Patientenseren zu untersuchen. Es wird berichtet, dass der Assay konsistenter und effizienter ist als die klassischen passiven kutanen Anaphylaxie-Tests, da der Assay die RBL-2H3-Zellen verwendet, die relativ einfach zu handhaben sind und im Vergleich zu Primärzellen wie Mastzellen oder menschlichen Basophilen eine geringere Variabilität der Ergebnisse erzeugen19,20. Darüber hinaus liefert der Assay eine gute Darstellung der biologischen Aktivität von Allergenen und kann den Gesamtallergengehalt in einer gegebenen komplexen Probe genau abschätzen3. Informationen zur Fehlerbehebung bei bestimmten Schritten im Protokoll finden Sie in Tabelle 1.
Was die Anwendbarkeit dieser Version des Mediator-Freisetzungstests betrifft, so wurde sie hauptsächlich für Forschungszwecke, aber auch für die Standardisierung allergener Extrakte aufgrund ihrer biologischen Aktivität verwendet. Dazu gehört die Analyse verschiedener Chargen von SPT-Lösungen, Provokationstestlösungen sowie Extrakten, die für die allergenspezifische Immuntherapie verwendet werden; wie gezeigt für Pollen, Katzenhaare, Hausstaubmilben und Erdnussextrakte sowie Bienengift3,17,21. Die Technik kann insbesondere bei der Diagnose von Nahrungsmittelallergien angewendet werden, da sie selbst minimale Mengen an allergenen Bestandteilen in komplexen Lebensmitteln wie Erdnüssen, Milch, Weizen und Eiern nachweisen kann22. In dieser Hinsicht wurde es auch als wertvolles Instrument zur Beurteilung der Allergenität von Tierfutterallergenen wie Tropomyosinen berichtet und kann bei der Unterscheidung potenter Allergene von Nichtallergenenhelfen 23. Als Forschungsinstrument wird der Assay verwendet, um die Auswirkungen der Lebensmittelverarbeitung zu untersuchen sowie den Einfluss der Ligandenbindung an Allergene und ihre Wirkung auf die Allergenität zu bewerten24,25. Zum Beispiel wurde gezeigt, dass die Bindung von Bet v 1 an Liganden die Allergen-IgE-Vernetzung nicht beeinflusst, obwohl sie eine Erhöhung ihrer thermischen und proteolytischen Stabilität verursachte25. Der Assay kann verwendet werden, um die Reaktivität des Patienten auf kleinere und größere Allergene zu vergleichen sowie die Kreuzreaktivität von Allergenhomologen und Isoformen zu untersuchen, wie in unserem Beispiel mit Bet v 1 und dem homologen Lebensmittelallergen Cor a 1 gezeigt (Abbildung 3). In Bezug auf Allergenisoformen wurde der Mediatorfreisetzungsassay verwendet, um das Hauptallergen Amb a 1,01 als die stärkste IgE-reaktive Isoform in Ambrosiapollen (Ambrosia artemisiifolia) zu identifizieren. Im Vergleich dazu zeigten die beiden anderen identifizierten Isoformen in Ambrosia-Pollenextrakten, Amb a 1,02 und Amb a 1,03, eine reduzierte Reaktivität auf das IgE26der Patienten.
In den letzten Jahren wurde der Assay zur Untersuchung potenzieller antiallergischer Verbindungen und neuartiger hypoallergener Varianten von Allergenen eingesetzt, was bei der Identifizierung geeigneter Kandidaten für eine allergenspezifische Immuntherapie27,28hilft. Ein weiterer neuartiger Ansatz ist die Überwachung der Behandlungswirksamkeit im Zuge einer allergenspezifischen Immuntherapie mit dem Assay. In diesem Zusammenhang entwickelte unsere Forschungsgruppe ein huRBL-Assay-Inhibitionssystem, das gut mit der Verringerung des Symptomscores des Patienten während der allergenspezifischen Immuntherapie korrelierte29. Der Assay wurde auch vorgeschlagen, um die immunsuppressiven Wirkungen von TGFβ1 auf allergeninduzierte IgE-vermittelte Degranulation zu untersuchen30.
Die Einschränkungen des Assays bestehen darin, dass die huRBL-Zellen zwar einige Merkmale von Mastzellen oder Basophilen besitzen, aber die natürliche Funktion dieser Effektorzellen nicht vollständig nachahmen. Zum Beispiel exprimieren Mastzellen weitgehend den Mustererkennungsrezeptor Toll-like Receptor 4 (TLR4), der für die Erkennung von Krankheitserregern notwendig ist, während er in den RBL-2H3-Zellen31völlig mangelhaft ist. Aufgrund dieses Unterschieds in der Funktionalität ahmt der Assay die reale Situation nicht vollständig nach, was bei der Interpretation der Daten berücksichtigt werden muss. Da es sich bei den huRBL-Zellen um krebsartige basophile Zellen handelt, können Veränderungen der Kulturbedingungen und eine längere Kultivierung zu phänotypischen Unterschieden führen, die zu veränderten Ergebnissen zwischen verschiedenen Labors führen20. Ein weiterer Aspekt ist die Wahl der Allergenkonzentration, die bei der Anpassung dieser Methode berücksichtigt werden muss, da hohe Allergenkonzentrationen aufgrund des Vorhandenseins hoher Mengen an Proteasen oder Endotoxinen zu einer nicht-IgE-vermittelten Degranulation führen können18. Weitere Einschränkungen sind die Abhängigkeit von menschlichen Seren mit relativ hohen spezifischen IgE-Spiegeln (RAST-Klasse 5-6) und der Bedarf an Zellkultursystemen, der nach wie vor ein Hindernis ist, das überwunden werden muss, um die Technik im klinischen Alltag zu implementieren.
Abgesehen von diesen Einschränkungen stellt der huRBL-Assay ein wertvolles Forschungsinstrument für die Diagnose und Behandlung allergischer Erkrankungen dar und kann in einer Vielzahl von Anwendungen eingesetzt werden.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken Prof. Dr. Stefan Vieths von der Abteilung Molekulare Allergologie, Paul-Ehrlich-Institut, Langen, Deutschland, für die Bereitstellung der humanisierten/FcεRI-transfizierten RBL-Zellen und für seine Zustimmung zur Verfassen dieser Forschungsmethodikarbeit. Wir danken Prof. Dr. Fatima Ferreira für ihr hervorragendes Feedback. Wir danken prof. Dr. Ronald van Ree und Dr. Jaap Akkerdaas vom Department of Experimental Immunology, Amsterdam University Medical Centers, Standort AMC, Amsterdam, Niederlande, für ihre Zustimmung zur Veröffentlichung repräsentativer Daten in diesem Methodenpapier, die im Rahmen des Projekts BM4SIT - innovations for allergy (www.BM4SIT.eu) generiert wurden.Die Arbeit der Autorinnen und Autoren wurde unterstützt durch den Österreichischen Wissenschaftsfonds (Projekt P32189), durch das Schwerpunktprogramm Allergie-Krebs-BioNano Forschungszentrum der Universität Salzburg, durch das vom Wissenschaftsfonds geförderte Promotionsprogramm Immunität bei Krebs und Allergie-ICA (FWF W01213) und durch das BM4SIT-Projekt (Förderkennzeichen 601763) aus dem Siebten Rahmenprogramm FP7 der Europäischen Union.
Materialien
| Name | Company | Catalog Number | Comments |
| 4-Methylumbelliferyl N-acetyl-β-D-glucosaminide | Sigma | M2133 | |
| 96-well plate for huRBL cells (Nunc MicroWell 96-Well, Nunclon Delta-treated, flat-bottom microplate) | ThermoFisher Scientific | 167008 | |
| 96-well plate for substrate solution and cell supernatant (Greiner Bio-One non-treated 96-well microplates) | Fisher Scientific | 655101 | |
| Bovine serum albumin (BSA) | Sigma | 10735078001 | |
| Citric acid | Applichem | 131018 | |
| Dulbecco's phosphate-buffered saline (DPBS without calcium and magnesium) | Sigma | D8537 | |
| G418 | Sigma | A1720 | |
| Glycine | Applichem | A3707 | |
| Heat-inactivated fetal calf/bovine serum (FCSi) | Sigma | F0804 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Minimum Essential Medium Eagle with Alpha Modification, with ribonucleosides, deoxyribonucleosides and sodium bicarbonate, without L-glutamine, liquid, sterile-filtered, suitable for cell culture | Sigma | M8042 | |
| Opti-MEM reduced serum medium, GlutaMAX supplement | Gibco/ThermoFisher Scientific | 51985034 | |
| Penicillin-Streptomycin (10K units Pen. 10 mg/mL Strep.) | Sigma | P4333 | |
| Sodium chloride (NaCl) | Applichem | A2942 | |
| Sodium hydrogen carbonate (NaHCO3) | Applichem | 131638 | |
| Triton X-100 | Sigma | X100 | |
| Trypsin-EDTA | Sigma | 59418C | |
| Tyrode’s salt | Sigma | T2145 |
Referenzen
- Curin, M., et al. Next-generation of allergen-specific immunotherapies: molecular approaches. Current Allergy and Asthma Reports. 18 (7), 39(2018).
- Okamoto-Uchida, Y., et al. Different results of IgE binding- and crosslinking-Based allergy tests caused by allergen immobilization. Biological and Pharmaceutical Bulletin. 39 (10), 1662-1666 (2016).
- Vogel, L., Lüttkopf, D., Hatahet, L., Haustein, D., Vieths, S. Development of a functional in vitro assay as a novel tool for the standardization of allergen extracts in the human system. Allergy. 60 (8), 1021-1028 (2005).
- Ocmant, A., et al. Basophil activation tests for the diagnosis of food allergy in children. Clinical and Experimental Allergy. 39 (8), 1234-1245 (2009).
- Platts-Mills, T. A. The role of immunoglobulin E in allergy and asthma. American Journal of Respiratory and Critical Care Medicine. 164 (8), Pt 2 1-5 (2001).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693-704 (2012).
- Lawrence, M. G., et al. Half-life of IgE in serum and skin: Consequences for anti-IgE therapy in patients with allergic disease. The Journal of Allergy and Clinical Immunology. 139 (2), 422-428 (2017).
- Draber, P., Halova, I., Polakovicova, I., Kawakami, T. Signal transduction and chemotaxis in mast cells. European Journal of Pharmacology. 778, 11-23 (2016).
- Peebles, R. S. Prostaglandins in asthma and allergic diseases. Pharmacology & Therapeutics. 193, 1-19 (2019).
- Cyphert, J. M., et al. Allergic inflammation induces a persistent mechanistic switch in thromboxane-mediated airway constriction in the mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (1), 140-151 (2012).
- Méndez-Enríquez, E., Hallgren, J. Mast cells and their progenitors in allergic asthma. Frontiers Immunology. 10, 821(2019).
- Demoly, P., Lebel, B., Arnoux, B. Allergen-induced mediator release tests. Allergy. 58 (7), 553-558 (2003).
- Yamaga, S., et al. Decreased intracellular histamine concentration and basophil activation in anaphylaxis. Allergology International. 69 (1), 78-83 (2020).
- Huang, L., et al. A rapid and sensitive assay based on particle analysis for cell degranulation detection in basophils and mast cells. Pharmacological Research. 111, 374-383 (2016).
- González-Pérez, R., Poza-Guedes, P., Barrios Del Pino, Y., Matheu, V., Sánchez-Machín, I. Evaluation of major mite allergens from European standardized commercial extracts for in vivo diagnosis: addressing the need for precision medicine. Clinical and Translational Allergy. 9, 14(2019).
- Focke, M., Marth, K., Valenta, R. Molecular composition and biological activity of commercial birch pollen allergen extracts. European Journal of Clinical Investigation. 39 (5), 429-436 (2009).
- Hoffmann, A., Vieths, S., Haustein, D. Biologic allergen assay for in vivo test allergens with an in vitro model of the murine type I reaction. The Journal of Allergy and Clinical Immunology. 99 (2), 227-232 (1997).
- Sun, N., Zhou, C., Zhou, X., Sun, L., Che, H. Use of a rat basophil leukemia (RBL) cell-based immunological assay for allergen identification, clinical diagnosis of allergy, and identification of anti-allergy agents for use in immunotherapy. Journal of Immunotoxicology. 12 (2), 199-205 (2015).
- Kaul, S., Hoffmann, A. Mediator release assay of rat basophil leukemia cells as alternative for passive cutaneous anaphylaxis testing (PCA) in laboratory animals. Altex. 18 (1), 55-58 (2001).
- Passante, E., Frankish, N. The RBL-2H3 cell line: its provenance and suitability as a model for the mast cell. Inflammation Research. 58 (11), 737-745 (2009).
- Kaul, S., et al. Mediator release assays based on human or murine immunoglobulin E in allergen standardization. Clinical and Experimental Allergy. 37 (1), 141-150 (2007).
- Huang, J., et al. Application of in vitro and in vivo models in the study of food allergy. Food Science and Human Wellness. 7 (4), 235-243 (2018).
- Klueber, J., et al. Homologous tropomyosins from vertebrate and invertebrate: Recombinant calibrator proteins in functional biological assays for tropomyosin allergenicity assessment of novel animal foods. Clinical and Experimental Allergy. 50 (1), 105-116 (2020).
- Zhang, T., et al. Different thermal processing effects on peanut allergenicity. Journal of the Science of Food and Agriculture. 99 (5), 2321-2328 (2019).
- Soh, W. T., et al. Multiple roles of Bet v 1 ligands in allergen stabilization and modulation of endosomal protease activity. Allergy. 74 (12), 2382-2393 (2019).
- Wolf, M., et al. Amb a 1 isoforms: Unequal siblings with distinct immunological features. Allergy. 72 (12), 1874-1882 (2017).
- Eichhorn, S., et al. Rational design, structure-activity relationship, and immunogenicity of hypoallergenic Pru p 3 variants. Molecular Nutrition & Food Research. 63 (18), 1900336(2019).
- Abd Rani, N. Z., et al. Mechanistic studies of the antiallergic activity of phyllanthus amarus Schum. and Thonn. and its compounds. Molecules. 26 (3), (2021).
- Huber, S., et al. Does clinical outcome of birch pollen immunotherapy relate to induction of blocking antibodies preventing IgE from allergen binding? A pilot study monitoring responses during first year of AIT. Clinical and Translational Allergy. 8 (1), 39(2018).
- Araujo, G. R., et al. TGFβ1 mimetic peptide modulates immune response to grass pollen allergens in mice. Allergy. 75 (4), 882-891 (2020).
- Passante, E., Frankish, N. Deficiencies in elements involved in TLR4-receptor signalling in RBL-2H3 cells. Inflammation Research. 59, Suppl 2 185-186 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten