需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
开放式协作学习中的脑间同步:fNIRS超扫描研究
摘要
概述了在自然学习环境中对协作学习二元组进行fNIRS超扫描实验的方案。此外,还提出了一种分析含氧血红蛋白(Oxy-Hb)信号的脑间同步(IBS)的管道。
摘要
fNIRS超扫描被广泛用于检测社会互动的神经生物学基础。通过这种技术,研究人员用一种称为脑间同步(IBS)的新指数(即,神经元或血液动力学信号随时间变化的相位和/或振幅对齐)来限定两个或多个交互式个体的并行大脑活动。本文介绍了在自然学习环境中对协作学习二元组进行fNIRS超扫描实验的协议。此外,还解释了分析含氧血红蛋白(Oxy-Hb)信号的IBS的管道。具体而言,讨论了实验设计、近红外光谱数据记录过程、数据分析方法以及未来的发展方向。总体而言,实施标准化的fNIRS超扫描管道是第二人称神经科学的基本组成部分。此外,这符合开放科学的呼吁,以帮助研究的可重复性。
引言
最近,为了揭示交互式二元组或组成员的并行大脑活动,研究人员采用了超扫描方法1,2。具体而言,脑电图(EEG),功能磁共振成像(fMRI)和功能性近红外光谱(fNIRS)用于同时记录两个或多个受试者的神经和大脑活动3,4,5。研究人员基于这种技术提取了需要同时进行脑耦合的神经指数,该技术指的是脑间同步(IBS)(即神经元或血液动力学信号随时间变化的相位和/或振幅对齐)。各种各样的超扫描研究发现,在多个人(例如,玩家 - 观众,教师 - 学习者和领导者 - 追随者)之间的社交互动期间,IBS 6,7,8。此外,IBS具有有效学习和教学的具体含义9,10,11,12,13,14。随着自然学习场景中超扫描研究的激增,建立超扫描实验的标准协议和该领域数据分析的管道是必要的。
因此,本文提供了一种用于对协作学习二元组进行基于fNIRS的超扫描的方案,以及用于分析IBS的管道。fNIRS是一种光学成像工具,它辐射近红外光来间接评估血红蛋白的光谱吸收,然后测量血流动力学/氧合活性15,16,17。与fMRI相比,fNIRS不易出现运动伪影,允许来自正在进行现实生活实验(例如,模仿,说话和非语言交流)的受试者的测量18,7,19。与脑电图相比,fNIRS具有更高的空间分辨率,使研究人员能够检测大脑活动的位置20。因此,fNIRS在空间分辨率、逻辑和可行性方面的这些优势使fNIRS能够进行超扫描测量1。使用这项技术,一个新兴的研究机构检测到一个索引项作为IBS - 两个(或更多)人的大脑活动的神经对齐 - 在不同形式的自然主义社会环境中9,10,11,12,13,14。在这些研究中,应用了各种方法(即相关性分析和小波变换相干性(WTC)分析)来计算该指数;同时,这种分析的标准管道是必要的,但缺乏。因此,在这项工作中提出了一种用于进行基于fNIRS的超扫描的协议以及使用WTC分析来识别IBS的管道。
本研究旨在使用fNIRS超扫描技术评估协作学习二元组中的IBS。首先,在协作学习任务期间,在每个二元组的前额叶和左颞顶区域同时记录血流动力学反应。这些地区已被确定为与互动教学和学习相关的9,10,11,12,13,14。其次,在每个相应的通道上计算IBS。fNIRS数据记录过程由两部分组成:静止状态会话和协作会话。静息状态持续5分钟,在此期间,两个参与者(面对面坐着,彼此分开,在一张桌子(0.8米)旁)需要保持静止和放松。此静息状态会话用作基线。然后,在协作会话中,参与者被告知一起学习整个学习材料,引发理解,总结规则,并确保掌握所有学习材料。这里介绍了进行实验和fNIRS数据分析的具体步骤。
研究方案
所有招募的参与者(40对偶,平均年龄22.1±1.2岁;100%右撇子;正常或矫正到正常视力)都是健康的。在实验之前,参与者给予了知情同意。参与者因其参与而获得经济补偿。该研究获得华东师范大学人类研究保护委员会(HR-0053-2021)的批准。
1. 采用数据前的准备步骤
- 自制近红外瓶盖
- 采用弹性泳帽放置光电支架网格。
注意:考虑到参与者的头部尺寸不同,使用两种尺寸的帽子。为头围为55.4±1.1厘米的参与者准备了小帽,为头围为57.9±1.2厘米的参与者准备了大帽。 - 根据弹性游泳帽上的标准国际10-10系统,将脑电电极(inion,Cz,T3,T4,Fpz和P5)的位置锚定为参考光子(见 材料表)。
- 首先,将标准的10-10脑电图帽(见材料表)放在头部模具上,并将弹性游泳帽放在脑电图帽上。其次,在每个盖子上用粉笔标记参考光极(inion,Cz,T3,T4,Fpz和P5)。最后,切下两个直径约15毫米的孔以放置两个参考光极(即Fpz和P5,图1)。
注意:具体而言,3 x 5光电极管探头组和4 x 4光电极管探头组分别放置在前额叶区域(参考光端放置在Fpz, 图1B)和左侧颞顶区域(参考光端放置在P5, 图1B)上。
- 首先,将标准的10-10脑电图帽(见材料表)放在头部模具上,并将弹性游泳帽放在脑电图帽上。其次,在每个盖子上用粉笔标记参考光极(inion,Cz,T3,T4,Fpz和P5)。最后,切下两个直径约15毫米的孔以放置两个参考光极(即Fpz和P5,图1)。
- 切孔以放置其他光电元件。将带有两个网格支架的游泳帽直接放在头部模具上。然后,用粉笔标记其他光斑的位置。之后,切开其余孔以确保网格支架适合。
- 将两个探头组(即3 x 5和4 x 4)安装到泳帽上(见 材料表)。
注:NIRS测量系统(见 材料表)提供了这些标准探头组(即3 x 5和4 x 4),带有标准支架插座,确保30 mm光极分离。 - 打开 NIRS 测量系统的探头组监控窗口,为每个人分别选择 3 x 5 和 4 x 4 的四个探头组。
注:两个电容的探头排列应与探头组窗口中的结构相对应(即接收器探头编号的确切位置和相应的发射器)。
- 采用弹性泳帽放置光电支架网格。
- 实验准备
- 在记录数据之前,请启动系统至少30分钟,确保NIRS系统保持稳定的工作温度。
注:稳定的工作温度范围为5°C至35°C。 - 将测量模式设置为与事件相关的测量。确保触发接收器处于活动状态(即RS232串行输入)。
注:该实验采用市售心理学软件编程(见 材料表)。近红外光(两种波长:695和830 nm)的吸收以10 Hz的采样率进行测量。 - 准备带照明的光纤探头,可用于将头发移到一边。
- 用一张桌子和两把椅子设置实验环境,以保持参与者的座位面对面。
- 在记录数据之前,请启动系统至少30分钟,确保NIRS系统保持稳定的工作温度。
2. 通过指导参与者来采用数据
- 准备参与者
- 指导参与者,包括NIRS测量方法的详细信息。
注:所有参与者都身体健康,并因参与而获得经济补偿。没有参与者在实验中途退出。NIRS的激光束可能对参与者的眼睛有害,他们被指示不要直接观察这些激光束。 - 让参与者面对面坐着(除了一张桌子(0.8米)),以确保他们可以直接看到对方。调整椅子到桌子的距离(即近0.3米),使参与者坐得舒适。
- 打开激光按钮,将带有探头组的盖子放在参与者的头上。
注:3 x 5探头组覆盖参与者的额头(底部行的中间探头放置在Fpz上);4 x 4探针组覆盖左颞顶皮层(第三行的第三个探针放置在P5上)。 - 将四根光纤束松散地放在支架的手臂上,不要与参与者或椅子接触。
注:此处,NIRS测量系统有四束光纤。此外,确保参与者不会感到太重而无法脱下帽子。 - 让探头尖端触摸参与者的头皮,小心地将每个弹簧负载探头进一步推入其插座。
- 执行信号校准。
- 首先,通过单击fNIRS机器的探头组监视器窗口中的 自动增益 来检查信号的质量。然后,通道的不良信号和足够信号分别在探头集监视器窗口中标记为黄色和绿色。
注意:对于信号不足的通道,使用发光的光纤探头将探头尖端下方的头发移动到一侧。 - 然后,将探头进一步推入其插座以获得足够的信号。重复此过程,直到在NIRS测量系统的探头组监控窗口中所有通道都标记为绿色,表明信号质量是可访问的。
- 首先,通过单击fNIRS机器的探头组监视器窗口中的 自动增益 来检查信号的质量。然后,通道的不良信号和足够信号分别在探头集监视器窗口中标记为黄色和绿色。
- 指导参与者,包括NIRS测量方法的详细信息。
- 运行实验
- 以 5 分钟的休息状态开始实验,该状态作为基线。然后,需要两名参与者共同学习学习材料。
- 实验结束后,单击" 文本文件输出 "以导出原始光强度数据,并将数据另存为文本文件。
注:NIRS测量系统中未应用滤光片。 - 使用三维(3D)数字化仪(见 材料表)确定每个参与者的发射器,接收器和其他参考(即inion,nasion,Cz以及左右耳)的位置。
- 使用市售数值计算平台21 获取记录通道的MNI坐标(参见 材料表)。 补充表S1 显示了每个通道的相应解剖位置。
- 用乙醇清洁探头和探头支架。用温和的洗涤剂清洗盖子,让盖子风干。
3. 数据分析
- 数据预处理
注意:以前的研究已经采用了可变的非商业软件包(例如,Homer222、分析红外23,或 NIRS LAB24) 与数值计算平台(请参见 材料表)上的fNIRS数据分析,它们都可以在网站上找到。这里,Homer2用于对NIRS数据进行预处理。此外,在其余阶段和协作学习阶段收集的 fNIRS 记录数据共享相同的预处理和分析管道。- 从 fNIRS 计算机复制数据集。将原始数据形成转换为正确的形成(即,将cvs文件转换为nirs文件)。
- 使用数值计算平台中提供的"hmrIntensity2OD"功能将原始数据转换为光密度(OD)数据(请参见 材料表)。
- 删除错误通道。然后分别对每个通道上每个参与者和完整采样点的OD值求平均值。
注:此处为46个平均OD值。- 计算每个参与者的标准偏差(SD)。
- 标记为不可用,并从每个参与者的分析中删除OD非常低或非常高(超过5 SD)的通道。
注意:此步骤可以在 fNIRS 数据预处理之前和/或之后执行。在此数据分析管道中,在对fNIRS数据进行预处理之前检测到不良通道。
- 将 OD 时间数据转换为 Oxy-Hb、DeOxy-Hb 和基于修改后的 Beer-Lambert 定律25的组合信号。
注:参考文献25说:"所有数据分析步骤都是在Oxy-Hb数据上进行的,Oxy-Hb数据是区域脑血流量变化的指标,具有更高的信噪比26。此外,以前的研究在教学和学习场景中使用了fNIRS超扫描,主要集中在Oxy-Hb浓度11,12,13,14上。 - 通过基于逐通道小波的方法从运动伪影中校准Oxy-Hb时间序列。
注:具体而言,采用调谐参数为0.1的Daubechies 5(db5)小波(详见Homer2手册)27,28用于消除运动伪影。 - 在校准的Oxy-Hb数据上施加带通滤波器(即0.01-1 Hz),以减少高频噪声和缓慢漂移。
- 对OxyHb信号进行主成分分析(PCA)以去除非神经全局成分(例如,血压,呼吸和血流量变化)29。
注:本文采纳了张及其同事提出的PCA分析29。- 首先,分解信号。
注:fNIRS信号分解的具体公式为:H = UΣ VT。在这里,fNIRS数据的时空模式以两个矩阵(即u和V)表示。U 是一个 2D(采样点 x 主成分)矩阵。V 也是一个 2D(主成分 x 主成分)矩阵。V 中的列表示一个主成分 (PC),该 PC 针对特定通道的强度在列的每个条目中估计。每台 PC 的相对重要性由对角矩阵 Σ 的值表示。 - 第二,进行空间平滑。
注:高斯核卷积用于去除局部信号并获取全局分量。 - 第三,重建信号。
注意:要计算 fNIRS 数据的全局分量,将平滑的空间模式矩阵V* 插入分解公式:H全局= UΣ(V*)T。然后,可以使用原始数据H减去HGlobal:H神经元=H - HGlobal来获得局部衍生的神经元信号。
- 首先,分解信号。
- 脑间同步
注:为了揭示第二人称神经科学中的脑耦合,这里采用了小波变换相干性(WTC)。简而言之,WTC测量两个时间序列之间的相关性作为频率和时间的函数。两次序列 x 和 y 的小波相干性的具体公式为: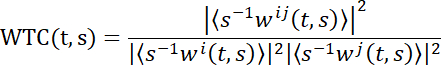
T 和 s 分别表示时间和小波尺度,‹·› 表示尺度和时间的平滑运算。W 表示连续小波变换。然后,生成一个2D(时间x频率)WTC矩阵30。多个工具箱用于计算 WTC 值。在这里,Grinsted及其同事创建的工具箱被使用了30。- 采用数值计算平台的WTC功能(见 材料表)。
注意:此处使用母小波的默认设置(即广义莫尔斯小波及其参数β和伽马)。母小波将每个时间序列转换为频域和时域。 - 设置其他参数的默认设置(即 MonteCarloCount,表示显著性计算中代理数据集的数量)。
- 在数值计算平台中计算两个相应通道(两个参与者的相同通道)的WTC值(请参见 材料表)。按照相同的程序,从46个通道生成46个WTC矩阵。
- 确定感兴趣的频带 (FOI),这对协作学习很敏感。
注意:这里,采用基于集群的排列方法来检测此类FOI31,这为多通道和多频率数据中的多重比较提供了解决方案。- 对于每个通道组合,分别在休息和协作学习阶段执行 WTC 值的时间平均值。然后,对这些时间平均的WTC值(协作学习与休息)进行配对的样本 t-检验以及整个频率(频率范围:0.01-1Hz 32)。接下来,确定任务效应显著的频率箱(协作学习>休息,p < 0.05)。
- 获取显著的频率相邻点 (≥2) 作为观测聚类和相应的 T 值。
- 对置换数据执行一系列配对样本 t检验,以生成步骤 3.2.4.2 中鉴定 1000 次的每个聚类的 T 值。
注意:为了形成置换数据,参与者被随机分配以形成新的双成员对。由于每个随机对的数据集的长度在二元组之间变化,因此较长的数据集将被修剪为与较短的数据集相同的长度33。 - 将原始对中基于聚类的基于聚类的平均值 T 值与 1000 个排列的 T 值进行比较。
注:由此公式34计算的 p 值: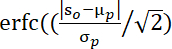 ,其中 S0 表示观测到的平均值聚类 t 值,μp 和 σp 表示排列值的平均值和标准差。
,其中 S0 表示观测到的平均值聚类 t 值,μp 和 σp 表示排列值的平均值和标准差。 - 每个二元组中每个通道中已识别的 FOI 中的平均 WTC 值。然后,将 fisher z 变换应用于 WTC 值,以获得 WTC 值的正态分布。使用此值可为 IBS 编制索引,以便进行进一步的统计分析。
- 采用数值计算平台的WTC功能(见 材料表)。
结果
图1所示为实验方案和探针位置。fNIRS数据记录过程由两部分组成:静息状态会话(5分钟)和协作会话(15-20分钟)。协作学习二元组需要放松并保持静止状态。之后,参与者被告知共同学习学习材料(图1A)。它们的前额叶和左颞顶区域被相应的探针组覆盖(图1B)。
图 2说明了 fNIRS 数据...
讨论
首先,在本协议中,阐述了在协作学习场景中进行fNIRS超扫描实验的具体步骤。其次,还介绍了评估协同学习二元组中血流动力学信号IBS的数据分析管道。进行fNIRS超扫描实验的详细操作将促进开放科学的发展。此外,这里提供了分析管道,以提高超扫描研究的再现性。在下文中,重点介绍了实验设计、进行实验、(fNIRS)超扫描实验中的数据分析等关键问题。此外,还讨论了当前限制的可能解决?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了华东师范大学优秀博士生学术创新促进计划(YBNLTS2019-025)和国家自然科学基金(31872783和71942001)的支持。
材料
| Name | Company | Catalog Number | Comments |
| EEG caps | Compumedics Neuroscan,Charlotte,USA | 64-channel Quik-Cap | We choose two sizes of cap(i.e.medium and large). |
| NIRS measurement system with probe sets and probe holder grids | Hitachi Medical Corporation, Tokyo, Japan | ETG-7100 Optical Topography System | The current study protocol requires an optional second adult probe set for 92 channels of measurement in total. |
| Numeric computing platform | The MathWorks, Inc., Natick, MA | MATLAB R2020a | Serves as base for Psychophysics Toolbox extensions (stimulus presentation), Homer2 (fNIRS preprocess analysis), and "wtc" function(WTC computation). |
| Psychology software | psychology software tools,Sharpsburg, PA,USA | E-prime 2.0 | We apply E-prime to start the fNIRS measurement system and send triggers which marking the rest phase and collaborative learning phase for fNIRS recording data. |
| Swimming caps | Zoke corporation,Shanghai,China | 611503314 | We first placed the standard 10-20 EEG cap on the head mold, and placed the swimming cap on the EEG cap. Second, we marked (inion, Cz, T3, T4, PFC and P5) with chalk. |
| Three-dimensional (3-D) digitizer | Polhemus, Colchester, VT, USA; | Three-dimensional (3-D) digitizer | Anatomical locations of optodes in relation to standard head landmarks were determined for each participant using a Patriot 3D Digitizer |
参考文献
- Babiloni, F., Astolfi, L. Social neuroscience and hyperscanning techniques: past, present and future. Neuroscience & Biobehavioral Reviews. 44, 76-93 (2014).
- Schilbach, L., et al. Toward a second-person neuroscience. Behavior Brain Science. 36, 393-414 (2013).
- Montague, P. Hyperscanning: simultaneous fMRI during linked social interactions. NeuroImage. 16, 1159-1164 (2002).
- Cui, X., Bryant, D. M., Reiss, A. L. NIRS-based hyperscanning reveals increased interpersonal coherence in superior frontal cortex during cooperation. NeuroImage. 59 (3), 2430-2437 (2012).
- Dikker, S., et al. Brain-to-brain synchrony tracks real-world dynamic group interactions in the classroom. Current Biology. 27 (9), 1375-1380 (2017).
- Abrams, D. A., et al. Inter-subject synchronization of brain responses during natural music listening. European Journal of Neuroscience. 37 (9), 1458-1469 (2013).
- Pan, Y., et al. Instructor-learner brain coupling discriminates between instructional approaches and predicts learning. NeuroImage. 211, 116657 (2020).
- Jiang, J., et al. Leader emergence through interpersonal neural synchronization. Proceedings of the National Academy of Sciences of the United States of America. 112 (14), 4274-4279 (2015).
- Bevilacqua, D., et al. Brain-to-brain synchrony and learning outcomes vary by student-teacher dynamics: Evidence from a real-world classroom electroencephalography study. Journal of Cognitive Neuroscience. 31 (3), 401-411 (2019).
- Dikker, S., et al. Morning brain: real-world neural evidence that high school class times matter. Social Cognitive and Affective Neuroscience. 15 (11), 1193-1202 (2020).
- Pan, Y., Guyon, C., Borragán, G., Hu, Y., Peigneux, P. Interpersonal brain synchronization with instructor compensates for learner's sleep deprivation in interactive learning. Biochemical Pharmacology. , 114111 (2020).
- Pan, Y., Novembre, G., Song, B., Li, X., Hu, Y. Interpersonal synchronization of inferior frontal cortices tracks social interactive learning of a song. NeuroImage. 183, 280-290 (2018).
- Zheng, L., et al. Enhancement of teaching outcome through neural prediction of the students' knowledge state. Human Brain Mapping. 39 (7), 3046-3057 (2018).
- Zheng, L., et al. Affiliative bonding between teachers and students through interpersonal synchronisation in brain activity. Social Cognitive and Affective Neuroscience. 15 (1), 97-109 (2020).
- Kleinschmidt, A., et al. Simultaneous recording of cerebral blood oxygenation changes during human brain activation by magnetic resonance imaging and near-infrared spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 16 (5), 817-826 (1996).
- Strangman, G., Culver, J. P., Thompson, J. H., Boas, D. A. A quantitative comparison of simultaneous BOLD fMRI and NIRS recordings during functional brain activation. NeuroImage. 17 (2), 719-731 (2002).
- Huppert, T. J., Hoge, R. D., Diamond, S. G., Franceschini, M. A., Boas, D. A. A temporal comparison of BOLD, ASL, and NIRS hemodynamic responses to motor stimuli in adult humans. NeuroImage. 29 (2), 368-382 (2006).
- Holper, L., Scholkmann, F., Wolf, M. Between-brain connectivity during imitation measured by fNIRS. NeuroImage. 63, 212-222 (2012).
- Hirsch, J., Zhang, X., Noah, J. A., Ono, Y. Frontal temporal and parietal systems synchronize within and across brains during live eye-to-eye contact. NeuroImage. 157, 314-330 (2017).
- Wilcox, T., Biondi, M. fNIRS in the developmental sciences. Wiley Interdisciplinary Reviews: Cognitive Science. 6 (3), 263-283 (2015).
- Ye, J. C., Tak, S., Jang, K. E., Jung, J., Jang, J. NIRS-SPM: statistical parametric mapping for nearinfrared spectroscopy. NeuroImage. 44 (2), 428-447 (2009).
- Huppert, T. J., Diamond, S. G., Franceschini, M. A., Boas, D. A. HomER: A review of time-series analysis methods for near-infrared spectroscopy of the brain. Applied Optics. 48 (10), 280-298 (2009).
- Santosa, H., Zhai, X., Fishburn, F., Huppert, T. The NIRS Brain AnalyzIR toolbox. Algorithms. 11 (5), 73 (2018).
- Xu, Y., Graber, H. L., Barbour, R. L. nirsLAB: a computing environment for fNIRS neuroimaging data analysis. Biomedical Optics. , (2014).
- Cope, M., Delpy, D. T. System for long-term measurement of cerebral blood and tissue oxygenation on newborn infants by near infra-red transillumination. Medical and Biological Engineering and Computing. 26 (3), 289-294 (1988).
- Hoshi, Y. Functional near-infrared spectroscopy: current status and future prospects. Journal of Biomedical Optics. 12 (6), 062106 (2007).
- Molavi, B., Dumont, G. A. Wavelet-based motion artifact removal for functional near-infrared spectroscopy. Physiological Measurement. 33 (2), 259 (2012).
- Cooper, R., et al. A systematic comparison of motion artifact correction techniques for functional near-infrared spectroscopy. Frontiers in Neuroscience. 6, 147 (2012).
- Zhang, X., Noah, J. A., Hirsch, J. Separation of the global and local components in functional near-infrared spectroscopy signals using principal component spatial filtering. Neurophotonics. 3 (1), 015004 (2016).
- Grinsted, A., Moore, J. C., Jevrejeva, S. Application of the cross wavelet transform and wavelet coherence to geophysical time series. Nonlinear Processes in Geophysics. 11, 561-566 (2004).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG-and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Nozawa, T., Sasaki, Y., Sakaki, K., Yokoyama, R., Kawashima, R. Interpersonal frontopolar neural synchronization in group communication: an exploration toward fNIRS hyperscanning of natural interactions. NeuroImage. 133, 484-497 (2016).
- Reindl, V., Gerloff, C., Scharke, W., Konrad, K. Brain-to-brain synchrony in parent-child dyads and the relationship with emotion regulation revealed by fNIRS-based hyperscanning. NeuroImage. 178, 493-502 (2018).
- Theiler, J., Eubank, S., Longtin, A., Galdrikian, B., Farmer, J. D. Testing for nonlinearity in time series: the method of surrogate data. Physica D: Nonlinear Phenomena. 58 (1-4), 77-94 (1992).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. NeuroImage. 15 (4), 870-878 (2002).
- Nichols, T., Hayasaka, S. Controlling the familywise error rate in functional neuroimaging: a comparative review. Statistical Methods in Medical Research. 12 (5), 419-446 (2003).
- Tsuzuki, D., et al. Virtual spatial registration of stand-alone fNIRS data to MNI space. NeuroImage. 34 (4), 1506-1518 (2007).
- Singh, A. K., Okamoto, M., Dan, H., Jurcak, V., Dan, I. Spatial registration of multi-channel multi-subject fNIRS data to MNI space without MRI. NeuroImage. 27 (4), 842-851 (2005).
- Noah, J. A., et al. Comparison of short-channel separation and spatial domain filtering for removal of non-neural components in functional near-infrared spectroscopy signals. Neurophotonics. 8 (1), 015004 (2021).
- Noah, J. A., et al. Real-time eye-to-eye contact is associated with cross-brain neural coupling in angular gyrus. Frontiers in Human Neuroscience. 14 (19), (2020).
- Torrence, C., Compo, G. P. A practical guide to wavelet analysis. Bulletin of the American Meteorological Society. 79 (1), 61-78 (1998).
- Osaka, N., Minamoto, T., Yaoi, K., Azuma, M., Osaka, M. Neural synchronization during cooperated humming: a hyperscanning study using fNIRS. Procedia-Social and Behavioral Sciences. 126, 241-243 (2014).
- Dommer, L., Jäger, N., Scholkmann, F., Wolf, M., Holper, L. Between-brain coherence during joint n-back task performance: a two-person functional near-infrared spectroscopy study. Behavioural Brain Research. 234 (2), 212-222 (2012).
- Holper, L., Scholkmann, F., Wolf, M. Between-brain connectivity during imitation measured by fNIRS. Neuroimage. 63, 212-222 (2012).
- Nguyen, T., et al. The effects of interaction quality on neural synchrony during mother-child problem solving. Cortex. 124, 235-249 (2020).
- Seth, A. K., Barrett, A. B., Barnett, L. Granger causality analysis in neuroscience and neuroimaging. Journal of Neuroscience. 35 (8), 3293-3297 (2015).
- Funane, T., et al. Synchronous activity of two people's prefrontal cortices during a cooperative task measured by simultaneous near-infrared spectroscopy. Journal of Biomedical Optics. 16 (7), 077011 (2011).
- Liu, T., Saito, H., Oi, M. Role of the right inferior frontal gyrus in turn-based cooperation and competition: a near-infrared spectroscopy study. Brain and Cognition. 99, 17-23 (2015).
- Lachaux, J. P., Rodriguez, E., Martinerie, J., Varela, F. J. Measuring phase synchrony in brain signals. Human Brain Mapping. 8 (4), 194-208 (1999).
- Burgess, A. P. On the interpretation of synchronization in EEG hyperscanning studies: a cautionary note. Frontiers in Human Neuroscience. 7, 881 (2013).
- Burgos-Robles, A., et al. Amygdala inputs to prefrontal cortex guide behavior amid conflicting cues of reward and punishment. Nature Neuroscience. 20 (6), 824-835 (2017).
- Mende, S., Proske, A., Narciss, S. Individual preparation for collaborative learning: Systematic review and synthesis. Educational Psychologist. , 1-25 (2020).
- Hamilton, A. F. D. C. Hyperscanning: Beyond the hype. Neuron. 109 (3), 404-407 (2021).
- Novembre, G., Iannetti, G. D. Hyperscanning alone cannot prove causality. Multibrain stimulation can. Trends in Cognitive Sciences. 25 (2), 96-99 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。