Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Sincronización intercerebros en el aprendizaje colaborativo abierto: un estudio fNIRS-Hyperscanning
En este artículo
Resumen
Se describe el protocolo para realizar experimentos de hiperescaneo fNIRS en díadas de aprendizaje colaborativo en un entorno de aprendizaje naturalista. Además, se presenta una tubería para analizar la sincronía intercerecere (SII) de las señales de hemoglobina oxigenada (Oxy-Hb).
Resumen
El hiperescaneo fNIRS es ampliamente utilizado para detectar los fundamentos neurobiológicos de la interacción social. Con esta técnica, los investigadores califican la actividad cerebral concurrente de dos o más individuos interactivos con un nuevo índice llamado sincronía intercereal (SII) (es decir, alineación de fase y / o amplitud de las señales neuronales o hemodinámicas a través del tiempo). Aquí se presenta un protocolo para realizar experimentos de hiperescaneo fNIRS sobre díadas de aprendizaje colaborativo en un entorno de aprendizaje naturalista. Además, se explica una tubería de análisis del SII de la señal de hemoglobina oxigenada (Oxy-Hb). Específicamente, se discuten el diseño experimental, el proceso de registro de datos NIRS, los métodos de análisis de datos y las direcciones futuras. En general, la implementación de una tubería de hiperescaneo fNIRS estandarizada es una parte fundamental de la neurociencia en segunda persona. Además, esto está en línea con el llamado a la ciencia abierta para ayudar a la reproducibilidad de la investigación.
Introducción
Recientemente, para revelar la actividad cerebral concurrente a través de las díadas interactivas o miembros de un grupo, los investigadores emplean el enfoque de hiperescaneo1,2. Específicamente, el electroencefalograma (EEG), la resonancia magnética funcional (fMRI) y la espectroscopia funcional de infrarrojo cercano (fNIRS) se utilizan para registrar las actividades neuronales y cerebrales de dos o más sujetos simultáneamente3,4,5. Los investigadores extraen un índice neuronal que implica un acoplamiento cerebral concurrente basado en esta técnica, que se refiere a la sincronía intercereal (SII) (es decir, la alineación de fase y / o amplitud de las señales neuronales o hemodinámicas a través del tiempo). Una gran variedad de investigaciones de hiperescaneo encontraron siI durante la interacción social entre múltiples individuos (por ejemplo, jugador-audiencia, instructor-aprendiz y líder-seguidor)6,7,8. Además, el SII tiene implicaciones específicas del aprendizaje y la instrucción efectivos9,10,11,12,13,14. Con el aumento de la investigación de hiperescaneo en escenarios de aprendizaje naturalista, es necesario establecer un protocolo estándar de experimentos de hiperescaneo y la canalización del análisis de datos en este campo.
Por lo tanto, este documento proporciona un protocolo para realizar hiperescaneo basado en fNIRS de díadas de aprendizaje colaborativo y una tubería para analizar el SII. fNIRS es una herramienta de imagen óptica, que irradia luz infrarroja cercana para evaluar la absorción espectral de hemoglobina indirectamente, y luego se mide la actividad hemodinámica / oxigenación15,16,17. En comparación con la fMRI, fNIRS es menos propenso a los artefactos de movimiento, lo que permite mediciones de sujetos que están haciendo experimentos de la vida real (por ejemplo, imitación, conversación y comunicación no verbal)18,7,19. En comparación con el EEG, fNIRS tiene una mayor resolución espacial, lo que permite a los investigadores detectar la ubicación de la actividad cerebral20. Por lo tanto, estas ventajas en resolución espacial, logística y viabilidad califican a fNIRS para realizar mediciones de hiperescaneo1. Usando esta tecnología, un organismo de investigación emergente detecta un término índice como SII, la alineación neuronal de la actividad cerebral de dos (o más) personas, en diferentes formas de entornos sociales naturalistas9,10,11,12,13,14. En esos estudios, se aplican varios métodos (es decir, análisis de correlación y análisis de coherencia de transformada de Wavelet (WTC)) para calcular este índice; mientras tanto, una tubería estándar sobre dicho análisis es esencial pero falta. Como resultado, en este trabajo se presenta un protocolo para realizar hiperescaneo basado en fNIRS y una canalización que utiliza el análisis WTC para identificar el SII.
Este estudio tiene como objetivo evaluar el SII en díadas de aprendizaje colaborativo utilizando la técnica de hiperescaneo fNIRS. En primer lugar, se registra simultáneamente una respuesta hemodinámica en las regiones temporoparietal prefrontal e izquierda de cada díada durante una tarea de aprendizaje colaborativo. Estas regiones han sido identificadas como asociadas con la enseñanza y el aprendizajeinteractivos 9,10,11,12,13,14. En segundo lugar, el SII se calcula en cada canal correspondiente. El proceso de registro de datos fNIRS consta de dos partes: sesión de estado de reposo y sesión colaborativa. La sesión en estado de reposo dura 5 minutos, durante los cuales ambos participantes (sentados cara a cara, separados entre sí por una mesa (0,8 m)) deben permanecer quietos y relajarse. Esta sesión de estado de reposo se sirve como línea de base. Luego, en la sesión colaborativa, se les dice a los participantes que estudien todos los materiales de aprendizaje juntos, obteniendo comprensión, resumiendo las reglas y asegurándose de que todos los materiales de aprendizaje sean dominados. Aquí, se presentan los pasos específicos para realizar el experimento y el análisis de datos fNIRS.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los participantes reclutados (40 díadas, edad media 22,1 ± 1,2 años; 100% diestros; visión normal o corregida a normal) estaban sanos. Antes del experimento, los participantes dieron su consentimiento informado. Los participantes fueron compensados financieramente por su participación. El estudio fue aprobado por el Comité Universitario de Protección de la Investigación Humana (HR-0053-2021), Universidad Normal del Este de China.
1. Pasos de preparación antes de adoptar los datos
- Tapas NIRS caseras
- Adopte una gorra de natación elástica para colocar la rejilla del soporte del optode.
NOTA: Teniendo en cuenta que los tamaños de cabeza de los participantes son diferentes, se utilizan dos tamaños de gorras. Las gorras pequeñas están preparadas para los participantes con una circunferencia de la cabeza de 55,4 ± 1,1 cm, y las gorras grandes son para los participantes con una circunferencia de la cabeza de 57,9 ± 1,2 cm. - Anclar la ubicación de los electrodos EEG (inión, Cz, T3, T4, Fpz y P5) como optodos de referencia según el sistema internacional estándar 10-10 sobre gorros de natación elásticos (ver Tabla de Materiales).
- Primero, coloque la tapa estándar de EEG 10-10 (consulte la Tabla de materiales)en el molde de la cabeza y coloque la gorra de natación elástica en la tapa de EEG. En segundo lugar, marque los optodos de referencia (inion, Cz, T3, T4, Fpz y P5) con tiza en cada tapa. Finalmente, corte dos orificios de unos 15 mm de diámetro para colocar los dos optodos de referencia (es decir, Fpz y P5, Figura 1).
NOTA: Específicamente, un conjunto de sondas optodo de 3 x 5 y un conjunto de sondas de optodo de 4 x 4 se colocan por separado sobre el área prefrontal (el optodo de referencia se coloca en Fpz, Figura 1B)y las regiones temporoparietales izquierdas (el optodo de referencia se coloca en P5, Figura 1B).
- Primero, coloque la tapa estándar de EEG 10-10 (consulte la Tabla de materiales)en el molde de la cabeza y coloque la gorra de natación elástica en la tapa de EEG. En segundo lugar, marque los optodos de referencia (inion, Cz, T3, T4, Fpz y P5) con tiza en cada tapa. Finalmente, corte dos orificios de unos 15 mm de diámetro para colocar los dos optodos de referencia (es decir, Fpz y P5, Figura 1).
- Cortar agujeros para colocar los otros optodos. Coloque una gorra de natación con dos soportes de rejilla directamente en el molde de la cabeza. Luego, marque la ubicación de otros optodos con tiza. Después de eso, corte los orificios de descanso para asegurarse de que el soporte de la rejilla encaje.
- Monte dos juegos de sondas (es decir, 3 x 5 y 4 x 4) en los gorros de natación (consulte la Tabla de materiales).
NOTA: El sistema de medición NIRS (consulte la Tabla de materiales)proporciona estos conjuntos de sondas estándar (es decir, 3 x 5 y 4 x 4) con zócalos de soporte estándar que garantizan la separación del optodo de 30 mm. - Abra la ventana del monitor del conjunto de sondas en el sistema de medición NIRS y seleccione cuatro conjuntos de sondas dispuestos en 3 x 5 y 4 x 4 para cada persona, por separado.
NOTA: La configuración de la sonda de las dos tapas debe corresponder a las estructuras en la ventana del conjunto de sondas (es decir, la ubicación exacta de los números de sonda del receptor y el emisor respectivo).
- Adopte una gorra de natación elástica para colocar la rejilla del soporte del optode.
- Preparación del experimento
- Antes de registrar los datos, asegúrese de que el sistema NIRS mantenga una temperatura de funcionamiento estable iniciando el sistema durante al menos 30 minutos.
NOTA: La temperatura de funcionamiento estable oscilaba entre 5 °C y 35 °C. - Establezca el modo de medición en medición relacionada con eventos. Asegúrese de que el receptor de disparadores esté activo (es decir, la entrada serie RS232).
NOTA: El experimento está programado en un software de psicología disponible comercialmente (ver Tabla de Materiales). La absorción de luz infrarroja cercana (dos longitudes de onda: 695 y 830 nm) se mide con una frecuencia de muestreo de 10 Hz. - Prepare la sonda de fibra óptica iluminada, que se puede usar para mover el cabello a un lado.
- Configure el entorno del experimento con una mesa con dos sillas para mantener los asientos de los participantes cara a cara.
- Antes de registrar los datos, asegúrese de que el sistema NIRS mantenga una temperatura de funcionamiento estable iniciando el sistema durante al menos 30 minutos.
2. Adoptar datos instruyendo a los participantes
- Preparar a los participantes
- Instruya a los participantes, incluidos los detalles de los métodos de medición nirs.
NOTA: Todos los participantes estaban sanos y fueron compensados financieramente por su participación. Ningún participante se retiró del experimento a mitad de camino. El rayo láser del NIRS puede ser dañino para los ojos de los participantes, y se les indicó que no miraran directamente a esos rayos láser. - Haga que los participantes se sienten cara a cara (aparte de una mesa (0,8 m)) para asegurarse de que pueden verse directamente. Ajuste la distancia de la silla a la mesa (es decir, casi 0,3 m) para que los participantes se sienten cómodamente.
- Encienda el botón láser y coloque las tapas con los conjuntos de sondas en las cabezas de los participantes.
NOTA: Los conjuntos de sondas de 3 x 5 cubren la frente de los participantes (la sonda central de la fila inferior se coloca en Fpz); los conjuntos de sondas 4 x 4 cubren la corteza temporoparietal izquierda (la tercera sonda de la tercera fila se coloca en P5). - Coloque los cuatro haces de fibra óptica libremente en los brazos del soporte sin contacto con los participantes o las sillas.
NOTA: Aquí, el sistema de medición NIRS tiene cuatro haces de fibras ópticas. Además, asegúrese de que los participantes no se sientan demasiado pesados para quitarse las tapas. - Deje que las puntas de la sonda toquen el cuero cabelludo de los participantes empujando cuidadosamente cada sonda de carga de resorte más lejos en su zócalo.
- Realizar la calibración de la señal.
- Primero, verifique la calidad de la señal haciendo clic en ganancia automática en la ventana del monitor del conjunto de sondas de la máquina fNIRS. Luego, la señal deficiente y la señal suficiente de un canal se marcan en amarillo y verde en la ventana del monitor del conjunto de sondas, respectivamente.
NOTA: Para un canal con señales insuficientes, se utilizan sondas de fibra óptica iluminadas para mover el cabello debajo de la punta de la sonda hacia un lado. - Luego, empuje las sondas más lejos en sus zócalos para obtener suficientes señales. Repita este proceso hasta que todos los canales estén marcados en verde en la ventana del monitor del conjunto de sondas del sistema de medición NIRS, lo que indica que la calidad de las señales es accesible.
- Primero, verifique la calidad de la señal haciendo clic en ganancia automática en la ventana del monitor del conjunto de sondas de la máquina fNIRS. Luego, la señal deficiente y la señal suficiente de un canal se marcan en amarillo y verde en la ventana del monitor del conjunto de sondas, respectivamente.
- Instruya a los participantes, incluidos los detalles de los métodos de medición nirs.
- Ejecutar el experimento
- Comience el experimento con un estado de reposo de 5 minutos, que sirve como línea de base. Luego, se requiere que dos participantes aprendan los materiales de aprendizaje.
- Después del experimento, haga clic en Salida de archivo de texto para exportar los datos de intensidad de luz sin procesar y guardar los datos como un archivo de texto.
NOTA: No se aplican filtros en el sistema de medición NIRS. - Utilice el digitalizador tridimensional (3D) (consulte la Tabla de materiales)para determinar las ubicaciones de emisores, receptores y otras referencias (es decir, inión, nasion, Cz y oídos izquierdo y derecho) para cada participante.
- Obtener las coordenadas MNI para los canales de grabación utilizando la plataforma informática numérica disponible comercialmente21 (ver Tabla de Materiales). La Tabla suplementaria S1 muestra las ubicaciones anatómicas correspondientes de cada canal.
- Limpie las sondas y los soportes de sonda con etanol. Lave las tapas con detergente suave y deje que las tapas se sequen al aire.
3. Análisis de datos
- Preprocesamiento de datos
NOTA: Investigaciones anteriores han adoptado paquetes de software variables no comerciales (por ejemplo, Homer222, AnalyzIR23, o nirs LAB24) con plataformas informáticas numéricas (véase Tabla de Materiales) en el análisis de datos de fNIRS, y todos están disponibles en el sitio web. Aquí Homer2 se utilizó para hacer el preprocesamiento de los datos NIRS. Además, tanto los datos de registro de fNIRS recopilados en el resto como las fases de aprendizaje colaborativo comparten la misma canalización de preprocesamiento y análisis.- Copie el conjunto de datos del equipo fNIRS. Convierta la formación de datos original a la formación adecuada (es decir, convierta el archivo cvs en un archivo nirs).
- Convierta datos sin procesar en datos de densidad óptica (OD) con la función "hmrIntensity2OD" proporcionada en la plataforma de computación numérica (consulte la Tabla de materiales).
- Elimine los canales defectuosos. Luego promedie el valor de OD para cada participante en cada canal y los puntos de muestra completos, respectivamente.
NOTA: Aquí se obtienen 46 valores de OD promediados.- Calcular la desviación estándar (DE) para cada participante.
- Marcar como inutilizable y eliminar los canales con OD muy bajo o alto (que superaron los 5 SDs) del análisis para cada participante.
NOTA: Este paso se puede realizar antes y/o después del preprocesamiento de datos fNIRS. En esta canalización de análisis de datos, los canales defectuosos se detectan antes del preprocesamiento de datos fNIRS.
- Convierta los datos de tiempo OD en Oxy-Hb, DeOxy-Hb y señal combinada basada en la Ley de Beer-Lambertmodificada 25.
NOTA: La referencia25 dice: "Todos los pasos del análisis de datos se llevan a cabo sobre datos de Oxy-Hb, que es un indicador del cambio en el flujo sanguíneo cerebral regional que tiene una mayor relación señal-ruido26. Además, investigaciones anteriores emplearon el hiperescaneo fNIRS en escenarios de enseñanza y aprendizaje centrados principalmente en la concentración de Oxy-Hb11,12,13,14". - Calibre series temporales de Oxy-Hb a partir de artefactos de movimiento mediante el método basado en wavelet canal por canal.
NOTA: Específicamente, el wavelet Daubechies 5 (db5) con parámetro de ajuste en 0.1 (ver detalles en el manual de Homer2)27,28 se adopta en la eliminación de artefactos de movimiento. - Aplique el filtro de paso de banda (es decir, 0.01-1 Hz) en los datos calibrados de Oxy-Hb para reducir el ruido de alta frecuencia y la deriva lenta.
- Realizar análisis de componentes principales (PCA) en la señal OxyHb para eliminar componentes globales no neurales (por ejemplo, presión arterial, respiración y variación del flujo sanguíneo)29.
NOTA: El análisis de la PCA propuesto por Zhang y sus colegas29 se adopta aquí.- Primero, descompone la señal.
NOTA: La fórmula específica de descomposición de la señal fNIRS es: H = UΣVT. Aquí, los patrones temporales y espaciales de los datos fNIRS se presentan en dos matrices (es decir, you y V). U es una matriz 2D (punto de muestra x componente principal). V es también una matriz 2D (componente principal x componente principal). La columna en V indica un componente principal (PC), y la fuerza de ese PC para un canal en particular se estima en cada entrada de la columna. La importancia relativa de cada PC está representada por el valor de la matriz diagonal Σ. - En segundo lugar, realizar el suavizado espacial.
NOTA: La convolución del núcleo gaussiano se emplea para eliminar señales localizadas y obtener el componente global. - Tercero, reconstruir la señal.
NOTA: Para calcular el componente global de los datos fNIRS, la matriz de patrón espacial suavizada V* se conecta de nuevo a la fórmula de descomposición: HGlobal = UΣ(V*)T. Luego, se puede obtener una señal neuronal derivada localizada utilizando datos originales H para restar HGlobal: HNeuronal = H - HGlobal.
- Primero, descompone la señal.
- Sincronía intercereencefáunica
NOTA: Para revelar el acoplamiento cerebral en la neurociencia en segunda persona, aquí se adopta la coherencia de la transformada de wavelet (WTC). Brevemente, WTC mide la correlación entre dos series temporales en función de la frecuencia y el tiempo. La fórmula específica de coherencia wavelet de dos series temporales x e y es: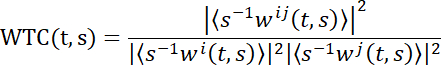
T y s denotan el tiempo y la escala de wavelet por separado, ‹·› indica una operación de suavizado en escala y tiempo. W representa la transformada de wavelet continua. Luego, se genera una matriz WTC 2D (tiempo x frecuencia)30. Se utilizan varias cajas de herramientas para calcular el valor wtc. Aquí se utilizó la caja de herramientas creada por Grinsted y sus colegas30.- Adoptar la función WTC de la plataforma de computación numérica (ver Tabla de Materiales).
NOTA: Aquí, se utiliza la configuración predeterminada de la wavelet madre (es decir, Generalized Morse Wavelet con sus parámetros beta y gamma). La wavelet madre convierte cada serie temporal en el dominio de frecuencia y tiempo. - Establezca la configuración predeterminada en los otros parámetros (es decir, MonteCarloCount, que representa el número de conjuntos de datos sustitutos en el cálculo de significación).
- Calcular el valor WTC para dos canales correspondientes (el mismo canal en dos participantes) en una plataforma de computación numérica (ver Tabla de Materiales). Siguiendo el mismo procedimiento, se generan 46 matrices WTC a partir de 46 canales.
- Determinar la banda de frecuencia de interés (FOI), que es sensible al aprendizaje colaborativo.
NOTA: Aquí, se adopta un enfoque de permutación basado en clúster para detectar dicha FOI31,que ofrece una solución a múltiples comparaciones en datos multicanal y multifrecuencia.- Realice el promedio de tiempo de los valores del WTC en las fases de reposo y aprendizaje colaborativo, respectivamente, para cada combinación de canales. Luego, realice pruebas tde muestra pareadas junto con toda la frecuencia (rango de frecuencia: 0.01-1Hz32)en estos valores de WTC promediados en el tiempo (aprendizaje colaborativo vs. descanso). A continuación, identifique los contenedores de frecuencia en los que el efecto de la tarea es significativo (aprendizaje colaborativo > descanso, p < 0,05).
- Obtener puntos vecinos de frecuencia significativa (≥2) como grupos observados y valores T correspondientes.
- Realice una serie de pruebas tde muestra pareadas en datos permutados para generar los valores T para cada clúster calificado en el paso 3.2.4.2 para 1000 veces.
NOTA: Para formar datos permutados, los participantes se asignan aleatoriamente para formar nuevos pares de dos miembros. Como la longitud de los conjuntos de datos varió entre las díadas para cada par aleatorio, el conjunto de datos más largo se recorta a la misma longitud que el más corto33. - Compare los valores de T basados en clúster promediados de los pares originales con los valores de T de 1000 permutaciones.
NOTA: Los valores de p evaluados por esta fórmula34: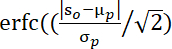 , donde S0 denota el valor t del grupo promediado observado, μp y σp indican la media y la desviación estándar de los valores de permutación.
, donde S0 denota el valor t del grupo promediado observado, μp y σp indican la media y la desviación estándar de los valores de permutación. - Valores medios de WTC en la FOI identificada en cada canal de cada díada. Luego, aplique la transformación z de fisher a los valores WTC para obtener una distribución normal de los valores WTC. Utilice este valor para indexar el SII para un análisis estadístico adicional.
- Adoptar la función WTC de la plataforma de computación numérica (ver Tabla de Materiales).
Access restricted. Please log in or start a trial to view this content.
Resultados
La figura 1 ilustra el protocolo experimental y la ubicación de la sonda. El proceso de registro de datos fNIRS consta de dos partes: sesión de estado de reposo (5 min) y sesión colaborativa (15-20 min). Las díadas de aprendizaje colaborativo son necesarias para relajarse y mantenerse quietos en la sesión de estado de reposo. Después de eso, se les dice a los participantes que co-aprendan el material de aprendizaje(Figura 1A). Sus regiones temporoparietale...
Access restricted. Please log in or start a trial to view this content.
Discusión
En primer lugar, en el presente protocolo, se indican los pasos específicos para realizar experimentos de hiperescaneo fNIRS en un escenario de aprendizaje colaborativo. En segundo lugar, también se presenta la tubería de análisis de datos que evalúa el SII de las señales hemodinámicas en las díadas de aprendizaje colaborativo. La operación detallada sobre la realización de experimentos de hiperescaneo fNIRS promovería el desarrollo de la ciencia abierta. Además, la tubería de análisis se proporciona aquí ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo cuenta con el apoyo del Programa de Promoción de la Innovación Académica de ECNU para Estudiantes de Doctorado Excelentes (YBNLTS2019-025) y la Fundación Nacional de Ciencias Naturales de China (31872783 y 71942001).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| EEG caps | Compumedics Neuroscan,Charlotte,USA | 64-channel Quik-Cap | We choose two sizes of cap(i.e.medium and large). |
| NIRS measurement system with probe sets and probe holder grids | Hitachi Medical Corporation, Tokyo, Japan | ETG-7100 Optical Topography System | The current study protocol requires an optional second adult probe set for 92 channels of measurement in total. |
| Numeric computing platform | The MathWorks, Inc., Natick, MA | MATLAB R2020a | Serves as base for Psychophysics Toolbox extensions (stimulus presentation), Homer2 (fNIRS preprocess analysis), and "wtc" function(WTC computation). |
| Psychology software | psychology software tools,Sharpsburg, PA,USA | E-prime 2.0 | We apply E-prime to start the fNIRS measurement system and send triggers which marking the rest phase and collaborative learning phase for fNIRS recording data. |
| Swimming caps | Zoke corporation,Shanghai,China | 611503314 | We first placed the standard 10-20 EEG cap on the head mold, and placed the swimming cap on the EEG cap. Second, we marked (inion, Cz, T3, T4, PFC and P5) with chalk. |
| Three-dimensional (3-D) digitizer | Polhemus, Colchester, VT, USA; | Three-dimensional (3-D) digitizer | Anatomical locations of optodes in relation to standard head landmarks were determined for each participant using a Patriot 3D Digitizer |
Referencias
- Babiloni, F., Astolfi, L. Social neuroscience and hyperscanning techniques: past, present and future. Neuroscience & Biobehavioral Reviews. 44, 76-93 (2014).
- Schilbach, L., et al. Toward a second-person neuroscience. Behavior Brain Science. 36, 393-414 (2013).
- Montague, P. Hyperscanning: simultaneous fMRI during linked social interactions. NeuroImage. 16, 1159-1164 (2002).
- Cui, X., Bryant, D. M., Reiss, A. L. NIRS-based hyperscanning reveals increased interpersonal coherence in superior frontal cortex during cooperation. NeuroImage. 59 (3), 2430-2437 (2012).
- Dikker, S., et al. Brain-to-brain synchrony tracks real-world dynamic group interactions in the classroom. Current Biology. 27 (9), 1375-1380 (2017).
- Abrams, D. A., et al. Inter-subject synchronization of brain responses during natural music listening. European Journal of Neuroscience. 37 (9), 1458-1469 (2013).
- Pan, Y., et al. Instructor-learner brain coupling discriminates between instructional approaches and predicts learning. NeuroImage. 211, 116657(2020).
- Jiang, J., et al. Leader emergence through interpersonal neural synchronization. Proceedings of the National Academy of Sciences of the United States of America. 112 (14), 4274-4279 (2015).
- Bevilacqua, D., et al. Brain-to-brain synchrony and learning outcomes vary by student-teacher dynamics: Evidence from a real-world classroom electroencephalography study. Journal of Cognitive Neuroscience. 31 (3), 401-411 (2019).
- Dikker, S., et al. Morning brain: real-world neural evidence that high school class times matter. Social Cognitive and Affective Neuroscience. 15 (11), 1193-1202 (2020).
- Pan, Y., Guyon, C., Borragán, G., Hu, Y., Peigneux, P. Interpersonal brain synchronization with instructor compensates for learner's sleep deprivation in interactive learning. Biochemical Pharmacology. , 114111(2020).
- Pan, Y., Novembre, G., Song, B., Li, X., Hu, Y. Interpersonal synchronization of inferior frontal cortices tracks social interactive learning of a song. NeuroImage. 183, 280-290 (2018).
- Zheng, L., et al. Enhancement of teaching outcome through neural prediction of the students' knowledge state. Human Brain Mapping. 39 (7), 3046-3057 (2018).
- Zheng, L., et al. Affiliative bonding between teachers and students through interpersonal synchronisation in brain activity. Social Cognitive and Affective Neuroscience. 15 (1), 97-109 (2020).
- Kleinschmidt, A., et al. Simultaneous recording of cerebral blood oxygenation changes during human brain activation by magnetic resonance imaging and near-infrared spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 16 (5), 817-826 (1996).
- Strangman, G., Culver, J. P., Thompson, J. H., Boas, D. A. A quantitative comparison of simultaneous BOLD fMRI and NIRS recordings during functional brain activation. NeuroImage. 17 (2), 719-731 (2002).
- Huppert, T. J., Hoge, R. D., Diamond, S. G., Franceschini, M. A., Boas, D. A. A temporal comparison of BOLD, ASL, and NIRS hemodynamic responses to motor stimuli in adult humans. NeuroImage. 29 (2), 368-382 (2006).
- Holper, L., Scholkmann, F., Wolf, M. Between-brain connectivity during imitation measured by fNIRS. NeuroImage. 63, 212-222 (2012).
- Hirsch, J., Zhang, X., Noah, J. A., Ono, Y. Frontal temporal and parietal systems synchronize within and across brains during live eye-to-eye contact. NeuroImage. 157, 314-330 (2017).
- Wilcox, T., Biondi, M. fNIRS in the developmental sciences. Wiley Interdisciplinary Reviews: Cognitive Science. 6 (3), 263-283 (2015).
- Ye, J. C., Tak, S., Jang, K. E., Jung, J., Jang, J. NIRS-SPM: statistical parametric mapping for nearinfrared spectroscopy. NeuroImage. 44 (2), 428-447 (2009).
- Huppert, T. J., Diamond, S. G., Franceschini, M. A., Boas, D. A. HomER: A review of time-series analysis methods for near-infrared spectroscopy of the brain. Applied Optics. 48 (10), 280-298 (2009).
- Santosa, H., Zhai, X., Fishburn, F., Huppert, T. The NIRS Brain AnalyzIR toolbox. Algorithms. 11 (5), 73(2018).
- Xu, Y., Graber, H. L., Barbour, R. L. nirsLAB: a computing environment for fNIRS neuroimaging data analysis. Biomedical Optics. , BM3A-1 (2014).
- Cope, M., Delpy, D. T. System for long-term measurement of cerebral blood and tissue oxygenation on newborn infants by near infra-red transillumination. Medical and Biological Engineering and Computing. 26 (3), 289-294 (1988).
- Hoshi, Y. Functional near-infrared spectroscopy: current status and future prospects. Journal of Biomedical Optics. 12 (6), 062106(2007).
- Molavi, B., Dumont, G. A. Wavelet-based motion artifact removal for functional near-infrared spectroscopy. Physiological Measurement. 33 (2), 259(2012).
- Cooper, R., et al. A systematic comparison of motion artifact correction techniques for functional near-infrared spectroscopy. Frontiers in Neuroscience. 6, 147(2012).
- Zhang, X., Noah, J. A., Hirsch, J. Separation of the global and local components in functional near-infrared spectroscopy signals using principal component spatial filtering. Neurophotonics. 3 (1), 015004(2016).
- Grinsted, A., Moore, J. C., Jevrejeva, S. Application of the cross wavelet transform and wavelet coherence to geophysical time series. Nonlinear Processes in Geophysics. 11, 561-566 (2004).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG-and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Nozawa, T., Sasaki, Y., Sakaki, K., Yokoyama, R., Kawashima, R. Interpersonal frontopolar neural synchronization in group communication: an exploration toward fNIRS hyperscanning of natural interactions. NeuroImage. 133, 484-497 (2016).
- Reindl, V., Gerloff, C., Scharke, W., Konrad, K. Brain-to-brain synchrony in parent-child dyads and the relationship with emotion regulation revealed by fNIRS-based hyperscanning. NeuroImage. 178, 493-502 (2018).
- Theiler, J., Eubank, S., Longtin, A., Galdrikian, B., Farmer, J. D. Testing for nonlinearity in time series: the method of surrogate data. Physica D: Nonlinear Phenomena. 58 (1-4), 77-94 (1992).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. NeuroImage. 15 (4), 870-878 (2002).
- Nichols, T., Hayasaka, S. Controlling the familywise error rate in functional neuroimaging: a comparative review. Statistical Methods in Medical Research. 12 (5), 419-446 (2003).
- Tsuzuki, D., et al. Virtual spatial registration of stand-alone fNIRS data to MNI space. NeuroImage. 34 (4), 1506-1518 (2007).
- Singh, A. K., Okamoto, M., Dan, H., Jurcak, V., Dan, I. Spatial registration of multi-channel multi-subject fNIRS data to MNI space without MRI. NeuroImage. 27 (4), 842-851 (2005).
- Noah, J. A., et al. Comparison of short-channel separation and spatial domain filtering for removal of non-neural components in functional near-infrared spectroscopy signals. Neurophotonics. 8 (1), 015004(2021).
- Noah, J. A., et al. Real-time eye-to-eye contact is associated with cross-brain neural coupling in angular gyrus. Frontiers in Human Neuroscience. 14 (19), (2020).
- Torrence, C., Compo, G. P. A practical guide to wavelet analysis. Bulletin of the American Meteorological Society. 79 (1), 61-78 (1998).
- Osaka, N., Minamoto, T., Yaoi, K., Azuma, M., Osaka, M. Neural synchronization during cooperated humming: a hyperscanning study using fNIRS. Procedia-Social and Behavioral Sciences. 126, 241-243 (2014).
- Dommer, L., Jäger, N., Scholkmann, F., Wolf, M., Holper, L. Between-brain coherence during joint n-back task performance: a two-person functional near-infrared spectroscopy study. Behavioural Brain Research. 234 (2), 212-222 (2012).
- Holper, L., Scholkmann, F., Wolf, M. Between-brain connectivity during imitation measured by fNIRS. Neuroimage. 63, 212-222 (2012).
- Nguyen, T., et al. The effects of interaction quality on neural synchrony during mother-child problem solving. Cortex. 124, 235-249 (2020).
- Seth, A. K., Barrett, A. B., Barnett, L. Granger causality analysis in neuroscience and neuroimaging. Journal of Neuroscience. 35 (8), 3293-3297 (2015).
- Funane, T., et al. Synchronous activity of two people's prefrontal cortices during a cooperative task measured by simultaneous near-infrared spectroscopy. Journal of Biomedical Optics. 16 (7), 077011(2011).
- Liu, T., Saito, H., Oi, M. Role of the right inferior frontal gyrus in turn-based cooperation and competition: a near-infrared spectroscopy study. Brain and Cognition. 99, 17-23 (2015).
- Lachaux, J. P., Rodriguez, E., Martinerie, J., Varela, F. J. Measuring phase synchrony in brain signals. Human Brain Mapping. 8 (4), 194-208 (1999).
- Burgess, A. P. On the interpretation of synchronization in EEG hyperscanning studies: a cautionary note. Frontiers in Human Neuroscience. 7, 881(2013).
- Burgos-Robles, A., et al. Amygdala inputs to prefrontal cortex guide behavior amid conflicting cues of reward and punishment. Nature Neuroscience. 20 (6), 824-835 (2017).
- Mende, S., Proske, A., Narciss, S. Individual preparation for collaborative learning: Systematic review and synthesis. Educational Psychologist. , 1-25 (2020).
- Hamilton, A. F. D. C. Hyperscanning: Beyond the hype. Neuron. 109 (3), 404-407 (2021).
- Novembre, G., Iannetti, G. D. Hyperscanning alone cannot prove causality. Multibrain stimulation can. Trends in Cognitive Sciences. 25 (2), 96-99 (2021).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados